富含异构体的3-蒈烷内酰胺和基于此的具有高光学纯度和可调结晶度的高性能用途用聚酰胺的制作方法
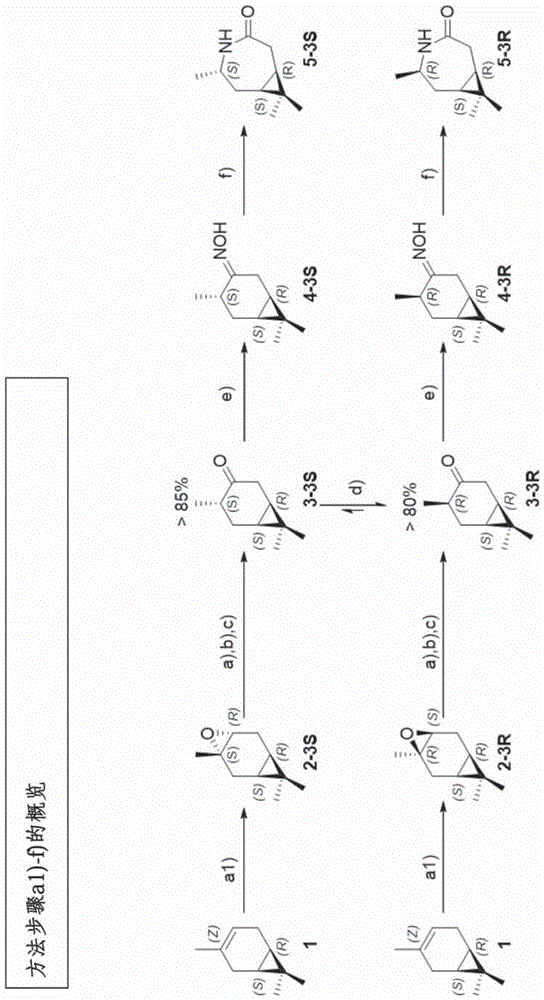
本发明涉及一种由3s-环氧蒈烷(iupac:(1s,3s,5r,7r)-3,8,8-三甲基-4-氧杂三环[5.l.0.03,5]辛烷)制备富含异构体的由3s-蒈酮和3r-蒈酮(iupac:(1r,4s,6s)-4,7,7-三甲基双环[4.l.0]庚烷-3-酮和(1r,4r,6s)-4,7,7-三甲基双环[4.l.0]庚烷-3-酮)构成的混合物的方法、一种由此获得的3s-蒈酮、一种由(+)-3-蒈烯((1s,6r)-3,7,7-三甲基双环[4.l.0]庚-3-烯)制备3s-蒈烷内酰胺(iupac:(1r,5s,7s)-5,8,8-三甲基-4-氮杂双环[5.1.0]辛烷-3-酮)的方法、一种由(+)-3-蒈烯制备3r-蒈烷内酰胺(iupac:(1r,5r,7s)-5,8,8-三甲基-4-氮杂双环[5.1.0]辛烷-3-酮)的方法、一种3s-蒈烷基肟(iupac:(1r,4s,6s)-4,7,7-三甲基双环[4.l.0]庚烷-3-酮肟)、一种3s-蒈烷内酰胺、一种3s-聚蒈烷酰胺、一种3r-聚蒈烷酰胺和一种3s/3r-共聚蒈烷酰胺,尤其是涉及一种3s-蒈烷内酰胺-3r-蒈烷内酰胺-共聚蒈烷酰胺、一种3s-蒈烷内酰胺-月桂精内酰胺-共聚蒈烷酰胺、一种3s-蒈烷内酰胺-己内酰胺-共聚蒈烷酰胺、一种3r-蒈烷内酰胺-月桂精内酰胺-共聚蒈烷酰胺、一种3r-蒈烷内酰胺-己内酰胺-共聚蒈烷酰胺。为了保护化石资源并减少温室气体排放,人们对使用可由再生原料制备的塑料取代传统塑料如化石基聚酰胺很感兴趣。聚酰胺是通过将具有氨基、最好是活化羧基的双官能单体相连而形成的。在此,不仅可以使二胺与二羧酸反应,也可以使氨基酸与氨基酸反应。在后者中,与氨基和羧基两者相连所需要的官能团存在于相同的分子中。尤其是,内酰胺如ε-己内酰胺例如可以通过开环聚合被用于制备聚酰胺。聚合所用的两种工业上重要的基于化石原材料的内酰胺是用于制备聚酰胺6(pa6)的ε-己内酰胺和用于制备聚酰胺12的月桂精内酰胺。ε-己内酰胺在工业上由环己酮制备,而月桂精内酰胺由环十二烷酮制备。在此,酮首先被转化为肟,肟又随后通过贝克曼重排转化为内酰胺、即聚酰胺制备用单体。迄今,在工业范畴可供使用的生物基聚酰胺主要基于蓖麻油来制备。由脂肪酸制备的单体生成线性的、部分结晶的聚合物链(pa11,pa410,pa610,pa1010,pa10.12),其性能与化石基聚酰胺相似。市售的脂肪酸基聚酰胺的玻璃化转变温度(tg)一般低于60℃。根据winnacker(m.winnacker,j.sag,a.tischner,b.rieger,macromol.rapidcommun.2017,38,1600787)的论述,基于β-蒎烯的聚酰胺具有160℃的tg和264℃的熔点(tm),但是仅获得约24kda的摩尔质量。薄荷酮内酰胺迄今只能被反应成低聚物。迄今所知的基于萜烯的和基于脂肪酸的聚酰胺是部分结晶的。此外,基于萜烯的和基于脂肪酸的聚酰胺迄今主要展现出低摩尔质量,或展现出低玻璃化转变温度和进而有限的应用领域。各单体的合成大多无法以工业化规模来进行(基于萜烯)。有利的是,用于单体制备的再生原料一方面在制备中不与食品生产构成竞争,另一方面,本身不必专为该应用来制造。特别有利的是,在由再生原料制备其它产品中,所述再生原料以余料/废料形式来形成。例如在纤维素制备中产生大量萜烯,特别是作为在由木材获得纤维素时的余料。关于此,参考de102014221061a1。另外,迄今所知的由再生原料制备聚酰胺的方法的缺点是,被用于聚酰胺制备的单体或在该单体合成路线上的中间产物通常无法以化学纯净的形式和/或也无法以异构体纯的形式获得。还不利的是,聚酰胺的使用温度通常不适于许多应用,并且可达到的摩尔质量也低。还可能不利的是,不能有针对性地调节聚酰胺的光学纯度、就是说(以下简称“即”)立构规整度和结晶度。原则上,在化学上有净化方法如色谱分离法可供使用以分离异构体、特别是用于制备单体的异构体中间产物或异构体单体本身,但这些方法通常非常复杂且昂贵。因此,与由化石原料制成的聚酰胺相比,相应的聚酰胺可能非常昂贵。因此,本发明的任务是提供由再生原料或余料制备聚酰胺的方法以及用于制备聚酰胺制备所需的单体和在这些单体合成路线上的中间产物的制备方法,在此,避免了从现有技术中已知的缺点。尤其应该能通过所提供的方法制备聚酰胺,其相比于由非再生原料或石油基原料构成的已知聚酰胺具有改善的产品性能、最好是改善的透明度和/或强度和/或韧性和/或立构规整性,尤其是针对立体选择性应用或对映选择性应用。本发明的任务尤其通过一种权利要求1的原理以及其它独立权利要求的原理来完成。本发明尤其也通过提供聚蒈烷酰胺来完成在此的技术问题,其中,该聚蒈烷酰胺是根据如下分子式(具有n个重复单元)的3s-聚蒈烷酰胺:或具有如下分子式(具有n个重复单元)的3r-聚蒈烷酰胺:本发明也涉及根据如下分子式(具有a、b和n个重复单元)的3s-3r-共聚蒈烷酰胺:所述聚蒈烷酰胺在优选实施方式中可以通过根据本发明的方法来制备,尤其采用本发明的如下方法,其由3-蒈烯、优选是3-环氧蒈烷且尤其是由此得到的由3s-蒈酮和3r-蒈酮构成的富含异构体的混合物来获得本发明的聚蒈烷酰胺。本发明的一个主要贡献是由3-蒈烯或3-环氧蒈烷通过本发明方法来提供用于共聚蒈烷酰胺合成的前体,尤其是提供用于提供3s-聚蒈烷酰胺的3s-蒈酮。本发明的一个有利设计规定了提供富含3s-蒈酮的混合物、尤其是富含3s-蒈酮的如下混合物,即,从中可以有利地获得3s-蒈烷基肟和3s-蒈烷内酰胺来作为用于3s-聚蒈烷酰胺或3s-共聚蒈烷酰胺的前体。本发明也涉及一种由3-环氧蒈烷制备由3s-蒈酮和3r-蒈酮构成的富含异构体的混合物的方法,包括如下方法步骤:a)提供反应混合物,其含有3-环氧蒈烷和至少一种酸性催化剂;b)在-40℃至140℃的温度通过重排反应来转化该反应混合物中的3-环氧蒈烷;和c)获得(相对于蒈酮总物质量)3s-蒈酮或3r-蒈酮所占异构体比例为至少80%的富含异构体的混合物。本发明优选规定在方法步骤a)中提供的反应混合物还含有第一有机溶剂。本发明尤其涉及一种由3-环氧蒈烷制备由3s-蒈酮和3r-蒈酮构成的富含异构体的混合物的方法,包括如下方法步骤:a)提供反应混合物,其含有3-环氧蒈烷、至少一种酸性催化剂和至少一种第一有机溶剂;b)在-40℃至140℃的温度下通过重排反应来转化该反应混合物中的3-环氧蒈烷;和c)获得(相对于3s-蒈酮和3r-蒈酮的总物质量)3s-蒈酮或3r-蒈酮所占异构体比例为至少80%的富含异构体的混合物。根据本发明的规定,含有3-环氧蒈烷、至少一种酸性催化剂和在优选实施方式中至少一种第一有机溶剂的反应混合物的提供最好对应于:将3-环氧蒈烷、至少一种酸性催化剂和可选的至少一种第一有机溶剂相互混合。在如此得到的反应混合物中,根据方法步骤b)按照本发明规定将3-环氧蒈烷反应成在方法步骤c)中得到的、(分别相对于3s-蒈酮和3r-蒈酮的、以下也简称“蒈酮”的总物质量)3s-蒈酮所占异构体比例为至少80%或3r-蒈酮所占异构体比例为至少80%的富含异构体的混合物,其中,3-环氧蒈烷被重排成3s-蒈酮和3r-蒈酮。具有异构体的混合物能优选被纯化或分离。所述至少一种酸催化剂优选是路易斯酸,特别优选是极强酸的金属盐,特别是比三氟乙酸(其pk为0.23)更强的酸的金属盐,所含金属最好是来自第三至第五周期,特别是4至13族、特别是7至12族的金属,其氧化态尤其为2至3。优选地,所述至少一种第一有机溶剂是脂肪族溶剂或芳香族溶剂,特别是仅由无杂原子的碳氢化合物构成的溶剂,尤其是具有4-10个碳、特别是5-7个碳的溶剂,并且沸点在30-126℃之间、优选在60-81℃之间,其相对极性尤其小于0.164(二噁烷)。本发明优选规定,在方法步骤b)中,在0-100℃、优选20-80℃、最好40-65℃、特别是45-60℃、特别是48-53℃、特别是50-60℃、特别是50℃或60℃的温度将3-环氧蒈烷反应为由s-和r-蒈酮构成的富含异构体的混合物。本发明还优选规定,在方法步骤b)中通过曼瓦尔德重排(meinwald-umlagerung)来转化3-环氧蒈烷。尤其规定,通过没有中间体的协同机制或通过具有中间体的机制,特别是通过中间体、即(1r,6s)-7,7-二甲基-4-亚甲基双环[4.1.0]庚烷-3-醇和(1r,6s)-4,7,7-三甲基双环[4.1.0]庚-3-烯-3-醇来进行曼瓦尔德重排。一种用于在方法步骤b)中将3s-环氧蒈烷进行立体选择性曼瓦尔德重排以在方法步骤c)中得到(相对于蒈酮总量)3s-蒈酮占比为至少80%的富含异构体的混合物的理论(但不限于此)是,所述反应最好通过协同机制进行。本发明优选规定,在方法步骤c)中获得的富含异构体的混合物中,(相对于蒈酮的总物质量)3s-蒈酮或3r-蒈酮所占异构体比例为至少85%、至少90%或至少95%。通过根据本发明的用于制备由3s-蒈酮和3r-蒈酮构成的富含异构体的混合物的方法有利地实现中间产物且特别是3-蒈酮的异构体的制备,可由所述异构体得到聚酰胺制备所需的本发明单体。根据本发明,所述反应在一个优选的实施方案中可如此被控制,即,所获的富含异构体的混合物中大量含有相应所期望的中间产物,即或是3s-蒈酮或3r-蒈酮。制备本发明的聚酰胺所需的单体可以根据本发明从由3s-蒈酮和3r-蒈酮构成的富含异构体的混合物通过其它中间产物、即3-蒈烷基肟和3-蒈烷内酰胺来有利、快速且高效地制备。可由其制备的本发明的基于萜烯的热塑性聚酰胺满足高的热需求并具有高的摩尔质量。另外,用于本发明聚合物的制备方法的效率或许可与商业所用的化石基聚酰胺制备方法相匹敌。在此也称为合成路线的本发明制备方法优选可以被如此控制,即,或是出现部分结晶的聚酰胺,或是出现完全非晶态的聚酰胺。根据本发明,可以通过本发明的制备方法制备基于3-蒈烯的内酰胺,即,本发明聚酰胺的单体,其分为两个非对映异构体,这在聚酰胺中导致完全非晶态或部分结晶,因此满足不同的应用要求。来自3s-蒈烷内酰胺的聚酰胺是部分结晶的,而来自3r-蒈烷内酰胺的聚酰胺是非晶态的。两种聚酰胺均可达到高于50kda或者(以下缩写为“或”)100kda、优选高于10kda或33kda的摩尔质量。本发明所提供的聚酰胺优选具有高光学纯度,在优选实施方式中是透明的并优选具有立构规整性,其尤其可有利地用于立体选择性应用和对映选择性应用、例如hplc或手性膜中的手性固定相。在一个优选实施方式中,本发明所提供的聚酰胺在其均聚物形式下是全同立构的。关于本发明,术语“3-蒈烯”不仅是指(1s,6r)-(+)-3-蒈烯、也是指异构体(1r,6s)-(-)-3-蒈烯。优选地,(1s,6r)-(+)-3-蒈烯被用作3-蒈烯。根据本发明由3-蒈烯制备的物质和产品与之相应地或是具有立体异构体(1s,6r)-(+)-构型、或是具有(1r,6s)-(-)-构型、最好是(1s,6r)-(+)-构型。关于本发明,术语“非晶态聚合物”是指如下聚合物,在此,在借助差示扫描量热法(dsc)的热分析中,根据下面给出的方法(3)在达到分解温度之前都只会看到玻璃化转变温度,而不会看到熔点,或者根据下文给出的方法(3.1)和(3.2),在达到320℃温度(方法3.1)前或达到分解温度(方法3.2)前都会只看到玻璃化转变温度,但无法看到熔点。关于本发明,术语“部分结晶的聚合物”是指如下聚合物,在此,根据如下给出的方法(3)或方法(3.1)或(3.2)在借助差示扫描量热法(dsc)的热分析中,在达到分解温度之前既能观察到玻璃化转变温度、也能观察到熔点。根据本发明,优选通过以下方法(4.1)或(4.2)、特别是方法(4.2)来确定数均分子量(mn)和重均分子量(mw)。关于本发明,多分散系数是重均分子量(mw)除以数均分子量(mn)所得之商(mw/mn),其中,(mn)和(mw)根据方法(4.1)或(4.2)尤其是方法(4.2)来确定。关于本发明,术语“吸水量”是指与干燥状态相比聚酰胺样品在用水处理后在与pa6(聚酰胺6)定性对比中减小的质量增量,这可以根据如下给出的方法(5)通过与pa6进行质量比较来确定。关于本发明,如果按照如下给出的方法(6)可以生成在与pa6和pa12的定性对比中无色透明乃至不透明的膜,则聚酰胺是“透明的”。关于本发明,术语“中间产物”是指如下化合物,其由初始化合物、在这里尤其是3-蒈烯或3-环氧蒈烷在执行了第一方法步骤之后得到并且在至少一个第二方法步骤例如也可以是多个方法步骤之后被转化成最终产品、在这里特别是3-蒈烷内酰胺或其聚酰胺。关于本发明,中间产物特别是3-蒈酮和3-蒈烷基肟,即用作由3-环氧蒈烷制备单体、即3-蒈烷内酰胺的前体。此外关于本发明,表述“富含异构体的混合物”是指由两种非对映异构化合物构成的混合物,在这里,其中一种非对映异构化合物在混合物中比另一种化合物更频繁地出现。在本发明上下文中的异构体优选为非对映异构化合物。特别是在本发明的一个优选的实施方式中,本发明的“富含异构体的混合物”具有(分别相对于所有异构体的物质量)至少80%、至少85%、至少90%、至少95%、至少98%、至少99%的异构体、特别是其中一种非对映异构化合物。表述“由3s-蒈酮和3r-蒈酮构成的富含异构体的混合物”(关于特定富集也称为富含3s-蒈酮或3r-蒈酮的混合物或异构体混合物)是指,所述富含异构体的混合物包含、尤其主要包含所述的非对映异构化合物,(与相对于混合物干物质重量的非对映异构化合物的干物质重量相关)尤其达到大于50%、尤其大于60%、尤其大于70%、尤其大于80%、尤其大于90%、尤其大于95%、尤其大于99%,特别是由非对映异构化合物组成。对于本发明所提供的其它富含异构体的混合物,特别是3s-蒈烷基肟和3r-蒈烷基肟以及3s-蒈烷内酰胺和3r-蒈烷内酰胺也适用的是,术语“由...富集而成的混合物”是指在混合物中主要存在各自所指出的异构体,(分别与相对于混合物干物质重量的非对映异构化合物的干物质重量相关)优选达到大于50重量%、尤其大于60重量%、尤其大于70重量%、尤其大于80重量%、尤其大于90重量%、尤其大于95重量%、尤其大于99重量%,特别是由所述非对映异构化合物组成。借助根据本发明的用于制备富含异构体的由3s-蒈酮和3r-蒈酮构成的混合物的方法,能以异构体的(分别相对于两种异构体的物质量)至少80%、特别是至少85%、优选至少90%、特别是至少95%的高收率和高纯度来获得期望的异构体,特别是没有大量的副产物、特别是不能转化或异构化为所需异构体的副产物。此外,在本发明方法中有利的是可以从环氧化物起仅在唯一的反应步骤中获得富含3s-蒈酮的异构体混合物,而无需中间步骤。除了非晶态比例提高外,由3-蒈烯合成的本发明聚酰胺还具有为100-130℃、特别是105-125℃、特别是105-115℃、110-120℃、尤其约115℃的明显更高的玻璃化转变温度tg,而不是像在大多数由再生原料制成的大多数市售聚酰胺中的约60℃。不受理论约束地,针对本发明的聚酰胺和共聚酰胺所观察到的值可能可被如此解释,即,由基于桥联的萜烯、即3-蒈烯的内酰胺、即本发明单体所制备的聚酰胺由于残留在聚合物链中的环而导致链的钩合,为此导致仅在较高温度出现的软化(玻璃化转变温度)。这允许聚合物可适用的更宽温度范围。由于3-蒈烯的分子结构,当反应生成内酰胺时可能出现两种不同的非对映异构体。根据本发明,在特定实施方式中可行的是,通过经济上有利的方法在立体中心有高选择性地合成两种异构体。根据本发明的、优选也可选择性由r-蒈烷内酰胺制备的3r-聚蒈烷酰胺(也称为3r-聚酰胺)是非晶态的,优选是完全非晶态的,并且其玻璃化转变温度tg为约100-130℃、特别是105-125℃、特别是110-120℃。因此,该材料展现出迄今对于市售有利的生物基聚酰胺所不知道的特性。优选也可选择性地由3s-蒈烷内酰胺制备的、根据本发明的3s-聚蒈烷酰胺(具有交换的新立体中心)是部分结晶的,其熔点tm在230-290℃、尤其是240-285℃、尤其是260-290℃的范围内,其中,玻璃化转变温度也在100-130℃、尤其是105-125℃、尤其是110-120℃范围内。除了非晶态范围外存在于分子中的结晶结构允许在明显更高的温度中应用。此外,本发明的3s-蒈烷内酰胺在优选实施方式中具有如下特点,3s-蒈烷内酰胺可与其它内酰胺、优选是己内酰胺(cl)或月桂精内酰胺(ll)共聚合。3s-蒈烷内酰胺此时最好在达到由在聚合开始时的单体量比所确定的最大值的至少1%、尤其是至少10%、尤其至少50%、尤其是至少70%、尤其是至少80%、最高达到100%的情况下被嵌入共聚蒈烷酰胺中。本发明因此也涉及3s-共聚蒈烷酰胺,其由3s-蒈烷内酰胺和至少另一种内酰胺且优选是3r-蒈烷内酰胺、己内酰胺和/或月桂精内酰胺制备或可制备。本发明的3s-蒈烷内酰胺-月桂精内酰胺-共聚蒈烷酰胺在优选实施方式中具有如下特点,即,随着3s-蒈烷内酰胺被渐增嵌入而显露出非晶相。这允许结晶度调节。另外,3s-蒈烷内酰胺-月桂精内酰胺-共聚蒈烷酰胺在优选实施方式中具有如下特点,即,随着3s-蒈烷内酰胺的渐增嵌入而可以得到较高的tg。这允许采用比pa12(聚酰胺12)更高的温度。本发明的3s-蒈烷内酰胺-己内酰胺-共聚蒈烷酰胺的特点优选是,随着3s-蒈烷内酰胺渐增嵌入而显露出非晶相。这允许结晶度调节。此外,3s-蒈烷内酰胺-月桂精内酰胺-共聚蒈烷酰胺在优选实施方式中具有如下特点,即,随着3s-蒈烷内酰胺被渐增嵌入而可获得较高的tg。这允许采用比pa6更高的温度。另外,本发明的3r-蒈烷内酰胺在优选实施方式中的特点是,3r-蒈烷内酰胺可以与其它内酰胺、优选是己内酰胺或月桂精内酰胺共聚合。在此,3r-蒈烷内酰胺优选在达到由在聚合开始时的单体量比所确定的最大值的至少1.0%、尤其是至少10%、尤其至少50%、尤其至少70%、尤其至少80%、最高达到100%的情况下被嵌入共聚蒈烷酰胺中。本发明因此也涉及3r-共聚蒈烷酰胺,其由3r-蒈烷内酰胺和至少另一种内酰胺、优选是3s-蒈烷内酰胺、己内酰胺和/或月桂精内酰胺制备或可制备。本发明的3r-蒈烷内酰胺-月桂精内酰胺-共聚蒈烷酰胺在优选实施方式中的特点是,随着3r-蒈烷内酰胺被渐增嵌入而显露出非晶相。这允许结晶度调节。此外,3r-蒈烷内酰胺-月桂精内酰胺-共聚蒈烷酰胺在优选实施方式具有如下特点,即,随着3r-蒈烷内酰胺被渐增嵌入而可获得较高的tg。这允许采用比pa12更高的温度。本发明的3r-蒈烷内酰胺-己内酰胺-共聚蒈烷酰胺在优选实施方式中的特点是,随着3r-蒈烷内酰胺被渐增嵌入而显露出非晶相。这允许结晶度调节。此外,3r-蒈烷内酰胺-月桂精内酰胺-共聚蒈烷酰胺在优选实施方式中具有如下特点,即,随着3r-蒈烷内酰胺被渐增嵌入而可获得较高的tg。这允许采用比pa6更高的温度。以下的表1a)和1b)公开了本发明的3r-聚蒈烷酰胺和3s-聚蒈烷酰胺、其共聚物以及与月桂精内酰胺和己内酰胺的共聚物的优选性能。表1a:本发明的3s-聚蒈烷酰胺、3r-聚蒈烷酰胺、3s-蒈烷内酰胺-3r-蒈烷内酰胺-共聚蒈烷酰胺、3s-蒈烷内酰胺-月桂精内酰胺-共聚蒈烷酰胺和3s-蒈烷内酰胺-己内酰胺-共聚蒈烷酰胺的性能(根据方法(3.1)、(3.2)和(4.2))。本发明的聚酰胺的另一特征可以得自针对3s-聚蒈烷酰胺(图78)、3r-聚蒈烷酰胺(图79)和3r/3s-共聚蒈烷酰胺(图80)的各自gpc曲线。表1b:根据本发明的3s-聚蒈烷酰胺、3r-聚蒈烷酰胺和3s-蒈烷内酰胺-3r-蒈烷内酰胺-共聚蒈烷酰胺的性能(根据方法(3)和(4.1))。本发明的聚酰胺的另一个特征可以得自针对3s-聚蒈烷酰胺(图51-60)、3r-聚蒈烷酰胺(图62-71)和3s/3r-共聚蒈烷酰胺(图72)、3s-蒈烷内酰胺-月桂精内酰胺-共聚蒈烷酰胺(图73-75)和3s-蒈烷内酰胺-蒈烷内酰胺-共聚蒈烷酰胺(图76-77)的各自的gpc曲线。本发明的3s-聚蒈烷酰胺(也称为3s-聚酰胺)在优选实施方式中具有如下特点,即,3s-聚蒈烷酰胺具有100-130℃、尤其是105-125℃、尤其是110-120℃的玻璃化转变温度或玻璃化转变范围(tg),具有230-300℃、尤其是230-290℃、尤其是250-300℃、尤其是255-295℃、尤其是260-290℃的熔点或者说熔融范围(tm),并且在优选实施方式中具有5.5×104-7.5×104克/摩尔、尤其是6.5×104克/摩尔的数均摩尔质量(mn),并在优选实施方式中具有0.4×104-2.4×104克/摩尔、尤其是1.4×104克/摩尔的重均摩尔质量(mw)(mn和mw根据方法(4.1)来测定)。本发明的3s-聚蒈烷酰胺(也称为3s-聚酰胺)最好具有以下特点,即,3s-聚蒈烷酰胺具有100-130℃、尤其是105-125℃、尤其是110-120℃的玻璃化转变温度或玻璃化转变范围(tg),以及具有230-300℃、尤其是230-290℃、尤其是250-300℃、尤其是255-295℃、尤其是260-290℃的熔点或熔融范围(tm),并且在优选实施方式中具有1.0-100kda、尤其是5-50kda、尤其是5-25kda、尤其是10-70kda的数均摩尔质量(mn),以及在优选实施方式中具有1.0-200kda、尤其是5-50kda、尤其是5-25kda、尤其是15-110kda的重均摩尔质量(mw)(mn和mw根据方法(4.2)来测定)。本发明的3s-聚蒈烷酰胺最好可以根据本发明方法之一来制备。此外在优选实施方式中,本发明的3s-聚蒈烷酰胺在优选实施方式中在借助于尤其根据实施例7.1.1-7.1.11的阴离子开环聚合进行聚合之后具有1.0-10,尤其是1.0-5、尤其是1.0-2.5、尤其是1.0-1.3的多分散指数(pd)。本发明的3r-聚蒈烷酰胺的特点优选是,3r-聚蒈烷酰胺具有100-130℃、尤其是105-125℃、尤其110-120℃的玻璃化转变温度(tg),并且在优选实施方式中具有2.0×105-4.0×105克/摩尔、尤其是3.0×105克/摩尔的数均摩尔质量(mn),并且在优选实施方式中具有0.1×105-2.1×105克/摩尔、尤其是1.1×105克/摩尔的重均摩尔质量(mw)(mn和mw根据方法(4.1)来测定)。本发明的3r-聚蒈烷酰胺最好具有如下特点,即,3r-聚蒈烷酰胺具有100-130℃、尤其是105-125℃、尤其是110-120℃的玻璃化转变温度(tg),并且在优选实施方式中具有1.0-100kda、尤其是10-70kda的数均摩尔质量(mn),并且在优选实施方式中具有1.0-200kda、尤其是15-110kda的重均摩尔质量(mw)(mn和mw根据方法(4.2)来测定)。优选地,本发明的3r-聚蒈烷酰胺可以根据本发明方法之一来制备。此外在优选实施方式中,本发明的3r-聚蒈烷酰胺在优选实施方式中在借助于尤其根据实施例7.2.1-7.2.10的阴离子开环聚合进行聚合之后具有1.0-10、尤其是1.0-5、尤其是1.0-2.5、尤其是1.0-1.3的多分散指数(pd)。本发明的也称为3s-蒈烷内酰胺-3r-蒈烷内酰胺-共聚蒈烷酰胺的3s/3r-共聚酰胺最好具有如下特点,即,3s/3r-聚酰胺具有100-130℃、尤其是105-125℃、尤其是110-120℃的玻璃化转变温度(tg),具有250-300℃、尤其是255-295℃、尤其是260-290℃的熔融范围,并且在优选实施方式中具有2.2×104-4.2×104克/摩尔、尤其是3.2×104克/摩尔的数均摩尔质量(mn),并且在优选实施方式中具有0.1×105-2.1×105克/摩尔、尤其是1.1×105克/摩尔的重均摩尔质量(mn和mw根据方法(4.1)来测定)。本发明的也被称为3s-蒈烷内酰胺-3r-蒈烷内酰胺-共聚蒈烷酰胺的3s/3r-共聚酰胺优选具有如下特点,即,3s/3r-聚酰胺具有100-130℃、尤其是105-125℃、尤其是110-120℃的玻璃化转变温度(tg),具有250-300℃、尤其是255-295℃、尤其是260-290℃的熔融范围,并且在优选实施方式中具有1.0-100kda、尤其是10-70kda的数均摩尔质量(mn),并且在优选实施方式中具有1.0-200kda、尤其是15-110kda的重均摩尔质量(mw)(mn和mw根据方法(4.2)来测定)。优选地,本发明的3s-蒈烷内酰胺-3r-蒈烷内酰胺-共聚蒈烷酰胺可以根据本发明方法之一来制备。另外,在优选实施方式中,本发明的3s-蒈烷内酰胺-3r-蒈烷内酰胺-共聚蒈烷酰胺在优选实施方式中在借助于尤其根据实施例7.3.2的阴离子开环聚合进行聚合之后具备1.0-10、尤其1.0-5、尤其1.0-2.5、尤其是1.0-1.3的多分散指数(pd)。本发明的3s-蒈烷内酰胺-月桂精内酰胺-共聚蒈烷酰胺最好具有以下特点,即,在3s-蒈烷内酰胺-月桂精内酰胺-共聚蒈烷酰胺内的3s-蒈烷内酰胺与月桂精内酰胺之比为1:1.4的情况下,玻璃化转变温度(tg)处于45-65℃、尤其是50-60℃,它根据dsc方法(3.2)不具有熔点,并且在优选实施方式中具有1.0-100kda、尤其是10-70kda的数均摩尔质量(mn),并且在优选实施方式中具有1.0-200kda、尤其是15-110kda的重均摩尔质量(mn和mw根据方法(4.2)来测定),优选地,它可以按照本发明方法之一来制备。本发明的3s-蒈烷内酰胺-月桂精内酰胺-共聚蒈烷酰胺最好具有以下特点,即,在3s-蒈烷内酰胺-月桂精内酰胺-共聚蒈烷酰胺内的3s-蒈烷内酰胺与月桂精内酰胺之比为1:2情况下,玻璃化转变温度(tg)处于35-55℃、尤其是40-50℃,它根据dsc方法(3.2)不具有熔点,并且在优选实施方式中具有1.0-100kda、尤其是10-70kda的数均摩尔质量(mn),并且在优选实施方式中具有1.0-200kda、尤其是15-110kda的重均摩尔质量(mn和mw根据方法(4.2)来测定),优选地,它可以根据本发明方法之一来制备。在优选实施方式中,本发明的3s-蒈烷内酰胺-月桂精内酰胺-共聚蒈烷酰胺还在借助于尤其是根据实施例8.1.1-8.1.3的阴离子开环聚合进行聚合之后具有1.0-10、尤其是1.0-5、尤其是1.0-2.5、尤其是1.0-1.3的多分散指数(pd)。本发明的3s-蒈烷内酰胺-己内酰胺-共聚蒈烷酰胺最好具有以下特点,即,在3s-蒈烷内酰胺-月桂精内酰胺-共聚蒈烷酰胺中的3s-蒈烷内酰胺与己内酰胺之比为1:4.6的情况下,玻璃化转变温度(tg)处于50-100℃、尤其是50-75℃、尤其是50-70℃、尤其是58-68℃,它根据dsc方法(3.2)具有140-220℃、尤其是155-200℃的熔融范围,并且在优选实施方式中具有1.0-100kda、尤其是10-70kda的数均摩尔质量(mn),并且在优选实施方式中具有1.0-200kda、尤其是15-110kda的重均摩尔质量(mn和mw根据方法(4.2)来测定),优选地,它可以根据本发明方法之一来制备。根据本发明的3s-蒈烷内酰胺-己内酰胺-共聚蒈烷酰胺最好有以下特点,即,在3s-蒈烷内酰胺-月桂精内酰胺-共聚蒈烷酰胺中的3s-蒈烷内酰胺与己内酰胺之比为1:1.2的情况下,玻璃化转变温度(tg)处于70℃-100℃、尤其处于80℃-93℃,其根据dsc方法(3.2)不具有熔点,并且在优选实施方式中具有1.0kda-100kda、尤其是10kda-70kda的数均摩尔质量(mn),并且在优选实施方式中具有1.0kda-200kda、尤其是15kda-110kda的重均摩尔质量(mn和mw按照方法(4.2)测定),优选地,它可以根据本发明方法之一来制备。此外在优选实施方式中,本发明的3s-蒈烷内酰胺-己内酰胺-共聚蒈烷酰胺在优选实施方式中在借助于尤其根据实施例8.1.1-8.1.3的阴离子开环聚合进行聚合之后具备1.0-10、尤其是1.0-5、尤其是1.0-2.5、尤其是1.0-1.3的多分散指数(pd)。通过适当选择反应条件而可以从同一初始化合物、尤其最好是天然物质即3-蒈烯起,以高选择性合成本发明内酰胺的第一异构体以及本发明内酰胺的第二异构体,第一异构体可基于其立体化学而转化成主要非晶态的聚酰胺,而第二异构体的聚酰胺是部分结晶的,其中,两种聚酰胺具有在100℃-130℃范围内的、尤其是110℃的玻璃化转变温度,其中,3s-蒈烷内酰胺可反应生成部分结晶的聚酰胺,3r-蒈烷内酰胺可反应生成非晶态聚酰胺。本发明的方法允许有目的地调节聚酰胺的结晶度并且提供富含异构体的3-蒈烷内酰胺和基于此的聚酰胺,其具有高光学纯度。利用本发明的聚酰胺,聚酰胺的因其化学稳定性而有价值的聚合物等级的应用领域可被进一步扩大。与pa66相似地,可以实现承受机械载荷和热载荷的构件比如筒子体、钻机壳体、卡车油盘等,以及因为有较高的耐热性而可以在超过100℃的温度下长期使用。完全非晶态的聚酰胺也提供了在透明塑料范围内的应用可能性。所述应用领域的组合也是可行的,由此,迄今已知的生物基聚酰胺的应用领域与此相关地可以通过本发明的聚酰胺被明显扩展。因此,本发明提供如下聚酰胺,其尤其以3s-聚蒈烷酰胺、3r-聚蒈烷酰胺、3s/3r-共聚蒈烷酰胺的形式或由至少其中一种本发明蒈烷内酰胺和至少另一种其它内酰胺组成的共聚蒈烷酰胺形式来构成。关于本发明,根据本发明的包含本发明单体的聚酰胺因此也能以共聚蒈烷酰胺(简称:共聚酰胺)的形式存在。本发明因此也涉及由本发明聚酰胺可制备或制备的塑料件,尤其是这种塑料件,其由本发明的聚酰胺构成或包含本发明的聚酰胺,尤其是大量包含聚酰胺,例如(相对于塑料件的总重量)占比分别超过5%、10%、15%、20%、30%、40%、50%、60%、70%、80%、90%或95%。本发明优选规定,在方法步骤a)中采用的3-环氧蒈烷是3s-环氧蒈烷,在方法步骤c)中得到的富含异构体的混合物是(相对于蒈酮、即3r-蒈酮和3s-蒈酮的总物质量)3s-蒈酮所占异构体比例为至少80%、尤其是至少85%、至少90%或至少95%的富含3s-蒈酮的混合物。还优选的是,在方法步骤a)中采用的3-环氧蒈烷是3r-环氧蒈烷,在方法步骤c)中得到的富含异构体的混合物是(相对于蒈酮的总物质量)3r-蒈酮所占异构体比例为至少80%、尤其是至少85%、至少90%或至少95%的富含3r-蒈酮的混合物。在一个优选实施方式中规定,该酸性催化剂是路易斯酸或质子酸或由路易斯酸和质子酸所构成的混合物。在另一个优选实施方式中规定,该酸性催化剂是强质子酸或pk最高为0.7的质子酸。还优选规定,该酸性催化剂是pk最高为0.7的质子酸,譬如磺酸、尤其是对甲苯磺酸(ptsa)、甲烷磺酸或三氟甲烷磺酸。优选该酸性催化剂是磺酸。还优选的是,该酸性催化剂是具有强酸阴离子、尤其是磺酸阴离子或者像氯酸盐、三氟甲烷磺酸盐(otf)或高氯酸盐(clo4)这样的阴离子的路易斯酸。还优选规定,酸性催化剂是路易斯酸铁、路易斯酸镍、路易斯酸铜、路易斯酸钴或路易斯酸锌、优选是路易斯酸铁。还优选规定,该酸性催化剂是具有尤其强酸阴离子的路易斯酸,或者是尤其是强质子酸或pk最高为0.7的尤其是强质子酸。还优选规定,作为路易斯酸的阴离子,采用尤其强酸阴离子、如磺酸阴离子,或者采用像氯酸盐或高氯酸盐这样的阴离子。还优选规定,作为用于路易斯酸的、尤其是用于路易斯酸铁、路易斯酸镍、路易斯酸钴、路易斯酸铜或路易斯酸锌的阴离子,采用氯酸盐和/或高氯酸盐和/或磺酸盐。优选地,作为路易斯酸可采用fe(clo4)2·h2o、ni(clo4)2、co(clo4)2、cu(clo4)2或其相应水合物。在一个优选实施方式中,该酸性催化剂是路易斯酸尤其是路易斯酸铁、路易斯酸铜、路易斯酸钴、路易斯酸镍或路易斯酸锌且优选是路易斯酸铁,其具有尤其是强酸阴离子、最好是三氟甲烷磺酸盐或高氯酸盐,或者该酸性催化剂是pk最高为0.7的强质子酸如磺酸、尤其是对甲苯磺酸、甲烷磺酸、三氟甲烷磺酸,或者是由前述路易斯酸和质子酸所构成的混合物。还优选规定,酸性催化剂是由前述路易斯酸和质子酸所构成的混合物。还优选规定,作为酸性催化剂采用沸石尤其是zsm-5。这还具有以下优点,即,沸石可事先作为可分离固体被添加至反应混合物并因此可以通过过滤被分离出。还优选规定,在气相重排中,作为酸性催化剂采用酸性多相催化剂。在另一个优选实施方式中规定,在优选实施方式中预定的第一有机溶剂是非极性溶剂或相对极性最多为0.310、尤其最高是0.200、优选最高是0.100的溶剂。在另一个优选实施方式中规定,第一有机溶剂是尤其非极性的溶剂比如脂肪族或芳香族的碳氢化合物、最好是二甲苯、甲苯、环己烷、正戊烷、己烷或正庚烷。在另一个优选实施方式中规定,第一有机溶剂是2-甲基-四氢呋喃、四氢呋喃、醋酸乙酯、氯仿或者二氯甲烷。在另一个优选实施方式中规定,第一有机溶剂是相对极性最高为0.310、尤其最高为0.200、优选最高为0.100的溶剂。关于本发明,术语“相对极性”是指就像在文献“有机化学中的溶剂和溶剂作用”(christianreichards,wiley-vch出版社,第3版,2003)中所描述的极性。从实施例1.1的表中得到环己烷、己烷、正庚烷和甲苯的相对极性。对于其它溶剂的其它相对极性,参阅reichards的所述文献。还优选规定,在根据方法步骤a)和b)的反应混合物中,3-环氧蒈烷以至少0.1m、最好是0.25m至5m、尤其是0.3至3m、特别最好是0.5m至2m、尤其是0.75至1.5m、尤其是1m的浓度被加入。这具有如下优点,即,在低浓度情况下不仅能有利地影响总选择性、也有利地影响异构体选择性。在优选实施方式中规定,在3s-环氧蒈烷的转化率至少为80%情况下,该方法具有相对于由3r-蒈酮和3s-蒈酮构成的混合物总量的至少50%、尤其是至少70%的选择性,并且其中,由3r-蒈酮和3s-蒈酮构成的混合物具有至少80%、最好至少85%的3s-蒈酮。还优选规定,酸性催化剂在根据方法步骤a)和b)的反应混合物中以相对于所加入的3-环氧蒈烷的0.01摩尔%至2.0摩尔%的浓度被加入。还优选规定,酸性催化剂在根据方法步骤a)和b)的反应混合物中以相对于所加入的3-环氧蒈烷的0.01摩尔%至2.0摩尔%、尤其是0.05摩尔%至1.0摩尔%、尤其是0.1摩尔%至0.5摩尔%、尤其是0.15摩尔%至0.25摩尔%、尤其优选0.2摩尔%的浓度被加入。用于方法步骤b)的反应时间最好为2分钟-25小时,尤其是5-24小时,尤其是5-20小时,尤其是30分钟-1小时,尤其是10分钟-40分钟。本发明在优选实施方式中涉及一种由3s-环氧蒈烷制备富含异构体的由3s-蒈酮和3r-蒈酮构成的混合物的方法,包括如下方法步骤:a)提供反应混合物,其含有3s-环氧蒈烷、至少一种酸性催化剂和第一有机溶剂,其中,该酸性催化剂是磺酸或者是选自由fe(clo4)2·h2o、ni(clo4)2、co(clo4)2、ni(clo4)2或cu(clo4)2构成的组的路易斯酸,或者是上述酸的混合物,并且其中,第一有机溶剂选自由甲苯、环己烷、正戊烷、己烷、正庚烷、2-甲基-四氢呋喃、四氢呋喃、醋酸乙酯和二氯甲烷构成的组,b)在反应混合物中的3s-环氧蒈烷在-40℃至140℃的温度下发生重排反应,和c)得到(相对于蒈酮的总物质量)3s-蒈酮所占异构体比例为至少80%的富含异构体的混合物。本发明也涉及一种前述的用于由3s-环氧蒈烷制备由3s-蒈酮和3r-蒈酮构成的富含异构体的混合物的方法,其中,酸性催化剂是选自由对甲苯磺酸(ptsa)、甲基磺酸和三氯甲基磺酸构成的组的磺酸。在一个特别优选实施方式中,在方法步骤a)中所加入的3-环氧蒈烷在方法步骤a1)中通过3-蒈烯的环氧化来获得。在另一个优选实施方式中规定,在方法步骤a)中加入的初始化合物是3s-环氧蒈烷,并且在方法步骤a1a)中通过3-蒈烯的环氧化而在存在a)过氧化酸如稀释的过醋酸或者b)过氧化物例如h2o2和酶的情况下来得到。在优选实施方式中,所述酶例如可以是尤其是来自念珠菌属、尤其是南极假丝酵母的脂肪酶如脂肪酶b。在另一个优选实施方式中规定,在方法步骤a)中采用的初始化合物是3r-环氧蒈烷,在方法步骤a1b)中通过3-蒈烯的环氧化而在存在n-溴代丁二酰亚胺(nbs)且可选地还存在有碱的情况下来获得。在一个特别优选实施方式中规定,在方法步骤c)中获得的富含异构体的混合物被纯化,尤其是离析形式来获得,尤其是酸性催化剂和/或第一溶剂被分离出,和/或该混合物或许经受进一步处理例如干燥。如果根据本发明由3s-环氧蒈烷得到富含3s-蒈酮达到至少80%的混合物,则它可以根据希望被反应成富含3r-蒈酮的混合物,以便因此能够在本发明的其它方法步骤中制备3r-蒈烷内酰胺、最好是3r-聚蒈烷酰胺。在一个优选实施方式中规定,优选在方法步骤c)中自3s-环氧蒈烷得到的富含3s-蒈酮的混合物在至少一种第二溶剂中在存在碱或质子酸情况下在方法步骤d)中被异构化成(相对于蒈酮的总物质量)3r-蒈酮所占异构体比例为至少50%、尤其至少60%、尤其至少70%、尤其至少80%、尤其至少85%、尤其至少90%或尤其是至少95%的富含3r-蒈酮的混合物。优选规定,该碱是氢氧化钾或氢氧化钠或者其它强碱。还优选规定,该碱是醇化物、尤其是甲醇盐。优选规定,质子酸是pk最高为0.7的质子酸。还优选规定,质子酸是强质子酸。质子酸优选是氯化氢水溶液(也称为hcl水溶液或者盐酸)或者硫酸。质子酸优选是磺酸。还优选规定,第二溶剂是相对极性为至少0.200的非质子极性溶剂,或是相对极性为至少0.200的质子极性溶剂。还优选规定,相对极性为至少0.200的非质子极性溶剂是像四氢呋喃、醋酸乙酯、氯仿、二氯甲烷、丙酮或乙腈这样的溶剂,尤其是丙酮或乙腈。还最好规定,相对极性为至少0.200的质子极性溶剂是像水、醇、胺类、碳酸或酰胺这样的溶剂。还优选规定,相对极性为至少0.200的质子极性溶剂是醇,如甲醇、乙醇、丙醇或丁醇。用于方法步骤d)的反应时间最好为2-80小时,尤其是5-68小时,最好是4-12小时,尤其是4-10小时。在一个优选实施方式中规定,在方法步骤d)中,优选在方法步骤c)中自3s-环氧蒈烷得到的富含3s-蒈酮的混合物在至少一种第二溶剂中、在存在尤其是强碱或pk最多为0.7的尤其强质子酸的情况下被异构化成(相对于蒈酮的总物质量)3r-蒈酮所占异构体比例为至少50%、尤其是至少60%、尤其是至少70%、尤其是至少80%、尤其是至少85%、尤其至少90%或尤其至少95%的富含3r-蒈酮的混合物,在这里,第二溶剂是相对极性为至少0.200的非质子极性溶剂,或者相对极性为至少0.200的质子极性溶剂。在一个特别优选实施方式中规定,在方法步骤d)中,优选在方法步骤c)中自3s-环氧蒈烷得到的富含3s-蒈酮的混合物在至少一种第二溶剂中、在存在尤其是强碱或pk最多为0.7的尤其是强质子酸、优选是磺酸溶液或盐酸溶液且最好是6%盐酸溶液的情况下被异构化成(相对于蒈酮的总物质量)3r-蒈酮所占异构体比例为至少50%、尤其是至少60%、尤其是至少70%、尤其是至少80%、尤其是至少85%、尤其是至少90%或尤其是至少95%的富含3r-蒈酮的混合物,在这里,第二溶剂是选自由四氢呋喃、醋酸乙酯、氯仿、二氯甲烷、丙酮和乙腈构成的组的、相对极性为至少0.200的非质子极性溶剂,或是选自由水、醇(尤其是甲醇、乙醇、丙醇、丁醇)、胺类、碳酸和酰胺构成的组的、相对极性为至少0.200的质子极性溶剂。该实施方式具有如下优点,即,可以在没有大量副产物的情况下、即以大的总体选择性来获得3r-蒈酮。当在方法步骤a)中作为酸性催化剂采用磺酸时还有利的是,为了重排生成3r-蒈酮,在方法步骤d)中可以在溶剂分离之后采用所述磺酸作为催化剂。根据本发明,在一种用于制备由3r-蒈酮和3s-蒈酮构成的富含异构体的混合物的方法中特别优选的是,在方法步骤a)中采用酸、尤其是磺酸或路易斯酸作为酸性催化剂。此实施方式具有以下优点,即,在溶剂蒸馏分离之后,不必添加其它的酸来催化以重排生成3r-蒈酮。在另一个优选实施方式中规定,在方法步骤d)中得到的经过异构化处理的富含异构体的混合物被纯化,尤其是以离析形式来获得,尤其是第二溶剂和/或酸或碱被分离出和/或该混合物或许经历其它的方法步骤例如干燥。在另一个实施方式中规定,在另一个方法步骤e)中,在方法步骤c)或d)中获得的由3s-蒈酮和3r-蒈酮构成的富含异构体的混合物在存在至少一种第三有机溶剂、碱和羟胺最好是盐酸羟胺(honh2·hcl)的情况下反应生成(相对于蒈烷基肟、即3r-蒈烷基肟和3s-蒈烷基肟的总物质量)3s-蒈烷基肟或3r-蒈烷基肟所占异构体比例为至少80%、尤其是至少85%、至少90%或至少95%的富含3-蒈烷基肟的混合物。如果在方法步骤e)中采用来自方法步骤c)或d)的富含3r-蒈酮的混合物,就将获得富含3r-蒈烷基肟的混合物。如果在方法步骤e)中采用根据方法步骤c)得到的富含3s-蒈酮的混合物,则将得到富含3s-蒈烷基肟的混合物。优选规定,第三有机溶剂是像醚、腈、醇这样的有机溶剂或含有水和前述第三有机溶剂之一的含水有机溶剂。还优选规定,该醚是四氢呋喃或2-甲基四氢呋喃。还优选规定,该腈是乙腈。还优选规定,该醇是甲醇、乙醇或异丙醇。在优选实施方式中,该碱是醋酸钠(naoac)。在一个优选实施方式中规定,在另一个方法步骤e)中,在方法步骤c)或d)中获得的由3s-蒈酮和3r-蒈酮构成的富含异构体的混合物在存在至少一种第三有机溶剂、碱和羟胺最好是盐酸羟胺(honh2·hcl)的情况下反应生成(相对于蒈烷基肟的总物质量)3s-蒈烷基肟或3r-蒈烷基肟所占异构体比例为至少80%、尤其至少85%、至少90%或至少95%的富含3-蒈烷基肟的混合物,其中,所述第三有机溶剂选自由醚(尤其是四氢呋喃、2-甲基四氢呋喃)、腈(尤其是乙腈)、醇(尤其是甲醇、乙醇和异丙醇)或者含有水和上述第三有机溶剂之一的含水有机溶剂构成的组。由此方法获得的富含3-蒈烷基肟的混合物提供如下优点,即,所期望的异构体以高占比存在于混合物中,因此从初始反应物开始,初始反应物的绝大部分能以高收率转化为期望产品、即用于期望单体的期望中间产物。在一个特别优选的实施方式中规定,在方法步骤e)中得到的富含3-蒈烷基肟的混合物被纯化,尤其以离析方式来获得,尤其是第三溶剂和/或碱和/或羟胺被分离出,和/或该混合物或许经历其它的方法步骤例如干燥。在另一个实施方式中规定,在另一个方法步骤f)中,在方法步骤e)中得到的富含3-蒈烷基肟的混合物最好在未经在先的纯化情况下重排反应成(相对于蒈烷内酰胺、即3r-蒈烷内酰胺和3s-蒈烷内酰胺的总物质量)3s-蒈烷内酰胺或3r-蒈烷内酰胺所占异构体比例为至少80%的富含3-蒈烷内酰胺的混合物。假定在方法步骤f)中采用来自方法步骤e)的富含3s-蒈烷基肟的混合物,则得到富含3s-蒈烷内酰胺的混合物、尤其是3s-蒈烷内酰胺。如果根据方法步骤e)所得到的富含3r-蒈烷基肟的混合物被用在方法步骤f)中,则得到富含3r-蒈烷内酰胺的混合物、尤其是3r-蒈烷内酰胺。在一个优选实施方式中规定,在另一个方法步骤f1)中,在方法步骤e)中得到的富含3-蒈烷基肟的混合物被调温到预定温度,并且在添加碱和对甲苯磺酸氯盐的情况下被重排反应成(相对于蒈烷内酰胺的总物质量)3s-蒈烷内酰胺或3r-蒈烷内酰胺所占异构体比例为至少80%、尤其是至少85%、至少90%或至少95%的富含3-蒈烷内酰胺的混合物。还优选规定,在方法步骤f1)中预定的温度为0-50℃,最好是10-40℃,最好是5-20℃,尤其是10-18℃。还优选规定,该碱是含水碱液。还优选的是,该碱是氢氧化钾溶液或氢氧化钠溶液。还优选规定,该重排是贝克曼重排。在一个优选实施方式中规定,在另一个方法步骤f1)中,在方法步骤e)中得到的富含3-蒈烷基肟的混合物被调温到-10℃至50℃、尤其是5℃至20℃、尤其是10℃至18℃的温度,并且在添加碱(尤其是含水碱液、最好是氢氧化钾溶液或氢氧化钠溶液)和对甲苯磺酸氯盐的情况下通过贝克曼重排反应成(相对于蒈烷内酰胺的总物质量)3s-蒈烷内酰胺或3r-蒈烷内酰胺所占异构体比例为至少80%、尤其至少85%、至少90%或至少95%的富含3-蒈烷内酰胺的混合物。这具有如下优点,即,除了在以醇为溶剂时,在没有中间的纯化步骤或溶剂替换情况下,从3-蒈酮到3-蒈烷基肟再到3-蒈烷内酰胺的转化可以在包含方法步骤e)和f)的一锅法中进行,例如在使用乙腈作为溶剂且使用盐酸羟胺、naoh和甲基苯磺酰氯的情况下,因此所述方法是极其快速、高效和经济的。在此情况下,获得与如下方法时同等的收率,其中,这些方法步骤在溶剂替换情况下先后执行。还优选规定,在另一个方法步骤f2)中,在方法步骤e)中得到的富含3-蒈烷基肟的混合物被调温到预定温度,并且在添加尤其是强路易斯酸情况下被重排反应成(相对于蒈烷内酰胺的总物质量)3s-蒈烷内酰胺或3r-蒈烷内酰胺所占异构体比例为至少80%、尤其是至少85%、至少90%或至少95%的富含3-蒈烷内酰胺的混合物。还优选规定,在方法步骤f2)中预定的温度为15-100℃、最好是77-87℃、特别优选是82℃。还优选规定,调温到溶剂的沸点,其中,该溶剂是在方法步骤e)中得到的富含3-蒈烷基肟的混合物溶解于或存在于其中的溶剂。优选规定,在方法步骤e)中得到的富含3-蒈烷基肟的混合物溶解于或存在于其中的溶剂是乙腈。还优选规定,路易斯酸是强路易斯酸。还优选规定,路易斯酸是in(clo4)3·nh2o(高氯酸铟n水合物)和/或zn(clo4)2·nh2o(高氯酸锌n水合物)。还优选规定,路易斯酸是in(cf3so3)3(三氟甲烷磺酸铟)和/或zn(cf3so3)2(三氟甲烷磺酸锌)。还优选规定重排是贝克曼重排。优选规定,在另一个方法步骤f2)中,在方法步骤e)中得到的富含3-蒈烷基肟的混合物被加热到77-87℃、尤其82℃的温度,且在添加尤其是强路易斯酸比如in(clo4)3·nh2o和/或zn(clo4)2·nh2o情况下被重排反应成(相对于蒈烷内酰胺的总物质量)3s-蒈烷内酰胺或3r-蒈烷内酰胺所占异构体比例为至少80%、尤其至少85%、至少90%或至少95%的富含3-蒈烷内酰胺的混合物,其中,自方法步骤e)得到的富含3-蒈烷基肟的混合物最好溶解于或存在于乙腈中。在一个特别优选实施方式中规定,在方法步骤f)中得到的富含3-蒈烷内酰胺的混合物被进一步纯化,尤其以离析形式来获得,尤其是所述碱和/或对甲苯磺酸氯盐被分离出,和/或该混合物或许经历其它方法步骤例如干燥。在一个优选实施方式中规定,在方法步骤g)中,最好在未经在先纯化的情况下,从在方法步骤f)中得到的富含3s-蒈烷内酰胺的混合物中通过结晶如蒸馏尤其是分级蒸馏来获得3s-蒈烷内酰胺。还优选规定,在尤其根据方法步骤g)分离出3s-蒈烷内酰胺之后,在方法步骤h)中从在方法步骤f)中得到的富含3-蒈烷内酰胺的混合物中获得3r-蒈烷内酰胺,优选通过结晶、例如通过蒸馏尤其是分级蒸馏。在本发明的一个优选实施方式中规定,在方法步骤i)中,所得到3s-蒈烷内酰胺、3r-蒈烷内酰胺或由3r-蒈烷内酰胺和3s-蒈烷内酰胺所构成的混合物被聚合成3s-聚蒈烷酰胺、3r-聚蒈烷酰胺或者3s/3r-共聚蒈烷酰胺,优选通过阳离子开环聚合、阴离子开环聚合、水解聚合或缩聚。根据本发明,本发明也涉及一种用于制备富含3-蒈烷基肟的混合物的方法,包含本发明的方法步骤a)、b)、c),在优选实施方式中还包含方法步骤a1)、d)、或a1)和d),其中,在另一个方法步骤e)中,在方法步骤c)或d)中得到的由3s-蒈酮和3r-蒈酮构成的富含异构体的混合物在存在至少一种第三有机溶剂、碱和羟胺且最好是盐酸羟胺(honh2·hcl)被反应成(相对于蒈烷基肟的总物质量)3s-蒈烷基肟或3r-蒈烷基肟所占异构体比例为至少80%、尤其至少85%、至少90%或至少95%的富含3-蒈烷基肟的混合物。还优选规定,第三有机溶剂是像醚、腈、醇这样的有机溶剂或含有水和前述第三有机溶剂之一的含水有机溶剂。还优选规定,醚是四氢呋喃或2-甲基四氢呋喃。还优选规定,该腈是乙腈。还优选规定,该醇是甲醇、乙醇或异丙醇。在优选实施方式中,该碱是醋酸钠(naoac)。根据本发明,本发明也涉及一种用于制备富含3-蒈烷基肟的混合物的方法,包括本发明的方法步骤a)、b)、c),在优选实施方式中还包含方法步骤a1)、d)、或a1)和d),其中,在另一个方法步骤e)中,在方法步骤c)或d)中得到的由3s-蒈酮和3r-蒈酮构成的富含异构体的混合物在存在至少一种第三有机溶剂、碱和羟胺且最好是盐酸羟胺(honh2·hcl)的情况下被反应成(相对于蒈烷基肟的总物质量)3s-蒈烷基肟或3r-蒈烷基肟所占异构体比例为至少80%、尤其至少85%、至少90%或至少95%的富含3-蒈烷基肟的混合物,其中,所述第三有机溶剂选自由醚(尤其是四氢呋喃、2-甲基四氢呋喃)、腈(尤其是乙腈)、醇(尤其是甲醇、乙醇和异丙醇)或者含有水和前述第三有机溶剂之一的含水有机溶剂构成的组。根据本发明,本发明也涉及一种用于制备富含3-蒈烷内酰胺的混合物的方法,包括根据本发明的方法步骤a)、b)、c)、e),在优选实施方式中还包含方法步骤a1)、d)、或a1)和d),其中,在另一个方法步骤f)中,在方法步骤e)中获得的富含3-蒈烷基肟的混合物被重排反应成(相对于蒈烷内酰胺的总物质量)3s-蒈烷内酰胺或3r-蒈烷内酰胺所占异构体比例为至少80%的富含3-蒈烷内酰胺的混合物。还最好规定,在制备富含3-蒈烷内酰胺的混合物的方法中,在另一个方法步骤f1)中,在方法步骤e)中获得的富含3-蒈烷基肟的混合物被调温到预定温度,并且在添加碱和对甲苯磺酸氯盐情况下被重排反应成(相对于蒈烷内酰胺的总物质量)3s-蒈烷内酰胺或3r-蒈烷内酰胺所占异构体比例为至少80%、尤其至少85%、至少90%或至少95%的富含3-蒈烷内酰胺的混合物。还优选规定,在方法步骤f1)中预定的温度为5-20℃、尤其是10-18℃。还最好规定,该碱是含水碱液。还最好规定,该含水碱液是氢氧化钾溶液或氢氧化钠溶液。还优选规定,所述重排是贝克曼重排。还最好规定,在制备富含3-蒈烷内酰胺的混合物的方法中,在另一个方法步骤f1)中,在方法步骤e)中获得的富含3-蒈烷基肟的混合物被调温到5至20℃、尤其是10至l8℃的温度,并且在添加尤其是含水碱液(尤其是氢氧化钾溶液或氢氧化钠溶液)和对甲苯磺酸氯盐情况下被重排反应、尤其是通过贝克曼重排反应为(相对于蒈烷内酰胺的总物质量)3s-蒈烷内酰胺或3r-蒈烷内酰胺所占异构体比例为至少80%、尤其是至少85%、至少90%或至少95%的富含3-蒈烷内酰胺的混合物。还优选规定,在制备富含3-蒈烷内酰胺的混合物的方法中,在另一个方法步骤f2)中,在方法步骤e)中获得的富含3-蒈烷基肟的混合物被调温到预定温度,并且在添加尤其是强路易斯酸情况下重排反应成(相对于蒈烷内酰胺的总物质量)3s-蒈烷内酰胺或3r-蒈烷内酰胺所占异构体比例为至少80%、尤其是至少85%、至少90%或至少95%的富含3-蒈烷内酰胺的混合物。还最好规定,在方法步骤f2)中预定的温度为15-100℃,最好是77-87℃,尤其最好是82℃。还最好规定,调温到溶剂的沸点,其中,该溶剂是在方法步骤e)中获得的富含3-蒈烷基肟的混合物溶解于或存在于其中的溶剂。优选规定,在方法步骤e)中获得的富含3-蒈烷基肟的混合物溶解于其中或存在于其中的溶剂是乙腈。还优选规定,路易斯酸是强路易斯酸。还最好规定,路易斯酸是in(clo4)3·nh2o和/或zn(clo4)2·nh2o。还优选规定,路易斯酸是in(cf3so3)3和/或zn(cf3so3)2。还最好规定,重排是贝克曼重排。还最好规定,在用于制备富含3-蒈烷内酰胺的混合物的方法中,在另一个方法步骤f2)中,在方法步骤e)中获得的富含3-蒈烷基肟的混合物被加热到77℃-87℃、尤其是82℃的温度,并且在添加尤其是强路易斯酸比如in(clo4)3·nh2o和/或zn(clo4)2·nh2o的情况下重排反应成(相对于蒈烷内酰胺的总物质量)3s-蒈烷内酰胺或3r-蒈烷内酰胺所占异构体比例为至少80%、尤其至少85%、至少90%或至少95%的富含3-蒈烷内酰胺的混合物,其中,从方法步骤e)获得的富含3-蒈烷基肟的混合物优选溶解于或存在于乙腈中。根据本发明,本发明也涉及一种用于由3s-蒈酮制备3s-蒈烷内酰胺的方法,其中,该方法包含方法步骤e)和f),并且其中,在方法步骤e)中采用最好通过方法步骤c)得到的、(相对于蒈酮的总物质量)3s-蒈酮所占异构体比例为至少80%、尤其是至少85%、至少90%或至少95%的由3s-蒈酮和3r-蒈酮构成的富含异构体的混合物,并且被反应成(相对于蒈烷基肟的总物质量)3s-蒈烷基肟所占异构体比例为至少80%、尤其至少85%、至少90%或至少95%的富含3s-蒈烷基肟的混合物,在方法步骤f)中在未除去来自方法步骤e)的溶剂且未离析出蒈烷基肟的情况下被反应成(相对于蒈烷内酰胺的总物质量)3s-蒈烷内酰胺所占异构体比例为至少80%、尤其是至少85%、至少90%或至少95%的富含3s-蒈烷内酰胺的混合物,并且其中,可选地在方法步骤g)中通过结晶来获得3s-蒈烷内酰胺,其中,作为方法步骤e)中的第三有机溶剂未采用醇。根据本发明,本发明也涉及一种用于由3r-蒈酮制备3r-蒈烷内酰胺的方法,其中,该方法包括方法步骤e)和f),并且其中,在方法步骤e)中采用最好通过方法步骤d)所得到的、由3s-蒈酮和3r-蒈酮构成的、(相对于蒈酮的总物质量)3r-蒈酮所占异构体比例为至少50%、尤其至少60%、尤其至少70%、尤其至少80%、尤其至少85%、尤其至少90%或尤其至少95%的富含异构体的混合物,并且反应成(相对于蒈烷基肟的总物质量)3r-蒈烷基肟所占异构体比例为至少50%、尤其至少60%、尤其至少70%、尤其至少80%、尤其至少85%、尤其至少90%或尤其至少95%的富含3r-蒈烷基肟的混合物,在方法步骤f)中在不除去来自方法步骤e)的溶剂且没有分离出蒈烷基肟的情况下反应成(相对于蒈烷内酰胺的总物质量)3r-蒈烷内酰胺所占异构体比例为至少50%、尤其至少60%、尤其至少70%、尤其至少80%、尤其至少85%、尤其至少90%或尤其至少95%的富含3r-蒈烷内酰胺的混合物,并且其中,可选地在方法步骤h)中在根据方法步骤f)通过结晶分离出3s-蒈烷内酰胺之后得到3r-蒈烷内酰胺,其中,作为方法步骤e)中的第三有机溶剂未采用醇。根据本发明,本发明也涉及一种用于制备3s-聚蒈烷酰胺、3r-聚蒈烷酰胺或者3s/3r-共聚蒈烷酰胺的方法以及由此制备的聚酰胺,其中,在方法步骤i)中,尤其是根据本发明所获得的3s-蒈烷内酰胺、3r-蒈烷内酰胺或者由3s-蒈烷内酰胺和3r-蒈烷内酰胺所构成的混合物最好通过阳离子开环聚合、阴离子开环聚合、水解聚合或缩聚而被聚合成3s-聚蒈烷酰胺、3r-聚蒈烷酰胺或者3s/3r-共聚蒈烷酰胺。根据本发明,本发明也涉及一种用于制备3s-聚蒈烷酰胺的方法以及由此制备的聚酰胺,其中,在方法步骤i)中,尤其是根据本发明所获得的3s-蒈烷内酰胺最好通过阳离子开环聚合、阴离子开环聚合、水解聚合或缩聚而被聚合成3s-聚蒈烷酰胺。据此,本发明也涉及一种3s-聚蒈烷酰胺。根据本发明,本发明也涉及一种用于制备3r-聚蒈烷酰胺的方法以及由此制备的聚酰胺,其中,在方法步骤i)中,尤其是根据本发明所获得的3r-蒈烷内酰胺最好通过阳离子开环聚合、阴离子开环聚合、水解聚合或缩聚而被聚合成3r-聚蒈烷酰胺。据此,本发明也涉及一种3r-聚蒈烷酰胺。根据本发明,本发明也涉及一种用于制备3s/3r-共聚蒈烷酰胺的方法以及由此制备的聚酰胺,其中,在方法步骤i)中,由3s-蒈烷内酰胺和3r-蒈烷内酰胺所构成的混合物、尤其是由根据本发明获得的3s-蒈烷内酰胺和3r-蒈烷内酰胺构成的混合物最好通过阳离子开环聚合、阴离子开环聚合、水解聚合或缩聚而被聚合成3s/3r-共聚蒈烷酰胺。据此,本发明也涉及一种3s/3r-共聚蒈烷酰胺。根据本发明,本发明也涉及一种用于制备共聚酰胺的方法以及由此制备的共聚酰胺,其中,在方法步骤i2)中,根据本发明所获得的3s-蒈烷内酰胺、3r-蒈烷内酰胺或由3s-蒈烷内酰胺和3r-蒈烷内酰胺所构成的混合物最好通过阳离子开环聚合、阴离子开环聚合、水解聚合或缩聚而与单体比如月桂精内酰胺或己内酰胺一同被聚合成共聚酰胺,尤其被聚合成3s-蒈烷内酰胺-月桂精内酰胺-共聚蒈烷酰胺(3s-蒈烷内酰胺-月桂精内酰胺-共聚酰胺)、3r-蒈烷内酰胺-月桂精内酰胺-共聚蒈烷酰胺(3r-蒈烷内酰胺-月桂精内酰胺-共聚酰胺)、3s-蒈烷内酰胺-3r-蒈烷内酰胺-月桂精内酰胺-共聚蒈烷酰胺(3s-蒈烷内酰胺-3r-蒈烷内酰胺-月桂精内酰胺-共聚酰胺)、3s-蒈烷内酰胺-己内酰胺-共聚蒈烷酰胺(3s-蒈烷内酰胺-己内酰胺-共聚酰胺)、3r-蒈烷内酰胺-己内酰胺-共聚蒈烷酰胺(3r-蒈烷内酰胺-己内酰胺-共聚酰胺)或者3s-蒈烷内酰胺-3r-蒈烷内酰胺-己内酰胺-共聚蒈烷酰胺(3s-蒈烷内酰胺-3r-蒈烷内酰胺-己内酰胺-共聚酰胺)。根据本发明,本发明也涉及一种用于制备聚合物且尤其是聚酰胺的方法,所述聚合物完全或作为共聚物或作为由各种聚合物或单体构成的混合物的一部分而包含本发明的3-蒈烷内酰胺、尤其是3s-聚蒈烷酰胺和/或3r-聚蒈烷酰胺、尤其是3s-聚蒈烷酰胺或者其断开的氨基酸、氨基酸酯或氨基酸衍生物。根据本发明,本发明也涉及一种用于由3-蒈烯制备3s-蒈烷内酰胺的方法,其中,该方法包括方法步骤a)-c)、e)、f)和g),尤其是a1)-c)、e)、f)和g),并且其中,在方法步骤a)中采用最好通过3-蒈烯的环氧化所得到的3s-环氧蒈烷,在方法步骤c)中获得(相对于蒈酮的总物质量)3s-蒈酮所占异构体比例为至少80%、尤其至少85%、至少90%或至少95%的富含3s-蒈酮的混合物,在方法步骤e)中反应成(相对于蒈烷基肟的总物质量)3s-蒈烷基肟所占异构体比例为至少80%、尤其至少85%、至少90%或至少95%的富含3s-蒈烷基肟的混合物,在方法步骤f)中反应成(相对于蒈烷内酰胺的总物质量)3s-蒈烷内酰胺所占异构体比例为至少80%、尤其至少85%、至少90%或至少95%的3s-蒈烷内酰胺混合物,并且在方法步骤g)中通过结晶获得3s-蒈烷内酰胺。在优选实施方式中,可以在方法步骤ia)中随后由3s-蒈烷内酰胺通过聚合、最好是阳离子开环聚合、阴离子开环聚合、水解聚合或缩聚来获得3s-聚蒈烷酰胺。根据本发明,本发明也涉及一种由3-蒈烯制备3r-蒈烷内酰胺的方法,其中,该方法包括方法步骤a)-c)、e)、f)和g)、尤其是a1)-c)、e)、f)和g),并且其中,在方法步骤a)中使用最好通过3-蒈烯的环氧化而得到的3r-环氧蒈烷,在方法步骤c)中获得(相对于蒈酮的总物质量)3r-蒈酮所占异构体比例为至少80%、尤其至少85%、至少90%或至少95%的富含3r-蒈酮的混合物,在方法步骤e)中反应成(相对于蒈烷基肟的总物质量)3r-蒈烷基肟所占异构体比例为至少80%、尤其至少85%、至少90%或至少95%的富含3r-蒈烷基肟的混合物,在方法步骤f)中反应成(相对于蒈烷内酰胺的总物质量)3r-蒈烷内酰胺所占异构体比例为至少80%、尤其至少85%、至少90%或至少95%的3r-蒈烷内酰胺混合物,并且在方法步骤h)中在分离出3s-蒈烷内酰胺之后获得3r-蒈烷内酰胺。在优选实施方式中,随后在方法步骤ib)中可以由3r-蒈烷内酰胺通过聚合、最好通过阳离子开环聚合、阴离子开环聚合、水解聚合或缩聚来获得3r-聚蒈烷酰胺。根据本发明,本发明也涉及一种由3-蒈烯制备3r-蒈烷内酰胺的方法,其中,该方法包括方法步骤a)-h)、最好是a1)-h),并且其中,在方法步骤a)中采用最好通过3-蒈烯的环氧化得到的3s-环氧蒈烷,在方法步骤c)中获得(相对于蒈酮的总物质量)3s-蒈酮所占异构体比例为至少80%、尤其是至少85%、至少90%或至少95%的富含3s-蒈酮的混合物,其在方法步骤d)中被异构化成(相对于蒈酮的总物质量)3r-蒈酮所占异构体比例为至少50%、尤其至少60%、尤其至少70%、尤其至少80%、尤其至少85%、尤其至少90%或尤其至少95%的富含3r-蒈酮的混合物,在方法步骤e)中被反应成(相对于蒈烷基肟的总物质量)3r-蒈烷基肟所占异构体比例为至少50%、尤其至少60%、尤其至少70%、尤其至少80%、尤其至少85%、尤其至少90%或尤其是至少95%的富含3r-蒈烷基肟的混合物,在方法步骤f)中被反应成(相对于蒈烷内酰胺总物质量)3r-蒈烷内酰胺所占异构体比例为至少50%、尤其至少60%、尤其是至少70%、尤其至少80%、尤其至少85%、尤其至少90%或尤其至少95%的富含3r-蒈烷内酰胺的混合物,且在分离出3s-蒈烷内酰胺后在方法步骤h)中获得3r-蒈烷内酰胺。在优选实施方式中,随后可以在方法步骤ib)中由3r-蒈烷内酰胺通过聚合、最好通过阳离子开环聚合、阴离子开环聚合、水解聚合或缩聚来获得3r-聚蒈烷酰胺。根据本发明,本发明也涉及一种3s-蒈酮,其尤其是根据本发明方法之一制备或可制备,根据如下分子式:根据本发明,本发明也涉及一种3s-蒈烷基肟,其尤其是根据本发明方法之一制备或可制备,根据如下分子式:根据本发明,本发明也涉及一种3s-蒈烷内酰胺,其尤其根据本发明方法之一制备或可制备,根据如下分子式:关于本发明,数n是指如下自然数,它尤其是大于或等于2的自然数,最好是2至1000000、特别最好是10至10000的自然数、特别优选是75至2000、尤其是100至1000的自然数。关于本发明,数a、b和c、尤其是a和b分别是指如下自然数,它尤其是大于或等于1的自然数,最好是1至1000、特别最好是10至50的自然数。关于本发明,数a是指如下自然数,它尤其是大于或等于1的自然数,最好是1至1000、特别最好是10至50的自然数。关于本发明,数b是指如下自然数,它尤其是大于或等于1的自然数,最好是1至1000、特别最好是10至50的自然数。关于本发明,数c是指如下自然数,它尤其是大于或等于1的自然数,最好是1至1000、特别最好是10至50的自然数。关于本发明,自然数a和b最好具有1:100至100:1、优选是1:10至10:1、特别优选是1:6至6:1的比例。关于本发明,自然数a和c最好具有1:100至100:1、优选是1:10至10:1、特别优选是1:6至6:1的比例。关于本发明,自然数b和c最好具有1:100至100:1、优选是1:10至10:1、特别优选是1:6至6:1的比例。在优选实施方式中,自然数n、a、b和c、尤其是a、b和c、尤其是a和b可以彼此相同或不同。在本发明的优选实施方式中,自然数n、a、b和c彼此无关。根据本发明,本发明也涉及一种3s-聚蒈烷酰胺,其尤其是根据本发明方法之一制备或可制备,根据如下分子式(具有n个重复单元):在一个优选实施方式中规定,本发明的3s-聚蒈烷酰胺只由根据如下重复单元的3s-聚蒈烷酰胺重复单元构成:还优选规定,本发明的3s-聚蒈烷酰胺含有(相对于重复单元总数n)占比为至少80%、尤其至少85%、尤其至少90%、尤其至少95%、尤其至少98%、尤其至少99%、尤其至少99.5%、尤其至少99.9%、尤其是100%的、根据如下重复单元的3s-聚蒈烷酰胺重复单元:根据本发明,本发明也涉及一种3r-聚蒈烷酰胺,其尤其是根据本发明方法之一制备或可制备,根据如下分子式(具有n个重复单元):在一个优选实施方式中规定,本发明的3r-聚蒈烷酰胺只由根据如下重复单元的3r-聚蒈烷酰胺重复单元构成:还最好规定,本发明的3r-聚蒈烷酰胺包含(相对于重复单元总数n)占比为至少80%、尤其至少85%、尤其至少90%、尤其至少95%、尤其至少98%、尤其至少99%、尤其至少99.5%、尤其至少99.9%、尤其是100%的、根据如下重复单元的3r-聚蒈烷酰胺重复单元:根据本发明,本发明也涉及一种共聚蒈烷酰胺,其尤其由3s-蒈烷内酰胺、3r-蒈烷内酰胺或由3s-蒈烷内酰胺和3r-蒈烷内酰胺构成的混合物根据本发明方法制备或可制备,包含至少一个如下分子式的重复单元和至少一个如下分子式的重复单元根据本发明,本发明也涉及一种3s/3r-共聚蒈烷酰胺,其尤其是根据本发明方法之一制备或可制备,根据如下分子式(具有a、b和n个重复单元):本发明也涉及一种共聚蒈烷酰胺,其尤其由3s-蒈烷内酰胺、3r-蒈烷内酰胺或由3s-蒈烷内酰胺和3r-蒈烷内酰胺、尤其是3s-聚蒈烷酰胺与至少另一种内酰胺构成的混合物根据本发明方法制备或可制备,其中,该共聚蒈烷酰胺具有至少一个嵌入的内酰胺(最好是月桂精内酰胺和/或己内酰胺)和至少一个如下分子式的重复单元或至少一个如下分子式的重复单元或两个上述重复单元。根据本发明,本发明也涉及一种共聚蒈烷酰胺,其尤其由3s-蒈烷内酰胺、3r-蒈烷内酰胺或由3s-蒈烷内酰胺和3r-蒈烷内酰胺与至少另一种内酰胺构成的混合物根据本发明方法制备或可制备,尤其含有根据以下分子式(具有a、b和c个重复单元)之一的如下重复单元中的至少一个:其中,a表示嵌入共聚酰胺中的其它内酰胺的重复单元。优选规定,内酰胺选自由月桂精内酰胺、己内酰胺和所述内酰胺混合物构成的组。根据本发明,本发明也涉及一种共聚蒈烷酰胺,其尤其由3s-蒈烷内酰胺或由3s-蒈烷内酰胺和3r-蒈烷内酰胺与至少另一种内酰胺构成的混合物根据本发明方法制备或可制备,尤其含有根据如下分子式(具有a、b和c个重复单元)之一的如下重复单元中的至少一个:其中,a表示嵌入共聚酰胺中的其它内酰胺的重复单元。优选规定,内酰胺选自由月桂精内酰胺、己内酰胺和上述内酰胺混合物构成的组。根据本发明,本发明也涉及一种共聚蒈烷酰胺,其尤其由3r-蒈烷内酰胺或由3s-蒈烷内酰胺和3r-蒈烷内酰胺与至少另一种内酰胺构成的混合物根据本发明的方法制备或可制备,尤其含有根据如下分子式(具有a、b和c个重复单元)之一的以下重复单元中的至少一个:其中,a表示嵌入共聚酰胺中的其它内酰胺的重复单元。优选规定,内酰胺选自由月桂精内酰胺、己内酰胺和所述内酰胺混合物构成的组。根据本发明,本发明也涉及一种3s-蒈烷内酰胺-月桂精内酰胺-共聚蒈烷酰胺(3s-蒈烷内酰胺-月桂精内酰胺-共聚酰胺),其尤其由3s-蒈烷内酰胺和月桂精内酰胺尤其是根据本发明方法之一制备或可制备,尤其是根据以下分子式(具有a、b和n个重复单元):根据本发明,本发明也涉及一种3s-蒈烷内酰胺-己内酰胺-共聚蒈烷酰胺(3s-蒈烷内酰胺-己内酰胺-共聚酰胺),其尤其由3s-蒈烷内酰胺和己内酰胺尤其是根据本发明方法之一制备或可制备,尤其根据以下分子式(具有a、b和n个重复单元):根据本发明,本发明也涉及一种3r-蒈烷内酰胺-月桂精内酰胺-共聚蒈烷酰胺(3r-蒈烷内酰胺-月桂精内酰胺-共聚酰胺),其尤其由3r-蒈烷内酰胺和月桂精内酰胺尤其是根据本发明方法之一制备或可制备,尤其根据以下分子式(具有a、b和n个重复单元):根据本发明,本发明也涉及一种3r-蒈烷内酰胺-己内酰胺-共聚蒈烷酰胺(3r-蒈烷内酰胺-己内酰胺-共聚酰胺),其尤其由3r-蒈烷内酰胺和己内酰胺尤其是根据本发明方法之一制备或可制备,尤其根据以下分子式(具有a、b和n个重复单元):根据本发明,本发明也涉及一种3s-蒈烷内酰胺-3r-蒈烷内酰胺-月桂精内酰胺-共聚蒈烷酰胺(3s-蒈烷内酰胺-3r-蒈烷内酰胺-月桂精内酰胺-共聚酰胺),其尤其是由3s-蒈烷内酰胺、3r-蒈烷内酰胺和月桂精内酰胺尤其根据本发明方法之一制备或可制备,尤其是根据以下分子式(具有a、b、c和n个重复单元):根据本发明,本发明也涉及一种3s-蒈烷内酰胺-3r-蒈烷内酰胺-己内酰胺-共聚蒈烷酰胺(3s-蒈烷内酰胺-3r-蒈烷内酰胺-己内酰胺-共聚酰胺),其尤其由3s-蒈烷内酰胺、3r-蒈烷内酰胺和己内酰胺尤其根据本发明方法之一制备或可制备,尤其是根据如下分子式(具有a、b、c和n个重复单元):本发明也涉及产品尤其是塑料产品,其包含按照本发明所制备的至少其中一种聚酰胺、尤其是3s-聚蒈烷酰胺、3r-聚蒈烷酰胺或者按照本发明所提供的共聚蒈烷酰胺中的至少一种,尤其含有至少5重量%、至少10重量%、至少15重量%、至少20重量%、至少30重量%、至少40重量%、至少50重量%、至少60重量%、至少70重量%、至少80重量%、至少90重量%、至少95重量%或至少99重量%的聚酰胺,尤其由至少其中一种所述聚酰胺构成。在一个优选实施方式中,这样的塑料产品是工业品、医疗器械或构件。根据本发明,关于根据本发明的用于制备和进一步转化由3s-蒈酮和3r-蒈酮构成的富含异构体的混合物的方法所公开的针对方法步骤a1)-i2)的优选实施方式同样优选适用于以下情况中的方法步骤a1)至i2):譬如用于制备富含3-蒈烷基肟的混合物、富含3-蒈烷内酰胺的混合物、3s-聚蒈烷酰胺、3r-聚蒈烷酰胺、3s/3r-共聚蒈烷酰胺、3s-蒈烷内酰胺-月桂精内酰胺-共聚蒈烷酰胺(3s-蒈烷内酰胺-月桂精内酰胺-共聚酰胺)、3r-蒈烷内酰胺-月桂精内酰胺-共聚蒈烷酰胺(3r-蒈烷内酰胺-月桂精内酰胺-共聚酰胺)、3s-蒈烷内酰胺-3r-蒈烷内酰胺-月桂精内酰胺-共聚蒈烷酰胺(3s-蒈烷内酰胺-3r-蒈烷内酰胺-月桂精内酰胺-共聚酰胺)、3s-蒈烷内酰胺-己内酰胺-共聚蒈烷酰胺(3s-蒈烷内酰胺-己内酰胺-共聚酰胺)、3r-蒈烷内酰胺-己内酰胺-共聚蒈烷酰胺(3r-蒈烷内酰胺-己内酰胺-共聚酰胺)、3s-蒈烷内酰胺-3r-蒈烷内酰胺-己内酰胺-共聚蒈烷酰胺(3s-蒈烷内酰胺-3r-蒈烷内酰胺-己内酰胺-共聚酰胺)的方法,以及适于3s-蒈烷基肟、3s-蒈烷内酰胺、3s-聚蒈烷酰胺、3r-聚蒈烷酰胺、3s/3r-共聚蒈烷酰胺、3s-蒈烷内酰胺-月桂精内酰胺-共聚蒈烷酰胺(3s-蒈烷内酰胺-月桂精内酰胺-共聚酰胺)、3r-蒈烷内酰胺-月桂精内酰胺-共聚蒈烷酰胺(3r-蒈烷内酰胺-月桂精内酰胺-共聚酰胺)、3s-蒈烷内酰胺-3r-蒈烷内酰胺-月桂精内酰胺-共聚蒈烷酰胺(3s-蒈烷内酰胺-3r-蒈烷内酰胺-月桂精内酰胺-共聚酰胺)、3s-蒈烷内酰胺-己内酰胺-共聚蒈烷酰胺(3s-蒈烷内酰胺-己内酰胺-共聚酰胺)、3r-蒈烷内酰胺-己内酰胺-共聚蒈烷酰胺(3r-蒈烷内酰胺-己内酰胺-共聚酰胺)以及对于3s-蒈烷内酰胺-3r-蒈烷内酰胺-己内酰胺-共聚蒈烷酰胺(3s-蒈烷内酰胺-3r-蒈烷内酰胺-己内酰胺-共聚酰胺)和聚合物且尤其是聚酰胺,其完全地或作为共聚物或由各种聚合物或单体构成的混合物的一部分而含有3-蒈烷内酰胺或其断开的氨基酸、氨基酸酯或氨基酸衍生物。本发明也涉及一种聚合物、尤其是聚酰胺,其完全或作为共聚物或作出由各种不同聚合物或单体构成的混合物的一部分而包含本发明的3-蒈烷内酰胺、尤其是3s-蒈烷内酰胺或3r-蒈烷内酰胺、尤其是3s-蒈烷内酰胺或者其断开的氨基酸、氨基酸酯或氨基酸衍生物,最好根据针对3s-蒈烷内酰胺、3s-聚蒈烷酰胺、3r-聚蒈烷酰胺和3s/3r-共聚蒈烷酰胺在此所示的分子式。其它的优选实施方式尤其来自从属权利要求。以下例子和相关附图解释了本发明,其中:分析方法gcms-分析方法,方法(1)(gcms气相色谱-质谱法):借助气相色谱分离和后续质谱分析的反应混合物分析气相色谱法分析在gc-2010+(shimadzu)上执行。分离通过gc毛细管柱来获得(bpx5:5%苯基,95%甲基苯基聚硅烷/硅氧烷,sge)。对于质谱法,采用具有电离化功能(70ev)的ms-qp2010plus(shimadzu)。测定数据的软件分析用gc-mspostrunanalysis(shimadzu)执行。得到的数据与美国国家标准与技术研究院的08版数据库相比较。表2:gc说明从相应给出的图中得到富含3s-蒈酮异构体的混合物(图3)的和富含3r-蒈酮异构体的混合物的(图4)示例性色谱图。下表3包含所有产物相关化合物的保留时间:化合物保留时间[分钟]3-蒈烯5.693s-环氧蒈烷7.253s-蒈酮8.153r-蒈酮8.043r-蒈烷基肟(trans)11.113s-蒈烷基肟(trans)10.753s-蒈烷内酰胺14.613r-蒈烷内酰胺14.14表3:保留时间在富含异构体的混合物中的3s-蒈酮与3r-蒈酮之间的异构体比例(百分比)可以通过两种产物、即3s-蒈酮和3r-蒈酮的峰面积的对比(产物的峰面积除以两种产物的总峰面积)、尤其是tic峰面积(总离子流,tic)来确定,此时保留时间根据表“所有产品相关化合物的保留时间”。假定有如下理论但不限于此,即,两种产物、即3s-蒈酮和3r-蒈酮被分裂为同样数量的片段,因此造成相应的离子流,两个峰面积的数比(根据上述设定条件来计算)也对应于两种产物、即3s-蒈酮和3r-蒈酮的物质量数比。在此关于由3s-蒈酮和3r-蒈酮构成的富含异构体的混合物所做说明相应地也适用于富含3-蒈烷基肟的混合物以及富含3-蒈烷内酰胺的混合物。nmr-分析方法,方法(2)(nmr,核磁共振):借助nmr光谱的反应混合物分析所有的nmr测量在jeol的jnm-eca400兆赫频谱仪上在25℃采用软件jeoldeltav5.0.4进行,其中,采用jeoldeltav5.0.4所含的standard-puls程序。dept135°technik被用来分配ch2信号。2dnmr方法(cosy,hsqc,hmbc)根据需要被采用。聚合物在dcood中被测量,所有其它物质在dmso-d6中被测量。测量结果的分析用软件jeoldeltav5.0.4进行。化合物即3s-蒈酮(1h:图5,13c:图6)、3s-蒈烷基肟(1h:图7,13c:图8)和3s-蒈烷内酰胺(1h:图9,13c:图10)的以及聚合物即3s-聚蒈烷酰胺(1h:图11,13c:图12,cosy:图13,hsqc:图14,dept:图15)、3r-聚蒈烷酰胺(1h:图16,13c:图17,cosy:图18,hsqc:图19,dept:图20)和3s/3r-共聚蒈烷酰胺(1h:图21,13c:图22)、3s-蒈烷内酰胺-月桂精内酰胺-共聚蒈烷酰胺(1h:图23)和3s-蒈烷内酰胺-己内酰胺-共聚蒈烷酰胺(1h:图24)的nmr谱(1h,13c)从相应给出的附图中得到。dsc-分析方法,方法(3)(dsc,差示扫描量热法)dsc分析在mettlertoledo的dsc-one上执行。所述测量结果的分析用mettlertoledo的分析软件stare(版本:13.00a(build6917)进行:c值保护气氮气加热过程i-20℃至350℃加热速度i20k/分钟冷却过程i350℃至-20℃冷却速度i-20k/分钟加热过程ii-20℃至350℃加热速度ii10k/分钟样本量5-10毫克表4:dsc分析说明从相应所给出的图中得到聚合物、即3s-聚蒈烷酰胺(图81)、3r-聚蒈烷酰胺(图82)以及3s/3r-共聚蒈烷酰胺(图83)的dsc谱并且示出加热过程ii。dsc-分析法,方法(3.1)(dsc,差示扫描量热法)根据方法(3.1)的dsc分析通过mettlertoledo的dsc1以及软件starev.16.00来执行。样本(5-10毫克)在铝坩埚中在氮气气氛下被测量。方法(3.1)被用于3s-聚蒈烷酰胺的分析。相应的图35-50示出区段10。区段温度[℃]始/终加热速度[k/分钟]氮气[毫升/分钟]1-20℃,2分钟等温502-20℃/320℃10503320℃/1分钟等温504320℃/-20℃-10505-20℃,1分钟等温506-20℃/320℃10507320℃/1分钟等温508320℃/-20℃-10509-20℃,1分钟等温10-20℃/320℃10表4.1:dsc-分析说明方法(3.1)从相应给出的附图中得到3s-聚蒈烷酰胺的dsc谱(图25至(含)图34)。dsc-分析法,方法(3.2)(dsc,差示扫描量热法)根据方法(3.2)的dsc-分析通过mettlertoledo的dsc1以及软件starev.16.00来执行。样本(5-10毫克)在铝坩埚中在氮气气氛下被测量。方法(3.2)被用于3r-聚蒈烷酰胺、3s-蒈烷内酰胺-3r-蒈烷内酰胺-共聚蒈烷酰胺、3s-蒈烷内酰胺-月桂精内酰胺-共聚酰胺和3s-蒈烷内酰胺-己内酰胺-共聚酰胺。相应的图35-50示出区段6和7。区段温度[℃]始/终加热速度[k/分钟]氮气[毫升/分钟]120/35020502350/20-2050320/22010504220(20分钟)等温505220/0-105060/37010507370/0-105080/4401050表4.2:dsc-分析说明方法(3.2)从相应给出的图中得到3r-聚蒈烷酰胺(图35至(含)图42)以及3s/3r-共聚蒈烷酰胺(图43和图44)、3s-蒈烷内酰胺-月桂精内酰胺-共聚蒈烷酰胺(图45、图46、图47)和3s-蒈烷内酰胺-己内酰胺-共聚蒈烷酰胺(图48、图49、图50)的dsc谱。gpc-分析法,方法(4.1)(gpc,凝胶渗透色谱)gpc测量在agilent的具有pmma校准功能的agilent1200系列上进行。测量结果分析利用chemstationgpc分析软件(wingpcunity,build5403)进行。参数值柱hfip凝胶柱洗提液hfip温度40℃注入体积20微升流速0.5毫升/分钟浓度1克/升表5.1:gpc-说明方法(4.1)从相应给出的图中得到聚合物、即3s-聚蒈烷酰胺(图78)、3r-聚蒈烷酰胺(图79)以及3s-蒈烷内酰胺-己内酰胺-共聚蒈烷酰胺(图80)的gpc谱。gpc分析法,方法(4.2)(gpc,凝胶渗透色谱)gpc分析用带有自动取样器(1260infinity,agilenttechnologies)的securitygpc和tcc6000柱式炉(polymerstandardservices,pss)来执行。数据用psswingpcunichrom(pss)来分析。pmma标准被用于窄摩尔质量校准。pa6标准(pss备调套件,mw/mn=31400/17400da;22000/13000da;17200/11300da)被用于宽摩尔质量校准。用于分析的分子量下限被设定为1.0kda。表5.2:gpc-分析说明方法(4.2)从相应给出的图中得到聚合物、即3s-聚蒈烷酰胺(图51至(含)图61)、3r-聚蒈烷酰胺(图62至(含)图71)、3s/3r-共聚蒈烷酰胺(图72)、3s-蒈烷内酰胺-月桂精内酰胺-共聚蒈烷酰胺(图73、图74和图75)以及3s-蒈烷内酰胺-己内酰胺-共聚蒈烷酰胺(图76和图77)的gpc谱。通过与pa6定性对比的吸水量确定,方法(5)pa6通过阴离子开环聚合来制备(2.8毫摩尔己内酰胺,0.1毫摩尔60%的包有石蜡的nah,0.05毫摩尔ac2o,180℃)。残余单体通过在水/乙醇中回流被除去。30-42毫克的pa6(三个样本)和本发明聚酰胺的至少两种样本在dsc(与dsc-分析法-方法(3)所述一样的仪器)中在230℃被加热3分钟,通过这种方式制备相同的聚酰胺嵌段。该物质在ohausdiscoverydv215cd秤上以0.01毫克的最大误差被测定。随后,样本分别在25℃在水中被搅拌3天。样本接着被空气干燥并在30分钟后和4.5小时后称量。随后,样本在80℃被干燥3小时并称量。相比于pa6的定性吸水量通过比较水浴后质量和干燥步骤后的质量损失来得出。通过与pa6和pa12定性对比的透明度确定,方法(6)pa6和pa12溶解在hfip(25毫克/毫升)中并被转入结晶皿(直径4-12厘米)或涂在ptfe膜上。在溶剂蒸发后在85℃干燥至少3小时。得到白色不透明的膜,并且通过目视比较来确定本发明聚合物的定性透明度。实施例实施例1(方法步骤a)、b)和c)):3s-蒈酮的合成(异构体纯度超过85%)1.8克的3s-环氧蒈烷(11.8毫摩尔)溶解在6.7毫升己烷(c=1.5m)中并被加热到60℃。7.0毫克的fe(clo4)2·h2o(0.03毫摩尔,0.2摩尔%)被添加并被搅拌20分钟。反应混合物被冷却到25℃,并且加入2毫升半饱和醋酸钠溶液。所述相被分离并且溶剂被蒸馏除去。gcms分析法(未修正):蒈酮总选择性80%,比例:3s-蒈酮:3r-蒈酮=85%:15%。质谱:ms(ei,70ev):m/z(%)=153.10(2.77),152.10(27.38),138.10(1.16),137.10(12.12),135.15(0.47),134.10(2.59),125.15(0.48),124.10(4.38),123.10(4.10),121.10(0.54)。ms(ei,70ev):%(m/z)=100.00(67.10),83.36(81.10),69.63(41.10),45.24(39.10),44.25(82.10),33.71(95.10),32.68(109.10),30.74(110.10),27.40(55.10),27.38(152.10)。图4示出富含3s-蒈酮异构体的混合物的gc色谱图。图5示出3s-蒈酮(纯形态)的1h-nmr,而图6示出3s-蒈酮(纯形态)的13c-nmr。nmr分配1hnmr(400mhz,dmso-d6):δ/ppm=2.56-2.47(m,1h,-co-ch2-ch-,溶剂信号重叠),2.10(qdd,j=7.3,5.0,2.7hz,1h,-chch3-),2.03-1.90(m,2h,-chch3-ch2-ch-,-co-ch2-ch-),1.70-1.62(m,1h,-chch3-ch2-ch-),1.13(d,j=7.2hz,3h,-chch3-),1.04(s,3h,-cchch3ch3-),1.03-0.97(m,1h,-co-ch2-ch-),0.90(s,3h,-cchch3ch3-),0.80(td,j=8.9,6.4hz,1h,-chch3-ch2-ch-)。13cnmr(100mhz,dmso-d6):δ/ppm=216.1(-co-),40.7(-chch3-),33.9(-co-ch2-ch-),27.8(-cchchch3ch3-,26.3(-chch3-ch2-ch-),21.1(-co-ch2-ch-),19.0(-cchchch3ch3-),16.7(-chch3-),16.4(-co-ch2-ch-),14.6(-cchchch3ch3-)。实施例1.1:合适的溶剂表6:溶剂极性对3s-环氧蒈烷重排成富含3s-蒈酮和3r-蒈酮的混合物的影响。所有试验以浓度为1m的3s-环氧蒈烷和0.2摩尔%的fe(clo4)2·h2o在25℃进行8小时。3s-环氧蒈烷的转化率为100%。值涉及gcms谱的tic区域(未修正值)。实施例1.2.1:路易斯酸锌和路易斯酸铁的对比催化剂[0.2%]转化率[%]蒈酮[%]3r-蒈酮[%]3s-蒈酮[%]t[小时]1zn(otf)24870991402fe(otf)2917315850.53fe(clo4)2·h2o1008215850.54fe(clo4)3·h2o1008116840.5表7:在60℃在环己烷情况下的路易斯酸铁和路易斯酸锌的对比,此时具有浓度为1m的3s-环氧蒈烷和0.2%催化剂(摩尔%)。值涉及gcms谱的tic区域(未修正值)。实施例1.2.2:各不同磺酸的对比表8:3s-环氧蒈烷被曼瓦尔德重排反应成富含3s-蒈酮和3r-蒈酮的混合物,此时以各不同的磺酸为酸性催化剂。根据表4的值涉及gcms谱的tic区域(未修正值)。实施例1.3:合适的路易斯酸浓度表9:fe(clo4)2·h2o量对重排成3r-蒈酮异构体和3s-蒈酮异构体的影响。所有试验以浓度为1m的3s-环氧蒈烷在25℃进行5小时。值涉及gcms谱的tic区域(未修正值)。所有试验在环己烷情况下进行。实施例1.4:合适的3s-环氧蒈烷浓度3s-环氧蒈烷[m]转化率[%]蒈酮[%]3r-蒈酮[%]3s-蒈酮[%]10.25856208020.57874138731.010070109042.010067109053.0100661090表10:3s-环氧蒈烷浓度对3s-环氧蒈烷重排成富含3s-蒈酮和3r-蒈酮的混合物的影响。所有试验在25℃以0.2%的fe(clo4)2·h2o进行7小时。值涉及gcms谱的tic区域(未修正值)。所有试验在环己烷下进行。实施例1.5:温度影响表11:在路易斯酸下温度对3s-环氧蒈烷的曼瓦尔德重排的影响。值涉及gcms谱的tic区域(未修正值)。实施例1.6:非铁基路易斯酸15.2毫克的3s-环氧蒈烷(0.1毫摩尔)被溶解在1毫升甲苯中。接着2摩尔%的ni(clo4)2溶液被加入醋酸乙酯中,且反应混合物以60℃被加热20.5小时。gcms-分析(未修正):蒈酮总纯度88.9%,3s-蒈酮92.0%,和3r-蒈酮8.0%。15.2毫克的3s-环氧蒈烷(0.1毫摩尔)溶解在1毫升甲苯中。接着2摩尔%的co(clo4)2溶液被加入醋酸乙酯中,且反应混合物以60℃被加热20.5小时。gcms分析(未修正):蒈酮总体纯度89.0%,3s-蒈酮93.3%和3r-蒈酮6.7%。152毫克的3s-环氧蒈烷(0.1毫摩尔)溶解在1毫升甲苯中。接着2摩尔%的cu(clo4)2溶液被加入醋酸乙酯中,反应混合物在室温被搅拌20小时。gcms-分析(未修正):蒈酮总体纯度63.0%,3s-蒈酮85.0%和3r-蒈酮15.0%。实施例2.1(方法步骤d)):3s-蒈酮异构化成3r-蒈酮来自实施例1的富含3s-蒈酮(87%)和3r-蒈酮(13%)的混合物的152微升的约80%溶液被溶解在845微升的mecn中并且添加5微升硫酸。反应混合物在60℃被搅拌5小时。溶剂被蒸馏除去。gcms分析法(未修正):蒈酮总选择性80%,比例:3s-蒈酮:3r-蒈酮=15%:85%。图4示出富含3r-蒈酮异构体的混合物的gc色谱。图5示出3s-蒈酮(纯形态)的1h-nmr,图6示出3s-蒈酮(纯形态)的13c-nmr。实施例2.2(方法步骤d)):溶剂对3s-蒈酮异构化为3r-蒈酮的影响(iii)表12:溶剂对富含3s-蒈酮的混合物(纯度79%,3s-蒈酮89%,3r-蒈酮11%)的异构化的影响。所有试验以浓度为1m的3s-蒈酮和作为异构化催化剂的浓度为2m的盐酸溶液进行。在室温(a)搅拌6小时后取样,继续在室温(b)搅拌15小时后取样,继续在60℃(c)搅拌48小时后取样。值涉及gcms谱的tic区域(未修正值)。实施例3.1(方法步骤a1a):在使用酵素脂肪酶cal-b的情况下将3-蒈烯环氧化为3s-环氧蒈烷(超过99%)10.87克的3-蒈烯(80毫摩尔)在160毫升醋酸乙酯中溶解并被转入带有kpg搅拌单元和尼龙酶袋的反应器中,酶袋填充有2.5克南极假丝酵母脂肪酶cal-b(稳固化)。它被加热到60℃并连续(2毫升/小时)添加9.35克的h2o235%。4小时后,反应混合物被冷却到室温,酶袋被去除并用2×50毫升naoh2m、1×50毫升饱和na2so3溶液和1×50毫升水来清洗。该溶剂在降低压力下被除去。gcms-分析(未修正):3s-环氧蒈烷(2)>99%。实施例3.2(方法步骤a1a)):用稀释的过醋酸将3-蒈烯环氧化成3s-环氧蒈烷(超过99%)1当量的naoac在12%过醋酸中溶解至c=1m(对应于1.3当量过醋酸)并在室温在1小时内加入1当量的3-蒈烯。温度被恒定保持低于40℃。gcms-分析(未修正):3s-环氧蒈烷(2)>99%。实施例3.3(方法步骤a1b)):将3-蒈烯环氧化成3r-环氧蒈烷(纯度超过85%)50克的3-蒈烯(367毫摩尔,1.0当量)在200毫升丙酮和200毫升水中溶解,并被调温到0℃。72克的n-溴代丁二酰亚胺(404毫摩尔,1.1当量)被逐份加入,内部温度被保持低于10℃。它在低于10℃的温度被搅拌0.5小时,随后在室温继续搅拌2小时。接着250毫升的5m的naoh被滴入(5.5毫升/分钟),搅拌直至完全反应成3r-环氧蒈烷(0.5小时)。反应混合物被混入200毫升己烷并且所述相被分离。含水相用200毫升己烷来提取。纯化的有机相用250毫升饱和硫酸钠溶液和250毫升水清洗。溶剂接着在降低压力下在50℃被分离。得到50克的3r-环氧蒈烷(纯度超过85%)(312毫摩尔,85%)。实施例4.1(方法步骤e)):3s-蒈酮的肟化富含3s-蒈酮和3r-蒈酮的混合物(80%纯度,85%3s-蒈酮,15%3r-蒈酮)在乙腈中溶解至c=2m。接着,1.3当量naoac被加入同体积的水中并且搅拌5分钟。1.1当量的盐酸羟胺被加入并且在25℃被搅拌1小时。gcms分析(未修正):肟总纯度80%,其中的3s-蒈烷基肟85%,3r-蒈烷基肟15%。质谱:ms(ei,70ev):m/z(%)=168.05(1.30),167.00(11.80),166.05(1.66),153.10(1.47),152.05(15.72),151.05(1.69),150.05(10.83),149.05(1.90),148.10(5.97),139.10(2.56)。ms(ei,70ev):%(m/z)=100.00(41.05),51.40(39.10),47.59(67.05),43.19(112.10),42.42(79.05),41.89(107.10),40.65(55.10),39.11(106.05),38.33(43.05),29.88(81.05)。nmr分配1hnmr(400mhz,dmso-d6):δ/ppm=10.07(s,1h,-noh),2.56(dd,j=18.6,1.6hz,1h,-cnoh-ch2-ch-),2.32-2.17(m,2h,-chch3-,-cnoh-ch2-ch-),1.90-1.78(m,j=16.8,8.1,3.1hz,1h,-chch3-ch2-ch-),1.37(dt,j=14.4,4.9hz,1h,-chch3-ch2-ch-),1.05(d,j=7.1hz,3h,ch2-chch3-cnoh-),0.96(s,3h,-cchchch3ch3-),0.79(td,j=8.9,1.8hz,1h,-cnoh-ch2-ch-)0.71(s,3h,-cchchch3ch3-),0.69-0.62(m,1h,chch3-ch2-ch-)。13cnmr(100mhz,dmso-d6):δ/ppm=161.5(-cnoh-),32.8(-chch3-),28.5(-cchchch3ch3-),26.8(-chch3-ch2-ch-),19.3(ch2-chch3-cnoh-),19.1(-cnoh-ch2-ch-),18.3(cchchch3ch3),17.1(-cnoh-ch2-ch-),16.7(-chch3-ch2-ch-),14.9(-cchchch3ch3-)。图7示出3s-蒈烷基肟(纯形态)的1h-nmr,图8示出3s-蒈烷基肟(纯形态)的13c-nmr。实施例4.2(方法步骤e)):3r-蒈酮的肟化9.00克的3r-蒈酮(58毫摩尔)溶解在60毫升乙腈中。接着,50毫升水和10.6克的醋酸钠三水合物(75毫摩尔)和4.6克的盐酸羟胺(64毫摩尔)被加入,并且在60℃搅拌20小时。反应混合物用碳酸氢钠溶液和水来清洗,用硫酸镁干燥并被真空浓缩。5克粗产物通过液柱色谱法(己烷/etoac)被纯化。收率为在92%纯度下的3.6克(72%)。肟的比例为3r-蒈烷基肟85%,3s-蒈烷基肟15%。实施例5.1.1(方法步骤f1)):3s-蒈烷基肟的贝克曼重排来自实施例4.1(方法步骤e))的反应混合物被冷却到15℃并且被缓慢添加呈10m的naoh形式的4当量的naoh。在15℃搅拌2小时之后,逐份加入1当量对甲苯磺酰氯,并且在室温继续搅拌2小时。含水相被分离出并用醋酸乙酯来提取(2x同体积)。有机相用半饱和的碳酸氢钠溶液(2x)且接着用饱和氯化钠溶液来清洗。gcms-分析(未修正):蒈烷内酰胺总纯度62%,3s-蒈烷内酰胺94.9%和3r-蒈烷内酰胺5.1%。质谱ms(ei,70ev):m/z(%)=168.10(1.05),167.15(8.33),166.25(0.70),154.20(0.30),153.20(4.44),152.20(44.99),151.25(0.22),150.20(0.23),139.20(1.42),138.15(1.09)。ms(ei,70ev):%(m/z)=100.00(44.10),60.39(67.10),44.99(152.20),44.18(81.10),42.43(82.10),37.54(110.15),35.25(41.05),28.11(57.10),19.97(39.05),19.46(55.10)。图9示出3s-蒈烷内酰胺(纯形态)的1h-nmr,图10示出3s-蒈烷内酰胺(纯形态)的13c-nmr。nmr分配1hnmr(400mhz,dmso-d6):δ/ppm=6.92(s,1h,-co-nh-)3.5-3.14(m,1h,-nh-chch3-ch2-),2.31-2.15(m,2h,-co-ch2-ch-),1.71-1.49(m,2h,-ch-ch2-cchch3-),1.05(d,j=6.4hz,3h,-nh-chch3-),1.01(s,3h,-cchchch3ch3-),0.97(s,3h,-cchchch3ch3-),0.85-0.76(m,1h,-cchchch3ch3-),0.57(td,j=9.0,2.1hz,1h,-cchchch3ch3-)。13cnmr(100mhz,dmso-d6):δ/ppm=173.8(-co-),46.3(-nh-chch3-),30.6(-co-ch2-ch-),30.4(ch-ch2-chch3-),28.6(-cchchch3ch3-),21.11(-nh-chch3-),20.1(co-ch2-ch-),20.1(-chch3-ch2-ch-),17.4(-cchchch3ch3-),14.9(-cchchch3ch3-)。实施例5.1.2(方法步骤f2)):3s-蒈烷基肟的催化贝克曼重排167毫克的3s-蒈烷基肟(1.0毫摩尔)在2毫升mecn中溶解并被回流加热。接着加入7.5摩尔%的zn(clo4)2·6h2o,并且搅拌48小时。溶剂在降低压力下被除去,残余物容留在醋酸乙酯中并用半饱和碳酸氢钠溶液和水多次清洗。在由醋酸乙酯结晶之后,获得120毫克的3s-蒈烷内酰胺(72%)。实施例5.2(方法步骤e)和f)):在一个步骤(一锅法)中的肟化和贝克曼重排35克的由3s-蒈酮(15%)和3r-蒈酮(85%)构成的混合物在280毫升乙腈(mecn)中溶解并混入280毫升水和50克的醋酸钠。接着,19.5克的盐酸羟胺被加入并在室温被搅拌48小时。所述相被分离并在冰浴冷却期间逐份加入270毫升的3m的naoh以得到有机相。反应混合物在冰浴中被搅拌2小时,接着逐份加入53.2克的甲基苯磺酰氯。反应混合物被搅拌4小时,接着用2m盐酸、碳酸氢钠溶液和半饱和氯化钠溶液清洗。溶剂在降低压力下被除去,所得的粗产物多次从乙酸乙酯中再结晶。获得7.90克的(20%)纯3r-蒈烷内酰胺。实施例6.1(方法步骤g)和h)):获得结晶的3s-蒈烷内酰胺来自实施例5(方法步骤f))的反应混合物被分级蒸馏,直至3s-蒈烷内酰胺几乎完全结晶。余留部分的3r-蒈烷内酰胺在反应条件下不会结晶且因此通过进一步的蒸馏步骤(方法步骤h))被除去,从而将获得3s-蒈烷内酰胺。从所述蒸馏中可以作为馏出物获得3r-蒈烷内酰胺。实施例6.2(方法步骤g)和h)):获得3r-蒈烷内酰胺3r-蒈烷内酰胺可以从3s-蒈烷内酰胺合成的母碱液(来自实施例6.1的残余溶液)中在蒸馏(沸点:350℃)和多次再结晶(醋酸乙酯)后作为纯产品获得。实施例6.3(方法步骤g)和h)):获得3r-蒈烷内酰胺3.50克的3r-蒈烷基肟(21毫摩尔)被溶解在25毫升乙腈中并且在冰浴中被冷却。接着,33毫升的2m氢氧化钠被逐份加入且被搅拌2小时。接着,4.50克的甲基苯磺酰氯(23毫摩尔)被逐份加入且在冰浴中被搅拌2.5小时。反应混合物用碳酸氢钠溶液和水来清洗,用硫酸镁来干燥并被真空浓缩。粗产物从乙酸乙酯中在-20℃再结晶,并且获得2.61克的(75%)纯3r-蒈烷内酰胺。实施例7.1(方法步骤i)):将3s-蒈烷内酰胺聚合成3s-聚蒈烷酰胺300毫克的3s-蒈烷内酰胺(1.8毫摩尔)、10毫克的n-苯甲酰-3s-蒈烷内酰胺(bz-5,0.036毫摩尔)和0.5毫克包有石蜡的氢化钠(0.02毫摩尔)在真空玻璃容器中被混合并在2毫巴被抽真空10分钟。反应容器被转移入180℃油浴中并被搅拌。在约20秒后结束聚合。聚合物被缓冷至室温并且获得部分结晶的3s-聚蒈烷酰胺。根据nmr分析,该均聚物是等规的。实施例7.1.1(方法步骤i)):将3s-蒈烷内酰胺聚合成3s-聚蒈烷酰胺300毫克的3s-蒈烷内酰胺(1.80毫摩尔)、10毫克的n-苯甲酰-3s-蒈烷内酰胺(bz-5,0.036毫摩尔)和0.5毫克包有石蜡的氢化钠(0.01毫摩尔)在真空玻璃容器中被混合并在2毫巴被抽真空10分钟。反应容器被转移入180℃油浴中并被搅拌。反应混合物在该温度被保持5分钟,接着缓冷至室温。所获得的聚合物被粉碎。残余单体和可溶低聚物通过在水-乙醇混合物(1:1)中回流而被除去。获得部分结晶的3s-聚蒈烷酰胺。根据nmr分析,该均聚物是等规的。dsc方法(3.1);tg(中值):115℃;tm(范围):260-290℃;mn:10.5kda(gpc-方法4.2);mw:16.8kda(gpc-方法4.2);pd:1.6;1h:图11;13c:图12;cosy:图13;hsqc:图14;dept:图15;dsc:图25;gpc:图51;结晶度:部分结晶。实施例7.1.2(方法步骤i)):将3s-蒈烷内酰胺聚合成3s-聚蒈烷酰胺300毫克的3s-蒈烷内酰胺(1.8毫摩尔)、5.4毫克的n-苯甲酰-3s-蒈烷内酰胺(bz-5,0.02毫摩尔)和3.5毫克包有石蜡的氢化钠(0.09毫摩尔)在真空玻璃容器中被混合并在2毫巴被抽真空10分钟。反应容器被转移入180℃油浴中并被搅拌。反应混合物在该温度被保持1.5小时,接着空气冷却至室温。所获得的聚合物被粉碎。残余单体和可溶低聚物通过在水-乙醇混合物(1:1)中回流而被除去。获得部分结晶的3s-聚蒈烷酰胺。根据nmr分析,该均聚物是等规的。dsc方法(3.1);tg(中值):115℃;tm(范围):250-285℃;mn:10.2(gpc-方法4.2);mw:16.2(gpc-方法4.2);pd:1.6;dsc:图26;gpc:图52;结晶度:部分结晶。实施例7.1.3(方法步骤i)):将3s-蒈烷内酰胺聚合成3s-聚蒈烷酰胺302毫克的3s-蒈烷内酰胺(1.81毫摩尔)、9.8毫克的n-苯甲酰-3s-蒈烷内酰胺(bz-5,0.036毫摩尔)和0.9毫克包有石蜡的氢化钠(0.02毫摩尔)在真空玻璃容器中被混合并在2毫巴被抽真空10分钟。反应容器被转移入180℃油浴且被搅拌。反应混合物在该温度被保持1小时,接着缓冷至室温。所获得的聚合物被粉碎。残余单体和可溶低聚物通过在水-乙醇混合物(1:1)中回流而被除去。获得部分结晶的3s-聚蒈烷酰胺。根据nmr分析,该均聚物是等规的。dsc方法3.1;tg(中值):115℃;tm(范围):260-290℃;mn:9.3kda(gpc-方法4.2);mw:14.5kda(gpc-方法4.2);pd:1.6;dsc:图27;gpc:图53;结晶度:部分结晶。实施例7.1.4(方法步骤i)):将3s-蒈烷内酰胺聚合成3s-聚蒈烷酰胺305毫克的3s-蒈烷内酰胺(1.84毫摩尔)、10.7毫克的n-苯甲酰-3s-蒈烷内酰胺(bz-5,0.039毫摩尔)和1.6毫克包有石蜡的氢化钠(0.04毫摩尔)在真空玻璃容器中被混合并在2毫巴被抽真空10分钟。反应容器被转移入180℃油浴中并被搅拌。反应混合物在该温度被保持1小时,接着缓冷至室温。所获得的聚合物被粉碎。残余单体和可溶低聚物通过在水-乙醇混合物(1:1)中回流而被除去。获得部分结晶的3s-聚蒈烷酰胺。根据nmr分析,该均聚物是等规的。dsc方法3.1;tg(中值):113℃;tm(范围):255-285℃;mn:9.1kda(gpc-方法4.2);mw:14.1kda(gpc-方法4.2);pd:1.3;dsc:图28;gpc:图54;结晶度:部分结晶。实施例7.1.5(方法步骤i)):将3s-蒈烷内酰胺聚合成3s-聚蒈烷酰胺308毫克的3s-蒈烷内酰胺(1.84毫摩尔)、20.7毫克的n-苯甲酰-3s-蒈烷内酰胺(bz-5,0.076毫摩尔)和4.0毫克包有石蜡的氢化钠(0.1毫摩尔)在真空玻璃容器中被混合并在2毫巴被抽真空10分钟。反应容器被转移入180℃油浴中并被搅拌。反应混合物在该温度被保持1小时,接着缓冷至室温。所获得的聚合物被粉碎。残余单体和可溶低聚物通过在水-乙醇混合物(1:1)中回流而被除去。获得部分结晶的3s-聚蒈烷酰胺。根据nmr分析,该均聚物是等规的。dsc方法3.1;tg(中值):111℃;tm(范围):245-285℃;mn:6.7kda(gpc-方法4.2);mw:9.5kda(gpc-方法4.2);pd:1.4;dsc:图29;gpc:图55;结晶度:部分结晶。实施例7.1.6(方法步骤i)):将3s-蒈烷内酰胺聚合成3s-聚蒈烷酰胺300毫克的3s-蒈烷内酰胺(1.80毫摩尔)、30.0毫克的n-苯甲酰-3s-蒈烷内酰胺(bz-5,0.11毫摩尔)和3.9毫克包有石蜡的氢化钠(0.10毫摩尔)在真空玻璃容器中被混合并在2毫巴被抽真空10分钟。反应容器被转移入180℃油浴中并被搅拌。反应混合物在该温度被保持1小时,接着缓冷至室温。所获得的聚合物被粉碎。残余单体和可溶低聚物通过在水-乙醇混合物(1:1)中回流而被除去。获得部分结晶的3s-聚蒈烷酰胺。根据nmr分析,该均聚物是等规的。dsc方法3.1;tg(中值):105;tm(范围):240-280℃;mn:5.9kda(gpc-方法4.2);mw:8.3kda(gpc-方法4.2);pd:1.4;dsc:图30;gpc:图56;结晶度:部分结晶。实施例7.1.7(方法步骤i)):将3s-蒈烷内酰胺聚合成3s-聚蒈烷酰胺300毫克的3s-蒈烷内酰胺(1.8毫摩尔)、4.9毫克的n-苯甲酰-3s-蒈烷内酰胺(bz-5,0.02毫摩尔)和4.0毫克包有石蜡的氢化钠(0.1毫摩尔)在真空玻璃容器中被混合并在2毫巴被抽真空10分钟。反应容器被转移入220℃油浴且被搅拌。反应混合物在该温度被保持1小时,随后缓冷至室温。所获得的聚合物被粉碎。残余单体和可溶低聚物通过在水-乙醇混合物(1:1)中回流而被除去。获得部分结晶的3s-聚蒈烷酰胺。根据nmr分析,该均聚物是等规的。dsc方法3.1;tg(中值):112℃;tm(范围):240-275℃;mn:7.5kda(gpc-方法4.2);mw:9.6kda(gpc-方法4.2);pd:1.3;dsc:图31;gpc:图57;结晶度:部分结晶。实施例7.1.8(方法步骤i)):将3s-蒈烷内酰胺聚合成3s-聚蒈烷酰胺300毫克的3s-蒈烷内酰胺(1.8毫摩尔)、10.6毫克的n-苯甲酰-3s-蒈烷内酰胺(bz-5,0.04毫摩尔)和3.8毫克包有石蜡的氢化钠(0.1毫摩尔)在真空玻璃容器中被混合并在2毫巴被抽真空10分钟。反应容器被转移入220℃油浴且被搅拌。反应混合物在该温度被保持1小时,接着缓冷至室温。所获得的聚合物被粉碎。残余单体和可溶低聚物通过在水-乙醇混合物(1:1)中回流而被除去。获得部分结晶的3s-聚蒈烷酰胺。根据nmr分析,该均聚物是等规的。dsc方法3.1;tg(中值):112℃;tm(范围):230-270℃;mn:7.1kda(gpc-方法4.2);mw:9.0kda(gpc-方法4.2);pd:1.3;dsc:图32;gpc:图58;结晶度:部分结晶。实施例7.1.9(方法步骤i)):将3s-蒈烷内酰胺聚合成3s-聚蒈烷酰胺309毫克的3s-蒈烷内酰胺(1.85毫摩尔)、19.6毫克的n-苯甲酰-3s-蒈烷内酰胺(bz-5,0.07毫摩尔)和4.0毫克包有石蜡的氢化钠(0.1毫摩尔)在真空玻璃容器中被混合并且在2毫巴被抽真空10分钟。反应容器被转移入220℃油浴中且被搅拌。反应混合物在该温度被保持1小时,接着缓冷至室温。所获得的聚合物被粉碎。残余单体和可溶低聚物通过在水-乙醇混合物(1:1)中回流而被除去。获得了部分结晶的3s-聚蒈烷酰胺。根据nmr分析,该均聚物是等规的。dsc方法3.1;tg(中值):110℃;tm(范围):240-280;mn:6.0kda(gpc-方法4.2);mw:7.5kda(gpc-方法4.2);pd:1.3;dsc:图33;gpc:图59;结晶度:部分结晶。实施例7.1.10(方法步骤i)):将3s-蒈烷内酰胺聚合成3s-聚蒈烷酰胺300毫克的3s-蒈烷内酰胺(1.83毫摩尔)、30.0毫克的n-苯甲酰-3s-蒈烷内酰胺(bz-5,0.11毫摩尔)和3.8毫克包有石蜡的氢化钠(0.1毫摩尔)在真空玻璃容器中被混合并在2毫巴被抽真空10分钟。反应容器被转移入220℃油浴且被搅拌。反应混合物在该温度被保持1小时,接着缓冷至室温。所获得的聚合物被粉碎。残余单体和可溶低聚物通过在水-乙醇混合物(1:1)中回流而被除去。获得部分结晶的3s-聚蒈烷酰胺。根据nmr分析,该均聚物是等规的。dsc方法3.1;tg(中值):109℃;tm(范围):230-270;mn:5.6kda(gpc-方法4.2);mw:7.3kda(gpc-方法4.2);pd:1.3;dsc:图34;gpc:图60;结晶度:部分结晶。实施例7.1.11(方法步骤i)):将3s-蒈烷内酰胺聚合成3s-聚蒈烷酰胺523毫克的3s-蒈烷内酰胺(3.1毫摩尔)、10.4毫克的n-苯甲酰-3s-蒈烷内酰胺(bz-5,0.038毫摩尔)和3.7毫克包有石蜡的氢化钠(0.09毫摩尔)在玻璃反应容器中在氮气下在加热块里在190℃被聚合1小时。聚合产物直接溶解在六氟异丙醇(hfip)中,并且取样以便gpc分析和nmr分析。mn:8.6kda(gpc-方法4.2);mw:16.9kda(gpc-方法4.2);pd:2.0;gpc:图61。实施例7.1.12(方法步骤i)):将3s-蒈烷内酰胺聚合成3s-聚蒈烷酰胺500毫克的3r-蒈烷内酰胺(3.0毫摩尔)在惰性气氛下在190℃在烧瓶中被搅拌熔融。接着,5.0毫克包有石蜡的氢化钠(0.13毫摩尔)和4.5微升醋酸酐(0.048毫摩尔)被添加。在反应混合物凝固后,缓冷至室温。所获得的聚合物被粉碎。残余单体和可溶低聚物通过在水-乙醇混合物(1:1)中回流而被除去。获得非晶态的聚-3r-蒈烷酰胺。根据nmr分析,该均聚物是等规的。mn:1.4×104克/摩尔(gpc-方法4.1);mw:65.2×105克/摩尔(gpc-方法4.1);tg:110-120℃(dsc-方法3);tm:260-290℃(dsc-方法3);gpc:图78;dsc:图81;结晶度:部分结晶。实施例7.2(方法步骤i)):将3r-蒈烷内酰胺聚合成3r-聚蒈烷酰胺300毫克的3r-蒈烷内酰胺(1.8毫摩尔)、10毫克的n-苯甲酰-3r-蒈烷内酰胺(0.036毫摩尔)和0.5毫克包有石蜡的氢化钠(0.02毫摩尔)在真空容器中被混合并在2毫巴被抽真空10分钟。反应容器被转移入170℃的热油浴并被搅拌。在约20秒后聚合结束,聚合物被缓冷至室温,并且获得非晶态的3r-聚蒈烷酰胺。根据nmr分析,该均聚物是等规的。实施例7.2.1(方法步骤i)):将3r-蒈烷内酰胺聚合成3r-聚蒈烷酰胺500毫克的3r-蒈烷内酰胺(3.0毫摩尔)在惰性气氛下在170℃在烧瓶中被搅拌熔化。接着,3.0毫克包有石蜡的氢化钠(0.08毫摩尔)和1.5微升醋酸酐(0.016毫摩尔)被添加。反应混合物在该温度被保持20秒,接着缓冷至室温。所获得的聚合物被粉碎。残余单体和可溶低聚物通过在水-乙醇混合物(1:1)中回流而被除去。获得非晶态的聚-3r-蒈烷酰胺。根据nmr分析,该均聚物是等规的。tg(中值):122℃(dsc-方法3.2);tm(范围):不存在(dsc-方法3.2);tg:110-120℃(dsc-方法3);tm(范围):不存在(dsc-方法3);mn:1.1×105克/摩尔(gpc-方法4.1);mw:3.0×105克/摩尔(gpc-方法4.1);mn:33.3kda(gpc-方法4.2);mw:64.7kda(gpc-方法4.2);pd:1.9;1h:图16;13c:图17;cosy:图18;hsqc:图19;dept:图20;dsc:图82(dsc-方法3);dsc:图35(dsc-方法3.2);gpc:图62;gpc:图79;结晶度:非晶态。实施例7.2.2(方法步骤i)):将3r-蒈烷内酰胺聚合成3r-聚蒈烷酰胺500毫克的3r-蒈烷内酰胺(3.0毫摩尔)在惰性气氛下在170℃在烧瓶中被搅拌熔化。随后5.0毫克包有石蜡的氢化钠(0.13毫摩尔)和4.5微升醋酸酐(0.05毫摩尔)被添加。反应混合物在所述温度被保持30分钟,接着缓冷至室温。所获得的聚合物被粉碎。残余单体和可溶低聚物通过在水-乙醇混合物(1:1)中回流而被除去。获得非晶态的聚3r-蒈烷酰胺。根据nmr分析,该均聚物是等规的。mn:29.5kda(gpc-方法4.2);mw:55.2kda(gpc-方法4.2);pd:1.9;gpc:图63。实施例7.2.3(方法步骤i)):将3r-蒈烷内酰胺聚合成3r-聚蒈烷酰胺1.0克的3r-蒈烷内酰胺(6.0毫摩尔)、14.6毫克的钾(0.37毫摩尔)和20微升苯甲酰氯(0.17毫摩尔)在惰性气氛下在150℃在烧瓶中被搅拌聚合。反应混合物在该温度被保持6小时,随后缓冷至室温。所获得的聚合物被粉碎。残余单体和可溶低聚物通过在水-乙醇混合物(1:1)中回流而被除去。获得非晶态的聚3r-蒈烷酰胺。根据nmr分析,该均聚物是等规的。mn:22.4kda(gpc-方法4.2);mw:38.1kda(gpc-方法4.2);pd:1.7;gpc:图64。实施例7.2.4(方法步骤i)):将3r-蒈烷内酰胺聚合成3r-聚蒈烷酰胺511毫克的3r-蒈烷内酰胺(3.1毫摩尔)、0.6毫克的n-苯甲酰-3s-蒈烷内酰胺(bz-5,0.002毫摩尔)和3.5毫克包有石蜡的氢化钠(0.09毫摩尔)在玻璃反应容器中在氮气下在加热块里在190℃被聚合1小时。聚合产物直接在六氟异丙醇(hfip)中溶解,并取样以用于gpc分析和nmr分析。获得非晶态的聚3r-蒈烷酰胺。根据nmr分析,该均聚物是等规的。dsc方法3.2;tg(中值):119℃;tm(范围):不存在;mn:19.9kda(gpc-方法4.2);mw:32.9kda(gpc-方法4.2);pd:1.7;dsc:图36;gpc:图65;结晶度:非晶态。实施例7.2.5(方法步骤i)):将3r-蒈烷内酰胺聚合成3r-聚蒈烷酰胺506毫克的3r-蒈烷内酰胺(3.0毫摩尔)、1.03毫克的n-苯甲酰-3s-蒈烷内酰胺(bz-5,0.004毫摩尔)和3.3毫克包有石蜡的氢化钠(0.08毫摩尔)在玻璃反应容器中在氮气下在加热块内在190℃被聚合1小时。聚合产物直接溶解在六氟异丙醇(hfip)中,并取样以用于gpc分析和nmr分析。获得非晶态的聚3r-蒈烷酰胺。根据nmr分析,该均聚物是等规的。dsc方法3.2;tg(中值):120℃;tm(范围):不存在;mn:20.2kda(gpc-方法4.2);mw:43.8kda(gpc-方法4.2);pd:2.2;dsc:图37;gpc:图66;结晶度:非晶态。实施例7.2.6(方法步骤i)):将3r-蒈烷内酰胺聚合成3r-聚蒈烷酰胺505毫克的3r-蒈烷内酰胺(3.0毫摩尔)、2.45毫克的n-苯甲酰-3s-蒈烷内酰胺(bz-5,0.009毫摩尔)和3.3毫克包有石蜡的氢化钠(0.08毫摩尔)在玻璃反应容器中在氮气下在加热块中在190℃被聚合1小时。聚合产物直接在六氟异丙醇(hfip)中溶解,并且取样以用于gpc分析和nmr分析。获得聚3r-蒈烷酰胺。根据nmr分析,该均聚物是等规的。dsc方法3.2;tg(中值):117℃;tm(范围):不存在;mn:19.6kda(gpc-方法4.2);mw:45.6kda(gpc-方法4.2);pd:2.3;dsc:图38;gpc:图67;结晶度:非晶态。实施例7.2.7(方法步骤i)):将3r-蒈烷内酰胺聚合成3r-聚蒈烷酰胺508毫克3r-蒈烷内酰胺(3.0毫摩尔)、5.13毫克的n-苯甲酰-3s-蒈烷内酰胺(bz-5,0.02毫摩尔)和3.2毫克包有石蜡的氢化钠(0.08毫摩尔)在玻璃反应容器中在氮气下在加热块中在190℃被聚合1小时。聚合产物直接在六氟异丙醇(hfip)中溶解并且取样以用于gpc分析和nmr分析。获得非晶态的聚3r-蒈烷酰胺。根据nmr分析,该均聚物是等规的。dsc方法3.2;tg(中值):116℃;tm(范围):不存在;mn:15.2kda(gpc-方法4.2);mw:36.3kda(gpc-方法4.2);pd:2.4;dsc:图39;gpc:图68;结晶度:非晶态。实施例7.2.8(方法步骤i)):将3r-蒈烷内酰胺聚合成3r-聚蒈烷酰胺513毫克的3r-蒈烷内酰胺(3.1毫摩尔)、7.50毫克的n-苯甲酰-3s-蒈烷内酰胺(bz-5,0.03毫摩尔)和3.5毫克包有石蜡的氢化钠(0.09毫摩尔)在玻璃反应容器中在氮气下在加热块中在190℃被聚合1小时。聚合产物直接在六氟异丙醇(hfip)中溶解,并且取样以用于gpc分析和nmr分析。获得非晶态的聚3r-蒈烷酰胺。根据nmr分析,该均聚物是等规的。dsc方法3.2;tg(中值):115℃;tm(范围):不存在;mn:13.5kda(gpc-方法4.2);mw:31.8kda(gpc-方法4.2);pd:2.3;dsc:图40;gpc:图69;结晶度:非晶态。实施例7.2.9(方法步骤i)):将3r-蒈烷内酰胺聚合成3r-聚蒈烷酰胺512毫克的3r-蒈烷内酰胺(3.1毫摩尔)、10.2毫克的n-苯甲酰-3s-蒈烷内酰胺(bz-5,0.04毫摩尔)和3.4毫克包有石蜡的氢化钠(0.09毫摩尔)在玻璃反应容器中在氮气下在加热块中在190℃被聚合1小时。聚合产物直接在六氟异丙醇(hfip)中溶解,并取样以用于gpc分析和nmr分析。获得非晶态的聚3r-蒈烷酰胺。根据nmr分析,该均聚物是等规的。dsc方法3.2;tg(中值):117℃;tm(范围):不存在;mn:13.1kda(gpc-方法4.2);mw:29.7kda(gpc-方法4.2);pd:2.3;dsc:图41;gpc:图70;结晶度:非晶态。实施例7.2.10(方法步骤i)):将3r-蒈烷内酰胺聚合成3r-聚蒈烷酰胺900毫克的3r-蒈烷内酰胺(5.39毫摩尔)、5.5毫克的n-苯甲酰-3s-蒈烷内酰胺(bz-5,0.02毫摩尔)和7.5毫克包有石蜡的氢化钠(0.19毫摩尔)在真空玻璃容器中被混合并且在2毫巴被抽真空10分钟。反应容器被转移入170℃的油浴中并搅拌。反应混合物在所述温度被保持30分钟,随后缓冷到室温。所获得的聚合物被粉碎。残余单体和可溶低聚物通过在水-乙醇混合物(1:1)中回流而被除去。获得非晶态的聚3r-蒈烷酰胺。根据nmr分析,该均聚物是等规的。dsc方法3.2;tg(中值):112℃;tm(范围):不存在;mn:24.6kda(gpc-方法4.2);mw:55.5kda(gpc-方法4.2);pd:2.3;dsc:图42;gpc:图71;结晶度:非晶态。实施例7.3(方法步骤i)):将3s-蒈烷内酰胺与3r-蒈烷内酰胺聚合成3s/3r-共聚蒈烷酰胺150毫克的3r-蒈烷内酰胺(0.9毫摩尔)、150毫克的3s-蒈烷内酰胺(0.9毫摩尔)、10毫克的n-苯甲酰-3s-蒈烷内酰胺(0.036毫摩尔)和0.5毫克包有石蜡的氢化钠(0.02毫摩尔)在真空容器中被混合并且在2毫巴被抽真空10分钟。反应容器被转送入180℃的热油浴中且被搅拌。在约20秒后结束聚合,聚合物将被缓冷到室温并且获得非晶态的3s/3r-聚蒈烷酰胺。实施例7.3.1(方法步骤i)):将3s-蒈烷内酰胺和3r-蒈烷内酰胺聚合成3s-蒈烷内酰胺-3r-蒈烷内酰胺-共聚蒈烷酰胺250毫克的3r-蒈烷内酰胺(1.5毫摩尔)和250毫克的3s-蒈烷内酰胺(1.5毫摩尔)在惰性气氛下在190℃在烧瓶中被搅拌熔融。接着5.0毫克包有石蜡的氢化钠(0.13毫摩尔)和4.5微升醋酸酐(0.048毫摩尔)被添加。反应混合物在所述温度保持30分钟,接着缓冷至室温。所获得的聚合物被粉碎。残余单体和可溶低聚物通过在水-乙醇混合物(1:1)中回流而被除去。得到非晶态的3s-蒈烷内酰胺-3r-蒈烷内酰胺-聚蒈烷酰胺。tg(中值):112℃(dsc方法3.2);tm(范围):不存在(dsc方法3.2);tg:110-120℃(dsc方法3);tm(范围):不存在(dsc方法3);mn:3.2×104(gpc-方法4.1);mw:1.1×105(gpc-方法4.1);1h:图21;13c:图22;dsc:图43;dsc:图83;gpc:图80;结晶度:非晶态。实施例7.3.2(方法步骤i)):将3s-蒈烷内酰胺和3r-蒈烷内酰胺聚合成3s-蒈烷内酰胺-3r-蒈烷内酰胺-共聚蒈烷酰胺750毫克的3s-蒈烷内酰胺(5.5毫摩尔)、362毫克的己内酰胺(0.9毫摩尔)、20.2毫克的n-苯甲酰-3s-蒈烷内酰胺(bz-5,0.07毫摩尔)和8.0毫克包有石蜡的氢化钠(0.20毫摩尔)在玻璃反应容器中在氮气下在加热块中在190℃被聚合1小时。所获得的聚合物被粉碎。残余单体和可溶低聚物通过在水-乙醇混合物(1:1)中回流而被除去。获得部分结晶的聚3s-蒈烷内酰胺-3r-蒈烷内酰胺-共聚酰胺。dsc方法3.2;mn:10.4kda(gpc-方法4.2);mw:15.0kda(gpc-方法4.2);pd:1.4;tg(中值):109℃;tm(范围):210-250℃;dsc:图44;gpc:图72;结晶度:部分结晶。实施例8(方法步骤i2)):3s-蒈烷内酰胺与月桂精内酰胺的共聚合5.00克的月桂精内酰胺(26毫摩尔)在190℃被熔化并且2.50克的3s-蒈烷内酰胺(15毫摩尔)溶解在其中。接着,75毫克的n-苯甲酰-3s-蒈烷内酰胺(iupac:(lr,5s,7s)-4-苯甲酰-5,8,8-三甲基-4-氮杂双环[5.l.0]辛烷-3-酮)和50毫克60%的包有石蜡的nah被添加。在完成聚合后,保持190℃温度30分钟,接着无需主动冷却地冷却到室温。所获得的聚合物被粉碎并且在乙醇-水混合物(1:1)中在回流温度下被搅拌24小时。过滤后,所获得的聚合物在120℃被干燥16小时。玻璃化转变温度(tg)范围:40-50℃;熔点(tm)范围:未示出;结晶度:非晶态。实施例8.1.1(方法步骤i2)):将3s-蒈烷内酰胺和月桂精内酰胺聚合成3s-蒈烷内酰胺-月桂精内酰胺-共聚蒈烷酰胺1.0克的月桂精内酰胺(5.0毫摩尔)、500毫克的3s-蒈烷内酰胺(3.0毫摩尔)、50毫克的n-苯甲酰-3s-蒈烷内酰胺(bz-5,0.18毫摩尔)和18毫克包有石蜡的氢化钠(0.45毫摩尔)在玻璃反应容器中在氮气下在油浴中在190℃被聚合1小时。残余单体和低聚物通过用乙醇从hfip中沉淀出聚合物而被分离。获得非晶态的3s-蒈烷内酰胺-月桂精内酰胺-共聚蒈烷酰胺。dsc方法3.2;tg(中值):46℃;tm(范围):不存在;1h:图23;mn:12.5kda(gpc-方法4.2);mw:24.5kda(gpc-方法4.2);pd:2.0;dsc:图45;gpc:图73;结晶度:非晶态。实施例8.1.2(方法步骤i2)):将3s-蒈烷内酰胺和月桂精内酰胺聚合成3s-蒈烷内酰胺-月桂精内酰胺-共聚蒈烷酰胺10克的月桂精内酰胺(50毫摩尔)、5克的3s-蒈烷内酰胺(30毫摩尔)、54毫克的n-苯甲酰-3s-蒈烷内酰胺(bz-5,0.2毫摩尔)和20毫克包有石蜡的氢化钠(0.50毫摩尔)在玻璃反应容器中在氮气下在油浴内在190℃被聚合1小时。残余单体和低聚物通过用乙醇从hfip中沉淀出聚合物而被分离。获得非晶态的3s-蒈烷内酰胺-月桂精内酰胺-共聚蒈烷酰胺。dsc方法3.2;mn:30.2kda(gpc-方法4.2);mw:60.1kda(gpc-方法4.2);pd:2.0;tg(中值):49℃;tm(范围):不存在;dsc:图46;gpc:图74;结晶度:非晶态。实施例8.1.3(方法步骤i2)):将3s-蒈烷内酰胺和月桂精内酰胺聚合成3s-蒈烷内酰胺-月桂精内酰胺-共聚蒈烷酰胺411毫克的3s-蒈烷内酰胺(2.5毫摩尔)、486毫克的月桂精内酰胺(2.5毫摩尔)、20.0毫克的n-苯甲酰-3s-蒈烷内酰胺(bz-5,0.07毫摩尔)和8.0毫克包有石蜡的氢化钠(0.20毫摩尔)在玻璃反应容器中在氮气下在加热块中在190℃被聚合1小时。所获得的聚合物被粉碎。残余单体和可溶低聚物通过在水-乙醇混合物(1:1)中回流而被除去。获得非晶态的3s-蒈烷内酰胺-月桂精内酰胺-共聚酰胺。dsc方法3.2;mn:10.0kda(gpc-方法4.2);mw:15.6kda(gpc-方法4.2);pd:1.6;tg(中值):55℃;tm(范围):不存在;dsc:图47;gpc:图75;结晶度:非晶态。实施例8.2.1(方法步骤i2)):将3s-蒈烷内酰胺和己内酰胺聚合成3s-蒈烷内酰胺-己内酰胺-共聚蒈烷酰胺5.0克的己内酰胺(44毫摩尔)、2.5克的3s-蒈烷内酰胺(15毫摩尔)、75毫克的n-苯甲酰-3s-蒈烷内酰胺(bz-5,0.28毫摩尔)和50毫克包有石蜡的氢化钠(1.3毫摩尔)在玻璃反应容器内在氮气下在油浴中在190℃被聚合1小时。残余单体和低聚物通过用乙醇从hfip中沉淀出聚合物而被分离。获得部分结晶的3s-蒈烷内酰胺-己内酰胺-共聚蒈烷酰胺。dsc方法3.2;mn:15.2kda(gpc-方法4.2);mw:31.1kda(gpc-方法4.2);pd:2.0;tg(中值):62℃;tm(范围):160-190℃;1h:图24;dsc:图48;gpc:图76;结晶度:部分结晶。实施例8.2.2(方法步骤i2)):将3s-蒈烷内酰胺和己内酰胺聚合成3s-蒈烷内酰胺-己内酰胺-共聚蒈烷酰胺537毫克的3s-蒈烷内酰胺(3.2毫摩尔)、362毫克的己内酰胺(3.2毫摩尔)、20.1毫克的n-苯甲酰-3s-蒈烷内酰胺(bz-5,0.07毫摩尔)和7.9毫克包有石蜡的氢化钠(0.20毫摩尔)在玻璃反应容器内在氮气下在加热块中在190℃被聚合1小时。所获得的聚合物被粉碎。残余单体和可溶低聚物通过在水-乙醇混合物(1:1)中回流而被除去。获得非晶态的3s-蒈烷内酰胺-己内酰胺-共聚蒈烷酰胺。dsc方法3.2;mn:12.1kda(gpc-方法4.2);mw:17.3kda(gpc-方法4.2);pd:1.4;tg(中值):88℃;tm(范围):不存在;dsc:图49;gpc:图77;结晶度:非晶态。实施例8.2.3(方法步骤i2)):将3s-蒈烷内酰胺和己内酰胺聚合成3s-蒈烷内酰胺-己内酰胺-共聚蒈烷酰胺250毫克的3s-蒈烷内酰胺(1.5毫摩尔)、57毫克的己内酰胺(0.5毫摩尔)、10毫克的n-苯甲酰-3s-蒈烷内酰胺(bz-5,0.04毫摩尔)和1.5毫克包有石蜡的氢化钠(0.04毫摩尔)在玻璃反应容器中在氮气下在加热块内在175℃被聚合1小时。所获得的聚合物被粉碎。残余单体和低聚物通过用乙醇从hfip中沉淀出聚合物而被分离。获得非晶态的聚3s-蒈烷内酰胺-己内酰胺-共聚蒈烷酰胺。dsc方法3.2;tg(中值):99℃;tm(范围):不存在;dsc:图50;结晶度:非晶态。实施例9(方法步骤i2)):3s-蒈烷内酰胺与己内酰胺的共聚合5.00克的己内酰胺(44毫摩尔)在190℃被熔化且2.50克的3s-蒈烷内酰胺(15毫摩尔)在其中溶解。接着75毫克的n-苯甲酰-3s-蒈烷内酰胺(iupac:(lr,5s,7s)-4-苯甲酰-5,8,8-三甲基-4-氮杂双环[5.l.0]辛烷-3-酮)和50毫克60%的包有石蜡的nah被添加。在完成聚合后,在190℃温度下保持30分钟,接着无需主动冷却地被冷却到室温。所获的聚合物被粉碎且在乙醇-水混合物(1:1)中在回流温度下被搅拌24小时。过滤后,所获得的聚合物在120℃被干燥16小时。玻璃化转变温度(tg)范围:50-60℃;熔点(tm)范围:160-200℃;结晶度:部分结晶。实施例10:3r-聚酰胺的吸水量pa6通过阴离子开环聚合来制备(2.8毫摩尔的己内酰胺,0.1毫摩尔60%的包有石蜡的nah,0.05毫摩尔的ac2o,180℃)。残余单体通过在水/乙醇中回流而被除去。30-42毫克的pa6(3个样本)和2个聚3r-蒈烷酰胺样本在dsc(与在dsc分析方法(3)中所述的一样的仪器)中在230℃被加热3分钟并且通过这种方式制备相同的聚酰胺嵌段。所述物质在ohausdiscoverydv215cd秤上以0.01毫克的最大误差被测定。样本随后分别在25℃在水中被搅拌3天。随后,样本被空气干燥并且在30分钟后和4.5小时后被称量。接着,样本在80℃被干燥3小时且被称量。所述时间足以使聚3r-蒈烷酰胺样本完全干燥。pa6的总体较高的吸水量和pa6的较长干燥时间表明,脂肪族取代的聚-3r-蒈烷酰胺相比于pa6具有普遍较低的吸水量。表13:吸水量。预处理:a=来自dsc的聚酰胺嵌段;b=水浴(3天)和空气干燥(30分钟);c=空气干燥(4.5小时);d=80℃干燥(3.0小时)。实施例11.1:通过与pa6和pa12相比较来定性测量3r-聚酰胺的透明度3r-聚酰胺在hfip中溶解(25毫克/毫升)并且通过小心滴涂来施加到ptfe薄膜上。在溶剂蒸发且在85℃干燥3小时之后,获得相比于pa6和pa12透光的(透明的)薄膜,薄膜具有因不均匀蒸发和空气夹杂而造成的瑕疵。实施例11.2:通过与pa6和pa12相比来定性测量非晶态3s-蒈烷内酰胺-月桂精内酰胺-共聚蒈烷酰胺的透明度非晶态的3s-蒈烷内酰胺-月桂精内酰胺-共聚蒈烷酰胺在hfip中溶解(25毫克/毫升)并且被转移入结晶皿(直径9厘米)中。在溶剂蒸发且在85℃干燥3小时之后,获得相比于pa6和pa12透光的(透明的)薄膜,薄膜具有因不均匀蒸发和空气夹杂而造成的瑕疵。实施例11.3:通过对比pa6和pa12来定性测量非晶态3s-蒈烷内酰胺-己内酰胺-共聚蒈烷酰胺的透明度非晶态的3s-蒈烷内酰胺-己内酰胺-共聚蒈烷酰胺在hfip中溶解(25毫克/毫升)且通过小心滴涂来施加到ptfe薄膜上。在溶剂蒸发且在85℃干燥3小时之后,获得与pa6和pa12相比透光的(透明的)薄膜,薄膜具有因不均匀蒸发和空气夹杂而造成的瑕疵。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1