一种人重组乙型干扰素的制备方法与流程
本申请是申请日为2014年4月9日、中国申请号为2014101411186、发明名称为“一种人重组乙型干扰素的制备方法”的发明申请的分案申请。
本发明属于生物医药领域,具体涉及一种人重组乙型干扰素的制备方法。
背景技术:
乙型干扰素(又称为β干扰素,interferon-β,ifn-β)是由体内纤维细胞和巨噬细胞分泌的细胞因子,是一种糖蛋白,含166个氨基酸,分子量约为20,500道尔顿,具有抗炎症功能,抗病毒、抗增殖以及免疫调节活性,其作为药物可广泛用于抗感染、抗肿瘤和拮抗自身免疫性疾病。尽管乙型干扰素已经在大肠杆菌、酵母、昆虫细胞和中国仓鼠卵巢癌细胞中进行表达,然而,由这些系统所表达和生产的蛋白量相对较少。
小分子类泛素修饰蛋白(smallubiquitin-likemodifier,sumo)具有高度类似泛素的桶状蛋白结构,具有相当的保守性,能够提供蛋白正确折叠的核心,极大提高了目的蛋白的溶解性,已经证明是最好的提高可溶蛋白表达量的标签之一。并且,sumo这个融合的蛋白标签可以在体外用源于酵母的sumo特异的蛋白水解酶ulp1极为高效的切割掉,从而获得与目的蛋白完全相同的重组蛋白质。然而,在真核表达系统中,由于存在大量的内源的sumo特异性的蛋白水解酶(如酿酒酵母中的ulp1和哺乳动物细胞中的senpn系列蛋白质),sumo蛋白标签会被迅速的切割掉,从而失去了作为蛋白标签所起的促溶和增进表达量作用,因而在真核系统中作用不显著。
技术实现要素:
本发明的目的是提供一种人重组乙型干扰素的制备方法,该方法能够在酵母细胞系统中获得高产量的与自然人乙型干扰素结构和功能相似的重组人乙型干扰素。
本发明所述的一种人重组乙型干扰素的制备方法,包括以下步骤:
(a)通过将亮氨酸拉链1、类泛素修饰分子羧基端与乙型干扰素融合,并在酵母系统高效表达,获得亮氨酸拉链1-类泛素修饰分子羧基端-乙型干扰素融合蛋白,分离所述融合蛋白,其序列如seqidno.1所示;
(b)将所述的融合蛋白,与类泛素的修饰分子氨基端-亮氨酸拉链2蛋白分子混合,所述类泛素的修饰分子氨基端-亮氨酸拉链2蛋白分子的序列如seqidno.2所示;所述亮氨酸拉链2与亮氨酸拉链1可相互作用形成亮氨酸拉链二聚体,从而生成类泛素分子重建物;所述类泛素分子重建物包含:由亮氨酸拉链1和亮氨酸拉链2相互作用形成的亮氨酸拉链二聚体、重建的类泛素分子以及乙型干扰素蛋白;
(c)用类泛素分子的特异性蛋白酶处理步骤b的重建物,从而将亮氨酸拉链二聚体和重建的类泛素分子切割下来,分离获得与自然人乙型干扰素结构和功能相似的重组人乙型干扰素。
根据本发明所述的制备方法的进一步特征,所述的类泛素修饰分子选自:sumo、泛素(ubiqutin),nedd8(neuralprecursorcellexpresseddevelopmentallydown-regulated8),干扰素刺激蛋白15(isg15interferon-stimulatedprotein15),延伸素b(elonginb),泛素类似物l(rublrelatedtoubiquitini)。
优选地,所述的类泛素修饰分子是sumo。
根据本发明所述的制备方法的进一步特征,所述sumo的羧基端区域具有seqidno.1中第52-96位的氨基酸序列;或者所述sumo的氨基端区域具有seqidno.2中第9-62位的氨基酸序列。
根据本发明所述的制备方法的进一步特征,所述的亮氨酸拉链1具有seqidno.1中第14-43位的氨基酸序列;或者所述的亮氨酸拉链2具有seqidno.2中第69-97位的氨基酸序列。
根据本发明所述的制备方法的进一步特征,所述步骤(a)中,在所述的亮氨酸拉链1的编码基因和类泛素分子羧基端区域的编码基因之间还包括一连接序列。
根据本发明所述的制备方法的进一步特征,所述的连接序列编码seqidno.1中第44-51位的氨基酸序列。
根据本发明所述的制备方法的进一步特征,所述步骤(b)中,在所述的类泛素分子氨基端区域和亮氨酸拉链2之间还包括一连接序列。
根据本发明所述的制备方法的进一步特征,所述的连接序列如seqidno.2中第63-68位所示。
根据本发明所述的制备方法的进一步特征,所述步骤(a)中,所述的融合蛋白还含有至少一个纯化用标签的编码基因;或者所述步骤(b)中,所述的类泛素分子重建物还包含至少一个纯化用标签。
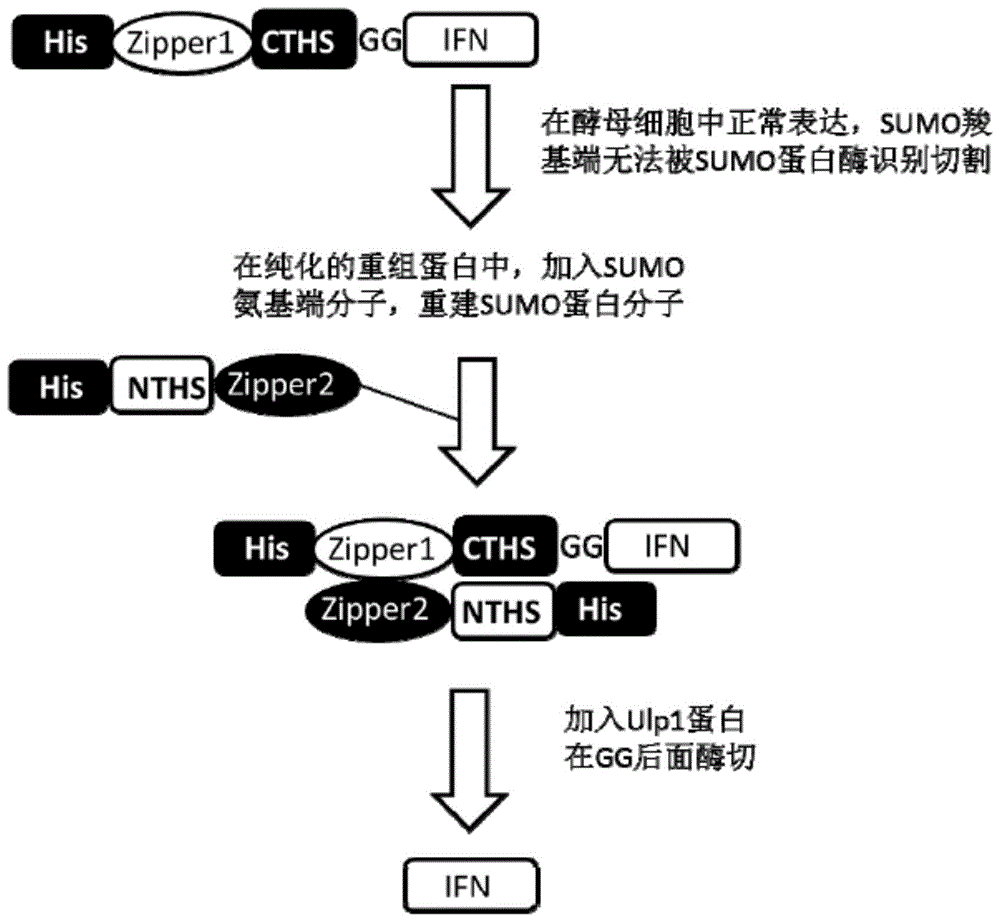
为了能够在酵母表达系统中使用sumo标签提高乙型干扰素表达水平,本发明采用了一种halfsumo互补表达系统。将sumo分为氨基端和羧基端结构域(nths和cths)两部分,将羧基端与乙型干扰素融合,由于羧基端继承了sumo的大部分保守蛋白结构域,具有甚至优于sumo的促溶效果,并且无法被内源性的蛋白水解酶识别和切割,从而可以在酵母系统中使用。在纯化好的sumo羧基端-乙型干扰素融合的目的蛋白中,加入sumo的氨基端蛋白分子,重组成为完整的sumo分子,被外加的类泛素修饰分子特异性蛋白酶(ulp1)所识别,以将融合的sumo羧基端标签移除得到与自然人乙型干扰素结构和功能相似的重组人乙型干扰素。
附图说明
图1为酵母中his-zipperl-cths-ifn诱导表达结果。
图2为his-zipper1-cths-ifn与his-nths-zipper2重建sumo蛋白分子后经sumo蛋白酶切后,利用ni-nta亲和层析,纯化获得乙型干扰素蛋白。
图3为乙型干扰素细胞病变抑制结果。
具体实施方式
本文中,所述的“亮氨酸拉链(leucinezipper)二聚体”是指来自不同多肽链的两个两用性的α-螺旋的疏水面(常常含有亮氨酸残基)相互作用形成一种圈对圈的二聚体结构。通常,亮氨酸拉链是由伸展的氨基酸组成,每7个氨基酸中的第7个氨基酸是亮氨酸,亮氨酸是疏水性氨基酸,排列在伐,螺旋的一侧,所有带电荷的氨基酸残基排在另一侧。当两条多肽相互接近时,亮氨酸之间相互作用形成二聚体,从而形成“拉链”。
本文中,所述的“亮氨酸拉链1”或“亮氨酸拉链2”是指当它们分别位于两条多肽链上时,并且两条多肽链相互接近时,可以发生相互作用并形成亮氨酸拉链二聚体的分子。
以下结合具体实施例对本发明做进一步说明,目的在于解释本发明的内容而非限制发明的保护范围。下面实施例中未注明具体条件的试验方法,通常按照常规条件,如sambrook等人著,分子克隆:试验指南(newyork,coldspringhabourlaboratorypress)中所述条件,或按照制造厂商建议条件进行。
i.材料和方法
质粒和菌株
大肠杆菌dh5、bl21和用于酵母表达的毕赤酵母菌株x33(购自invitrogen)。用于酵母表达的ppiczαa购自invitrogen公司。
培养基或缓冲液的配方:
(1)luriabertani(lb)培养基
bacto-胰蛋白胨10g/l;bacto-酵母抽提物5g/l;nacl10g/l;灭菌。
(2)rbcl化学感受态所需s.o.b培养液
bacto-胰蛋白胨20g/l;bacto-酵母抽提物5g/l;nacl0.6g/l;kcl0.5g/l;灭菌,使用前加入灭菌的mgcl2、mgso4至终浓度10mm。
(3)大肠杆菌感受态细胞缓冲液1
rbcl12g/l;mncl2·4h2o9.9g/l;cacl2·2h2o1.5g/l;甘油150g/l;kac2.94g/l;由10%hac调至ph5.8,过滤除菌,4℃保存。
(4)大肠杆菌感受态细胞缓冲液2
0.5mmops20ml(ph6.8);rbc11.2g/l;cacl2·2h2o11g/l;甘油150g/l;过滤除菌,4℃保存。
(5)毕赤酵母培养基配方
培养基配方所用母液:10×ynb(13.4%酵母氮源碱(ynb)含硫酸铵不含氨基酸)溶解134gynb于1000ml水中,过滤除菌,加热至ynb完全溶解,存于4℃。
500×生物素(0.02%):溶解20mg生物素于100ml水中,过滤除菌,放于4℃。
100×h(0.4%组氨酸):溶解400mgl-组氨酸于100ml水中,低于50℃加热以促溶解,过滤除菌;
10×d(20%葡萄糖):溶解200gd-葡萄糖于1000ml水中,高压灭菌15min或过滤除菌;
10×m(5%甲醇):混合5ml甲醇与95ml水,过滤除菌存于4℃,可放2个月;
10×gy(10%甘油):混合100ml甘油与900ml水,过滤或高压灭菌,室温放置;
1m磷酸钾缓冲液(ph6.0):132ml1mk2hpo3,868ml1mkh2po3,调整ph值为6.0±0.1(如果需调ph值,用磷酸或koh)。
过滤或高压灭菌;
ypd(yped)培养基(il):1%酵母提取物,2%蛋白胨,2%葡萄糖;
md/mdh培养基1l:1.34%ynb,4×10-5%生物素,2%葡萄糖,加入湿热灭菌800ml水;于60℃下加入100ml10×ynb,2ml500×b,100ml10×d。制mdh时,加入10ml100×h,混匀存于4℃;如制备平板,于第一步加入15g琼脂粉;倒置平板,4℃放置。
bmgy培养基:1%酵母浸出物,2%蛋白胨,100mm磷酸钾(ph6.0),1.34%ynb,4×10-5%生物素,1%甘油;
bmmy培养基:1%酵母浸出物,2%蛋白胨,100mm磷酸钾(ph6.0),1.34%ynb,4×10-5%生物素,0.5%甲醇;
克隆的构建
在基因的两端通过链式聚合酶反应(pcr)引入合适的限制性内切酶酶切位点,或者已有质粒上得到目的dna片段,然后用限制性内切酶切割2-3小时,电泳后,用qiagen公司的回收试剂盒回收酶切后的dna片段,连入相应的载体。转化到dh5α感受态细胞中,扩增,获得目的质粒。
rbcl感受态细胞的制备
(1)将大肠杆菌菌种划线到lb平板,37℃培养10~12小时。
(2)挑单克隆于30mls.o.b(用前以1∶100比例加入1mmgcl2,以1∶100比例加入1mmg2so4)中,37℃,培养过夜。
(3)1∶100接过夜菌到200mls.o.b(用前以1∶100比例加入1mmgcl2,以1∶100比例加入1mmg2so4)中,37℃培养至od600为0.35。
(4)把菌液迅速转移至冰盐浴(-3~-5℃)中,预冷15分钟。
(5)4℃,4500rpm×5min离心,弃上清。加入64ml感受态细胞缓冲液1,悬浮,冰盐浴15分钟。
(6)4℃4000rpm×5min离心,弃上清。加入16ml感受态细胞缓冲液2,在冰上悬浮菌体。
(7)立即分装成200μl/管(管预冷)。
(8)液氮速冻,-70℃保存。
转化
(1)将5μl连接产物或者100ng质粒加入200μl感受态细胞中,弹匀后冰上放置30分钟。
(2)42℃温浴2分钟,冰上放置2分钟。加入800μllb,37℃温浴30~45分钟。
(3)8,000rpm离心1分钟,倒去900μl上清,用管底残留的100μl左右的液体将沉淀悬浮,铺盘。
(4)倒置放于37℃培养箱中12~15小时。
毕赤酵母电转化感受态制备
(1)在含5mlypd的50ml离心管中,培养毕赤酵母,30℃过夜。
(2)取0.1-0.5ml过夜培养物,接种含500ml新鲜培养基的2l摇瓶,过夜生长至od600=1.3-1.5。
(3)在4℃,15,000rpm离心5min收集细胞,用500ml预冷的灭菌水悬浮细胞。
(4)如上离心,用250ml预冷的灭菌水悬浮细胞。
(5)如上离心,用20ml预冷的1m山梨醇悬浮细胞。
(6)如上离心,用1ml预冷的1m山梨醇悬浮细胞,至终体积约1.5ml。
毕赤酵母电转化
(1)取80μl上述细胞与5-20μg线性化dna(溶于5-10μlte)混合,转入预冷的0.2cm电转杯中。
(2)在冰上放置5min。
(3)根据所使用装置(bio-rad电转仪)推荐的酿酒酵母参数进行电击。
(4)立即加入1ml预冷的1m山梨醇至杯中,将内容物转移至灭菌离心管中。
(5)分成200-600μl等份,涂于md平板上。
毕赤酵母蛋白表达诱导
(1)挑取单克隆,接种至含100mlbmgy培养基的1l隔板摇瓶中。在摇床中28-30℃,250-300rpm生长至od600=2-6(约16-18小时)。
(2)室温1500-3000g离心5min收集细胞,去除上清,用1/5-1/10原培养基体积的bmmy重悬细胞(约10-20ml)。
(3)置于100ml隔板摇瓶中,用2层灭菌纱布或干酪包布盖住瓶口,放入摇床继续培养。
(4)每隔24小时,加入甲醇至终浓度为0.5%以继续诱导。
(5)在下列的各个时间点,取1ml培养基至1-5ml离心管。这些样品用于分析表达水平及确定诱导后收集细胞的最佳时间。
毕赤酵母表达蛋白纯化
(1)取毕赤酵母诱导表达物离心,12,000rpm30min,4℃,取上清。
(2)将上清用孔径为0.45μm滤膜过滤,然后进行ni-nta亲和层析,采用连续梯度洗脱方式(平衡液:50mmtris(ph8.0),50mmnacl,2.5%glycerol;洗脱液:50mmtris(ph8.0),50mmnacl,2.5%glycerol,500mmimldazol),按峰收集,每个收集样品进行sds-page电泳检测。
(3)将含有目的蛋白的收集样品,合并然后透析至含50mmtris(ph8.0)、50mmnacl的2.5%glycerol溶液中。
ii.实施例
实施例1.表达载体构建
6his-zipper1-cths的dna序列通过分别通过ecori和xhoi位点,插入到ppiczα中,再通过bsai和xhal,插入乙型干扰素ifn,构建酵母表达质粒ppiczα-6his-zipper1-cths-ifn。
6his-nths-zipper2的dna序列通过分别通过ncoi和xhoi位点插入到pet28α中,构建原核表达质粒pet28a-6his-nths-zipper2。
其中,cths是sumo的c末端(c-sumo)的简写。对应的sumo的n端简称为nths(或nt),zipper是指亮氨酸拉链。
实施例2.酵母表达和蛋白纯化
将质粒ppiczα-6his-zipper1-cths-ifn转化到毕赤酵母,挑取单克隆,接种至含100mlbmgy培养基的1l隔板摇瓶中。在摇床中28-30℃,250-300rpm生长至od600=2-6,以1500-3000g离心5min收集细胞,去除上清,用1/5-1/10原培养基体积的bmmy重悬细胞(约10-20ml),在接种于100ml隔板摇瓶中,用2层灭菌纱布或干酪包布盖住瓶口,放入摇床继续培养。每隔24小时,加入甲醇至终浓度为0.5%以诱导。
诱导结束后,以12,000rpm离心30min,取上清,用孔径为0.45μm滤膜过滤,然后进行ni-nta亲和层析,采用连续梯度洗脱方式(平衡液:50mmtris(ph8.0),50mmnacl,2.5%glycerol;洗脱液:50mmtris(ph8.0),50mmnacl,2.5%glycerol,500mmimldazol),按峰收集,每个收集样品进行sds-page电泳检测。
将含有目的蛋白的收集样品合并,按照4∶1的质量比例混合纯化好的6his-zipper1-cths-ifn和6his-nths-zipper2蛋白混匀,在30℃温浴半小时重建sumo,加入coolcuttmprotease在30℃切割1小时,然后sds-page电泳检测。sumo酶切反应条件按照genecopoeoia公司coolcuttmprotease产品说明书建议进行。
随后,酶切产物进行ni-nta亲和层析(平衡液:50mmtris(ph8.0),50mmnacl,2.5%glycerol;洗脱液:50mmtris(ph8.0),50mmnacl,2.5%glycerol,500mmimldazol),收集穿透液,随后进行sds-page电泳检测,获得了ifn蛋白。
实施例3.乙型干扰素细胞病变抑制法(cytopathiceffectinhibition,cpei)
将不同稀释度的乙型干扰素样品加入96孔平底培养板中,100μl/孔;将不同稀释度的标准品加入96孔平底培养板中,100μl/孔;每孔加4×106/mlwish细胞,100μl/孔;除wish细胞对照孔外,每孔加vsv病毒,50μl/孔;置5%co2,37℃培养箱培养48-52小时;镜下观察病毒对照孔出现细胞病变时,弃上清,加入结晶紫染液染色5分钟;用流水冲洗培养板,直到冲洗液无色为止,晾干培养板;每孔加入70%乙醇150μl/孔。使结晶紫充分溶解;酶标仪上比色,读取600nm波长的数值。
采用avonex是美国biogen公司生产的乙型干扰素,作为对照,该药于1995年通过美国fda批准使用的用于多发性硬化病的治疗药,结果显示本发明方法生产乙型干扰素具有与对照相似的活性。
- 还没有人留言评论。精彩留言会获得点赞!