一种白细胞抗原结合多肽
本发明涉及基因工程领域,具体是一种白细胞抗原结合多肽。
背景技术:
抗体在临床药物治疗和临床诊断中占据重要地位,在临床诊断、肿瘤治疗、抗移植排斥、自身免疫性疾病的治疗中得到大规模的应用。随着抗体构建技术的发展,抗体药物先后历经了鼠源抗体(无人源氨基酸序列)、嵌合抗体(60%~70%人源化氨基酸序列)、人源化抗体(90%~95%人源化氨基酸序列)和全人源抗体(100%人源氨基酸序列)等几个阶段。
嵌合抗体使用人源基因代替已有的鼠源单克隆抗体fc区,因而可保留抗原抗体的特异性,降低hama效应。嵌合抗体氨基酸序列中30%左右为鼠源氨基酸序列,因而残留一定的免疫原性,有些能产生很强的hama效应。为了降低鼠源成分,研究者在嵌合抗体的基础上,进一步用人源框架区(fr)来代替鼠源框架区(fr),除了3个互补决定区(cdr)是鼠源外,其余都是人源结构,这种进一步人源化的抗体被称为cdr移植抗体或者改型抗体。全人源抗体需要在特定的转基因小鼠中进行或者在人体血液中采集分离特定b细胞,工艺难度较大,目前在国内应用尚不广泛。
cd3仅存在于t细胞表面,由6条肽链组成,常与tcr紧密结合形成含有8条肽链的复合物,在细胞内信息传递中起着重要作用。已有的研究表明抗人t细胞cd3单抗具有激活和抑制t细胞的双重功能,它在抗肿瘤、抗多种器官移植排斥以及再生障碍性贫血的治疗中具有广阔的应用前景。
技术实现要素:
本发明的目的在于提供一种白细胞抗原结合多肽,应用基因工程技术设计了一种人源化抗cd3分子的单链抗体并在大肠杆菌中实现高效表达,通过对一种鼠抗cd3抗体的序列分析,通过替换骨架区序列,实现抗体人源化,为了提高蛋白在原核细胞中的翻译表达水平,突变了重链可变区的半胱氨酸残基,构建目的基因的原核表达载体,选取大肠杆菌作为表达宿主,通过高密度发酵,获得融合的,带有纯化标签的融合蛋白,突变后的融合蛋白的表达水平是突变前的5到10倍,融合蛋白通过亲和层析、酶切和分子筛层析获得纯的,有活性的抗体蛋白,此抗体与人免疫t细胞表面cd3分子有良好的亲和力。
本发明的目的可以通过以下技术方案实现:
一种白细胞抗原结合多肽,应用基因工程设计一种人源化抗cd3分子的单链抗体,对一种鼠抗cd3抗体的序列分析,通过替换骨架区序列,实现抗体人源化,通过突变重链可变区的半胱氨酸残基,构建目的基因的原核表达载体,选取表达宿主,发酵,获得融合的、带有纯化标签的融合蛋白,再通过亲和层析、酶切和分子筛层析获得纯化的、有活性的抗体蛋白。
进一步地,所述单链抗体由重链可变区和轻链可变区组成。
进一步地,所述重链可变区蛋白序列包括四个骨架区和三个cdr区,重链可变区的cdr区包括vh-cdr1、vh-cdr2和vh-cdr3,重链可变区蛋白序列为:diqmtqspsslsasvgdrvtitcktssggastsqygnwyqqtpgkapkrwiyagcnrkgpgvpsrfsgsgsgtdytftisslqpediatyycglfssviwffgqgtklqitr。
进一步地,所述轻链可变区蛋白序列含四个骨架区和三个cdr区,轻链可变区的cdr区包括vl-cdr1、vl-cdr2和vl-cdr3,轻链可变区蛋白序列为:qvqlvqsgggvvqpgrslrlsckasgytftcsygmvwvrqapgkglewiggklrsrsnvsastygdtfrdrftisrdnskntaflqmdslrpedtgvyfcarhaqfaqstassfaswgqgtpvtvss。
进一步地,所述骨架区还包括人和哺乳类动物的抗体骨架区,cdr区高度特异,单个氨基酸残基的改变会影响抗体的亲和力。
进一步地,宿主系统包括脊椎动物、昆虫、植物、真菌、细菌和病毒,细菌选用大肠杆菌,优选大肠杆菌bl21菌株。
进一步地,所述宿主系统经过载体转化、转染或转导得到含有抗体蛋白的基因表达载体的宿主系统,并用于表达携带有重链可变区和轻链可变区的氨基酸序列。
进一步地,所述抗体蛋白通过含有抗体基因表达载体的构建进行批量制备。
进一步地,携带有基因序列的质粒载体和其它密码子偏爱的编码同种蛋白的基因表达载体,优选pet载体。
进一步地,基因载体经宿主系统大规模表达和纯化后的产物作为试剂、添加剂或用于临床。
本发明的有益效果:
1、本发明抗原结合多肽采用原核表达系统,具有技术简单成熟,产物简单,表达量大,易于分离纯化等特点,在工业生产中具有成本低、产量高、操作简便,比酵母以及其他的真核表达系统更加容易进行工业化的优点。为克服原核表达系统中缺乏蛋白翻译后修饰加工系统和容易形成没有活性的前体蛋白的问题,本发明应用大肠杆菌融合表达策略,通过高密度发酵以及一系列的下游纯化手段成功获得具有良好生物活性的单链抗体;
2、本发明抗原结合多肽在elisa检测中证明本抗体和cd3分子有良好的亲和力;scfv可以用于血液中cd3阳性细胞的标记,表明本发明成功地实现了目的基因的原核大肠杆菌的表达和目的蛋白产物的纯化;
3、本发明中cd3抗原的单链scfv抗体可以单独用于抑制cd3抗原的治疗,也可以作为靶向分子携带特定的药物靶向投递药物。
附图说明
下面结合附图对本发明作进一步的说明。
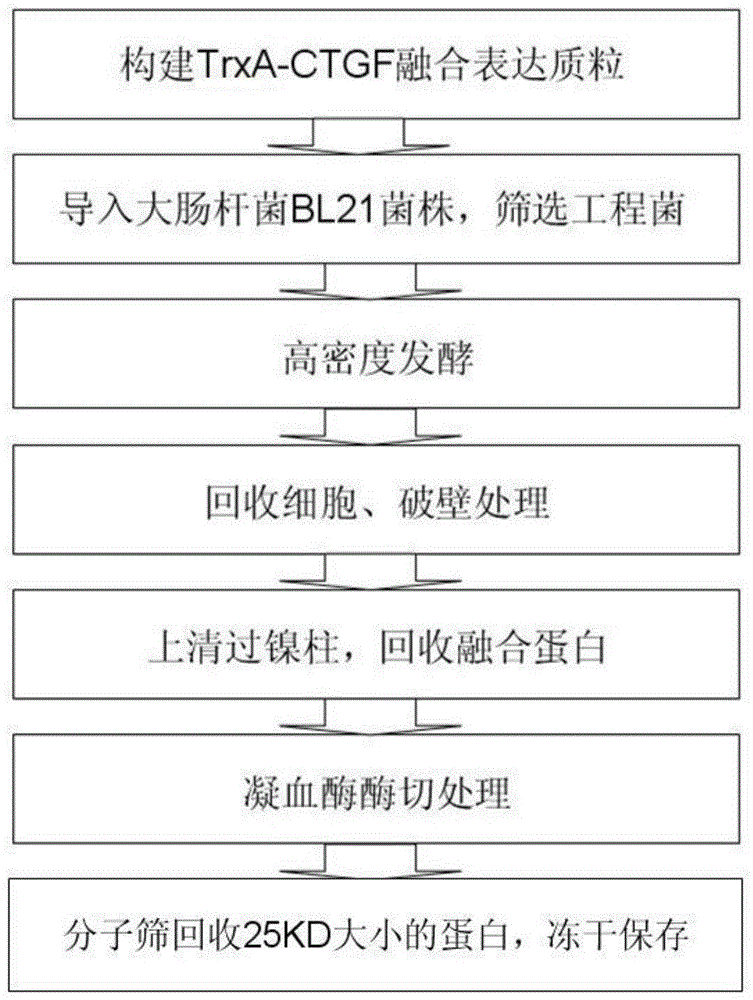
图1是本发明抗原结合多肽生产工艺图;
图2是本发明scfv抗体经镍柱纯化和分子杂交;
图3是本发明scfv抗体与cd3抗原结合的elisa实验;
图4是本发明scfv与cd3阳性细胞的结合。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其它实施例,都属于本发明保护的范围。
一种白细胞抗原结合多肽,生产工艺如图1所示,通过同源替换的方式,将一个鼠源抗cd3抗体的vl和vh的cdr区移植到igg的框架区,设计了人源化抗cd3单链抗体,设计dna并通过酶切、连接插入pet32质粒,构建trxa-scfv融合表达质粒。
通过钙盐共沉淀的转化方法将构建的trxa-scfv融合表达质粒导入大肠杆菌bl21菌株中,将pet32质粒上携带的氨苄抗性基因通过氨苄平皿筛选阳性工程菌。
运用高密度发酵技术,在50升发酵罐中用bl培养基,温度20-25℃(优选温度为25℃),在ph碱性(优选ph为7.6)和溶氧20-40%(优选28%的溶氧)的条件下进行发酵12小时,获得100克/升以上的菌体湿重。
菌体经过离心回收,用反复冻融、裂解液和超声处理等方法进行破壁处理,反复的冻融和超声以及酶裂解联合应用能获得理想的破壁效果,裂解后显微镜观察,溶菌产物用高速离心8000转/分下离心15钟取上清。
溶菌上清在通过镍柱亲和层析处理之后,获得很纯的目的融合蛋白,选用novagen公司生产的镍柱亲和柱。
目的蛋白分子量为25kd,选用25-30kd孔径的分子筛(优选30000的葡聚糖凝胶分子筛)。
回收的溶液用冻干机冻干成冻干粉,在冷藏或室温条件下保存。
通过检索genbank证实我们获得的scfv基因序列是一个全新的序列,其表达的蛋白产物有252个氨基酸,2个二硫键,该序列包含完整的人免疫球蛋白重链v区和轻链v区,该序列框架区(vh-fr1、fr2、fr3,vl-fr1、fr2、fr3)为人源,其互补决定簇(vh-cdr1、cdr2、cdr3,vl-cdr1、cdr2、cdr3)为新的序列。
目的基因在多种pet载体以及pet/elp-i-cat等质粒中都能表达,因为scfv抗体对大肠杆菌几乎没有毒性,所以外源基因在大肠杆菌中可以游离表达也可以融合表达。本发明选取pet28的bl21菌株表达系统作为优选表达系统。t7启动子是当今大肠杆菌表达系统的主流,这个功能强大兼专一性高的启动子经过巧妙的设计而成为原核表达的首选,尤其以novagen公司的pet系统为杰出代表。强大的t7启动子完全专一受控于t7rna聚合酶,而高活性的t7rna聚合酶合成mrna的速度比大肠杆菌rna聚合酶快5倍——当二者同时存在时,宿主本身基因的转录竞争不过t7表达系统,几乎所有的细胞资源都用于表达目的蛋白;诱导表达后仅几个小时目的蛋白通常可以占到细胞总蛋白的50%以上。
目前,原核表达系统中研究和应用最为广泛的就是大肠杆菌,在原有的很多的研究和技术水平上,为目的基因的表达和纯化提供了丰富的经验,为实现scfv抗体的高效表达提供了广泛的理论基础。目前工业上应用的促进蛋白溶解性表达的方法主要是融合表达。低温表达也是促进蛋白溶解性表达的另一种重要手段,这种方法不是从基因水平诱导,而是在蛋白表达的过程中,利用低温发酵使蛋白表达速率下降,从而为蛋白的自我折叠提供充足的时间,避免了包涵体的出现,也就不需要蛋白复性。蛋白复性是一项复杂的技术,尤其对于含有较多二硫键的抗体肽类,复性比较复杂,繁琐。在室温下的摇瓶实验中,显示有较多的目的蛋白的沉淀,但在低温发酵中(18℃)可以发现沉淀中的目的条带明显的减少。
与真核表达系统相比,原核表达系统具有技术简单成熟,产物简单,表达量大,易于分离纯化等特点,在工业生产中具有成本低、产量高、操作简便,比酵母以及其他的真核表达系统更加容易进行工业化的优点。目前一般认为原核表达系统缺乏蛋白翻译后修饰加工系统,容易形成没有活性的前体蛋白,本发明应用大肠杆菌融合表达策略,通过高密度发酵以及一系列的下游纯化手段成功获得具有良好生物活性的单链抗体。在elisa检测中证明我们的抗体和cd3分子有良好的亲和力;scfv可以用于血液中cd3阳性细胞的标记,说明本发明成功地实现了目的基因的原核大肠杆菌的表达和目的蛋白产物的纯化。
此cd3抗原的单链scfv抗体不但可以单独用于抑制cd3抗原的治疗,而且可以作为靶向分子携带特定的药物靶向投递药物。
实施例1
表达系统的构建
分子技术包括目的基因的pcr扩增,限制性酶切,琼脂糖凝胶电泳,dna片段的回收和酶连反应,细菌转化和筛选。pcr采用bio-red公司生产的pcr仪,pcr所用酶和试剂及耗材购自novagen公司。dna提取和回收均采用novagen公司生产的商业纯化回收柱。所用的限制酶和连接酶均购自takara。然后通过钙盐共沉淀的转化方法将构建好的质粒导入大肠杆菌bl21菌株中,利用pet28质粒其上携带的kana抗性基因用kana平皿筛选阳性工程菌。
实施例2
高密度发酵
实验证实利用改造大肠杆菌进行表达能实现高密度发酵,获得目的产物的高效表达和高产。发酵体积可从数升到数千升,发酵培养基采用普通的bl培养基配方,此外添加100mg/l的葡萄糖作为额外的碳源,此外发酵培养基中需添加1%浓度的amp。ph平衡在7.6左右;温度稳定25℃;溶氧稳定在28%;此外转速都以溶氧为标准进行调节,压力选在室压下进行发酵。发酵生产过程在12至18小时之间,具体通过在线hplc分析培养基营养成分和菌体重量以及sds-page电泳结果来进行控制,以获得最大发酵产量。培养基接入工程菌后,需培养5到8小时使吸光度在1.5以上,然后加入乳糖类似物iptg诱导表达6到10小时。
实验证明在10l的发酵罐中发酵菌体湿重都超过100g/l,最高可达180g/l左右;目的蛋白产量都在1g/l以上,通过调整发酵的时间和诱导时间,在50l发酵罐中可达8g/l以上。
实施例3
目的蛋白回收纯化
菌体用裂解液处理过夜,然在1.6kw/升发酵液的条件下超声5分钟,并于显微镜下观察细胞的破碎情况,当视野中少于2个细菌时停止超声,超声过后的液体在12000rp/min,4℃下离心30分钟取上清。
上清液用凝血酶于室温下酶切过夜,酶浓度为1g/kg蛋白,用sds-page电泳分析酶切效果,可以观察到酶切后的目的蛋白是不断增多的,8小时后基本切割完全,12小时后完全切割。凝血酶购自长春海王生物制药有限责任公司,酶切缓冲液的配制参照厂家说明书。凝血酶酶切后的溶液在12000rp/min,4℃下离心45分钟,收集上清液。
上清液用novagen公司生产的镍柱回收上清液中的目的蛋白,包括镍柱的重新激活、上样、杂蛋白的洗脱和目的蛋白的洗脱四个步骤。重新激活过程包括:用5m/l的盐酸胍清洗镍柱上的残留的蛋白,直到洗脱液中不再出现蛋白;然后用0.1mm/l的edta清洗镍柱,将柱子上的镍彻底洗脱至柱子颜色变成白色;再用ph8.0的磷酸缓冲溶液清洗残留的edta溶液。
待柱子清理完毕之后,重新用20ml/ml柱体积的0.1mm/l的硫酸镍溶液充分浸泡亲和柱,流速要求所有硫酸镍溶液的过柱时间大于1小时。然后用蒸馏水和ph8.0的磷酸缓冲液将多余的硫酸镍系脱下来。上样过程的流速控制为20ml样品/ml柱体积·h。
结果如图2所示,泳道1、marker;2、细菌裂解上清;3、镍柱10mm咪唑洗脱蛋白;4、镍柱500mm咪唑洗脱蛋白;5、葡聚糖凝胶回收蛋白。目的蛋白与镍柱有非常高的结合力,用sds-page电泳分析洗脱液,发现10mm的咪唑溶液洗脱下来的溶液中几乎没有目的条带,500mm的咪唑溶液洗脱下来的溶液中只含有目的条带。杂蛋白的洗脱液采用10mm的咪唑溶液,连续洗脱直到不再有蛋白被洗脱下来。目的蛋白的洗脱液用500mm的咪唑溶液,洗脱过程可以用蛋白检测仪检测,洗脱峰高的最大吸收值大概在0.8左右,收集此峰就是目的蛋白。
上清液用孔径大小为30000的葡聚糖凝胶层析柱回收各个样品,sds电泳分析蛋白样品分子量,回收25kd大小的蛋白样品柱溶液,样品纯度在90%以上,溶液用冻干机冻干成冻干粉。回收的蛋白冻干镍柱和层析柱的具体操作参照novagen公司附带的使用说明书。葡聚糖凝胶购自北京东凯元医药生物技术研究院,柱子的清洗和洗脱的具体操作参照厂家说明书,冻干机为普通的实验室冻干机。
实施例5
elisa活性检验
取样品的冻干粉若干配制成溶液,并稀释到1mg/ml。抗原用cd3抗原,一抗为样品,二抗用辣根过氧化酶标记的羊抗人抗体。elisa采用复孔形式,空白和非转化bl21细菌的裂解蛋白作为参照,样品采用梯度稀释法在10×、50×、250×、1250×共4个梯度检验其与cd3抗原的亲和力。
结果如图3和图4所示,scfv抗体与cd3抗原具有良好的亲和力,且能用于血细胞cd3阳性细胞的标记cd。
在本说明书的描述中,参考术语“一个实施例”、“示例”、“具体示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不一定指的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任何的一个或多个实施例或示例中以合适的方式结合。
以上显示和描述了本发明的基本原理、主要特征和本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内。
序列表
<110>东南大学
<120>一种白细胞抗原结合多肽
<160>2
<170>siposequencelisting1.0
<210>1
<211>112
<212>prt
<213>大肠杆菌噬菌体(enterobacteriaphagebl21)
<400>1
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcyslysthrserserglyglyalaserthr
202530
serglntyrglyasntrptyrglnglnthrproglylysalaprolys
354045
argtrpiletyralaglycysasnarglysglyproglyvalproser
505560
argpheserglyserglyserglythrasptyrthrphethrileser
65707580
serleuglnprogluaspilealathrtyrtyrcysglyleupheser
859095
servaliletrpphepheglyglnglythrlysleuglnilethrarg
100105110
<210>2
<211>127
<212>prt
<213>大肠杆菌噬菌体(enterobacteriaphagebl21)
<400>2
glnvalglnleuvalglnserglyglyglyvalvalglnproglyarg
151015
serleuargleusercyslysalaserglytyrthrphethrcysser
202530
tyrglymetvaltrpvalargglnalaproglylysglyleuglutrp
354045
ileglyglylysleuargserargserasnvalseralaserthrtyr
505560
glyaspthrpheargaspargphethrileserargaspasnserlys
65707580
asnthralapheleuglnmetaspserleuargprogluaspthrgly
859095
valtyrphecysalaarghisalaglnphealaglnserthralaser
100105110
serphealasertrpglyglnglythrprovalthrvalserser
115120125
- 还没有人留言评论。精彩留言会获得点赞!