一种装载减毒沙门氏菌的单核细胞或巨噬细胞及其制备方法和应用与流程
1.本发明涉及生物技术领域,特别涉及一种装载减毒沙门氏菌的单核细胞或巨噬细胞及其制备方法和应用。
背景技术:
2.自19世纪末威廉
·
科利医生( william coley)尝试使用热灭活的革兰氏阳性细菌(链球菌)和革兰氏阴性细菌(粘质沙门氏菌)对肿瘤患者进行治疗以来,越来越多的微生物被开发与改造用于进行肿瘤的治疗(coley wb,1991,clinical orthopaedics and related research,262(262):3-11)。这些微生物,往往被称作“溶瘤菌”,包括沙门氏菌,李斯特菌,大肠杆菌,因其自身的兼性厌氧特性以及肿瘤微环境特有特征,包括肿瘤内部乏氧环境,免疫抑制环境和大量坏死细胞释放出的养料,而能够在注射给药后实现于肿瘤部位的高效定殖(gurbatri cr,2020,science translational medicine,12(530);zhou s,2018,nature reviews cancer,18(12): 727-743;suh s,2019,advanced science,6(3): 1801309)。然而这类溶瘤菌因其自身毒性,往往也会导致机体不同程度的肝脾损伤。例如,vnp20009,一种鼠伤寒沙门氏菌的减毒株(以下简述为vnp),因其更低的毒性与临床前良好的抑瘤效果而受到广泛的关注(clairmont c,2000,journal of infectious diseases,181: 1996-2002)。尽管通过两种基因(puri和msbb)的缺失实现了vnp较原沙门氏菌毒性的大幅降低,但在临床前小鼠实验中,借助vnp20009静脉或腹腔注射的抑瘤治疗仍会因为菌株在正常脏器中的存在与积累而带来一定程度的毒副作用,如肝脏损伤,脾脏肿大,小鼠体重骤降。虽然使用瘤内注射能够减轻这一损伤的发生(chowdhry s,2019,nature medicine,25(7): 1057-1063;toso j f,2002,journal of clinical oncology,20(1): 142-152),但这无疑大大限制了微生物疗法的应用范围。在临床i期实验中,vnp展现出可喜的安全性,但在有效性上表现不佳(toso j. f,2002,journal of clinical oncology, 20(1):142-152)。因此,如何进一步提高vnp溶瘤菌在体内的肿瘤靶向性及其肿瘤抑制效果是极具挑战性的问题。
3.近些年来,多种类型的白细胞,包括巨噬细胞、中性粒细胞,t细胞,因其对肿瘤区域独特的归巢效应而被用作有效的肿瘤药物递送载体(xie z,2017,small,13(10) ;xue j,2017,nature nanotechnology,12(7): 692-700 ;huang b,2015,science translational medicine,7(291): 291ra94)。这类免疫细胞可以通过感知肿瘤相关趋化因子或细胞因子,如集落刺激因子1 (csf-1) 、肿瘤坏死因子(tnf)、趋化因子配体5(ccl5)的提示(salmon h,2019,nature reviews cancer,19(4): 215-227),在穿过多种屏障后到达患者的肿瘤区域。而目前借助细胞递药的主要挑战之一在于,受限于单个细胞的载药量以及所需较高的有效治疗剂量,往往需要注射大量的细胞进行治疗(小鼠上需要10^7-10^8级别)(xue j,2017,nature nanotechnology,12(7): 692-700;huang b,2015,science translational medicine,7(291): 291ra94),继而对应着复杂的操作手段与昂贵的治疗
费用。因此,如何改进以巨噬细胞为代表的细胞递药平台,实现细胞治疗的简便性、低剂量性、有效性,是研究人员不断探索的内容。
技术实现要素:
4.本发明目的是针对目前的肿瘤治疗困境,提供了一种使用巨噬细胞免疫细胞作为减毒沙门氏菌载体进行肿瘤靶向治疗的技术,以实现1)减少单独注射减毒沙门氏菌因脱靶所致的毒副作用;2)避免减毒沙门氏菌的过早暴露而被迅速清除。最终提高减毒沙门氏菌在肿瘤内的滴度,并通过巨噬细胞与溶瘤菌的联用,提高肿瘤抑制效果。
5.为了解决现有技术的问题, 本发明提供了如下技术方案:本发明的一种装载减毒沙门氏菌的单核细胞或巨噬细胞,其制备方法包括如下步骤:以巨噬细胞装载减毒沙门氏菌,所述的巨噬细胞为巨噬细胞系raw264.7或腹腔及血液来源的原代巨噬细胞pemf,所述的减毒沙门氏菌为减毒鼠伤寒沙门氏菌vnp20009及其衍生或基因改造菌株,肿瘤靶向性不发生改变,包括但不限于前述已经申请发明发明的各菌株(zl201410209851.7,zl201610946268.3,zl201610945015.4,zl201610945021.x,202010182038.0;acta pharmaceutica sinica b 2021,11(10):31653177;phop/phoq);菌株为不携带或携带表达治疗基因、示踪基因外源基因的表达质粒。
6.更进一步地,所述的减毒沙门氏菌为含有能表达治疗基因、示踪基因外源基因的表达质粒的减毒沙门氏菌及其衍生或基因改造菌株,所述的治疗基因为能够在减毒沙门氏菌表达的、具有治疗作用的蛋白质的编码基因,包括但不限于前述已经申请发明的细胞凋亡类抗肿瘤基因、血管生成抑制剂基因或免疫检查点阻断剂抗体基因(zl201110360656.0;202111278413.2;202210011915.7;202210070594.8;202210181926.x;202210182870.x;202210182455.4;202210182222.4;acta pharmaceutica sinica b 2021,11(10):31653177;theranostics 2017, 7(8):2250-2260;sci rep 2016, 21;6:34178;american journal of cancer research 2015, 5(2):792-801;current gene therapy 2014, 14(2):75-85;mol cell proteomics. 2011,10(6):m111.009399;cancer biology & therapy 2005,8(4):840-845);所述的示踪基因为能够在减毒沙门氏菌表达荧光蛋白rfp或荧光素酶示踪蛋白luxcdabe的基因,包括但不限于来源于绿色荧光蛋白gfp或红色荧光蛋白rfp及其衍生荧光蛋白的基因(seq id no.5),荧光素酶蛋白基因(seq id no.4)。
7.更进一步地,所述的减毒沙门氏菌中携带能在减毒沙门氏菌中表达治疗基因、示踪基因外源基因的表达质粒,质粒上有在减毒沙门氏菌中常用的启动子,包括但不限于j23100组成型启动子或者nirb启动子、adhe启动子、扩增sifb启动子环境影响的启动子;质粒上含有防质粒丢失元件at;所述的扩增防质粒丢失元件at的序列为seq id no.1所示的核苷酸序列;所述的扩增sifb启动子psifb的序列为seq id no.2所示的核苷酸序列;所述的j23100组成型启动子的序列为seq id no.3所示的核苷酸序列;所述的psifb 上游引物的序列为seq id no.6所示的核苷酸序列;所述的psifb下游引物的序列为seq id no.7所示的核苷酸序列。
8.将经25-500 ng/ml lps诱导处理4-48小时的raw264.7巨噬细胞系,或通过5%淀粉肉汤腹腔注射刺激2-4天联合贴壁培养法纯化获得的原代单核细胞或巨噬细胞分别与减毒沙门氏菌以1:5-1:100比例分别共培养30-150分钟,然后用 50-100
ꢀµ
g/ml 庆大霉素处理
细胞 30-60分钟以杀死细胞外细菌。使用稀释涂板计算巨噬细胞吞噬后活vnp的数量,以记录不同处理条件下胞内的有效装载菌株数目与细胞活性,并用于最终共培养时间的确定以及后续细胞实际给药剂量的计算。
9.本发明的一种装载减毒沙门氏菌的单核细胞或巨噬细胞的制备方法,包括如下步骤:在巨噬细胞和减毒沙门氏菌vnp20009或其衍生及突变菌株的条件下,基于特定质粒的电转构建可稳定组成型表达红色荧光rfp(seq id no.5所示的核苷酸序列)的vnp20009,记做vnp-rfp,或表达荧光素酶luxcdabe(seq id no.4所示的核苷酸序列)的vnp20009菌vnp-luxcdabe,质粒中使用了组成型强启动子j23100与质粒防丢失原件at(seq id no.1所示的核苷酸序列)。
10.进一步地,未经处理的raw264.7为m0型巨噬细胞,以25-500 ng/ml lps诱导4-48小时后, raw264.7为m1型巨噬细胞,或通过5%淀粉肉汤腹腔注射刺激2-4天联合贴壁培养法纯化获得的原代单核细胞或巨噬细胞。将经lps诱导处理的raw264.7或原代巨噬细胞与表达示踪蛋白或治疗蛋白的减毒沙门氏菌以1:5-1:100比例分别共培养30、60、90、120、150分钟,借助50-100
ꢀµ
g/ml庆大霉素处理细胞 30-60 分钟以杀死细胞外游离或粘附的减毒沙门氏菌。使用稀释涂板计算巨噬细胞吞噬后活vnp的数量,以记录不同处理条件下胞内的有效装载菌株数目与细胞活性,并用于最终共培养时间的确定以及后续细胞实际给药剂量的计算。
11.具体地,荧光定量检测raw264.7吞噬表达示踪蛋白或治疗蛋白的减毒沙门氏菌的数量与共培养时间的相关性;通过梯度稀释法,获得表达示踪蛋白或转载自治疗蛋白的减毒沙门氏菌数量与对应荧光强度间的线性关系,用来有效间接计算巨噬细胞胞内的表达示踪蛋白或转载自治疗蛋白的减毒沙门氏菌数目;酶标仪检测示踪蛋白荧光强度(550 nm,585 nm),结合细菌数目-荧光线性关系算得平均每100个巨噬细胞所装载的总细菌数。更进一步地,一种评价和示踪装载减毒沙门氏菌的巨噬细胞中减毒沙门氏菌的装载效率及巨噬细胞活性的方法,将装载减毒沙门氏菌的单核细胞或巨噬细胞转至pbs配置的0.3% tritonx-100中静置10-15 min,以穿孔巨噬细胞而释放出胞内的减毒沙门氏菌;梯度稀释后涂带有卡纳霉素抗性的lb平板,分析检测单核细胞或巨噬细胞装载的活减毒沙门氏菌数及其装载效率与共培养时间的相关性;利用台酚蓝分析检测巨噬细胞与减毒沙门氏菌共培养30、60、90、120、150分钟后,细胞的活性状态;为了进一步验证巨噬细胞有效装载了减毒沙门氏菌,在获得装载有减毒沙门氏菌的巨噬细胞后,使用4%多聚甲醛对细胞进行固定,室温,避光,静置30 min,pbs清洗23次,借助鬼笔环肽与dapi按照厂商说明书分别对巨噬细胞骨架与细胞核染色,室温,避光,静置30 min,pbs清洗23次,使用正置荧光显微镜观察并拍摄。
12.本发明的一种评价和示踪装载减毒沙门氏菌的单核细胞或巨噬细胞的细菌装载效率和组织分布及水平的方法,单核细胞或巨噬细胞中装载能够表达或定量检测的荧光蛋白或荧光素酶示踪蛋白,评价和示踪装载减毒沙门氏菌的单核细胞或巨噬细胞的细菌装载效率和组织分布及水平。
13.进一步地,包括dir近红外染料在内的常用光学染料标记单核细胞或巨噬细胞,定量检测光学染料,评价和示踪装载减毒沙门氏菌的单核细胞或巨噬细胞的组织分布及水平。
14.进一步地,未经处理的m0型巨噬细胞raw264.7,以25-500 ng/ml lps诱导4-48小时后,raw264.7转变为m1型巨噬细胞;或通过5%淀粉肉汤腹腔注射刺激2-4天联合贴壁培养法纯化获得的原代单核细胞或巨噬细胞。将经lps诱导处理的raw264.7或原代单核细胞或巨噬细胞与表达示踪蛋白或治疗蛋白的减毒沙门氏菌以1:5-1:100比例分别共培养30-150分钟,借助50-100
ꢀµ
g/ml庆大霉素处理细胞30-60 分钟以杀死胞外游离或粘附的减毒沙门氏菌后,荧光定量检测raw264.7吞噬表达示踪蛋白或治疗蛋白的减毒沙门氏菌的数量与共培养时间的相关性;通过梯度稀释法,获得表达示踪蛋白或转载自治疗蛋白的减毒沙门氏菌数量与对应荧光强度间的线性关系,用来有效间接计算巨噬细胞胞内的表达示踪蛋白或转载自治疗蛋白的减毒沙门氏菌数目;酶标仪检测示踪蛋白荧光强度(550 nm,585 nm),结合细菌数目-荧光线性关系算得平均每100个巨噬细胞所装载的总细菌数。
15.将装载减毒沙门氏菌的单核细胞或巨噬细胞转至pbs配置的0.3% tritonx-100中静置10-15 min,以穿孔巨噬细胞而释放出胞内的减毒沙门氏菌;梯度稀释后涂带有卡纳霉素抗性的lb平板,分析检测单核细胞或巨噬细胞装载的活减毒沙门氏菌数及其装载效率与共培养时间的相关性;利用台酚蓝分析检测巨噬细胞与减毒沙门氏菌共培养30、60、90、120、150分钟后,细胞的活性状态;为了进一步验证巨噬细胞有效装载了减毒沙门氏菌,在获得装载有减毒沙门氏菌的巨噬细胞后,使用4%多聚甲醛对细胞进行固定,室温,避光,静置30 min,pbs清洗23次,借助鬼笔环肽与dapi按照厂商说明书分别对巨噬细胞骨架与细胞核染色,室温,避光,静置30 min,pbs清洗23次,使用正置荧光显微镜观察并拍摄。
16.本发明所述的装载减毒沙门氏菌的单核细胞或巨噬细胞在制备抗肿瘤药物中的应用。
17.进一步地,所述应用包括装载减毒沙门氏菌的单核细胞或巨噬细胞单独用于制备抗肿瘤药物,或与现有的抗肿瘤药物组成组合物,或与现有化学药物治疗、中药治疗、生物治疗、物理治疗方法在抗肿瘤治疗中联合运用。
18.提高减毒沙门氏菌在肿瘤内的滴度、降低减毒沙门氏菌对正常组织器官的毒副作用,同时,减毒沙门氏菌的装载提高了巨噬细胞的趋化能力、吞噬能力,从而提高了肿瘤治疗效果;更进一步,减毒沙门氏菌表达治疗蛋白或示踪蛋白能够进一步提高装载减毒沙门氏菌的单核细胞或巨噬细胞的抗肿瘤效果或示踪装载减毒沙门氏菌的单核细胞或巨噬细胞的组织分布及水平。
19.有益效果:本发明可同时解决这两类问题,满足了本领域对一种低毒、高效且经济的组合物来治疗实体肿瘤的需求。本发明的优势是,通过获得装载有减毒沙门氏菌的单核细胞或巨噬细胞,在经静脉注射给药荷瘤小鼠后,单核细胞或巨噬细胞因其天然的肿瘤靶向特性与高效的渗透能力,携带减毒沙门氏菌至肿瘤内部区域,避免了减毒沙门氏菌早期因在机体循环系统中的长时间暴露而被迅速清除,同时也减少了减毒沙门氏菌在正常脏器中的积累,最终实现在肿瘤区域的高效富集。
20.与现有技术相比,本发明具有如下优点:(1)虽然对这类减毒沙门氏菌进行基于肿瘤微环境特征的改造,如调控菌体乏氧生长、靶向肿瘤特异性标志物,也能够有效提高菌体在小鼠体内对肿瘤的靶向性,但这些瘤内靶向性的升高都是以菌体能够到达肿瘤区域作为前提条件。
21.以vnp20009为例,i期临床结果表明,vnp20009经静脉注射进入肿瘤患者体内后,
多数患者肿瘤区域内并不存在vnp20009,且亦不存在菌体定殖的痕迹。但通过瘤内注射方式行vnp20009治疗,却能够在患者肿瘤区域获得高滴度的vnp20009,且未减毒的沙门氏菌也可有效侵染癌症患者的肿瘤区域,并实现肿瘤的有效抑制。这说明无论是沙门氏菌,还是减毒后的vnp20009,均具备在肿瘤内定殖的能力。但在肿瘤患者中经静脉给药的vnp20009却无法到达肿瘤,这可能是由于vnp20009作为减毒的沙门氏菌,虽然避免了沙门氏菌的强毒性,然而也因此更易被人体的免疫系统快速清除。可见实现vnp20009在人体肿瘤中从无到有的可达性,相较于小鼠/犬类肿瘤中从低到高的靶向性,是更急迫于解决的问题。此外临床前研究表明基于减毒沙门氏菌的抗肿瘤疗法虽然效果显著,但仍存在不可忽视的毒副作用,如何避免这些毒副作用是急需解决的问题。
22.(2)在多数情况下,体内存在强烈的先天免疫反应,入侵的微生物会被巨噬细胞和中性粒细胞抗原呈递细胞 (apc) 迅速清除。 然而,沙门氏菌可以产生一系列自我保护措施,包括增加细菌抗菌肽耐药基因表达和抑制细胞内溶酶体蛋白表达,以在巨噬细胞介导的吞噬作用后存活。然后,由于细菌的持续细胞内刺激与增殖,引发了巨噬细胞的膨胀和破裂,最终会导致细菌的延迟释放。因此事先将vnp20009溶瘤菌藏匿在巨噬细胞中以避免菌体在人体内的过早暴露,并借助巨噬细胞运送至肿瘤区域后再释放,可能是一种实现溶瘤菌在人体肿瘤中富集的有效策略,也暗示了本发明所提出的这一新型平台在临床上的应用潜力。
23.(3)目前借助细胞递药的主要挑战之一在于,受限于单个细胞的载药量以及所需较高的有效治疗剂量,往往需要注射大量的细胞进行治疗(小鼠上需要10
7-108个细胞/只),继而对应着复杂的操作手段与昂贵的治疗费用。在这里所提供的一种新型治疗策略,基于免疫细胞对溶瘤菌的高效装载与溶瘤菌的自我增殖能力,大大降低了所需的细胞注射剂量。该方法仅需105的装载细胞便可有效治疗小鼠肿瘤,借助fda指导指南,换算得到人体所需注射量仅为2.4
×
107细胞(=1
×
105×
(3/37)
×
(60/0.02))。这种新型细胞疗法所需的细胞量仅为传统细胞疗法的1/100-1/1000,且实际上只要有少量的装载细胞到达肿瘤区域并释放出减毒沙门氏菌后,凭借菌体的不断增殖作用,即可获得有效的治疗效果。
24.(4)本专利发明的装载减毒沙门氏菌的单核细胞或巨噬细胞既能够有效装载减毒沙门氏菌,又能有效释放减毒沙门氏菌。减毒沙门氏菌能够增强单核细胞或巨噬细胞的趋化能力、吞噬能力和ros、no水平。肿瘤细胞能够加速溶瘤菌从单核细胞或巨噬细胞的释放。本发明的应用效果未显著减轻溶瘤菌治疗诱导的肿瘤模型体重减轻、脾脏肿大和肝脏炎症病变,有效避免溶瘤菌治疗的毒副作用,降低细菌在正常组织器官中的分布和滴度,具有更高的肿瘤靶向性,有效提高了肿瘤治疗效果。达到了单核细胞或巨噬细胞和溶瘤菌混合治疗所无法达到的疗效和对毒副作用的改善。
附图说明
25.附图缩写说明:vnp:减毒鼠伤害沙门氏菌vnp20009;rfp:红色荧光蛋白;vnp-rfp:vnp携带rfp基因质粒;raw264.7(vnp):装载有vnp的巨噬细胞系raw264.7;pemφ(vnp):装载有vnp的小鼠原代腹腔巨噬细胞pemφ;mφ(vnp):raw264.7(vnp)与pemφ(vnp)两种细胞的统称;vnp-luxcdabe:vnp携带luxcdabe基因质粒。
26.图1为本发明的巨噬细胞raw264.7对vnp的装载情况图;图1a为本发明的荧光显微镜拍照指示巨噬细胞对vnp的装载。1、未装载vnp巨噬细胞拍摄;2、共培养60分钟后,装载vnp巨噬细胞拍摄。
27.图1b为本发明的巨噬细胞raw264.7对vnp总装载以及细胞活性与共培养时间变化关系。1、(左)平均每100个巨噬细胞内总vnp数变化;2. (右)巨噬细胞细胞活性变化(n = 5)。
28.图1c为本发明的巨噬细胞raw264.7对vnp有效装载与共培养时间变化关系。1、(左)平均每100个巨噬细胞内活性vnp总数变化;2. (右)巨噬细胞内活性vnp总数与细胞内装载总vnp数比值变化。(n=5,*p《0.05,**p《0.01,****p《0.0001)。
29.图2为本发明的原代腹腔巨噬细胞pemφ对vnp的装载情况图;图2a为本发明的荧光显微镜拍照指示巨噬细胞对vnp的装载。1、未装载vnp巨噬细胞拍摄;2、共培养60分钟后,装载vnp巨噬细胞拍摄。
30.图2b为本发明的巨噬细胞pemφ对vnp总装载以及细胞活性与共培养时间变化关系。1、(左)平均每100个巨噬细胞内总vnp数变化;2. (右)巨噬细胞细胞活性变化(n = 5)。
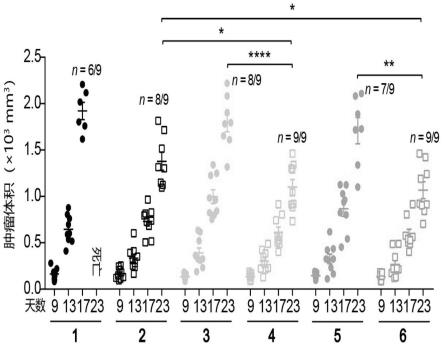
31.图2c为本发明的巨噬细胞pemφ对vnp有效装载与共培养时间变化关系。1、(左)平均每100个巨噬细胞内活性vnp总数变化;2. (右)巨噬细胞内活性vnp总数与细胞内装载总vnp数比值变化(n=5,ns表示无显著差异,*p《0.05,***p《0.001,****p《0.0001)。
32.图3为本发明的装载vnp巨噬细胞raw264.7(vnp)和pemφ(vnp)对胞内vnp的释放情况图。
33.图3a为本发明的raw264.7(vnp-rfp)和pemφ(vnp)对胞内vnp释放实验设计示意图,使用3.0微米transwell板培养。1、raw264.7或pemφ与肿瘤细胞(b16f10)在下室直接接触共培养,raw264.7(vnp-rfp)或pemφ(vnp-rfp)在上室培养,记做“raw264.7(vnp)上室”或“pemφ(vnp) 上室”组;2. raw264.7(vnp-rfp) 或pemφ(vnp-rfp)与肿瘤细胞(b16f10)在下室直接接触共培养,raw264.7或pemφ在上室培养,记做“raw264.7上室
”ꢀ
或“pemφ上室”组; 12小时后通过荧光定量检测培液中vnp-rfp数量。
34.图3b为本发明的检测并比较不同组别上清vnp-rfp数量。1、“raw264.7(vnp)上室”组;2.
ꢀ“
raw264.7上室”组;3、
ꢀ“
pemφ(vnp) 上室”组;4、“pemφ上室”组。
35.图3c为本发明的将制备的raw264.7(vnp)和pemφ(vnp)细胞分别在用稀盐酸调节的不同ph值(7.4和6.7) 的培养基中培养,释放细胞内vnp,不同时间收集培养基上清进行涂布平板分析细菌滴度。
36.图3d为本发明的分析了从 raw264.7(vnp) 和pemφ(vnp)细胞释放的 vnp 菌株数量与 (c) 中的培养时间之间的相关性。1、ph=6.7;2、ph=7.4;a、raw264.7(vnp)组;b、pemφ(vnp)组。(n=4,ns表示无显著差异,****p《0.0001);图4为本发明的装载vnp巨噬细胞raw264.7(vnp)和pemφ(vnp)胞内vnp释放过程检测图。
37.图4a为本发明的装载vnp巨噬细胞raw264.7(vnp)和pemφ(vnp)胞内vnp释放过程检测实验设计示意图。raw264.7(vnp-psifb-rfp)或pemφ(vnp-psifb-rfp)在添加了50 μg/ml庆大霉素的培养基中孵育。在指定时间点通过荧光显微镜计数释放至细胞外的vnp数量。
38.图4b为本发明的荧光显微镜计数不同时间点上清中平均每100个细胞视野旁vnp数量。1、raw264.7(vnp-psifb-rfp);2、pemφ(vnp-psifb-rfp)。(n=4,ns表示无显著差异,*p《0.05)图5为本发明的由raw264.7(vnp)和pemφ(vnp)释放的vnp生长能力、细胞侵染和杀伤能力检测图。
39.图5a为本发明的经不同处理后的vnp在lb培养基中生长曲线。1、未处理的vnp;2、由raw264.7(vnp)释放的vnp;3、由pemφ(vnp)释放的vnp (n = 4)。
40.图5b为本发明的通过平板计数法检测经不同处理后的vnp侵染b16f10细胞4小时后胞内活菌数量。1、未处理的vnp;2、由raw264.7(vnp)释放的vnp;3、由pemφ(vnp)释放的vnp (n = 5)。
41.图5c为本发明的通过流式细胞术检测检测经不同处理后的vnp侵染b16f10细胞4小时后b16f10细胞凋亡水平。1、未处理的vnp;2、由raw264.7(vnp)释放的vnp;3、由pemφ(vnp)释放的vnp(n=3,ns表示无显著差异,****p《0.0001)。
42.图6为本发明的装载vnp巨噬细胞raw264.7(vnp) 和pemφ(vnp)吞噬能力检测图;图6a为本发明的空载巨噬细胞或细菌装载巨噬细胞分别与荧光微球(pe)以1:10比例共培养4小时后,流式检测细胞为荧光微球的吞噬情况,红色圈门部分为显著吞噬微球的巨噬细胞群;a、raw264.7;b、raw264.7(vnp);c、pemφ;d、pemφ(vnp)。
43.图6b为本发明的定量分析比较具有强吞噬能力巨噬细胞的百分比变化。1、raw264.7;2、raw264.7(vnp);3、pemφ;4、pemφ(vnp)。(n=5,ns表示无显著差异,*p《0.05, ****p《0.0001)。
44.图7为本发明的装载vnp巨噬细胞raw264.7(vnp)和pemφ(vnp)趋化能力检测图。
45.图7a为本发明的在8.0微米transwell板下室添加肿瘤细胞,9-12h后在上室添加空载巨噬细胞或细菌装载巨噬细胞,静置培养16h后显微拍摄上室下层巨噬细胞穿孔趋化情况。1、下室不添加细胞,上室添加raw264.7;2、下室添加b16f10细胞,上室添加raw264.7;3、下室不添加细胞,上室添加raw264.7(vnp); 4、下室添加b16f10细胞,上室添加raw264.7(vnp);5、下室不添加细胞,上室添加pemφ;6、下室添加b16f10细胞,上室添加pemφ;7、下室不添加细胞,上室添加pemφ(vnp); 8、下室添加b16f10细胞,上室添加pemφ(vnp)。
46.图7b为本发明的随机选取显微拍摄视野计数并统计比较细胞趋化情况。1、上室添加raw264.7;2. 上室添加raw264.7(vnp);3、上室添加pemφ;4、上室添加pemφ(vnp);a、下室不添加细胞;b、下室添加b16f10细胞(n=5,ns表示无显著差异,*p《0.05,****p《0.0001)。
47.图8为本发明的装载vnp巨噬细胞raw264.7(vnp) 和pemφ(vnp)对肿瘤细胞间接杀伤能力检测图;图8a为本发明的 raw264.7(vnp)和pemφ(vnp)对肿瘤细胞间接杀伤能力检测实验设计示意图,使用0.4微米transwell板培养。1、上室不添加细胞,记做“空白对照组”;2、上室添加l929细胞,记做“正常对照组”;3.上室添加raw264.7或pemφ细胞,记做“raw264.7组”或“pemφ组”;4.上室添加raw264.7(vnp)或pemφ(vnp),记做“raw264.7(vnp)组”或“pemφ(vnp)组”;培养12小时后检测下室细胞状况。
48.图8b为本发明的利用cck8检测法检测比较下室肿瘤细胞增殖水平。1、空白对照组;2、正常对照组;3、raw264.7组;4、raw264.7(vnp)组;5、pemφ组;6. pemφ(vnp)组。(ns
表示无显著差异,*p《0.05,**p《0.01,****p《0.0001)。
49.图8c为本发明的利用ros检测试剂盒检测细胞内ros水平变化。1. raw264.7;2. raw264.7(vnp);3、pemφ;4. pemφ(vnp) (n = 5)。图8d为本发明的利用no检测试剂盒检测细胞no产生水平变化。1. raw264.7;2. raw264.7(vnp); 3、pemφ;4. pemφ(vnp)。(n=5,*p《0.05,**p《0.01,****p《0.0001)图9为本发明的装载vnp巨噬细胞raw264.7(vnp)与pemφ(vnp)体内减毒效果评估与肿瘤靶向性检测图;图9a为本发明的实验流程操作示意图,将制备好的vnp或raw264.7(vnp)或pemφ(vnp)经尾静脉注射给b16f10荷瘤小鼠,以pbs作为阴性对照,并在注射治疗后3小时、1天、3天、6天、12天分别处死部分小鼠进行检测;1、pbs;2、vnp;3、raw264.7(vnp);4、pemφ(vnp);图9b为本发明的治疗后1天小鼠体重变化比较。1、pbs;2、vnp;3、raw264.7(vnp);4、pemφ(vnp)。(n = 16);图9c为本发明的治疗后1天肝脏损伤比较。1、pbs;2、vnp;3、raw264.7(vnp);4、pemφ(vnp);黑色箭头为肝脏发生显著性损伤处;标尺为5毫米;图9d为本发明的治疗后1天肝脏显著性损伤处数目统计比较。1、pbs;2、vnp;3、raw264.7(vnp);4、pemφ(vnp)(n = 5);图9e为本发明的治疗后1天脾脏肿大情况比较。1、pbs;2、vnp;3、raw264.7(vnp);4、pemφ(vnp);标尺为5毫米;图9f为本发明的治疗后1天脾脏重量比较。1、pbs;2、vnp;3、raw264.7(vnp);4、pemφ(vnp);(**p《0.01,***p《0.001,****p《0.0001)(n = 5)。
50.图10为本发明的装载vnp巨噬细胞raw264.7(vnp)与pemφ(vnp)治疗b16f10荷瘤小鼠时副作用肝脏损伤程度。
51.图10a为本发明的治疗后1天肝脏h&e染色切片。1、pbs;2、vnp;3、raw264.7(vnp);4、pemφ(vnp);白色箭头处为明显病变区域;标尺为100μm。
52.图10b为本发明的治疗后1天血清alt(丙氨酸氨基转移酶)和ast(天冬氨酸氨基转移酶)浓度比较。1、pbs;2、vnp;3、raw264.7(vnp);4、pemφ(vnp)。(n=5,**p《0.01)。
53.图11为本发明的装载vnp巨噬细胞raw264.7(vnp)与pemφ(vnp)体内脏器菌株滴度比较图(时间节点包括给药后3小时,1天,3天,6天,12天);11a为本发明的装载vnp巨噬细胞raw264.7(vnp)与pemφ(vnp)治疗b16f10荷瘤小鼠过程中vnp生物分布情况。1、vnp;2、raw264.7(vnp);3、pemφ(vnp);a、肿瘤;b、肝脏;c、脾脏;d、肺;e、肾脏;f、心脏。(n = 4或5)11b为本发明的治疗后第6天肿瘤相较肝脏与脾脏内vnp滴度比值比较。1、vnp;2、raw264.7(vnp);3、pemφ(vnp);a、肿瘤/肝脏;b、肿瘤/脾脏。(n=5,ns表示无显著差异,*p《0.05,**p《0.01,***p《0.001,****p《0.0001)图12为本发明的装载vnp巨噬细胞raw264.7(vnp)与pemφ(vnp)治疗b16f10荷瘤小鼠1天后各脏器h&e染色切片图。1、pbs;2、vnp;3、raw264.7(vnp);4、pemφ(vnp);标尺为40 μm。
54.图13为本发明的装载vnp巨噬细胞raw264.7(vnp)与pemφ(vnp)治疗b16f10荷瘤小鼠效果比较图;1、pbs;2、vnp;3、raw264.7;4、raw264.7(vnp);5、pemφ;6、pemφ(vnp)。(n=9,*p《0.05,**p《0.01,****p《0.0001)图14为本发明的装载vnp-luxcdabe的dir标记的巨噬细胞pemφ(vnp-luxcdabe)肿瘤靶向性活体成像分析图。图14a为本发明的装载vnp-luxcdabe的dir标记的巨噬细胞
pemφ(vnp-luxcdabe)治疗b16f10荷瘤小鼠过程中指定时间点活体成像分析。1、vnp-luxcdabe近红外荧光与明场叠加成像;2上、pemφ(vnp-luxcdabe)近红外荧光与明场叠加成像;2下、pemφ(vnp-luxcdabe)生物光与明场叠加成像;3、pemφ生物光与明场叠加成像;白色圆圈指示肿瘤部位。图14b为本发明的不同时间点肿瘤部位基于近红外荧光强度分析巨噬细胞密度。1、pemφ;2、pemφ(vnp-luxcdabe)。(n = 3或4);图14c为本发明的不同时间点肿瘤部位基于生物光强度分析vnp菌株密度。1、vnp-luxcdabe;2、pemφ(vnp-luxcdabe)。(n = 3或4);图14d为本发明的治疗后36小时肿瘤及各脏器近红外荧光与明场叠加成像。1、pemφ;2、pemφ(vnp-luxcdabe);图14e为本发明的治疗后36小时肿瘤及各脏器近红外荧光强度比例。1、pemφ;2、pemφ(vnp-luxcdabe)。(n=4,ns表示无显著差异,*p《0.05,***p《0.001)。
55.图15为本发明的装载vnp巨噬细胞pemφ(vnp)肿瘤靶向性机制分析。图15a为本发明的荷瘤小鼠与无瘤小鼠血清ccl2趋化因子浓度比较。1、无瘤小鼠;2、b16f10荷瘤小鼠。(n = 4);图15b为本发明的装载vnp巨噬细胞pemφ(vnp)治疗b16f10荷瘤小鼠血清及肿瘤ccl2趋化因子浓度比较。1、pbs;2、pemφ;3、pemφ(vnp);a、血清;b肿瘤裂解液。(n=4或5,*p《0.05,**p《0.01,***p《0.001)。
56.图16为本发明的装载vnp巨噬细胞pemφ(vnp)减毒机制分析图;图16a为本发明的实验流程操作示意图,通过尾静脉给予装载vnp巨噬细胞pemφ(vnp)和 pemφ细胞 和 vnp菌株的简单混合物pemφ+vnp,并评估它们的毒性和肿瘤靶向性。以给与体积pbs或者单一vnp为对照(n = 4或5);图16b为本发明的治疗后1天肝脏损伤比较。1、pbs;2、vnp;3、pemφ+vnp;4、pemφ(vnp);黑色箭头为肝脏发生显著性损伤处;标尺为10毫米;图16c为本发明的治疗后1天肝脏显著性损伤处数目统计比较。1、pbs;2、vnp;3、pemφ+vnp;4、pemφ(vnp);图16d为本发明的治疗后1天脾脏肿大情况比较。1、pbs;2、vnp;3、pemφ+vnp;4、pemφ(vnp);标尺为10毫米;图16e为本发明的治疗后1天脾脏重量比较。1、pbs;2、vnp;3、pemφ+vnp;4、pemφ(vnp);图16f为本发明的治疗后第6天,脾脏,肝脏和肿瘤内vnp滴度比较。1、vnp;2、pemφ+vnp;3、pemφ(vnp);a、脾脏;b、肝脏;c、肿瘤;图16g为本发明的治疗后第6天,肿瘤相较肝脏与脾脏内vnp滴度比值比较。1、vnp;2、pemφ+vnp;3、pemφ(vnp);a、肿瘤/脾脏;b、肿瘤/肝脏。(ns表示无显著差异,*p《0.05,**p《0.01,***p《0.001)。
具体实施方式
57.下面结合附图和具体实施方式对本发明进行详细说明。以下实施例用于说明本发明,但是不用来限制本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。
58.实施例1装载减毒沙门氏菌巨噬细胞的制备及优化本发明中的减毒沙门氏菌为减毒鼠伤寒沙门氏菌vnp20009及其衍生或基因改造菌株,肿瘤靶向性不发生改变,包括但不限于前述已经申请发明发明的各菌株(zl201410209851.7,zl201610946268.3,zl201610945015.4,zl201610945021.x,202010182038.0;acta pharmaceutica sinica b 2021,11(10):31653177;phop/phoq),以下仅以减毒鼠伤寒沙门氏菌vnp20009为例。
59.含at元件的rfp表达菌的构建携带表达治疗基因、示踪基因外源基因的质粒经过电转化到减毒鼠伤寒沙门氏菌vnp20009构建可表达表达治疗蛋白、示踪蛋白的基因的减毒沙门氏菌,所用的启动子为减毒沙门氏菌常用的启动子,包括但不限于j23100组成型启动子或者nirb启动子、adhe启动子、扩增sifb启动子环境影响的启动子,质粒上含有防质粒丢失元件at。例如,构建表达红色荧光rfp的vnp20009菌(vnp-rfp),为了使得实验结果更易观察与稳定,质粒中使用了组成型强启动子j23100与质粒防丢失原件at。
60.以经100 ng/ml lps诱导处理12h的raw264.7与vnp-rfp(带有rfp荧光表达质粒的vnp菌株)以1:10比例分别共培养不同时间,然后用 50
ꢀµ
g/ml 庆大霉素处理细胞 60 分钟以杀死细胞外细菌作为解说例。我们发现 raw264.7 细胞可以成功加载 vnp-rfp(图1a)。基于荧光强度与细菌数量之间的线性关系的荧光定量检测显示,raw264.7 细胞吞噬的 vnp-rfp 总量与共培养时间呈正相关(图1b,左)。此外,使用稀释涂板计算巨噬细胞吞噬后活vnp-rfp的数量,结果表明raw264.7细胞中加载的活vnp-rfp数量也与共培养时间呈正相关(图1c,左) ,在此期间加载效率(raw264.7 中的活细菌数/总细菌数)在 60 分钟(220
ꢀ±ꢀ
13 cfu(平均值
ꢀ±ꢀ
sem)/100 个细胞)达到峰值(图 1c,右),且巨噬细胞显示出可接受的细胞活力(高于 90%)(图1b,右)。故此处理培养条件下推荐选择moi=10,共培养60min后,获得的raw264.7(vnp)用于后续研究,而胞内的活性细菌数也将视作注射时的有效参考。
61.(1) 巨噬细胞系装载vnp条件的摸索:以未经处理的raw264.7为m0型巨噬细胞,以25-500 ng/ml lps诱导4-48小时后的raw264.7为m1型巨噬细胞。将经lps诱导处理的raw264.7或通过5%淀粉肉汤腹腔注射刺激2-4天联合贴壁培养法纯化获得的原代单核细胞或巨噬细胞pemφ与vnp-rfp以1:5-1:100比例分别共培养30、60、90、120、150分钟,借助50-100
ꢀµ
g/ml 庆大霉素处理细胞 30-60分钟杀死胞外游离或粘附的vnp-rfp后,荧光定量检测raw264.7吞噬vnp-rfp的量与共培养时间的相关性。通过梯度稀释法,获得菌株vnp-rfp菌体数与对应荧光强度间的线性关系,用来有效间接计算巨噬细胞胞内的vnp-rfp数目。酶标仪检测rfp荧光强度(550 nm,585 nm),结合菌株数目-荧光线性关系算得平均每100个巨噬细胞所装载的总细菌数。随后,将raw264.7(vnp-rfp)转至pbs配置的0.3% tritonx-100中静置10-15 min,以穿孔巨噬细胞而释放出胞内的vnp菌株。梯度稀释后涂带有卡纳霉素抗性的lb平板,分析检测raw264.7装载的活vnp-rfp数及其装载效率与共培养时间的相关性。利用台酚蓝分析检测巨噬细胞与vnp共培养30、60、90、120、150分钟后,细胞的活性状态。为了进一步验证巨噬细胞有效装载了vnp,在获得装载有vnp的巨噬细胞后,使用4%多聚甲醛对细胞进行固定(室温,避光,静置30 min),pbs清洗23次,借助鬼笔环肽与dapi按照厂商说明书分别对巨噬细胞骨架与细胞核染色(室温,避光,静置30 min),pbs清洗23次,使用正置荧光显微镜观察并拍摄。
62.(2)原代巨噬细胞(pemφ)装载vnp条件的摸索:配制5%淀粉肉汤(1.8%营养肉汤+5%可溶性淀粉+重蒸水),加热搅拌待淀粉完全溶解后高压蒸汽灭菌(115
°
,30分钟),分装于1.5 ml ep管中保存于4
°
,使用前加热溶解即可。取7-10周龄雌性/雄性c57小鼠腹腔注射1 ml淀粉肉汤,23 d后处死并提取腹腔巨噬细胞,采用贴壁法获取高纯度原代腹腔巨噬细胞,利用利多卡因于4
°
下静置5-8 min消化以获得细胞悬液后用于后续实验。后续实验方法同i)中所述。后述mφ即为raw264.7(m1)与pemφ
两种巨噬细胞的代表统称。
63.本发明同时确定了小鼠血液或腹腔原代巨噬细胞pemf对vnp-rfp的装载状况。本发明首先通过淀粉肉汤刺激制备高纯度血液或腹腔巨噬细胞,然后用贴壁培养物纯化,确保每次获得的巨噬细胞纯度高于98%。类似的,以pemf与vnp-rfp以1:10比例分别共培养不同时间,然后用50
ꢀµ
g/ml庆大霉素处理细胞60分钟以杀死细胞外细菌作为解说例。pemf同样可有效装载vnp-rfp菌株(图 2a),但与raw264.7细胞不同,pemf细胞的有效vnp负载持续随时间降低(图 2c,右)。pemf细胞中装载的活vnp菌株的数量在60分钟时数量充足(510
ꢀ±ꢀ
10 cfu(平均值
ꢀ±ꢀ
sem)/100个细胞)(图 2c,左),此时对应的 pemf(vnp)细胞活力仍均高于 85%,满足后续的实验需求(图 2b)。故此处理培养条件下推荐选择moi=10,共培养60 min后,获得的pemf(vnp)用于后续研究,而胞内的活性细菌数也将视作注射时的有效参考。
64.实施例2装载减毒沙门氏菌巨噬细胞的特征检测 (1)胞内菌株释放:体外研究确认mφ(vnp)(包括raw264.7(vnp)与pemφ(vnp))对装载vnp的释放:按照前述方法获得mφ(vnp)后,利用transwell板实现mφ(vnp)对肿瘤细胞的直接/间接接触,即在3.0 mm transwell板(该大小孔径细胞无法穿过,但细菌仍可有效穿过)的下室铺上肿瘤细胞, mφ(vnp-rfp)
up
组的上室添加mφ(vnp-rfp)细胞,下室添加mφ细胞。相对的,mφ(vnp-rfp)
down
组的上室添加mφ细胞,下室添加mφ(vnp-rfp)细胞。放置培养箱中静置培养12 h后,收集上清并进行梯度稀释后涂卡纳抗性的lb平板,以进行菌落计数统计。体外研究确认经mφ(vnp)释放的vnp生物活性变化:使用bioscreen c来动态检测不同 vnp在lb培养基中的生长曲线。简而言之,将10 μl vnp 悬浮液 (od
600 = 1.0) 接种到1 ml lb培养基中,并将每孔300 μl溶液接种在bioscreen c多孔板中。将多孔板在37
°
c下孵育30小时。在波长为600 nm的棕色滤光片下每30分钟测量一次od值。最终获得菌株的实时生长曲线。将b16f10 细胞 (2.0
ꢀ×ꢀ
105) 接种到12孔板中并孵育6-8小时,直到细胞粘附在壁上。然后,将收集的正常的vnp或释放的vnp菌株与细胞以moi=100共培养4小时。 收集板中的所有细胞,洗涤并重悬于结合缓冲液中,用1 μg apc偶联的annexin v蛋白染色,并在黑暗中置于冰上30分钟。 所有样品在加入1 μl pi后,使用流式细胞术分析细胞凋亡情况。
65.(2) 趋化检测:利用经典的transwell实验,比较mφ与mφ(vnp)的趋化能力。使用8.0 mm transwell板,在下室分别添加肿瘤细胞b16f10。待下室细胞贴壁后,去上清,再加入700ul的细胞培养液(dmem,10%胎牛血清,100 mg/l的庆大霉素)。按照前述方法获取mφ与mφ(vnp),使用dmem(含100 mg/ml的庆大霉素)调整细胞浓度,取100 ml细胞悬液加入上室中,37
°ꢀ
5%二氧化碳条件下静置培养。16 h后取出上室,用棉签小心擦去小室上层细胞,加入pbs清洗小室23次后,将小室置于4%多聚甲醛中固定2030 min。固定结束后用pbs清洗23次以去除残留的多聚甲醛,再将小室浸泡在结晶紫中室温避光染色30 min。pbs清洗去除残留的染色液,晾干后使用正置荧光显微镜拍照记录小室下层细胞状况。
66.(3)对肿瘤细胞间接杀伤能力检测:利用0.4 mm transwell板实现巨噬细胞与肿瘤细胞的间接接触,以检测巨噬细胞在装载vnp后对肿瘤细胞的间接杀伤能力。在0.4 mm transwell小室下室分别添加肿瘤细
胞b16f10,细胞约60,000个/孔。培养12 h待下室细胞贴壁后,去上清,再加入1,200 ml的细胞培养液(dmem,10%胎牛血清,100 mg/l的庆大霉素)。按照前述方法获取mφ、mφ(vnp)与l929,使用dmem(10%胎牛血清,100 mg/l的庆大霉素)调整细胞浓度至1
×
106/ml,取200 ml细胞悬液加入上室中,以上室不添加任何细胞作为空白组,37
°ꢀ
5%二氧化碳条件下培养12 h。12 h后取出小室。为检测装载组是否会对肿瘤细胞增殖产生影响,利用cck8检测试剂盒按照厂商说明书检测上述ldh检测实验中下室肿瘤细胞的增殖情况,以不添加上室细胞组作为空白对照。借助活性氧检测试剂盒与细胞no检测试剂盒,按照试剂盒提供说明方法,检测了巨噬细胞与vnp以1:10共培养60分钟后,细胞活性氧(ros)以及no产生水平的变化,以分析巨噬细胞装载vnp后对肿瘤细胞杀伤增强的可能机制。
67.(4)吞噬能力变化:将mφ与vnp以1:10分别共培养60分钟后,庆大霉素杀死胞外残留的菌株,将细胞与荧光微球按照1:10进行混合,于37℃细胞培养箱中静置培养4 h后。吸弃上清并用pbs清洗3次以去除未被吞噬的荧光微球。小心吹打收集细胞后,流式检测巨噬细胞对荧光微球吞噬情况。
68.(5)细胞释放菌株的抗肿瘤活性变化:使用bioscreen c获得lb培养基中不同vnp的生长曲线(包括正常vnp以及巨噬细胞释放出的vnp)。简而言之,将10 μl vnp悬浮液 (od600 = 1.0) 接种到1 ml lb培养基中,并将每孔300 μl溶液接种在bioscreen c多孔板中。将多孔板在37
°
c下孵育30小时。在波长为600nm的棕色滤光片下每30分钟测量一次od值。汇总数据以分析比较细菌生长活性变化。将b16f10细胞 (2.0
ꢀ×ꢀ
105) 接种到12孔板中并孵育6-8小时,直到细胞粘附在壁上。然后,将收集的未加工的vnp或细胞释放的vnp菌株与细胞以moi=100共培养4小时。 收集板中的所有细胞,洗涤并重悬于binding buffer结合缓冲液中,用1 μg apc偶联的annexin v蛋白染色,避光冰上静置30分钟。 所有样品均加入1 μl pi,轻轻混合后使用流式细胞仪分析细胞凋亡情况。
69.实施例3抑瘤效果比较构建原位黑色素瘤荷瘤小鼠模型。具体来说,实验动物小鼠选用6-8周龄雌性c57bl/6小鼠。小鼠被随机分配到不同的组别中。在小鼠右侧前肢腋下接种100 ml细胞,100 ml含有细胞2
×
105(c57bl/6,b16f10)以进行成瘤。待小鼠肿瘤长至约80-160 mm3后再进行治疗。将减毒沙门氏菌或者巨噬细胞装载的减毒沙门氏菌经尾静脉注射给药荷瘤小鼠,所有进行尾静脉注射治疗的菌株,在注射前均进行两次活化。
70.使用pbs调整细菌滴度至5
×
106/ml,腹腔注射100 ml。在按照前述方法获得装载相应vnp的巨噬细胞后,pbs调整细胞浓度至2.5
×
106/ml(raw264.7)或1
×
106/ml(pemφ),尾静脉注射100 ml。
71.肿瘤体积的计算按照公式v=length
×
width2×
0.52进行。每隔一段时间对特定组别小鼠进行肿瘤大小的量取并经计算后用于绘制肿瘤生长曲线图。数值以mean
±
sem表示。
72.实施例4减毒效果比较:(1)肿瘤内滴度检测:
为了检测其胞内菌在体内的动态分布,raw264.7(vnp-rfp)和 pemφ(vnp-rfp) 细胞如前所述制备,通过尾静脉注射100
ꢀµ
l pbs、5
ꢀ×ꢀ
10
5 vnp-rfp、2.5
ꢀ×ꢀ
10
5 raw264.7(vnp-rfp) 或1
ꢀ×ꢀ
10
5 pemφ(vnp) 细胞于b16f10荷瘤小鼠体内。在设计时间点处死小鼠后,获取小鼠各脏器以及肿瘤组织,借助组织研磨仪破碎后添加0.3% tritonx-100,室温放置15-20 min以穿孔细胞,使vnp游离出来,期间颠倒晃动数次。在进行适当比例稀释后,涂至卡纳抗性lb平板分析检测,以统计小鼠体内各脏器内vnp滴度。计算并比较肿瘤/脾脏靶向性与肿瘤/肝脏靶向性的变化。为了更直观的观察,如前所述收获pemφ(vnp-luxcabde),并将细胞与近红外(nir)荧光染料dir一起孵育45分钟。
73.通过尾静脉将100
ꢀµ
l pbs中的pemφ、pemφ (vnp-luxcdabe) 细胞 (1
ꢀ×ꢀ
105) 或vnp-luxcdabe菌株 (5
ꢀ×ꢀ
105) 注射到a20荷瘤小鼠体内。使用体内成像系统检测luxcdabe和dir的荧光信号。
74.(2)组织病理、血常规与血生化分析:经摘眼球取血作血常规检查。将血液室温静置30分钟后,4度、3000转、离心15分钟,小心吸取上清血清。 从血液中获得的血清在-80
°
c下冷冻保存,直到测定血液生化指标和elisa。 常规血液检查、血液生化分析、肿瘤、心脏、肝脏、脾脏、肺和肾脏切片的h&e染色和肿瘤切片巨噬细胞的荧光免疫染色由武汉服务生物公司制备。
75.(3)酶联免疫吸附分析(elisa)在给药后第24小时,对小鼠取血以获取血清并处死以收集肿瘤。将获得的肿瘤以10 mg肿瘤组织/50 μl组织裂解物添加到组织裂解物中,并使用组织匀浆器进行匀浆。通过离心收集上清液。通过小鼠ccl2 elisa试剂盒收集血清和肿瘤组织裂解物用于ccl2细胞因子检测。
76.试验例1装载减毒沙门氏菌的单核细胞或巨噬细胞胞内菌株释放检测方法借助3.0 mm的transwell小室,在按照前述方法获得raw264.7(vnp-rfp)或pemf (vnp-rfp)后,将其置于添加有50 mg/l庆大霉素与10%血清的dmem培养基中持续培养,12 h后撤去培液中的抗生素,再与肿瘤细胞以直接接触组(mf (vnp)
down
组)或间接隔离(mf (vnp)
up
组)的方式共培养16 h(图3a)。结果发现,与肿瘤细胞的直接接触可加速巨噬细胞对胞内vnp的释放,mf (vnp) down
胞内的vnp-rfp在释放出来后仍具有生物活性,并于培液中快速增殖,表明肿瘤细胞加速了菌株释放(图3b)。由于肿瘤微环境通常呈酸性(~ph 6.5-6.8),为了探究酸性对细胞内细菌释放的影响,本发明同时将制备的raw264.7(vnp
‑ꢀ
rfp)和pemf(vnp
‑ꢀ
rfp)细胞在利用稀盐酸调节的不同ph 值(7.4和6.7)培养基中培养(图3c)。结果表明,酸性环境对菌株的释放及其增殖没有显着影响(图3d)。为了进一步验证细胞对细菌的有效释放行为,本发明构建了一种减毒沙门氏菌菌株,该菌株基于扩增扩增sifb启动子在巨噬细胞内有条件地表达rfp(命名为vnp-psifb-rfp)。扩增扩增sifb启动子是一种经典的沙门氏菌致病岛 ii (spi-2)启动子,可被细胞内缺氧、低ph值和低磷酸盐环境激活。vnp-psifb-rfp仅在被巨噬细胞吞噬后才表达rfp。接下来,本发明制备了raw264.7(vnp-psifb-rfp)和pemf(vnp-psifb-rfp)细胞,并在添加了庆大霉素的培养基中培养(图4a)。3小时后通过荧光显微镜观察并计数在细胞外出现带有红色荧光的vnp-psifb-rfp。由于vnp-psifb-rfp仅在细胞内环境中激活和表达rfp,因此细胞外激活的菌株无疑是从细胞
中释放出来的。然后,在剩余的测试期间(3-15小时)记录细菌的持续缓慢释放情况,结果再次证实细菌可有效从细胞内释放出来(图4b)。
77.试验例2经免疫细胞装载再释放出来的减毒沙门氏菌活性检测方法收集raw264.7(vnp-rfp)和pemf (vnp-rfp) 释放的vnp菌株,与未经处理的vnp在37
ꢀ°
c下于lb中进行生长速率的比较(图5a)。同时将上述3种菌株与b16f10细胞以moi=100进行共培养。培养1小时后,用pbs洗涤细胞,然后用50μg/ml庆大霉素处理1 h以去除残留的vnp。用0.3% triton x-100裂解细胞,并通过将10,000倍稀释的细胞裂解物涂布在lb板上来确定肿瘤细胞内vnp的数量(图5b)。将上述3种菌株与b16f10细胞以moi=100 进行共培养4小时后,使用经典的凋亡检测法(膜联蛋白 v和碘化丙啶 (pi) 染色)流式细胞仪检测肿瘤细胞的凋亡情况。结果表明细胞释放的vnp和正常的vnp在体外增殖活性和侵袭和杀死肿瘤细胞的能力方面没有显着差异(图5c)。
78.本发明所述装载减毒沙门氏菌的免疫细胞细胞吞噬能力检测方法是,将raw264.7/raw264.7 (vnp)和pemf/pemf (vnp)细胞与荧光微球以1:10 的比例共孵育4小时。流式细胞仪检测吞噬微球的巨噬细胞百分比。结果表明,相较对照巨噬细胞,与vnp共培养的巨噬细胞在相同时间内能够吞噬更多量的荧光微球,这暗示其具备更强的吞噬能力(图6a,b)。
79.试验例3装载减毒沙门氏菌的免疫细胞细胞趋化能力检测方法利用经典的transwell实验比较raw264.7/pemf与raw264.7(vnp)/pemf(vnp)的趋化能力,于上室分别添加ⅰ)raw264.7;ⅱ)raw264.7(vnp);ⅲ)pemf;ⅳ)pemf(vnp),于下室添加b16f10肿瘤细胞,以下室不添加任何细胞作为阴性对照,在相同时间内,相较raw264.7组,raw264.7(vnp)组有更多的细胞能够主动穿过小孔向下室肿瘤细胞进行趋化,并且相较raw264.7(vnp)组,pemf和pemf(vnp)组有更多的细胞能够主动穿过小孔,表明其趋化能力更强(图7a,b)。
80.试验例4装载减毒沙门氏菌的的单核细胞或巨噬细胞对肿瘤细胞的间接杀伤能力检测方法在0.4 mm transwell小室下室铺上肿瘤细胞(b16f10),于上室分别加入ⅰ)l929;ⅱ) raw264.7或pemf细胞;ⅲ)raw264.7(vnp) 或pemf(vnp)细胞,以不加细胞作为空白对照,以下室不添加细胞,上室添加上述各类细胞为背景对照,以去除上室细胞背景的干扰(图8a)。在共培养12 h后,借助cck8分别检测下室肿瘤细胞增殖能力。检测结果表明,raw264.7(vnp)和pemf(vnp)组下室肿瘤细胞增殖能力(细胞活率)显著弱于raw264.7和pemf组(图8b)。这些结果表明,raw264.7(vnp)和pemf(vnp)具有显著的肿瘤细胞间接杀伤能力,并且pemf(vnp)的杀伤能力更强。激活的巨噬细胞能够通过产生ros与no来实现对肿瘤细胞的间接杀伤作用,而巨噬细胞与vnp的共培养可升高细胞的ros与no的产生水平,相较最初的raw264.7或pemf细胞,raw264.7(vnp)或pemf(vnp)的ros与no均显著提升(图8c,d),这可能是经共培养后巨噬细胞杀伤效果增强的原因之一。
81.试验例5
本发明所述装载减毒沙门氏菌的免疫细胞体内对肿瘤靶向性、减毒、生物分布与治疗效果检测方法是:将vnp或raw264.7(vnp)或pemf(vnp)分别经尾静脉注射b16f10荷瘤小鼠,基于前期实验获得的巨噬细胞有效装载剂量与vnp治疗小鼠肿瘤的有效剂量以及耐受剂量,其中vnp经尾静脉注射给药剂量为5
×
10
5 cfu/只小鼠,对应raw264.7(vnp)注射量为2.5
×
105细胞/只小鼠,pemf(vnp)注射量为1
×
105细胞/只小鼠(图9a)。为了研究mf (vnp) 细胞是否可以减轻vnp在小鼠中引起的急性毒性和炎症反应,本发明首先评估了不同处理后24小时体重和肝脏和脾脏的形态特征的变化。结果证实,采用这种策略可显著减轻vnp诱导的体重减轻、脾肿大和肝脏炎症病变(图9b-f)。肝脏h&e染色切片显示,raw264.7(vnp)组与pemf(vnp)组相较vnp组肝脏损伤面积减少(图10a)。血液学检测中肝脏损伤指标alt(丙氨酸氨基转移酶)和ast(天门冬氨酸氨基转移酶)检测结果显示,raw264.7(vnp)组与pemf(vnp)组显著缓解了vnp的急性肝损伤(图10b)。所有这些结果表明,mf(vnp)细胞治疗有效避免了单次给药vnp引起的副作用。mf (vnp) 细胞治疗后体内较低的炎症反应可能是由于正常器官中菌株滴度的降低。为了验证这一假设,本发明通过稀释涂板法来比较vnp 在体内的定植情况。结果表明,无论使用哪种巨噬细胞装载 vnp,在肝脏和脾脏中都观察到较少的vnp(图11a)。选择第6天vnp在每个组织中的定植作为代表。肿瘤靶向性是指肿瘤中细菌滴度与正常器官中细菌滴度的比率,用于评估这些组之间vnp的肿瘤特异性递送效果的差异。经比较,raw264.7(vnp)组相较单一vnp组的肿瘤/脾脏靶向性,肿瘤/肝脏靶向性分别提升了7.8-48.8倍,2.6-12.2倍,而pemf(vnp)组相较单一vnp组的肿瘤/脾脏靶向性,肿瘤/肝脏靶向性分别提升了6.9-51.7倍倍,2.1-12.9倍(图11b)。这些结果突出了巨噬细胞介导的vnp递送的肿瘤靶向性增加。此外,与单个 vnp 组相比,mf (vnp) 组中其他器官(包括心脏、肺和肾脏)的vnp滴度也降低(图11a),而h&e染色这些器官切片没有显示这些组之间明显的组织学缺陷差异,表明细胞制剂对这些器官的治疗诱导的毒性可以忽略不计(图12)。本发明还评估了不同治疗组别间的抗肿瘤作用,发现单独的巨噬细胞具有相对有效的抗肿瘤能力,这很容易理解,因为本发明使用了具有肿瘤杀伤作用的活化的m1样巨噬细胞。与pbs组相比,vnp组显著抑制肿瘤进展,而 mf (vnp) 组均显示出更好的抗肿瘤活性(图13)。这些结果表明,这种新策略不仅避免了单一给药vnp引起的副作用,而且有效地提高了对肿瘤的治疗效果。
82.结果表明pemφ(vnp)相较任意单一的治疗方式,抗肿瘤效果显著升高。肿瘤倍数生长时间均显著延长(图13、表1)。pbs组的肿瘤倍数生长时间为2.178
±
0.1503天,vnp20009组肿瘤倍数生长时间为3.511
±
0.1543天,raw264.7组的肿瘤倍数生长时间为2.803
±
0.1331天,raw264.7(vnp)组的肿瘤倍数生长时间为4.483
±
0.3191天,pemφ组肿瘤倍数生长时间为3.216
±
0.2046天,pemφ(vnp)组肿瘤倍数生长时间为 4.663
±
0.4282(图13、表1)。与pbs组相比,vnp20009组的肿瘤倍数生长时间延长61.2%,raw264.7组的肿瘤倍数生长时间延长28.7%,raw264.7(vnp)组的肿瘤倍数生长时间105.8%,pemφ组的肿瘤倍数生长时间延长47.7%,pemφ(vnp)组的肿瘤倍数生长时间为114.1%。与vnp20009组相比,raw264.7组和pemφ的肿瘤倍数生长时间都短于vnp20009组,raw264.7(vnp)组的肿瘤倍数生长时间延长27.7%,raw264.7(vnp)组的肿瘤倍数生长时间延长32.8%;与raw264.7组相比,vnp20009组的肿瘤倍数生长时间延长25.3%,raw264.7(vnp)组的肿瘤倍数生长时间延
长59.9%,pemφ组的肿瘤倍数生长时间延长14.7%,raw264.7(vnp)组的肿瘤倍数生长时间延长66.4%;与raw264.7(vnp)相比,pemφ(vnp)组的肿瘤倍数生长时间延长4.0%;与pemφ组相比,raw264.7(vnp)组的肿瘤倍数生长时间延长39.4%,pemφ(vnp)组的肿瘤倍数生长时间延长45.0%。pemφ(vnp)组的肿瘤倍数生长时间的延长幅度(114.1%)大于pemφ组和vnp20009组两组各自的肿瘤倍数生长时间延长值之和的理论值(47.7%+61.2%=108.9%);raw264.7(vnp)组的肿瘤倍数生长时间的延长幅度(105.8%)大于raw264.7组和vnp20009组两组各自的肿瘤倍数生长时间延长值之和的理论值(28.7%+61.2%=89.9%)。
83.pemφ(vnp)相较任意单一的治疗方式,抗肿瘤效果显著升高,肿瘤延迟时间均显著延长(图13、表1)。pbs组的肿瘤延迟时间为2.130
±
0.1590天,vnp20009组肿瘤延迟时间为3.261
±
0.2619天,raw264.7组的肿瘤延迟时间为2.416
±
0.1682天,raw264.7(vnp)组的肿瘤延迟时间为4.321
±
0.2676天,pemφ组肿瘤延迟时间为2.781
±
0.2083天,pemφ(vnp)组肿瘤延迟时间为4.613
±
0.3337天(图13、表1)。与pbs组相比,vnp20009组的肿瘤延迟时间延长53.1%,raw264.7组的肿瘤延迟时间延长13.4%,raw264.7(vnp)组的肿瘤延迟时间延长102.9%,pemφ组的肿瘤延迟时间延长30.6%,pemφ(vnp)组的肿瘤延迟时间116.6%。与vnp20009组相比,raw264.7组和pemφ的肿瘤延迟时间都短于vnp20009组,raw264.7(vnp)组的肿瘤延迟时间延长32.5%,pemφ(vnp)组的肿瘤延迟时间延长41.5%;与raw264.7组相比,vnp20009组的肿瘤延迟时间延长25.3%, raw264.7(vnp)组的肿瘤延迟时间延长78.8%,pemφ组的肿瘤延迟时间延长15.1%,raw264.7(vnp)组的肿瘤延迟时间延长90.9%;与raw264.7(vnp)相比,pemφ(vnp)组的肿瘤延迟时间延长4.0%,差异不太大;与pemφ组相比,raw264.7(vnp)组的肿瘤延迟时间延长55.4%,pemφ(vnp)组的肿瘤延迟时间延长65.9%。pemφ(vnp)组的肿瘤延迟时间的延长幅度(116.6%)远大于pemφ组和vnp20009组两组各自的肿瘤延迟时间延长值之和的理论值(30.6%+53.1%=83.7%);raw264.7(vnp)组的肿瘤延迟时间的延长幅度(102.9%)远大于raw264.7组和vnp20009组两组各自的肿瘤延迟时间延长值之和的理论值(13.4%+53.1%=66.5%);上述结果从而有力证明了装载了减毒沙门氏菌工程菌的单核细胞或巨噬细胞或巨噬细胞系(raw264.7)产生了比减毒沙门氏菌和单核细胞或巨噬细胞或巨噬细胞系(raw264.7)混合联用更好的、远超意料的协同治疗效果。
84.上述结果从而有力证明了装载了减毒沙门氏菌工程菌的单核细胞或巨噬细胞或巨噬细胞系(raw264.7)产生了比减毒沙门氏菌和单核细胞或巨噬细胞或巨噬细胞系(raw264.7)混合联用更好的、远超意料的协同治疗效果。
85.表1 pbsvnpraw264.7raw264.7(vnp)pemφpemφ(vnp)肿瘤倍增时间(天)2.178
±
0.15033.511
±
0.15432.803
±
0.13314.483
±
0.31913.216
±
0.20464.663
±
0.4282肿瘤延迟时间(天)2.130
±
0.15903.261
±
0.26192.416
±
0.16824.321
±
0.26762.781
±
0.20834.613
±
0.3337
数据展示为mean
±
sem试验例6本发明所述装载减毒沙门氏菌的免疫细胞活体成像检测方法:利用表达荧光素酶的vnp-luxcdabe与带有dir染料标记的pemf共孵育获得pemf(vnp-luxcdabe),将pemf细胞(1
×
105)、pemf(vnp-luxcdabe)细胞(1
×
105)或vnp-luxcdabe菌株(5
×
105cfu)经尾静脉注射到a20荷瘤小鼠体内,在指定时间点利用ivis
® lumina iii活体成像系统进行近红外荧光以及生物光成像。结果显示,给药后近红外荧光信号首先出
现在脾脏、肝脏区域,12小时可在肿瘤区域检测到pemf和pemf(vnp-luxcdabe)的近红外荧光信号、vnp-luxcdabe和pemf(vnp-luxcdabe)的生物光信号(图14a)。给药24小时后,与pemf组相比pemf(vnp-luxcdabe)组肿瘤部位红外荧光强度更高,说明pemf(vnp-luxcdabe)比单一pemf的肿瘤富集能力更强(图14b); vnp-luxcdabe与pemf(vnp-luxcdabe)组肿瘤部位生物光强度近似(图14c)。肿瘤及各脏器红外荧光成像分析显示,相较单一pemf,pemf(vnp-luxcdabe)肿瘤部位红外荧光信号比例更高,而肝脏和脾脏信号比例更低,进一步证明装载减毒沙门氏菌的免疫细胞的肿瘤靶向能力(图14d,e)。本发明所述装载减毒沙门氏菌的免疫细胞体内肿瘤靶向性归结于肿瘤部位趋化因子招募作用的验证方法是,利用elisa分别检测正常小鼠和a20荷瘤小鼠的血清趋化因子ccl2水平,以及注射pbs、pemf和pemf(vnp)的a20小鼠血清和肿瘤趋化因子ccl2水平。结果显示,a20荷瘤小鼠血清ccl2水平显著高于正常小鼠(图15a) 高ccl2水平有利于巨噬细胞向肿瘤区域招募。另外,相比于pbs和pemf组,pemf(vnp)组荷瘤小鼠的血清及肿瘤ccl2水平更高(图15b),一定程度上解释了pemf(vnp)比pemf肿瘤富集能力更强的原因。
86.试验例7本发明所述装载减毒沙门氏菌的免疫细胞体内减毒效应归结于巨噬细胞免疫细胞靶向携带作用的验证方法是,分别将pemf+vnp(简单混合组)与pemf (vnp)(有效装载组)经尾静脉注射b16f10荷瘤小鼠,并评估它们的毒性和肿瘤靶向性(图16a)。第1天的肝脾比较发现,vnp组与pemf+vnp组中,小鼠均出现显著的肝脏损伤与脾脏肿大,而pemf (vnp)组中的这些毒性副作用受到显著缓解(图16b-e)。第6天的肝、脾、肿瘤内菌株滴度以及肿瘤/脾脏靶向性,肿瘤/肝脏靶向性表明,vnp组与pemf+vnp组表现出相接近的脏器内滴度。而相较pemf+vnp组,pemf (vnp)的肝脾内菌株滴度显著降低且肿瘤/脾脏靶向性,肿瘤/肝脏靶向性显著升高(图16f,g)。这表明将巨噬细胞和vnp 的混合物直接注射到小鼠体内,而不是加载,并没有降低vnp的毒性,也不能减少vnp在肝脏和脾脏中的积累。
87.所述装载减毒沙门氏菌的单核细胞或巨噬细胞可以单独用于制备抗肿瘤药物,也可以与现有的抗肿瘤药物组成组合物,或与现有化学药物治疗、中药治疗、生物治疗、物理治疗方法在抗肿瘤治疗中联合运用。
88.上述说明示出并描述了本发明的若干优选实施例,但如前所述,应当理解本发明并非局限于本文所披露的形式,不应看作是对其他实施例的排除,而可用于各种其他组合、修改,并能够在本发明构想范围内,通过上述教导或相关领域的技术或知识进行改动。而本领域人员所进行的改动和变化不脱离本发明的精神和范围,则都应在本发明所附权利要求的保护范围内。
89.上述说明示出并描述了本发明的若干优选实施例,但如前所述,应当理解本发明并非局限于本文所披露的形式,不应看作是对其他实施例的排除,而可用于各种其他组合、修改,并能够在本发明构想范围内,通过上述教导或相关领域的技术或知识进行改动。而本领域人员所进行的改动和变化不脱离本发明的精神和范围,则都应在本发明所附权利要求的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1