一种检测肠道病毒71型的引物和探针组合及其试剂盒的制作方法
1.本发明属于体外检测试剂领域,具体涉及一种检测肠道病毒71型的引物和探针组合及其试剂盒。
背景技术:
2.肠道病毒是引起手足口病的病原体。至少20多种a组肠道病毒血清型可引起手足口病,以肠道病毒71型(ev71)、柯萨奇病毒a16型(cv-a16)、柯萨奇病毒a6型(cv-a6)、柯萨奇病毒a10(cv-a10)最为常见,其中,重症和死亡病例多数由ev-a71感染所致。基于vp1基因序列差异可以将ev71分为a、b、c3个基因型,其中b与c又可分为5个基因亚型b1-b5与c1-c5。其中,中国主要流行的ev71型病毒为c4a亚型。
3.目前,肠道病毒71型检测的主要方法有:病毒分离培养法,但在病毒分离培养法中细胞增殖的培养技术操作复杂,技术及设备要求高,耗时长,不适合处理大量样本,且许多肠道病毒不能进行细胞培养,或者可以培养但不出现细胞病理效应;血清学检测法,该检测方法在疾病早期血液中较难检测到病毒抗体,不适用于早期诊断,且肠道病毒血清型众多,临床使用检测价值有限;基因序列测序法,基因序列测序法成本昂贵,步骤复杂繁琐,耗时长等缺点,临床检测不适宜使用。荧光pcr技术所用的荧光探针提高了检测的特异性和灵敏度,检测ev71 rna较病毒分离培养法和血清学检测法都要敏感,而且对无症状感染者也能做出准确检测,能够对肠道病毒71型感染做出早期诊断。
4.然而,目前国内外已有基于实时荧光pcr技术检测ev71 rna的试剂盒应用于临床检测中,但部分试剂盒由于样本处理方法、引物和探针设计位点、反应试剂耐受性不同而引起不同程度的假阴性,检测效率低、特异性不高。
技术实现要素:
5.有鉴于此,本发明提供一种检测肠道病毒71型的引物和探针组合及其试剂盒,旨在提供可快速准确检测肠道病毒71型的试剂。
6.为达到此目的,本发明提供一种检测肠道病毒71型的引物和探针组合,所述检测肠道病毒71型的引物和探针组合包括:
7.ev71上游引物,所述ev71型上游引物的核苷酸序列如seq id no:1所示;
8.ev71下游引物,所述ev71型下游引物的核苷酸序列如seq id no:2所示;及,
9.ev71探针,所述探针的核苷酸序列如seq id no:3所示。
10.可选地,所述探针的5’端标记有荧光基团,3’端标记有荧光淬灭基团。
11.可选地,所述荧光基团选自fam、vic、rox或cy5中的任意一种;和/或,
12.所述荧光淬灭基团选自bhq1或bhq2中的一种。
13.可选地,所述检测肠道病毒71型的引物和探针组合还包括:
14.内标上游引物,所述内标上游引物的核苷酸序列如seq id no:4所示;
15.内标下游引物,所述内标下游引物的核苷酸序列如seq id no:5所示;及,
16.内标探针,所述内标探针的核苷酸序列如seq id no:6所示。
17.此外,本发明还提供一种检测肠道病毒71型的试剂盒,所述检测肠道病毒71型的试剂盒包括ev71反应液、dna聚合酶及逆转录酶,其中,所述ev71反应液包括pcr反应缓冲液、dntps及上述检测肠道病毒71型的引物和探针组合。
18.可选地,所述检测肠道病毒71型的试剂盒还包括阴性对照品和阳性对照品。
19.可选地,所述ev71反应液中,所述pcr反应缓冲液的含量为2.5~5μl;和/或,
20.所述ev71反应液中,所述dntps的浓度为0.1~0.5μm;和/或,
21.所述ev71反应液中,所述ev71上游引物的浓度为0.1~1μm;和/或,
22.所述ev71反应液中,所述ev71上游引物的浓度为0.1~1μm;和/或,
23.所述ev71反应液中,所述ev71探针的浓度为0.1~1μm;和/或,
24.所述dna聚合酶为taq酶;和/或,
25.所述dna聚合酶的活性为0.5~2u;和/或,
26.所述逆转录酶的活性为1~10u。
27.可选地,所述ev71反应液还包括核苷酸序列如seq id no:4所示的内标上游引物,核苷酸序列如seq id no:5所示的内标下游引物及核苷酸序列如seq id no:6所示的内标探针;和/或,
28.所述ev71反应液还包括mgcl2;和/或,
29.所述dntps包括datp、dutp、dgtp及dctp;和/或,
30.所述检测肠道病毒71型的试剂盒还包括内标质粒。
31.可选地,所述内标质粒包括果蝇靶序列;和/或,
32.所述ev71反应液中,所述内标上游引物的浓度为0.1~1μm;和/或,
33.所述ev71反应液中,所述内标下游引物的浓度为0.1~1μm;和/或,
34.所述ev71反应液中,所述内标探针的浓度为0.1~1μm。
35.此外,一种检测肠道病毒71型的方法,所述检测肠道病毒71型的方法包括以下步骤:
36.获取待检测样品;
37.将所述检测样品、阴性对照品及阳性对照品采用如权利要求6~9任一项所述的试剂盒进行pcr反应;
38.若pcr反应的扩增结果判定待检测样品的是否存在肠道病毒71型。
39.本发明中,通过基于肠道病毒71型高度保守序列筛选出的引物与探针组合,和可能存在同源性序列、其他肠道病毒、其他病原体等均无交叉反应,具有很好的特异性;同时,通过包含其的引物和探针组合的试剂盒检测肠道病毒71型,检测操作快速、方法简便、检测灵敏度高、检测范围宽,可以在较短的时间内对粪便等未知样本中的ev71 rna进行快速准确的检测,为诊断肠道病毒71型感染提供可靠的实验依据。其检测结果可用于肠道病毒71型感染的辅助诊断,为肠道疾病的早期诊断以及高危人群的初筛提供分子诊断依据,适合推广。
附图说明
40.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现
有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅为本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
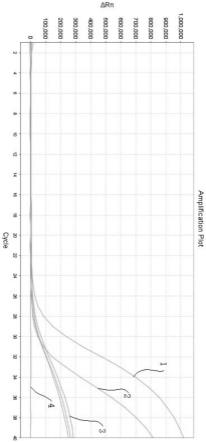
41.图1为实施例2检测样本为阳性的曲线图;
42.图2为实施例2检测样本为阴性的曲线图;
43.图3为实施例3检测阳性参考品和阴性参考品结果图;
44.图4为实施例4特异性实验结果图;
45.图5为实施例5精密度实验结果图;
46.图6为实施例6灵敏度实验结果图;
47.图7为对比例1检测阳性参考品和阴性参考品结果图。
48.本发明目的的实现、功能特点及优点将结合实施例,参照附图做进一步说明。
具体实施方式
49.为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。显然,所描述的实施例仅仅是本发明的一部分实施例,而不是全部的实施例。
50.需要说明的是,实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。另外,全文中出现的“和/或”的含义,包括三个并列的方案,以“a和/或b”为例,包括a方案、或b方案、或a和b同时满足的方案。此外,各个实施例之间的技术方案可以相互结合,但是必须是以本领域普通技术人员能够实现为基础,当技术方案的结合出现相互矛盾或无法实现时应当认为这种技术方案的结合不存在,也不在本发明要求的保护范围之内。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
51.鉴于背景技术提出的现有的实时荧光pcr技术检测ev71 rna的试剂盒应用于临床检测中,出现测试效率低且特异性不高的技术缺陷,本发明提供一种检测肠道病毒71型的引物和探针组合,所述检测肠道病毒71型的引物和探针组合包括:
52.ev71上游引物,所述ev71型上游引物的核苷酸序列如seq id no:1所示,序列中,y为c或t;ev71下游引物,所述ev71型下游引物的核苷酸序列如seq id no:2,序列中,k为g或t;所示;及,ev71探针,所述探针的核苷酸序列如seq id no:3所示。
53.本发明中,通过基于肠道病毒71型高度保守序列筛选出的引物与探针组合,和可能存在同源性序列、其他肠道病毒、其他病原体等无交叉反应,具有很好的特异性。
54.在一些实施例中,所述探针的5’端标记有荧光基团,3’端标记有荧光淬灭基团。基于此种目的,在本发明中,所述荧光基团所述荧光基团选自fam、vic、rox或cy5中的任意一种;所述荧光淬灭基团选自bhq1或bhq2中的一种。在一些实施例中,所述荧光基团为fam,所述荧光淬灭基团为bhq2。
55.本发明通过在探针标记荧光基团和荧光淬灭基团,可以通过荧光信号反应扩增情况,以此判断检测结果。
56.在一些实施例中,所述检测肠道病毒71型的引物和探针组合还包括:
57.内标上游引物,所述内标上游引物的核苷酸序列如seq id no:4所示;
58.内标下游引物,所述内标下游引物的核苷酸序列如seq id no:5所示;及,内标探针,所述内标探针的核苷酸序列如seq id no:6所示。本发明中,通过在引物体系中设置内标引物对及探针,通过扩增具有高度保守序列对的内标,排除实验误差,提高检测准确率以及结果的可靠性。
59.进一步,所述内标探针的5’端标记有与ev71探针不一样的荧光基团,3’端标记有荧光淬灭基团。以此,可以通过选取不同的仪器通道进行实验,进一步提高检测速率。基于此前提,在一些实施例中,所述内标探针的5’端标记的荧光基团为rox。
60.此外,本发明还提供一种检测肠道病毒71型的试剂盒,所述检测肠道病毒71型的试剂盒包括ev71反应液、dna聚合酶及逆转录酶,其中,所述ev71反应液包括pcr反应缓冲液、dntps及上述所述的检测肠道病毒71型的引物和探针组合。本发明通过上述试剂盒体系检测肠道病毒71型,检测操作快速、方法简便、检测灵敏度高、检测范围宽,可以在较短的时间内对粪便等未知样本中的ev71 rna进行快速准确的检测,为诊断肠道病毒71型感染提供可靠的实验依据。其检测结果可用于肠道病毒71型感染的辅助诊断,为肠道疾病的早期诊断以及高危人群的初筛提供分子诊断依据,适合推广。
61.在一些实施例中,所述检测肠道病毒71型的试剂盒还包括阴性对照品和阳性对照品。通过增设阴性对照品与阳性对照品来确保检测条件的可靠性,以此,增强实验结果的可靠性。基于此前提条件下选择的阳性对照品可以为包含ev71型扩增靶序列的假病毒;所述阴性对照品可以为depc水。
62.在一些实施例中,所述ev71反应液中,所述pcr反应缓冲液的含量为2.5~5μl;所述dntps的浓度为0.1~0.5μm;所述ev71上游引物的浓度为0.1~1μm;所述ev71上游引物的浓度为0.1~1μm;所述ev71探针的浓度为0.1~1μm;所述dna聚合酶为taq酶;所述dna聚合酶的活性为0.5~2u;所述逆转录酶的活性为1~10u。通过将试剂盒中的体系组分采用上述含量或浓度进行复配,可以进一步提高荧光信号输出强度,进而提高测试敏感度,扩大测试的浓度检测范围。
63.在一些实施例中,所述检测肠道病毒71型的引物和探针组合还包括核苷酸序列如seq id no:4所示的内标上游引物,核苷酸序列如seq id no:5所示的内标下游引物及核苷酸序列如seq id no:6所示的内标探针;所述ev71反应液还包括mgcl2;所述dntps包括datp、dutp、dgtp及dctp;所述检测肠道病毒71型的试剂盒还包括内标质粒。本发明中,通过在试剂盒体系中引入内标质粒和对应的扩增引物对,以此提高测试结果的准确率与有效性。
64.在一些实施例中,所述内标质粒包括果蝇靶序列;所述内标质粒的含量为1~2μl;所述ev71反应液中,所述内标上游引物的浓度为0.1~1μm;所述内标下游引物的浓度为0.1~1μm;所述内标探针的浓度为0.1~1μm。本发明中,通过含果蝇靶序列质粒作为内标质粒,选取与人和肠道病毒无关联的靶序列一起扩增,监控本试剂盒使用过程是否受抑制,仪器是否异常等情况。时,通过内标体系控制在上述含量或浓度,可以保证内标的扩增效率,保证了内标扩增产物荧光信号的强度,进而提高的了检测灵敏度。
65.此外,一种检测肠道病毒71型的方法,所述检测肠道病毒71型的方法包括以下步骤:
66.步骤s10:获取待检测样品;
67.步骤s20:将所述检测样品、阴性对照品及阳性对照品采用上述试剂盒进行pcr反应;
68.步骤s30:根据pcr反应的扩增结果判定待检测样品的是否存在肠道病毒71型。
69.通过上述检测步骤采用检测肠道病毒71型的试剂盒对待检测样品进行检测,通过pcr反应的扩增结果判定是否存在肠道病毒71型,检测快速、可靠。
70.所述步骤s20包括以下步骤:
71.步骤s201:提取所述待检测样品的基因组rna;
72.步骤s202:将所述ev71反应液与所述基因组rna、taq酶,逆转录酶,内标质粒充分混匀后,组成样品pcr反应体系;后进行pcr反应。
73.进一步,所述样品pcr反应体系如下所示:
74.ev71反应液:15μl;
75.taq酶:0.5μl;
76.逆转录酶:0.5μl;
77.内标质粒:1μl;
78.基因组rna:8μl。
79.步骤s203:配置阳性对照pcr反应体系,配置方法与步骤s202一致,唯一不同的是,将基因组rna替换成阳性对照品;
80.步骤s204:配置阳性对照pcr反应体系,配置方法与步骤s202一致,唯一不同的是,将基因组rna替换成阴性对照品。
81.通过上述方法配置成的pcr体系可以使pcr信号更强,提高测试灵敏度。
82.进一步,所述pcr反应条件如下所示:
[0083][0084][0085]
将pcr反应条件控制在参数范围时,可以使pcr信号更强,提高测试灵敏度。
[0086]
所述步骤s30中,包括以下步骤;
[0087]
步骤s301:结果有效性判断,所述结果有效性判断包括:
[0088]
a.内标通道:所有样本包括阳性对照和阴性对照的检测中内参探针荧光基团对应通道出现明显的s型扩增曲线,且ct值≤34;
[0089]
b.阳性对照:ev71探针荧光基团对应通道出现明显的s型扩增曲线,且24≤ct值≤34;
[0090]
c.阴性对照:ev71探针荧光基团对应通道无扩增曲线,或者扩增曲线为直线或倾斜线但无指数增长期,无ct值(显示undetermined);
[0091]
步骤s302:在结果有效性判断符合的前提下进行结果阴阳性判断,所述结果阴阳
性判断包括:
[0092]
a.样本在ev71探针荧光基团对应通道ct值显示为undet,则判断为阴性;
[0093]
b.样本在ev71探针荧光基团对应通道ct值≤38,则判断为阳性;
[0094]
c.样本在ev71探针荧光基团对应通道ct值38<ct<40,建议重做(可以将核酸提取样本量加倍),若重做结果为38<ct<40或ct≤38且呈s型扩增曲线,则可实验需同时符合以上三个条件视为有效,否则无效,需重做。判断为ev71阳性。
[0095]
通过步骤s30对测试结果进行判断,可以判断样品中是否具有肠道病毒71型。
[0096]
以下结合具体实施例和附图对本发明的技术方案作进一步详细说明,应当理解,以下实施例仅仅用以解释本发明,并不用于限定本发明。
[0097]
实施例1
[0098]
本实施例提供一种肠道病毒71型检测试剂盒,具体包括ev71反应液、5u的逆转录酶(天根生化科技(北京)有限公司购买)、1.5u的taq酶(天根生化科技(北京)有限公司购买)包含ev71型扩增靶序列的假病毒(委托复百奥生物科技有限公司合成)及depc水及含果蝇靶序列的质粒(委托通用生物系统(安徽)有限公司合成)。
[0099]
ev71反应液中的各组分含量如下表所示:
[0100]
组分终浓度/含量1人份用量pcr反应缓冲液5μl5μldntps0.4μm0.4μlev71上游引物0.5μm1.25μlev71下游引物0.5μm1.25μlev71探针0.5μm1.25μl内标上游引物0.5μm1.25μl内标下游引物0.5μm1.25μl内标探针0.5μm1.25μl加depc水至2.1μl2.1μl
[0101]
上表中,ev71上游引物的核苷酸序列如seq id no:1所示,序列中,y为c,ev71下游引物的核苷酸序列如seq id no:2所示,序列中,k为g;ev71探针的核苷酸序列如seq id no:3所示,内标上游引物的核苷酸序列如seq id no:4所示,内标下游引物的核苷酸序列如seq id no:5所示,内标探针的核苷酸序列如seq id no:6所示,其中,ev71探针的5’端标记有fam基团,3’端标记有bhq1淬灭基团,内标探针的的5'端标记rox荧光基团,3'端标记bhq2淬灭基团;dntps包括datp、dutp、dgtp及dctp,pcr反应缓冲液为与taq酶配套的high affinity hot taq(购买自天根生化科技(北京)有限公司)
[0102]
实施例2
[0103]
本实施例采用实施例1试剂盒对20例待测粪便样品进行检测,具体操作步骤如下:
[0104]
1.粪便样品基因组rna提取
[0105]
提取试剂:购买自天根生化科技(北京)有限公司的病毒基因组dna/rna提取试剂盒(dp315)
[0106]
往200mg新鲜粪便样本中加入250μl的无菌生理盐水,漩涡震荡至完全分散,12000rpm离心5分钟,上清液用于rna提取。往ep管中依次加入560μl准备好的carrier rna
工作液(为裂解液rl与carrier rna溶液的混合液)、140μl样品,涡旋混匀15秒,瞬时离心,室温静置10min;加560μl无水乙醇,涡旋混匀15s,瞬时离心;吸取630μl液体于rna吸附柱中,盖上盖子,8000rpm离心1min,弃滤液,重复操作1次;加500μl缓冲液gd,盖上盖子,8000rpm离心1min,弃滤液;加500μl漂洗液rw,盖上盖子,8000rpm离心1min,弃滤液,重复操作1次;1200rpm离心3min,以除尽残留的洗涤液;将rna吸附柱置于新的1.5ml ep管中;往rna吸附膜中央滴加60μlrnase-free ddh2o(洗脱缓冲液),室温静置5min,12000rpm离心1min,收集产物(即为纯化的基因组rna),-20℃保存。
[0107]
2.试剂准备
[0108]
按照待测样本数20个加1个阳性对照和1个阴性对照,取试剂盒中的ev71反应液15μl
×
22,taq酶0.5μl
×
22,逆转录酶0.5μl
×
22,内标质粒1μl
×
22,充分混匀后每个扩增反应管分装17μl,分别加入阳性对照、阴性对照、以及处理好的20个样本各8μl,使得总反应为25μl,盖好盖子并转移至pcr扩增室。
[0109]
3.pcr扩增
[0110]
1)将pcr反应管放入荧光pcr仪内,设置样本名称;
[0111]
2)荧光通道选择:选择fam通道(reporter:fam,quencher:none)和rox通道(reporter:rox,quencher:none),按照下表设置pcr反应条件,设置好运行pcr扩增程序。
[0112][0113]
4.结果分析:
[0114]
20例样本检测结果如下:
[0115]
肠道病毒71型阳性样本6例,其中一个检测结果如图1所示;图1中,1为阳性样本测试曲线,2为阳性对照曲线,3为内标对照,4为阴性对照。
[0116]
肠道病毒71型阴性样本14例,其中一个检测结果如图2所示;图2中,1为阳性对照,2为内标对照,3为阴性样本和阴性对照测试曲线。
[0117]
上述20例样本同时用金标测序法进行检测,结果一致率为100%,说明本发明检测方法结果准确可靠,操作简单便捷,更有利于临床应用和大规模推广。
[0118]
实施例3
[0119]
本实施例提供实施例1试剂盒的准确性试验,具体操作如下:
[0120]
用实施例1试剂盒检测6份阳性参考品和13份阴性参考品,检测方法按照实施例1提供的本发明试剂盒操作步骤进行,结果如图3所示,图3中,1为阳性参考品测试曲线,2为内标对照,3为阴性参考品对照曲线。
[0121]
由图3可以看出,6份阳性参考品均成s型扩增曲线,可判断全部为阳性;13份阴性参考品呈平直的扩增曲线且无ct值,可判断全部为阴性。阳性参考品和阴性参考品符合率结果符合率皆为100%。说明本发明试剂盒准确性高。
[0122]
实施例4
[0123]
本实施例提供实施例1试剂盒的特异性试验,具体操作如下:
[0124]
为了检测实施例1试剂盒的特异性,实施例1试剂盒检测cva2、cva6、cva10、cva16、cvb3、cvb5、疱疹病毒、巨细胞病毒、大肠埃希氏菌、甲型副伤寒沙门氏菌、肺炎克雷伯氏菌、痢疾志贺氏菌和铜绿假单胞菌。检测方法按照实施例1提供的本发明试剂盒操作步骤进行,结果如图4所示,图4中,1为阳性对照品曲线,2为内标对照,3为cva2、cva6、cva10、cva16、cvb3、cvb5、疱疹病毒、巨细胞病毒、大肠埃希氏菌、甲型副伤寒沙门氏菌、肺炎克雷伯氏菌、痢疾志贺氏菌和铜绿假单胞菌测试曲线。
[0125]
由图4可以看出,阳性对照结果为阳性,以上13种病原微生物为全为阴性。说明本发明试剂盒仅能特异性扩增肠道病毒71型,而不与肠道内其它细菌和病毒的核酸发生交叉反应,未出现假阳性,吻合度为100%,证明本发明试剂盒特异性好。
[0126]
实施例5
[0127]
本实施例提供实施例1试剂盒的精密度试验,具体操作如下:
[0128]
利用实施例1试剂盒对两份精密度参考品j1和j2进行精密度测试,每份样本重复测试10次,检测方法按照实施例1提供的本发明试剂盒操作步骤进行,结果如图5所示,1为j1曲线,2为j2曲线。其中,所述精密度参考品j1和j2由ev71型国家参考品稀释制备而成。
[0129]
从图5中可以看出,两份精密度重复样本的扩增曲线ct值均表现集中,经数据分析显示ct值变异系数(cv%)小于5.0%,表明本发明试剂盒具有较高的精密度。
[0130]
实施例6
[0131]
本实施例提供实施例1试剂盒的灵敏度试验,具体操作如下:检出限参考品为稀释成3600copies/ml、1000copies/ml、360copies/ml的肠道病毒ev71-c4病毒培养物,由ev71型国家参考品稀释制备而成。阳性对照为含有ev71片段的假病毒;阴性对照为无ev71基因片段的depc水。
[0132]
采用本发明试剂盒对上述阴、阳性对照和检出限参考品进行检测,检测方法按照实施例1提供的本发明试剂盒操作步骤进行,检测结果如图6所示,图6中,1为3600copies/ml曲线,2为1000copies/ml曲线。请参阅图6,对最低检测限样本进行定值,其浓度为1000copies/ml,表明本发明试剂盒具有良好的灵敏度。
[0133]
对比例1
[0134]
本对比例提供针对ev71序列设计出另一组探针和引物组合,该组引物对包括核苷酸序列如seq.id.no:7所示的上游引物,核苷酸序列seq.id.no:8所示的下游引物,该组的探针的核苷酸序列如seq.id.no:9所示,其中探针的5’端标记有fam基团,3’端标记有bhq1基团。
[0135]
将探针和引物组合制备成试剂盒,试剂盒的其余组分均与实施例1中除ev71上游引物,ev71下游引物及ev71探针的之外的成分一样。
[0136]
按实施例3所示的方法进行准确性实验,结果如图7所示,1为阳性参照品,2为阴性参考品,阳性参考品和阴性参考品符合率均低于85%。
[0137]
通过准确率测试可知,采用实施例1试剂盒可以有效提高测试准确率至100%。
[0138]
以上仅为本发明的优选实施例,并非因此限制本发明的专利范围,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包括在本发明的专利保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1