用于有机电气元件的化合物、使用所述化合物的有机电气元件及其电子装置的制作方法
本发明涉及用于有机电气元件的化合物、使用所述化合物的有机电气元件及其电子装置。
背景技术:
通常,有机发光现象是指通过使用有机材料将电能转化为光能的现象。使用有机发光现象的有机电气元件通常具有包括阳极、阴极和插入其间的有机材料层的结构。在此,为了提高有机电气元件的效率和稳定性,有机材料层通常由多层结构构成,所述多层结构由不同材料构成,并且例如可以包括空穴注入层、空穴传输层、发射层、电子传输层、电子注入层等。
用作有机电气元件中的有机材料层的材料可以根据其功能分为发光材料和电荷传输材料,例如空穴注入材料、空穴传输材料、电子传输材料、电子注入材料等。
包含杂原子的双型环状化合物的性质根据材构料结具有非常大的差异,并且因此被应用于各种层作为有机电气元件的材料。具体地,根据环的数量和稠合位置以及杂原子的类型和布置,带间隙(homo、lumo)、电性质、化学性质和物理性质是不同的,因此已经发展了对使用所述化合物的各种有机电气元件的层的应用开发。
在使用磷光掺杂剂材料的磷光有机电气元件中,主体材料的lumo和homo能级对有机电气元件的效率和寿命具有很大影响,并且根据是否能够有效地控制发射层中的电子和空穴注入、发射层中的电荷平衡、掺杂剂淬灭,可以防止由于空穴传输层界面处的光发射而导致的效率和寿命的降低。
对于荧光和磷光主体材料,近来我们已经研究了使用tadf(热激活延迟荧光)、激态络合物等提高有机电气元件的效率和寿命,具体地,已经进行了许多研究以确定从主体材料至掺杂剂材料的能量传递方法。
尽管存在用于确定tadf(热激活延迟荧光)和激态络合物的发射层中的能量传递的各种方法,但可以通过pl寿命(trtp)测量方法容易地确认。
trtp(时间分辨瞬态pl)测量方法是在将脉冲光源照射到主体薄膜上之后观察衰减时间的方法,并且是可以通过观察能量传递和发射延迟时间来确定能量传递方法的测量方法。trtp测量是能够区分荧光和磷光,以及混合主体材料的能量传递方法、激态络合物能量传递方法和tadf能量传递方法的测量方法。
如此,根据能量如何从主体材料传递至掺杂剂材料,存在影响效率和寿命的各种因素。
由于能量传递方法根据材料的不同而不同,因此没有充分地进行用于有机电气元件的稳定且有效的主体材料的开发。因此,持续需要开发新材料,并且尤其迫切地需要开发用于发射层的主体材料。
参考文献kr101170666b1用作现有技术文献。
本发明的详细描述
技术实现要素:
为了解决磷光主体材料的问题提出了本发明,并且本发明的目的在于通过控制包括磷光掺杂剂的磷光发射有机电气元件的主体材料的homo能级,以提供能够控制电荷平衡并且改善发射层中的效率和寿命的化合物,以及使用所述化合物的有机电气元件及其电子装置。
技术方案
为了控制磷光发射有机电气元件的发射层中的有效空穴注入,通过包含与作为主要成分的第一主体材料组合的第二主体材料,可以减小发射层与相邻层之间的能量势垒,并且使发射层中的电荷平衡最大化,以提供有机电气元件的高效率和高寿命。
本发明提供了有机电气元件,其包括第一电极、第二电极,以及形成在所述第一电极与所述第二电极之间的有机材料层,其中所述有机材料层包括发射层,其中所述发射层是磷光发射层并且包含由式1表示的第一主体化合物和由式2表示的第二主体化合物。
本发明还提供了有机电气元件和使用所述由式表示的化合物的电子装置。
发明效果
通过使用根据本发明的混合物作为磷光主体材料,可以实现有机电气元件的高发光效率和低驱动电压,并且可以大大改善装置的寿命。
附图说明
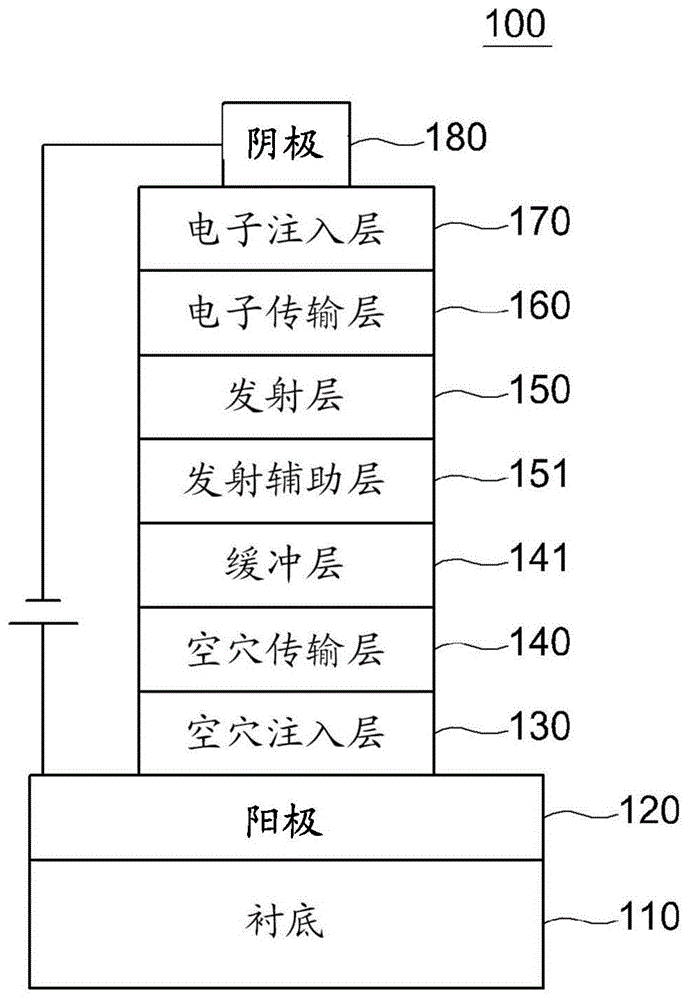
图1是根据本发明的有机电致发光装置的示例。
100:有机电气元件,110:衬底
120:第一电极(阳极),130:空穴注入层
140:空穴传输层,141:缓冲层
150:发射层,151:发射辅助层
160:电子传输层,170:电子注入层
180:第二电极(阴极)
具体实施方式
在下文,将详细地描述本发明的一些实施方案。此外,在本发明的以下描述中,当在本文中并入已知功能和配置可能使本发明的主题相当不清楚时,将省略其详细描述。
此外,当描述本发明的组件时,本文可以使用诸如第一、第二、a、b、(a)、(b)等术语。这些术语中的每一个不用于限定相应组件的实质、顺序或次序,而仅用于区分相应组件与其它组件。应注意,如果组件被描述为“连接”、“联接”或“连接”至另一个组件,则该组件可以直接连接或联接至另一个组件,但在各组件之间可以“连接”、“联接”或“连接”其它组件。
如说明书和所附权利要求书中使用,除非另外说明,否则以下是如下术语的含义。
除非另外说明,否则如本文使用的术语“卤代”或“卤素”包括氟、溴、氯或碘。
除非另外说明,否则如本文使用的术语“烷基”或“烷基基团”具有1个至60个碳原子的单键,并且意指饱和脂肪族官能团,包括直链烷基基团、支链烷基基团、环烷基基团(脂环族)、被烷基取代的环烷基基团或被环烷基取代的烷基基团。
除非另外说明,否则如本文使用的术语“卤代烷基”或“卤烷基”包括被卤素取代的烷基基团。
除非另外说明,否则如本文使用的术语“杂烷基”意指构成烷基的一个或多个碳原子被杂原子取代的烷基。
除非另外说明,否则如本文使用的术语“烯基”或“炔基”具有2个至60个碳原子的双键或三键,但不限于此,并且包括直链或支链基团。
除非另外说明,否则如本文使用的术语“环烷基”意指形成具有3个至60个碳原子的环的烷基,但不限于此。
除非另外说明,否则如本文使用的术语“烷氧基”、“烷氧基基团”或“烷基氧基基团”意指氧基连接至烷基基团,并且具有1个至60个碳原子,但不限于此。
除非另外说明,否则如本文使用的术语“烯氧基”、“烯氧基基团”或“烯基氧基基团”意指氧基连接至烯基基团,并且具有2个至60个碳原子,但不限于此。
除非另外说明,否则如本文使用的术语“芳基氧基基团”或“芳氧基基团”意指氧基连接至芳基基团,并且具有6个至60个碳原子,但不限于此。
除非另外说明,否则如本文使用的术语“芳基基团”或“亚芳基基团”具有6个至60个碳原子,但不限于此。在本文,芳基基团或亚芳基基团意指单环和多环芳香族基团,并且也可以与相邻基团结合而形成。“芳基基团”的实例可以包括苯基基团、联苯基基团、芴基团或螺芴基团。
前缀“芳基”或“芳”意指被芳基基团取代的基团。例如,芳基烷基可以是被芳基取代的烷基,并且芳基烯基可以是被芳基取代的烯基,并且被芳基取代的基团具有如本文定义的碳原子数。
此外,当前缀依次命名时,这意味着取代基以首先描述的顺序列出。例如,芳基烷氧基意指被芳基取代的烷氧基,烷氧基羰基意指被烷氧基取代的羰基,并且芳基羰基烯基也意指被芳基羰基取代的烯基,其中芳基羰基可以是被芳基取代的羰基。
除非另外说明,否则如本文使用的术语“杂烷基”意指含有一个或多个杂原子的烷基。除非另外说明,否则如本文使用的术语“杂芳基基团”或“亚杂芳基基团”意指含有一个或多个杂原子的c2至c60芳基或亚芳基基团,但不限于此,并且包括单环和多环中的至少一个,并且还可以与相邻基团结合而形成。
除非另外说明,否则如本文使用的术语“杂环基团”含有一个或多个杂原子,具有2个至60个碳原子,但不限于此,包括单环和多环中的任一个,并且可以包括杂脂肪族环和/或杂芳香族环。此外,也可以与相邻基团结合而形成杂环基团。
除非另外说明,否则如本文使用的术语“杂原子”表示n、o、s、p或si中的至少一个。
此外,术语“杂环基团”可以包括含有so2代替构成环的碳的环。例如,“杂环基团”包括以下化合物。
除非另外说明,否则如本文使用的术语“脂肪族”意指具有1个至60个碳原子的脂肪族烃,并且如本文使用的术语“脂肪族环”意指具有3个至60个碳原子的脂肪族烃环。
除非另外说明,否则如本文使用的术语“环”意指具有3个至60个碳原子的脂肪族环、或具有6个至60个碳原子的芳香族环、或具有2个至60个碳原子的杂环、或通过它们的组合而形成的稠环,并且包括饱和环或不饱和环。
除了以上提及的杂化合物以外,其它杂化合物或杂基团包含但不限于一个或多个杂原子。
除非另外说明,否则如本文使用的术语“羰基”由-cor'表示,其中r'可以是氢、具有1个至20个碳原子的烷基、具有6个至30个碳原子的芳基、具有3个至30个碳原子的环烷基、具有2个至20个碳原子的烯基、具有2个至20个碳原子的炔基、或这些的组合。
除非另外说明,否则如本文使用的术语“醚”由-r-o-r'表示,其中r或r'可以独立地是氢、具有1个至20个碳原子的烷基、具有6个至30个碳原子的芳基、具有3个至30个碳原子的环烷基、具有2个至20个碳原子的烯基、具有2个至20个碳原子的炔基或这些的组合。
除非另外说明,否则如本文使用的术语“取代或未取代的”意指取代基被至少一个取代基取代,所述至少一个取代基包括但不限于氘、氢、卤素、氨基基团、腈基团、硝基基团、c1-c20烷基基团、c1-c20烷氧基基团、c1-c20烷基胺基团、c1-c20烷基噻吩基团、c6-c20芳基噻吩基团、c2-c20烯基基团、c2-c20炔基基团、c3-c20环烷基基团、c6-c20芳基基团、被氘取代的c6-c20芳基基团、c8-c20芳基烯基基团、硅烷基团、硼基团、锗基团和c2-c20杂环基团。
除非另外明确说明,否则如本文使用的本发明中使用的式以与根据以下式的指数的定义的取代基定义相同的方式应用。
在此,当a是0的整数时,这意指取代基r1不存在,即,当a是0时,这意指所有氢结合至形成苯环的碳,并且在这种情况下,可以省略结合至碳的氢的显示,并且可以描述化学式或化合物。
当a是1的整数时,一个取代基r1结合至形成苯环的碳中的任一个,并且当a是2或3的整数时,它们分别结合如下,其中r1可以彼此相同或不同,并且当a是4至6的整数时,其以类似的方式结合至苯环的碳,却省略了结合至形成苯环的碳的氢的符号。
在下文,将描述根据本发明的方面的化合物和包含所述化合物的有机电气元件。
本发明提供了有机电气元件,其包括第一电极、第二电极,以及形成在第一电极与第二电极之间的有机材料层,其中有机材料层包括发射层,其中发射层包含由式1表示的第一主体化合物和由式2表示的第二主体化合物作为所述磷光发射层。
{在式1和式2中,
1)ar1、ar2、ar3、ar4、ar5、ar6和ar7各自独立地选自氢;氘;卤素;c6-c60芳基基团;芴基基团;包含o、n、s、si、p中的至少一个杂原子的c2-c60杂环基团;c3-c60脂肪族环和c6-c60芳香族环的稠环基团;c1-c50烷基基团;c2-c20烯基基团;c2-c20炔基基团;c1-c30烷氧基基团;c6-c30芳氧基基团;和-l'-n(ra)(rb);并且ar1和ar2或ar3和ar4可以彼此结合以形成环,
2)其中,l'选自单键;c6-c60亚芳基基团;亚芴基基团;c3-c60脂肪族环和c6-c60芳香族环的稠环基团;和c2-c60杂环,并且ra和rb各自独立地选自c6-c60芳基基团;芴基基团;c3-c60脂肪族环和c6-c60芳香族环的稠环基团;和含有o、n、s、si和p中的至少一个杂原子的c2-c60杂环基团,
3)l1、l2、l3、l4和l5独立地选自单键;c6-c60亚芳基基团;亚芴基基团;或含有o、n、s、si和p中的至少一个杂原子的c2-c60亚杂芳基基团;
4)x1是o或s,
5)环a和环b独立地是c6-c60芳基基团;或c2-c20杂环基团,
6)x2是单键、n-l6-ar7、o、s或cr'r”,
其中r'和r”独立地是氢;c6-c60芳基基团;芴基基团;c3-c60杂环基团;或c1-c50烷基基团;r'和r”可以彼此结合以形成螺环,
7)x是0至4的整数,y是0至3的整数,rc和rd各自独立地选自氢;c6-c60芳基基团;芴基基团;包含o、n、s、si和p中的至少一个杂原子的c2-c60杂环基团;c3-c60脂肪族环和c6-c60芳香族环的稠环基团;c1-c50烷基基团;c2-c20烯基基团;c2-c20炔基基团;c1-c30烷氧基基团;c6-c30芳氧基基团;和-l'-n(ra)(rb),
8)其中,芳基基团、芴基基团、亚芳基基团、杂环基团、亚芴基基团、稠环基团、烷基基团、烯基基团、烷氧基基团和芳氧基基团可以是被一个或多个取代基取代的,所述一个或多个取代基选自氘;卤素;硅烷基团;硅氧烷基团;硼基团;锗基团;氰基基团;硝基基团;c1-c20烷硫基基团;c1-c20烷氧基基团;c1-c20烷基基团;c2-c20烯基基团;c2-c20炔基基团;c6-c20芳基基团;被氘取代的c6-c20芳基基团;芴基基团;c2-c20杂环基团;c3-c20环烷基基团;c7-c20芳基烷基基团和c8-c20芳基烯基基团,其中所述取代基可以彼此结合以形成饱和或不饱和环,其中术语“环”意指c3-c60脂肪族环或c6-c60芳香族环或c2-c60杂环基团或通过其组合而形成的稠环。
此外,本发明提供了有机电气元件,其中式1中的a和b各自独立地包括由以下式a-1至式a-7中的任一种表示的化合物
在式a-1至式a-7中,
z1至z48各自独立地是crc或n,
结合至l1至l3的z1至z48是碳(c),
rc与ra的定义相同,
*表示待缩合的位置。
本发明提供了包含以下化合物的有机电气元件,其中式1或式2中的l1至l5由以下式b-1至式b-13中的任一种表示。
在式b-1至式b-13中,
y是n-l5-ar7、o、s或crdre,
l5与l3的定义相同,
ar7与ar5的定义相同,
rd和re与ra的定义相同,
a、c、d和e各自独立地是0至4的整数,b是0至6的整数,
f和g各自独立地是0至3的整数,h是0至2的整数,i是0或1的整数,
r1、r2和r3各自独立地是氢;氘;氚;卤素;氰基基团;硝基基团;c6-c60芳基基团;芴基基团;包含o、n、s、si或p中的至少一个杂原子的c2-c60杂环基团;c3-c60脂肪族环和c6-c60芳香族环的稠环基团;c1-c50烷基基团;c2-c20烯基基团;c2-c20炔基基团;c1-c30烷氧基基团;c6-c30芳氧基基团;和-la-n(rf)(rg);或者在a、b、c、d、e、f和g是2或更大,并且h是2或更大的情况下,多个的每者彼此相同或不同,并且多个r1或多个r2或多个r3,或相邻的r1和r2,或相邻的r2和r3可以彼此结合以形成芳香族环或杂芳香族环,
其中,la选自单键;c6-c60亚芳基基团;亚芴基基团;含有o、n、s、si和p中的至少一个杂原子的c2-c60杂环基团;c3-c60脂肪族环和c6-c60芳香族环的稠环基团;和c3-c60脂肪族烃基团;
rf和rg各自独立地选自c6-c60芳基基团;芴基基团;含有o、n、s、si和p中的至少一个杂原子的c2-c60杂环基团;c3-c60脂肪族环和c6-c60芳香族环的稠环基团,
z49、z50和z51各自独立地是crh或n,
z4、z50和z51中的至少一个是n,
rh选自氢;氘;氚;卤素;氰基基团;硝基基团;c6-c60芳基基团;芴基基团;包含o、n、s、si或p中的至少一个杂原子的c2-c60杂环基团;c3-c60脂肪族环和c6-c60芳香族环的稠环基团;c1-c50烷基基团;c2-c20烯基基团;c2-c20炔基基团;c1-c30烷氧基基团;c6-c30芳氧基基团;并且相邻的r1和rh可以彼此结合以形成芳香族环或杂芳香族环。
本发明提供了化合物,其中由式1表示的第一主体化合物包括由以下式3至式5中的任一种表示的化合物。
式3
式4
式5
在式3至式5中,
x1、a、b、l1、l2、ar2、ar3和ar4与以上定义的相同,
c和d与a的定义相同,
w是n-l7-ar8、o、s或crirj,
l6和l7与l4的定义相同,
ar8与ar5的定义相同,
ri和rj与ra的定义相同,
两个ar8各自相同或不同,两个w各自相同或不同,两个c各自相同或不同,两个d各自相同或不同。
本发明提供了化合物,其中由式1表示的第一主体化合物包括由式6表示的化合物。
式6
在式6中,
x1、ar2、ar3和ar4与以上定义的相同,
z1、z2、z3和z4各自独立地是crc或n,
结合至n的z1至z4是碳(c),
rc与ra的定义相同,
w是n-l7-ar8、o、s或crirj,
l7与l4的定义相同,
ar8与ar5的定义相同,
ri和rj与ra的定义相同。
在本发明中,作为另一个实例,由式1表示的第一主体化合物包括由式7或式8或式9表示的化合物。
式7
式8
式9
在式7至式9中,
x1、ar2、ar3和ar4,z1、z2、z3、z4和w与以上定义的相同。
在另一个方面中,由式2表示的第二主体化合物包括由式10至式13中的任一种表示的化合物。
在式10至式13中,
x2、l3、l4、l5、ar5、ar6、rc、rd、x、y与以上定义的相同。
此外,由式2表示的第二主体化合物包括由式14表示的化合物。
式14
在式14中,
1)x2、l3、l4、l5、ar5、rc、rd、x、y与以上定义的相同,
2)x3与x2的定义相同,
3)re和rf与rd和rc的定义相同,
4)n与y的定义相同,m与x的定义相同。
由式2表示的第二主体化合物包括由式15至式18表示的化合物。
在式15至式18中,
x2、l3、l4、l5、ar5、rc、rd、x、y、x3、re、rf、m、n与以上定义的相同。
此外,由式2表示的化合物包括由式19表示的化合物。
式19
在式19中,
a是以下式a-1或式a-2,
x11和x12各自独立地是o或s,
a'、b'、c'和d'各自独立地是0或1,
ar11、ar12、ar13和ar14各自独立地是c6-c18芳基基团。
由式19表示的化合物包括由以下式20或式21表示的化合物。
在式20和式21中,
x11、x12、a'、b'、c'和d'与以上定义的相同。
作为另一个实例,由式2表示的化合物包括由式22表示的化合物。
这些化合物可以与诸如双咔唑、叔胺和多环杂环化合物的第二主体混合以用于发射层中。
<式22>
在式22中,
a是以下式a-1或式a-2,
ar11是c6-c18芳基基团,
x11、x12和x13各自独立地是o或s,
m'和n'各自独立地是0或1,
a'和c'各自独立地是0至5中的任一个的整数,
d'是0至4中的任一个的整数,
r21是c6-c18芳基基团,
ar13和ar14各自独立地是c6-c18芳基基团。
此外,由式22表示的化合物可以由以下式23或式24表示。
在式23和式24中,
x11、x12、x13、a'、c'、d'、m'、n'、ar13、ar14、r21与以上定义的相同。
包括在式2中的化合物可以与诸如双咔唑、叔胺和多环杂环化合物的第二主体混合以用于发射层,并且更具体地,可以使用包括在式19或式22中的化合物。
作为另一个实例,由式1表示的第一主体化合物包括化合物1-1至化合物1-175。
作为另一个实例,由式2表示的第二主体化合物包括以下化合物。即,化合物1'-1至化合物1'-84、化合物2-1至化合物2-60、化合物3-1至化合物3-36、化合物p-1至化合物p-120、化合物4-1至化合物4-12、化合物5-1至化合物5-20、化合物6-1至化合物6-16和化合物7-1至化合物7-24。
参考图1,根据本发明的有机电气元件(100)包括形成在衬底(110)上的第一电极(120)、第二电极(180)以及在第一电极(120)与第二电极(180)之间的包含由式1表示的化合物的有机材料层。在此,第一电极(120)可以是阳极(正电极),并且第二电极(180)可以是阴极(负电极)。在倒置的有机电气元件的情况下,第一电极可以是阴极,并且第二电极可以是阳极。
有机材料层可以包括依次形成在第一电极(120)上的空穴注入层(130)、空穴传输层(140)、发射层(150)、发射辅助层(151)、电子传输层(160)和电子注入层(170)。在此,可以不形成除了发射层(150)以外的其余层。有机材料层可以还包括空穴阻挡层、电子阻挡层、发射辅助层(151)、电子传输辅助层、缓冲层(141)等,并且电子传输层(160)等可以起空穴阻挡层的作用。
尽管未示出,但根据本发明的有机电气元件可以还包括形成在第一电极和第二电极的至少一侧上的保护层,该侧是与有机材料层相对的一侧。
否则,即使使用相同的核,带间隙、电特性、界面特性等也可以根据哪种取代基结合在哪个位置处而变化,因此,核和与其相关的sub-取代体的组合的选择也是非常重要的,特别是,当实现各有机材料层的能级和t1值以及材料的独特性质(迁移率、界面特性等)的最佳组合时,可以同时实现长寿命和高效率。
根据本发明的实施方案的有机电致发光装置可以使用pvd(物理气相沉积)方法制造。例如,通过在衬底上沉积金属或导电金属氧化物或其合金来形成阳极,并且在其上形成包括空穴注入层(130)、空穴传输层(140)、发射层(150)、电子传输层(160)和电子注入层(170)的有机材料层之后,可以通过在其上沉积可以用作阴极的材料来制造根据本发明的实施方案的有机电致发光装置。
此外,还可以在空穴传输层(140)与发射层(150)之间形成发射辅助层(151),并且还可以在发射层(150)与电子传输层(160)之间形成电子传输辅助层。
因此,本发明包括在第一电极与发射层之间的至少一个空穴传输层,其中空穴传输层包括空穴传输层、发射辅助层或两者,并且其中空穴传输层包含由式1表示的化合物。
此外,由式1和式2表示的化合物以1:9至9:1中的任一个的比率混合以包含在发射层中,优选地以1:9至5:5的比例混合,更优选地以2:8或3:7的比例混合以包含在发射层中。
本发明还可以包括形成在第一电极的与有机材料层相对侧的一侧或第二电极的与有机材料层相对侧的一侧中的至少一侧上的光效率增强层。
此外,通过旋涂工艺、喷嘴印刷工艺、喷墨印刷工艺、狭涂工艺、浸涂工艺或辊对辊工艺中的一种形成有机材料层,并且由于根据本发明的有机材料层可以通过各种方法形成,所以本发明的范围不受形成有机材料层的方法限制。
根据本发明的实施方案的有机电气元件可以根据使用的材料是前发射型、后发射型或双侧发射型。
woled(白色有机发光装置)易于实现高分辨率和优异的可加工性,同时具有可以使用现有lcd滤色器技术制造的优点。主要用作背光装置的白色有机发光装置的各种结构已经被提出并且授予专利。通常,r(红色)、g(绿色)、b(蓝色)发光部件以并排的方式布置,并且r发光层、g发光层、b发光层上下堆叠,并且通过有机发射层蓝色(b)电致发光,以及利用使用来此的光的无机磷光体的光致发光的颜色转换材料(ccm)方法以及本发明可以应用于此类woled。
本发明还提供了电子装置,其包括具有有机电气元件的显示装置;以及用于驱动显示装置的控制单元。
根据另一个方面,本发明提供了电子装置,其中有机电气元件是oled、有机太阳能电池、有机光导体、有机晶体管和用于单色或白色照明的元件中的至少一个。此时,电子装置可以是当前使用或未来将使用的有线/无线通信终端,并且涵盖所有种类的包括移动通信终端的电子装置,例如便携式电话、个人数字助理(pda)、电子词典、点对多点(pmp)、远程控制器、导航单元、游戏机、各种种类的电视以及各种种类的计算机。
在下文,将通过实施例的方式详细地描述根据本发明的由式1和式2表示的化合物的合成例和本发明的有机电气元件的制备例,但不限于本发明的以下实施例。
[合成例1]
可以如以下反应方案1中所示通过sub1与sub2之间的反应来合成根据本发明的由式1表示的最终产物1,但不限于此。x1、a、b、l1、l2、ar1或ar4可以与式1中定义的相同,并且hal1是br或cl。
<反应方案1>
i.sub1的合成例
通过以下反应方案2的反应路径合成反应方案1的sub1,但不限于此。
<反应方案2>
1.sub1-1的合成例
将起始材料sub2-1(15.22g,89.94mmol)加入到圆底烧瓶中并且溶解在甲苯(750ml)中,加入sub1-1-c(cas登记号:669773-34-6)(46.14g,134.91mmol)、pd2(dba)3(2.47g,2.70mmol)、p(t-bu)3(1.46g,7.19mmol)、naot-bu(25.93g,269.81mmol)并且在80℃搅拌。在反应完成之后,用ch2cl2和水萃取反应混合物。将有机层经mgso4干燥并且浓缩。将所得化合物通过硅胶柱色谱分离并且重结晶以获得23.61g的产物。(产率:61%)
2.sub1-3的合成例
向起始材料sub2-12(13.94g,63.57mmol)中加入sub1-3-e(cas登记号:201138-91-2)(31.08g,95.35mmol)、pd2(dba)3(1.75g,1.91mmol)、p(t-bu)3(1.03g,5.09mmol)、naot-bu(18.33g,190.71mmol)、甲苯(530ml),进行与sub1-1的合成方法中描述的相同步骤以获得19.78g的产物。(产率:67%)。
3.sub1-5的合成例
(1)sub1-5-a的合成
将起始材料(2-溴-6-碘苯基)(乙基)硫烷(9.94g,28.98mmol)加入到圆底烧瓶中并且溶解在thf(100ml)中,加入(4-氯苯基)硼酸(4.53g,28.98mmol)、pd(pph3)4(1.00g,0.87mmol)、naoh(2.32g,57.96mmol)、水(50ml)并且在80℃搅拌。在反应完成之后,用ch2cl2和水萃取反应混合物。将有机层经mgso4干燥并且浓缩。将所得化合物通过硅胶柱色谱分离并且重结晶以获得8.55g的产物。(产率:90%)
(2)sub1-5-b的合成
向以上合成中获得的sub1-5-a(8.55g,26.09mmol)中加入乙酸(90ml),加入35%过氧化氢(h2o2)(2.66g,78.28mmol)并且在室温搅拌。当反应完成时,在用naoh水溶液中和之后,用ea进行萃取并且用水洗涤。将有机层经mgso4干燥并且浓缩。将所得化合物通过硅胶柱色谱分离以获得8.70g的产物。(产率:97%)
(3)sub1-5-c的合成
向以上合成中获得的sub1-5-b(8.70g,25.32mmol)中加入硫酸(h2so4)(50ml)并且在室温搅拌。当反应完成时,在用naoh水溶液中和之后,用mc进行萃取并且用水洗涤。将有机层经mgso4干燥并且浓缩。将所得化合物通过硅胶柱色谱分离以获得7.16g的产物。(产率:95%)
(4)sub1-5的合成
将获得的sub1-5-c(7.16g,24.06mmol)加入到圆底烧瓶中并且溶解在甲苯(240ml)中,加入sub2-11(5.28g,24.06mmol)、pd2(dba)3(0.66g,0.72mmol)、p(t-bu)3(0.49g,2.41mmol)、naot-bu(4.62g,48.12mmol)并且在80℃搅拌。在反应完成之后,用ch2cl2和水萃取反应混合物。将有机层经mgso4干燥并且浓缩。将所得化合物通过硅胶柱色谱分离并且重结晶以获得8.08g的产物。(产率:77%)
4.sub1-17的合成例
(1)sub1-17-a的合成
在起始材料(4-溴-2-碘苯基)(乙基)硫烷(10.65g,31.05mmol)中加入(4-氯-[1,1'-联苯]-2-基)硼酸(7.22g,31.05mmol)、pd(pph3)4(1.08g,0.93mmol)、naoh(2.48g,62.10mmol)、thf(100ml)、水(50ml),并且进行与sub1-5-a的合成方法中描述的相同步骤以获得9.90g的产物。(产率:79%)。
(2)sub1-17-b的合成
将在以上合成中获得的sub1-17-a(9.90g,24.52mmol)、乙酸(80ml)、35%过氧化氢(h2o2)(2.50g,73.56mmol)用于sub1-5-b的合成方法。因此,获得产物9.78g(产率:95%)。
(3)sub1-17-c的合成
将在以上合成中获得的sub1-17-b(9.78g,23.30mmol)用于sub1-5-c的合成方法。因此,获得产物7.84g(产率:90%)。
(4)sub1-17的合成
向在以上合成中获得的sub1-17-c(7.84g,20.98mmol)中加入sub2-78(7.02g,20.98mmol)、pd2(dba)3(0.58g,0.63mmol)、p(t-bu)3(0.42g,2.10mmol)、naot-bu(4.03g,41.96mmol)和甲苯(210ml),并且进行与sub1-5的合成方法中描述的相同步骤以获得10.79g的产物。(产率:82%)。
5.sub1-82的合成例
在起始材料sub2-1(16.48g,97.38mmol)中,加入sub1-82-c(cas登记号:83834-10-0)(49.96g,146.07mmol)、pd2(dba)3(2.68g,2.92mmol)、p(t-bu)3(1.58g,7.79mmol)、naot-bu(28.08g,292.15mmol)、甲苯(810ml),并且进行与sub1-1的合成方法中描述的相同步骤以获得26.40g的产物。(产率:63%)。
6.sub1-102的合成例
(1)sub1-102-d的合成
在起始材料4-溴-2-碘苯酚(39.85g,133.32mmol)中加入(2-氯苯基)硼酸(20.85g,133.32mmol)、pd(pph3)4(4.62g,4.00mmol)、naoh(10.67g,266.64mmol)、thf(440ml)、水(220ml),并且进行与sub1-5-a的合成方法中描述的相同步骤以获得28.73g的产物。(产率:76%)。
(2)sub1-102-e的合成
向在以上合成中获得的sub1-102-d(28.73g,101.32mmol)中加入pd(oac)2(2.27g,10.13mmol)、3-硝基吡啶(1.26g,10.13mmol)、bzootbu(过氧化苯甲酸叔丁酯)(39.36g,202.65mmol)、c6f6(六氟苯)(150ml)、dmi(n,n'-二甲基咪唑烷酮)(100ml)并且在90℃回流3小时。当反应完成时,将反应产物的温度冷却至室温,用ea萃取,并且用水洗涤。将有机层经mgso4干燥并且浓缩,并且使用硅胶柱分离所得有机材料以获得13.69g(48%)的产物。
(3)sub1-102的合成
向在以上合成中获得的sub1-102-e(13.69g,48.63mmol)中加入sub2-29(13.39g,48.63mmol)、pd2(dba)3(1.34g,1.46mmol)、p(t-bu)3(0.98g,4.86mmol)、naot-bu(9.35g,97.25mmol)、甲苯(490ml),并且进行与sub1-5的合成方法中描述的相同步骤以获得19.67g的产物。(产率:85%)。
7.sub1-104的合成例
向起始材料sub2-1(9.15g,54.04mmol)中加入sub1-104-c(cas登记号:31574-87-5)(27.73g,81.07mmol)、pd2(dba)3(1.48g,1.62mmol)、p(t-bu)3(0.87g,4.32mmol)、naot-bu(15.58g,162.13mmol)、甲苯(450ml),并且进行与sub1-1的合成方法中描述的相同步骤以获得15.12g的产物。(产率:65%)。
8.sub1-112的合成例
(1)sub1-112-a的合成
在起始材料(3-溴-2-碘苯基)(以及)硫烷(12.73g,37.11mmol)中加入(2-氯苯基)硼酸(5.80g,37.11mmol)、pd(pph3)4(1.29g,1.11mmol)、naoh(2.97g,74.22mmol)、thf(120ml)、水(60ml),并且进行与sub1-5-a的合成方法中描述的相同步骤以获得9.48g的产物。(产率:78%)。
(2)sub1-112-b的合成
加入在以上合成中获得的sub1-112-a(9.48g,28.93mmol)、乙酸(95ml)、35%过氧化氢(h2o2)(2.95g,86.80mmol),并且进行与sub1-5-b的合成方法中描述的相同步骤以获得9.74g的产物。(产率:98%)。
(3)sub1-112-c的合成
加入在以上合成中获得的sub1-112-b(9.74g,28.34mmol)、硫酸(h2so4)(60ml),并且进行与sub1-5-c的合成方法中描述的相同步骤以获得7.76g的产物。(产率:92%)。
(4)sub1-112的合成
向在以上合成中获得的sub1-112-c(7.76g,26.08mmol)中加入sub2-1(4.41g,26.08mmol)、pd2(dba)3(0.72g,0.78mmol)、p(t-bu)3(0.53g,2.61mmol)、naot-bu(5.01g,52.15mmol)、甲苯(260ml),并且进行与sub1-5的合成方法中描述的相同步骤以获得5.84g的产物。(产率:58%)。
属于sub1的化合物可以是如下化合物,但不限于此,并且表1显示了属于sub1的一些化合物的fd-ms(场解吸-质谱)值。
[表1]
ii.sub2的合成
反应方案3的sub2可以通过以下反应方案3的反应路径合成(在本申请人的韩国专利注册号10-1251451(于2013年4月5日注册)中开始),但不限于此。
z1是ar1或ar3,z2是ar2或ar4。
<反应方案3>
属于sub2的化合物可以是以下化合物,但不限于此,并且表2显示了属于sub2的一些化合物的fd-ms(场解吸-质谱)值。
[表2]
iii.最终产物的合成
在用甲苯在圆底烧瓶中溶解sub1(1当量)之后,将sub2(1当量)、pd2(dba)3(0.03当量)、(t-bu)3p(1.00当量)和naot-bu(2当量)在100℃搅拌。当反应完成时,将所得化合物用ch2cl2和水萃取,并且将有机层经mgso4干燥并且浓缩,并将所得化合物用硅胶柱重结晶以获得最终产物1。
通过在本申请人的韩国专利注册号10-1668448(于2016年10月17日注册)和韩国专利注册号10-1789998(于2017年10月19日注册)中公开的合成方法制造本发明的化合物1-30、化合物1-32、化合物1-35、化合物1-37、化合物1-67、化合物1-80、化合物1-86、化合物1-94、化合物1-111、化合物1-119、化合物1-133。
1.1-1的合成例
将获得的sub1-1(5.97g,13.87mmol)加入到圆底烧瓶中并且溶解在甲苯(140ml)中,加入sub2-17(3.74g,13.87mmol)、pd2(dba)3(0.38g,0.42mmol)、p(t-bu)3(0.28g,1.39mmol)、naot-bu(2.67g,27.74mmol)并且在100℃搅拌。在反应完成之后,用ch2cl2和水萃取反应混合物。将有机层经mgso4干燥并且浓缩。将所得化合物通过硅胶柱色谱分离并且重结晶以获得6.09g的产物。(产率:71%)
2.1-2的合成例
向在以上合成中获得的sub1-1(5.29g,12.29mmol)中加入sub2-37(4.32g,12.29mmol)、pd2(dba)3(0.34g,0.37mmol)、p(t-bu)3(0.25g,1.23mmol)、naot-bu(2.36g,24.58mmol)、甲苯(125ml),并且进行与1-1的合成方法中描述的相同步骤以获得6.81g的产物。(产率:79%)。
3.1-4的合成例
向在以上合成中获得的sub1-3(6.13g,13.20mmol)中加入sub2-41(4.08g,13.20mmol)、pd2(dba)3(0.36g,0.40mmol)、p(t-bu)3(0.27g,1.32mmol)、naot-bu(2.54g,26.40mmol)、甲苯(130ml),并且进行与1-1的合成方法中描述的相同步骤以获得7.32g的产物。(产率:80%)。
4.1-10的合成例
向在以上合成中获得的sub1-5(5.56g,12.75mmol)中加入sub2-43(4.28g,12.75mmol)、pd2(dba)3(0.35g,0.38mmol)、p(t-bu)3(0.26g,1.28mmol)、naot-bu(2.45g,25.51mmol)、甲苯(130ml),并且进行与1-1的合成方法中描述的相同步骤以获得8.06g的产物。(产率:86%)。
5.1-24的合成例
向在以上合成中获得的sub1-17(6.18g,9.85mmol)中加入sub2-1(1.67g,9.85mmol)、pd2(dba)3(0.27g,0.30mmol)、p(t-bu)3(0.20g,0.99mmol)、naot-bu(1.89g,19.71mmol)、甲苯(100ml),并且进行与1-1的合成方法中描述的相同步骤以获得5.62g的产物。(产率:75%)。
6.1-122的合成例
向在以上合成中获得的sub1-82(5.05g,11.73mmol)中加入sub2-49(4.12g,11.73mmol)、pd2(dba)3(0.32g,0.35mmol)、p(t-bu)3(0.24g,1.17mmol)、naot-bu(2.26g,23.47mmol)、甲苯(120ml),并且进行与1-1的合成方法中描述的相同步骤以获得7.65g的产物。(产率:93%)。
7.1-125的合成例
向在以上合成中获得的sub1-82(5.20g,12.08mmol)中加入sub2-40(3.13g,12.08mmol)、pd2(dba)3(0.33g,0.36mmol)、p(t-bu)3(0.24g,1.21mmol)、naot-bu(2.32g,24.17mmol)、甲苯(120ml),并且进行与1-1的合成方法中描述的相同步骤以获得6.69g的产物。(产率:91%)。
8.1-141的合成例
向在以上合成中获得的sub1-102(6.26g,13.15mmol)中加入sub2-1(2.23g,13.15mmol)、pd2(dba)3(0.36g,0.39mmol)、p(t-bu)3(0.27g,1.32mmol)、naot-bu(2.53g,26.30mmol)、甲苯(130ml),并且进行与1-1的合成方法中描述的相同步骤以获得6.57g的产物。(产率:82%)。
9.1-146的合成例
向在以上合成中获得的sub1-104(6.12g,14.22mmol)中加入sub2-83(5.84g,14.22mmol)、pd2(dba)3(0.39g,0.43mmol)、p(t-bu)3(0.29g,1.42mmol)、naot-bu(2.73g,28.43mmol)、甲苯(140ml),并且进行与1-1的合成方法中描述的相同步骤以获得8.00g的产物。(产率:74%)。
10.1-158的合成例
向在以上合成中获得的sub1-112(5.75g,14.90mmol)中加入sub2-29(4.10g,14.90mmol)、pd2(dba)3(0.41g,0.45mmol)、p(t-bu)3(0.30g,1.49mmol)、naot-bu(2.86g,29.80mmol)、甲苯(150ml),并且进行与1-1的合成方法中描述的相同步骤以获得6.24g的产物。(产率:67%)。
同时,根据以上描述的合成例制备的本发明的化合物1-1至化合物1-175的fd-ms值显示于以下表3中。
[表3]
[合成例2]
可以通过如以下反应方案4中所示使sub3和sub4反应来制备根据本发明的由式2表示的化合物(最终产物),但不限于此。
<反应方案4>
1'-1的合成例
在将sub1(1)(34.7g,80mmol)和sub2(1)(30.9g,80mmol)、k2co3(19.3g,140mmol)、pd(pph3)4(2.8g,2.4mmol)置于圆底烧瓶之后,加入thf和水将其溶解,然后在80℃回流12小时。当反应完成时,将反应产物的温度冷却至室温,用ch2cl2萃取,并且用水洗涤。将有机层经mgso4干燥并且浓缩,并且使用硅胶柱分离所得有机材料以获得所需产物(37.4g,71%)。
1'-6的合成例
使用1'-1的合成方法,使用sub1(6)(44.6g,80mmol)和sub2(2)(30.9g,80mmol)以获得产物(43.2g,69%)。
1'-12的合成例
使用1'-1的合成方法,使用sub1(12)(42.7g,80mmol)和sub2(33)(34.9g,80mmol)以获得产物(42.7g,66%)。
1'-33的合成例
使用1'-1的合成方法,使用sub1(27)(40.8g,80mmol)和sub2(9)(43.1g,80mmol)以获得产物(51.0g,72%)。
1'-44的合成例
使用1'-1的合成方法,使用sub1(27)(40.8g,80mmol)和sub2(10)(37.0g,80mmol)以获得产物(45.4g,70%)。
1'-53的合成例
使用1'-1的合成方法,使用sub1(34)(44.0g,80mmol)和sub2(29)(29.6g,80mmol)以获得产物(41.2g,68%)。
1'-64的合成例
使用1'-1的合成方法,使用sub1(37)(48.2g,80mmol)和sub2(34)(34.9g,80mmol)以获得产物(45.6g,71%)。
1'-75的合成例
使用1'-1的合成方法,使用sub1(25)(34.7g,80mmol)和sub2(35)(41.8g,80mmol)以获得产物(46.4g,73%)。
2-1的合成例
使用1'-1的合成方法,使用sub1(1)(34.7g,80mmol)和sub2(27)(37.0g,80mmol)以获得产物(42.3g,72%)。
2-22的合成例
使用1'-1的合成方法,使用sub1(38)(50.7g,80mmol)和sub2(24)(37.0g,80mmol)以获得产物(51.6g,69%)。
2-33的合成例
使用1'-1的合成方法,使用sub1(27)(40.8g,80mmol)和sub2(36)(49.2g,80mmol)以获得产物(53.9g,70%)。
2-40的合成例
使用1'-1的合成方法,使用sub1(25)(34.7g,80mmol)和sub2(37)(43.1g,80mmol)以获得产物(44.7g,69%)。
2-51的合成例
使用1'-1的合成方法,使用sub1(33)(36.0g,80mmol)和sub2(38)(35.7g,80mmol)以获得产物(41.1g,70%)。
2-55的合成例
使用1'-1的合成方法,使用sub1(39)(42.1g,80mmol)和sub2(23)(37.0g,80mmol)以获得产物(44.9g,68%)。
2-58的合成例
使用1'-1的合成方法,使用sub1(25)(34.7g,80mmol)和sub2(39)(47.9g,80mmol)以获得产物(45.9g,66%)。
3-10的合成例
使用1'-1的合成方法,使用sub1(37)(28.6g,80mmol)和sub2(10)(37.0g,80mmol)以获得产物(38.9g,74%)。
p-41的合成例
将核2(5g,14mmol)、sub1(4.6g,15.2mmol)、pd(pph3)4(0.5g,0.4mmol)、k2co3(5.7g,41.3mmol)、thf和水加入到圆底烧瓶中并且在90℃搅拌。在反应完成之后,用ch2cl2和水萃取反应混合物。将有机层经mgso4干燥并且浓缩。将所得化合物通过硅胶柱色谱分离并且重结晶以获得4.6g的p-41。(产率:57%)
p-91的合成例
将核1(5g,14mmol)、sub9(5.8g,15.4mmol)、pd(pph3)4(0.5g,0.4mmol)、k2co3(5.8g,41.9mmol)、thf和水加入到圆底烧瓶中并且在90℃搅拌。在反应完成之后,用ch2cl2和水萃取反应混合物。将有机层经mgso4干燥并且浓缩。将所得化合物通过硅胶柱色谱分离并且重结晶以获得4.7g的p-91。(产率:51%)
p-106的合成例
将核1(5g,14mmol)、sub16(5.8g,15.4mmol)、pd(pph3)4(0.5g,0.4mmol)、k2co3(5.8g,41.9mmol)、thf和水加入到圆底烧瓶中并且在90℃搅拌。在反应完成之后,用ch2cl2和水萃取反应混合物。将有机层经mgso4干燥并且浓缩。将所得化合物通过硅胶柱色谱分离并且重结晶以获得5.8g的p-106。(产率:63%)
p-146的合成例
将核1(5g,14mmol)、sub2(5.8g,15.4mmol)、pd(pph3)4(0.5g,0.4mmol)、k2co3(5.8g,41.9mmol)、thf和水加入到圆底烧瓶中并且在90℃搅拌。在反应完成之后,用ch2cl2和水萃取反应混合物。将有机层经mgso4干燥并且浓缩。将所得化合物通过硅胶柱色谱分离并且重结晶以获得4.7g的p-146。(产率:51%)
p-4的合成例
将核1(5g,14mmol)、sub6(5.9g,15.4mmol)、pd(pph3)4(0.5g,0.4mmol)、k2co3(5.8g,41.9mmol)、thf和水加入到圆底烧瓶中并且在90℃搅拌。在反应完成之后,用ch2cl2和水萃取反应混合物。将有机层经mgso4干燥并且浓缩。将所得化合物通过硅胶柱色谱分离并且重结晶以获得6.1g的p-4。(产率:66%)
4-1的合成例
将获得的sub1-1'(50g,98.04mmol)加入到圆底烧瓶中并且用甲苯(359ml)溶解,加入sub2-1'(52.51g,117.65mmol)、pd(pph3)4(4.53g,3.92mmol)、k2co3(40.65g,294.12mmol)和水(180ml)并且搅拌回流。在反应完成之后,用ch2cl2和水萃取反应混合物。将有机层经mgso4干燥并且浓缩。之后,使浓缩物通过硅胶柱并且重结晶以获得64.61g的产物。(产率:83%)
5-3的合成例
将获得的sub1-1”(60g,133.35mmol)加入到圆底烧瓶中并且用甲苯(489ml)溶解,加入sub2-3”(58.28g,160.01mmol)、pd(pph3)4(6.16g,5.33mmol)、k2co3(55.29g,400.04mmol)和水(244ml)并且搅拌回流。在反应完成之后,用醚和水萃取所得混合物。将有机层经mgso4干燥并且浓缩。将所得化合物通过硅胶柱色谱分离并且重结晶以获得73.40g的产物。(产率:75%)
7-8的合成例
将2-氯-4-苯基-6-(7-苯基二苯并[b,d]呋喃-2-基)-1,3,5-三嗪(58g,133.35mmol)加入到圆底烧瓶中并且用thf(489ml)溶解,加入[1,1':3',1”:3”,1”'-四联苯基]-3-基硼酸(56g,160.01mmol)、pd(pph3)4(6.16g,5.33mmol)、k2co3(55.29g,400.04mmol)和水(244ml)并且搅拌回流。在反应完成之后,用醚和水萃取所得混合物。将有机层经mgso4干燥并且浓缩。将所得化合物通过硅胶柱色谱分离并且重结晶以获得71.33g的产物。(产率:76%)
[表4]
有机电气元件的制造和评价
实施例1)绿色有机发光二极管的制造和评价
首先,在形成在玻璃衬底上的ito层(阳极)上,将n1-(萘-2-基)-n4,n4-双(4-(萘-2-基(苯基)氨基)苯基)-n1-苯基苯-1,4-二胺(在下文将缩写为2-tnata)真空沉积以形成具有60nm的厚度的空穴注入层。将4,4-双[n-(1-萘基)-n-苯基氨基]联苯(在下文缩写为-npd)真空沉积以形成具有60nm的厚度的空穴传输层。随后,使用6:4的由式1和式2表示的本发明的化合物的混合物作为主体,以及通过以95:5重量掺杂ir(ppy)3[三(2-苯基吡啶)-铱]作为掺杂剂,在空穴传输层上沉积具有30nm的厚度的发射层。将(1,1'-联苯)-4-根合)双(2-甲基-8-喹啉根合)铝(在下文缩写为balq)真空沉积至10nm的厚度作为空穴阻挡层,并且将三(8-羟基喹啉)铝(在下文缩写为alq3)沉积至40nm的厚度作为电子传输层。之后,将碱金属卤化物(lif)真空沉积至0.2nm的厚度作为电子注入层,并且将al沉积至150nm的厚度以形成阴极,由此制造oled。
对通过实施例和比较例制造的oled施加正向偏置直流电压,使用photoresearchco.的pr-650测量电致发光(el)性质,并且使用mcscienceinc.制造的寿命测量设备以5000cd/m2的参考亮度测量t95寿命。在以下表中,显示了装置的制造和评价结果。
[比较例1]
以与实施例1中相同的方式制造有机电致发光装置,但仅使用比较化合物1作为主体。
[比较例2]
以与实施例1中相同的方式制造有机电致发光装置,但仅使用比较化合物2作为主体。
[比较例3]
以与实施例1中相同的方式制造有机电致发光装置,但仅使用比较化合物3作为主体。
[比较例4、比较例5]
以与实施例1中相同的方式制造有机电致发光装置,但仅使用由式2表示的化合物作为主体。
[比较例6]
以与实施例1中相同的方式制造有机电致发光装置,但将比较化合物1和由式2表示的化合物混合并且用作主体。
[比较例7]
以与实施例1中相同的方式制造有机电致发光装置,但将比较化合物2和由式2表示的化合物混合并且用作主体。
[比较例8]
以与实施例1中相同的方式制造有机电致发光装置,但将比较化合物3和由式2表示的化合物混合并且用作主体。
[表5]
从表5的结果可以看出,与使用单一化合物的装置(比较例1至比较例5)或与比较化合物混合的装置(比较例6至比较例8)相比,当将由式1和式2表示的本发明的有机电致发光装置的材料混合并且用作磷光主体(实施例1至实施例56)时,显著地改善了驱动电压、效率和寿命。当将叔胺化合物、比较化合物2和比较化合物3用作单一材料的磷光主体时,驱动、效率和寿命均显示出差的结果,并且比较化合物1在寿命方面是最佳的。当单独使用由式2表示的化合物时,与比较化合物相比,存在驱动电压和效率略微增加,但当将比较化合物1至比较化合物3与由式2表示的化合物混合并且用作磷光主体时,与用作单一化合物相比,所有效果均得到改善。当将具有强空穴传输能力的比较化合物1和由式2表示的化合物混合时,其在寿命方面显示出显著的效果,并且当将叔胺化合物、比较化合物2和比较化合物3混合时,其在驱动方面显示出显著的效果。仅从该结果可以看出,即使具有单一主体的差性能的化合物,当与具有良好电荷平衡的化合物混合时也可以改善效果。
此外,证实了其中将本发明的式1和式2的化合物混合并且用作主体的实施例1至实施例56与比较例1至比较例8的情况相比得到显著改善。
基于以上实验结果,本发明人确定在式1的化合物和式2的化合物的混合物的情况下,每个化合物具有除了所述化合物的性质以外的新性质,并且分别测量了使用式1的化合物、式2的化合物和本发明的混合物的pl寿命。结果,证实了当将本发明的化合物(式1和式2)混合时,与单一化合物不同,形成了新的pl波长,并且新形成的pl波长的减少和消失时间比式1和式2的化合物中的每个的减少和消失时间少约60倍至约360倍。据认为,当与本发明的化合物混合时,不仅电子和空穴移动通过每个化合物的能级,而且具有由于混合而形成的新能级的新区域(激态络合物)的电子、空穴传输或能量转移也增加了效率和寿命。结果,当使用本发明的混合物时,混合薄膜是显示激态络合物能量转移和发光过程的重要实例。
此外,本发明的组合优于其中将比较化合物混合并且用作磷光主体的比较例6至比较例8的原因在于通过使用其中在比较化合物2和比较化合物3中添加多一个胺基团的由式1表示的化合物来改善空穴特性,并且与具有强电子性质的由式2表示的化合物具有良好的电化学协同效应。因此,增加了发射层中空穴与电子之间的电荷平衡,使得在发光层内部而不是空穴传输层界面良好地进行发光,从而减少htl界面处的劣化,使整个装置的驱动电压、效率和寿命最大化。
实施例2)通过混合比率制造和评价绿色有机发光二极管
[表6]
如表6中所示,通过使用不同比率(7:3、5:5、4:6、3:7)的本发明的化合物的混合物,以与实施例1中相同的方式制造和测量装置。作为通过比率测量的结果,在7:3的情况下,其类似于以6:4测量的实施例1的结果,但在其中第一主体的比率降低的5:5、4:6和3:7的情况下,驱动电压、效率和寿命的结果逐渐降低。这可以解释为,因为当诸如以7:3和4:6混合适当量的具有强空穴性质的由式1表示的化合物时,发射层中的电荷平衡被最大化。
实施例3)绿色有机发光二极管的制造和评价
首先,在形成在玻璃衬底上的ito层(阳极)上,将n1-(萘-2-基)-n4,n4-双(4-(萘-2-基(苯基)氨基)苯基)-n1-苯基苯-1,4-二胺(在下文将缩写为2-tnata)真空沉积以形成具有60nm的厚度的空穴注入层。随后,将4,4-双[n-(1-萘基)-n-苯基氨基]联苯(在下文缩写为npd)真空沉积在膜上以形成具有60nm的厚度的空穴传输层。随后,使用由式19和式21表示的本发明的化合物作为主体,以及通过以5:5重量掺杂ir(ppy)3[三(2-苯基吡啶)-铱]作为掺杂剂,在空穴传输层上沉积具有30nm的厚度的发射层。将(1,1'-联苯)-4-根合)双(2-甲基-8-喹啉根合)铝(在下文缩写为balq)真空沉积至10nm的厚度作为空穴阻挡层,并且将三(8-羟基喹啉)铝(在下文缩写为alq3)沉积至40nm的厚度作为电子传输层。之后,将碱金属卤化物(lif)真空沉积至0.2nm的厚度作为电子注入层,并且将al沉积至150nm的厚度以形成阴极,由此制造oled。
对通过实施例和比较例制造的oled施加正向偏置直流电压,使用photoresearchco.的pr-650测量电致发光(el)并且,并且使用mcscienceinc.制造的寿命测量设备以5000cd/m2的参考亮度测量t95寿命。在以下表中,显示了装置的制造和评价结果。
[比较例9-比较例12]
以与实施例3中相同的方式制造有机电致发光装置,但分别将比较化合物4至比较化合物7用作单一主体。
[表7]
如以上描述,可以看出,与使用比较化合物的有机电致发光装置相比,使用本发明的化合物作为磷光主体的有机电致发光装置显著改善了所有驱动电压、效率和寿命。比较化合物4与本发明之间的差异在于间亚苯基的连接基团的存在或不存在,并且比较化合物5与比较化合物6区别在于在二苯并呋喃中存在或不存在诸如苯基或联苯基的次级取代基,并且比较化合物7区别在于二苯并呋喃的取代基数量。综合判断装置数据,证实了间亚苯基的连接基具有改善效率的作用,特别是二苯并呋喃的次级取代基具有显著改善寿命的作用。这意味着,即使具有相同的核,化合物的能级(homo能级、lumo能级、t1能级)由于特定取代基被取代而显著不同,化合物的物理性质的这种差异充当在装置沉积期间改善装置性能的主要因素(例如,能量平衡),表明可以得到这些不同的装置结果。
尽管出于说明性目的已经描述了本发明的示例性实施方案,但本领域技术人员将理解,在不背离如所附权利要求中公开的本发明的范围和主旨的情况下,各种修改、增添和替换是可行的。因此,在本发明中公开的实施方案旨在例示本发明的技术构思的范围,并且本发明的范围不受实施方案限制。
本发明的范围应基于所附权利要求来解释,并且应解释为包括在与权利要求等同的范围内的所有技术构思均属于本发明。
工业实用性
根据本发明,可以制造具有高亮度、高发光和长寿命的优异的装置特性的有机装置,因此具有工业实用性。
- 还没有人留言评论。精彩留言会获得点赞!