一种亲水相互作用色谱固定相及其制备方法与流程
本发明是涉及一种亲水相互作用色谱固定相及其制备方法,属于色谱分析技术领域。
背景技术:
亲水相互作用色谱(hydrophilicinteractionchromatography,hilic)作为一种高效液相色谱技术,在强极性和离子型化合物如氨基酸、碳水化合物和多肽等的分离分析中发挥着重要作用。近年来,随着蛋白组学、糖组学、代谢组学等生命科学领域对极性化合物分离需求的增加,亲水相互作用色谱得到了快速发展。
作为色谱技术的核心,固定相材料的发展直接影响着色谱分离的选择性和分离效率,制约着亲水相互作用色谱的应用和推广。hilic固定相种类繁多,早期hilic的固定相主要是nplc(normalphaseliquidchromatography,正相色谱)的固定相,如纯硅胶、氨基键合相、氰基键合相、二醇基键合相。但是,这些固定相均存在一定的缺陷,例如:纯硅胶柱在中性或碱性条件下,由于没有任何键合相的保护,硅胶颗粒容易溶解,稳定性较差,亲水性不强,对极性化合物的保留较弱,且分离选择性相对不足;氨基键合相与酸性化合物结合能力强,对一些强酸性化合物容易产生死吸附,在分离一些还原糖时,氨基容易与醛基形成席夫碱,改变键合相和分析物的性质,并且氨基柱稳定性较差,键合相容易流失;氰基键合相极性弱,对亲水性化合物的保留差,二醇基键合相为非离子型键合相,具有一定的氢键作用,其表面极性大于氰基键合相,然而相比于硅胶柱其亲水性较差,因此,氰基和二醇基键合相的应用领域较少。
随着研究的深入,目前通常采用的hilic固定相主要以硅胶基质为基础,采用降低表面硅羟基密度或共价连接极性配基的方式合成,例如:将含酰胺基、羟基、两性离子等强极性基团的分子键合到基质表面。采用的基质通常为硅胶基质,少部分为聚合物基质。这些固定相较以往的固定相而言,其分离效率和分离选择性有所提高,但是仍然存在一定的缺陷,例如:流动相中需要添加缓冲盐,操作较为繁琐,成本较高;分离过程液相的流速范围为毫升至微升,导致进样量多,样品浓度高,灵敏度低,从而导致分析效果较差等。
n-乙烯基吡咯烷酮(nvp)是水溶性非离子型高分子化合物聚乙烯基吡咯烷酮(pvp)的前体。聚乙烯基吡咯烷酮(pvp)是一种具有溶解性、低毒性、生物相容性、成膜性、化学稳定性、生理惰性等优异性能的均聚物,广泛应用于医疗卫生、日用化工、食品、饮 料、酿造、纺织印染、新材料等领域,但目前还没有关于聚乙烯基吡咯烷酮(pvp)用于制备亲水相互作用色谱固定相的相关报道。
技术实现要素:
针对现有技术存在的上述问题,本发明的目的是提供一种亲水相互作用色谱固定相及其制备方法。
本发明所述的亲水相互作用色谱固定相,是指在多孔硅胶表面键合有聚乙烯基吡咯烷酮的硅胶整体柱或在毛细管内壁直接键合有聚乙烯基吡咯烷酮的毛细管整体柱。
作为优选方案,所述硅胶整体柱的制备包括如下步骤:
a)无机硅胶整体柱的制作:先将聚乙二醇、尿素用醋酸溶解,使形成均相透明溶液,然后加入四甲氧基硅烷,搅拌使四甲氧基硅烷完全水解得到聚合液,再在氮气保护下将聚合液灌入毛细管柱中,两端封口后在35~45℃陈化反应15~25小时,得到无机硅胶整体柱;
b)无机硅胶整体柱的中孔制备:对步骤a)制得的无机硅胶整体柱采用程序升温方式升温至120℃进行热处理以制备中孔,得到具有双孔结构的无机硅胶整体柱;
c)无机硅胶整体柱的老化:分别用水和甲醇依次冲洗步骤b)制得的具有双孔结构的无机硅胶整体柱,接着室温干燥直至甲醇全部挥发,再采用程序升温方式升温至320℃进行老化处理;
d)无机硅胶整体柱的活化:先采用4~8m的浓盐酸活化5~7小时,随后用水冲洗至中性,接着用甲醇冲洗、氮气干燥,再在175~185℃加热0.5~1.5小时;
e)硅烷化修饰:先将γ-甲基丙烯酸氧丙基三甲氧基硅烷(简称γ-maps)的甲醇溶液灌入经步骤d)活化处理后的无机硅胶整体柱中,再在55~65℃反应10~14小时,接着用甲醇冲洗、氮气干燥,得到硅烷化修饰的硅胶整体柱;
f)n-乙烯基吡咯烷酮修饰:先将n-乙烯基吡咯烷酮和偶氮二异丁腈用甲醇和二甲苯的混合溶剂超声溶解,然后将混合溶液灌入到硅烷化修饰的硅胶整体柱中,再在75~85℃反应10~14小时,接着用甲醇溶剂冲洗,用流动相平衡后备用。
作为进一步优选方案,步骤a)中的聚合液是由600~1200mg聚乙二醇、700~1100mg尿素溶解于0.005~0.03mol/l的醋酸溶液中,然后加入3~5ml的四甲氧基硅烷进行水解得到。
作为进一步优选方案,步骤b)中的程序升温方式为:用25分钟由25℃程序升温至40℃,用3小时由40℃程序升温至120℃,在120℃保温3小时。
作为进一步优选方案,步骤c)中的程序升温方式为:用25分钟由25℃程序升温至45℃,用2.5小时由45℃程序升温至120℃,用3小时由120℃程序升温至320℃,在320℃保温24小时。
作为进一步优选方案,步骤e)中的γ-甲基丙烯酸氧丙基三甲氧基硅烷的甲醇溶液的质量浓度为50wt%。
作为进一步优选方案,步骤f)中的混合溶剂是由甲醇与二甲苯按体积比3:7形成,所述混合溶液中的n-乙烯基吡咯烷酮的浓度为15~60mg/ml,偶氮二异丁腈与n-乙烯基吡咯烷酮的质量比为5%~15%。
作为优选方案,所述毛细管整体柱是由10~25wt%n-乙烯基吡咯烷酮、4~15wt%交联剂、60~85wt%致孔剂和0.1~0.4wt%引发剂在预处理后的毛细管中进行原位聚合反应制得,上述各组成的比例之和为100%。
作为进一步优选方案,所述交联剂为季戊四醇。
作为进一步优选方案,所述致孔剂为甲醇与水组成的二元致孔体系。
作为更进一步优选方案,所述二元致孔体系中水的质量占比为15~20%,甲醇的质量占比为80~85%。
作为进一步优选方案,所述引发剂为偶氮二异丁腈(简称aibn)。
所述的毛细管整体柱包括毛细管液相色谱整体柱和毛细管电色谱整体柱。
作为优选方案,所述毛细管液相色谱整体柱的制备包括如下步骤:
a)毛细管预处理:先依次用0.5~1.5mol/l的naoh溶液、水、甲醇冲洗毛细管,然后氮气吹干,再将甲醇与3-(甲基丙烯酰氧)丙基三甲氧基硅烷的混合溶液加入吹干后的毛细管中,在55~65℃下反应10~24小时,接着用甲醇冲洗,氮气吹干备用;
b)先将10~25wt%n-乙烯基吡咯烷酮、4~15wt%交联剂、60~85wt%致孔剂和0.1~0.4wt%引发剂超声混合10~15分钟,然后用氮气脱除其中的空气后导入经步骤a)预处理后的毛细管中,再将毛细管两端密封,在55~65℃下反应8~24小时;待反应完成后,用甲醇冲洗毛细管以除去残留的试剂,即得到所述的毛细管液相色谱整体柱。
作为优选方案,所述毛细管电色谱整体柱的制备包括如下步骤:
①毛细管预处理:先依次用0.5~1.5mol/l的naoh溶液、水、甲醇冲洗毛细管,然后氮气吹干,再将甲醇与3-(甲基丙烯酰氧)丙基三甲氧基硅烷的混合溶液加入吹干后的毛细管中,在55~65℃下反应10~24小时,接着用甲醇冲洗,氮气吹干备用;
②先将10~25wt%n-乙烯基吡咯烷酮、4~15wt%交联剂、60~85wt%致孔剂和0.1~ 0.4wt%引发剂超声混合10~15分钟,然后用氮气脱除其中的空气后导入经步骤①预处理后的毛细管中,使毛细管剩余10~12cm不填充,再将毛细管两端密封,并使填充部分朝下、未填充部分朝上,在55~65℃下反应8~24小时;待反应完成后,用甲醇冲洗毛细管以除去残留的试剂,再制作检测窗口,即得到所述的毛细管电色谱整体柱。
作为进一步优选方案,上述甲醇与3-(甲基丙烯酰氧)丙基三甲氧基硅烷的体积比为1∶(0.5~2)。
与现有技术相比,本发明具有如下显著性有益效果:
实验证明:本发明提供的亲水相互作用色谱固定相具有典型的亲水相互作用色谱的保留机理,不仅可实现一系列极性化合物的有效分离,而且无需采用缓冲盐流动相,即可实现极性化合物的高效分离,并且重现性好,电色谱柱效可高达200000plates/m;另外,所述亲水相互作用色谱固定相的制备条件易控制,原料价廉易得,制备工艺简单,易于实现工业化。
附图说明
图1a为本发明实施例1制备的毛细管液相色谱整体柱的扫描电镜图;
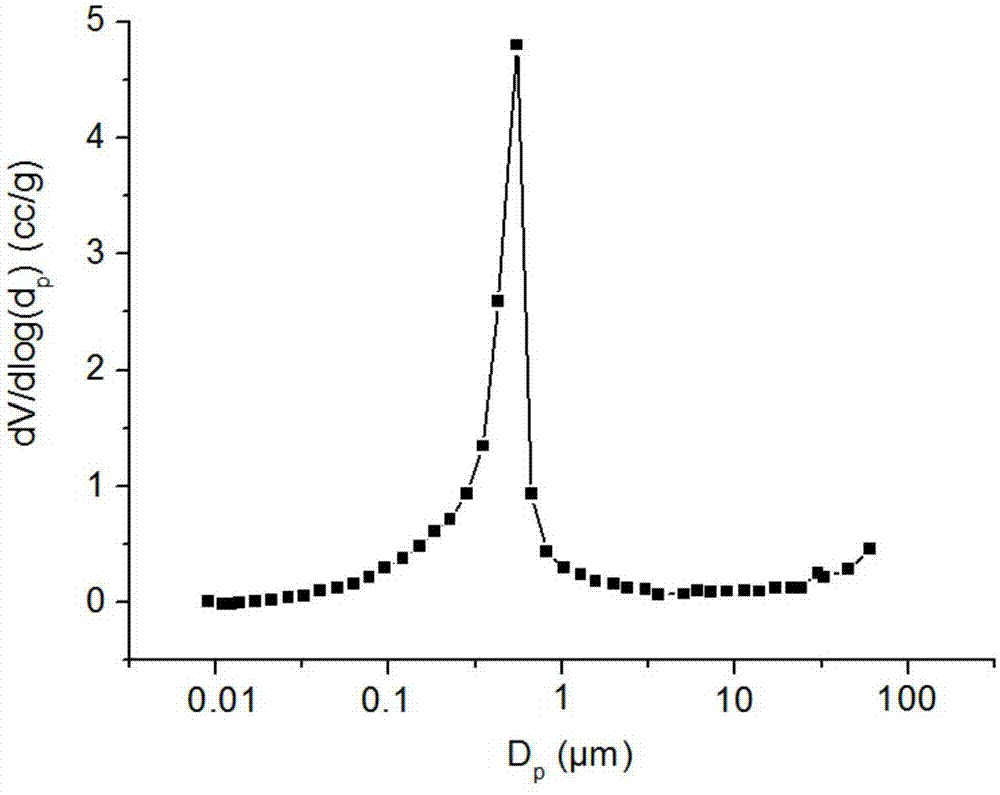
图1b为本发明实施例1制备的毛细管液相色谱整体柱的孔径分布图;
图2为本发明实施例2的hilic色谱图;
图3为本发明实施例3的hilic色谱图;
图4为本发明实施例4的hilic色谱图;
图5为本发明实施例5的hilic色谱图;
图6为本发明实施例6制备的毛细管电色谱整体柱中缓冲盐浓度与电渗流关系图;
图7为本发明实施例7的hi-cec色谱图;
图8为本发明实施例8的hi-cec色谱图;
图9为本发明实施例9的hi-cec色谱图;
图10为本发明实施例10的hi-cec色谱图;
图11为本发明实施例11制备的硅胶整体柱的扫描电镜图;
图12为本发明实施例12的hilic色谱图。
具体实施方式
下面结合具体实施例进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不 用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件或按照制造厂商所建议的条件。
实施例1:毛细管液相色谱整体柱的制备
a)毛细管预处理:用1.0mol/l的naoh溶液冲洗毛细管4h,然后用去离子水冲洗至中性,接着用甲醇冲洗15min,氮气吹干备用;将甲醇与3-(甲基丙烯酰氧)丙基三甲氧基硅烷按体积比为1:1的混合溶液充满吹干后的毛细管中,置于60℃烘箱中反应12h,接着用无水甲醇冲洗毛细管15min,氮气吹干备用;
b)制备毛细管液相色谱整体柱:称取150mgn-乙烯基吡咯烷酮、60mg季戊四醇、820mg甲醇水溶液(其中甲醇680mg,去离子水140mg)、1.5mg偶氮二异丁腈,将各组分混合得到色谱原料,然后将该色谱原料超声混合10min后,用氮气脱除其中的空气后导入经步骤a)预处理后的毛细管中,将毛细管两端密封,置于60℃烘箱中反应10h,通过热引发使色谱原料在毛细管中原位聚合;待反应完成后,将毛细管柱接在液相色谱上用甲醇冲洗除去管内残留的试剂,即得到所述毛细管液相色谱整体柱。
切除上述毛细管液相色谱整体柱端口部分,调整柱长至250mm,即可作为固定相用于亲水相互作用液相色谱分析。
图1a为本实施例制备的毛细管液相色谱整体柱的截面扫描电镜图;图1b为本实施例制备的毛细管液相色谱整体柱的整体材料的孔径分布图。
从图1a中可以清晰的看出该固定相整体材料的骨架,这些球型颗粒凝聚形成较大的“簇”,“簇”与“簇”之间由大孔包围,而这些“簇”最终堆积成一个完整的聚合物柱,由此可见,采用本实施例的制备方法制备出的固定相完整性好,具有很好的形貌结构;
从图1b中可以看出,固定相整体材料中多数大孔孔径直径在670nm左右,孔径分布均匀。
实施例2
使用实施例1制备的毛细管液相色谱整体柱作为固定相对甲苯、丙烯酰胺、硫脲的混合物进行hilic分析,分析条件为:
流动相a为h2o,流动相b为乙腈,液相方法:97.5%b;流速:800nl/min;检测波长:214nm;得到的hilic色谱图如图2所示;
由图2所示的hilic色谱图可见:甲苯、丙烯酰胺、硫脲依次从谱图中出现,这说明采用本发明的毛细管液相色谱整体柱作为固定相可以实现甲苯、丙烯酰胺、硫脲的高效分离。
实施例3
使用实施例1制备的毛细管液相色谱整体柱作为固定相对苯酚类化合物进行hilic分析,分析条件为:
流动相a为h2o,流动相b为乙腈,液相方法:92.5%b;流速:800nl/min;检测波长:214nm;得到的hilic色谱图如图3所示;
由图3所示的hilic色谱图可见:甲苯、苯酚、邻苯二酚、间苯二酚、对苯二酚、连苯三酚等苯酚类化合物依次从谱图中出现,这说明采用本发明的毛细管液相色谱整体柱作为固定相可以实现苯酚类化合物的高效分离。
实施例4
使用实施例1制备的毛细管液相色谱整体柱作为固定相对苯甲酸类化合物进行hilic分析,分析条件为:
流动相a为h2o,流动相b为乙腈,液相方法:85%b;流速:800nl/min;检测波长:214nm;得到的hilic色谱图如图4所示;
由图4所示的hilic色谱图可见:苯甲酸、2-羟基苯甲酸、4-羟基苯甲酸、2,4-二羟基苯甲酸、3,4-二羟基苯甲酸、3,5-二羟基苯甲酸、3,4,5-三羟基苯甲酸等苯甲酸类化合物依次从谱图中出现,这说明采用本发明的毛细管液相色谱整体柱作为固定相可以实现苯甲酸类化合物的高效分离。
实施例5
使用实施例1制备的毛细管液相色谱整体柱作为固定相对碱性核苷类化合物进行hilic分析,分析条件为:
流动相a为h2o,流动相b为乙腈,液相方法:0min,93%b;5min,93%b;12min,88%b;15min,85%b;流速:800nl/min;检测波长:254nm;得到的hilic色谱图如图5所示;
由图5所示的hilic色谱图可见:尿嘧啶、胸苷、尿苷、腺苷、胞苷、鸟苷等碱性核苷类化合物依次从谱图中出现,这说明采用本发明的毛细管液相色谱整体柱作为固定相可以实现碱性核苷类化合物的高效分离。
实施例6:毛细管电色谱整体柱的制备
a)毛细管预处理:用1.0mol/l的naoh溶液冲洗毛细管4h,然后用去离子水冲洗至中性,接着用甲醇冲洗15min,氮气吹干备用;将甲醇与3-(甲基丙烯酰氧)丙基三甲氧基硅烷按体积比为1:1的混合溶液充满吹干后的毛细管中,置于60℃烘箱中反应12h,接着用 无水甲醇冲洗毛细管15min,氮气吹干备用;
b)制备毛细管电色谱整体柱:称取100mgn-乙烯基吡咯烷酮、50mg季戊四醇、850mg甲醇水溶液(其中甲醇660mg,去离子水190mg)、1.5mg偶氮二异丁腈,将各组分混合得到色谱原料,然后将该色谱原料超声混合10min后,用氮气脱除其中的空气后填充到经步骤a)预处理后的毛细管中,使毛细管剩余10~12cm不填充,将毛细管两端密封,并使填充部分朝下、未填充部分朝上垂直固定于60℃烘箱内反应10h,通过热引发使色谱原料在毛细管中原位聚合;待反应完成后,用甲醇冲洗毛细管以除去管内残留的试剂,然后将距离填料一端10cm的毛细管外表面的聚酰亚胺涂层去掉3mm作为检测窗口,即得到所述的毛细管电色谱整体柱。
切除上述毛细管电色谱整体柱端口部分,调整柱长至250mm,即可作为固定相用于亲水相互作用电色谱分析。
关于本实施例制备的毛细管电色谱整体柱,我们考察了缓冲盐浓度对表观电渗流(eof)的影响情况,分析条件为:
流动相acn/h2o(95/5,v/v)包含不同浓度(0,1mm,2.5mm,5.0mm,7.5mm)的甲酸铵缓冲液(ph=3.0);电压:-15kv;两端加压0.2mpa;t0标志物:甲苯;检测波长:214nm;实验结果如图6所示;
由图6所示的缓冲盐浓度与eof值关系图可见:随着缓冲盐浓度的增加,eof值反而有所下降,而eof值的降低不利于色谱分离,由此可见,以本发明的毛细管电色谱整体柱为固定相用于亲水相互作用电色谱分离时,无需加入缓冲盐,从而使分析操作更为简单,成本低廉。
实施例7
使用实施例6制备的毛细管电色谱整体柱作为固定相对甲苯、丙烯酰胺、硫脲在cec模式下进行hilic分析,cec模式下分析条件为:
流动相acn/h2o(95/5,v/v),ph2.5;电压:-15kv;两端加压0.2mpa;检测波长:214nm;得到的hi-cec色谱图如图7所示;
由图7所示的hi-cec色谱图可见:甲苯、丙烯酰胺、硫脲依次从谱图中出现,这说明采用本发明的毛细管电色谱整体柱作为固定相可以实现甲苯、丙烯酰胺、硫脲的高效分离。
实施例8
使用实施例6制备的毛细管电色谱整体柱作为固定相对苯酚类化合物在cec模式下进 行hilic分析,cec模式下分析条件为:
流动相acn/h2o(90/10,v/v),ph2.5;电压:-15kv;进样端加压0.4mpa;检测波长:214nm;得到的hi-cec色谱图如图8所示;
由图8所示的hi-cec色谱图可见:苯酚,2-氨基苯酚,邻苯二酚,对苯二酚,间苯二酚,连苯三酚依次从谱图中出现,这说明采用本发明的毛细管电色谱整体柱作为固定相可以实现苯酚类化合物的高效分离。
实施例9
使用实施例6制备的毛细管电色谱整体柱作为固定相对核苷类化合物在cec模式下进行hilic分析,cec模式下分析条件为:
流动相acn/h2o(90/10,v/v),ph2.5;电压:-15kv;进样端加压0.4mpa;检测波长:254nm;得到的hi-cec色谱图如图9所示;
由图9所示的hi-cec色谱图可见:尿嘧啶,胞苷,尿苷,腺苷,肌苷依次从谱图中出现,这说明采用本发明的毛细管电色谱整体柱作为固定相可以实现核苷类化合物的高效分离。
实施例10
使用实施例6制备的毛细管电色谱整体柱作为固定相对苯甲酸类化合物在cec模式下进行hilic分析,cec模式下分析条件为:
流动相acn/h2o(90/10,v/v),ph3.0;电压:-15kv;两端加压0.2mpa;检测波长:214nm;得到的hi-cec色谱图如图10所示;
由图10所示的hi-cec色谱图可见:苯甲酸,2-羟基苯甲酸,4-羟基苯甲酸依次从谱图中出现,这说明采用本发明的毛细管电色谱整体柱作为固定相可以实现苯甲酸类化合物的高效分离。
实施例11:硅胶整体柱的制备
1)无机硅胶整体柱的制作:分别称取900mg聚乙二醇(peg10000)、900mg尿素,加入0.01m的醋酸10ml室温搅拌溶解30min,待形成均相透明的溶液后,加入4mltmos冰浴搅拌45min使四甲氧基硅烷完全水解反应得到聚合液,然后在氮气保护下将聚合液灌入75μm毛细管柱中,两端封口后在40℃陈化反应20h,得到无机硅胶整体柱;
2)无机硅胶整体柱的中孔制备:对步骤1)的无机硅胶整体柱采用程序升温方式升温至120℃进行热处理以制备中孔,升温程序为:用25分钟由25℃程序升温至40℃,用3小时由40℃程序升温至120℃,在120℃保温3小时,得到具有双孔结构的无机硅胶整体柱;
3)无机硅胶整体柱的老化:用水和甲醇分别冲洗步骤2)制得的无机硅胶整体柱1h,接着室温干燥直至甲醇全部挥发,采用程序升温方式升温至320℃进行老化处理,升温程序为:用25分钟由25℃程序升温至45℃,用2.5小时由45℃程序升温至120℃,用3小时由120℃程序升温至320℃,在320℃保温24小时;
4)无机硅胶整体柱的活化:采用6m的浓盐酸活化6h,随后用水冲洗至中性,接着用甲醇冲洗1h后氮气干燥,然后180℃加热1h;
5)硅烷化修饰:将50wt%γ-甲基丙烯酸氧丙基三甲氧基硅烷(简称γ-maps)的甲醇溶液灌入步骤4)中的无机硅胶整体柱中,于60℃反应12h,接着用甲醇冲洗1h后氮气干燥,得到硅烷化修饰的硅胶整体柱;
6)n-乙烯基吡咯烷酮修饰:将n-乙烯基吡咯烷酮和偶氮二异丁腈用体积比为3:7的甲醇与二甲苯形成的混合溶剂超声溶解,溶解后的n-乙烯基吡咯烷酮的浓度为30mg/ml,偶氮二异丁腈的加入量为n-乙烯基吡咯烷酮质量的10%,将溶解后的溶液灌入到硅烷化修饰的硅胶整体柱中,然后在80℃反应12h,接着用甲醇溶剂冲洗1h,用流动相平衡后备用。
切除上述整体柱端口部分,调整柱长至250mm,即可作为固定相用于亲水相互作用液相色谱分析。
图11为本实施例制备的硅胶整体柱的截面扫描电镜图;
从图11中可以看出该硅胶整体柱的骨架结构均一,具有明显的双孔分布特征,连续贯穿的通透孔道可以大大减小传质阻力,通透性好,表面介孔可提供较大的表面积。
实施例12
使用实施例11制备的硅胶整体柱作为固定相对甲苯,硫脲进行hilic分析,分析条件为:
流动相a为h2o,流动相b为乙腈,液相方法:95%b;流速:800nl/min;检测波长:214nm;得到的hilic色谱图如图12所示;
由图12所示的hilic色谱图可见:甲苯,硫脲依次从谱图中出现,这说明采用本发明的硅胶整体柱作为固定相可以实现甲苯,硫脲的高效分离。
综上所述:本发明以n-乙烯基吡咯烷酮为原料制备出的整体柱固定相,整体形貌结构好,用于hilic液相分离应用时,流动相无需额外加入缓冲盐、操作简单,并且液相的流速范围从以往的毫升、微升级降低至纳升,进样量大大减少,灵敏度大大提高,从而使得分离效率提高,不仅可以实现极性相差较大的化合物的分离(例如:甲苯、丙烯酰胺和硫脲),更可以实现极性非常接近的同系列化合物的分离(例如:邻苯二酚、间苯二酚、对苯二酚 等苯酚类化合物;2-羟基苯甲酸、4-羟基苯甲酸、2,4-二羟基苯甲酸、3,4-二羟基苯甲酸、3,5-二羟基苯甲酸等苯甲酸类化合物;胸苷、尿苷、腺苷、胞苷等碱性核苷类化合物),分离的化合物从中性、酸性到碱性都可以;尤其是,本发明的整体柱固定相还可以用于特殊的亲水作用毛细管电色谱hi-cec的分离,并且分离时除了无需加入缓冲盐以外,还无需加入电渗流改性剂,并且分离柱效高达200000plates/m,从而可以满足中性及带电荷的极性化合物的分离需求;由此可见,本发明将n-乙烯基吡咯烷酮应用于制备亲水相互作用色谱的固定相,大大的扩大了n-乙烯基吡咯烷酮的应用范围和亲水相互作用色谱固定相的种类,相对于现有技术,取得了显著性进步和出乎意料的效果。
最后需要在此指出的是:以上仅是本发明的部分优选实施例,不能理解为对本发明保护范围的限制,本领域的技术人员根据本发明的上述内容作出的一些非本质的改进和调整均属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!