用于样品分析的装置和方法与流程
相关申请的交叉引用
本申请要求2015年4月3日提交的美国临时专利申请号62/142,858的权益,该申请通过引用整体并入本文。
简介
分析物分析经常通过进行样品制备步骤来执行,所述样品制备步骤手工地或使用复杂的机器人技术执行。样品制备以后,制备的样品中分析物的测定还涉及使用昂贵且复杂的系统,用于将制备的样品运输至机器,所述机器然后执行制备的样品中的分析物的分析。
在分析物分析领域中非常需要可以用于制备样品并测定制备的样品的集成装置。这样的集成装置可以提供低成本选项,且可以相当大地增加执行分析物分析的便利性,特别是在临床应用(诸如护理点应用)中。
这样,有兴趣在于用于执行分析物分析的集成装置。
技术实现要素:
本发明公开了一种集成的微流体和分析物检测装置。本文中还提供了使用集成的微流体和分析物检测装置和有关系统的示例性方法。
本发明公开了一种数字微流体和分析物检测装置,包括第一基底和第二基底,其中所述第二基底与所述第一基底被间隙(gap)隔开,所述第一基底包括多个电极以产生作用于液体微滴的电驱动力;和孔阵列,其尺寸确定为容纳所述液体微滴的一部分,其中至少一部分的所述孔阵列定位在所述多个电极中的一个或多个和所述间隙之间。
在一些实施方案中,所述多个电极定位在所述第一基底的表面上。在某些实施方案中,所述装置还包括第一层,所述第一层设置在所述第一基底的表面上并覆盖所述多个电极。在一些实施方案中,所述第一基底包括在此处引入所述液体微滴的第一部分和液体微滴向其移动的第二部分。在某些实施方案中,所述多个电极和所述第一层从所述第一部分延伸至所述第一基底的第二部分。在某些实施方案中,所述孔阵列定位在所述第一基底的第二部分中。在某些实施方案中,所述第二基底包括第一部分和第二部分,其中所述第一部分与所述第一基底的第一部分呈面对布置,且所述第二部分与所述孔阵列呈面对布置。在某些实施方案中,所述第二基底的第二部分是基本上透明的以促进所述孔阵列的光学询问。
在一些实施方案中,所述装置还包括设置在所述第一层的表面上的第二层。在某些实施方案中,所述第二层在所述第一基底的第一部分和第二部分上面延伸。在某些实施方案中,所述第一层是电介质层,且所述第二层是疏水层。在某些实施方案中,所述孔阵列定位在所述第二层中。在某些实施方案中,所述孔阵列定位在所述第一层中。在某些实施方案中,所述孔阵列具有亲水表面。
在一些实施方案中,所述孔阵列包括侧壁,所述侧壁定向成促进存在于在所述孔阵列上面移动的微滴中的珠子或颗粒的接收和保留。在某些实施方案中,所述孔阵列包括与第二侧壁相对的第一侧壁,其中所述第一侧壁相对于所述孔的底以钝角定向,且其中所述第二侧壁相对于所述孔的底以锐角定向,其中微滴的运动是在与所述孔的底平行的方向且从所述第一侧壁至所述第二侧壁。在某些实施方案中,所述孔阵列具有截头圆锥形状,并且所述截头圆锥形状的较狭窄部分提供所述孔阵列的开口。在某些实施方案中,所述孔阵列包括与第二侧壁相对的第一侧壁,其中所述第一侧壁的顶部分相对于所述孔的底以钝角定向,且所述侧壁的底部分垂直于所述孔的底定向,且其中所述第二侧壁相对于所述孔的底垂直定向,其中所述微滴的运动是在与所述孔的底平行的方向且从所述第一侧壁至所述第二侧壁,其中所述第一侧壁的顶部分是在所述孔的开口处。
还公开了一种数字微流体和分析物检测装置,包括限定所述装置的第一基底和第二基底,其中所述第二基底与所述第一基底被间隙隔开,其中所述装置包括第一部分和第二部分;且所述第一部分包括多个电极以驱动第一液体微滴和第二液体微滴的组合,所述第一液体微滴含有来自生物样品的目标分析物,所述第二液体微滴含有至少一个珠子;且所述第二部分包括孔阵列,其尺寸确定为容纳所述液体微滴的一部分。
在一些实施方案中,所述多个电极仅定位在所述装置的第一部分中。在某些实施方案中,所述多个电极定位在所述第一基底的表面上。在一些实施方案中,所述装置还包括第一层,所述第一层设置在所述第一基底的表面上并覆盖所述多个电极。在某些实施方案中,所述第一基底包括在此处引入所述液体微滴的第一部分和液体微滴向其移动的第二部分。在某些实施方案中,所述多个电极和所述第一层从所述第一部分延伸至所述第一基底的第二部分。在某些实施方案中,所述孔阵列定位在所述第一基底的第二部分中。
在某些实施方案中,所述第二基底包括第一部分和第二部分,其中所述第一部分与所述第一基底的第一部分呈面对布置,且所述第二部分与所述孔阵列呈面对布置。
在某些实施方案中,所述第二基底的第二部分是基本上透明的以促进所述孔阵列的光学询问。在某些实施方案中,所述多个电极被构造成使置于所述间隙中的微滴向所述装置的第二部分移动,所述装置包括将所述第一部分与所述第二部分流体地连接的毛细管部分,其中所述毛细管包括亲水材料以促进所述微滴在没有电力的情况下从第一部分经由所述毛细管部分向第二部分的运动。
在一些实施方案中,所述装置还包括设置在所述第一层的上表面上的第二层。在某些实施方案中,所述第二层在所述第一基底上面延伸。在某些实施方案中,所述第一层是电介质层,且所述第二层是疏水层。
在一些实施方案中,所述多个孔定位在所述第二层中。在某些实施方案中,所述孔阵列定位在所述第一层中。在某些实施方案中,所述孔阵列具有亲水表面。在某些实施方案中,所述孔包括侧壁,所述侧壁定向成促进存在于在所述孔阵列上面移动的微滴中的纳米珠子或纳米颗粒的接收和保留。在某些实施方案中,所述孔包括与第二侧壁相对的第一侧壁,其中所述第一侧壁相对于所述孔的底以钝角定向,且其中所述第二侧壁相对于所述孔的底以锐角定向,其中所述微滴的运动是在与所述孔的底平行的方向且从所述第一侧壁至所述第二侧壁。在某些实施方案中,所述孔具有截头圆锥形状,并且所述截头圆锥形状的较狭窄部分提供所述孔的开口。在某些实施方案中,所述孔包括与第二侧壁相对的第一侧壁,其中所述第一侧壁的顶部分相对于所述孔的底以钝角定向,且所述侧壁的底部分垂直于所述孔的底定向,且其中所述第二侧壁垂直于所述孔的底定向,其中所述微滴的运动是在与所述孔的底平行的方向且从所述第一侧壁至所述第二侧壁,其中所述第一侧壁的顶部分是在所述孔的开口处。
本文中还公开了一种表面声波微流体和分析物检测装置,包括第一基底和第二基底,其中所述第二基底与所述第一基底被间隙隔开,其中所述装置包括第一部分和第二部分,所述第一部分包括连接到表面声波产生部件的覆板;且所述第二部分包括定位在所述第一基底或所述第二基底上的多个孔。
在一些实施方案中,所述覆板包括在所述覆板的上表面上的声子结构。在某些实施方案中,所述覆板覆盖压电晶体层。在某些实施方案中,所述第二基底是基本上透明的。
本文中还公开了一种表面声波微流体和分析物检测装置,包括第一基底和第二基底,其中所述第二基底与所述第一基底被间隙隔开,所述第一基底包括多个孔,且所述第二基底包括声子结构,其中所述多个孔和所述声子结构定位在彼此的对面。
在一些实施方案中,所述第二基底是覆板。在某些实施方案中,所述覆板设置在所述第二基底上,且所述声子结构位于所述覆板上。在某些实施方案中,所述第一基底、第二基底和覆板是基本上透明的。
本发明还公开了检测或测量液体微滴中的目标分析物的方法。在某些实施方案中,所述方法包括以下步骤:提供含有目标分析物的第一液体微滴,提供含有至少一种固体支持物的第二液体微滴,所述固体支持物含有结合所述目标分析物的特异性结合成员,使用能量施加力以操纵所述第一液体微滴和所述第二液体微滴以建立混合物,将所述混合物的全部或至少一部分移动至孔阵列,其中所述阵列的一个或多个孔的大小足以容纳所述至少一种固体支持物,在将所述混合物的一部分移动至孔阵列之前或之后,将可检测标记加入所述混合物,和检测所述孔中的目标分析物。
在某些实施方案中,所述至少一种固体支持物包括至少一种特异性地结合所述目标分析物的结合成员。在某些实施方案中,所述方法包括:在将所述混合物的至少一部分移动至孔阵列之前,将可检测标记加入所述混合物。在某些实施方案中,所述方法包括:在将所述混合物的至少一部分移动至孔阵列之后,将可检测标记加入所述混合物。在某些实施方案中,所述可检测标记包括至少一种特异性地结合所述目标分析物的结合成员。在某些实施方案中,所述可检测标记包括发色团、荧光化合物、酶、化学发光化合物或放射性化合物。在某些实施方案中,所述结合成员是受体或抗体。
在某些实施方案中,使用的能量是电驱动力或声力。在某些实施方案中,所述电驱动力是微滴驱动、电泳、电润湿、介电电泳、静电驱动、电场介导、电极介导、毛细管力、色谱法、离心或抽吸。在某些实施方案中,所述声力是表面声波。
在某些实施方案中,产生电驱动力包括产生交流电。在某些实施方案中,所述交流电具有10v或更高的均方根(rms)电压。在某些其它实施方案中,所述交流电具有在射频范围内的频率。
在某些实施方案中,所述第一液体微滴是可极化的液体,所述第二液体微滴是可极化的液体,所述混合物是可极化的液体,或所述第一液体微滴和第二液体微滴二者各自是可极化的液体。
在某些实施方案中,所述方法还包括使用电驱动力将所述混合物的至少一部分定位在所述孔阵列上面。在某些其它实施方案中,所述方法还包括使用毛细管元件将所述混合物的至少一部分定位在所述孔阵列上面,所述毛细管元件被构造成促进所述混合物向所述孔阵列的运动。
在某些实施方案中,所述支持物是磁性固体支持物。在某些其它实施方案中,当使用磁性固体支持物时,从相对于所述混合物的至少一部分的相反方向施加电驱动力和磁场。在某些实施方案中,所述方法还包括如下混合所述混合物:使所述混合物前后移动,使所述混合物以环状模式移动,将所述混合物分割成两份或更多份的子混合物和合并所述子混合物。在某些实施方案中,所述混合物是水性液体。在某些其它实施方案中,所述混合物是不可混溶的液体。在某些其它实施方案中,所述液体微滴是疏水液体微滴。在某些实施方案中,所述孔阵列具有亲水表面。在某些其它实施方案中,所述孔阵列具有疏水表面。在某些实施方案中,所述基底包括亲水表面。在某些其它实施方案中,所述基底包括疏水表面。在某些实施方案中,所述方法还包括用一系列电极产生电驱动力以将所述混合物移动至所述孔阵列,从而密封被加载的孔。
在某些实施方案中,给所述阵列的一个或多个孔加载至少一种固体支持物。在某些其它实施方案中,所述加载包括施加磁场以促进至少一种固体支持物向所述阵列的一个或多个孔中的运动。在某些其它实施方案中,所述方法还包括除去在所述加载以后没有加载进所述阵列的孔中的任何固体支持物。在某些其它实施方案中,所述除去包括用所述系列电极产生电驱动力以将可极化的流体微滴移动至所述孔阵列,以将所述混合物的至少一部分移动至离开所述孔阵列一段距离。在某些其它实施方案中,所述除去包括用所述系列电极产生电驱动力以移动水性洗涤微滴横穿过所述孔阵列。
在某些实施方案中,使用微流体装置、数字微流体装置(dmf)、基于表面声波的微流体装置(saw)、集成的dmf和分析物检测装置、集成的saw和分析物检测装置或基于机器人技术的测定处理单元执行所述方法。
在其它实施方案中,所述方法包括以下步骤:提供含有目标分析物的第一液体微滴,提供含有可检测标记的第二液体微滴,所述可检测标记含有结合所述目标分析物的特异性结合成员,使用能量施加力以操纵所述第一液体微滴和所述第二液体微滴,从而建立混合物,将所述混合物的全部或至少一部分移动至孔阵列,和检测所述孔中的目标分析物。
在某些实施方案中,所述可检测标记包括发色团、荧光化合物、酶、化学发光化合物或放射性化合物。在某些实施方案中,所述结合成员是受体或抗体。
在某些实施方案中,使用的能量是电驱动力或声力。在某些实施方案中,所述电驱动力是微滴驱动、电泳、电润湿、介电电泳、静电驱动、电场介导、电极介导、毛细管力、色谱法、离心或抽吸。在某些实施方案中,所述声力是表面声波。
在某些实施方案中,产生电驱动力包括产生交流电。在某些实施方案中,所述交流电具有10v或更高的均方根(rms)电压。在某些其它实施方案中,所述交流电具有在射频范围内的频率。
在某些实施方案中,所述第一液体微滴是可极化的液体,所述第二液体微滴是可极化的液体,所述混合物是可极化的液体,或所述第一液体微滴和第二液体微滴二者各自是可极化的液体。
在某些实施方案中,所述方法还包括使用电驱动力将所述混合物的至少一部分定位在所述孔阵列上面。在某些其它实施方案中,所述方法还包括使用毛细管元件将所述混合物的至少一部分定位在所述孔阵列上面,所述毛细管元件被构造成促进所述混合物向所述孔阵列的运动。
在某些实施方案中,所述方法还包括如下混合所述混合物:使所述混合物前后移动,使所述混合物以环状模式移动,将所述混合物分割成两份或更多份的子混合物和合并所述子混合物。在某些实施方案中,所述混合物是水性液体。在某些其它实施方案中,所述混合物是不可混溶的液体。在某些其它实施方案中,所述液体微滴是疏水液体微滴。在某些实施方案中,所述孔阵列具有亲水表面。在某些其它实施方案中,所述孔阵列具有疏水表面。在某些实施方案中,所述基底包括亲水表面。在某些其它实施方案中,所述基底包括疏水表面。在某些实施方案中,所述方法还包括用一系列电极产生电驱动力以将所述混合物移动至所述孔阵列,从而密封被加载的孔。
在某些实施方案中,给所述阵列的一个或多个孔加载至少一种可检测标记。在某些其它实施方案中,所述除去包括用所述系列电极产生电驱动力以将可极化的流体微滴移动至所述孔阵列,以将所述混合物的至少一部分移动至离开所述孔阵列一段距离。在某些其它实施方案中,所述除去包括用所述系列电极产生电驱动力以移动水性洗涤微滴横穿过所述孔阵列。
在某些实施方案中,使用微流体装置、数字微流体装置(dmf)、基于表面声波的微流体装置(saw)、集成的dmf和分析物检测装置、集成的saw和分析物检测装置或基于机器人技术的测定处理单元执行所述方法。
在其它实施方案中,所述方法包括测量液体微滴中的目标分析物的步骤,所述方法包括:提供含有目标分析物的第一液体微滴,提供含有至少一种固体支持物的第二液体微滴,所述固体支持物含有结合所述目标分析物的特异性结合成员,使用能量施加力以操纵所述第一液体微滴和所述第二液体,从而建立混合物,将所述混合物的全部或至少一部分移动至孔阵列,其中所述阵列的一个或多个孔的大小足以容纳所述至少一种固体支持物,在将所述混合物的一部分移动至孔阵列之前或之后,将可检测标记加入所述混合物,和测量所述孔中的可检测标记。
在某些实施方案中,所述至少一种固体支持物包括至少一种特异性地结合所述目标分析物的结合成员。在某些实施方案中,所述方法包括:在将所述混合物的至少一部分移动至孔阵列之前,将可检测标记加入所述混合物。在某些实施方案中,所述方法包括:在将所述混合物的至少一部分移动至孔阵列之后,将可检测标记加入所述混合物。在某些实施方案中,所述可检测标记包括至少一种特异性地结合所述目标分析物的结合成员。在某些实施方案中,所述可检测标记包括发色团、荧光化合物、酶、化学发光化合物或放射性化合物。在某些实施方案中,所述结合成员是受体或抗体。
在某些实施方案中,使用的能量是电驱动力或声力。在某些实施方案中,所述电驱动力是微滴驱动、电泳、电润湿、介电电泳、静电驱动、电场介导、电极介导、毛细管力、色谱法、离心或抽吸。在某些实施方案中,所述声力是表面声波。
在某些实施方案中,产生电驱动力包括产生交流电。在某些实施方案中,所述交流电具有10v或更高的均方根(rms)电压。在某些其它实施方案中,所述交流电具有在射频范围内的频率。
在某些实施方案中,所述第一液体微滴是可极化的液体,所述第二液体微滴是可极化的液体,所述混合物是可极化的液体,或所述第一液体微滴和第二液体微滴二者各自是可极化的液体。
在某些实施方案中,所述方法还包括使用电驱动力将所述混合物的至少一部分定位在所述孔阵列上面。在某些其它实施方案中,所述方法还包括使用毛细管元件将所述混合物的至少一部分定位在所述孔阵列上面,所述毛细管元件被构造成促进所述混合物向所述孔阵列的运动。
在某些实施方案中,所述支持物是磁性固体支持物。在某些其它实施方案中,当使用磁性固体支持物时,从相对于所述混合物的至少一部分的相反方向施加电驱动力和磁场。
在某些实施方案中,所述方法还包括如下混合所述混合物:使所述混合物前后移动,使所述混合物以环状模式移动,将所述混合物分割成两份或更多份的子混合物和合并所述子混合物。
在某些实施方案中,所述混合物是水性液体。在某些其它实施方案中,所述混合物是不可混溶的液体。在某些其它实施方案中,所述液体微滴是疏水液体微滴。在某些实施方案中,所述孔阵列具有亲水表面。在某些其它实施方案中,所述孔阵列具有疏水表面。在某些实施方案中,所述基底包括亲水表面。在某些其它实施方案中,所述基底包括疏水表面。在某些实施方案中,所述方法还包括用一系列电极产生电驱动力以将所述混合物移动至所述孔阵列,从而密封被加载的孔。
在某些实施方案中,给所述阵列的一个或多个孔加载至少一种固体支持物。在某些其它实施方案中,所述加载包括施加磁场以促进至少一种固体支持物向所述阵列的一个或多个孔中的运动。在某些其它实施方案中,所述方法还包括除去在所述加载以后没有加载进所述阵列的孔中的任何固体支持物。在某些其它实施方案中,所述除去包括用所述系列电极产生电驱动力以将可极化的流体微滴移动至所述孔阵列,以将所述混合物的至少一部分移动至离开所述孔阵列一段距离。在某些其它实施方案中,所述除去包括用所述系列电极产生电驱动力以移动水性洗涤微滴横穿过所述孔阵列。
在某些实施方案中,使用微流体装置、数字微流体装置(dmf)、基于表面声波的微流体装置(saw)、集成的dmf和分析物检测装置、集成的saw和分析物检测装置或基于机器人技术的测定处理单元执行所述方法。
在某些实施方案中,所述测量包括确定阵列孔中的固体支持物的总数。在某些实施方案中,所述测量包括确定含有所述可检测标记的阵列孔中的固体支持物的数目。在某些实施方案中,所述测量包括:从阵列孔中的固体支持物的总数中减去含有可检测标记的固体支持物的数目,以确定不含有任何可检测标记的阵列孔中的固体支持物的数目。在某些实施方案中,所述测量包括:确定含有可检测标记的固体支持物与不含有任何可检测标记的固体支持物的数目的比率。
本文中还公开了一种给孔加载颗粒的方法,包括用多个电极产生电场以将含有微粒的液体微滴移动至孔阵列,其中所述孔阵列的一个或多个孔的大小足以在其中加载颗粒;给一个或多个孔加载颗粒;和用所述多个电极产生电场以将可极化的流体微滴移动至所述孔阵列,从而密封所述孔阵列。
在一些实施方案中,所述方法还包括使用电场将所述液体微滴定位在所述孔阵列上面。在一些实施方案中,所述方法还包括使用毛细管元件将所述液体微滴定位在所述孔阵列上面,所述毛细管元件被构造成促进所述液体微滴向所述孔阵列的运动。在一些实施方案中,所述颗粒是磁珠。在一些实施方案中,所述加载包括施加磁场以促进一个或多个磁珠向所述阵列的一个或多个孔中的运动。在一些实施方案中,所述孔阵列具有亲水表面。在一些实施方案中,所述孔阵列具有疏水表面。在一些实施方案中,所述产生电场包括产生交流电。在某些实施方案中,所述交流电具有10v或更高的均方根(rms)电压。在某些实施方案中,所述交流电具有在射频范围内的频率。
本文中还公开了一种形成数字微流体和分析物检测装置的方法,包括展开包括第一基底的第一卷(roll)以将所述第一基底的第一部分定位在第一位置;在处于所述第一位置的所述第一基底的第一部分上形成多个电极;和在处于第二位置的所述第一基底的第二部分上形成孔阵列。
在一些实施方案中,所述方法还包括:在形成所述孔阵列之前,展开所述第一卷以将邻接所述第一基底的第一部分的所述第二部分定位在所述第二位置。在一些实施方案中,所述方法还包括:展开包括第二基底的第二卷以将第三基底的第三部分定位在第三位置;和以足以将所述第二基底与所述第一基底相隔定位的方式在所述第三位置粘合所述第二基底和所述第一基底。
本文中还公开了一种形成集成的数字微流体和分析物检测装置的方法,包括展开包括第一基底的第一卷以将所述第一基底的第一部分定位在第一位置;在处于所述第一位置的所述第一基底的第一部分上形成多个电极;展开包括第二基底的第二卷以将所述第二基底的第二部分定位在第二位置;在处于第二位置的所述第二部分上形成孔阵列;和粘合所述第二基底和所述第一基底,所述粘合的方式足以:将所述第二基底与所述第一基底相隔定位;和将所述第二部分定位在所述第一部分上面,或在邻接所述第一基底的第一部分的第三部分上面,其中所述孔阵列面对所述第一基底。
在一些实施方案中,所述形成孔阵列包括使用热或紫外纳米压印光刻、纳米压印辊子(roller)、激光消融,或通过将包括孔阵列的预制基底粘在所述第一基底的第一部分上。在一些实施方案中,所述方法还包括使所述第一基底经受强烈的热、压力或紫外线以使用模具在所述第一基底上或内部形成声子结构。
在一些实施方案中,所述方法还包括使用印刷机装置在所述系列电极上施加疏水材料和/或电介质材料。在一些实施方案中,所述疏水材料和/或电介质材料包括固化材料。在一些实施方案中,所述方法还包括施加热或紫外线以固化施加的疏水材料和/或电介质材料。在一些实施方案中,所述方法还包括将所述第一基底和第二基底切块(dicing)以产生包括所述第一部分和第二部分的粘合基底。
本文中还公开了一种检测液体微滴中的目标分析物的方法,所述方法包括:提供包括目标分析物的第一液体微滴;提供包括特异性结合成员和经标记的分析物的第二液体微滴,其中所述结合成员固定化在至少一种固体支持物上,所述特异性结合成员特异性地结合所述目标分析物,且所述经标记的分析物是用可检测标记进行标记的目标分析物;使用能量来施加力以操纵所述第一液体微滴和所述第二液体微滴,从而建立混合物;和将所述混合物的全部或至少一部分移动至孔阵列,其中所述阵列的一个或多个孔的大小足以容纳所述至少一种固体支持物。
本文中还公开了一种检测液体微滴中的目标分析物的方法,包括提供包括目标分析物的第一液体微滴;提供包括固定化的分析物和至少一种特异性结合成员的第二液体微滴,其中所述固定化的分析物是固定化在至少一种固体支持物上的目标分析物,所述至少一种特异性结合成员特异性地结合所述目标分析物,且所述至少一种特异性结合成员用可检测标记进行标记;使用能量来施加力以操纵所述第一液体微滴和所述第二液体微滴,从而建立混合物;将所述混合物的全部或至少一部分移动至孔阵列,其中所述阵列的一个或多个孔的大小足以容纳所述至少一种固体支持物;和检测所述孔中的目标分析物。
附图说明
图1a图示说明了根据一个实施方案,集成的数字微流体和分析物检测装置的侧视图。
图1b图示说明了根据另一个实施方案,集成的数字微流体和分析物检测装置的侧视图。
图2a图示说明了根据一个实施方案,集成的数字微流体和分析物检测装置的侧视图。
图2b图示说明了根据另一个实施方案,集成的数字微流体和分析物检测装置的侧视图。
图3a图示说明了图2a的装置的侧视图,其中液体微滴正在所述装置中移动。
图3b图示说明了图2b的装置的侧视图,其中微滴正在所述装置中移动。
图4a图示说明了图2a的装置的侧视图,其中含有颗粒/珠子的微滴正在移动到孔阵列上。
图4b图示说明了图2b的装置的侧视图,其中含有颗粒/珠子的微滴与不可混溶的流体微滴正在移动到孔阵列上。
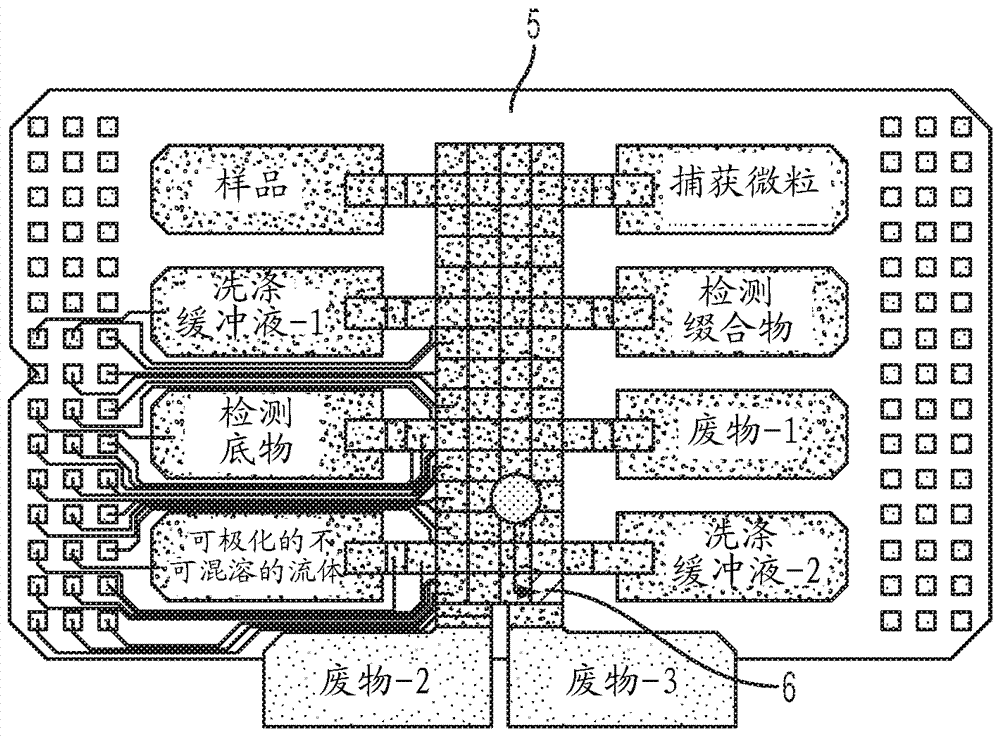
图5图示说明了使用所述装置的亲水毛细管区域使水性微滴在所述孔阵列上面移动。
图6图示说明了正在孔阵列上面移动的水性微滴。
图7a-7b图示说明了孔的侧壁的各种示例取向。
图8图示说明了制造数字微流体和分析物检测装置的第二(例如,底)基底的一个实施例。
图9图示说明了制造数字微流体和分析物检测装置的第一(例如,顶)基底的一个实施例。
图10图示说明了组装顶基底和底基底以制造多个数字微流体和分析物检测装置的一个实施例。
图11a和图11b显示了从本公开的示例性数字微流体和分析物检测装置的底基底的顶部的视图。
图12a-12d图示说明了将孔阵列制造进集成的数字微流体和分析物检测装置的实施例。
图13a图示说明了集成的微流体和分析物装置和孔阵列的表面声音部件的一个实施方案的侧视图。
图13b图示说明了集成的微流体和分析物装置和孔阵列的表面声音部件的另一个实施方案的侧视图。
图14a-14b图示说明了制造样品制备部件和孔阵列部件的一个实施例。
图15描绘了本公开的一种示例性方法。
图16图示说明了用于除去没有位于描绘的装置的孔中的珠子的一种示例性方法。
图17图示说明了用于除去没有位于描绘的装置的孔中的珠子的另一种示例性方法。
图18描绘了低成本dmf芯片的制造过程的示意图。
图19描绘了根据图18中的示意图制造的单个柔性芯片。
图20描绘了根据本公开的实施方案,dmf芯片中的微滴的驱动。
图21a-21e描绘了根据本公开的实施方案,dmf芯片中的免疫测定的表现。
图22a和22b是示意图,显示了根据本公开的实施方案,dmf顶电极芯片和孔阵列的设计和制造方法。
图23显示了根据本公开的实施方案,孔设计的示意图。
图24a和24b是示意图,显示了根据本公开的实施方案的孔间隔形式。
图25是根据本公开的实施方案,孔阵列的放大光学图像的集合。
图26的示意图显示了根据本公开的实施方案,从dmf顶电极芯片和孔阵列的集成dmf-孔装置的组装。
图27a-27g是一组示意图,显示了根据本公开的实施方案,在集成dmf-孔装置上执行的免疫测定。
图28是根据本公开的实施方案,与孔阵列中的数字荧光检测偶联的基于酶联免疫吸附测定(elisa)的夹心免疫测定的示意图。
图29是示意图,显示了根据本公开的实施方案,用于dmf-指导的微粒向孔阵列中的顶加载的部件。
图30a-30d是一组示意图,显示了根据本公开的实施方案,使用集成dmf-孔装置的促甲状腺激素(tsh)免疫测定的步骤。
具体实施方式
本发明公开了一种集成的微流体和分析物检测装置。本文中还提供了使用集成的微流体和分析物检测装置和有关系统的示例性方法。
在更详细地描述本发明之前,应当理解,本发明不限于描述的具体实施方案,因此,当然可以变化。还应当理解,在本文中使用的术语仅仅用于描述具体实施方案的目的,且无意成为限制性的,因为本发明的范围仅由所附权利要求书限定。
必须指出,在本文中和在所附权利要求书中使用的单数形式“一个”、“一种”和“所述”包括复数指示物,除非上下文另外清楚地指明。因而,例如,表述“一个电极”包括多个这样的电极,且表述“所述孔”包括对一个或多个孔和本领域技术人员已知的其等同物的提及,以此类推。
在本文中提及的所有出版物都通过引用并入本文,以公开和描述与所述出版物引用有关的方法和/或材料。如果本公开和通过引用并入的出版物之间存在矛盾,以本公开为准。
详细描述
本公开的实施方案涉及用于分析样品中的分析物的方法、系统和装置。在某些实施方案中,所述样品可以是生物样品。
1.定义
在描述本公开的实施方案之前,应当理解,本发明不限于具体的特定实施方案,因此,当然可以变化。还应该理解,本文中使用的术语仅用于描述具体实施方案的目的,且无意进行限制。
如本文中使用的“包含”、“包括”、“具有”、“有”、“可以”、“含有”及其变体意图是开放式的过渡短语、术语或词语,其不排除另外动作或结构的可能性。单数形式“一个”、“一种”和“所述”包括复数所指示物,除非上下文另外清楚地指明。本公开也预见到“包含”本文呈现的实施方案或元件、“由其组成”和”基本上由其组成”的其它实施方案,不论是否明确地阐述。
就本文中所述的数字范围而言,明确地预见到具有相同精确度的在二者之间的每个插入数字。例如,就6-9的范围而言,除了6和9以外还预见到数字7和8,且就范围6.0-7.0而言,明确地预见到数字6.0、6.1、6.2、6.3、6.4、6.5、6.6、6.7、6.8、6.9和7.0。
在本文中可互换地使用的“亲和力”和“结合亲和力”表示结合成员与分析物的结合的趋势或强度。例如,结合亲和力可以由平衡解离常数(kd)、解离速率(kd)或结合速率(ka)表示。
如本文中使用的“类似物”表示具有与目标分子类似的结构的分子(例如,核苷类似物、核苷酸类似物、糖磷酸酯类似物、分析物类似物等)。分析物类似物是在结构上类似于分析物、但是结合成员对其具有不同亲和力的分子。
如本文中使用的术语“适体”表示可以以高亲和力和特异性结合预选靶标(包括小分子、蛋白和肽等)的寡核苷酸或肽分子。由于它们的形成螺旋和单链环的倾向,适体可以采取多种形状。寡核苷酸或核酸适体可以是单链dna或rna(ssdna或ssrna)分子。肽适体可以包括短的可变肽结构域,其在两个末端处连接至蛋白支架。
“珠子”和“颗粒”在本文中可互换地使用,且表示基本上球形的固体支持物。
“组分、”“多种组分、”或“至少一种组分”通常表示捕获抗体、检测试剂或缀合物、校准物、对照、灵敏度对象组、容器、缓冲液、稀释剂、盐、酶、酶的辅因子、检测试剂、预处理试剂/溶液、底物(例如,作为溶液)、停止溶液等,其可以根据本文所述的方法和本领域中已知的其它方法,被包括在用于测定试验样品(诸如患者尿、血清、全血、组织抽吸物或血浆样品)的试剂盒中。一些组分可以是在溶液中或者被冻干以重构用于测定。
在本文中可互换地使用的“数字微流体(dmf)”、“数字微流体模块(dmf模块)”或“数字微流体装置(dmf装置)”表示利用数字的或基于微滴的微流体技术来提供分散的且小体积的微滴形式的液体的操纵的模块或装置。数字微流体使用乳剂科学的原理,在通道中建立流体-流体分散(主要是油包水乳剂)。它允许产生单分散滴/泡或具有非常低的多分散性。数字微流体基于可重构网络内不连续流体微滴的显微操作。通过组合微滴形成、易位、分拆和合并的基本操作,可以将复杂指令程序化。
数字微流体操作离散体积的流体,其可以由二元电信号操纵。通过使用离散的单位体积微滴,可以将微流体运行定义为一组重复的基本操作,即,使一个单位的流体移动一个单位的距离。可以使用液体的表面张力性质形成微滴。微滴的驱动是基于由电极产生的静电力的存在,所述电极放在所述微滴所位于的底表面下方。可以使用不同类型的静电力来控制微滴的形状和运动。可以用于建立前述静电力的一种技术是基于介电电泳,其依赖于微滴和周围介质之间的电容率差异,且可以利用高频率ac电场。可以用于建立前述静电力的另一种技术是基于电润湿,其依赖于存在于表面上的液体微滴和所述表面之间的表面张力对施加于所述表面的电场的相依性。
“拖拉标签(dragtag)”表示迁移率修饰剂。拖拉标签可以是遗传工程改造的高度重复性多肽(“蛋白聚合物”),其被设计成大的、水溶性的和完全单分散的。可以将带正电荷的精氨酸以规律间隔有意地引入氨基酸序列中以增加流体动力学阻力,而不增加拖拉标签长度。拖拉标签描述在美国专利公开号20120141997中,其通过引用并入本文。
如本文中使用的“酶可切割序列”表示可以被酶切割的任何核酸序列。例如,所述酶可以是蛋白酶或内切核酸酶,诸如限制性内切核酸酶(也称作限制性酶)。限制性内切核酸酶能够在预定核苷酸之间的特定dna切割位点处识别和切割dna分子。一些内切核酸酶(例如,如fokl)包含切割结构域,其在特定位置非特异性地切割dna,不论存在于该位置的核苷酸。在一些实施方案中,限制性内切核酸酶的特异性dna切割位点和dna识别位点是相同的。
“球状蛋白”表示具有大致球形的水溶性蛋白。球状蛋白的例子包括但不限于卵白蛋白、β-球蛋白、c-反应蛋白、纤维蛋白、血红蛋白、igg、igm和凝血酶。
在本文中可互换地使用的“标记”或“可检测标记”表示连接到特异性结合成员或分析物,以使得所述特异性结合成员和所述分析物之间的反应可检测的部分,且如此标记的特异性结合成员或分析物被称作“可检测地标记”。标记可以产生通过视觉装置或仪器装置可检测的信号。各种标记包括:(i)通过可切割的接头连接到特异性结合成员或分析物的标签;或(ii)产生信号的物质,诸如发色团、荧光化合物、酶、化学发光化合物、放射性化合物等。标记的代表性例子包括产生光的部分(例如,吖啶鎓化合物)和产生荧光的部分(例如,荧光素)。本文描述了其它标记。在这点上,所述部分本身可以不是可检测的,但是可以在与另一个部分反应以后变成可检测的。术语“可检测地标记的”的应用意图包括这样的标记法。
“微粒”和“微珠”在本文中可互换地使用,且表示允许占据或沉降在孔阵列(例如,如检测模块中的孔阵列)中的微珠或微粒。所述微粒和微珠可以含有至少一种结合目标分析物的特异性结合成员和至少一种可检测标记。可替换地,所述微粒和微珠可以含有结合分析物的第一特异性结合成员和也结合分析物且含有至少一种可检测标记的第二特异性结合成员。
“核苷碱基”或“碱基”是指核酸或多核苷酸技术或肽核酸技术领域中通常已知的用于产生聚合物的那些天然存在的和合成的杂环部分。合适的核苷碱基的非限制性例子包括:腺嘌呤、胞嘧啶、鸟嘌呤、胸腺嘧啶、尿嘧啶、5-丙炔基-尿嘧啶、2-硫-5-丙炔基-尿嘧啶、5-甲基胞嘧啶、假异胞嘧啶、2-硫尿嘧啶和2-硫胸腺嘧啶、2-氨基嘌呤、n9-(2-氨基-6-氯嘌呤)、n9-(2,6-二氨基嘌呤)、次黄嘌呤、n9-(7-脱氮-鸟嘌呤)、n9-(7-脱氮-8-氮杂-鸟嘌呤)和n8-(7-脱氮-8-氮杂-腺嘌呤)。核苷碱基可以连接至其它部分以形成核苷、核苷酸和核苷/核苷酸类似物。
“核苷”表示由在1'位与戊糖(诸如核糖、2'-脱氧核糖或2',3'-二脱氧核糖)的异头碳相连的嘌呤、脱氮嘌呤或嘧啶核苷碱基(例如,腺嘌呤、鸟嘌呤、胞嘧啶、尿嘧啶、胸腺嘧啶、7-脱氮腺嘌呤、7-脱氮鸟苷)组成的化合物。
如本文中使用的“核苷酸”表示核苷的磷酸酯,例如,单-、二-或三-磷酸酯,其中最常见的酯化位点是连接到戊糖的c-5位置的羟基。
“核苷碱基聚合物”或“核苷碱基寡聚体”表示通过键连接以形成寡聚体的两个或更多个核苷碱基。核苷碱基聚合物或寡聚体包括但不限于:多核苷酸和寡核苷酸(例如,dna和rna聚合物和寡聚体)、多核苷酸和寡核苷酸类似物和多核苷酸和寡核苷酸模仿物,诸如聚酰胺或肽核酸。核苷碱基聚合物或寡聚体在大小上可以从几个核苷碱基至几百个核苷碱基或至几千个核苷碱基变化。所述核苷碱基聚合物或寡聚体可以包括约2-100个核苷碱基或约8000-10000个核苷碱基。例如,所述核苷碱基聚合物或寡聚体可以具有至少约2个核苷碱基、至少约5个核苷碱基、至少约10个核苷碱基、至少约20个核苷碱基、至少约30个核苷碱基、至少约40个核苷碱基、至少约50个核苷碱基、至少约60个核苷碱基、至少约70个核苷碱基、至少约80个核苷碱基、至少约90个核苷碱基、至少约100个核苷碱基、至少约200个核苷碱基、至少约300个核苷碱基、至少约400个核苷碱基、至少约500个核苷碱基、至少约600个核苷碱基、至少约700个核苷碱基、至少约800个核苷碱基、至少约900个核苷碱基、至少约1000个核苷碱基、至少约2000个核苷碱基、至少约3000个核苷碱基、至少约4000个核苷碱基、至少约5000个核苷碱基、至少约6000个核苷碱基、至少约7000个核苷碱基、至少约8000个核苷碱基、至少约9000个核苷碱基或至少约10000个核苷碱基。
“聚合物刷子”表示用一个末端连接至表面的聚合物层。所述聚合物靠近在一起并形成层或包覆物(coating),所述层或包覆物形成它自身的环境。所述刷子可以处于溶剂状态(当悬挂链浸入溶剂中时)或处于熔化状态(当悬挂链完全填满可用空间时)。另外,当聚合物链本身携带静电荷时,存在单独类别的聚电解质刷子。所述刷子可以通过高密度的移植链来表征。然后,有限的空间导致链的强延伸,和系统的罕见性能。刷子可以用于稳定胶体、减少表面之间的摩擦和提供人工关节中的润滑。
“多核苷酸”或“寡核苷酸”表示核苷碱基聚合物或寡聚体,其中核苷碱基通过糖磷酸酯键(糖-磷酸酯主链)连接。示例性的多核苷酸和寡核苷酸包括2'-脱氧核糖核苷酸的聚合物(dna)和核糖核苷酸的聚合物(rna)。多核苷酸可以完全由核糖核苷酸组成,完全由2'-脱氧核糖核苷酸组成,或由它们的组合组成。术语核酸包括术语多核苷酸和寡核苷酸,且包括核苷酸单体的单链和双链聚合物。
“多核苷酸类似物”或“寡核苷酸类似物”表示核苷碱基聚合物或寡聚体,其中核苷碱基通过包含一个或多个糖磷酸酯类似物的糖磷酸酯主链连接。典型的糖磷酸酯类似物包括但不限于:糖烷基膦酸酯、糖亚磷酰胺类、糖烷基磷酸三酯或取代的烷基磷酸三酯、糖硫代磷酸酯、糖二硫代磷酸酯、糖磷酸酯和糖磷酸酯类似物,其中所述糖是2'-脱氧核糖或核糖以外的糖,核苷碱基聚合物具有带正电荷的糖-胍基互连,诸如在美国专利号6,013,785和美国专利号5,696,253中描述的那些。
如本文中使用的“受体”表示识别内源化学信号并对其做出应答的蛋白-分子。当这样的内源化学信号结合受体时,它们造成某种形式的细胞/组织-应答。受体的例子包括但不限于神经受体、激素受体、营养物受体和细胞表面受体。
如本文中使用的“隔离物”表示这样的化学部分:其从特异性结合成员延伸出可切割基团,或其提供结合成员和支持物之间的链接,或其从光可切割的部分延伸出标记/标签。在一些实施方案中,可以在基于多肽或核苷酸的标签或标记的n-端或c-端处包括一个或多个隔离物,以便使所述序列与特异性结合成员具有最佳距离。隔离物可以包括但不限于:6-氨基己酸,6-氨基己酸;1,3-二氨基丙烷;1,3-二氨基乙烷;聚乙二醇(peg)聚合物基团,和1-5个氨基酸的短氨基酸序列,诸如聚甘氨酸序列。
在本文中可互换地使用的“特异性结合配偶体”或“特异性结合成员”表示,相对于对其它分子的显著更少的识别,两种不同分子中特异性地识别另一种分子的一种分子。所述两种不同分子中的一种分子具有在表面上或在内腔中的区域,其特异性地结合另一种分子的特定空间和极性构成,并因此被定义为与所述另一种分子的特定空间和极性构成互补。所述分子可以是特异性结合对的成员。例如,特异性结合成员可以包括但不限于蛋白,诸如受体、酶、抗体和适体、肽、核苷酸、寡核苷酸、多核苷酸和它们的组合。
如本文中使用的“标签”或“标签分子”都表示这样的分子(例如,从第二结合成员切割,从靶分析物解离):其用于提供样品中的分析物水平的指示。这些术语表示单标签分子或多个相同标签分子。同样,除非另有说明,否则“标签”表示一个标签或一个或多个标签。
如本文中使用的“示踪剂”表示与标签或标记缀合的分析物或分析物片段,其中所述与标签或标记缀合的分析物可以与分析物有效地竞争抗体上对所述分析物特异性的位点。例如,所述示踪剂可以是分析物或分析物的类似物,诸如环孢素或它的类似物isa247、维生素d和它的类似物、性激素和它们的类似物等。
除非另有定义,否则在本文中使用的所有技术和科学术语具有本领域普通技术人员通常理解的相同含义。在冲突的情况下,以本文件(包括定义)为准。下面描述了优选的方法和材料,但与本文描述的那些类似或等同的方法和材料也可以用于实践或试验本发明。本文中提及的所有出版物、专利申请、专利和其它参考文献通过引用整体并入,以公开和描述引用的出版物与其相关的方法和/或材料。本文中公开的材料、方法和实施例仅仅是示例性的,且无意成为限制性的。
用于分析物分析的方法
本文中提供了用于分析物分析的方法。所述方法可能涉及单个分子计数。在某些实施方案中,用于分析物分析的方法可能涉及评估存在于样品中的分析物。在某些实施方案中,所述评估可以用于确定分析物在样品中的存在和/或浓度。在某些实施方案中,所述方法还可以用于确定存在于在样品中的多种不同分析物的存在和/或浓度。
本文中提供了用于检测液体微滴中的目标分析物的方法(其中所述目标分析物来自试验或生物样品)。所述方法包括:提供含有目标分析物的第一液体微滴,提供含有至少一种固体支持物(例如,如磁性固体支持物(诸如珠子))的第二液体微滴,所述固体支持物含有结合所述目标分析物的特异性结合成员,使用能量施加力以操纵所述第一液体微滴(其含有所述目标分析物)和所述第二液体(其含有至少一种固体支持物)以建立混合物,将所述混合物的全部或至少一部分移动至孔阵列(其中所述阵列的一个或多个孔的大小足以容纳所述至少一种固体支持物),在将所述混合物的一部分移动至所述孔阵列之前、之后或者之前或之后二者,将至少一种可检测标记加入所述混合物,和检测所述孔中的目标分析物。在某些实施方案中,“使用能量施加力以操纵所述第一液体微滴和所述第二液体微滴”表示使用非机械力(即,例如,不使用泵和/或阀而产生的能量)来提供或施加力,所述力至少操作(诸如合并或组合)所述第一液体微滴和第二液体微滴(和任选地,另外的微滴)成为混合物。可以用在本文所述的方法中的非机械力的例子包括电驱动力(诸如微滴驱动、电泳、电润湿、介电电泳、静电驱动、电场介导、电极介导、毛细管力、色谱法、离心或抽吸)和/或声力(诸如表面声波(或“saw”))。在某些实施方案中,产生的电驱动力是交流电。例如,所述交流电可以具有10v、15v、20v、25v、30v、35v或更高的均方根(rms)电压。例如,这样的交流电可以具有10v或更高、15v或更高、20v或更高、25v或更高、30v或更高或35v或更高的rms电压。可替换地,所述交流电可以具有在射频范围内的频率。
在某些实施方案中,如果使用磁性固体支持物,可以施加电驱动力和磁场,并相对于所述混合物的至少一部分从相反方向施加。在某些其它实施方案中,所述混合物通过如下移动它进行混合:前后,以环状模式或将它分割成两份或更多份的子混合物并然后合并所述子混合物。在某些其它实施方案中,使用系列或多个电极(即,至少2个或更多、至少3个或更多、至少4个或更多、至少5个或更多、至少6个或更多、至少7个或更多、至少8个或更多、至少9个或更多、至少10个或更多、至少11个或更多、至少12个或更多、至少13个或更多、至少14个或更多、至少15个或更多等)可以产生电驱动力,以将所述混合物移动至所述孔阵列,从而密封所述孔(其加载了至少一种固体支持物)。
在某些实施方案中,将所述混合物的全部或至少一部分移动至孔阵列导致至少一种固体支持物向所述孔阵列中的加载(填充和/或放置)。在某些实施方案中,使用磁场来促进所述混合物的运动,并因而促进至少一种固体支持物向所述阵列的一个或多个孔中的运动。在某些实施方案中,将至少一种固体支持物加载进孔中以后,可以使用本领域已知的常规技术除去没有加载进孔中的任何固体支持物。例如,这样的除去可以包括用系列或多个电极产生电驱动力(诸如前文描述的那种),以使流体微滴(诸如可极化的流体微滴)移动至所述孔阵列,从而使所述混合物的至少一部分移动至离开所述孔阵列一段距离(其长度不是关键性的)。在某些实施方案中,可以使用水性洗涤液体来除去没有与任何目标分析物结合的固体支持物。在这样的实施方案中,所述除去包括用系列或多个电极产生电驱动力以移动水性洗液(或洗涤)微滴(第三微滴)穿过所述孔阵列。用于所述洗涤的水性液体的量和类型不是关键性的。
在某些实施方案中,所述方法中的混合物是水性液体。在其它实施方案中,所述混合物是不可混溶的液体。在其它实施方案中,所述液体微滴是疏水液体微滴。在其它实施方案中,所述液体微滴是亲水液体微滴。在某些实施方案中,在所述方法中使用的孔阵列具有疏水表面。在其它实施方案中,所述孔阵列具有亲水表面。
在某些实施方案中,在所述方法中使用的第一液体微滴是可极化的液体。在某些实施方案中,在所述方法中使用的第二液体微滴是可极化的液体。在某些实施方案中,在所述方法中使用的第一液体微滴和第二液体微滴是可极化的液体。在某些实施方案中,所述混合物是可极化的液体。在某些实施方案中,所述第一微滴、第二微滴和混合物中的一种或多种是可极化的液体。
在某些实施方案中,所述至少一种固体支持物包含至少一种特异性地结合所述目标分析物的结合成员。在某些实施方案中,在将所述混合物的至少一部分移动至孔阵列之前,将所述可检测标记加入所述混合物中。在某些其它实施方案中,在移动所述目标分析物的至少一部分以后,将所述可检测标记加入所述混合物中。在某些实施方案中,所述可检测标记包含至少一种特异性地结合所述目标分析物的结合成员。在某些实施方案中,所述可检测标记包含发色团、荧光化合物、酶、化学发光化合物或放射性化合物。在某些实施方案中,所述结合成员是受体、适体或抗体。在某些实施方案中,所述方法还包括使用毛细管元件将所述混合物的至少一部分定位在所述孔阵列上面,所述毛细管元件被构造成促进所述混合物向所述孔阵列的运动。
在某些实施方案中,使用微流体装置执行本文描述的方法。在某些实施方案中,使用数字微流体装置(dmf)执行本文描述的方法。在某些实施方案中,使用基于表面声波的微流体装置(saw)执行本文描述的方法。在某些实施方案中,使用集成的dmf和分析物检测装置执行本文描述的方法。在某些实施方案中,使用集成的基于表面声波的微流体装置和分析物检测装置执行本文描述的方法。在某些实施方案中,使用基于机器人技术的测定处理单元执行本文描述的方法。
本文中提供了用于检测液体微滴中的目标分析物的方法(其中所述目标分析物来自试验或生物样品)。所述方法包括:提供含有目标分析物的第一液体微滴,提供含有至少一种可检测标记的第二液体微滴,所述可检测标记含有结合所述目标分析物的特异性结合成员,使用能量施加力以操纵所述第一液体微滴(其含有所述目标分析物)和所述第二液体(其含有至少一种固体支持物)以建立混合物(即,分析物/可检测标记-特异性的结合成员复合物),将所述混合物的全部或至少一部分移动至孔阵列(其中所述阵列的一个或多个孔的大小足以容纳所述至少一种固体支持物),和检测所述孔中的目标分析物。在某些实施方案中,“使用能量施加力以操纵所述第一液体微滴和所述第二液体微滴”表示使用非机械力(即,例如,不使用泵和/或阀而产生的能量)来提供或施加力,所述力至少操作(诸如合并或组合)所述第一液体微滴和第二液体微滴(和任选地,另外的微滴)成为混合物。可以用在本文所述的方法中的非机械力的例子包括电驱动力(诸如微滴驱动、电泳、电润湿、介电电泳、静电驱动、电场介导、电极介导、毛细管力、色谱法、离心或抽吸)和/或声力(诸如表面声波(或“saw”))。在某些实施方案中,产生的电驱动力是交流电。例如,所述交流电可以具有10v、15v、20v、25v、30v、35v或更高的均方根(rms)电压。例如,这样的交流电可以具有10v或更高、15v或更高、20v或更高、25v或更高、30v或更高或35v或更高的rms电压。可替换地,所述交流电可以具有在射频范围内的频率。
在某些实施方案中,所述混合物通过如下移动它进行混合:前后,以环状模式,或将它分割成两份或更多份的子混合物并然后合并所述子混合物。在某些其它实施方案中,可以使用系列或多个电极(即,至少2个或更多、至少3个或更多、至少4个或更多、至少5个或更多、至少6个或更多、至少7个或更多、至少8个或更多、至少9个或更多、至少10个或更多、至少11个或更多、至少12个或更多、至少13个或更多、至少14个或更多、至少15个或更多等)产生电驱动力,以将所述混合物移动至所述孔阵列,从而密封所述孔(其加载了至少一种固体支持物)。
在某些实施方案中,将所述混合物的全部或至少一部分移动至孔阵列导致分析物/可检测标记-特异性的结合成员复合物向所述孔阵列中的加载(填充和/或放置)。在某些实施方案中,使用磁场来促进所述混合物的运动,并因而促进至少一种分析物/可检测标记-特异性的结合成员复合物向所述阵列的一个或多个孔中的运动。例如,这样的除去可以包括用系列或多个电极产生电驱动力(诸如前文描述的那种),以使流体微滴(诸如可极化的流体微滴)移动至所述孔阵列,从而使所述混合物的至少一部分移动至离开所述孔阵列一段距离(其长度不是关键性的)。在某些实施方案中,可以使用水性洗涤液体来除去没有结合任何分析物的任何可检测标记-特异性的结合成员。在这样的实施方案中,所述除去包括用系列或多个电极产生电驱动力以移动水性洗液(或洗涤)微滴(第三微滴)穿过所述孔阵列。用于所述洗涤的水性液体的量和类型不是关键性的。
在某些实施方案中,所述方法中的混合物是水性液体。在其它实施方案中,所述混合物是不可混溶的液体。在其它实施方案中,所述液体微滴是疏水液体微滴。在其它实施方案中,所述液体微滴是亲水液体微滴。在某些实施方案中,在所述方法中使用的孔阵列具有疏水表面。在其它实施方案中,所述孔阵列具有亲水表面。
在某些实施方案中,在所述方法中使用的第一液体微滴是可极化的液体。在某些实施方案中,在所述方法中使用的第二液体微滴是可极化的液体。在某些实施方案中,在所述方法中使用的第一液体微滴和第二液体微滴是可极化的液体。在某些实施方案中,所述混合物是可极化的液体。在某些实施方案中,所述第一微滴、第二微滴和混合物中的一种或多种是可极化的液体。
在某些实施方案中,所述可检测标记结合至至少一种固体支持物。在某些实施方案中,所述可检测标记包含发色团、荧光化合物、酶、化学发光化合物或放射性化合物。在某些实施方案中,所述结合成员是受体、适体或抗体。在某些实施方案中,所述方法还包括使用毛细管元件将所述混合物的至少一部分定位在所述孔阵列上面,所述毛细管元件被构造成促进所述混合物向所述孔阵列的运动。
在某些实施方案中,使用微流体装置执行本文描述的方法。在某些实施方案中,使用数字微流体装置(dmf)执行本文描述的方法。在某些实施方案中,使用基于表面声波的微流体装置(saw)执行本文描述的方法。在某些实施方案中,使用集成的dmf和分析物检测装置执行本文描述的方法。在某些实施方案中,使用集成的基于表面声波的微流体装置和分析物检测装置执行本文描述的方法。在某些实施方案中,使用基于机器人技术的测定处理单元执行本文描述的方法。
本文中提供了用于测量液体微滴中的目标分析物的方法(其中所述目标分析物来自试验或生物样品)。所述方法包括:提供含有目标分析物的第一液体微滴,提供含有至少一种固体支持物(例如,磁性固体支持物(诸如珠子))的第二液体微滴,所述固体支持物含有结合所述目标分析物的特异性结合成员,使用能量施加力以操纵所述第一液体微滴(其含有所述目标分析物)和所述第二液体(其含有至少一种固体支持物)以建立混合物,将所述混合物的全部或至少一部分移动至孔阵列(其中所述阵列的一个或多个孔的大小足以容纳所述至少一种固体支持物),在将所述混合物的一部分移动至所述孔阵列之前、之后或者之前或之后二者,将至少一种可检测标记加入所述混合物,和测量所述孔中的目标分析物。在某些实施方案中,“使用能量施加力以操纵所述第一液体微滴和所述第二液体微滴”表示使用非机械力(即,例如,不使用泵和/或阀而产生的能量)来提供或施加力,所述力至少操作(诸如合并或组合)所述第一液体微滴和第二液体微滴(和任选地,另外的微滴)成为混合物。可以用在本文所述的方法中的非机械力的例子包括电驱动力(诸如微滴驱动、电泳、电润湿、介电电泳、静电驱动、电场介导、电极介导、毛细管力、色谱法、离心或抽吸)和/或声力(诸如表面声波(或“saw”))。在某些实施方案中,产生的电驱动力是交流电。例如,所述交流电可以具有10v、15v、20v、25v、30v、35v或更高的均方根(rms)电压。例如,这样的交流电可以具有10v或更高、15v或更高、20v或更高、25v或更高、30v或更高或35v或更高的rms电压。可替换地,所述交流电可以具有在射频范围内的频率。
在某些实施方案中,如果使用磁性固体支持物,可以施加电驱动力和磁场,并相对于所述混合物的至少一部分从相反方向施加。在某些其它实施方案中,所述混合物通过如下移动它进行混合:前后,以环状模式,或将它分割成两份或更多份的子混合物并然后合并所述子混合物。在某些其它实施方案中,使用系列或多个电极(即,至少2个或更多、至少3个或更多、至少4个或更多、至少5个或更多、至少6个或更多、至少7个或更多、至少8个或更多、至少9个或更多、至少10个或更多、至少11个或更多、至少12个或更多、至少13个或更多、至少14个或更多、至少15个或更多等)可以产生电驱动力以将所述混合物移动至所述孔阵列,从而密封所述孔(其加载了至少一种固体支持物)。
在某些实施方案中,将所述混合物的全部或至少一部分移动至孔阵列导致至少一种固体支持物向所述孔阵列中的加载(填充和/或放置)。在某些实施方案中,使用磁场来促进所述混合物的运动,并因而促进至少一种固体支持物向所述阵列的一个或多个孔中的运动。在某些实施方案中,将至少一种固体支持物加载进孔中以后,使用本领域已知的常规技术可以除去没有加载进孔中的任何固体支持物。例如,这样的除去可以包括用系列或多个电极产生电驱动力(诸如前文描述的那种)以使流体微滴(诸如可极化的流体微滴)移动至所述孔阵列,从而使所述混合物的至少一部分移动至离开所述孔阵列一段距离(其长度不是关键性的)。在某些实施方案中,可以使用水性洗涤液体来除去没有与任何目标分析物结合的固体支持物。在这样的实施方案中,所述除去包括用系列或多个电极产生电驱动力以移动水性洗液(或洗涤)微滴(第三微滴)穿过所述孔阵列。用于所述洗涤的水性液体的量和类型不是关键性的。
在某些实施方案中,所述方法中的混合物是水性液体。在其它实施方案中,所述混合物是不可混溶的液体。在其它实施方案中,所述液体微滴是疏水液体微滴。在其它实施方案中,所述液体微滴是亲水液体微滴。在某些实施方案中,在所述方法中使用的孔阵列具有疏水表面。在其它实施方案中,所述孔阵列具有亲水表面。
在某些实施方案中,在所述方法中使用的第一液体微滴是可极化的液体。在某些实施方案中,在所述方法中使用的第二液体微滴是可极化的液体。在某些实施方案中,在所述方法中使用的第一液体微滴和第二液体微滴是可极化的液体。在某些实施方案中,所述混合物是可极化的液体。在某些实施方案中,所述第一微滴、第二微滴和混合物中的一种或多种是可极化的液体。
在某些实施方案中,所述至少一种固体支持物包含至少一种特异性地结合所述目标分析物的结合成员。在某些实施方案中,在将所述混合物的至少一部分移动至孔阵列之前,将所述可检测标记加入所述混合物中。在某些其它实施方案中,在将所述目标分析物的至少一部分移动至所述孔阵列以后,将所述可检测标记加入所述混合物中。在某些实施方案中,所述可检测标记包含至少一种特异性地结合所述目标分析物的结合成员。在某些实施方案中,所述可检测标记包含发色团、荧光化合物、酶、化学发光化合物或放射性化合物。在某些实施方案中,所述结合成员是受体、适体或抗体。在某些实施方案中,所述方法还包括使用毛细管元件将所述混合物的至少一部分定位在所述孔阵列上面,所述毛细管元件被构造成促进所述混合物向所述孔阵列的运动。
在某些实施方案中,使用微流体装置执行本文描述的方法。在某些实施方案中,使用数字微流体装置(dmf)执行本文描述的方法。在某些实施方案中,使用基于表面声波的微流体装置(saw)执行本文描述的方法。在某些实施方案中,使用集成的dmf和分析物检测装置执行本文描述的方法。在某些实施方案中,使用集成的基于表面声波的微流体装置和分析物检测装置执行本文描述的方法。在某些实施方案中,使用基于机器人技术的测定处理单元执行本文描述的方法。
在某些实施方案中,所述测量首先包括确定所述阵列孔中固体支持物的总数(“固体支持物总数”)。接着,确定所述阵列孔中含有可检测标记的固体支持物的数目,例如,确定由可检测标记产生的信号的强度(“阳性值”)。从所述固体支持物总数减去所述阳性值以提供所述孔阵列中不含有可检测标记或未检出的固体支持物的数目(“阴性值”)。然后,可以确定所述孔阵列中阳性值与阴性值的比率,并然后与校正曲线进行对比。可替换地,使用如下所示的poission方程式
其中:
e:a是等于大约2.71828的常数,
μ:ixghd是指在指定区域中发生的成功的数目,且
x:是在指定区域中发生的成功的实际数目。
所述样品可以是含有或疑似含有目标分析物的任何试验样品。本文中使用的“分析物”、“靶分析物”、“目标分析物”可互换地使用,且表示在本文公开的方法和装置中测量的分析物。在下面进一步描述了目标分析物。
本文中使用的“接触”及其语法等同词表示任何类型的组合动作,其使结合成员与样品中的目标分析物足够近,以致于如果对所述结合成员特异性的目标分析物存在于所述样品中,将发生结合相互作用。接触可以以多种不同的方式实现,包括将所述样品与结合成员组合,通过引入结合成员与分析物紧密靠近而将靶分析物暴露于结合成员等。
在某些情况下,可以将所述第一结合成员固定化在固体支持物上。本文中使用的术语“固定化”表示所述第一结合成员与固体支持物的表面的稳定结合。“稳定结合”是指两个实体之间的物理结合,其中结合的平均半衰期是一天或更多,例如,在生理条件下。在某些方面,两个实体之间的物理结合在pbs中在4℃具有2天或更多、1周或更多、1个月或更多(包括6个月或更多,例如,1年或更多)的平均半衰期。根据某些实施方案,所述稳定结合源自两个实体之间的共价键、两个实体之间的非共价键(例如,离子键或金属键)或其它形式的化学吸引力,诸如氢键合、范德华力等。
具有在其上面固定化了结合试剂的表面的固体支持物可以是呈平面或非平面构象的任何方便表面,诸如微流体芯片的表面、隔室的内表面、珠子(如本文中定义)的外表面或多孔珠子的内表面和/或外表面。例如,所述第一结合成员可以共价地或非共价地连接至珠子,例如,胶乳、琼脂糖、sepharose、链霉亲和素、甲苯磺酰基活化的、环氧树脂、聚苯乙烯、氨基珠子、胺珠子、羧基珠子等。在某些实施方案中,所述珠子可以是颗粒,例如,微粒。在一些实施方案中,所述微粒可以是约0.1nm至约10微米,约50nm至约5微米,约100nm至约1微米,约0.1nm至约700nm,约500nm至约10微米,约500nm至约5微米,约500nm至约3微米,约100nm至700nm,或约500nm至700nm。例如,所述微粒可以是约4-6微米、约2-3微米或约0.5-1.5微米。小于约500nm的颗粒有时被视作纳米颗粒。因而,所述微粒任选地可以是约0.1nm至约500nm之间、约10nm至约500nm之间、约50nm至约500nm之间、约100nm至约500nm之间、约100nm、约150nm、约200nm、约250nm、约300nm、约350nm、约400nm、约450nm或约500nm的纳米颗粒。
在某些实施方案中,所述珠子可以是磁珠或磁性颗粒。在某些实施方案中,所述珠子可以是磁性纳米珠子、纳米颗粒、微珠或微粒。磁性珠子/颗粒可以是铁磁性的、亚铁磁性的、顺磁的、超顺磁的或铁磁流体的。示例性的铁磁性材料包括fe、co、ni、gd、dy、cro2、mnas、mnbi、euo、nio/fe。亚铁磁性材料的例子包括nife2o4、cofe2o4、fe3o4(或feo.fe2o3)。珠子可以具有固体核心部分,其为磁性的且被一个或多个非磁性层包围。可替代地,所述磁性部分可以是在非磁性核心周围的层。在其上面固定化了第一结合成员的固体支持物可以以干燥形式或以液体形式储存。在使样品与在其上面固定化了第一结合成员的磁珠接触之前或之后,可以使磁珠处于磁场中。
接触步骤以后,可以将样品和第一结合成员温育足够的时间段以允许发生结合成员和分析物之间的结合相互作用。另外,所述温育可以是在促进特异性结合相互作用的结合缓冲液中。通过改变结合缓冲液,可以在测定中操作或改变所述第一结合成员和/或所述第二结合成员的结合亲和力和/或特异性。在一些实施方案中,通过改变结合缓冲液,可以增加所述结合亲和力和/或特异性。在一些实施方案中,通过改变结合缓冲液,可以降低所述结合亲和力和/或特异性。
使用下述的公开的方法和装置可以测量所述第一结合成员和/或所述第二结合成员的结合亲和力和/或特异性。在一些实施方案中,使用一组条件测定样品的一个等分试样,并与使用不同组的条件测定的样品的另一个等分试样进行对比,由此确定所述条件对结合亲和力和/或特异性的影响。例如,变化或改变所述条件可以是以下一种或多种:从样品除去靶分析物,加入与靶分析物或配体竞争结合的分子,和改变ph、盐浓度或温度。额外地或可替换地,持续时间可以是可变的,且改变条件可以包括在再次执行检测方法之前等待持续时间。
所述结合缓冲液可以包括抗原-抗体结合缓冲液的分子标准,例如,白蛋白(例如,bsa)、非离子型去污剂(吐温-20、tritonx-100)和/或蛋白酶抑制剂(例如,pmsf)。在某些情况下,在加入样品之前或之后,可以将结合缓冲液加入微流体芯片、隔室等中。在某些情况下,在与样品接触之前,所述第一结合成员可以存在于结合缓冲液中。用于发生结合成员和分析物之间的结合相互作用的时间长度可以根据经验确定,且可以取决于结合成员和分析物之间的结合亲和力和结合亲合力。在某些实施方案中,所述接触或温育可以持续5秒至1小时的时间段,例如,10秒至30分钟,或1分钟至15分钟,或5分钟至10分钟,例如,10秒、15秒、30秒、1分钟、5分钟、10分钟、15分钟、30分钟、45分钟、1小时或2小时。结合相互作用的其它条件(例如,温度、盐浓度)也可以根据经验确定,或可以基于生产商的说明书。例如,所述接触可以在室温(21℃-28℃,例如,23℃-25℃)、37℃或4℃进行。在某些实施方案中,在接触步骤过程中可以进行样品与第一结合成员的任选混合。
固定化的第一结合成员和分析物之间的复合物形成以后,可以与样品一起从所述第一结合成员附近除去任何未结合的分析物,而第一结合成员和分析物的复合物由于它与固体支持物的结合可以保留。任选地,可以使固体支持物与洗涤缓冲液接触以除去非特异性地结合至固体支持物的任何分子。
第一个接触步骤和任选的样品除去和/或任选的洗涤步骤以后,可以使第一结合成员和分析物的复合物与第二结合成员接触,由此导致夹心复合物的形成,其中所述两个结合成员结合所述分析物。第二成员与第一结合成员-分析物复合物的任选混合可以在第二个接触步骤中进行。在一些实施方案中,分析物分子相对于表面的固定化可以辅助任何多余的第二结合成员从溶液中除去,无需担忧从所述表面移去分析物分子。在一些实施方案中,所述第二结合成员可以包括可检测标记,其包含一种或多种产生信号的物质,诸如发色团、荧光化合物、化学发光化合物、酶、放射性化合物等。
如上面所指出的,所述第二个接触步骤可以在对于分析物和第二结合成员之间的结合相互作用而言足够的条件下进行。所述第二个接触步骤以后,可以除去任何未结合的第二结合成员,随后是任选的洗涤步骤。通过合适的方式,例如,微滴驱动、电泳、电润湿、介电电泳、静电驱动、电场介导、电极介导、毛细管力、色谱法、离心、抽吸或saw,可以使任何未结合的第二结合成员与第一结合成员-分析物-第二结合成员的复合物分离。从第一结合成员-分析物-第二结合成员的复合物的附近除去任何未结合的第二结合成员后,可以通过合适的方式分离可检测标记,或者可以使用本领域已知的技术检测可检测标记,所述可检测标记连接到存在于所述第一结合成员-分析物-第二结合成员的复合物中的第二结合成员。在一些实施方案中,所述可检测标记包含含有一种或多种产生信号的物质(诸如发色团、荧光化合物、酶、化学发光化合物、放射性化合物等)的可检测标记。可替换地,在一些实施方案中,如果所述可检测标记包含标签,可以从除去未结合的试剂以后保留的复合物切割或分离所述标签。例如,所述标签可以经由可切割的接头(“可切割的接头”如在本文中所述)连接到所述第二结合成员。可以将第一结合成员-分析物-第二结合成员的复合物暴露于切割剂,所述切割剂介导所述可切割的接头的切割。
如本文中指出的,所述标签可以包括核酸。在某些实施方案中,所述分析物的定量不包括通过确定存在于所述标签中的核酸序列的至少一部分的身份来确定所述标签的身份。例如,所述计数步骤可以不包括确定所述标签的序列。在其它实施方案中,可以不对所述标签测序,但是,可以确定所述标签的身份达到一个标签可以与另一个标签区分开的程度,这基于由它的大小、构象、电荷、电荷量等引起的与标签有关的可区分信号。标签的鉴别在涉及同时分析样品中的多种不同分析物(例如,样品中的2、3、4种或更多种不同分析物)的方法中可能是有用的。
在某些实施方案中,使用不同的第一结合成员和第二结合成员中的多个(其中一对第一结合成员和第二结合成员对样品中的单个分析物是特异性的),可以执行单个样品中的多种分析物的同时分析。在这些实施方案中,与对单个分析物特异性的第一对第一结合成员和第二结合成员的第二结合成员结合的可检测标记可以与下述可检测标记区分开:与对不同分析物特异性的第二对第一结合成员和第二结合成员的第二结合成员结合的可检测标记。如上面所指出的,基于产生信号的物质的差异等,第一可检测标记可以与第二可检测标记区分开。
在一些实施方案中,可以基本上准确地确定的流体样品中分析物的浓度小于约5000fm(10-15摩尔)、小于约3000fm、小于约2000fm、小于约1000fm、小于约500fm、小于约300fm、小于约200fm、小于约100fm、小于约50fm、小于约25fm、小于约10fm、小于约5fm、小于约2fm、小于约1fm、小于约500am(10-18摩尔)、小于约100am、小于约10am、小于约5am、小于约1am、小于约0.1am、小于约500zm(10-21摩尔)、小于约100zm、小于约10zm、小于约5zm、小于约1zm、小于约0.1zm或更小。
在一些情况下,检测限度(例如,在溶液中可以确定的分析物的最低浓度)是约100fm、约50fm、约25fm、约10fm、约5fm、约2fm、约1fm、约500am(10-18摩尔)、约100am、约50am、约10am、约5am、约1am、约0.1am、约500zm(10-21摩尔)、约100zm、约50zm、约10zm、约5zm、约1zm、约0.1zm或更小。在一些实施方案中,可以基本上准确地确定的流体样品中分析物的浓度是在约5000fm至约0.1fm之间、约3000fm至约0.1fm之间、约1000fm至约0.1fm之间、约1000fm至约0.1zm之间、约100fm至约1zm之间、约100am至约0.1zm之间或更小。
检测上限(例如,在溶液中可以确定的分析物的较高浓度)是至少约100fm、至少约1000fm、至少约10pm(皮摩尔)、至少约100pm、至少约100pm、至少约10nm(纳摩尔)、至少约100nm、至少约1000nm、至少约10µm、至少约100µm、至少约1000µm、至少约10mm、至少约100mm、至少约1000mm或更大。
在一些情况下,可以快速地检测分析物在样品中的存在和/或浓度,通常在小于约1小时中,例如,45分钟、30分钟、15分钟、10分钟、5分钟、1分钟或30秒。
在某些实施方案中,本文所述的方法的至少一些步骤可以在数字集成微流体和分析物检测装置上进行,诸如在本文中描述的装置。在某些实施方案中,使用与分析物检测装置结合的数字集成微流体装置实现本公开的方法。例如,所述数字微流体装置和所述分析物检测装置可以是单独的装置,且可以在所述微流体装置中产生含有可检测标记的微滴并运输至所述分析物检测装置。
在某些实施方案中,使用其中数字微流体模块与分析物检测装置集成的装置,诸如下述的装置,实现本公开的方法。在某些实施方案中,所述数字微流体模块和所述分析物检测装置可以可逆地集成。例如,两个模块可以物理地组合以形成集成装置,且所述装置然后可以分离成各个模块。在某些实施方案中,使用一次用弃的筒实现本公开的方法,所述筒包括具有嵌入式分析物检测装置的微流体模块。在下一部分中进一步描述了用于执行本文中提供的方法的装置的示例性实施方案。
本发明的方法的示例性实施方案包括:使含有目标分析物的样品微滴与含有第一结合成员的微滴合并,所述第一结合成员结合所述目标分析物且其可以固定化在固体支持物(诸如磁性颗粒或珠子)上。可以将单个合并的微滴温育足以允许所述第一结合成员结合所述目标分析物的时间段。任选地,可以搅拌所述单个微滴以促进样品与第一结合成员的混合。混合可以如下实现:使所述单个微滴前后移动,使所述单个微滴围绕多个电极移动,分裂微滴并然后合并微滴,或使用saw等。接着,可以使所述单个微滴经受磁力以将珠子保留在装置中的一个位置,而微滴可以移动离开并用含有第二结合成员的微滴替代,所述第二结合成员可以任选地含有可检测标记。在加入第二结合成员之前,通过使洗涤缓冲液的微滴移动至使用磁力将珠子保留在的位置,可以执行一个任选的洗涤步骤。足以使第二结合成员结合与第一结合成员结合的分析物的时间段以后,可以使含有第二结合成员的微滴移动离开,而珠子保留在第一个位置处。可以使用洗涤缓冲液的微滴洗涤珠子。洗涤步骤以后,可以除去磁力,并使含有经标记的珠子(含有第一特异性结合成员/分析物/第二特异性结合成员-任选的可检测标记)的微滴移动至检测模块诸如本文描述的那种。允许所述经标记的珠子沉降进检测模块的孔阵列中。所述珠子可以通过重力或通过施加电或磁力而沉降。在除去没有位于孔内的任何珠子的洗涤步骤以后,可以使用疏水液体密封所述孔。在以上实施方案中,任选地,在组合以后,可以操纵微滴(例如,前后移动、在圆形方向移动、振荡、分裂/合并、暴露于saw等)以促进样品与测定试剂(例如,第一结合成员、第二结合成员等)的混合。在其中所述可检测标记是酶的实施方案中,在将所述复合物移动至所述孔阵列之前或之后,可以加入底物。
使用电动力(例如,电润湿、介电电泳、电极介导、光诱导电润湿、电场介导和静电驱动)压力、表面声波等,可以实现微滴在集成的微流体和分析物检测装置中的移动。基于装置的细节可以确定用于移动微滴的力,所述细节描述在下述部分中,且针对在本文中描述的特定装置。
多路复用
所述方法可以包括一个或多个(或可替代地两个或多个)特异性结合成员以在多路复用测定中检测样品中的一个或多个(或可替代地两个或多个)靶分析物。所述一个或多个(或可替代地两个或多个)特异性结合成员中的每一个结合不同的靶分析物,且每个特异性结合成员用不同的可检测标记进行标记。例如,第一特异性结合成员结合第一靶分析物,第二特异性结合成员结合第二靶分析物,第三特异性结合成员结合第三靶分析物等,且第一特异性结合成员用可检测标记进行标记,第二特异性结合成员用第二可检测标记进行标记,第三特异性结合成员用第三可检测标记进行标记等。例如所述第一、第二和第三可检测标记可以各自具有不同的颜色。可替换地,可以使用不同类型的标记,例如,所述第一标记是酶标记,所述第二标记是发色团,且所述第三标记是化学发光化合物。
示例性的靶分析物
本领域技术人员明白,使用本公开的方法和装置,可以检测并任选地定量可被第一和第二结合成员特异性地结合的任何分析物。
在一些实施方案中,所述分析物可以是生物分子。生物分子的非限制性例子包括大分子,例如,蛋白、脂类和碳水化合物。在某些情况下,所述分析物可以是激素、抗体、生长因子、细胞因子、酶、受体(例如,神经、激素、营养物和细胞表面受体)或它们的配体、癌症标志物(例如,psa、tnf-α)、心肌梗塞的标志物(例如,肌钙蛋白、肌酸激酶等)、毒素、药物(例如,成瘾的药物)、代谢剂(例如,包括维生素)等。蛋白分析物的非限制性实施方案包括肽、多肽、蛋白片段、蛋白复合物、融合蛋白、重组蛋白、磷蛋白、糖蛋白、脂蛋白等。
在某些实施方案中,所述分析物可以是翻译后修饰的蛋白(例如,磷酸化的、甲基化的、糖基化的蛋白),且所述第一结合成员或所述第二结合成员可以是对翻译后修饰特异性的抗体。经修饰的蛋白可以结合固定化在固体支持物上的第一结合成员,其中所述第一结合成员结合经修饰的蛋白,但是不结合未经修饰的蛋白。在其它实施方案中,所述第一结合成员可以结合未经修饰的和经修饰的蛋白,且所述第二结合成员可以是对翻译后修饰的蛋白特异性的。
在一些实施方案中,所述分析物可以是细胞,例如,循环的肿瘤细胞、致病性细菌、病毒(包括逆转录病毒、疱疹病毒、腺病毒、慢病毒、丝状病毒(埃博拉病毒)、肝炎病毒(例如,甲型、乙型、丙型、丁型和戊型);hpv等);孢子等。
可以通过本文呈现的方法分析的分析物的一个非限制性列表包括aβ42淀粉样蛋白β-蛋白、胎球蛋白-a、tau、分泌粒蛋白ii、朊病毒蛋白、α-突触核蛋白、tau蛋白、神经丝轻链、parkin、pten诱导的假定激酶1、dj-1、富亮氨酸重复序列激酶2、突变的atp13a2、apoh、血浆铜蓝蛋白、过氧化物酶体增殖子活化的受体γ共活化剂-1α(pgc-1α)、转甲状腺素蛋白、维生素d-结合蛋白、促细胞凋亡的激酶r(pkr)和它的磷酸化的pkr(ppkr)、cxcl13、il-12p40、cxcl13、il-8、dkk-3(精液)、p14endocan片段、血清、ace2、针对cd25的自身抗体、htert、cai25(muc16)、vegf、sil-2、骨桥蛋白、人附睾蛋白4(he4)、α-胎蛋白、白蛋白、白蛋白尿、微白蛋白尿、嗜中性粒细胞明胶酶-相关的脂质运载蛋白(ngal)、白介素18(il-18)、肾损伤分子-1(kim-1)、肝脂肪酸结合蛋白(l-fabp)、lmp1、barf1、il-8、癌胚抗原(cea)、braf、ccni、egrf、fgf19、frs2、greb1和lzts1、α-淀粉酶、癌胚抗原、ca125、il8、硫氧还蛋白、β-2微球蛋白水平-监测病毒的活性、肿瘤坏死因子-α受体-监测病毒的活性、ca15-3、促卵泡激素(fsh)、黄体化激素(lh)、t-细胞淋巴瘤侵入和转移1(tiam1)、n-钙粘着蛋白、ec39、双调蛋白、脱氧尿苷三磷酸酶、分泌型钙结合微丝蛋白(pgsn)、psa(前列腺特异性抗原)、胸腺素βl5、胰岛素、血浆c-肽、糖基化的血红蛋白(hba1c)、c-反应蛋白(crp)、白介素-6(il-6)、arhgdib(rhogdp-解离抑制剂2)、cfl1(丝切蛋白-1)、pfn1(profilin-1)、gstp1(谷胱甘肽s-转移酶p)、s100a11(蛋白s100-a11)、prdx6(硫氧还原蛋白过氧化物酶-6)、hspe1(10kda热激蛋白、线粒体的)、lyz(溶菌酶c前体)、gpi(葡萄糖-6-磷酸异构酶)、hist2h2aa(组蛋白h2a类型2-a)、gapdh(甘油醛-3-磷酸脱氢酶)、hspg2(基膜-特异性的硫酸类肝素蛋白聚糖核心蛋白前体)、lgals3bp(半乳糖凝集素-3-结合蛋白前体)、ctsd(组织蛋白酶d前体)、apoe(载脂蛋白e前体)、iqgap1(rasgtpase-活化样蛋白iqgap1)、cp(血浆铜蓝蛋白前体)和iglc2(iglc1蛋白)、pcdgf/gp88、egfr、her2、muc4、igf-ir、p27(kip1)、akt、her3、her4、pten、pik3ca、ship、grb2、gab2、pdk-1(3-磷酸肌醇磷脂依赖性的蛋白激酶-1)、tsc1、tsc2、mtor、mig-6(erbb受体反馈抑制剂1)、s6k、src、kras、mek促分裂原活化蛋白激酶1、cmyc、topoii拓扑异构酶(dna)iiα170kda、frap1、nrg1、esr1、esr2、pgr、cdkn1b、map2k1、nedd4-1、foxo3a、ppp1r1b、pxn、ela2、ctnnb1、ar、ephb2、klf6、anxa7、nkx3-1、pitx2、mki67、phlpp、脂联素(adipoq)、纤维蛋白原α链(fga)、瘦素(lep)、高级糖基化终产物-特异性的受体(agerakarage)、α-2-hs-糖蛋白(ahsg)、血管生成素(ang)、cd14分子(cd14)、铁蛋白(fth1)、胰岛素-样生长因子结合蛋白1(igfbp1)、白介素2受体、α(il2ra)、血管细胞粘附分子1(vcam1)和vonwillebrand因子(vwf)、髓过氧化物酶(mpo)、il1α、tnfα、核周抗-嗜中性粒细胞胞质抗体(p-anca)、乳铁蛋白、钙卫蛋白、威尔曼瘤-1蛋白、水通道蛋白-1、mll3、ambp、vdac1、大肠杆菌(e.coli)肠毒素(热不稳定的外毒素、热稳定的肠毒素)、流感ha抗原、破伤风毒素、白喉毒素、肉毒杆菌毒素、志贺毒素、志贺样毒素i、志贺样毒素ii、难辨梭菌(clostridiumdifficile)毒素a和b等。
样品
本文中使用的“样品”、“试验样品”、“生物样品”表示含有或疑似含有目标分析物的流体样品。所述样品可以源自任意合适的来源。在一些情况下,所述样品可以包含液体、流动的微粒固体、或固体颗粒的流体混悬液。在一些情况下,在本文描述的分析之前可以处理所述样品。例如,所述样品可以在分析之前从它的来源分离或纯化;但是,在某些实施方案中,可以直接测定未处理的含有分析物的样品。分析物分子的来源可以是合成的(例如,在实验室中生产)、环境(例如,空气、土壤、流体样品,例如,水供给等)、动物(例如,哺乳动物)、植物或它们的任意组合。在一个特定实施例中,分析物的来源是人体物质(例如,体液、血液、血清、血浆、尿、唾液、汗液、痰、精液、粘液、泪液、淋巴液、羊水、间质液、肺灌洗液、脑脊液、粪便、组织、器官等)。组织可以包括但不限于骨骼肌组织、肝组织、肺组织、肾组织、心肌组织、脑组织、骨髓、子宫颈组织、皮肤等。所述样品可以是液体样品或固体样品的液体提取物。在某些情况下,所述样品的来源可以是器官或组织,诸如活组织检查样品,其可以通过组织崩解/细胞裂解而溶解。
可以分析宽范围体积的流体样品。在几个示例性实施方案中,样品体积可以是约0.5nl、约1nl、约3nl、约0.01μl、约0.1μl、约1μl、约5μl、约10μl、约100μl、约1ml、约5ml、约10ml等。在一些情况下,流体样品的体积是在约0.01μl至约10ml之间、约0.01μl至约1ml之间、约0.01μl至约100μl之间、或约0.1μl至约10μl之间。
在一些情况下,所述流体样品在用于测定中之前可以稀释。例如,在其中分析物分子的来源是人体液(例如,血液、血清)的实施方案中,可以用适当的溶剂(例如,缓冲液诸如pbs缓冲液)稀释所述流体。在使用之前,可以将流体样品稀释约1倍、约2倍、约3倍、约4倍、约5倍、约6倍、约10倍、约100倍或更大。
在一些情况下,所述样品可以经历分析前处理。分析前处理可以提供另外的功能性诸如非特异性的蛋白除去和/或有效的、仍然可廉价实现的混合功能性。分析前处理的一般方法可以包括使用电动陷俘、ac动电学、表面声波、等速电泳、介电电泳、电泳、或本领域中已知的其它预浓缩技术。在一些情况下,在用于测定中之前可以浓缩流体样品。例如,在其中分析物分子的来源是人体液(例如,血液、血清)的实施方案中,通过沉淀、蒸发、过滤、离心或它们的组合可以浓缩所述流体。在使用之前,可以将流体样品浓缩约1倍、约2倍、约3倍、约4倍、约5倍、约6倍、约10倍、约100倍或更大。
在某些实施方案中,在测量分析物之前没有扩增分析物(即,分析物的拷贝数没有增加)。例如,在其中分析物是dna或rna的情况下,没有将所述分析物复制以增加所述分析物的拷贝数。在某些情况下,所述分析物是蛋白或小分子。
特异性结合成员
本领域技术人员明白,所述结合成员将取决于要分析的分析物。多种靶分子的结合成员是已知的,或可以使用已知技术容易地发现或开发。例如,当靶分析物是蛋白时,结合成员可以包括蛋白,特别是源自骆驼科动物的抗体或其片段(例如,抗原结合片段(fab)、fab'片段、f(ab')2片段、重组抗体、嵌合抗体、单链fv(“scfv”)、单链抗体、单结构域抗体,诸如可变重链结构域(“vhh”;也被称作“vhh片段”)(vhh和制备它们的方法描述在gottlin等人,journalofbiomolecularscreening,14:77-85(2009))、重组vhh单结构域抗体和vnar片段、二硫键连接的fv(“sdfv”)和抗-独特型(“抗-id”)抗体和以上任一种的功能上有活性的表位结合片段、全长多克隆或单克隆抗体、抗体-样片段等)、其它蛋白,诸如受体蛋白、蛋白a、蛋白c等。在其中分析物是小分子(例如,类固醇、后胆色素类、维a酸类和脂类)的情况下,所述第一结合成员和/或所述第二结合成员可以是支架蛋白(例如,脂质运载蛋白)或受体。在一些情况下,蛋白分析物的结合成员可以是肽。例如,当靶分析物是酶时,合适的结合成员可以包括酶底物和/或酶抑制剂,其可以是肽、小分子等。在一些情况下,当靶分析物是磷酸化的物质时,所述结合成员可以包含磷酸盐结合剂。例如,所述磷酸盐结合剂可以包含金属离子亲和介质诸如在美国专利号7,070,921和美国专利申请号20060121544中描述的那些。
在某些情况下,所述结合成员中的至少一个可以是适体,诸如在美国专利号5,270,163、5,475,096、5,567,588、5,595,877、5,637,459、5,683,867、5,705,337中描述的那些。可以开发核酸适体(例如,单链dna分子或单链rna分子)用于捕获基本上任何靶分子。适体以高度特异性的、构象依赖性的方式结合靶分子,通常具有非常高的亲和力,尽管可以选择具有较低结合亲和力的适体。基于非常小的结构差异,诸如甲基或羟基的存在或不存在,适体可以在靶分析物分子之间区分,且某些适体可以在d-和l-对映异构体和非对映异构体之间区分。适体可以结合小分子靶标,包括药物、金属离子和有机染料、肽、生物素和蛋白。适体在生物素化、荧光素标记以后和当连接到玻璃表面和微球时可以保留功能活性。
核酸适体是这样的寡核苷酸:其可以是单链寡脱氧核苷酸、寡核糖核苷酸或经修饰的寡脱氧核苷酸或寡核糖核苷酸。术语“修饰”包括具有共价地修饰的碱基和/或糖的核苷酸。例如,经修饰的核苷酸包括具有糖的核苷酸,所述糖共价地连接到除了在3'位置处的羟基以外且除了在5'位置处的磷酸酯基团以外的低分子量有机基团。因而,经修饰的核苷酸还可以包括2'取代的糖诸如2'-o-甲基-;2-o-烷基;2-o-烯丙基;2'-s-烷基;2'-s-烯丙基;2'-氟-;2'-卤代或2-叠氮基-核糖,碳环糖类似物a-端基异构糖;差向异构糖诸如阿拉伯糖、木糖或来苏糖、吡喃糖、呋喃糖和景天庚酮糖。
可以将肽适体设计成干扰蛋白相互作用。肽适体可以是基于在其上面连接可变肽环的蛋白支架,由此限制所述适体的构象。在一些情况下,所述肽适体的支架部分源自细菌硫氧还蛋白a(trxa)。
当靶分子是碳水化合物时,潜在地合适的捕获组分(如本文中定义)包括,例如,抗体、凝集素和选择素。本领域普通技术人员明白,可以与目标靶分子特异性地结合的任何分子可以潜在地用作结合成员。
对于某些实施方案,合适的靶分析物/结合成员复合物可以包括但不限于,抗体/抗原、抗原/抗体、受体/配体、配体/受体、蛋白/核酸、酶/底物和/或抑制剂、碳水化合物(包括糖蛋白和糖脂)/凝集素和/或选择素、蛋白/蛋白、蛋白/小分子等。
在具体实施方案中,所述第一结合成员可以通过链接连接到固体支持物,所述链接可以包含促进结合成员与支持物的连接的、所述支持物和/或结合成员的任何部分、官能化或修饰。结合成员和支持物之间的链接可以包括一个或多个化学或物理(例如,经由范德华力、氢键合、静电相互作用、疏水/亲水相互作用等的非特异性连接)键和/或提供这样的键的化学隔离物。
在某些实施方案中,固体支持物还可以包含保护性的、阻断性的或钝化性的层,该层可以消除或减小在测定过程中非捕获组分(例如,分析物分子、结合成员)与结合表面的非特异性连接,所述非特异性连接可能导致检测过程中的假阳性信号或导致信号的损失。在某些实施方案中可以用于形成钝化层的材料的例子包括但不限于:聚合物,诸如聚乙二醇,其排斥蛋白的非特异性结合;具有该性质的天然存在的蛋白,诸如血清白蛋白和酪蛋白;表面活性剂,例如,两性离子表面活性剂,诸如磺基甜菜碱;天然存在的长链脂类;聚合物刷子,和核酸,诸如鲑鱼精dna。
某些实施方案利用是蛋白或多肽的结合成员。如本领域已知的,可以使用任何数目的技术将多肽连接至多种固体支持物。已知多种将反应性部分添加至蛋白的技术,例如,在美国专利号5,620,850中描述的方法。此外,已知将蛋白连接至表面的方法,例如,参见heller,acc.chem.res.23:128(1990)。
如本文中解释的,结合成员和分析物之间的结合是特异性的,例如,当结合成员和分析物是结合对的互补部分时。在某些实施方案中,所述结合成员特异性地结合所述分析物。“特异性地结合”或“结合特异性”是指,结合成员以足以在分析物分子和试验样品的其它组分或污染物之间区分的特异性结合分析物分子。例如,根据一个实施方案,所述结合成员可以是特异性地结合分析物上的表位的抗体。根据一个实施方案,所述抗体可以是能够特异性地结合目标分析物的任何抗体。例如,适当的抗体包括但不限于,单克隆抗体、双特异性抗体、微体、结构域抗体(dab)(例如,诸如在holt等人(2014)trendsinbiotechnology21:484-490中所述),且包括单结构域抗体sdab,其为天然存在的,例如,如在软骨鱼和骆驼科中,或其为合成的,例如,纳米抗体、vhh或其它结构域结构)、合成的抗体(有时被称作抗体模拟物)、嵌合抗体、人源化抗体、抗体融合物(有时被称作“抗体缀合物”)和分别每种的片段。作为另一个实施例,所述分析物分子可以是抗体,且所述第一结合成员可以是抗原且所述第二结合成员可以是特异性地结合靶抗体的第二抗体,或所述第一结合成员可以是特异性地结合靶抗体的第二抗体且所述第二结合成员可以是抗原。
在一些实施方案中,所述结合成员可以是化学上程序化的抗体(cpab)(描述在rader(2014)trendsinbiotechnology32:186-197中)、双特异性的cpab、抗体募集分子(arm)(描述在mcenaney等人(2012)acschem.biol.7:1139-1151)、有支链的捕获剂诸如三配体捕获剂(描述在millward等人(2011)j.am.chem.soc.133:18280-18288)、从非抗体支架衍生出的经工程改造的结合蛋白诸如单抗体(源自人纤连蛋白的第十个纤连蛋白iii型结构域)、亲和体(源自免疫球蛋白结合蛋白a)、darpins(基于锚蛋白重复模块)、anticalins(源自脂质运载蛋白后胆色素-结合蛋白和人脂质运载蛋白2)和半胱氨酸结肽(knottin)(描述在gilbreth和koide,(2012)currentopinioninstructuralbiology22:1-8;banta等人(2013)annu.rev.biomed.eng.15:93-113)、ww结构域(描述在patel等人(2013)proteinengineering,design&selection26(4):307-314)、重新设定目标的受体配体、affitins(描述在béhar等人(2013)26:267-275)和/或adhirons(描述在tiede等人(2014)proteinengineering,design&selection27:145-155)。
根据其中分析物是生物细胞(例如,哺乳动物、禽类、爬虫类、其它脊椎动物、昆虫、酵母、细菌、细胞等)的一个实施方案,所述结合成员可以是对细胞表面抗原(例如,细胞表面受体)具有特异性亲和力的配体。在一个实施方案中,所述结合成员可以是粘附分子受体或其部分,其对在靶细胞类型的表面上表达的细胞粘附分子具有结合特异性。在使用中,粘附分子受体与在靶细胞的细胞外表面上的粘附分子结合,由此固定化或捕获所述细胞,然后可以使用第二结合成员检测结合的细胞,所述第二结合成员可以与第一结合成员相同或可以结合在细胞的表面上表达的不同分子。
在一些实施方案中,分析物分子和结合成员之间的结合亲和力应当在测定的条件下足以保持结合,所述条件包括用于除去非特异性地结合的分子或颗粒的洗涤步骤。在一些情况下,例如在某些生物分子的检测中,分析物分子与它的互补结合成员的结合常数可以是在至少约104至约106m-1、至少约105至约109m-1、至少约107至约109m-1之间、大于约109m-1或更大。
可检测标记:标签和产生信号的物质
本文所述的方法可以包括与可检测标记(诸如标签)结合的特异性结合成员以分析分析物。掺入的标签或标记不实质上干扰反应方案的进行。例如,掺入的标签或标记不干扰分析物和它的互补结合成员之间的结合常数或相互作用。掺入的标签或标记的大小和数目可能与捕获速度和读出速率有关。通过增加掺入的标签或标记的大小和/或数目,可以增加捕获速度和读出速率。掺入的标签或标记不改变结合成员动力学(例如,抗体动力学)或反应方案。示例性的标签包括:聚合物,例如,阴离子聚合物或阳离子聚合物(例如,具有净正电荷的多肽,例如,聚组氨酸或聚赖氨酸),其中所述聚合物是约5-1000个残基长度;不与结合成员交叉反应和/或干扰测定的蛋白(例如,球状蛋白),树枝状聚合物,例如,dna树枝状聚合物;和带电荷的颗粒,例如,珠子。聚合物标签可以包括核酸,例如,脱氧核糖核酸或核糖核酸。聚合物标签可以包括核苷碱基聚合物。在某些情况下,所述标签可以是dna或rna适体,其中所述适体不结合所述分析物。聚合物标签或颗粒(例如,珠子)可以足够大以产生可再现的信号。适体可以是20-220个碱基长度,例如,20-60个碱基长。颗粒(例如,珠子或树枝状聚合物)的大小可以在约1nm至约950nm直径范围内,例如,10nm-900nm、20nm-800nm、30nm-700nm、50nm-600nm、80nm-500nm、100nm-500nm、200nm-500nm、300nm-500nm或400nm-500nm直径,例如,10nm、20nm、30nm、50nm、100nm、200nm、300nm、400nm、500nm、600nm、700nm、800nm或900nm。在某些情况下,所述珠子/颗粒可以由具有净负或正电荷的材料制成,或可以处理成具有净负或正电荷。示例性的珠子/颗粒包括由有机或无机聚合物制成的那些。有机聚合物包括聚合物例如聚苯乙烯、碳、聚丙烯酰胺等。无机聚合物包括硅或金属珠子/颗粒。在某些情况下,所述珠子/颗粒可以不是磁性的。
在某些情况下,所述标签可以是单链dna或rna。单链dna或rna可以之前与探针分子杂交。在某些情况下,所述方法可以包括分析单个样品中的多种分析物。结合样品中的不同分析物的第二结合成员可以包括与其连接的不同单链dna或rna作为标签,且所述不同单链dna或rna可以与不同探针杂交,所述不同探针将不同单链dna或rna进一步彼此区分开。在其它实施方案中,连接到不同第二结合成员的标签可以具有可区分的不同发夹结构(例如,发夹结构的长度)。在另一个实施方案中,连接到不同第二结合成员的标签可以具有可区分的不同长度:例如,所述标签可以是不同长度(例如,25碱基对、50碱基对、75碱基对、100碱基对、150碱基对、200碱基对或更多)的双链dna。在某些情况下,连接到不同第二结合成员的标签可以具有不同的聚乙二醇(peg)长度,或可以是用peg差别地修饰的dna或rna。
应当指出,对标签或标签分子的提及包括单个标签或单标签分子以及多个标签(其全部可以是相同的)。所述标签可以是任意大小或形状。在一些实施方案中,所述标签可以是约10至950nm直径的纳米颗粒或纳米珠子,例如,20-900nm、30-800nm、40-700nm、50-600nm、60-500nm、70-400nm、80-300nm、90-200nm、100-150nm、200-600nm、400-500nm、2-10nm、2-4nm或3-4nm直径。所述标签可以是基本上球形的,例如球形珠子或纳米珠子,或半球形的。所述标签可以是约0.5kda至约50kda大小的蛋白,例如,约0.5kda至约400kda、约0.8kda至约400kda、约1.0kda至约400kda、约1.5kda至约400kda、约2.0kda至约400kda、约5kda至约400kda、约10kda至约400kda、约50kda至约400kda、约100kda至约400kda、约150kda至约400kda、约200kda至约400kda、约250kda至约400kda、约300kda至约400kda、约0.5kda至约300kda、约0.8kda至约300kda、约1.0kda至约300kda、约1.5kda至约300kda、约2.0kda至约300kda、约5kda至约300kda、约10kda至约300kda、约50kda至约300kda、约100kda至约300kda、约150kda至约300kda、约200kda至约300kda、约250kda至约300kda、约0.5kda至约250kda、约0.8kda至约250kda、约1.0kda至约250kda、约1.5kda至约250kda、约2.0kda至约250kdainsize、约5kda至约250kda、约10kda至约250kda、约50kda至约250kda、约100kda至约250kda、约150kda至约250kda、约200kda至约250kda、约0.5kda至约200kda、约0.8kda至约200kda、约1.0kda至约200kda、约1.5kda至约200kda、约2.0kda至约200kdainsize、约5kda至约200kda、约10kda至约200kda、约50kda至约200kda、约100kda至约200kda、约150kda至约200kda、约0.5kda至约100kda、约0.8kda至约100kda、约1.0kda至约100kda、约1.5kda至约100kda、约2.0kda至约100kda、约5kda至约100kda、约10kda至约100kda、约50kda至约100kda、约0.5kda至约50kda、约0.8kda至约50kda、约1.0kda至约50kda、约1.5kda至约50kda、约2.0kda至约50kda、约5kda至约50kda、约10kda至约50kda.约10kda至约90kda、约10kda至约80kda、约10kda至约70kda、约10kda至约60kda、约20kda至约90kda、约20kda至约80kda、约20kda至约70kda、约20kda至约60kda、约40kda至约90kda、约40kda至约80kda、约40kda至约70kda、或约40kda至约60kda。
在某些实施方案中,所述标签可以是纳米颗粒或纳米珠子。如本文中指出的,所述纳米颗粒可以可逆地(例如,可切割地)连接到第二结合成员。在某些方面,所述纳米颗粒可以是确定直径的纳米珠子。在某些情况下,本公开的方法、系统和装置可以用于同时分析样品中的多种不同分析物。对于这样的分析,可以使用各自特异性地结合相应分析物的多种第二结合成员。所述不同第二结合成员中的每一种可以连接到不同大小的纳米珠子,所述纳米珠子可以用于鉴别所述第二结合成员。例如,所述不同纳米珠子标签可以具有不同直径,例如,1nm、2nm、4nm、6nm、8nm、10nm、12nm、14nm或larger,诸如up-20nm、30nm、50nm、100nm、200nm、300nm、400nm、500nm、600nm、700nm、800nm、900nm、950nm或990nm。
可以在本发明的方法中用作标签的示例性纳米颗粒包括在5nm-950nm直径范围内的金纳米颗粒或聚苯乙烯纳米颗粒。
在某些情况下,所述标签可以是聚合物,例如,核酸。通过检测标签特有的信号,诸如与聚合物标签的大小或长度有关的信号,可以确定标签的存在。通过测量它在孔或通道中的停留时间,例如,通过测量电流的短暂阻断的持续时间,可以确定聚合物标签的大小或长度。
可以是标签或标记的部分、全部、与标签或标记结合、或连接到标签或标记的元件包括:纳米颗粒;金颗粒;银颗粒;银、铜、锌或其它金属涂层或沉着物;聚合物;拖拉标签(如本文中定义);磁性颗粒;可浮颗粒;金属颗粒;带电荷的部分;介电电泳标签,具有和没有杂质的二氧化硅(例如,石英、玻璃等);聚甲基丙烯酸甲酯(pmma);聚酰亚胺;氮化硅;金;银;量子点(包括cds量子点);碳点;荧光团;猝灭剂;聚合物;聚苯乙烯;janus颗粒;散射颗粒;荧光颗粒;磷光颗粒;球体;立方体;绝缘体;导体;标有条形码的或带标记的颗粒;多孔颗粒;固体颗粒;纳米壳;纳米棒;微球;分析物诸如病毒、细胞、寄生虫和生物体;核酸;蛋白;分子识别元件;隔离物;peg;树枝状聚合物;电荷改变剂;磁性材料;酶;dna,包括适体序列;可扩增的dna;重复的dna序列;可检测元件与分子识别元件(例如,工程改造的结合成员)的融合物或缀合物;抗-抗体适体;针对抗体结合蛋白的适体;吸收的或吸附的可检测的化合物;血红素;萤光素;磷光体;叠氮基或炔烃(例如,末端或非末端炔烃)或其它点击化学参与物。
在某些实施方案中,可以选择标签以提供足够高以实现样品的快速分析的捕获速率。在某些实施方案中,所述标签的捕获速率可以是约1个事件/10秒、1个事件/5秒、1个事件/秒或更高。在某些实施方案中,可以使用直链聚合物标签,例如,核糖聚合物、脱氧核糖聚合物、寡核苷酸、dna或rna。
在某些情况下,不可以使用直链聚合物标签(例如,核糖聚合物、脱氧核糖聚合物、寡核苷酸、dna或rna),因为这些标签的捕获速率对于某些应用而言可能太低。具有半球形、球形或基本上球形形状且因而缩短测定持续时间的标签可以用在需要较快标签计数的应用中。在某些情况下,基于测定所需的捕获速率,可以选择球形或半球形标签的大小。例如,对于较高的捕获速率,可以选择较大尺寸的球形或半球形标签。在某些情况下,所述标签可以是球形标签,例如,在相同测量条件下,具有比直链标签(例如,dna标签)的捕获速率快约10倍、30倍、50倍、100倍、300倍、500倍或1000倍的捕获速率的纳米颗粒/纳米珠子。
在一些实施方案中,所述标签可以缀合至抗体,例如,cpsp抗体缀合物。在一些实施方案中,所述标签可以缀合至具有隔离物的抗体,例如,具有隔离物的cpsp抗体缀合物。在一些实施方案中,所述标签可以缀合至寡核苷酸和抗体,例如,cpsp寡核苷酸-抗体缀合物。在一些实施方案中,所述标签可以缀合至具有隔离物的寡核苷酸和抗体,例如,具有隔离物的cpsp寡核苷酸-抗体缀合物。在一些实施方案中,所述标签可以缀合至寡核苷酸,例如,cpsp寡核苷酸缀合物。
在某些实施方案中,本文描述的方法可以包括与可检测标记(诸如产生信号的物质,诸如发色团、荧光化合物、酶、化学发光化合物、放射性化合物、颗粒(前提条件是,它们具有荧光性能)等)结合的特异性结合成员。标记的例子包括产生光的部分,例如,吖啶鎓化合物,和产生荧光的部分,例如,荧光素。
本领域已知的任何合适的产生信号的物质可以用作可检测标记。例如,所述可检测标记可以是放射性标记(诸如3h、14c、32p、33p、35s、90y、99tc、111in、125i、131i、177lu、166ho和153sm)、酶标记(诸如辣根过氧化物酶、碱性过氧化物酶、葡萄糖6-磷酸脱氢酶等(如果使用酶,那么还必须添加对应的酶底物))、化学发光标记(诸如吖啶酯、硫代酸酯或磺酰胺;鲁米诺、异鲁米诺、菲啶鎓酯等)、荧光标记(诸如荧光素(例如,5-荧光素、6-羧基荧光素、3'6-羧基荧光素、5(6)-羧基荧光素、6-六氯-荧光素、6-四氯荧光素、异硫氰酸荧光素等))、罗丹明、藻胆蛋白、r-藻红蛋白、量子点(例如,硫化锌加帽的硒化镉)、测温标记或免疫聚合酶链式反应标记。对标记、标记方法和标记检测的介绍,参见:polak和vannoorden,introductiontoimmunocytochemistry,第2版,springerverlag,n.y.(1997),和haugland,handbookoffluorescentprobesandresearchchemicals(1996),其为molecularprobes,inc.,eugene,oregon出版的组合手册和目录。荧光标记可以用在fpia中(参见,例如,美国专利号5,593,896、5,573,904、5,496,925、5,359,093和5,352,803,其特此通过引用整体并入)。吖啶鎓化合物可以在均相化学发光测定中用作可检测标记(参见,例如,adamczyk等人,bioorg.med.chem.lett.16:1324-1328(2006);adamczyk等人,bioorg.med.chem.lett.4:2313-2317(2004);adamczyk等人,biorg.med.chem.lett.14:3917-3921(2004);和adamczyk等人,org.lett.5:3779-3782(2003))。
在一个方面,所述吖啶鎓化合物是吖啶鎓-9-甲酰胺。用于制备吖啶鎓9-甲酰胺的方法描述在mattingly,j.biolumin.chemilumin.6:107-114(1991);adamczyk等人,j.org.chem.63:5636-5639(1998);adamczyk等人,tetrahedron55:10899-10914(1999);adamczyk等人,org.lett.1:779-781(1999);adamczyk等人,bioconjugatechem.11:714-724(2000);mattingly等人,inluminescencebiotechnology:instrumentsandapplications;dyke,k.v.编;crcpress:bocaraton,第77-105页(2002);adamczyk等人,org.lett.5:3779-3782(2003);和美国专利号5,468,646、5,543,524和5,783,699(针对它关于相同内容的教导,它们中的每一篇通过引用整体并入本文)。
吖啶鎓化合物的另一个例子是吖啶鎓-9-甲酸芳基酯。式ii的吖啶鎓-9-甲酸芳基酯的一个例子是10-甲基-9-(苯氧基羰基)吖啶鎓氟代磺酸盐(availablefromcaymanchemical,annarbor,mi)。制备吖啶鎓-9-甲酸芳基酯的方法描述mccapra等人,photochem.photobiol.4:1111-21(1965);razavi等人,luminescence15:245-249(2000);razavi等人,luminescence15:239-244(2000);和美国专利号5,241,070(针对它关于相同内容的教导,它们中的每一篇通过引用整体并入本文)。在信号的强度和/或信号的迅速方面,这样的吖啶鎓-9-甲酸芳基酯是在由至少一种氧化酶对分析物的氧化中产生的过氧化氢的有效化学发光指示剂。吖啶鎓-9-甲酸芳基酯的化学发光发射的进程快速地(即,在1秒以下)完成,而吖啶鎓-9-甲酰胺化学发光发射延长超过2秒。但是,吖啶鎓-9-甲酸芳基酯在有蛋白存在下丧失它的化学发光性能。因此,它的应用要求在信号产生和检测过程中不存在蛋白。用于分离或除去样品中的蛋白的方法是本领域技术人员众所周知的,且包括但不限于超滤、萃取、沉淀、透析、色谱法和/或消化(参见,例如,wells,highthroughputbioanalyticalsamplepreparation.methodsandautomationstrategies,elsevier(2003))。从试验样品除去或分离的蛋白的量可以是约40%、约45%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%或约95%。关于吖啶鎓-9-甲酸芳基酯和它的用途的其它细节阐述在2007年4月9日提交的美国专利申请号11/697,835中。可以将吖啶鎓-9-甲酸芳基酯溶解在任意合适的溶剂中,诸如脱气的无水n,n-二甲基甲酰胺(dmf)或胆酸钠水溶液。
可切割的接头
在本文所述的方法中使用的标签可以通过通用接头连接到特异性结合成员。可切割的接头确保所述标签可以被除去。所述通用接头可以是可切割的接头。例如,所述标签可以通过可切割的接头连接到第二结合成员。可以使第一结合成员-分析物-第二结合成员的复合物暴露于介导可切割的接头的切割的切割剂。所述接头可以通过任意合适的方法进行切割,所述方法包括暴露于酸、碱、亲核体、亲电体、残基、金属、还原剂或氧化剂、光、温度、酶等。合适的接头可以从标准的化学阻断基团改进,如在greene&wuts,protectivegroupsinorganicsynthesis,johnwiley&sons中公开的。在guillier等人(chem.rev.100:2092-2157,2000)中公开了在固相合成中使用的其它合适的可切割接头。所述接头可以是酸可切割的、碱可切割的或光可切割的。氧化还原反应可以是切割方案的组成部分。可切割的接头可以是带电荷的聚合物。
所述接头可以是光可切割的接头、化学可切割的接头或热可切割的接头。在所述接头是光可切割基团的情况下,所述切割剂可以是破坏或切割光可切割基团的适当波长的光。在许多实施方案中,用于切割光可切割的连接基团的光的波长范围为约180nm至400nm,例如,约250nm至400nm,或约300nm至400nm。优选的是,活化切割所需的光不影响分析物的其它组分。合适的接头包括基于o-硝基苄基化合物和硝基藜芦基化合物的那些。还可以使用基于安息香化学的接头(lee等人,j.org.chem.64:3454-3460,1999)。
可替换地,在切割接头是化学可切割的基团的情况下,所述切割剂可以是能够切割所述基团的化学试剂。通过基于氧化/还原的切割、酸催化的切割、碱催化的切割或亲核置换,可以切割化学可切割的接头。例如,在连接基团是二硫键的情况下,可以使用二硫苏糖醇或β-巯基乙醇释放所述标签。在其中连接基团是限制位点的再其它实施方案中,所述试剂是催化剂,诸如酶,所述酶可以是水解酶、限制性酶或另一种切割连接基团的酶。例如,所述限制性酶可以是i型、ii型、iis型、iii型和iv型限制性酶。
在一些实施方案中,所述切割接头是酶可切割序列。在本文任意实施方案的一个方面,酶可切割序列是2、3、4、5、6、7、8、9或10个核苷酸长度的核酸序列。在一个实施方案中,所述酶可切割序列包含至少10个核苷酸的序列。在一个实施方案中,所述酶可切割序列包含2-20个核苷酸之间的序列。在一个实施方案中,所述酶可切割序列包含2-15个核苷酸之间的序列。在一个实施方案中,所述酶可切割序列包含4-10个核苷酸之间的序列。在一个实施方案中,所述酶可切割序列包含4-15个核苷酸之间的序列。
例如,所述可切割的接头可以是吖啶鎓,醚诸如被取代的苄基醚或其衍生物(例如,苄基羟基(hydryl)醚、茚满基醚等)(其可以被酸性或温和还原条件切割(例如,过氧化氢,以产生吖啶酮和磺酰胺)),使用p-消除产生的带电荷的聚合物(其中弱碱可以用于释放产物),缩醛,包括其硫代类似物(其中分离通过弱酸实现,特别是在有捕获羰基化合物存在下),光不稳定的键(例如,o-硝基苯甲酰基、7-硝基茚满基、2-硝基二苯甲基醚或酯等),或肽接头,对其进行酶水解,特别是在所述酶识别特定序列的情况下,诸如针对因子xa的肽或肠激酶。接头的例子包括但不限于二硫键接头、酸不稳定的接头(包括二烷氧基苄基接头)、sieber接头、吲哚接头、叔丁基sieber接头、亲电子地可切割的接头、亲核地可切割的接头、光可切割的接头、在还原条件、氧化条件下切割、通过使用安全捕获接头进行的切割和通过消除机制进行的切割。
亲电子地切割的接头通常由质子切割,且包括对酸敏感的切割。合适的接头包括经修饰的苄基系统诸如三苯甲基、对烷氧基苄基酯和对烷氧基苄基酰胺。其它合适的接头包括叔丁氧基羰基(boc)基团和缩醛系统。为了制备合适的接头分子,还可以考虑亲硫金属(诸如镍、银或汞)在硫代缩醛或其它含硫保护基的切割中的应用。
对于亲核切割,可以使用基团诸如在水中不稳定的酯(即,可以简单地在碱性ph切割)和对非水性亲核体不稳定的基团。可以使用氟离子来切割基团诸如三异丙基硅烷(tips)或叔丁基二甲基硅烷(tbdms)中的硅-氧键。
对还原切割敏感的接头可以与诸如二硫键还原一起使用。使用基于钯的催化剂的催化氢化已经用于切割苄基和苄氧基羰基。
基于氧化的方案是本领域众所周知的。这些包括对烷氧基苄基的氧化以及硫和硒接头的氧化。还可以使用用于切割二硫键和其它基于硫或硒的接头的碘水溶液。
安全捕获接头是分两步切割的那些接头。在一个优选的系统中,第一步是产生反应性的亲核中心,随后是第二步,其包括导致切割的分子内环化。例如,可以用肼或光化学处理乙酰丙酸酯键以释放活性胺,后者然后可以环化以切割分子中别处的酯(burgess等人,j.org.chem.62:5165-5168,1997)。
还可以使用消除反应。例如,可以使用基团诸如fmoc和氰基乙基的基于碱的消除以及烯丙型系统的钯催化的还原消除。
集成的数字微流体和分析物检测装置
本文描述了与集成的数字微流体和分析物检测装置有关的系统、装置和方法。
在某些实施方案中,所述集成的数字微流体和分析物检测装置可以具有两个模块:样品制备模块和分析物检测模块。在某些实施方案中,所述样品制备模块和所述分析物检测模块是分离的或分离的且邻近的。在某些实施方案中,所述样品制备模块和所述分析物检测模块是共定位的、混杂的或互相交叉的。所述样品制备模块可以包括用于移动、合并、稀释、混合、分离样品和试剂的微滴的系列或多个电极。所述分析物检测模块可以包括在其中检测分析物相关信号的孔阵列。在某些情况下,所述检测模块还可以包括用于将制备的样品的微滴移动至所述孔阵列的系列或多个电极。在某些实施方案中,所述检测模块可以包括在第一基底(例如,上基底)中的孔阵列,所述第一基底设置在被间隙隔开的第二基底(例如,下基底)上面。在这些实施方案中,所述孔阵列处于倒置取向。在某些实施方案中,所述检测模块可以包括在第二基底(例如,下基底)中的孔阵列,所述第二基底设置在被间隙隔开的第一基底(例如,上基底)下面。在这样的实施方案中,所述第一基底和所述第二基底处于面对布置。使用存在于第一基底和/或第二基底中的电极,可以将微滴移动(例如,通过电驱动)至所述孔阵列。在某些实施方案中,所述孔阵列(包括在所述孔之间的区域)可以是疏水的。在其它实施方案中,所述系列或多个电极可以局限于样品制备模块,且使用其它方式可以使制备的样品的微滴(和/或不可混溶的流体的微滴)移动至所述检测模块。
在某些实施方案中,可以将所述样品制备模块用于执行免疫测定的步骤。可以使用任意免疫测定形式来产生可检测信号,所述信号指示目标分析物在样品中的存在且与样品中分析物的量成比例。在本文中描述了示例性的免疫测定。
在某些情况下,所述检测模块包括这样的孔阵列:其被光学地询问以测量与存在于所述样品中的分析物的量有关的信号。所述孔阵列可以具有亚飞升体积、飞升体积、亚纳升体积、纳升体积、亚微升体积或微升体积。例如,所述孔阵列可以是飞升孔阵列、纳升孔阵列或微升孔阵列。在某些实施方案中,阵列中的孔可以都具有基本上相同的体积。所述孔阵列可以具有至多100µl的体积,例如,约0.1飞升、1飞升、10飞升、25飞升、50飞升、100飞升、0.1pl、1pl、10pl、25pl、50pl、100pl、0.1nl、1nl、10nl、25nl、50nl、100nl、0.1微升、1微升、10微升、25微升、50微升或100微升。
在某些实施方案中,所述样品制备模块和所述检测模块可以都存在于单个基础基底上,且所述样品制备模块和所述检测模块可以包括用于移动液体微滴的系列或多个电极。在某些实施方案中,这样的装置可以包括第一基底和第二基底,其中所述第二基底定位在所述第一基底上面且与所述第一基底被间隙隔开。所述第一基底可以包括:第一部分(例如,近端部分),样品制备模块定位在此处,在这里将液体微滴引入所述装置中;和第二部分(例如,远端部分),所述液体微滴炒向其移动,检测模块定位在所述第二部分处。本领域技术人员理解,“近端”考虑到“远端”和“第一”考虑到“第二”的应用是相对术语,且是相对于彼此可互换的。在某些实施方案中,所述第一部分和所述第二部分是分离的或分离的且邻近的。在某些实施方案中,所述第一部分和所述第二部分是共定位的、混杂的或互相交叉的。所述第一基底可以包括系列或多个电极,所述电极覆盖在所述第一基底的上表面上并从所述第一部分延伸至所述第二部分。所述第一基底可以包括设置在所述第一基底的上表面上的层,所述层覆盖所述系列或多个电极并从所述第一部分延伸至所述第二部分。所述第一层可以由电介质材料和疏水材料制成。电介质和疏水材料的例子包括聚四氟乙烯材料(例如,teflon®)或氟表面活性剂(例如,fluoropel™)。可以以提供基本上平坦表面的方式沉积第一层。可以将孔阵列定位在所述第一基底的第二部分中并覆盖所述系列或多个电极的部分,并形成检测模块。所述孔阵列可以定位在所述第一层中。在某些实施方案中,在所述第一层中制造所述孔阵列之前或之后,可以将亲水层设置在所述第一基底的第二部分中的第一层上面以提供具有亲水表面的孔阵列。所述第一基底和第二基底之间的空间/间隙可以用空气或不可混溶的流体填充。在某些实施方案中,所述第一基底和第二基底之间的空间/间隙可以用空气填充。
在某些实施方案中,所述样品制备模块和所述检测模块都可以使用单个基础基底制造,但是用于移动液体微滴的系列或多个电极可以仅存在于所述样品制备模块中。在这样的一个实施方案中,所述第一基底可以包括系列或多个电极,其在所述第一基底的第一部分处覆盖在所述第一基底的上表面上,其中所述系列或多个电极没有延伸至所述第一基底的第二部分。在这样的实施方案中,所述系列或多个电极仅定位在所述第一部分中。如上所述的电介质/疏水材料(例如,特氟隆)的第一层可以设置在所述第一基底的上表面上,且可以覆盖所述系列或多个电极。在某些实施方案中,所述第一层可以仅设置在所述第一基底的第一部分上面。在其它实施方案中,所述第一层可以设置在位于所述第一部分以及所述第二部分上面的所述第一基底的上表面上面。孔阵列可以定位在所述第一基底的第二部分的第一层中,从而形成检测模块,其不包括存在于所述孔阵列下面的系列或多个电极。
在某些情况下,所述第一层可以是电介质层,且疏水材料的第二层可以设置在所述电介质层上面。所述孔阵列可以定位在所述疏水层中。在所述疏水层中制造所述孔阵列之前或之后,可以将亲水层设置在所述第一基底的第二部分中的疏水层上面。
在某些实施方案中,所述第二基底可以在所述第一基底的第一部分和第二部分上面延伸。在这样的一个实施方案中,所述第二基底可以是基本上透明的,至少在覆盖所述孔阵列的区域中。在其它情况下,所述第二基底可以以隔开方式设置在所述第一基底的第一部分上面,且可以不设置在所述第一基底的第二部分上面。因而,在某些实施方案中,所述第二基底可以存在于所述样品制备模块中,但是不存在于所述检测模块中。
在某些情况下,所述第二基底可以包括形成电极的导电层。所述导电层可以设置在所述第二基底的下表面上。所述导电层可以被由如上所述的电介质/疏水材料制成的第一层覆盖。在某些情况下,所述导电层可以被电介质层覆盖。所述电介质层可以被疏水层覆盖。所述导电层和覆盖它的任何层可以横过所述第二基底的下表面设置,或可以仅存在于所述第二基底的第一部分上。在某些实施方案中,所述第二基底可以在所述第一基底的第一部分和第二部分上面延伸。在这样的一个实施方案中,所述第二基底和设置在其上面的任何层(例如,导电层、电介质层等)可以是基本上透明的,至少在覆盖所述孔阵列的区域中。
在其它情况下,在所述第一基底上的系列或多个电极可以构造为共平面电极,且所述第二基底可以不包括电极。
在某些情况下,存在于所述第一层和/或所述第二层中的电极可以由基本上透明的材料(诸如氧化铟锡、氟掺杂过的氧化锡(fto)、掺杂过的氧化锌等)制成。
在一些实施方案中,所述样品制备模块和所述检测模块可以制造在单个基础基底上。在其它实施方案中,所述样品制备模块和所述检测模块可以制造在单独基底上,它们可以随后连接以形成集成的微流体和分析物检测装置。在某些实施方案中,所述第一基底和第二基底可以使用可定位在所述基底之间的隔离物隔开。
本文中所述的装置可以是平面的,且可以具有任何形状,例如,矩形或正方形、具有圆角的矩形或正方形、圆、三角形等。
基于微滴的微流体表示通过主动力或被动力产生和驱动(诸如移动、合并、分割等)液体微滴。主动力的例子包括但不限于电场。示例性的主动力技术包括电润湿、介电电泳、光诱导电润湿、电极介导、电场介导、静电驱动等或它们的组合。在一些实施例中,所述装置可以经由基于微滴的微流体(例如,电润湿)或经由电润湿和液体微滴的连续流体流的组合在间隙中驱动液体微滴横过第一层的上表面(或第二层的上表面,当存在时)。在其它实施例中,所述装置可以包括微通道以将液体微滴从样品制备模块递送至检测模块。在其它实施例中,所述装置可以依赖于经由基于微滴的微流体在间隙中横过疏水层表面的液体微滴驱动。电润湿可能包括如下改变表面的润湿性能:向所述表面施加电场,和影响存在于所述表面上的液体微滴和所述表面之间的表面张力。可以经由外部压力源(诸如外部机械泵或集成的机械微泵,或毛细管力和电动机制的组合)使用连续流体流移动液体微滴。被动力的例子包括但不限于,t-汇合和流聚焦方法。被动力的其它例子包括使用较稠的不可混溶的液体,例如,重油流体,其可以连接到第一基底表面上的液体微滴并移动所述液体微滴横过表面。所述较稠的不可混溶的液体可以是比水更稠且不在可察觉的程度上与水混合的任何液体。例如,所述不可混溶的液体可以是烃、卤代烃、极性的油、非极性的油、氟化油、氯仿、二氯甲烷、四氢呋喃、1-己醇等。
所述第一基底和第二基底之间的空间可以是多达1mm高度,例如,0.1µm、0.5µm、1µm、5µm、10µm、20µm、50µm、100µm、140µm、200µm、300µm、400µm、500µm、1µm-500µm、100µm-200µm等。在本文所述的装置中产生并移动的微滴的体积可以在约10µl至约5皮升范围内,例如,10µl-1皮升、7.5µl-10皮升、5µl-1nl、2.5µl-10nl或1µl-100nl、800-200nl、10nl-0.5µl,例如,10µl、1µl、800nl、100nl、10nl、1nl、0.5nl、10皮升或更小。
图1a图示说明了示例性的集成的数字微流体和分析物检测装置10。装置10包括第一基底11和第二基底12,其中第二基底12定位在第一基底11上面且与所述第一基底被间隙13隔开。如在图1a中图示说明的,第二基底12具有与第一基底11相同的长度。但是,在其它示例性装置中,第一基底11和第二基底12可以具有不同长度。所述第二基底可以包括或不包括电极。第一基底11包括第一部分15,在这里将液体微滴(例如,样品微滴、试剂微滴等)引到第一基底11上。第一基底11包括液体微滴向其移动的第二部分16。第一部分15也可以被称作样品制备模块,且第二部分16可以被称作分析物检测模块。第一基底11包括定位在第一基底11的上表面上的系列或多个电极17。电介质/疏水材料(例如,电介质的和疏水的特氟隆)的层18设置在所述第一基底的上表面上并覆盖系列或多个电极17。孔阵列19定位在所述第一基底的第二部分16上的层18中。
图1b图示说明了集成的数字微流体和分析物检测装置20的另一个实施例,其包括第一基底21和第二基底22,其中第二基底22定位在第一基底20上面且与所述第一基底的上表面被间隙23隔开。第一基底21包括:第一部分25,在这里将液体引到第一基底21上;和第二部分26,向其引导液体用于检测分析物相关信号。第一基底21包括定位在所述第一基底的上表面上的系列或多个电极27。电介质材料的层28定位第一基底21的上表面上且覆盖系列或多个电极27。在该示例性装置中,所述系列或多个电极27仅定位在第一基底21的第一部分上。第二基底22可以包括或不包括电极。
图2a图示说明了另一种示例性的集成的数字微流体和分析物检测装置30。装置30包括第一基底31和第二基底32,其中第二基底32定位在第一基底31上面且与所述第一基底的上表面被间隙33隔开。第一基底31包括第一部分35,在这里将液体微滴(例如,样品微滴、试剂微滴等)引到第一基底31上。第一基底31包括液体微滴向其移动的第二部分36。所述第一部分也可以被称作样品制备模块,且所述第二部分可以被称作检测模块。第一基底31包括定位在所述第一基底的上表面上的系列或多个电极37。电介质材料的层38设置在所述第一基底的上表面上并覆盖系列或多个电极37。疏水材料的层34覆盖在电介质层38上。孔阵列39定位在第一基底31的第二部分上的疏水层34中。所述孔阵列可以具有亲水的或疏水的表面。
图2b图示说明了集成的数字微流体和分析物检测装置40的另一个实施例,其包括第一基底41和第二基底42,其中第二基底42定位在第一基底40上面且与所述第一基底的上表面被间隙43隔开。所述第一基底包括:第一部分45,在此处将液体引到第一基底41上;和第二部分46,向其引导液体用于检测分析物相关信号。第一基底41包括定位在所述第一基底的上表面上的系列或多个电极47。电介质材料的层48定位在第一基底41的上表面上并覆盖系列或多个电极47。在该示例性装置中,系列或多个电极47仅定位在第一基底41的第一部分45上。电介质层48覆盖第一基底41的整个上表面,且疏水层44覆盖电介质层的整个上表面。孔阵列49定位在疏水层44中,且孔阵列49仅定位在覆盖第一基底41的第二部分46的疏水层部分处。在该实施例中,将电介质层48显示为在第一基底41的整个上表面上面延伸。在其它实施例中,所述电介质层和所述疏水层可以局限于所述第一部分,且所述孔可以定位在位于所述第一基底的第二部分上的亲水层中。
在一些实施例中,可以将液体经由微滴驱动器引入间隙中(没有图示)。在其它实施例中,可以将液体经由流体入口、端口或通道引入间隙中。在图中没有图示所述装置的另外有关部件。这样的图可以包括用于加载样品、洗涤缓冲液、结合成员、酶底物、废物流体等的隔室。可以将测定试剂包含在作为集成装置的部分的外部蓄池中,其中当特定测定步骤需要时可以将预定体积从蓄池移动至装置表面。另外,可以将测定试剂以干燥的、印刷的或低压冻干的试剂的形式沉积在所述装置上,它们可以在此处储存延长的时间段而不丧失活性。可以将这样的干燥的、印刷的或低压冻干的试剂在分析物分析之前或过程中再水合。
在一些实施例中,所述第一基底可以由柔性材料诸如纸(具有油墨喷射印刷的电极)或聚合物制成。在其它实施例中,所述第一基底可以由非柔性材料(例如,印刷的电路板、塑料或玻璃或硅)制成。在一些实施例中,所述第一基底由单个薄板制成,其然后可以经历随后的加工以建立所述系列或多个电极。在一些实施例中,可以将多个系列或多个电极制造在第一基底上,所述第一基底可以被切割以形成多个被系列或多个电极覆盖的第一基底。在一些实施例中,所述电极可以经由一般胶粘剂或焊接剂粘合至导电层的表面。所述第二基底可以由任意合适材料制成,所述材料包括但不限于柔性材料,诸如纸(具有或没有油墨喷射印刷的电极)、聚合物、印刷的电路板等。
在一些实施例中,所述电极包含金属、金属混合物或合金、金属半导体混合物或合金或导电聚合物。金属电极的一些例子包括铜、金、铟、锡、氧化铟锡和铝。在一些实施例中,所述电介质层包含绝缘材料,其具有低电导率或能够经受静电场。在一些实施例中,所述电介质层可以由瓷(例如,陶瓷)、聚合物或塑料制成。在一些实施例中,所述疏水层可以由具有疏水性质的材料(例如特氟隆和通用碳氟化合物)制成。在另一个实施例中,所述疏水材料可以是氟表面活性剂(例如,fluoropel)。在包括沉积在电介质层上的亲水层的实施方案中,它可以是玻璃、石英、二氧化硅、金属氢氧化物或云母的层。
本领域普通技术人员明白,所述电极阵列(例如,系列)可以在单位面积的第一基底上包括特定数目的电极,所述数目可以基于电极的大小和互相交叉的电极的存在或不存在而增加或减小。可以使用多种方法制造电极,所述方法包括电极的光刻、原子层沉积、激光刻绘或蚀刻、激光消融、柔性版印刷和喷墨印刷。
在一些实施例中,可以将特殊掩膜版图案施加于设置在第一基底的上表面上的导电层,随后将暴露的导电层进行激光消融以在所述第一基底上产生系列或多个电极。
在一些实施例中,由所述系列或多个电极产生的电势转移在覆盖所述系列或多个电极的第一层(或第二层,当存在时)的上表面上形成的液体微滴横过所述数字微流体装置的表面被所述孔阵列接收。每个电极可以能够独立地移动所述微滴横过所述数字微流体装置的表面。
图3a图示说明了示例性的集成的数字微流体和分析物检测装置100的侧视图,其中液体微滴正在间隙170中移动。装置100包括第一基底110和第二基底120,其中第二基底120定位在第一基底110上面且与所述第一基底的上表面被间隙170隔开。第一基底110包括第一部分115,在这里将液体微滴(例如,样品微滴、试剂微滴等)引到第一基底110上。第一基底110包括液体微滴向其移动的第二部分130。所述第一部分也可以被称作样品制备模块,且所述第二部分可以被称作检测模块。第一基底110包括定位在所述第一基底的上表面上的系列或多个电极145。电介质材料的层150设置在所述第一基底的上表面上并覆盖系列或多个电极145。疏水材料的层155覆盖在电介质层150上。孔阵列160定位在第一基底110的第二部分上的疏水层155中。所述孔阵列可以具有亲水的或疏水的表面。如在图3a中图示说明的,将液体微滴图示为从第一部分115驱动至含有孔阵列160的第二部分130。含有多个珠子或颗粒190的液体微滴180正在经由使用系列或多个电极145的主动定向运动移动横过第一部分115且到达第二部分130。箭头指示液体微滴的运动方向。尽管这里没有显示,但是可以使用可极化的油来移动微滴和密封孔。尽管这里图示了珠子/颗粒,但是微滴可以包括分析物分子来替代固体支持物,或包括分析物分子和固体支持物二者。
图3b图示说明了示例性的集成的数字微流体和分析物检测装置101的侧视图,其中微滴180正在间隙170中从第一部分115向包括孔阵列160的第二部分130移动。装置101包括第一基底110和第二基底120,其中第二基底120定位在第一基底110上面且与所述第一基底的上表面被间隙170隔开。第一基底110包括第一部分115,在这里将液体微滴(例如,样品微滴、试剂微滴等)引到第一基底110上。第一基底110包括液体微滴向其移动的第二部分130。所述第一部分也可以被称作样品制备模块,且所述第二部分可以被称作检测模块。第一基底110包括定位在所述第一基底的第一部分115处的上表面上的系列或多个电极145。电介质材料的层150设置在所述第一基底的上表面上并覆盖系列或多个电极145。疏水材料的层155覆盖在电介质层150上。孔阵列160定位在第一基底110的第二部分上的疏水层155中。所述孔阵列可以具有亲水的或疏水的表面。横过所述装置的第一部分的表面的运动是经由电极145,然后使用被动流体力使微滴180移动至第二部分,诸如穿过由191和192形成的毛细管元件的毛细管运动。在一些实施例中,所述毛细管元件可以包括亲水材料,其用于在没有施加的所述系列或多个电极产生的电场存在下促进水性微滴从第一部分向第二部分的运动。在一些实施例中,可以将疏水材料的条带设置成靠近亲水毛细管空间。可以在没有数字微流体电极存在下使用疏水材料的条带使不可混溶的流体的微滴在上面移动至所述孔阵列。可以穿过疏水毛细管元件流动的液体的一些例子包括重油流体,诸如氟化油,其可以用于促进液体微滴在所述孔阵列上面的运动。在其它实施例中,还可以利用油微滴来除去多余的微滴。
除了移动基于水的流体以外,通过电介导的驱动也可以移动不可混溶的流体,诸如基于有机物的不可混溶的流体。应当理解,微滴驱动与偶极矩和介电常数有关,它们还与电导率相关。在某些实施方案中,所述不可混溶的液体可以具有大于约0.9d的分子偶极矩、大于约3的介电常数和/或大于约10-9sm-1的电导率。在chatterjee,等人.labonchip,6,199-206(2006)中讨论了可移动的不可混溶的液体的例子及其特征。不可混溶的液体在本文公开的分析物分析测定中的应用的例子包括辅助水性微滴运动、移动定位在孔上面的水性流体、在孔的光学询问之前从所述孔移动未沉积的珠子/颗粒/分析物分子、密封孔等。可在本文公开的装置中移动的基于有机物的不可混溶的流体的一些例子包括1-己醇、二氯甲烷、二溴甲烷、thf和氯仿。还预见到满足上述标准的基于有机物的油在类似的条件下是可移动的。在有些使用不可混溶的流体微滴的实施方案中,所述装置中的间隙/空间可以用空气填充。
图4a图示说明了含有珠子或颗粒190的液体微滴180,其已经移动至图3a的集成装置的第二部分且定位在孔阵列160上面。所述微滴可以以直线或往复移动或运动在所述孔阵列上面连续移动,且可以在所述孔阵列上面暂停。在所述孔阵列上面移动微滴和/或暂停微滴促进颗粒或珠子190向孔阵列160中的沉积。将所述孔的大小设置成包括一个珠子/颗粒。在图4a所图示说明的装置中,使用系列或多个电极145在所述孔阵列上面移动微滴。尽管在这里描绘了珠子/颗粒,但是也可以以类似的方式,并通过在不可混溶的流体密封孔之前使含有分析物分子的微滴在孔上面暂停足够的时间段以允许分析物分子扩散进孔中,移动含有分析物分子的微滴。将所述孔的大小设置成包括一个珠子/颗粒。还可以将所述孔的大小设置成包括一个分析物分子/孔。
图4b图示说明了含有珠子或颗粒190的液体微滴185,其已经在不使用系列或多个电极的情况下移动至图3b的集成装置的第二部分且定位在孔阵列上面。在图4b中,正在使用疏水液体195(诸如不可混溶的流体)的微滴使液体微滴在孔阵列上面移动以促进珠子/颗粒190向孔160中的沉积。箭头的方向指示微滴185正在移动的方向。
图5显示了使用系列或多个电极57使疏水流体微滴62(例如,可极化的流体)在第一部分55上面移动。描绘的装置50包括第一基底51和第二基底52,其中第二基底52定位在第一基底51上面且与所述第一基底的上表面被间隙53隔开。第一基底51包括第一部分55,在这里将液体微滴(例如,样品微滴、试剂微滴等)引到第一基底51上。第一基底51包括液体微滴向其移动的第二部分56。第一基底51包括定位在所述第一基底的第一部分55处的上表面上的系列或多个电极57。电介质材料的层58设置在所述第一基底的上表面上并覆盖系列或多个电极57。疏水材料的层54覆盖在电介质层58上。孔阵列59定位在第一基底51的第二部分上的疏水层54中。所述孔阵列可以具有亲水的或疏水的表面。毛细管元件60由疏水材料的两个条带在第一基底51和第二基底52上的沉积形成。所述疏水毛细管在所述系列或多个电极不存在于第二部分56中的情况下促进疏水流体微滴62向孔阵列59的运动。在其它实施方案中,所述毛细管元件可以由亲水材料的两个条带在第一基底51和第二基底52上的沉积形成。所述亲水材料在所述系列或多个电极不存在于第二部分56中的情况下促进水性微滴向孔阵列59的运动。在某些实施方案中,所述毛细管元件可以包括与一对疏水材料条带交替的一对亲水材料条带。可以将水性微滴导向一对亲水条带所定位的区域,同时可以将不可混溶的流体的微滴导向一对疏水条带所定位的区域。
图6描绘了集成的数字微流体和分析物检测装置的另一个实施方案。装置600包括在其上面形成电极阵列607的底层601。所述电极阵列被电介质层608覆盖。疏水层609仅设置在底基底的第一部分605中。亲水层610设置在底基底601的第二部分606上。孔阵列位于亲水层610的第二部分中。还描绘了与所述底基底被间隙/空间603隔开的顶基底602。顶基底602包括电介质层608,其设置在位于所述底基底的第一部分上方的顶基底的底表面上。所述顶基底包括亲水层610,其设置在位于所述底基底的第二部分对面的顶基底的底表面上。水性微滴611不润湿疏水层,且在到达亲水的第二部分后,微滴611在孔阵列619上面分布,由此通过被动毛细管力促进水相的运动。以类似的方式,可以将以上概念反转来促进基于有机物的不可混溶的流体在所述孔上面的润湿和铺展。在该情况下,所述第二部分上的顶和底基底可以被疏水材料/涂层包被,由此允许基于有机物的不可混溶的流体通过被动毛细管力在所述孔上面流动。
如本文中使用的数字微流体表示使用系列电极来操作微流体装置中的微滴,例如,在小空间中移动微滴、分割微滴、合并微滴等。本文中使用的术语“微滴”和“流体微滴”可互换地用于表示离散的液体体积,其是大致球形的形状且在至少一个侧面上被微流体装置的壁或基底约束。“大致球形的”在微滴的上下文中表示形状诸如球形,特别是扁球,例如,圆盘形、棒条形、截短的球体、椭圆体、半球形或卵形。本文公开的装置中的微滴的体积可以在约10µl至约5pl的范围内,例如,10µl-1pl、7.5µl-10pl、5µl-1nl、2.5µl-10nl或1µl-100nl,例如,10µl、5µl、1µl、800nl、500nl或更小。
在一些实施例中,所述孔阵列包括多个单独孔。所述孔阵列可以包括可在10-109个/mm2的范围内的多个孔。在某些情况下,可以制造覆盖大约12mm2面积的约100,000-500,000个孔(例如,飞升孔)的阵列。每个孔可以测量约4.2µm宽x3.2µm深(体积大约50飞升),且可以能够容纳单个珠子/颗粒(约3µm直径)。在该密度,飞升孔彼此相距大约7.4µm的距离。在一些实施例中,可以将孔阵列制造成具有10nm至10,000nm直径的单独孔。
单个珠子/颗粒/分析物分子在孔中的放置允许数字读出或模拟读出。例如,对于低数目的阳性孔(<~70%阳性),可以使用poisson统计以数字格式定量分析物浓度;对于高数目的阳性孔(>~70%),将带有信号的孔的相对强度分别与从单个珠子/颗粒/分析物分子产生的信号强度进行对比,并用于产生模拟信号。可以为较低分析物浓度使用数字信号,反之可以为较高分析物浓度使用模拟信号。可以使用数字和模拟定量的组合,其可以扩展线性动态范围。本文中使用的“阳性孔”表示具有与珠子/颗粒/分析物分子的存在有关的信号的孔,所述信号高于阈值。本文中使用的“阴性孔”表示可能不具有与珠子/颗粒/分析物分子的存在有关的信号的孔。在某些实施方案中,来自阴性孔的信号可以是在背景水平,即,低于阈值。
所述孔可以是多种形状中的任一种,例如,具有平底表面的圆柱形、具有圆底表面的圆柱形、立方体、骰状、截头圆锥形、倒置截头圆锥形、或圆锥形。在某些情况下,所述孔可以包括侧壁,所述侧壁可以定向成促进存在于已经在孔阵列上面移动的液体微滴中的微珠或微粒的接收和保留。在一些实施例中,所述孔可以包括第一侧壁和第二侧壁,其中所述第一侧壁可以在所述第二侧壁对面。在一些实施例中,所述第一侧壁相对于所述孔的底以钝角定向,且所述第二侧壁相对于所述孔的底以锐角定向。微滴的运动可以是在与所述孔的底平行的方向且从所述第一侧壁至所述第二侧壁。
在一些实施例中,通过模塑、压力、热或激光或它们的组合中的一种或多种可以制造孔阵列。在一些实施例中,使用纳米压印/纳米球光刻可以制造孔阵列。还可以使用本领域众所周知的其它制造方法。
图7a-7b图示说明了孔的几种示例性侧壁取向。如在图7a-b中所示,所述孔包含与第二侧壁相对的第一侧壁。图7a图示说明了显示孔阵列中的各个孔460的垂直横截面。图7a图示说明了第一侧壁401和第二侧壁402。所述第一侧壁相对于孔的底表面143处于钝角,且所述第二侧壁相对于孔的底表面143处于锐角。箭头指示液体微滴横过所述阵列移动的方向。所述孔的侧壁的这种取向促进接收和保留珠子/颗粒/分析物分子490。
在图7b中,第一侧壁410的顶部分415相对于孔的底412以钝角定向,且第一侧壁410的底部分416与孔的底412垂直定向,且第二侧壁411与孔的底412垂直定向,其中液体微滴的运动是在与所述孔的底平行的方向且从所述第一侧壁至所述第二侧壁,其中所述第一侧壁的顶部分是在所述孔的开口处。
可以通过许多方法制造本文所述的集成装置。在某些情况下,所述方法可能包括激光消融、喷雾涂布、卷对卷(rolltoroll)、柔性版印刷和纳米压印光刻(nil)的组合以构建所述第一基底、系列或多个电极、电介质层和疏水层。
在一些实施例中,多个辊子可以展开第一卷以将所述第一基底驱动至第一位置。然后可以将导电材料施加于所述第一基底。可以将所述导电材料图案化进系列或多个电极中。在一些实施例中,所述印刷机装置包含一个或多个涂布辊子以将疏水材料或电介质材料中的至少一种施加于所述第一基底上的至少一个电极图案。在一些实施例中,所述涂布辊子用于将防污材料施加于所述第一基底。
在一些实施例中,所述系统还包含联合体(merger)以将所述第一基底与所述第二基底对齐。在一些实施例中,所述联合体包含两个辊子。并且,一些公开的实施例包括固化站以固化所述疏水材料或所述电介质材料。一些公开的实施例还包括粘合站以将所述第一基底的至少第一部分与所述第二基底的至少第一部分粘合。所述粘合的部分包括电极图案。所述方法还包括以隔开距离结合所述第一基底和所述第二基底。所述第一基底和第二基底之间的空间可以是约0.01mm至1mm高度,例如,0.1µm、0.5µm、1µm、5µm、10µm、20µm、50µm、100µm、140µm、200µm、300µm、400µm、500µm、1µm-500µm、100µm-200µm等。
在一些实施例中,所述方法包括模压所述第一基底以在所述第一基底上建立一个或多个突出物。在这样的实施例中,所述突出物与所述第一基底和所述第二基底以隔开距离分离。
可以手工地或自动地或半自动地运转本公开的装置。在某些情况下,可以由运行程序的处理器运转所述装置,所述程序用于实现产生分析物相关信号和检测所述信号所需的步骤。如在此使用的,短语“分析物相关信号”或“分析物有关信号”表示这样的信号:其指示分析物的存在且与样品中分析物的量成比例。所述信号可以是荧光、化学发光、比色测量、浊度测量等。在某些情况下,所述读出可以是数字的,例如,将阳性计数(例如,孔)的数目与阴性计数(例如,孔)的数目进行对比以得到数字计数。
图8是用于建立集成的数字微流体和分析物检测装置的基础基底的第一个示例性系统或组合装置500的简图。第一个实施例组合装置500包括系列或多个辊子,包括第一辊子502、第二辊子504和第三辊子506,它们以同步旋转运转以驱动基础基底508穿过第一个实施例组合装置500。第一个实施例组合装置500可以包括除第一辊子502、第二辊子504和第三辊子506以外的辊子以使用卷对卷技术移动基础基底508穿过组合装置。其它实施例可以使用传送机、滑轮和/或任意其它合适的运输机构。
在第一个实施例组合装置500中,第一辊子502旋转以展开基础基底508,后者在一些实施例中是处于滚动构型(rolledconfiguration)的单个薄板。基础基底508包括第一层510和第二层512。在该实施例中,第一层510包含不导电的柔性基底或网,例如塑料,且第二层512包括导电材料。第二层512的导电材料可以是,例如,金属诸如金、银或铜,或非金属导体诸如导电聚合物。在其它实施例中,可以使用不同的金属或金属和/或导电聚合物的组合。在一些实施例中,基础基底508包括设置在非导电第一层510和导电第二层512之间的任选粘合剂层513。作为一个实施例,粘合剂层513可以包含铬,金层设置在铬粘合剂层513的顶部上以形成导电第二层512。因而,在图8的基础基底508中,在被第一辊子502展开之前将非导电第一层510和导电第二层512预粘附以形成基础基底508。
在图8的实施例基础基底508中,非导电第一层510具有小于约500nm的厚度。如下面将描述的,这样的厚度允许基础基底508经由多个辊子移动穿过第一个实施例组合装置500。并且,在一些实施例中,非导电第一层510的厚度大于导电第二层512的厚度。作为一个实施例,导电第二层512的厚度可以是大约30nm。在其它实施例中,导电第二层512的厚度小于约500nm。在一些实施例中,基于例如第一层510和/或第二层512的材料和/或要使用基础基底508形成的微滴驱动器的操作目的,选择非导电第一层510和/或导电第二层512的厚度。
第一辊子502将基础基底508驱动至激光消融站514。激光消融站514包括含有母模518的掩膜版516,所述母模518要投射到基础基底508的导电第二层512上。基于特征诸如分辨率(例如,要消融的基础基底508的单位面积上的电极数目)、电极大小、限定电极图案的线的构型、电极的互相交叉、电极之间的间隙或间距和/或用于将电极连接至仪器(例如,电源)的电迹线,可以预先定义与掩膜版516结合的母模518。在一些实施例中,基于基础基底508要与其关联的微滴驱动器的一个或多个运行应用(例如,用于与生物测定和/或化学测定一起使用),选择母模518的特征。并且,在一些实施例中,母模518是可构造的或可重构的以使激光消融站514能够在基础基底508上形成不同图案。额外地或可替换地,在一些实施例中,掩膜版516可用一个或多个替代掩膜版替换。
激光消融站514包括透镜520。随着基础基底508由于辊子(例如,第一辊子502)的旋转而遇到激光消融站514,基础基底508的部分522在透镜520下面经过或过去。部分522可以是例如基础基底508的矩形或正方形部分,其具有小于基础基底508的面积的面积且包括导电第二层512。透镜520将母模518的至少部分成像或投射在与部分522关联的导电第二层512上。将激光束524经由掩膜版516和透镜520引导到部分522上,使得激光束524基于投射的母模518选择性地穿透导电第二层512。在一些实施例中,激光束524也可以基于投射的母模518穿透非导电第一层500或部分(例如,非导电第一层510的厚度的一部分)。掩膜版516的固体部分阻断激光束524,且掩膜版516的开放部分允许激光束524穿过掩膜版516并与基础基底508接触。激光束524可以例如与激元激光器关联。
作为向激光束524暴露的结果,受照射的部分522的非导电第一层510吸收与激光束524关联的能量。受照射的非导电第一层510发生光化学解离,从而导致非导电第一层510的结构键的选择性解散以及非导电第一层510的片段和导电第二层512的覆盖受照射的非导电第一层510的部分根据母模518的射出。在一些实施例中,基于非导电第一层510和/或导电第二层512的深度(例如,厚度)预先定义激光束524穿透基础基底508的深度(例如,辐射强度)。在一些实施例中,激光束524穿透深度是可调节的,以改变作为基础非导电第一层510的碎裂的结果激光束524消融导电第二层512的深度。在一些实施例中,随着实施例系统500运转,该调节是动态的。并且,在一些实施例中,基础基底508在暴露于激光束524以后经历清洗以除去颗粒和/或表面污染物。
如图8中所示,暴露于激光消融站514以后,基础基底508的部分522包括电极阵列526。电极阵列526由形成在导电第二层512中的多个电极构成。作为向激光束524的暴露和非导电第一层510的碎裂的结果,导电第二层512的部分从基础基底508除去。除去的与电极阵列526有关的部分是基于母模518。在一些实施例中,所述除去的部分与掩膜版516的开放部分匹配。
返回图8,部分522在激光消融站514处经历激光消融以形成电极阵列526以后,部分522通过第一辊子502、第二辊子504和第三辊子506的旋转移动至印刷机528。在第一个实施例组合装置500中,印刷机528包括能够将具有疏水和/或电介质性质的材料530的至少一个层施加于电极阵列526的设备或器械。在第一个实施例组合装置500中,印刷机528可以通过沉积技术沉积疏水材料和/或电介质材料530,所述沉积技术包括但不限于基于网的涂布(例如,通过与印刷机528关联的辊子)、狭槽模具涂布、自旋涂布、化学气相沉积、物理气相沉积和/或原子层沉积。印刷机528还可以施加除疏水材料和/或电介质材料530以外的其它材料(例如,防污涂层、抗凝剂)。印刷机528还可以施加具有不同厚度和/或覆盖基础基底508的不同部分的材料的一个或多个层。
如上所述,在第一个实施例组合装置500中,第一辊子502、第二辊子504和第三辊子506中的至少一个将基础基底508推进至印刷机528用于将疏水材料和/或电介质材料530施加于电极阵列526。在一些实施例中,印刷机528包括多个对准辊子531以在施加疏水材料和/或电介质材料530(例如,通过辊子涂布方法)中促进进料准确度和对准基础基底508作为印刷机528的运转的部分。
在第一个实施例组合装置500中,将疏水材料和/或电介质材料530施加于电极阵列526以使电极阵列526完全地或基本上完全地绝缘。
在一些实施例中,通过印刷机528以基本上液体形式沉积疏水材料和/或电介质材料530。为了在基础基底508上建立结构性的或经处理的层532来支持微滴,通过辊子(例如,第一辊子502、第二辊子504和第三辊子506)使部分522移动穿过固化站534。在固化站534处,将疏水材料和/或电介质材料处理和/或改性以形成第一个经处理的层532。将疏水材料和/或电介质材料处理和/或改性可以包括固化所述材料。例如,在固化站534处,施加热来促进疏水材料和/或电介质材料530的硬化。在一些实施例中,将部分522暴露于紫外线以固化疏水材料和/或电介质材料530和形成经处理的层532,从而使电极阵列526绝缘。在其它实施例中,所述疏水材料和/或电介质材料的固化和/或改性在没有热和/或光子源的情况下完成。在一些实施例中,随着施加电场(例如,与电极阵列526连接)来操作微滴,所述经处理的层532支持微滴。例如,在电润湿过程中,作为施加的电压(其影响微滴在经处理的表面532上的表面张力)的结果,微滴相对于经处理的层532的接触角变化。电润湿仅仅是示例性的,还可以使用其它力移动微滴。
穿过固化站534以后,制备部分522以充当微滴驱动器的底基底和/或充当数字微流体芯片。因为基础基底508包括与导电第二层512粘合的非导电第一层510(如上面公开的),不需要另外的粘附,例如电极阵列526与非导电第一层510的粘附。这样的构型通过减少加工步骤增加制备微滴驱动器的基础基底508的效率。并且,如上所述,当部分522是在激光消融站514、印刷机528或固化站534中的任一个处时,基础基底508的其它部分并行地移动穿过第一个实施例组合装置500的各个站514、528、534中的其它站。例如,当部分522是在固化站534处时,第一辊子502、第二辊子504和第三辊子506连续地、周期性地或非周期性地推进基础基底508的一个或多个其它部分穿过例如激光消融站514和/或印刷机528。以这样的方式,通过基本上连续的高速自动化过程实现微滴驱动器的基础基底508的制备。
固化步骤以后,使图案辊子在基础基底的第二部分上面滚动以建立孔阵列540。随后可以用亲水材料(未显示)涂布孔阵列540。
尽管可以将基础基底508视作包括连续部分,在第一个实施例组合装置500的一些实施例运转中,随着所述连续部分经历加工以建立电极阵列526(例如,通过电极图案)和接收疏水材料和/或电介质材料530的涂布,基础基底508保持作为单个薄板。因而,为了使用经加工的基础基底508建立一个或多个微滴驱动器,在一些实施例中,将基础基底508切割(例如,切块)以形成包含电极阵列526的各个单元,这将在下面进一步公开。在一些实施例中,在切块之前,在被第一辊子502展开之前,将基础基底508(包括部分522)以类似于基础基底508的最初滚动构型类似的滚动构型回卷。这样的回卷可以通过作为卷对卷加工的部分的一个或多个辊子完成。在这样的实施例中,可以在稍后的时间将基础基底508切块或以其它方式分离。在其它实施例中,所述辊子(例如,第二辊子504和第三辊子506)推进基础基底508用于与顶基底合并。
图9图示说明了第二个实施例组合装置600,其用于建立具有单个电极的微滴驱动器的实施例顶基底。第二个实施例组合装置600包括系列或多个辊子,包括第一辊子602、第二辊子604和第三辊子606,它们以同步旋转运转以驱动顶基底608穿过第二个实施例组合装置600。第二个实施例组合装置600可以包括除第一辊子602、第二辊子604和第三辊子606以外的辊子以移动顶基底608穿过组合装置600。
在第二个实施例组合装置600中,第一辊子602旋转以展开顶基底608,其在一些实施例中是在滚动构型中的薄板。图9的实施例顶基底608包括第一层610和第二层612。与实施例基础基底508一样,在该实施例中,顶基底608的实施例第一层610包含非导电材料,例如,塑料,且实施例第二层612包括导电材料,诸如金属,包括例如,金、铬、银、氧化铟锡或铜和/或任意其它合适金属中的一种或多种,导电聚合物,或金属和/或导电聚合物的组合。在一些实施例中,通过粘合剂层(例如,铬)将导电第二层612粘附至非导电第一层。
在第二个实施例组合装置600中,第一辊子602、第二辊子604和第三辊子606旋转以将顶基底612推进至印刷机614。印刷机614给导电第二层612涂布疏水材料和/或电介质材料616(例如teflon®或parylenec或电介质诸如陶瓷)。印刷机614与图8的第一个实施例组合装置500的印刷机528基本上类似。例如,印刷机614可以通过基于网的涂布、狭槽模具涂布、自旋涂布、化学气相沉积、物理气相沉积、原子层沉积和/或其它沉积技术将疏水材料和/或电介质材料616施加于顶基底608。印刷机614可以包括对准辊子617以促进在疏水材料和/或电介质材料616和/或其它涂布材料施用过程中,顶基底608相对于印刷机614的对齐。
接收疏水材料和/或电介质材料616的涂布以后,第二辊子504和第三辊子506将部分618推进至固化站620。如结合图8的固化站534公开的,第二个实施例组合装置600的固化站620促进通过热对疏水材料的改性(例如,固化)以形成经处理的层622。经处理的层622通过完全地或基本上完全地覆盖导电第二层612而使导电第二层612绝缘,所述导电第二层612充当顶基底608的单个电极。因而,在涂布部分618的第二层612中,使顶基底608的电势传导部分与微滴绝缘,所述微滴可以施加包括部分618的微滴驱动器。
穿过固化站620以后,制备部分618以充当微滴驱动器的顶基底。因为顶基底608包括预粘附至导电第二层612的非导电第一层610,不需要另外的粘附,例如,电极与非导电第一层610的粘附,由此增加微滴驱动器的顶基底608的制备效率。
在第二个实施例组合装置600中,第一辊子602、第二辊子604和第三辊子606旋转以推进顶基底608,使得所述顶基底的部分以基本上连续的、周期的和/或非周期的系列穿过印刷机614或固化站620之一作为第二个实施例组合装置60的卷对卷运转的部分。因而,尽管结合部分618描述了第二个实施例组合装置600,但是应当理解,作为第一辊子602、第二辊子604和第三辊子606的旋转的结果,以与部分618基本上类似的方式制备顶基底608的连续部分。以这样的方式,沿着顶基底608的长度给顶基底308提供经处理的层622。
在实施例顶基底608中,导电第二层612充当电极。但是,在一些实施例中,导电第二层612经历激光消融以形成一个或多个电极阵列。在这样的实施例中,第二个实施例组合装置600包括激光消融站。因而,在接收疏水材料616之前,将顶基底608暴露于激光束,其在受照射的导电第二层612中建立电极图案。并且,在一些实施例中,所述电极阵列不是形成在基础基底表明上/内部,而是仅形成在顶基底608表明上/内部。
在第二个实施例组合装置600的运转过程中,随着顶基底608的连续部分被疏水材料616涂布,顶基底保持单个薄板。作为一个或多个微滴驱动器的制造的部分,使顶基底608与基础基底对齐。在一些实施例中,穿过固化站620以后,通过一个或多个辊子使顶基底回卷成滚动构型。在这样的实施例中,可以将完成的辊切块或以其它方式切割和/或分离成各个单元,所述单元以隔开距离对齐并与基础基底的各个经切块的单元粘合以建立微滴驱动器。
在其它实施例中,穿过固化站620以后,所述辊子(例如,第一辊子602、第二辊子604和第三辊子606)继续推进顶基底608以通过自动化的卷对卷加工将顶基底608与基础基底合并。在这样的实施例中,为了制备顶基底608用于与基础基底508对齐,第一辊子602、第二辊子604和第三辊子606旋转,从而反转顶基底相对于基础基底的取向,使得当基础基底508和顶基底608以平行构型对齐时,基础基底的经处理的层面对顶基底608的经处理的层622。
如在图10中所示,第三个实施例组合装置650包括形成一对合并辊子的第三辊子656和第四辊子608,通过第三个实施例组合装置650的各个第一辊子652和第二辊子654向所述合并辊子供给基础基底508和顶基底608。随着合并辊子656、658之一旋转,基础基底658和顶基底658在预定的隔开距离或间隙以平行构型对齐。
第三个实施例组合装置650包括粘合站664。粘合站664连接或粘合基础基底508和顶基底608作为制造微滴驱动器的部分。例如,在粘合站664处,可以将一种或多种粘合剂选择性地施加于基础基底508和/或顶基底608的预定部分(例如,限定得到的微滴驱动器的周长的基础基底508和/或顶基底608的部分)以建立基础基底508和顶基底608之间的粘结,同时保留间隙662。在一些实施例中,在粘合站664处粘合基底508、608包括形成间隙662(例如,在施加粘合剂之前)。
可以在粘合站664处使用的粘合剂的例子包括环氧树脂、箔、带和/或紫外可固化的粘合剂。在一些实施例中,将聚合物诸如su-8和/或聚二甲基硅氧烷(pdms)的层施加于基础基底508和/或顶基底608以粘结所述基底。并且,在一些实施例中,所述粘合站664通过例如紫外线提供粘合剂的固化。粘合站664可以应用一种或多种方法,包括,例如,热(例如热粘结)、压力、固化等,以粘结基础基底658和顶基底608。
在第三个实施例组合装置650中,可以将合并的部分660选择性地切割、切块或以其它方式分离以形成一个或多个微滴驱动器,如基本上在图10中由合并的部分660表示的。第三个实施例组合装置650包括切块站666。切块站666可以是例如切割装置、分裂器或更通常的器械,以将连续的合并的部分660分割成与各个微滴驱动器对应的离散单元。基于例如电极图案,可以将合并的部分660切割成各个微滴驱动器,使得每个微滴驱动器包括电极阵列的覆盖区和通过电极图案形成的其它电极。
图11a描绘了底基底70的顶视图,在所述底基底70上电极阵列存在于第一部分73和第二部分74中。显示了在所述第二部分上制造孔阵列的步骤71以后的底基底72。图11b描绘了底基底80的顶视图,其中电极阵列仅设置在第一部分83中。在第二部分84中形成孔阵列的步骤81以后,刻画底基底82。
所述孔阵列可以制造在电介质/疏水层、疏水层(如果存在的话)或亲水层(如果存在的话)上。用于在第一基底的疏水层上制造孔阵列的一种示例性方法使用热或紫外纳米压印光刻。图12a图示说明了用于制造孔阵列的一种示例性方法,其中利用平纳米压印模具770在第一基底710的第二部分处向疏水层750施加足够的压力以便形成孔阵列760图案。在该实施例中,所述纳米压印冲压装置可以是平冲压元件,其冲压轮廓对应于所述第二层的上表面。
图12b图示说明了另一种示例性方法,其中可以利用纳米压印辊子775将孔阵列的图案施加于第一基底的第二部分的疏水层。所述纳米压印辊子可以通过在一个方向推进辊子775将图案压印在第一基底710的疏水层750上。随着所述辊子在一个方向推进,所述辊子留下孔阵列760的图案的压印,其对应于所述辊子上的压印图案。在一个实施例中,随着辊子775将图案压印在第一基底710的疏水层750上,辊子775以逆时针方向滚动。应当理解,可以改变所述辊子或冲压装置以形成合适体积的孔,例如,飞升辊子或冲压装置可以用于形成飞升孔。
图12c图示说明了在第一基底的第二部分的疏水层形成孔阵列图案的另一种示例性方法。在该实施例中,可以施加激光以消融疏水层750的上表面。所述激光消融步骤可以在所述第二层上产生孔阵列760图案。用于消融所述第二层的合适激光的一些例子包括具有飞秒和皮秒激光的参数。在一些实施例中,所述激光消融步骤包括使用专门掩膜版来限定所需的孔阵列图案。在一些实施例中,激光775利用聚焦元件777(例如,透镜)来准确地靶向和消融图案。在一些实施例中,在激光消融步骤以后,可以给孔阵列涂布电介质和/或疏水层。
图12d图示说明了在第一基底710的第二部分的电介质层740上形成孔阵列760的图案的另一个实施例。如在图12d中所示,所述方法利用卷对卷制造来单独地制造微流体部件和孔阵列。在一个实施例中,第一卷725含有微流体部件,其包括第一基底710和电介质层740,其中所述第一基底包含系列或多个电极745,所述电介质层740设置在所述第一基底的上表面上并覆盖系列或多个电极745。第二卷780含有基底750,其具有已经被包括在所述基底上的孔阵列760的图案。在一些实施例中,通过热或紫外纳米压印光刻可以施加以前被包括在基底750上的孔阵列760的图案。在其它实施例中,通过激光消融可以预先将所述孔阵列的图案包括在所述基底上。如在图12d中所示,压印的第二卷780还可以包括压印在孔阵列的基底上的疏水涂层。所述单独的辊通过辊子705和708展开,然后进行层压过程,其中两个薄膜可以通过将孔基底叠压在微流体部件基底上面而层压在一起以形成孔阵列和微流体部件的堆叠构型。
如本文中所述,“卷对卷”可以包括等同术语“卷轴至卷轴(reel-to-reel)”,且通过使基底以高速(包括、例如,每秒几米的速率)移动穿过不同部件而运转。卷对卷组装促进滚动基底的展开、所述基底穿过部件的前进和经处理的基底向辊中的回卷。
如以前指出的,由所述第一基底和第二基底的第二部分形成的检测模块用于检测分析物相关信号。在一些实施例中,目标分析物或生物样品的检测可以通过光学信号检测而发生。例如,照射激发光(例如,激光)以便测量信号强度结果。在其它实施例中,通过测量从每个孔隔室发出的光学信号可以检测所需分析物,并通过量化所述结果来定量。例如,通过数字分析将阳性计数(例如,孔)的数目与阴性计数(例如,孔)的数目进行对比。可以检测来自所述装置的孔的多种信号。示例性的信号包括荧光、化学发光、比色测量、浊度测量等。
本文中所述的装置可以用于产生分析物相关信号和量化信号。在图15中描绘了示例性方法。图15中的装置包括具有电极阵列81的顶基底80。所述顶基底以与底基底82隔开方式定位,所述底基底82包括在所述装置的第二部分中的孔阵列83。使用电极81可以使含有颗粒或珠子或分析物分子(未显示)的微滴84移动至孔阵列83。允许颗粒或珠子或分析物分子移动至孔的足够时间段以后,可以将微滴84移动至废物隔室/吸收垫等。然后可以使缓冲液的微滴85移动至孔阵列以除去没有沉积在孔中的任何颗粒或珠子。在一些情况下,所述缓冲液微滴可以推动微滴84前进至废物隔室。不可混溶的流体微滴86可以在孔阵列上面移动并密封孔。在光学地询问孔之前可以除去任何多余的微滴86。
图16描绘了一种方法,其中数字微流体电极(例如电极145)将含有颗粒/珠子或分析物分子190的微滴180定位在孔阵列160上面。足以将颗粒/珠子/分析物分子沉积在孔中的时间段以后,所述微滴被不可混溶的液体微滴195(或如本文中解释的不可混溶的液体)替换。不可混溶的液体微滴起作用以将没有沉积在孔中的含有任何珠子/颗粒/分析物分子的微滴180移动离开所述孔并覆盖所述孔。
图17描绘了用于除去没有沉积在孔中的任何珠子的另一种方法。在图17中,在除去含有珠子的微滴以后,许多珠子190残留在孔上面。使用水性微滴185洗掉这些珠子。除去水性微滴以后,所述孔阵列含有沉积的珠子。然后将不可混溶的流体195移动到所述孔阵列上面以密封孔。
可以利用许多力来促进颗粒/珠子从定位在孔阵列上面的微滴运动进孔中。这样的力包括重力、电动力、磁力等。可以使用永磁体或电磁体作为磁力的来源。在某些实施方案中,所述磁体没有位于集成的微流体和检测芯片上。分析物分子可以通过扩散沉积进孔中。
方法的变体和装置应用的变体
本公开的确定目标分析物在样品中的存在或量的方法和微流体装置的应用可以是如上所述。考虑到用于分析分析物的其它方法,还可以改造所述方法和公开的微流体装置的应用。众所周知的变体的例子包括但不限于,免疫测定,诸如夹心免疫测定(例如,单克隆-多克隆夹心免疫测定,包括酶检测(酶免疫测定(eia)或酶联免疫吸附测定(elisa)、竞争性抑制免疫测定(例如,正向和反向)、酶多种免疫测定技术(emit)、竞争性结合测定、生物发光共振能量转移(bret)、一步抗体检测测定、均匀测定、异质测定、飞行中捕获(captureonthefly)测定等。在一些情况下,下面的描述可以与上述方法重叠;在其它情况下,下面的描述可以提供替代方案。
免疫测定
使用免疫测定可以分析目标分析物和/或肽或其片段。可以利用任何免疫测定。所述免疫测定可以是例如酶联免疫测定(elisa)、竞争性抑制测定,诸如正向或反向竞争性抑制测定或竞争性结合测定。在一些实施方案中,可检测标记(例如,诸如一种或多种荧光标记,通过可切割的接头(其可以化学地或通过光切割进行切割)连接的一种或多种标签)连接到捕获抗体和/或检测抗体。
可以使用异质形式。例如,在从受试者得到试验样品以后,制备第一混合物。所述混合物含有要针对目标分析物进行评估的试验样品和第一特异性结合配偶体,其中所述第一特异性结合配偶体和在所述试验样品中所含的任何目标分析物形成第一特异性结合配偶体-目标分析物复合物。优选地,所述第一特异性结合配偶体是抗-目标分析物抗体或其片段。为了形成所述混合物而加入试验样品和第一特异性结合配偶体的次序不是关键性的。优选地,所述第一特异性结合配偶体固定化在固相上。在免疫测定中使用的固相(用于第一特异性结合配偶体,和任选地,第二特异性结合配偶体)可以是本领域中已知的任何固相,例如,但不限于、磁性颗粒、珠子、纳米珠子、微珠、纳米颗粒、微粒、膜、支架分子、薄膜、滤纸、圆盘或芯片(例如,微流体芯片)。
形成含有第一特异性结合配偶体-目标分析物复合物的混合物以后,使用本领域中已知的任何技术从所述复合物除去任何未结合的目标分析物。例如,通过洗涤可以除去未结合的目标分析物。但是,理想地,第一特异性结合配偶体比存在于试验样品中的任何目标分析物过量地存在,使得存在于试验样品中的所有目标分析物被第一特异性结合配偶体结合。
除去任何未结合的目标分析物以后,将第二特异性结合配偶体加入所述混合物中以形成第一特异性结合配偶体-目标分析物-第二特异性结合配偶体复合物。所述第二特异性结合配偶体优选地是结合目标分析物上的表位的抗-目标分析物(诸如抗体),所述表位不同于所述第一特异性结合配偶体结合的目标分析物上的表位。此外,也优选地,所述第二特异性结合配偶体含有可检测标记(例如可检测标记,通过可切割的接头连接的标签等)或用其标记。
固定化的抗体或其片段的应用可以整合在免疫测定中。所述抗体可以固定化在多种支持物上,诸如磁性或色谱基体颗粒、胶乳颗粒或改性的表面胶乳颗粒、聚合物或聚合物薄膜、塑料或塑料薄膜、平面基底、微流体表面、固体基底材料的碎片等。
夹心免疫测定
夹心免疫测定测量两个抗体层(即,捕获抗体(即至少一种捕获抗体)和检测抗体(即至少一种检测抗体))之间的抗原的量。捕获抗体和检测抗体结合抗原(例如,目标分析物)上的不同表位。理想地,捕获抗体与表位的结合不干扰检测抗体与表位的结合。单克隆或多克隆抗体可以在夹心免疫测定中用作捕获抗体和检测抗体。
通常,采用至少两种抗体来分离和定量试验样品中的目标分析物。更具体地,所述至少两种抗体结合形成免疫复合物(其被称作“夹心”)的目标分析物的某些表位或目标分析物片段。一种或多种抗体可以用于捕获试验样品中的目标分析物(这些抗体经常被称作“捕获”抗体),且一种或多种也结合目标分析物的具有可检测标记(例如,荧光标记,通过可切割的接头连接的标签等)的抗体可以用于完成夹心(这些抗体经常被称作“检测”抗体或“检测”抗体)。在一些实施方案中,适体可以用作第二结合成员。在夹心测定中,测定中的任意其它抗体与它各自表位的结合理想地不减少抗体与它的表位的结合。换而言之,选择抗体,使得与疑似含有目标分析物的试验样品发生接触的一种或多种第一抗体不结合被第二或随后抗体识别的全部或部分表位,由此干扰一种或多种第二检测抗体的结合目标分析物的能力。
在一个实施方案中,疑似含有目标分析物的试验样品可以同时或依次与至少一种捕获抗体和至少一种检测抗体接触。在夹心测定形式中,首先使疑似含有目标分析物(诸如膜相关的目标分析物、可溶性的目标分析物、膜相关的目标分析物的片段、可溶性的目标分析物的片段、目标分析物(膜相关的或可溶性的目标分析物)的变体或其任意组合)的试验样品与至少一种捕获抗体接触,所述捕获抗体在允许形成抗体-目标分析物复合物的条件下特异性地结合特定表位。如果使用超过一种捕获抗体,形成多种捕获抗体-目标分析物复合物。在夹心测定中,以相对于在试验样品中预见到的目标分析物或目标分析物片段的最大量摩尔过量的量使用抗体,优选地,至少一种捕获抗体。
任选地,在使试验样品与至少一种第一捕获抗体接触之前,所述至少一种捕获抗体可以结合至促进抗体-目标分析物复合物从试验样品分离的固体支持物。可以使用本领域中已知的任何固体支持物,包括但不限于,呈平面基底或珠子等形式的由聚合材料制成的固体支持物。使用化学偶联剂或通过本领域中已知的其它方式,通过吸附、通过共价键合,可以使所述抗体结合至固体支持物,前提条件是,这样的结合不干扰所述抗体的结合目标分析物或目标分析物片段的能力。此外,如果必要的话,可以将固体支持物衍生化以允许与所述抗体上的各种官能团的反应性。这样的衍生化需要使用某些偶联剂,例如,但不限于,马来酸酐、n-羟基琥珀酰亚胺、叠氮化物、炔属烃和1-乙基-3-(3-二甲基氨基丙基)碳二亚胺。
使疑似含有目标分析物的试验样品与至少一种捕获抗体接触以后,将试验样品温育以便允许形成捕获抗体-目标分析物复合物。所述温育可以在约4.5至约10.0的ph、在约2℃至约45℃的温度进行,并持续至少约1分钟至约18小时、约2-6分钟或约3-4分钟的时间段。
形成捕获抗体(多个抗体)-目标分析物复合物以后,然后使所述复合物与至少一种检测抗体接触(在允许形成捕获抗体(多个抗体)-目标分析物-检测抗体(多个抗体)复合物的条件下)。如果使捕获抗体-目标分析物复合物与超过一种检测抗体接触,那么形成捕获抗体(多个抗体)-目标分析物-检测抗体(多个抗体)检测复合物。与捕获抗体一样,当使至少一种检测(和随后)抗体与捕获抗体-目标分析物复合物接触时,捕获抗体(多个抗体)-目标分析物-检测抗体(多个抗体)复合物的形成需要在与上述那些类似的条件下的温育时间段。优选地,至少一种检测抗体含有可检测标记(例如,荧光标记,通过可切割的接头连接的标签等)。在形成捕获抗体(多个抗体)-目标分析物-检测抗体(多个抗体)复合物之前、同时或之后,可检测标记可以结合至少一种检测抗体。可以使用本领域中已知的任何可检测标记,例如,荧光标记,如本文所讨论的可切割的接头,和本领域中已知的其它。
为了形成测定混合物而加入试验样品和特异性结合配偶体的次序不是关键性的。如果第一特异性结合配偶体被可检测地标记(例如,荧光标记,与可切割的接头连接的标签等),那么形成可检测地标记的第一特异性结合配偶体-目标分析物复合物。可替换地,如果使用第二特异性结合配偶体且所述第二特异性结合配偶体被可检测地标记(例如,荧光标记,与可切割的接头连接的标签等),那么形成可检测地标记的第一特异性结合配偶体-目标分析物-第二特异性结合配偶体的复合物。使用本领域已知的任何技术,诸如洗涤,可以从混合物除去任何未结合的特异性结合配偶体,无论是标记的还是未标记的。
接着,产生信号,其指示目标分析物或其片段的存在。基于产生的信号的参数,可以定量样品中目标分析物的量。任选地,通过质谱法、比重测定方法和本领域已知的其它技术,可以使用已知浓度的目标分析物的系列稀释物或溶液产生标准曲线。
本文中提供了用于测量或检测存在于生物样品中的目标分析物的方法。在这样的方法中,可以将含有目标靶分析物的样品微滴与含有珠子(诸如磁珠)的微滴合并,在所述珠子上连接第一特异性结合配偶体,其特异性地结合存在于所述样品中的目标靶分析物。合并建立单个微滴,可以将其温育足以允许第一特异性结合配偶体结合存在于样品微滴中的目标分析物的时间。任选地,可以搅拌所述单个微滴以促进所述样品与第一特异性结合配偶体的混合。混合可以如下实现:使单个微滴前后移动,使单个微滴在多个电极上面回转移动,分割微滴并然后合并所述微滴,或使用saw等。接着,可以使单个微滴经受磁力以将珠子保留在装置中的一个位置,同时所述微滴可以移动离开到达废物隔室或垫并被含有第二结合成员的微滴替代。所述第二特异性结合配偶体可以是可检测地标记。所述标记可以是可光学地检测的任意标记。例如,所述标记可以是荧光标记。在加入第二结合成员之前,通过将洗涤缓冲液的微滴移动至使用所述力(例如,磁力)将珠子保留在的位置,可以执行一个任选的洗涤步骤。可以或不可以将所述珠子再悬浮于洗涤缓冲液中。如果使用磁珠,可以将磁力施加于所述磁珠并将洗涤缓冲液运输至废物位置。足够第二特异性结合配偶体结合与第一结合成员结合的目标分析物的时间段以后,可以将含有第二特异性结合配偶体的微滴移动开,同时将珠子保留在所述位置。可以使用洗涤缓冲液的微滴洗涤所述珠子。洗涤步骤以后,可以将含有经标记的珠子的微滴移动前进至检测模块(诸如,如果使用磁珠的话,通过除去磁力),所述珠子具有第一结合成员、目标分析物和第二结合配偶体的复合物。如本文中解释的,所述免疫测定可以在样品制备模块中完成。可以允许经标记的珠子沉降进检测模块的孔阵列中。使用重力或通过施加电或磁力可以沉降珠子。用于除去没有位于孔内的任何珠子的洗涤步骤以后,可以使用疏水液体密封孔。
正向竞争性抑制
在正向竞争形式中,使用已知浓度的经标记的目标分析物(例如,具有荧光标记、与可切割的接头连接的标签等的分析物)的等分试样与试验样品中的目标分析物竞争对目标分析物抗体的结合。
在正向竞争测定中,可以使固定化的特异性结合配偶体(诸如抗体)依次或同时与试验样品和经标记的目标分析物、其目标分析物片段或目标分析物变体接触。目标分析物肽、目标分析物片段或目标分析物变体可以用任何可检测标记进行标记,包括包含与可切割的接头连接的标签的可检测标记。在该测定中,所述抗体可以固定化在固体支持物上。可替换地,所述抗体可以连接到已经固定化在固体支持物(诸如微粒或平面基底)上的抗体,诸如抗物种抗体。
本文中提供了用于测量或检测存在于生物样品中的目标分析物的方法。在这样的方法中,可以将含有目标靶分析物的样品微滴与含有磁珠和用可检测标记(诸如荧光标记)标记的分析物的微滴合并,在所述磁珠上连接第一特异性结合配偶体,其特异性地结合存在于所述样品中的目标靶分析物。任选地,可以搅拌所述单个微滴以促进所述样品与第一特异性结合配偶体和经标记的分析物的混合。混合可以如下实现:使单个微滴前后移动,使单个微滴在多个电极上面回转移动,分割微滴并然后合并所述微滴,或使用saw等。接着,可以使单个微滴经受力(诸如磁力)以将珠子保留在装置中的一个位置,同时所述微滴可以移动离开到达废物隔室或垫并被含有第二结合成员的微滴替代。通过将洗涤缓冲液的微滴移动至使用磁力将珠子保留在的位置,可以执行一个任选的洗涤步骤。可以或不可以将所述珠子再悬浮于洗涤缓冲液中;将力施加于珠子(诸如,如果使用磁珠,磁力)并将洗涤缓冲液运输至废物位置。足够第一特异性结合配偶体结合目标分析物的时间段以后,可以将微滴移动开,同时将珠子保留在所述位置。任选的洗涤步骤以后,可以将含有经标记的珠子(其具有第一结合成员和目标分析物的复合物)的微滴移动前进至检测模块(诸如,如果使用磁珠的话,通过除去磁力)。如本文中解释的,所述免疫测定可以在样品制备模块中完成。可以允许经标记的珠子沉降进检测模块的孔阵列中。使用重力或通过施加力(例如,电或磁力)可以沉降珠子。用于除去没有位于孔内的任何珠子的洗涤步骤以后,可以使用疏水液体密封孔。
在与上面关于夹心测定形式描述的那些类似的条件下温育经标记的目标分析物、试验样品和抗体。然后可以产生两种不同的抗体-目标分析物复合物。具体地,产生的抗体-目标分析物复合物之一含有可检测标记(例如,荧光标记等),而其它抗体-目标分析物复合物不含有可检测标记。在定量可检测标记之前,所述抗体-目标分析物复合物可以、但是不一定与试验样品的剩余部分分离。不论抗体-目标分析物复合物是否与试验样品的剩余部分分离,然后定量抗体-目标分析物复合物中的可检测标记的量。然后可以确定在试验样品中的目标分析物(诸如膜相关的目标分析物、可溶性的目标分析物、可溶性的目标分析物的片段、目标分析物(膜相关的或可溶性的目标分析物)的变体或其任意组合)的浓度,例如,如上所述。
反向竞争测定
在反向竞争测定中,固定化的目标分析物可以依次或同时接触试验样品和至少一种标记的抗体。
本文中提供了用于测量或检测存在于生物样品中的目标分析物的方法。在这样的方法中,可以将含有目标靶分析物的样品微滴与含有第一特异性结合配偶体和目标分析物所连接的磁珠的微滴合并,所述第一特异性结合配偶体特异性地结合存在于所述样品中的目标靶分析物且用可检测标记(诸如荧光标记、酶标记等)标记。合并建立单个微滴,可以将其温育足以允许第一特异性结合配偶体结合存在于样品微滴中的目标分析物的时间。任选地,可以搅拌所述单个微滴以促进所述样品与第一特异性结合配偶体的混合。混合可以如下实现:使单个微滴前后移动,使单个微滴在多个电极上面回转移动,分割微滴并然后合并所述微滴,或使用saw等。接着,可以使单个微滴经受磁力以将珠子保留在装置中的一个位置,同时所述微滴可以移动离开到达废物隔室或垫并被含有第二结合成员的微滴替代。通过将洗涤缓冲液的微滴移动至使用磁力将珠子保留在的位置,可以执行一个任选的洗涤步骤。可以或不可以将所述珠子再悬浮于洗涤缓冲液中;将磁力施加于所述磁珠并将洗涤缓冲液运输至废物位置。足够第一特异性结合配偶体结合与第一结合成员结合的目标分析物的时间段以后,可以除去磁力,并可以将含有经标记的珠子(其具有第一结合成员、目标分析物的复合物)的微滴移动前进至检测模块。如本文中解释的,所述免疫测定可以在样品制备模块中完成。可以允许经标记的珠子沉降进检测模块的孔阵列中。使用重力或通过施加电或磁力可以沉降珠子。用于除去没有位于孔内的任何珠子的洗涤步骤以后,可以使用疏水液体密封孔。
目标分析物可以结合至固体支持物,诸如上面关于夹心测定形式讨论的固体支持物。
在与上面关于夹心测定形式描述的那些类似的条件下温育固定化的目标分析物、试验样品和至少一种标记的抗体。然后产生两种不同的目标分析物-抗体复合物。具体地,产生的目标分析物-抗体复合物之一被固定化且含有可检测标记(例如,荧光标记等),而其它目标分析物-抗体复合物没有固定化且含有可检测标记。通过本领域已知的技术,诸如洗涤,从固定化的目标分析物-抗体复合物的存在除去未固定化的目标分析物-抗体复合物和试验样品的剩余部分。一旦除去未固定化的目标分析物抗体复合物,然后在切割所述标签以后定量固定化的目标分析物-抗体复合物中的可检测标记的量。然后可以通过如上所述对比可检测标记的量来确定试验样品中的目标分析物的浓度。
一步免疫测定或“飞行中捕获”
在飞行中捕获免疫测定中,用固定化试剂预包被固体基底。将捕获剂、分析物和检测剂一起加入固体基底,继之以在检测前的洗涤步骤。捕获剂可以结合分析物且包含固定化试剂的配体。捕获剂和检测剂可以是抗体或本文描述的或本领域已知的能够捕获或检测的任意其它部分。所述配体可以包含肽标签,且所述固定化试剂可以包含抗-肽标签抗体。可替代地,所述配体和所述固定化试剂可以是能够结合在一起,从而用于飞行中捕获测定的任何试剂对(例如,特异性结合对和其它,诸如本领域已知的)。可以测量超过一种分析物。在一些实施方案中,可以用抗原包被固体基底,且要分析的分析物是抗体。
在某些其它实施方案中,在一步免疫测定或“飞行中捕获”中,使用用固定化试剂(诸如生物素、链霉亲和素等)预包被的固体支持物(诸如微粒)和至少第一特异性结合成员和第二特异性结合成员(其分别作为捕获试剂和检测试剂起作用)。第一特异性结合成员包含固定化试剂的配体(例如,如果在固体支持物上的固定化试剂是链霉亲和素,在第一特异性结合成员上的配体可以是生物素)且也结合目标分析物。第二特异性结合成员包含可检测标记且结合目标分析物。可以将固体支持物和第一和第二特异性结合成员加入试验样品(依次或同时)。在第一特异性结合成员上的配体结合固体支持物上的固定化试剂以形成固体支持物/第一特异性结合成员复合物。存在于样品中的任何目标分析物结合固体支持物/第一特异性结合成员复合物以形成固体支持物/第一特异性结合成员/分析物复合物。第二特异性结合成员结合固体支持物/第一特异性结合成员/分析物复合物,并检测可检测标记。在检测之前可以采用任选的洗涤步骤。在某些实施方案中,在一步测定中,可以测量超过一种分析物。在某些其它实施方案中,可以采用超过两种特异性结合成员。在某些其它实施方案中,可以加入多种可检测标记。在某些其它实施方案中,可以检测多种目标分析物。
飞行中捕获测定的应用可以以本文中描述的和本领域已知的多种形式进行。例如所述形式可以是夹心测定诸如上述,但是可替代地可以是竞争测定,可以采用单个特异性结合成员,或使用其它变体诸如已知的。
组合测定(用ag/ab共包被微粒)
在组合测定中,将固体基底(诸如微粒)用抗原和抗体共包被以分别从样品捕获抗体和抗原。可以将固体支持物用两种或更多种不同抗原共包被以从样品捕获两种或更多种不同抗体。可以将固体支持物用两种或更多种不同抗体共包被以从样品捕获两种或更多种不同抗原。
另外,本文所述的方法可以使用封闭剂阻止测定化合物之间的特异性的或非特异性的结合反应(例如,hama参与)。一旦所述试剂(和任选地,任何对照)被固定化在支持物上,可以在所述支持物上封闭所述试剂的剩余结合位点。可以使用本领域普通技术人员已知的任意合适的封闭剂。例如,可以采用牛血清白蛋白(“bsa”)、酪蛋白在pbs中的磷酸盐缓冲盐水(“pbs”)溶液、tween20™(sigmachemicalcompany,st.louis,mo.)或其它合适的表面活性剂,以及其它封闭剂。
从本公开可见,本文公开的方法和装置(包括变体)可以用于诊断疑似具有疾病、障碍或病症的受试者中的疾病、障碍或病症。例如,所述样品分析可以用于检测疾病标志物,例如,癌症标志物、心脏病症的标志物、毒素、病原体,例如,病毒、细菌或其部分。所述方法和装置也可以用于测量存在于生物样品中的分析物。所述方法和装置还可以用在血液筛查测定中以检测靶分析物。所述血液筛查测定可以用于筛查血液供给。
表面声波装置、系统和方法
本公开提供了与集成的表面声波(saw)样品制备和分析物检测装置有关的系统、装置和方法。
在一个实施例中,所述装置包括样品制备部件,例如,具有表面以允许液体或流体通过声力操纵横过其表面传送的基底。在同一个实施例中,所述装置包括分析物检测部件,其被构造成接收传送的液体和在所述传送的液体上执行分析物检测。
本文中使用的“表面声波(saw)”及其语法等同词通常表示在沿着表面的方向传播声波。“移动表面声波”(tsaw)能够实现表面声波向液体中的耦合。在一些实施例中,所述耦合可以呈表面声波向液体中的穿透或泄漏的形式。在一些实施例中,所述表面声波是raleigh波。表面声波的传播可以通过表面声波穿过液体的流动来执行。表面声波的传播可以以多种不同的方式和通过使用不同的材料进行,包括由换能器(诸如系列或多个电极)产生电势。
可以将电极图案化在平面基底上。在一些实施例中,所述平面基底可以是压电层。在一些实施例中,使用标准的光刻和剥离(liftoff)/湿蚀刻方法可以将所述电极制造在压电层上。电极的结构、电极之间的距离、基底上电极的数目(即,分辨率)可以变化。在一些实施例中,使用互相交叉的(idt)换能器或电极。在一些实施例中,所述样品制备部件可以包括液体。在一些实施例中,可以存在多个层。所述不同层可以具有用于散射表面声波的散射结构的不同布置或构型。结果,由于存在的不同散射结构,横过不同层的液体微滴运动可以不同。
在一些实施例中,当激活单个换能器或电极时,传播saw。在其它实施例中,在基底表面上制造的多个(例如,对)电极可以产生两个朝向彼此传播的移动saw。在一些实施例中,当将射频(rf)范围施加于电极时,激活saw位移。被激活后,电极或换能器发射跨基底表面的电势,其中基底经受机械应力。机械应力的例子是基底表面的连续收缩和扩大。作为基底的这种连续变形的结果,表面声波横过表面传播。
可以根据振幅和频率来测量表面声波。因此,由电极产生的电势的频率和振幅是saw的振幅和频率的原因。
saw的传播可以是在直线方向。在一些实施例中,saw可以横过基底表面的纵向长度传播。在其它实施例中,saw可以横过基底表面的宽度传播。在其它实施例中,saw的传播可以是在非直线方向和运动。因为流体是耗散系统,对通过saw实现的谐波加压的应答可能不一定是谐波。
当tsaw接触液体时,所述液体吸收saw的能量的部分,且可以以纵向波的形式折射它。折射的声能的吸收诱导流体流动或横过基底表面的传送。当表面声波沿着样品制备部件的表面传播时,saw可以与液体发生接触。作为液体与saw相互作用的结果,导致saw被转移进液体中。saw借助于“无接触操纵”来操纵流体,这是指液体通过泄漏或穿透进所述流体中的声波传送至检测部件。由此,存在生物样品或分析物的外部污染的最小化。
在一些实施例中,示例性的驱动流体动作包括泵送、混合、喷射等。所以,沿着样品制备部件的表面传送液体。
在一些实施例中,在激活saw电极之前,可以将液体作为要在样品制备部件的表面上驱动的微滴进行分配。微滴驱动可以用于定位微滴和将微滴分配在样品制备部件上。
在其它实施例中,替代基于液体微滴的微流体,可以使用saw驱动的泵将液体泵送至开放表面上。在一些实施例中,可以穿过封闭通道泵送流体。
所述液体可以是含有或疑似含有任何目标分析物的任何试验样品。本文中使用的“分析物”、“靶分析物”、“目标分析物”表示在本文公开的方法和装置中测量的分析物。液体微滴也可以表示在水溶液中的颗粒或珠子。样品可以包括生物流体样品,例如,血液、血浆、血清、唾液、汗液等。
在一些实施例中,所述液体可以作为单个颗粒进行设置。在其它实施例中,所述液体可以作为一群颗粒(例如,数千个颗粒)进行设置。液体微滴可以随宽范围的长度标尺、大小(nm至mm)、以及形状而变化。
图案化在样品制备平台的表面上的声子结构的存在也可以影响表面声波的传播。这些声子结构可以控制声音声波的传播。例如,声子结构可以控制saw的方向、运动、速度;因而,提供增强的功能性。使用对基底的标准光刻、剥离(liftoff)/湿蚀刻方法、模压/纳米压印光刻和微型机械加工、压力、热和激光修改可以将声子结构制造在基底上以形成这些声子结构。这些声子结构同样可以呈现多种形状和大小。在一些实施例中,所述声子结构可以是在基底内形成格栅的柱、锥体或孔。
表面声波样品制备部件
本文中使用的“样品制备部件”及其语法等同词表示通常平面的表面,液体微滴最初分散在其上面,且可以在这里实现本文所述的免疫测定的步骤。在一些实施例中,所述基底可以由具有高声反射的材料制成。
在一些实施例中,所述样品制备部件包括连接到基底的覆板。在一些实施例中,所述覆板可除去地连接到所述基底。在其它实施例中,所述覆板永久性地连接到所述基底。一些例子包括从基于聚合物的材料或纸材料制备所述基底。基于聚合物的基底可以用疏水涂料处理,或制造可以将疏水层添加在基于聚合物的基底或另一个基底上面,使得所述基底是水性流体不可渗透的。
在一些实施例中,所述样品制备部件还可以包括被包含在覆板上的测定试剂。所述样品制备部件还包括连接到基底的覆板。
在又另一个实施例中,所述样品制备部件可以包括被包含在所述覆板上的一系列散射结构。散射结构的例子可以包括声子结构,其在下面更详细地描述。
在一些实施例中,所述基底可以是压电材料。压电层可以由复合层诸如单晶铌酸锂(linbo3)制成。所述覆板还可以包括系列或多个电极或换能器。在一些实施例中,由电极或idt产生的表面声波也可以连接进所述覆板中。
在一些实施例中,所述覆板可以由多种材料,诸如塑料(例如,pet、pc等)制成。
在一些实施例中,所述覆板可以由具有相对高的电-力耦合系数的材料制成。在一些实施例中,可以将电极制造在压电材料上。在一个实施例中,可以使用linbo3作为基底以将saw微流体应用中的电极图案化。在另一个实施例中,可以使用硅作为基底材料以将电极图案化。适合用于制造产生saw的基底的材料的其它例子包括多晶材料、微晶材料、纳米晶体材料、非晶体材料或复合材料。适合用于制造产生saw的基底的材料的其它例子包括铁电材料、热电材料、压电材料或磁致伸缩材料。
如本文中所述,所述基底是能够产生表面声波和传播声波的材料。
除了要分析的分析物或生物样品以外,样品制备部件还可以包括缓冲液或洗涤流体。在一些实施例中,这些缓冲液或洗涤流体可以促进液体横过样品制备部件和在检测部件上的传送。在其它情况下,可以使用这些流体洗掉任何残余的液体或生物样品(在它们已经被定位在孔阵列中以后)。这样的流体的例子包括空气、惰性气体、疏水液体、亲水液体、油、基于有机物的溶剂和高密度水溶液。在某些情况下,可以给所述装置填充填充流体,所述填充流体可以是空气、惰性气体、疏水液体、亲水液体、油、基于有机物的溶剂和高密度水溶液。
在一些实施例中,通过将小染料或颗粒引入液体微滴中,可以观察到saw诱导的流体运动。
样品制备表面具有这样的表面:在其上面所述液体可以沿着所述表面传送。所述样品制备表面的表面可以是呈平面或非平面构象的任意方便表面。可以用疏水材料涂布所述表面以促进所述液体沿着表面的运动。在一些实施例中,所述疏水材料可以包括十八烷基三氯硅烷(ots)。在其它实施例中,可以将所述表面图案化以促进液体运动。
在一些实施例中,所述样品制备表面的基底可以是弹性的或柔性的。在其上面形成表面的基底可以是弹性的,使得所述表面能够变形,从而促进表面声波横过所述表面的传播。
在某些实施方案中,所述基底的表面可以包括微流体通道以促进传送流体。在其它实施方案中,在所述基底的内部包括微流体通道以将流体传送进所述基底中。
在一些实施例中,可以在样品制备部件的基底的上表面上方提供覆盖密封件。在某些情况下,所述覆盖密封件可以阻止所述表面的液体内容物的污染。在其它情况下,所述覆盖密封件可以是液体不可渗透的层。在其它情况下,所述覆盖密封件可以由柔性材料(诸如塑料、硅或其它类型的橡胶)制成。在其它情况下,所述覆盖密封件可以由非柔性材料(诸如玻璃或其它非柔性材料)制成。在一些实施例中,所述覆盖密封件可以是热、紫外线或其它电磁辐射不可透过的,以阻止表面或存在于所述表面上的液体内容物的变形。
在一些实施例中,合适的隔离物可以定位在所述基底和所述覆盖密封件之间。本文中使用的“合适的隔离物”表示定位在样品制备部件的基底和覆盖密封件之间的元件。在一些实施例中,所述合适的隔离物可以促进液体微滴在所述表面和所述覆盖密封件之间移动。在其它实施例中,所述合适的隔离物可以减少传播中的表面声波和表面之间的耦合。
在第一个实施例样品制备部件中,所述第一基底包含具有相对高的电-力耦合系数并且具有柔性的且可变形的表面的材料。例如,所述第一基底可以是压电材料或硅。
在一些实施例中,将电极布置在表面上或嵌入在压电层内。在该背景下使用的术语“电极”表示电路,包括电极、系列或多个电极(例如,超过一个)、换能器。也可以将电极图案化在压电层中。在一些实施例中,使用标准光刻和剥离(liftoff)/湿蚀刻方法可以将电极制造在基底上。电极的结构、电极之间的距离、基底上电极的数目(即,分辨率)可以变化。在一些实施例中,使用互相交叉的(idt)换能器或电极。idt被定义为系列或多个电极和在其上面包括所述系列或多个电极的压电层的组合。在一些实施例中,在压电层上形成换能器电极结构。在其它实施例中,将换能器电极结构嵌入压电层内。
在一些实施例中,当单个换能器或电极被激活时,传播表面声波。在其它实施例中,在基底表面上制造的多个(例如,对)电极可以产生两个朝向彼此传播的移动表面声波。在一些实施例中,当将射频(rf)范围施加于电极时,激活表面声位移。被激活后,电极或换能器发射跨基底表面的电势,其中基底经受机械应力。机械应力的例子是基底表面的连续收缩和扩大。作为基底的这种连续变形的结果,表面声波横过表面传播。
在一些实施例中,表面声波的波长依赖于换能器(idt)或系列或多个电极的间距。
在一个实施例中,所述样品制备部件可以包括被包含在覆板表面上的一系列声子结构。所述声子结构可以控制声波的传播。例如,所述声子结构可以控制表面声波的方向、运动、速度。所述声子结构还可以呈现多种形状和大小。在一些实施例中,所述声子结构可以是在基底内形成格栅的柱、锥体或孔。基于特征诸如分辨率(例如,表面上单位面积的电极数目)、电极大小、电极的互相交叉和/或电极之间的间隙或间距,可以预定义在覆板的表面上的声子结构的图案。在一些实施例中,基于saw样品制备部件要与其关联的微滴驱动器的一种或多种运转应用(例如,用于与生物测定和/或化学测定一起使用)选择图案的特征。在其它构型中,电极的图案可以是可重构的以使不同的图案能够适应不同的应用。在一些实施例中,所述系列或多个电极或每个单个电极的大小或尺寸的增加也可以减少在相邻电极之间施加的疏水材料的量。因而,电极图案的特征可以使saw平台的表面积最大化。此外,所述系列或多个电极/换能器的增加的互相交叉促进通过操纵它们的电势使液体横过表面传送的容易度。
在第一个实施例样品制备部件中,可以将疏水材料施加于所述系列或多个电极和所述基底的表面以使覆板不可透过水溶液。由于疏水材料,通过微滴或流体泵驱动的液体处于与基底表面的疏水层形成接触角的珠状构型。在运转中,saw声波横过耦合至液体的表面传播,例如通过穿透或泄漏进液体中。saw声波的振幅或频率可以控制移动的液体的得到的频率和运动。
在某些实施方案中,表面声波沿着基底的表面传播,并然后耦合进覆板中。此后,表面声波继续传播并被可以形成在覆板中的声子结构导引。
在一些实施例中,在由两个或更多个电极产生saw声波的情况下,它可以导致控制与得到的表面声波耦合的液体的方向。传送的液体的方向可以是在直线方向或非直线方向。在一些实施例中,所述液体微滴的传送可以是在滚动运动中。在其它实施例中,液体微滴的传送可以是在横过所述表面的滑动运动中。在一些实施例中,在表面上缺乏声子结构的情况下,saw的传播和得到的液体微滴的传送是在同一个方向。在其它实施例中,在表面上存在声子结构的情况下,saw的传播和得到的液体微滴的传送是在相反方向或不同方向。
在一些实施例中,所述疏水材料是施加于覆板表面的聚四氟乙烯材料(例如,teflon®)或氟表面活性剂(例如,fluoropel™)。
分析物检测部件
在一些实施方案中,所述分析物检测部件可以包括孔阵列,在其中可以为了分析物或生物样品检测目的而分离分子、颗粒、珠子或细胞。tsaw(移动表面声波)产生在表面上横过流体通道的声冲流以将流体(微滴或细胞)推向孔阵列。
所述孔的形状和几何构造可以随需要的操作类型或应用而变化。在一些实施例中,所述孔可以在深隔室至浅隔室之间变化。所述孔可以是多种形状中的任一种,例如,具有平底表面的圆柱形、具有圆底表面的圆柱形、立方体、骰状、截头圆锥形、倒置截头圆锥形、或圆锥形。在某些情况下,所述孔可以包括侧壁,所述侧壁可以定向成促进存在于已经在孔阵列上面移动的液体微滴中的微珠或微粒的接收和保留。在一些实施例中,所述孔可以包括第一侧壁和第二侧壁,其中所述第一侧壁可以在所述第二侧壁对面。在一些实施例中,所述第一侧壁相对于所述孔的底以钝角定向,且所述第二侧壁相对于所述孔的底以锐角定向。微滴的运动可以是在与所述孔的底平行的方向且从所述第一侧壁至所述第二侧壁。所述孔阵列可以具有亚飞升体积、飞升体积、亚纳升体积、纳升体积、亚微升体积或微升体积。例如,所述孔阵列可以是飞升孔阵列、纳升孔阵列或微升孔阵列。在某些实施方案中,阵列中的孔可以都具有基本上相同的体积。所述孔阵列可以具有至多100µl的体积,例如,约0.1飞升、1飞升、10飞升、25飞升、50飞升、100飞升、0.5pl、1pl、10pl、25pl、50pl、100pl、0.1nl、1nl、10nl、25nl、50nl、500nl、0.1微升、1微升、10微升、25微升、50微升或100微升。
在某些情况下,使用例如连续卷筒纸(web-fed)制造工艺,可以从单个平面表面制造样品制备部件和分析物检测部件。在这样的一个实施例中,样品制备部件和数字分析物检测部件可以与彼此邻接地定位。
在一些实施例中,所述样品制备部件可以包括样品入口。本文中使用的“样品入口”表示用于将液体引导至样品制备部件的管状构件、通道或导管。例如,所述样品入口可以将生物样品引导至基底的表面上。在其它实施例中,所述样品入口可以将生物样品引导至基底内部。
在其它实施例中,所述样品制备部件和所述数字分析物检测部件可以以堆叠构型定位在彼此上面,被用于微滴操作的空间隔开。在所述样品制备部件以堆叠构型定位在所述分析物检测部件上面或反之亦然(所述分析物检测部件定位在所述样品制备部件上面)的实施例中,入口或通道可以定位在所述两个部件之间。入口或通道可以将样品或分析物引导至所述两个部件之间。
可以将声子结构制造或包括在样品制备部件的覆板上。在某些情况下,将声子结构压印或模压在覆板上。在这样的实施例中,声子结构的模压或压印是在单个步骤中。在其它实施例中,它可以是多个步骤。声子结构的压印或模压可以是通过在有模具、掩膜版或图案存在下压力、热或紫外线的施用的组合。在一个实施例中,从模具在覆板上引起的压力可以诱导覆板的表面的变形。
将声子结构包括在覆板上以后,可以使它固化足够的时间段以允许声子结构的硬化或变形。另外,可以使声子结构经受改变所述声子结构的物理性能的试剂的处理。
在一些实施例中,在制造集成的样品制备和分析物检测装置过程中,可以以脱水形式印刷用于分析物检测的试剂。通过样品或缓冲液的应用,而发生所述试剂的再水合。
在一些实施例中,所述孔阵列包括各个孔隔室,每个孔隔室具有第一末端和第二末端。在一个实施例中,所述孔的第一末端可以是开放的,而所述孔的第二末端是封闭的。在其它实施例中,所述孔的第一末端和孔隔室的第二末端都是封闭的。所述孔隔室的第一末端的封闭可以是通过永久性封闭机构和暂时性封闭机构。本文中使用的“永久性”是指,所述封闭机构意图保持为所述孔的隔室的固定物。本文中使用的“暂时性”是指,所述封闭机构可以被除去,而不影响所述封闭机构的结构、完整性或刚度。在某些方面,孔隔室第一末端的封闭可以是通过永久性封闭机构和暂时性封闭机构的组合。在一个实施例中,所述暂时性封闭机构可以是液体,诸如油流体,其可以填充孔隔室的第一末端。在一些实施例中,在以前已经将分析物、生物样品或分析物有关的可检测标记沉积在孔中以后,所述油滴可以填充第一个孔末端。在其它实施例中,所述油滴可以是所述孔的第一末端的封闭,无论分析物或生物样品在所述孔内的存在。
所述孔阵列具有适合用于接收多个标记、珠子、经标记的珠子、标签等的孔隔室图案(例如,所述阵列中的孔的形成)。所述孔阵列的图案可以随分辨率和孔隔室之间的间距而变化。
在一些实施例中,可以使用纳米压印光刻制造所述孔阵列的图案。在其它实施例中,通过模塑、压力、热或激光中的任一种的组合可以制造所述孔阵列的图案。
孔阵列的大小可以变化。在一些实施例中,可以将所述孔阵列制造成具有100nm直径且具有500nm的周期(periodicity)的各个孔隔室。
在一些实施例中,所述孔阵列可以基本上如在关于数字微流体和检测模块的部分中所述。
在一些实施例中,目标分析物或生物样品的检测可以通过光学信号检测而发生。例如,照射激发光(例如,激光)以便测量信号强度结果。在其它实施例中,通过测量从每个孔隔室发出的光学信号可以检测所需分析物,并通过量化所述结果来定量。例如,将阳性计数(例如,孔)的数目与阴性计数(例如,孔)的数目进行对比以得到数字计数。可替代地或另外,可以测量与分析物浓度相关的信号(模拟定量)。可以检测来自装置的孔的多种信号。示例性的信号包括荧光、化学发光、比色测量、浊度测量等。
样品制备和分析物检测装置的邻近构型
在一些实施方案中,所述孔阵列与样品制备部件定位在相同覆板上。在一些实施例中,所述覆板和所述孔阵列可以定位在第一基底上。所述第一基底可以分成第一部分和第二部分,在所述第一部分处最初设置要分析的微滴,向所述第二部分移动所述微滴用于分析物检测。所述覆板可以存在于所述第一基底的第一部分上,且所述孔阵列可以定位在所述第一基底的第二部分上。这样,形成样品制备部件的覆板和形成分析物检测部件的孔阵列可以直接邻近。本文中使用的术语“直接邻近”表示不存在分离或分开样品制备部件和孔阵列的物体。在其中样品制备部件和孔阵列彼此直接邻近的实施例中,横过样品制备部件的表面的液体微滴的传送无缝地转移到孔阵列的表面上。在其它实施例中,所述孔阵列定位成间接地邻近所述样品制备部件。本文中使用的术语“间接地邻近”表示存在分离或分开样品制备部件的物体或元件。
在一些实施例中,为了促进液体运动和提高微滴在各个孔隔室中的位置准确度,可以将样品制备部件的基底表面图案的或用亲水材料涂布。在其它实施例中,可以使用试剂诸如油和乳剂来密封孔阵列。
图13a图示说明了定位成邻近分析物检测部件的样品制备部件的侧视图。如在图13a中所示,所述样品制备部件包括覆板810。覆板810包括一系列声子结构830。所述声子结构的大小、形状和尺寸可以变化。如在图13a中所示,所述样品制备部件定位成直接邻近包含孔阵列860的分析物检测部件。在这些部件定位成彼此邻近的情况下,可以将横过覆板810的表面传送的液体收集进孔阵列860上的各个孔隔室中。在该特定实施例中,样品输入通道840定位在覆板810和盖子870之间。覆板810和盖子870被空间/间隙850隔开,所述空间/间隙850限定在其中操作(例如,合并、分割、搅拌等)液体微滴的空间。但是,在其它实施例中,不包括样品输入通道。所述样品输入通道的大小、尺寸和变体可以变化。例如,所述样品输入通道可以将流体引导至覆板810的表面上。在其它实施例中,所述样品输入通道可以将流体引导至覆板810的内部。
在一些实施例中,可以将覆盖密封件提供在样品制备部件的表面上方。在某些情况下,所述覆盖密封件可以阻止所述表面的液体内容物的污染。在其它情况下,所述覆盖密封件是液体不可渗透的层。在其它情况下,所述覆盖密封件由柔性材料(诸如塑料、硅或其它类型的橡胶)制成。在其它情况下,所述覆盖密封件由非柔性材料(诸如玻璃或其它非柔性材料)制成。在一些实施例中,所述覆盖密封件可以是热、紫外线或其它电磁辐射不可透过的,以阻止表面或存在于所述样品制备部件的表面上的液体内容物的变形。
在一些实施例中,可以提供散热件以便消散由横过基底表面的表面声波的产生所引起的热。
样品制备和分析物检测装置的堆叠构型
在一些实施方案中,所述孔阵列(检测部件)定位在被空间隔开的所述样品制备部件上面,在所述空间中操纵微滴。在一些实施例中,入口或通道可以定位在所述两个部件之间。所述入口或通道可以将样品或分析物引导至所述两个部件之间。
在一些实施例中,所述孔阵列可以压印或模压在第一基底上,且所述声子结构可以存在于覆板上,所述覆板以与所述第一基底隔开的方式定位。所述覆板可以由第二基底支持。
在一些实施例中,通过使用粘合剂、胶粘剂、带、胶、焊接剂或能够将孔阵列连接至覆板的其它附连剂,可以促进将包括孔阵列的第一基底与覆板连接的步骤。在其它实施例中,将孔阵列连接到样品制备部件的声子结构上的步骤可以通过使用机械紧固件、固定器、螺栓和其它机械部件诸如掣子来实现。在其它实施例中,将孔阵列连接到样品制备部件的声子结构上的步骤可以通过将孔阵列设置和定位在样品制备部件的声子结构上而发生。在一些实施例中,基底的声子结构可以呈与孔阵列部件平行的取向。
覆板的声子结构和孔阵列之间的间距可以随要执行的应用的类型、在基底的表面上驱动的液体微滴的大小、声子结构的大小、形状和布置、样品通道/入口的大小、和横过表面传播的表面声波的振幅而变化。
图13b图示说明了覆板和孔阵列部件的堆叠构型的侧视图。如在图13b中所示,覆板810包括一系列声子结构830。声子结构830布置成重复结构元件的阵列。声子结构的大小、形状和尺寸可以变化。在该实施例中,孔阵列860也存在。在该实施例中,孔阵列860直接定位在覆板上面。如在图13b中所示,所述孔的开口可以与声子结构直接相对。在该特定实施例中,样品输入通道840定位在孔阵列和覆板之间。但是,在其它实施例中,没有包括样品输入通道。样品输入通道的大小、尺寸和变体可以变化。例如,样品输入通道可以将流体引导至覆板810的表面上。在其它实施例中,样品输入通道可以将流体引导至覆板810的内部。包括孔阵列860的基底820以与覆板810隔开的方式定位,且与覆板810被间隙/空间850隔离。
如在图13a-b中所示的孔阵列可以在大小和/或形状方面变化。例如,所述孔阵列可以是基本上浅的或深的。孔阵列的分辨率受每个孔隔室之间的间距影响。例如,孔隔室之间的微小间距允许较大数目的孔以收集较大数目的分析物或生物样品。在一些实施例中,可以通过消融基底来形成孔阵列。通过使用专门图案或专门掩膜版并对所述掩膜版进行激光消融,可以形成孔阵列的图案。
制造表面声波样品制备和检测装置
图14a-14b图示说明了用于单独制造在前述部分中公开的saw装置的示例性方法。图14a图示说明了通过在单个基础基底上制造声子结构和孔阵列使样品制备部件和孔阵列部件定位成彼此邻近。将覆板(例如,参见图13a,覆板810)放在组装线900上。利用一系列辊子的传送带样机构促进覆板沿着组装线900的传送。覆板的辊914被解缠绕(unspooled)并经受模压单元910,后者使所述材料经受强烈的热、压力或紫外线以便使用模具在覆板上形成声子结构或在覆板内嵌入声子结构。使用激光消融924建立孔阵列。此后,所述覆板穿过多个辊子到达表面处理部件920,其修改所述覆板的性能。此后,所述覆板穿过喷墨印刷机930,其将测定试剂沉积在所述覆板上。在一些实施例中,可以对得到的结构进行固化步骤。在其它实施例中,可以对得到的结构进行表面处理以修改它们的物理性能,例如,掺入测定方案所需的官能化试剂。然后将盖子(例如,图13a,盖子870)层压940在覆板上。所述盖子可以随着使用辊子将辊905解缠绕和移动而提供。在将盖子放在覆板上之前,将合适的隔离物放在覆板和盖子之间以使液体微滴能够在两个表面之间移动。可以将组装的结构切块950以产生单个的装置。
图14b图示说明了用于制造在图13b中描绘的装置的一种示例性方法。使用模压单元910对覆板(例如,参见图13b,覆板810)的辊914进行制造过程,所述模压单元910使所述覆板经受强烈的热、压力或紫外线以便在有模具存在下形成声子结构的重复结构元件。此后,所述覆板穿过表面处理部件920以修改覆板表面的性能。此后,所述覆板穿过喷墨印刷机930,以原位沉积测定试剂。为了形成包含孔阵列的检测模块,对第一基底(例如,参见图13b,基底820)的辊906进行激光消融924。在层压单元940处,将覆板和含有孔阵列的第一基底组合在一起并随后以隔开构型粘结。所以,覆板和基底在堆叠构型内垂直地对齐。此后,使堆叠的基底经受切块部件950,例如,以产生单个的装置。
本文所述的传送微滴驱动的装置和系统和方法还可以包括多种影响微滴驱动的其它力。例如,横过表面的微滴运动可以包括电场介导的力、静电驱动(诸如电驱动)、电润湿、介电电泳、电场梯度或电极介导的力。在其中将表面声波和数字微阵列电极的组合用于微滴操作的实施方案中,本文所述的saw装置可以包括系列或多个电极。
本文公开的集成装置可以用于制备多种用于检测目标分析物的样品,诸如生物样品。在某些情况下,所述装置可以用于实现数字免疫测定和检测与分析物的存在或不存在相关的颗粒/珠子的存在或不存在。
试剂盒和筒
本文中还提供了用或不用公开的装置执行上述方法的试剂盒。所述试剂盒可以包括关于用公开的装置分析分析物的说明书。在试剂盒中包括的说明书可以附连到包装材料,或可以作为包装插页来包含。所述说明书可以是书写的或印刷的材料,但不限于此。本公开预见到能够存储这样的说明书并将它们传递给最终使用者的任何介质。这样的介质包括但不限于电子存储介质(例如,磁盘、磁带、偏码键筒、芯片)、光学介质(例如,cdrom)等。本文中使用的“说明书”可以包括提供所述说明书的因特网站点的地址。
所述试剂盒可以包括筒,所述筒包括具有嵌入式分析物检测的微流体模块,如上所述。在一些实施方案中,微流体和分析物检测可以是用于可逆地集成在一起的单独部件,或可以完全地或不可逆地集成在筒中。所述筒可以是一次用弃的。所述筒可以包括一种或多种可用于实践上面公开的方法的试剂。所述筒可以包括一个或多个容器,所述容器容纳所述试剂作为一种或多种单独的组合物,或者任选地,在试剂的相容性将允许的情况下,作为混合物。所述筒还可以包括从用户观点看可能希望的其它材料,诸如缓冲液、稀释剂、标准品(例如,校准物和对照)和/或可用于样品处理、洗涤或进行测定的任意其它步骤的任意其它材料。所述筒可以包括上述的特异性结合成员中的一种或多种。
可替换地或额外地,所述试剂盒可以包含校准物或对照,例如,经纯化的和任选地低压冻干的目标分析物,或呈在筒上或单独的液体、凝胶或其它形式,和/或至少一个用于与上述装置和方法一起使用的容器(例如,试管、微孔滴定板或条带),和/或缓冲液,诸如测定缓冲液或洗涤缓冲液,其中任一种可以提供为浓缩的溶液。在一些实施方案中,所述试剂盒包含执行测定必需的所有组分,即试剂、标准物、缓冲液、稀释剂等。所述说明书还可以包括关于制作标准曲线的说明书。
所述试剂盒还可以包含用于定量目标分析物的参比标准。所述参比标准可以用于建立标准曲线以插入和/或外推目标分析物浓度。所述试剂盒可以包括在浓度水平方面变化的参比标准。例如,所述试剂盒可以包括具有高浓度水平、中浓度水平或低浓度水平的一种或多种参比标准。关于参比标准的浓度范围,这可以根据测定进行优化。参比标准的示例性浓度范围包括但不限于,例如:约10fg/ml、约20fg/ml、约50fg/ml、约75fg/ml、约100fg/ml、约150fg/ml、约200fg/ml、约250fg/ml、约500fg/ml、约750fg/ml、约1000fg/ml、约10pg/ml、约20pg/ml、约50pg/ml、约75pg/ml、约100pg/ml、约150pg/ml、约200pg/ml、约250pg/ml、约500pg/ml、约750pg/ml、约1ng/ml、约5ng/ml、约10ng/ml、约12.5ng/ml、约15ng/ml、约20ng/ml、约25ng/ml、约40ng/ml、约45ng/ml、约50ng/ml、约55ng/ml、约60ng/ml、约75ng/ml、约80ng/ml、约85ng/ml、约90ng/ml、约95ng/ml、约100ng/ml、约125ng/ml、约150ng/ml、约165ng/ml、约175ng/ml、约200ng/ml、约225ng/ml、约250ng/ml、约275ng/ml、约300ng/ml、约400ng/ml、约425ng/ml、约450ng/ml、约465ng/ml、约475ng/ml、约500ng/ml、约525ng/ml、约550ng/ml、约575ng/ml、约600ng/ml、约700ng/ml、约725ng/ml、约750ng/ml、约765ng/ml、约775ng/ml、约800ng/ml、约825ng/ml、约850ng/ml、约875ng/ml、约900ng/ml、约925ng/ml、约950ng/ml、约975ng/ml、约1000ng/ml、约2µg/ml、约3µg/ml、约4µg/ml、约5µg/ml、约6µg/ml、约7µg/ml、约8µg/ml、约9µg/ml、约10µg/ml、约20µg/ml、约30µg/ml、约40µg/ml、约50µg/ml、约60µg/ml、约70µg/ml、约80µg/ml、约90µg/ml、约100µg/ml、约200µg/ml、约300µg/ml、约400µg/ml、约500µg/ml、约600µg/ml、约700µg/ml、约800µg/ml、约900µg/ml、约1000µg/ml、约2000µg/ml、约3000µg/ml、约4000µg/ml、约5000µg/ml、约6000µg/ml、约7000µg/ml、约8000µg/ml、约9000µg/ml或约10000µg/ml。
在试剂盒中提供的任何特异性结合成员可以包含标记,诸如荧光团、酶、树枝状聚合物、珠子、纳米颗粒、纳米珠子、微粒、微珠、聚合物、蛋白、生物素/抗生物素蛋白标记等,或所述试剂盒可以包括用于标记特异性结合成员的试剂、或用于检测特异性结合成员和/或用于标记分析物的试剂、或用于检测分析物的试剂。如果需要的话,所述试剂盒可以含有一种或多种不同标签或标记。所述试剂盒还可以包括引起切割的组分,诸如介导切割的试剂。例如,介导切割的试剂可以包括还原剂,诸如二硫苏糖醇(dtt)或三(2-羧基乙基)膦(tcep)。特异性结合成员、校准物和/或对照可以提供在单独容器中或预分配在适当的测定形式或筒中。
所述试剂盒可以包括一种或多种特异性结合成员,例如,以在多路复用测定中检测样品中的一种或多种靶分析物。所述试剂盒中不同类型的特异性结合成员的数目可以随所述试剂盒的预期用途宽泛地变化。所述试剂盒中特异性结合成员的数目可以在1种至约10种的范围内或更高。例如,所述试剂盒可以包括1-10种特异性结合成员、1-9种特异性结合成员、1-8种特异性结合成员、1-7种特异性结合成员、1-6种特异性结合成员、1-5种特异性结合成员、1-4种特异性结合成员、1-3种特异性结合成员、1-2种特异性结合成员、2-10种特异性结合成员、2-9种特异性结合成员、2-8种特异性结合成员、2-7种特异性结合成员、2-6种特异性结合成员、2-5种特异性结合成员、2-4种特异性结合成员、3-10种特异性结合成员、3-9种特异性结合成员、3-8种特异性结合成员、3-7种特异性结合成员、3-6种特异性结合成员、3-5种特异性结合成员、3-4种特异性结合成员、4-10种特异性结合成员、4-9种特异性结合成员、4-8种特异性结合成员、4-7种特异性结合成员、4-6种特异性结合成员、5-10种特异性结合成员、5-9种特异性结合成员、5-8种特异性结合成员、5-7种特异性结合成员、5-6种特异性结合成员、6-10种特异性结合成员、6-9种特异性结合成员、6-8种特异性结合成员、6-7种特异性结合成员、7-10种特异性结合成员、7-9种特异性结合成员、7-8种特异性结合成员、8-10种特异性结合成员、8-9种特异性结合成员或9-10种特异性结合成员。所述一种或多种特异性结合成员中的每一种可以结合不同的靶分析物,且每种特异性结合成员可以用不同的可检测标记进行标记。例如,所述试剂盒可以包括:结合第一靶分析物的第一特异性结合成员、结合第二靶分析物的第二特异性结合成员、结合第三靶分析物的第三特异性结合成员等,且所述第一特异性结合成员用第一可检测标记进行标记,所述第二特异性结合成员用第二可检测标记进行标记,所述第三特异性结合成员用第三可检测标记进行标记等。除了一种或多种特异性结合成员以外,所述试剂盒还可以包含一种或多种另外的测定组分,诸如合适的缓冲介质等。最后,所述试剂盒可以包含关于在根据主题发明的分析物检测方法中使用特异性结合成员的说明书,其中关于使用的这些说明书可以存在于试剂盒包装上和/或包装插页上。
任选地,所述试剂盒包括质量控制组分(例如,灵敏度对象组、校准物和阳性对照)。质量控制试剂的制备是本领域众所周知的,且描述在多种免疫诊断产品的插页上。灵敏度对象组成员任选地用于确立测定性能特征,且进一步任选地是试剂盒试剂的完整性和测定的标准化的有用指示剂。
所述试剂盒还可以任选地包括进行诊断测定或便利质量控制评价所需的其它试剂,诸如缓冲液、盐、酶、酶辅因子、底物、检测试剂等。用于分离和/或处理试验样品的其它组分(诸如缓冲液和溶液)(例如,预处理试剂)也可以包括在试剂盒中。所述试剂盒可以另外包括一种或多种其它对照物。试剂盒的一种或多种组分可以被低压冻干,在该情况下,试剂盒可以进一步包含适合用于重构低压冻干的组分的试剂。所述组分中的一种或多种可以呈液体形式。
所述试剂盒的各种组分任选地在必要时提供在合适的容器中。所述试剂盒还可以包括用于容纳或储存样品的容器(例如,用于尿、唾液、血浆、脑脊液或血清样品的容器或筒,或用于储存、运输或处理组织,从而建立组织抽吸物的适当容器)。在适当的情况下,试剂盒任选地也可以含有反应容器、混合容器和促进试剂或试验样品的制备的其它组分。所述试剂盒还可以包括一个或多个用于辅助获得试验样品的样品收集/获取器械,诸如各种血液收集/转移装置诸如微取样装置、微针或其它最小侵袭性的无痛血液收集方法;血液收集试管;刺血针;毛细管血液收集试管;其它刺破单个指尖的血液收集方法;口腔拭子,鼻/喉拭子;16-号或其它尺寸的针,用于冲孔活组织检查的环形刀片(例如,1-8mm或其它适当的尺寸),外科手术刀或激光(例如,特别是手持式),注射器,无菌容器,或插管,其用于得到、储存或抽吸组织样品;等。所述试剂盒可以包括一个或多个用于辅助关节抽吸、锥形活组织检查、冲孔活组织检查、细针抽吸活组织检查、图像引导的经皮针吸活组织检查、支气管肺泡灌洗、内窥镜活组织检查和腹腔镜活组织检查的器械。
如果所述标签或可检测标记是或包括至少一种吖啶鎓化合物,所述试剂盒可以包含至少一种吖啶鎓-9-甲酰胺、至少一种吖啶鎓-9-甲酸芳基酯或它们的任意组合。如果所述标签或可检测标记是或包括至少一种吖啶鎓化合物,所述试剂盒还可以包含过氧化氢的来源,诸如缓冲液、溶液和/或至少一种碱性溶液。如果需要的话,所述试剂盒可以含有固相,诸如磁性颗粒、珠子、膜、支架分子、薄膜、滤纸、圆盘或芯片。
如果需要的话,所述试剂盒可以进一步包含一种或多种组分,所述组分是单独的或与说明书进一步组合,所述组分用于针对另一种分析物测定试验样品,所述另一种分析物可以是生物标志物,诸如疾病状态或障碍(诸如传染性疾病、心脏疾病、代谢疾病、甲状腺疾病等)的生物标志物。
本发明具有由下述非限制性实施例例示说明的多个方面。
实施例
实施例1:低成本dmf芯片的制造
使用与用于电极图案形成(electrodepatterning)的湿剥离过程(wetlift-offprocess)组合的卷对卷(roll-to-roll,r2r)柔性版印刷制造低成本柔性dmf芯片。在图18中描绘了制造过程的示意图。将一卷的melinexst506聚对苯二甲酸乙二醇酯(pet)5.0mil基底(1)用作用于dmf电极印刷的起始原料。在anilox辊子组件上,使用3.8ml/m2的油墨转移体积,使用1.14mm厚的印刷版(flintmco3),以10m/分钟的速率,将一层黄色油墨(sunchemical)柔性印刷(2)在pet基底上。dmf电极图案的负像源自柔性印刷步骤(3)。在金属沉积之前,将油墨在热空气烤箱中干燥2次(2x100℃)。使用evar2r金属蒸发器将银金属层沉积在印刷的pet基底上以形成80nm厚度的均匀银涂层(4)。在超声处理浴中,使用丙酮+超声的组合,在1m/分钟的速度对金属化的油墨-薄膜基底(5)进行湿剥离过程(6)。该化学/物理处理允许银-油墨层溶解,同时保持仅银层完整。油墨-银层的除去产生dmf印刷的电极图案,其由80个驱动电极(2.25x2.25mm)组成,具有50或140
通过使用旋转丝网印刷或凹版印刷,将电介质涂料施加于电极和蓄池。对于旋转丝网印刷,使用henkeledacpf-455b作为电介质涂料,在2m/分钟的印刷速度和50%的紫外固化率,通过用gallusnf(400l)丝网印刷。典型电介质厚度是10-15
可替换地,对于小批量的单个芯片,可以分别使用化学气相沉积(cvd)和自旋涂布施加电介质和疏水涂料。
实施例2:低成本dmf芯片的功能试验
对如在上面实施例1中所述制造的3”x2”基于pet的dmf底芯片进行驱动能力测试。图20描绘了3”x2”基于pet的dmf芯片(1),在其上面定位0.7mm厚的玻璃基底(3)。所述玻璃基底(3)包括在所述玻璃基底的下表面上的透明氧化铟锡(ito)电极和在所述ito电极上面的特氟隆涂层。所述dmf芯片包括80个具有直边电极设计的银驱动电极和在电极之间的50μm间隙,以及8个缓冲液蓄池(参见上面实施例1)。
分别通过cvd和自旋涂布,使用电介质parylene-c层(6-7μm厚)和特氟隆的最终涂层(50nm厚)涂布底电极。将大约50μl含有0.1%表面活性剂的pbs缓冲液(2)移入底dmf芯片上的四个邻近蓄池中。微滴大小范围为700-1,500nl(一个或两个微滴),并且除了混合必需的圆形扫描模式以外,针对垂直和水平横向运动进行检查(4)。使用90vrms的电压实现微滴驱动。测试了所述芯片上大约90%的驱动电极,并发现是功能完好的。
实施例3:在低成本dmf芯片上的tsh免疫测定
使用化学发光检测,针对它的进行促甲状腺激素(tsh)免疫测定的能力,测试了如在上面实施例2中所述的用玻璃基底覆盖的3’x2”基于pet的dmf芯片。假样品包括掺入含有封闭剂和表面活性剂的tbs缓冲液中的tsh校准材料。试验了3个样品——0、4、40μiu/ml。将2μl包被在5μm磁性微粒(3x108个颗粒/ml)上的抗-βtsh捕获抗体从微粒蓄池分配进dmf电极阵列的中央。通过在dmf芯片下结合钕磁体条(图21a)(3英寸×1/2英寸×1/4英寸厚,相对渗透性μr=1.05,残余场强度br=1.32t),将磁性微粒与缓冲液分离。将5μl样品移动至微粒团(slug),随后在4个电极的正方形构型上混合微粒混悬液(图21b)5分钟。通过磁体将微粒与样品分离,并将上清液移动至废物蓄池(图21c和21d)。将2μl1μg/ml与辣根过氧化物酶(hrp)缀合的抗-tsh检测抗体移动至微粒团并混合2分钟。用磁体分离微粒,并将上清液移动至废物蓄池。将含有免疫测定夹心复合物的微粒用4x2μl含有0.1%表面活性剂的pbs洗涤缓冲液洗涤共4次。将来自每个洗涤步骤的洗涤缓冲液在完成所述步骤后移动至废物。将由1μlsupersignalh2o2和1μl鲁米诺(thermofisherscientific)组成的化学发光底物移动至微粒团,随后混合6分钟。使用集成的hamamatsuh10682-110pmt和5vdc源,在427nm发射(347nm激发)测量化学发光信号。针对相对发光绘制剂量-响应曲线(参见图21e)。
实施例4:dmf顶电极芯片和孔阵列的制造和设计
顶电极设计:
使用卷对卷(r2r)凹版印刷和紫外压印,制造含有孔阵列的低成本柔性dmf顶电极芯片。参考图22,基础设计(1)包括印刷在聚对苯二甲酸乙二醇酯(pet)的柔性基底上的两组孔阵列,所述柔性基底用作dmf芯片的顶电极。所述设计由印刷在melinexst504pet基底(2)(solutia,oc50st504)上的100nm厚的氧化铟锡(ito)层(3)组成。使用pedot:pss底漆的涂层(4)改善含有最终孔阵列的紫外模压光刻胶(5)的粘附。
顶电极的卷对卷制造:
图22b显示了dmf顶电极的制造过程的示意图。使用凹版印刷(8)将20nm厚的pedot:pss底漆层(7)(cleviosvpai4083)(用异丙醇稀释以降低粘度)涂布在5-milmelinexst504pet基底(6)上。卷大小为250mx200mmx125μm;印刷速度为10m/分钟。将得到的底漆涂布的ito电极(9)转移至第二个r2r印刷线,在此处给紫外光刻胶层(10)施加凹版涂料(11)以形成用于紫外模压(13)的前体材料。与纳米阵列模具接触,随后紫外固化,产生最终的r2r顶电极薄膜(14),其准备好切割。
孔设计:
孔设计显示在图23中。将含有ito普通电极的顶芯片设计成被切为3”x1.4”条带(15),每个含有两个纳米大小的孔阵列(16),它们定位成与底芯片(17)上的两个外驱动电极对齐。顶电极在底芯片上的放置给出最终的dmf芯片组合装置(18)。每个阵列含有大约60,000个孔(245x245)。
参考图24a和24b,在最初的设计中使用两种不同的孔间隔形式——六角形(19)和直行(20)。另外,使用两个垫片(shim)设计来印刷两种不同的孔大小(21)——具有8.0μm节距的4.2μm宽x3.0μm深;具有8.0μm节距的4.5μmx3.2μm。进行孔大小和几何间距改变,以优化2.7μm直径珠子的随后微粒加载。在不同r2r运行批次上进行post-fabqc以检查适当间距、大小和完整性。如果观察到变形的孔或孔间距和/或大小是不正确的,制造新的垫片并重新印刷阵列。图25显示了六角形(22)和直行(23)阵列在200倍放大率的光学图像。
实施例5:含有孔阵列的dmf顶电极芯片的组装
dmf塑料芯片组装:
图26示意地描述了从dmf顶电极芯片和纳米大小的孔阵列的集成dmf-孔装置的组装,如在上面实施例4中所述。通过将2x2条的90μm双面胶带(24)(3m)放在底dmf芯片(25)的相对侧上,来组装dmf芯片。讲含有嵌入的阵列(26)的顶电极置于底芯片顶部中心上,使得两个阵列的位置与下面两个驱动电极对齐。最终组装的芯片(27)具有180μm(2x90μm带)的间隙高度。
实施例6:在低成本dmf-孔集成芯片上的tsh免疫测定
描述了使用dmf、微米大小的孔阵列和荧光底物的数字检测的组合的tsh的免疫测定(图27a-27g)。给dmf芯片(顶和底电极)预加载免疫测定(ia)试剂,如在(1)中所示(图27a)。使用空气作为填充流体,在dmf芯片上进行测定。所述样品可以是生物样品,诸如全血、血清、血浆、尿、痰、间质液或类似的基质。捕获微粒由2x107至2x108个颗粒/ml密度的用抗-βtsh抗体包被的固相磁性微粒的混悬液组成。将大约1-2μl样品移动到dmf芯片上并与1-2μl微粒组合,随后在dmf芯片的区域1(2)内混合(图27b)。区域1由16个dmf电极组成,其预留用于组合、混合和洗涤样品以在磁性微粒上形成tsh的捕获复合物。温育时间可以在1-10分钟范围内,随后是来自洗涤缓冲液1蓄池的1-2μl洗涤缓冲液(pbs,0.1%表面活性剂)的1-3次洗涤。通过在dmf芯片下面结合磁体并将上清液移动至废物蓄池1,将上清液从ia复合物除去。
将含有在固相上捕获的tsh抗原的微粒团再悬浮于1-2μl用生物素标记的抗-βtsh检测缀合物抗体(链霉亲和素-β-半乳糖苷酶复合物,在pbs中40pm的浓度)。在4x4个电极上面混合的同时,在dmf电极阵列(3)上的区域2中将所述混合物温育1-10分钟(图27c)。结合磁体以捕获磁性微粒,并将上清液除去至废物蓄池1。将所述团用来自洗涤缓冲液2蓄池的1-2μl洗涤缓冲液(pbs,0.1%表面活性剂)洗涤1-3次。通过在dmf芯片下面结合磁体并将上清液移动至废物蓄池2,将上清液从ia复合物除去。通过移动1-2μl100μm检测底物(4)(试卤灵-β-d-吡喃半乳糖苷,rgp),将含有免疫测定夹心复合物的微粒团再悬浮(图27d)。将混合物温育1-3分钟以允许rgp的酶促转换——从β-半乳糖苷酶对rgp的酶促转换产生的荧光产物。
如在图27e中所示,将混合物移动(5)至在底或顶基底上含有飞升孔阵列(6)的dmf芯片上的点。飞升孔的大小稍微大于在测定中使用的微粒的大小。孔的数目可以在1,000-2,000,000范围内。通过使用重力(被动加载)或磁体(主动加载)将微粒沉积在孔中。将多余的上清液移动至废物-3蓄池。
如在图27f和27g中所示,通过使用在电介质上的电润湿(ewod)、介电电泳(dep)力或表面声波(saw),将1-5μl可极化的不可混溶的流体(即有机溶剂、油等)移动至阵列位置(7,8)来密封飞升孔,由此密封孔。合适的可极化的不可混溶的流体的一些例子包括硅油、氟硅油、矿物油、1-己醇、thf、间二氯苯、氯仿等(s.fan,等人,labonchip,9,1236,2009;d.chatterjee,等人,labonchip,6,199,2006)。整个测定的填充流体是空气。
用宽视野显微镜/ccd照相机,通过白光照射确定孔中总颗粒数目,随后在574nm/615nm激发/发射(曝光时间=3-10秒)成像用于确定含有检测标记的珠子的数目。从用tsh校准物运行的标准曲线确定最后的tsh浓度。使用poisson方程式和阳性与阴性珠子的比率确定数字定量。
实施例7:顶加载可极化流体的纳米大小的孔
一般免疫测定形式:
可以使用3’x2”基于pet的dmf芯片运行基于elisa的夹心免疫测定,其与孔阵列中的数字荧光检测偶联。参考图28,将含有要分析的特定抗原的样品(3)与用捕获抗体(1)包被的磁性微粒(2)混合,并混合以允许期望的抗原的免疫捕获。洗涤以后,将捕获的抗原(4)与用检测部分(6)标记的第二检测抗体(5)混合。将含有夹心免疫测定复合物(7)的珠子混合物再次洗涤以除去未结合的检测抗体。如下将微粒加载进孔阵列的顶基底中:将水性微滴移动至所述阵列,并施加磁体以将珠子拉入孔中。通过使用dmf力,使可极化的不可混溶的流体微滴在所述孔上面移动,将孔密封。ccd照相机将所述阵列成像以确定阳性和阴性微粒的数目。使用poisson统计来定量样品。使用空气作为填充流体,在dmf芯片上进行所有免疫测定处理步骤。
tsh免疫测定-dmf:
将1-2μl的包被在2.7μm磁性微粒(3x108个颗粒/ml)上的抗-tsh捕获抗体从dmf芯片上的微粒蓄池分配进dmf电极阵列的中央。通过结合磁体(位于dmf芯片下方),并将上清液移动至废物蓄池,将磁性微粒与缓冲液分离。将1μl水性样品从dmf样品蓄池抽出并移动至微粒团,继之以混合步骤,其中使微滴在几个电极上面移动1-5分钟。通过施加底磁体将微粒与样品分离,随后将上清液除去至废物蓄池。将1-2μl与β-半乳糖苷酶(β-gal)缀合的抗-tsh检测抗体(0.5μg/ml)移动至微粒团并混合2-5分钟。使用底磁体分离微粒并将上清液移动至废物蓄池。将含有免疫测定夹心复合物的微粒用4x2μl含有0.1%表面活性剂的pbs洗涤缓冲液洗涤共4次。将来自每个洗涤步骤的洗涤缓冲液在完成所述步骤后移动至废物。从rgp蓄池中取1μl100μm试卤灵-β-d-吡喃半乳糖苷(rgp)并移动至微粒团,随后混合15-30秒。所述珠子现在准备好沉积到孔阵列中。
tsh免疫测定-数字阵列检测:
如在图29中所示,用于dmf-指导的微粒向阵列中的顶加载的基本部件包括:具有80-nm厚的银电极(8)(电极间隙<100μm,2.25mmx2.25mm)、5-10μm厚的电介质/疏水层(9)的基于pet的底电极芯片,含有孔阵列(14)(被构造成容纳不超过1个微粒)的基于pet的顶ito电极(10)芯片,和含有2.7μm磁性微粒(12)的水性微滴(11)。填充流体是空气(13)。在顶电极和底电极之间的间隙高度是大约180μm(来自2条90μm双面胶带)。
通过使用dmf力(ewod、dep和/或电介导力)的组合移动水性的和不可混溶的流体,诸如硅油,完成运输和密封。以前已经证实,需要不同的驱动电压来移动相同dmf芯片上的水性和油微滴二者(s-kfan,等人,labonchip,9,1236,2009)。
将荧光底物rgp加入含有免疫测定复合物的水性微滴以后(图30a),使用20-50vrms(1khz)的电压使微滴移动至电极,所述电极定位在含有约60,000个孔的孔阵列(245x245阵列;4.2μm直径;3.0μm深度;8.0μm节距)下面。结合顶磁体(15)以促进微粒向孔中的有效加载(图30b);总沉积时间是30-60秒。水性微滴随着顶磁体脱离而移开,剩下沉积的和表面结合的珠子的薄层(图30c)。使用200-300v电压(dc),从蓄池移动出硅油微滴,并移动至定位在阵列下面的电极(图30d),由此洗掉任何表面结合的微粒,同时密封在孔中所含的微粒。在574/615nm(激发/发射)用ccd照相机监测从rgp至试卤灵的酶促转换产生的荧光。确定“结合”微粒与“脱离”微粒的比率。根据tsh校正曲线,通过内插法确定样品中的tsh浓度。
最后,尽管已经关于本文的不同实施方案和具体实施例描述了本发明的不同方面和特征,但是所有这些都可以常规地做出或实现,应该理解,本发明有权获得所附权利要求的整个范围内的保护。
应当理解,前述详细描述和附随实施例仅仅是示例性的,且不应用作对本发明的范围的限制,所述范围仅由所附权利要求和它们的等同方案限定。
本领域技术人员明白对公开的实施方案的不同变化和修改。可以在不脱离其精神和范围的情况下做出这样的变化和修改,包括但不限于与本发明的化学结构、取代基、衍生物、中间体、合成、组合物、制剂或使用方法有关的那些。
为了完整性的原因,在以下编号的条款中阐述了本发明的不同方面:
1.一种数字微流体和分析物检测装置,其包含:
第一基底和第二基底,其中所述第二基底与所述第一基底被间隙隔开,所述第一基底包含多个电极以产生作用于液体微滴的电驱动力;和
孔阵列,其尺寸确定为容纳所述液体微滴的一部分,其中至少一部分的所述孔阵列定位在所述多个电极中的一个或多个和所述间隙之间。
2.根据条款1的装置,其中所述多个电极定位在所述第一基底的表面上。
3.根据条款1或条款2的装置,所述装置还包含第一层,所述第一层设置在所述第一基底的表面上并覆盖所述多个电极。
4.前述条款中的任一项的装置,其中所述第一基底包含在此处引入所述液体微滴的第一部分和液体微滴向其移动的第二部分。
5.条款4的装置,其中所述多个电极和所述第一层从所述第一部分延伸至所述第一基底的第二部分。
6.条款5的装置,其中所述孔阵列定位在所述第一基底的第二部分中。
7.根据条款4的装置,其中所述第二基底包含第一部分和第二部分,其中所述第一部分与所述第一基底的第一部分呈面对布置,且所述第二部分与所述孔阵列呈面对布置。
8.条款7的装置,其中所述第二基底的第二部分是基本上透明的以促进所述孔阵列的光学询问。
9.根据条款3的装置,所述装置还包含设置在所述第一层的表面上的第二层。
10.根据条款9的装置,其中第二层在所述第一基底的第一部分和第二部分上面延伸。
11.根据条款9-10中的任一项的装置,其中所述第一层是电介质层,且所述第二层是疏水层。
12.根据条款9-11中的任一项的装置,其中所述孔阵列定位在所述第二层中。
13.根据条款3中的任一项的装置,其中所述孔阵列定位在所述第一层中。
14.根据前述条款中的任一项的装置,其中所述孔阵列具有亲水表面。
15.根据前述条款中的任一项的装置,其中所述孔阵列包含侧壁,所述侧壁定向成促进存在于在所述孔阵列上面移动的微滴中的珠子或颗粒的接收和保留。
16.根据条款16的装置,其中所述孔阵列包含与第二侧壁相对的第一侧壁,其中所述第一侧壁相对于所述孔的底以钝角定向,且其中所述第二侧壁相对于所述孔的底以锐角定向,其中微滴的运动是在与所述孔的底平行的方向且从所述第一侧壁至所述第二侧壁。
17.根据条款15的装置,其中所述孔阵列具有截头圆锥形状,并且所述截头圆锥形状的较狭窄部分提供所述孔阵列的开口。
18.根据条款15的装置,其中所述孔阵列包含与第二侧壁相对的第一侧壁,其中所述第一侧壁的顶部分相对于所述孔的底以钝角定向,且所述侧壁的底部分垂直于所述孔的底定向,且其中所述第二侧壁相对于所述孔的底垂直定向,其中所述微滴的运动是在与所述孔的底平行的方向且从所述第一侧壁至所述第二侧壁,其中所述第一侧壁的顶部分是在所述孔的开口处。
19.一种数字微流体和分析物检测装置,其包含:
限定所述装置的第一基底和第二基底,其中所述第二基底与所述第一基底被间隙隔开,其中所述装置包含第一部分和第二部分;且
所述第一部分包含多个电极以驱动第一液体微滴和第二液体微滴的组合,所述第一液体微滴含有来自生物样品的目标分析物,所述第二液体微滴含有至少一个珠子;且
所述第二部分包含孔阵列,其尺寸确定为容纳所述液体微滴的一部分。
20.根据条款19的装置,其中所述多个电极仅定位在所述装置的第一部分中。
21.根据条款19或条款20的装置,其中所述多个电极定位在所述第一基底的表面上。
22.根据条款19-21中的任一项的装置,所述装置还包含第一层,所述第一层设置在所述第一基底的表面上并覆盖所述多个电极。
23.条款19-22中的任一项的装置,其中所述第一基底包含在此处引入所述液体微滴的第一部分和液体微滴向其移动的第二部分。
24.条款23的装置,其中所述多个电极和所述第一层从所述第一部分延伸至所述第一基底的第二部分。
25.条款24的装置,其中所述孔阵列定位在所述第一基底的第二部分中。
26.根据条款23的装置,其中所述第二基底包含第一部分和第二部分,其中所述第一部分与所述第一基底的第一部分呈面对布置,且所述第二部分与所述孔阵列呈面对布置,
27.条款26的装置,其中所述第二基底的第二部分是基本上透明的以促进所述孔阵列的光学询问。
28.根据条款19-27中的任一项的装置,其中所述多个电极被构造成使置于所述间隙中的微滴向所述装置的第二部分移动,所述装置包含将所述第一部分与所述第二部分流体地连接的毛细管部分,其中所述毛细管包含亲水材料以促进所述微滴在没有电力的情况下从第一部分经由所述毛细管部分向第二部分的运动。
29.根据条款22中的任一项的装置,其中第二层设置在所述第一层的上表面上。
30.根据条款29的装置,其中第二层在所述第一基底上面延伸。
31.根据条款29-30中的任一项的装置,其中所述第一层是电介质层,且所述第二层是疏水层。
32.根据条款29-31中的任一项的装置,其中所述多个孔定位在所述第二层中。
33.根据条款22的装置,其中所述孔阵列定位在所述第一层中。
34.根据条款19-33中的任一项的装置,其中所述孔阵列具有亲水表面。
35.根据条款19-34中的任一项的装置,其中所述孔包含侧壁,所述侧壁定向成促进存在于在所述孔阵列上面移动的微滴中的纳米珠子或纳米颗粒的接收和保留。
36.根据条款35的装置,其中所述孔包含与第二侧壁相对的第一侧壁,其中所述第一侧壁相对于所述孔的底以钝角定向,且其中所述第二侧壁相对于所述孔的底以锐角定向,其中所述微滴的运动是在与所述孔的底平行的方向且从所述第一侧壁至所述第二侧壁。
37.根据条款36的装置,其中所述孔具有截头圆锥形状,并且所述截头圆锥形状的较狭窄部分提供所述孔的开口。
38.根据条款35的装置,其中所述孔包含与第二侧壁相对的第一侧壁,其中所述第一侧壁的顶部分相对于所述孔的底以钝角定向,且所述侧壁的底部分垂直于所述孔的底定向,且其中所述第二侧壁垂直于所述孔的底定向,其中所述微滴的运动是在与所述孔的底平行的方向且从所述第一侧壁至所述第二侧壁,其中所述第一侧壁的顶部分是在所述孔的开口处。
39.一种表面声波微流体和分析物检测装置,其包含:
第一基底和第二基底,其中所述第二基底与所述第一基底被间隙隔开,其中所述装置包含第一部分和第二部分,
所述第一部分包含连接到表面声波产生部件的覆板;且
所述第二部分包含定位在所述第一基底或所述第二基底上的多个孔。
40.根据条款39的装置,其中所述覆板包括在所述覆板的上表面上的声子结构。
41.根据条款39或条款40的装置,其中所述覆板覆盖压电晶体层。
42.根据条款39-40中的任一项的装置,其中所述第二基底是基本上透明的。
43.一种表面声波微流体和分析物检测装置,其包含:
第一基底和第二基底,其中所述第二基底与所述第一基底被间隙隔开,
所述第一基底包含多个孔,且
所述第二基底包含声子结构,其中所述多个孔和所述声子结构定位在彼此的对面。
44.根据条款43的装置,其中所述第二基底是覆板。
45.根据条款43的装置,其中覆板设置在所述第二基底上,且所述声子结构位于所述覆板上。
46.根据条款43-45中的任一项的装置,其中所述第一基底、第二基底和覆板是基本上透明的。
47.一种检测液体微滴中的目标分析物的方法,所述方法包括:
(a)提供含有目标分析物的第一液体微滴;
(b)提供含有至少一种固体支持物的第二液体微滴,所述固体支持物含有结合所述目标分析物的特异性结合成员;
(c)使用能量来施加力以操纵所述第一液体微滴和所述第二液体微滴,从而建立混合物;
(d)将所述混合物的全部或至少一部分移动至孔阵列,其中所述阵列的一个或多个孔的大小足以容纳所述至少一种固体支持物;
(e)在将所述混合物的一部分移动至孔阵列之前或之后,将可检测标记加入所述混合物;和
(f)检测所述孔中的目标分析物。
48.条款47的方法,其中所述至少一种固体支持物包含至少一种特异性地结合所述目标分析物的结合成员。
49.条款47或48中的任一项的方法,所述方法还包括:在将所述混合物的至少一部分移动至孔阵列之前,将可检测标记加入所述混合物。
50.条款47或48中的任一项的方法,所述方法还包括:在将所述混合物的至少一部分移动至孔阵列之后,将可检测标记加入所述混合物。
51.条款47-50中的任一项的方法,其中所述可检测标记包含至少一种特异性地结合所述目标分析物的结合成员。
52.条款47-51中的任一项的方法,其中所述可检测标记包含发色团、荧光化合物、酶、化学发光化合物或放射性化合物。
53.条款47-52中的任一项的方法,其中所述结合成员是受体或抗体。
54.条款47-53中的任一项的方法,其中所述能量是电驱动力或声力。
55.条款54的方法,其中所述电驱动力是微滴驱动、电泳、电润湿、介电电泳、静电驱动、电场介导、电极介导、毛细管力、色谱法、离心或抽吸。
56.条款54的方法,其中所述声力是表面声波。
57.条款47-56中的任一项的方法,其中所述第一液体微滴是可极化的液体,所述第二液体微滴是可极化的液体,所述混合物是可极化的液体,或所述第一液体微滴和第二液体微滴二者各自是可极化的液体。
58.条款47-55中的任一项的方法,所述方法还包括使用电驱动力在所述孔阵列上面操纵所述混合物的至少一部分。
59.条款47-58中的任一项的方法,所述方法还包括使用毛细管元件在所述孔阵列上面操纵所述混合物的至少一部分,所述毛细管元件被构造成促进所述混合物向所述孔阵列的运动。
60.条款47-59中的任一项的方法,其中所述固体支持物是磁性固体支持物。
61.条款60的方法,其中从相对于所述混合物的至少一部分的相反方向施加电驱动力和磁场。
62.条款47-61中的任一项的方法,所述方法还包括如下混合所述混合物:使所述混合物前后移动,使所述混合物以环状模式移动,将所述混合物分割成两份或更多份的子混合物和合并所述子混合物。
63.条款47-62中的任一项的方法,其中所述混合物是水性液体。
64.条款47-62中的任一项的方法,其中所述混合物是不可混溶的液体。
65.条款47-64中的任一项的方法,其中所述液体微滴是疏水液体微滴。
66.条款47-65中的任一项的方法,其中所述孔阵列具有亲水表面。
67.条款47-65中的任一项的方法,其中所述孔阵列具有疏水表面。
68.条款47-67中的任一项的方法,其中所述方法在装置中执行,所述装置包含第一基底和第二基底,且至少一个基底包含亲水表面。
69.条款47-67中的任一项的方法,其中所述方法在装置中执行,所述装置包含第一基底和第二基底,且至少一个基底包含疏水表面。
70.条款47-69中的任一项的方法,所述方法还包括用多个电极产生电驱动力以将所述混合物移动至所述孔阵列,从而加载所述孔。
71.条款47-70中的任一项的方法,其中给所述阵列的一个或多个孔加载至少一种固体支持物。
72.条款71的方法,其中所述加载包括施加磁场以促进至少一种固体支持物向所述阵列的一个或多个孔中的运动。
73.条款72的方法,所述方法还包括除去在所述加载以后没有加载进所述阵列的孔中的任何固体支持物。
74.条款73的方法,其中所述除去包括用所述多个电极产生电驱动力以将可极化的流体微滴移动至所述孔阵列,以将所述混合物的至少一部分移动至离开所述孔阵列一段距离。
75.条款74的方法,其中所述除去包括用所述多个电极产生电驱动力以移动水性洗涤微滴横穿过所述孔阵列。
76.条款75的方法,其中产生电驱动力包括产生交流电。
77.条款75的方法,其中所述交流电具有10v或更高的均方根(rms)电压。
78.条款75或76中的任一项的方法,其中所述交流电具有在射频范围内的频率。
79.条款47-78中的任一项的方法,其中使用微流体装置、数字微流体装置(dmf)、基于表面声波的微流体装置(saw)、集成的dmf和分析物检测装置、集成的saw和分析物检测装置或基于机器人技术的测定处理单元执行所述方法。
80.一种检测液体微滴中的目标分析物的方法,所述方法包括:
(a)提供含有目标分析物的第一液体微滴;
(b)提供含有可检测标记的第二液体微滴,所述可检测标记含有结合所述目标分析物的特异性结合成员;
(c)使用能量来施加力以操纵所述第一液体微滴和所述第二液体微滴,从而建立混合物;
(d)将所述混合物的全部或至少一部分移动至孔阵列;和
(e)检测所述孔中的目标分析物。
81.条款80的方法,其中所述可检测标记包含发色团、荧光化合物、酶、化学发光化合物或放射性化合物。
82.条款80-81中的任一项的方法,其中所述能量是电驱动力或声力。
83.条款82的方法,其中所述电驱动力是微滴驱动、电泳、电润湿、介电电泳、静电驱动、电场介导、电极介导、毛细管力、色谱法、离心或抽吸。
84.条款83的方法,其中所述声力是表面声波。
85.条款80-83的方法,其中所述第一液体微滴是可极化的不可混溶的液体,所述第二液体微滴是可极化的液体,所述混合物是可极化的液体,或所述第一液体微滴和第二液体微滴二者各自是可极化的液体。
86.条款80-83和85中的任一项的方法,所述方法还包括使用电驱动力在所述孔阵列上面操纵所述混合物。
87.条款80-86中的任一项的方法,所述方法还包括使用毛细管元件在所述孔阵列上面操纵所述混合物,所述毛细管元件被构造成促进所述混合物向所述孔阵列的运动。
88.条款80-87中的任一项的方法,所述方法还包括如下混合所述混合物:使所述混合物前后移动,使所述混合物以环状模式移动,将所述混合物分割成两份或更多份的子混合物和合并所述子混合物。
89.条款80-88中的任一项的方法,其中所述混合物是水性液体。
90.条款80-88中的任一项的方法,其中所述混合物是不可混溶的液体。
91.条款80-90中的任一项的方法,其中所述液体微滴是疏水液体微滴。
92.条款80-91中的任一项的方法,其中所述孔阵列具有亲水表面。
93.条款80-91中的任一项的方法,其中所述孔阵列具有疏水表面。
94.条款80-93中的任一项的方法,其中所述方法在装置中执行,所述装置包含第一基底和第二基底,且至少一个基底包含亲水表面。
95.条款80-93中的任一项的方法,其中所述方法在装置中执行,所述装置包含第一基底和第二基底,且至少一个基底包含疏水表面。
96.条款80-95中的任一项的方法,所述方法还包括用多个电极产生电驱动力以将所述混合物移动至所述孔阵列,从而加载所述孔。
97.条款80-96中的任一项的方法,其中给所述阵列的一个或多个孔加载至少一种可检测标记。
98.条款97的方法,所述方法还包括除去在所述加载以后没有加载进所述阵列的孔中的任何可检测标记。
99.条款98的方法,其中所述除去包括用所述多个电极产生电驱动力以将可极化的流体微滴移动至所述孔阵列,以将所述混合物的至少一部分移动至离开所述孔阵列一段距离。
100.条款99的方法,其中所述除去包括用所述多个电极产生电驱动力以移动水性洗涤微滴横穿过所述孔阵列。
101.条款100的方法,其中产生电驱动力包括产生交流电。
102.条款101的方法,其中所述交流电具有10v或更高的均方根(rms)电压。
103.条款100或101中的任一项的方法,其中所述交流电具有在射频范围内的频率。
104.条款80-103中的任一项的方法,其中使用微流体装置、数字微流体装置(dmf)、基于表面声波的微流体装置(saw)、集成的dmf和分析物检测装置、集成的saw和分析物检测装置或基于机器人技术的测定处理单元执行所述方法。
105.一种测量液体微滴中的目标分析物的方法,所述方法包括:
(a)提供含有目标分析物的第一液体微滴;
(b)提供含有至少一种固体支持物的第二液体微滴,所述固体支持物含有结合所述目标分析物的特异性结合成员;
(c)使用能量来施加力以操纵所述第一液体微滴和所述第二液体,从而建立混合物;
(d)将所述混合物的全部或至少一部分移动至孔阵列,其中所述阵列的一个或多个孔的大小足以容纳所述至少一种固体支持物;
(e)在将所述混合物的一部分移动至孔阵列之前或之后,将可检测标记加入所述混合物;和
(f)测量所述孔中的可检测标记。
106.条款105的方法,其中所述至少一种固体支持物包含至少一种特异性地结合所述目标分析物的结合成员。
107.条款105或106中的任一项的方法,所述方法还包括:在将所述混合物的至少一部分移动至孔阵列之前,将可检测标记加入所述混合物。
108.条款105或106中的任一项的方法,所述方法还包括:在将所述混合物的至少一部分移动至孔阵列之后,将可检测标记加入所述混合物。
109.条款105-108中的任一项的方法,其中所述可检测标记包含至少一种特异性地结合所述目标分析物的结合成员。
110.条款105-109中的任一项的方法,其中所述可检测标记包含发色团、荧光化合物、酶、化学发光化合物或放射性化合物。
111.条款105-109中的任一项的方法,其中所述结合成员是受体或抗体。
112.条款105-109中的任一项的方法,其中所述能量是电驱动力或声力。
113.条款112的方法,其中所述电驱动力是微滴驱动、电泳、电润湿、介电电泳、静电驱动、电场介导、电极介导、毛细管力、色谱法、离心或抽吸。
114.条款112的方法,其中所述声力是表面声波。
115.条款105-114的方法,其中所述第一液体微滴是可极化的液体,所述第二液体微滴是可极化的液体,所述混合物是可极化的液体,或所述第一液体微滴和第二液体微滴二者各自是可极化的液体。
116.条款105-112和115中的任一项的方法,所述方法还包括使用电驱动力在所述孔阵列上面操纵所述混合物。
117.条款105-116中的任一项的方法,所述方法还包括使用毛细管元件在所述孔阵列上面操纵所述混合物,所述毛细管元件被构造成促进所述混合物向所述孔阵列的运动。
118.条款105-117中的任一项的方法,其中所述固体支持物是磁性固体支持物。
119.条款118的方法,其中从相对于所述混合物的至少一部分的相反方向施加电驱动力和磁场。
120.条款105-119中的任一项的方法,所述方法还包括如下混合所述混合物:使所述混合物前后移动,使所述混合物以环状模式移动,将所述混合物分割成两份或更多份的子混合物和合并所述子混合物。
121.条款105-120中的任一项的方法,其中所述混合物是水性液体。
122.条款105-121中的任一项的方法,其中所述混合物是不可混溶的液体。
123.条款105-122中的任一项的方法,其中所述液体微滴是疏水液体微滴。
124.条款105-123中的任一项的方法,其中所述孔阵列具有亲水表面。
125.条款105-123中的任一项的方法,其中所述孔阵列具有疏水表面。
126.条款105-124中的任一项的方法,其中所述方法在装置中执行,所述装置包含第一基底和第二基底,且至少一个基底包含亲水表面。
127.条款105-124中的任一项的方法,其中所述方法在装置中执行,所述装置包含第一基底和第二基底,且至少一个基底包含疏水表面。
128.条款105-128中的任一项的方法,所述方法还包括用多个电极产生电驱动力以将所述混合物移动至所述孔阵列,从而加载所述孔。
129.条款105-128中的任一项的方法,其中给所述阵列的一个或多个孔加载至少一种固体支持物。
130.条款129的方法,其中所述加载包括施加磁场以促进至少一种固体支持物向所述阵列的一个或多个孔中的运动。
131.条款130的方法,所述方法还包括除去在所述加载以后没有加载进所述阵列的孔中的任何固体支持物。
132.条款131的方法,其中所述除去包括用所述多个电极产生电驱动力以将可极化的流体微滴移动至所述孔阵列,以将所述混合物的至少一部分移动至离开所述孔阵列一段距离。
133.条款132的方法,其中所述除去包括用所述多个电极产生电驱动力以移动水性洗涤微滴横穿过所述孔阵列。
134.条款133的方法,其中产生电驱动力包括产生交流电。
135.条款134的方法,其中所述交流电具有10v或更高的均方根(rms)电压。
136.条款134或135中的任一项的方法,其中所述交流电具有在射频范围内的频率。
137.条款105-136中的任一项的方法,其中使用微流体装置、数字微流体装置(dmf)、基于表面声波的微流体装置(saw)、集成的dmf和分析物检测装置、集成的saw和分析物检测装置或基于机器人技术的测定处理单元执行所述方法。
138.条款105-137中的任一项的方法,其中所述测量包括确定阵列孔中的固体支持物的总数。
139.条款138的方法,其中所述测量包括确定含有所述可检测标记的阵列孔中的固体支持物的数目。
140.条款139的方法,其中所述测量包括:从阵列孔中的固体支持物的总数中减去含有可检测标记的固体支持物的数目,以确定不含有任何可检测标记的阵列孔中的固体支持物的数目。
141.条款140的方法,确定含有可检测标记的固体支持物与不含有任何可检测标记的固体支持物的数目的比率。
142.一种给孔加载颗粒的方法,所述方法包括:
(a)用多个电极产生电场以将含有微粒的液体微滴移动至孔阵列,其中所述孔阵列的一个或多个孔的大小足以在其中加载颗粒;
(b)给一个或多个孔加载颗粒;和
(c)用所述多个电极产生电场以将可极化的流体微滴移动至所述孔阵列,从而密封所述孔阵列。
143.条款142的方法,所述方法还包括使用电场在所述孔阵列上面操纵液体微滴。
144.条款142或143中的任一项的方法,所述方法还包括使用毛细管元件在所述孔阵列上面操纵液体微滴,所述毛细管元件被构造成促进所述液体微滴向所述孔阵列的运动。
145.条款142-144中的任一项的方法,其中所述颗粒是磁珠。
146.条款142的方法,其中所述加载包括施加磁场以促进一个或多个磁珠向所述阵列的一个或多个孔中的运动。
147.条款142-146中的任一项的方法,其中所述孔阵列具有亲水表面。
148.条款142-146中的任一项的方法,其中所述孔阵列具有疏水表面。
149.条款142-148中的任一项的方法,其中产生电场包括产生交流电。
150.条款149的方法,其中所述交流电具有10v或更高的均方根(rms)电压。
151.条款149或159中的任一项的方法,其中所述交流电具有在射频范围内的频率。
152.一种形成数字微流体和分析物检测装置的方法,所述方法包括:
展开包含第一基底的第一卷以将所述第一基底的第一部分定位在第一位置;
在处于所述第一位置的所述第一基底的第一部分上形成多个电极;和
在处于第二位置的所述第一基底的第二部分上形成孔阵列。
153.条款152的方法,所述方法还包括:在形成所述孔阵列之前,展开所述第一卷以将邻接所述第一基底的第一部分的所述第二部分定位在所述第二位置。
154.条款152或条款153的方法,所述方法还包括:
展开包含第二基底的第二卷以将第三基底的第三部分定位在第三位置;和
以足以将所述第二基底与所述第一基底相隔定位的方式在所述第三位置粘合所述第二基底和所述第一基底。
155.一种形成集成的数字微流体和分析物检测装置的方法,所述方法包括:
展开包含第一基底的第一卷以将所述第一基底的第一部分定位在第一位置;
在处于所述第一位置的所述第一基底的第一部分上形成多个电极;
展开包含第二基底的第二卷以将所述第二基底的第二部分定位在第二位置;
在处于第二位置的所述第二部分上形成孔阵列;和
粘合所述第二基底和所述第一基底,其中所述粘合的方式足以:
将所述第二基底与所述第一基底相隔定位;并且
将所述第二部分定位在所述第一部分上面,或在邻接所述第一基底的第一部分的第三部分上面,
其中所述孔阵列面对所述第一基底。
156.条款152-155中的任一项的方法,其中所述形成孔阵列包括使用热或紫外纳米压印光刻、纳米压印辊子、激光消融,或通过将包括孔阵列的预制基底粘在所述第一基底的第一部分上。
157.条款152-156中的任一项的方法,所述方法还包括使所述第一基底经受强烈的热、压力或紫外线以使用模具在所述第一基底上或内部形成声子结构。
158.条款152-157中的任一项的方法,所述方法还包括使用印刷机装置在所述系列电极上施加疏水材料和/或电介质材料。
159.条款158的方法,其中所述疏水材料和/或电介质材料包含固化材料。
160.条款159的方法,所述方法还包括施加热或紫外线以固化施加的疏水材料和/或电介质材料。
161.条款152-160中的任一项的方法,所述方法还包括将所述第一基底和第二基底切块以产生包含所述第一部分和第二部分的粘合基底。
162.一种检测液体微滴中的目标分析物的方法,所述方法包括:
(a)提供包含目标分析物的第一液体微滴;
(b)提供包含特异性结合成员和经标记的分析物的第二液体微滴,其中所述结合成员固定化在至少一种固体支持物上,所述特异性结合成员特异性地结合所述目标分析物,且所述经标记的分析物是用可检测标记进行标记的目标分析物;
(c)使用能量来施加力以操纵所述第一液体微滴和所述第二液体微滴,从而建立混合物;和
(d)将所述混合物的全部或至少一部分移动至孔阵列,其中所述阵列的一个或多个孔的大小足以容纳所述至少一种固体支持物。
163.一种检测液体微滴中的目标分析物的方法,所述方法包括:
(a)提供包含目标分析物的第一液体微滴;
(b)提供包含固定化的分析物和至少一种特异性结合成员的第二液体微滴,其中所述固定化的分析物是固定化在至少一种固体支持物上的目标分析物,所述至少一种特异性结合成员特异性地结合所述目标分析物,且所述至少一种特异性结合成员用可检测标记进行标记;
(c)使用能量来施加力以操纵所述第一液体微滴和所述第二液体微滴,从而建立混合物;
(d)将所述混合物的全部或至少一部分移动至孔阵列,其中所述阵列的一个或多个孔的大小足以容纳所述至少一种固体支持物;和
(e)检测所述孔中的目标分析物。
164.一种检测液体微滴中的目标分析物的方法,所述方法包括:
(a)提供含有目标分析物的第一液体微滴;
(b)提供含有至少一种固体支持物的第二液体微滴,所述固体支持物含有结合所述目标分析物的特异性结合成员;
其中将所述第一液体微滴和第二液体微滴提供到一种数字微流体和分析物检测装置中,所述装置包含:
第一基底和第二基底,其中所述第二基底与所述第一基底被间隙隔开,所述第一基底包含多个电极以产生作用于液体微滴的电驱动力;和
孔阵列,其尺寸确定为容纳所述液体微滴的一部分,其中至少一部分的所述孔阵列定位在所述多个电极中的一个或多个和所述间隙之间;
(c)使用电驱动力操纵所述第一液体微滴和所述第二液体微滴,从而建立混合物;
(d)将所述混合物的全部或至少一部分移动至所述孔阵列,其中所述阵列的一个或多个孔的大小足以容纳所述至少一种固体支持物;
(e)在将所述混合物的一部分移动至孔阵列之前或之后,将可检测标记加入所述混合物;和
(f)检测所述孔中的目标分析物。
165.条款164的方法,其中所述至少一种固体支持物包含至少一种特异性地结合所述目标分析物的结合成员。
166.条款164或165中的任一项的方法,所述方法还包括:在将所述混合物的至少一部分移动至孔阵列之前,将可检测标记加入所述混合物。
167.条款164或166中的任一项的方法,所述方法还包括:在将所述混合物的至少一部分移动至孔阵列之后,将可检测标记加入所述混合物。
168.条款164-167中的任一项的方法,其中所述可检测标记包含至少一种特异性地结合所述目标分析物的结合成员。
169.条款164-168中的任一项的方法,其中所述可检测标记包含发色团、荧光化合物、酶、化学发光化合物或放射性化合物。
170.条款164-168中的任一项的方法,其中所述结合成员是受体或抗体。
171.条款164-170中的任一项的方法,其中所述电驱动力是微滴驱动、电泳、电润湿、介电电泳、静电驱动、电场介导、电极介导、毛细管力、色谱法、离心或抽吸。
172.条款164-171中的任一项的方法,其中所述第一液体微滴是可极化的液体,所述第二液体微滴是可极化的液体,所述混合物是可极化的液体,或所述第一液体微滴和第二液体微滴二者各自是可极化的液体。
173.条款164-171中的任一项的方法,所述方法还包括使用电驱动力在所述孔阵列上面操纵所述混合物。
174.条款164-173中的任一项的方法,所述方法还包括使用毛细管元件在所述孔阵列上面操纵所述混合物,所述毛细管元件被构造成促进所述混合物向所述孔阵列的运动。
175.条款164-174中的任一项的方法,其中所述固体支持物是磁性固体支持物。
176.条款175的方法,其中从相对于所述混合物的至少一部分的相反方向施加所述电驱动力和所述磁场。
177.条款164-176中的任一项的方法,所述方法还包括如下混合所述混合物:使所述混合物前后移动,使所述混合物以环状模式移动,将所述混合物分割成两份或更多份的子混合物和合并所述子混合物。
178.条款164-176中的任一项的方法,其中所述混合物是水性液体。
179.条款164-176中的任一项的方法,其中所述混合物是不可混溶的液体。
180.条款164-179中的任一项的方法,其中所述液体微滴是疏水液体微滴。
181.条款164-180中的任一项的方法,其中所述孔阵列具有亲水表面。
182.条款164-180中的任一项的方法,其中所述孔阵列具有疏水表面。
183.条款164-182中的任一项的方法,其中所述基底包含亲水表面。
184.条款164-182中的任一项的方法,其中所述基底包含疏水表面。
185.条款164-184中的任一项的方法,所述方法还包括用多个电极产生电驱动力以将所述混合物移动至所述孔阵列,从而加载所述孔。
186.条款164-185中的任一项的方法,其中给所述阵列的一个或多个孔加载至少一种固体支持物。
187.条款186的方法,其中所述加载包括施加磁场以促进至少一种固体支持物向所述阵列的一个或多个孔中的运动。
188.条款187的方法,所述方法还包括除去在所述加载以后没有加载进所述阵列的孔中的任何固体支持物。
189.条款188的方法,其中所述除去包括用所述多个电极产生电驱动力以将可极化的流体微滴移动至所述孔阵列,以将所述混合物的至少一部分移动至离开所述孔阵列一段距离。
190.条款189的方法,其中所述除去包括用所述电极产生电驱动力以移动水性洗涤微滴横穿过所述孔阵列。
191.条款190的方法,其中产生电驱动力包括产生交流电。
192.条款191的方法,其中所述交流电具有10v或更高的均方根(rms)电压。
193.条款191或192中的任一项的方法,其中所述交流电具有在射频范围内的频率。
194.一种检测液体微滴中的目标分析物的方法,所述方法包括:
(a)提供含有目标分析物的第一液体微滴;
(b)提供含有至少一种固体支持物的第二液体微滴,所述固体支持物含有结合所述目标分析物的特异性结合成员;
其中将所述第一液体微滴和第二液体微滴提供进表面声波微流体和分析物检测装置中,所述装置包含:
第一基底和第二基底,其中所述第二基底与所述第一基底被间隙隔开,其中所述装置包含第一部分和第二部分,
所述第一部分包含连接到表面声波产生部件的覆板;且
所述第二部分包含定位在所述第一基底或所述第二基底上的多个孔,
(c)使用表面声力操纵所述第一液体微滴和所述第二液体微滴,从而建立混合物;
(d)将所述混合物的全部或至少一部分移动至所述孔阵列,其中所述阵列的一个或多个孔的大小足以容纳所述至少一种固体支持物;
(e)在将所述混合物的一部分移动至孔阵列之前或之后,将可检测标记加入所述混合物;和
(f)检测所述孔中的目标分析物。
195.条款194的方法,其中所述至少一种固体支持物包含至少一种特异性地结合所述目标分析物的结合成员。
196.条款194或195中的任一项的方法,所述方法还包括:在将所述混合物的至少一部分移动至孔阵列之前,将可检测标记加入所述混合物。
197.条款194或196中的任一项的方法,所述方法还包括:在将所述混合物的至少一部分移动至孔阵列之后,将可检测标记加入所述混合物。
198.条款194-197中的任一项的方法,其中所述可检测标记包含至少一种特异性地结合所述目标分析物的结合成员。
199.条款194-198中的任一项的方法,其中所述可检测标记包含发色团、荧光化合物、酶、化学发光化合物或放射性化合物。
200.条款194-199中的任一项的方法,其中所述结合成员是受体或抗体。
201.条款194-200中的任一项的方法,其中所述第一液体微滴是可极化的液体,所述第二液体微滴是可极化的液体,所述混合物是可极化的液体,或所述第一液体微滴和第二液体微滴二者各自是可极化的液体。
202.条款194-201中的任一项的方法,所述方法还包括使用毛细管元件在所述孔阵列上面操纵所述混合物,所述毛细管元件被构造成促进所述混合物向所述孔阵列的运动。
203.条款194-202中的任一项的方法,其中所述固体支持物是磁性固体支持物。
204.条款70的方法,其中所述方法还包括用疏水液体密封所述孔阵列。
205.条款96的方法,其中所述方法还包括用疏水液体密封所述孔阵列。
206.条款185的方法,其中所述方法还包括用疏水液体密封所述孔阵列。
- 还没有人留言评论。精彩留言会获得点赞!