一种基于固定化SNAP-tag融合蛋白的细胞膜色谱柱及其制备方法与流程
本发明属于细胞膜色谱柱制备技术领域,涉及一种基于固定化snap-tag融合蛋白的细胞膜色谱柱及其制备方法。
背景技术:
细胞膜色谱是一种有效的从复杂体系中直接筛选识别目标组分的新技术。但其作为一种新兴技术,不可避免的仍存在一定的缺陷,主要体现在两个方面:第一是细胞膜色谱柱的寿命有待进一步提升,作为生物亲和色谱方法的一种,细胞膜具有所有生物亲和色谱的通性特点,即生物材料维持活性较难,而且由于细胞膜与硅胶之间主要通过疏水作用相结合,因而其柱效降低较快,寿命往往较短,因为随着细胞膜色谱柱的使用,其上生物材料也就是细胞膜会逐渐脱落失活,导致其有效使用寿命往往不到72小时,这就大大阻碍了细胞膜色谱柱的商品化应用道路。第二是细胞膜色谱特异性较差,细胞膜色谱作为一种生物亲和色谱,其活性筛选功能是经由其上所搭载的生物活性材料,亦即细胞膜所实现的。而由于细胞膜表面受体众多,难以确定其上哪个蛋白靶点与潜在活性药物之间相互作用,这也对后期进行潜在活性成分的药理活性验证带来了不便。
在众多生物分析和生物医学的研究领域中,蛋白质固定化发挥着越来越重要的作用,传统的蛋白质固定化方法(如非特异性物理吸附、亲和标签的非共价结合、选择性的酶共价结合等)往往存在特异性不好、结合力不稳定、靶蛋白功能可能受化学修饰的影响等问题。snap-tag凭借其与其底物苯甲基鸟嘌呤(benzylguanine,bg)的高特异性识别和稳定共价结合的性质,成为目前蛋白固定化最有力的工具。snap-tag是一种新型的自我标记标签蛋白,snap-tag无论在体内还是体外都可以特异性并快速与其配体,即苯甲基鸟嘌呤(benzylguanine,bg)衍生物发生反应,以共价键结合。苯甲基鸟嘌呤可事先固定在基质表面,然后混合提取液中的snap-tag融合蛋白即可特异性地与底物作用,形成共价键,从而使得融合蛋白间接固定在基质表面。
但是,目前关于基于固定化snap-tag融合蛋白的细胞膜色谱柱及其制备方法等技术还鲜有报道。
技术实现要素:
为了克服上述现有技术的缺点,本发明的目的在于提供一种基于固定化snap-tag融合蛋白的细胞膜色谱柱及其制备方法,该细胞膜色谱柱的柱寿命延长,稳定性提高,特异性强;该制备方法操作简单,易于实现。
为了达到上述目的,本发明采用以下技术方案予以实现:
本发明公开了一种基于固定化snap-tag融合蛋白的细胞膜色谱柱,该细胞膜色谱柱是将苯甲基鸟嘌呤键合到硅胶上,细胞膜上的snap-tag融合受体特异性结合苯甲基鸟嘌呤,使snap-tag融合蛋白固定在硅胶表面得到细胞膜固定相,再将细胞膜固定相采用湿法装柱制得。
优选地,所述硅胶为氨基化硅胶。
进一步优选地,苯甲基鸟嘌呤通过三聚氯氰键合到氨基化硅胶上。
进一步优选地,所述氨基化硅胶为氨丙基硅胶。
本发明还公开了一种基于固定化snap-tag融合蛋白的细胞膜色谱柱的制备方法,包括以下步骤:
1)将3-氨丙基三乙氧基硅烷键合到硅胶上,制得氨丙基硅胶;
2)采用三聚氯氰修饰氨丙基硅胶,制得三聚氯氰修饰的硅胶固定相;
3)将三聚氯氰修饰的硅胶固定相制备成悬浮液,然后加入等摩尔的6-[[4-(氨基甲基)苯基]甲氧基]-7h-嘌呤-2-胺,充分搅拌反应,制备得到苯甲基鸟嘌呤修饰的硅胶固定相;
4)培养snap-tag融合蛋白高表达细胞,当细胞计数不低于107个时,去除培养基,获得细胞,分离出细胞膜;
5)将细胞膜配制成细胞膜悬液,将细胞膜悬液加入步骤3)制得的苯甲基鸟嘌呤修饰的硅胶固定相中,搅拌均匀后静置过夜,得到以苯甲基鸟嘌呤修饰的硅胶为载体的细胞膜固定相;
6)将以苯甲基鸟嘌呤修饰的硅胶为载体的细胞膜固定相采用湿法装柱获得基于固定化snap-tag融合蛋白的细胞膜色谱柱。
优选地,步骤1)中的硅胶使用前经活化处理。
优选地,步骤4)中,将获得的细胞用tris-hcl混悬后置于细胞超声破碎仪中进行破碎,然后通过差速离心分离细胞膜。
与现有技术相比,本发明具有以下有益效果:
本发明公开的基于固定化snap-tag融合蛋白的细胞膜色谱柱将苯甲基鸟嘌呤共价键合到硅胶上,细胞膜上的snap-tag融合受体即可特异性地与底物作用,形成共价键,从而使得snap-tag融合蛋白间接固定在硅胶表面,一方面由于共价键合的方法实现细胞膜在硅胶上的固定,从而进一步延长细胞膜色谱柱的柱寿命,提高其稳定性。另一方面,由于靶标蛋白与snap-tag的融合,可特异性地与底物作用,即细胞膜色谱柱上只存在靶标受体,无其他受体的干扰,大大提高了其特异性。
附图说明
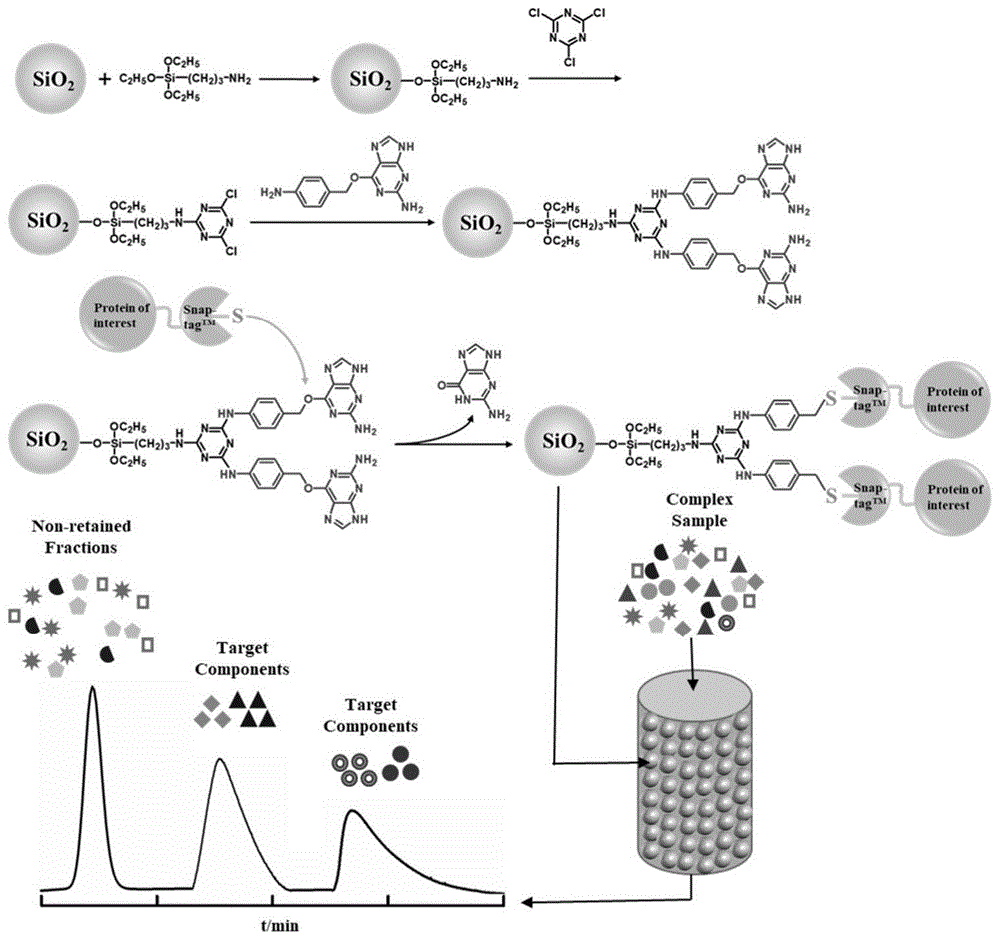
图1为固定化snap-tag融合蛋白的细胞膜色谱柱制备流程图;
图2为氨基修饰硅胶(nh2-sio2),三聚氯氰修饰硅胶(tct-sio2),苯甲基鸟嘌呤修饰硅胶(bg-sio2)的红外谱图;
图3为氨基修饰硅胶(nh2-sio2),三聚氯氰修饰硅胶(tct-sio2),苯甲基鸟嘌呤修饰硅胶(bg-sio2)的x射线光电子能谱图。
具体实施方式
为了使本技术领域的人员更好地理解本发明方案,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分的实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都应当属于本发明保护的范围。
需要说明的是,本发明的说明书和权利要求书及上述附图中的术语“第一”、“第二”等是用于区别类似的对象,而不必用于描述特定的顺序或先后次序。应该理解这样使用的数据在适当情况下可以互换,以便这里描述的本发明的实施例能够以除了在这里图示或描述的那些以外的顺序实施。此外,术语“包括”和“具有”以及他们的任何变形,意图在于覆盖不排他的包含,例如,包含了一系列步骤或单元的过程、方法、系统、产品或设备不必限于清楚地列出的那些步骤或单元,而是可包括没有清楚地列出的或对于这些过程、方法、产品或设备固有的其它步骤或单元。
下面结合附图对本发明做进一步详细描述:
参见图1,本发明提供一种基于固定化snap-tag融合蛋白的细胞膜色谱柱及其制备方法。首先制备氨基键合硅胶,然后将三聚氯氰键合到氨基化硅胶上,作为苯甲基鸟嘌呤键合到硅胶上的linker,接下来细胞膜上的snap-tag融合受体即可特异性地与底物作用,形成共价键,从而使得融合蛋白间接固定在硅胶表面制得细胞膜固定相。再通过湿法装入色谱柱中,构成一种基于固定化snap-tag融合蛋白的细胞膜色谱柱。该固定化snap-tag融合蛋白的细胞膜色谱柱延长细胞膜色谱柱的柱寿命,提高其稳定性。解决了现有的细胞膜色谱柱存在特异性较差的问题,为细胞膜色谱柱的商品化奠定了基础。
1、本发明中基于固定化snap-tag融合蛋白细胞膜色谱柱的制备,包括以下步骤:
1)氨基键合硅胶固定相的制备
称取大孔硅胶(型号:zex-ii,5μm,
准确称取10.0g活化后的硅胶、5.0g3-氨丙基三乙氧基硅烷和100ml甲苯,置于250ml三口瓶中,于110℃下搅拌回流反应12h,反应结束后分别用甲苯、甲醇洗涤所得的固体粉末,过滤并收集滤饼,于100℃真空干燥条件下烘干,即得异丙基侧链保护的氨基色谱固定相。
2)三聚氯氰键合硅胶固定相的制备
将2g氨基丙基硅胶加入到40ml水中,通过冰浴将混合物冷却至0℃。在搅拌下,缓慢加入0.36g三聚氯氰,在此期间逐渐加入nahco3以使反应溶液的ph保持在
3)苯甲基鸟嘌呤键合硅胶固定相的制备
将2g三聚氯氰修饰的硅胶固定相溶解在35ml丙酮中并倒入50ml冰水中以形成非常细的悬浮液。加入等摩尔比的6-[[4-(氨基甲基)苯基]甲氧基]-7h-嘌呤-2-胺,50℃下搅拌60分钟得到苯甲基鸟嘌呤修饰的硅胶固定相。
对苯甲基鸟嘌呤键合硅胶固定相进行表征:采用红外光谱,x射线光电子能谱对氨基色谱固定相、三聚氯氰修饰的硅胶固定相、苯甲基鸟嘌呤修饰的硅胶固定相进行表征。
图2为氨基修饰硅胶(nh2-sio2),三聚氯氰修饰硅胶(tct-sio2),苯甲基鸟嘌呤修饰硅胶(bg-sio2)的红外谱图,tct-sio2红外上在1560cm-1,1517cm-1出现了1,3,5-三嗪环的骨架振动吸收峰,说明三聚氯氰已经成功键合到了氨基色谱固定相上。bg-sio2红外上在1587cm-1,1507cm-1出现了1,3,5-三嗪环的骨架振动吸收峰,与tct-sio2红外上1,3,5-三嗪环的骨架振动吸收峰相比发生了位移,是由于苯甲基鸟嘌呤的取代所致。
为了进一步验证所制备的苯甲基鸟嘌呤键合硅胶固定相,采用x射线光电子能谱对其进行验证,图3为氨基修饰硅胶(nh2-sio2),三聚氯氰修饰硅胶(tct-sio2),苯甲基鸟嘌呤修饰硅胶(bg-sio2)的x射线光电子能谱图。在tct-sio2的xps谱图中,在201.2ev处观测到氯(cl2p)的特征信号,这是由于通过衍生反应偶联了三聚氯氰,表明三聚氯氰成功的键合到了氨基色谱固定相上。在bg-sio2的xps谱图中,氯(cl2p)的特征信号信号消失,这是由于三聚氯氰上的两个氯均被苯甲基鸟嘌呤衍生物取代所致。bg-sio2与tct-sio2相比,碳的含量由31.9%提高到61.9%,碳含量的变化是由于苯甲基鸟嘌呤衍生物引入引起的,也说明了苯甲基鸟嘌呤衍生物的成功键合。
4)细胞膜色谱固定相的制备
将培养的snap-tag-egfrhek293高表达细胞计数不低于(107个),利用0.25%胰蛋白酶消化,3000g4℃条件下离心10min,去除培养基取沉淀物,加入10mmol/l的pbs缓冲液重新混悬并于3000g4℃条件下离心10min,吸取细胞表面残留的培养基,重复3次,将培养好的细胞分离出来。然后用5ml50mmol/l的tris-hcl混悬细胞置于细胞超声破碎仪中将细胞破碎,1000g4℃条件下离心10min,取上清置于离心管中12000g4℃条件下离心10min,沉淀即为细胞膜,利用10mmol/l的pbs清洗细胞膜1次。再将细胞膜悬液加入到0.05g苯甲基鸟嘌呤修饰的硅胶固定相,置于磁力搅拌器上于4℃条件搅拌30min,利用snap-tag与其底物苯甲基鸟嘌呤的高特异性识别和稳定共价结合使细胞膜固定苯甲基鸟嘌呤修饰的硅胶固定相表面,即得细胞膜色谱固定相。
5)细胞膜色谱柱的建立
将得到的固定化snap-tag融合蛋白的细胞膜色谱固定相利用rpl-zd10装柱机湿法装入10mm(l)×2.0mm(i.d.)的柱芯中,即得以基于固定化snap-tag融合蛋白的细胞膜色谱柱。
2、基于固定化snap-tag融合蛋白的细胞膜色谱柱的效果验证
普通egfr细胞膜色谱柱和基于固定化snap-tag融合蛋白的细胞膜色谱柱的柱内柱间差异性主要以吉非替尼的保留时间为指标,柱内差异性为分别制备一根普通egfr细胞膜色谱柱和基于固定化snap-tag融合蛋白的细胞膜色谱柱,置于液相色谱中,充分平衡后,连续进5μl0.1mg/ml的吉非替尼样品5次,分别记录每次进样的吉非替尼的保留时间。柱间差异性为按照同样的方法分别同时制备3根普通egfr细胞膜色谱柱和基于固定化snap-tag融合蛋白的细胞膜色谱柱,置于液相色谱仪内应用相同的色谱条件充分平衡后,分别进5μl0.1mg/ml的吉非替尼样品,分别记录每根普通egfr细胞膜色谱柱和基于固定化snap-tag融合蛋白的细胞膜色谱柱上吉非替尼的保留时间,结果如表1所示。普通egfr细胞膜色谱柱和基于固定化snap-tag融合蛋白的细胞膜色谱柱的柱内柱间差异性均良好,但基于固定化snap-tag融合蛋白的细胞膜色谱柱rsd值更小,其重复性更好。接下来考察了普通egfr细胞膜色谱柱和基于固定化snap-tag融合蛋白的细胞膜色谱柱的活性时间。分别同时制备3根普通egfr细胞膜色谱柱和基于固定化snap-tag融合蛋白的细胞膜色谱柱,之后将其置于液相色谱内,充分平衡后,不停地进样5μl0.1mg/ml的吉非替尼样品,经过3天后,吉非替尼在普通egfr细胞膜色谱柱和基于固定化snap-tag融合蛋白的细胞膜色谱柱上仍有明显的保留,但在基于固定化snap-tag融合蛋白的细胞膜色谱柱上的rsd值较小,经过7天后,吉非替尼在普通egfr细胞膜色谱柱的保留不断减弱,而在基于固定化snap-tag融合蛋白的细胞膜色谱柱上还有较好的保留,结果如表1所示,表明基于固定化snap-tag融合蛋白的细胞膜色谱柱较普通细胞膜色谱柱的寿命有所延长。
表1普通egfr细胞膜色谱柱和固定化snap-tag融合蛋白的细胞膜色谱柱的重现性和活性考察
以上内容仅为说明本发明的技术思想,不能以此限定本发明的保护范围,凡是按照本发明提出的技术思想,在技术方案基础上所做的任何改动,均落入本发明权利要求书的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!