用于形成聚集体的多肽的聚集体的检测方法与流程
本专利申请主张2014年12月02日向韩国特许厅提出的韩国专利申请第10-2014-0170608号作为优先权,上述专利申请的公开事项插入于本说明书作为参照。
本发明涉及生物样品(biosample)的用于形成聚集体的多肽的聚集体的检测方法或试剂盒。
背景技术:
首先,还存在构成蛋白质的多肽形成多聚体(multimer),来形成功能性蛋白质的情况,但是在正常状态下,以单体存在,若处于非正常的状态(例如,转换为错配型(mismatchedtype)),则通过形成多聚体,来凝聚而诱发疾病的情况多(massimostefani,etal.,j.mol.med.81:678-699(2003);andradfordse,etal.,cell.97:291-298(1999))。
例如,与蛋白质的非正常的凝聚或错配相关的疾患或疾病包含:阿尔茨海默病(alzheimerdisease)、克罗伊茨费尔特-雅各布病(creutzfeldt-jakobdisease)、海绵状脑病(spongiformencephalopathies)、帕金森病(parkinson`sdisease)、亨廷顿病(huntington`sdisease)、肌萎缩性侧索硬化症(amyotrophiclateralsclerosis)、丝氨酸蛋白酶抑制剂缺乏症(serpindeficiency)、肺气肿(emphysema)、肝硬化(cirrhosis)、ii型糖尿病、一次性全身性淀粉样变病(amyloidosis)、二次性全身性淀粉样变病、额颞痴呆(fronto-temporaldementias)、老年人淀粉样变病、家族性淀粉样多发性神经病(familialamyloidpolyneuropathy)、遗传性淀粉样脑血管病(hereditarycerebralamyloidangiopathy)及血液透析相关淀粉样变病。
在对是否存在这种疾患或疾病或进行程度进行测定中,由于抗原的量在试样中非常少或抗原的大小非常小,难以进行测定或在体内的抗原的量和试样中的抗原的量不成比例的情况下,例如,众所周知,与正常人相比,参与阿尔茨海默病的β-淀粉样蛋白(aβ,amyloid-β)也在非正常人中β-淀粉样蛋白低聚物的水平高,但是当难以检测血液试样内β-淀粉样蛋白低聚物量或在血液试样内以非定型的方式存在β-淀粉样蛋白低聚物时,有可能难以进行诊断。
并且,还存在由于所要测定的抗原过小或量少,因此很难通过三明治法酶联免疫吸附试验(sandwichelisa)诊断疾病的情况。
对此,本发明人认识到对患者和正常人之间的诊断信号的差异(differentiation)进行最大化的用于形成聚集体的多肽的聚集体检测方法的开发必要性。
本说明书全文中,参照了多篇论文及专利文献,并表示了其引用。所引用的论文及专利文献的公开内容全部插入于本说明书作为参照,从而更加明确说明本发明所属的技术领域的水平及本发明的内容。
技术实现要素:
要解决的问题
在上述背景下,本发明人为了开发检测用于形成聚集体的多肽的聚集体的新型方法,进行了广泛的研究,其结果,利用抑制多肽的聚集体形成的防御系统(clearingsystem)或疏水相互作用(hydrophobicinteraction)的差异,来开发了对患者和正常人之间的诊断信号的差异进行最大化的用于形成聚集体的多肽的聚集体检测方法。
因此,本发明的目的在于,提供生物样品的用于形成聚集体的多肽的聚集体的检测方法。
本发明的再一目的在于,提供用于检测生物样品的用于形成聚集体的多肽的聚集体的试剂盒。
根据以下发明的详细说明、发明要求保护范围及附图更加明确本发明的其他目的及优点。
解决问题的方案
根据本发明的一实施方式,本发明提供生物样品的用于形成聚集体的多肽的聚集体的检测方法,上述生物样品的用于形成聚集体的多肽的聚集体的检测方法包括:步骤(a),向分析对象的生物样品掺加(spiking)(ⅰ)上述用于形成聚集体的多肽的单体形式或多聚体形式、(ⅱ)上述用于形成聚集体的多肽的疏水性缺失体(hydrophobicdeletedderivativeofaggregate-formingpolypeptide)或(ⅲ)上述用于形成聚集体的多肽的单体形式或多聚体形式和上述用于形成聚集体的多肽的疏水性缺失体;步骤(b),通过培养上述步骤(a)的结果物,来还形成上述用于形成聚集体的多肽的聚集体;步骤(c),使结合剂-标志物与上述步骤(b)的结果物相接触,上述结合剂-标志物由信号产生标志物和与上述用于形成聚集体的多肽的聚集体相结合的结合剂结合而成;以及步骤(d),对从与上述用于形成聚集体的多肽的聚集体结合而成的结合剂-标志物产生的信号进行检测,其中,进行充分时间的上述步骤(b)的培养,使得所掺加的上述(ⅰ)上述用于形成聚集体的多肽的单体形式或多聚体形式、(ⅱ)上述用于形成聚集体的多肽的疏水性缺失体或(ⅲ)上述用于形成聚集体的多肽的单体形式或多聚体形式和上述用于形成聚集体的多肽的疏水性缺失体能够借助上述生物样品进行多聚体化。
本发明涉及利用抑制多肽的聚集体形成的防御系统或疏水相互作用的差异,来对患者和正常人之间的诊断信号的差异进行最大化的用于形成聚集体的多肽的聚集体检测方法。
在本说明书中,术语“用于形成聚集体的多肽”是指可形成多聚体形式(低聚物型)或可形成基于与单体形式的疏水相互作用的聚集体的多肽。尤其,下述结构变化会诱发多种疾病。例如,包含阿尔茨海默病、克罗伊茨费尔特-雅各布病、海绵状脑病、帕金森病、亨廷顿病、肌萎缩性侧索硬化症、丝氨酸蛋白酶抑制剂缺乏症、肺气肿、肝硬化、ii型糖尿病、一次性全身性淀粉样变病、二次性全身性淀粉样变病、额颞痴呆、老年人淀粉样变病、家族性淀粉样多发性神经病、遗传性淀粉样脑血管病及血液透析相关淀粉样变病。
通常,上述用于形成聚集体的多肽的非-聚集体为正常,聚集体诱发疾病,尤其,诱发如阿尔茨海默病、克罗伊茨费尔特-雅各布病或帕金森病等神经退行性疾病。
根据本发明的一实例,进行掺加的上述(ⅰ)上述用于形成聚集体的多肽的单体形式或多聚体形式、(ⅱ)上述用于形成聚集体的多肽的疏水性缺失体或(ⅲ)上述用于形成聚集体的多肽的单体形式或多聚体形式和上述用于形成聚集体的多肽的疏水性缺失体的多聚体化的上述生物样品为具有上述用于形成聚集体的多肽的多聚体形式参与的疾病的人类的生物样品,更优选地,可借助上述生物样品进行多聚体化的充分的培养时间为如下充分的时间:利用具有用于形成聚集体的多肽的多聚体形式参与的疾病的人类的生物样品来产生的信号比利用正常人类的生物样品来产生的信号大1.5~20倍。
以下,对用于检测生物样品的用于形成聚集体的多肽的聚集体的本发明的方法按步骤进行详细说明如下:
步骤(a)进行掺加
首先,本发明的方法包括向分析对象的生物样品掺加(ⅰ)上述用于形成聚集体的多肽的单体形式或多聚体形式(低聚物型)、(ⅱ)上述用于形成聚集体的多肽的疏水性缺失体或(ⅲ)上述用于形成聚集体的多肽的单体形式或多聚体形式(低聚物型)和上述用于形成聚集体的多肽的疏水性缺失体的步骤。
在本说明书中,术语“生物样品”是指所要进行分析的有机体-来源试样。上述生物样品是指可根据生物源的细胞、组织或生物体液或可根据本发明进行分析的其他介质(medium),它们包含从人类采集的试样、从动物采集的试样、用于人类或动物的食品采集的试样。优选地,分析对象的生物样品为包含血液、血清、血浆、淋巴液、牛奶、小便、大便、眼泪、唾液、精液、脑提取物(例如,脑部均质液)、脊髓液(scf)、阑尾、脾脏及扁桃体组织提取物的体内流体试样。更优选地,上述生物样品为血液,最优选地,为血浆。
根据本发明的再一实例,上述用于形成聚集体的多肽包含:参与阿尔茨海默病的β-淀粉样蛋白肽和tau蛋白质;参与克罗伊茨费尔特-雅各布病及海绵状脑病的朊病毒蛋白;参与帕金森病的α-突触核蛋白;参与一次性全身性淀粉样变病的免疫球蛋白轻链;参与二次性全身性淀粉样变病的血清淀粉样蛋白a;参与额颞痴呆的tau蛋白质;参与老年人淀粉样变病的甲状腺素视黄质运载蛋白;参与家族性淀粉样多发性神经病的甲状腺素视黄质运载蛋白;参与遗传性淀粉样脑血管病的半胱氨酸蛋白酶抑制剂c;参与血液透析相关淀粉样变病的β2-微球蛋白;参与亨廷顿病的亨廷顿蛋白;参与肌萎缩性侧索硬化症的超氧化物歧化酶;参与丝氨酸蛋白酶抑制剂缺乏症、肺气肿及肝硬化的丝氨酸蛋白酶抑制剂;以及参与ii型糖尿病的胰淀素。更优选地,上述用于形成聚集体的多肽为参与阿尔茨海默病的β-淀粉样蛋白肽或tau蛋白质或者参与帕金森病的α-突触核蛋白,最优选地,是β-淀粉样蛋白肽或α-突触核蛋白。
在本说明书中,术语“掺加”是指向分析对象的生物样品添加用于形成聚集体的多肽单体形式(或多聚体形式)和/或用于形成聚集体的多肽的疏水性缺失体或添加后进行混合的过程。
在本说明书中,术语“多聚体”是由两个以上的单体结合而成的,多聚体中还包含低聚物。
根据本发明,在向生物样品掺加(ⅰ)上述用于形成聚集体的多肽的单体形式或多聚体形式的情况中,为了利用用于抑制形成用于形成聚集体的多肽的聚集体的防御系统差异来对患者和正常人之间的诊断信号的差异进行最大化,即,在患者的生物样品中因防御系统的程度低,从而促进用于形成聚集体的多肽的聚集体的形成,相反地,在正常人的生物样品中,因防御系统的程度高,从而使用于形成聚集体的多肽的聚集体的形成减少,由此使诊断信号的差异最大化。
根据本发明的另一实例,上述用于形成聚集体的多肽的单体形式为由序列表中序列1的氨基酸序列形成的β-淀粉样蛋白肽或由序列表中序列2的氨基酸序列形成的α-突触核蛋白。
根据本发明,在向作为分析对象的生物样品掺加(ⅱ)上述用于形成聚集体的多肽的疏水性缺失体的情况中,利用包含具有疏水性(hydrophobic)的氨基酸残基的用于形成聚集体的多肽的疏水性缺失体和存在于生物样品的用于形成聚集体的多肽的单体形式或多聚体形式(低聚物型)和疏水相互作用的差异,来对患者和正常人之间的诊断信号的差异进行最大化,即,借助存在于患者的生物样品的用于形成聚集体的多肽的单体形式或多聚体形式(低聚物型)和用于形成聚集体的多肽的疏水性缺失体借助疏水相互作用,来大量形成聚集体,或借助存在于正常人的生物样品的用于形成聚集体的多肽的单体形式和用于形成聚集体的多肽的疏水性缺失体可借助疏水相互作用形成聚集体,但是与患者相比形成得少,从而使患者和正常人之间的诊断信号的差异最大化。
在本说明书中术语“用于形成聚集体的多肽的疏水性缺失体”是指在用于形成聚集体的多肽的氨基酸序列中以包含多个疏水性氨基酸残基的方式使氨基酸残基缺失的衍生物,以使可借助用于形成聚集体的多肽的单体形式或多聚体形式(低聚物型)和疏水相互作用来形成聚集体。
作为用于形成聚集体的多肽的疏水性缺失体,为了用于形成聚集体的多肽的单体形式或多聚体形式(低聚物型)和疏水相互作用,可考虑长度(分子量)和/或疏水性氨基酸残基来选择,优选地,上述用于形成聚集体的多肽的疏水性缺失体为包含序列表中序列1的氨基酸序列中的第37位氨基酸残基至第42位氨基酸残基的β-淀粉样蛋白delete肽,更优选地,上述β-淀粉样蛋白delete肽为包含序列表中序列1的氨基酸序列中的第29位氨基酸残基至第42位氨基酸残基的肽,尤其优选地,上述β-淀粉样蛋白delete肽为包含序列表中序列1的氨基酸序列中的第17位氨基酸残基至第42位氨基酸残基的肽,最优选地,上述β-淀粉样蛋白delete肽为包含序列表中序列1的氨基酸序列中的第9位氨基酸残基至第42位氨基酸残基的肽。
根据本发明,在向分析对象的生物样品掺加(ⅲ)上述用于形成聚集体的多肽的单体形式或多聚体形式和上述用于形成聚集体的多肽的疏水性缺失体的情况中,均利用分别掺加上述的(ⅰ)上述用于形成聚集体的多肽的单体形式或多聚体形式及(ⅱ)上述用于形成聚集体的多肽的疏水性缺失体来实现的效果,即,利用用于抑制形成多肽的聚集体的防御系统及疏水相互作用的差异,来将患者和正常人之间的诊断信号的差异最大化。
根据本发明的再一实例,向上述步骤(a)的结果物还添加缓冲液。更优选地,相对于生物样品,添加3~15倍(v/v)的上述缓冲液,尤其优选地,添加5~13倍(v/v)的上述缓冲液,进而优选地,添加7~11倍(v/v)的上述缓冲液,进而优选地,添加8~10倍(v/v)的上述缓冲液。
在本发明中所利用的缓冲液可使用在本领域中公知的多种缓冲液,但优选地,上述缓冲液为含有非离子性表面活性剂的磷酸盐缓冲液。
作为在本发明中所利用的在磷酸盐缓冲液中含有的非离子性表面活性剂,可使用在本领域中公知的非离子性表面活性剂,优选地,包含烷氧基化烷基醚、烷氧基化烷基酯、烷基多苷、聚甘油酯、聚山梨醇酯类及多糖酯。更优选地,使用吐温-20(tween-20)或聚乙二醇辛基苯基醚(tritonx-100),最优选地,使用吐温-20。
步骤(b),还形成用于形成聚集体的多肽的聚集体
其次,本发明的方法包括:步骤(b),通过培养上述步骤(a)的结果物,来还形成上述用于形成聚集体的多肽的聚集体。
本发明的最大特征之一为如下:由于在生物样品中所要测定的用于形成聚集体的多肽的聚集体(抗原)的量非常少或用于形成聚集体的多肽的聚集体(抗原)的大小非常小,难以进行测定或在体内的用于形成聚集体的多肽的聚集体(抗原)的量和生物样品中的用于形成聚集体的多肽地聚集体(抗原)的量不成比例的情况下,通过向生物样品掺加上述的(ⅰ)上述用于形成聚集体的多肽的单体形式或多聚体形式、(ⅱ)上述用于形成聚集体的多肽的疏水性缺失体或(ⅲ)上述用于形成聚集体的多肽的单体形式或多聚体形式和上述用于形成聚集体的多肽的疏水性缺失体,来还形成用于形成聚集体的多肽的聚集体,从而可测定疾病或是否存在疾病或疾病的进行程度。
根据本发明的再一实例,在1~50℃的温度下,更优选地,在25~50℃的温度下,尤其优选地,在25~45℃的温度下,进而优选地,在25~40℃的温度下,进而优选地,在25~38℃的温度下,培养(incubation)上述步骤(a)的结果物,来还形成上述步骤(b)的用于形成聚集体的多肽的聚集体。
在本发明中,进行充分时间的上述步骤(b)的培养,使得所掺加的上述(ⅰ)上述用于形成聚集体的多肽的单体形式或多聚体形式、(ⅱ)上述用于形成聚集体的多肽的疏水性缺失体或(ⅲ)上述用于形成聚集体的多肽的单体形式或多聚体形式和上述用于形成聚集体的多肽的疏水性缺失体可借助上述生物样品进行多聚体化,更优选地,可借助上述生物样品进行多聚体化的充分的培养时间为如下充分的时间:使利用具有用于形成聚集体的多肽的多聚体形式参与的疾病的人类的生物样品来产生的信号比利用正常人类的生物样品来产生的信号大1.5~20倍。
根据本发明的另一实例,在用于使利用人类的生物样品来产生的信号比利用正常人类的生物样品来产生的信号大1.5~20倍而进行充分时间的上述步骤(b)的用于形成聚集体的多肽的聚集体的进一步形成的步骤中,将上述步骤(a)的结果物培养1天至12天,更优选地,培养30小时(hr)至10天,尤其优选地,培养2天至8天,进而优选地,培养2天至6天,进而优选地,培养3天至6天,最优选地,培养4天至6天,最优选地培养5天至6天。
在本说明书中,术语“培养”是指在恒定的温度下,使分析对象的生物样品规定时间保持站立(kepttostand)或进行摇动(shaking),在摇动的情况下,优选地,指轻微摇动(mildshaking)。
本发明的最大特征之一中的另一个为在恒定的温度下,通过将生物样品站立(即,培养),来使存在于生物样品的经掺加的用于形成聚集体的多肽的单体形式(多聚体形式)和/或上述用于形成聚集体的多肽的疏水性缺失体和用于形成聚集体的多肽相互聚集(aggregation)得好,从而将患者和正常人之间的诊断信号的差异最大化。
步骤(c),上述用于形成聚集体的多肽的聚集体相结合的结合剂-标志物与上述步骤(b)的结果物相接触
并且,本发明的方法包括步骤(c),使结合剂-标志物与上述步骤(b)的结果物相接触,上述结合剂-标志物由信号产生标志物和与上述用于形成聚集体的多肽的聚集体相结合的结合剂结合而成。
在本发明中,与上述用于形成聚集体的多肽的聚集体相结合的结合剂为抗体,肽适体、adnectin、affibody(美国专利第5831012号)、avimer(silverman,j.etal,naturebiotechnology23(12):1556(2005))或kunitz结构域(kunitzdomain,arnouxbetal.,actacrystallogr.dbiol.crystallogr.58(pt7):12524(2002))及nixon,ae,currentopinionindrugdiscovery&development9(2):2618(2006))。
在本发明中,与上述用于形成聚集体的多肽的聚集体进行结合的结合剂相结合的信号产生标志物包含化合物标志物(例如,生物素)、酶标志物(例如,碱性磷酸酶、过氧化物酶、β-半乳糖苷酶及β-葡糖苷酶)、放射性标志物(例如,i125及c14)、荧光标志物(例如,荧光素)、发光标志物、化学发光标志物及荧光共振能量转移标志物(fret,fluorescenceresonanceenergytransfer),但并不限定于此。
步骤(d),对从与上述用于形成聚集体的多肽的聚集体结合而成的结合剂-标志物产生的信号进行检测
最后,本发明的方法包括:步骤(d),检测从与上述用于形成聚集体的多肽的聚集体结合而成的结合剂-标志物产生的信号。
对从与上述用于形成聚集体的多肽的聚集体结合而成的结合剂-标志物产生的信号进行检测的步骤可通过在本领域中公知的多种方法进行,例如,可利用与抗原-抗体反应相关的免疫分析法来进行。
根据本发明的另一实例,通过包括如下步骤的方法来进行上述步骤(c)及步骤(d):步骤(c-1),使上述步骤(b)的结果物与用于对捕获(capturing)上述聚集体的上述用于形成聚集体的多肽上的表位进行识别的捕获抗体相接触;步骤(c-2),使上述捕获的聚集体与用于对上述用于形成聚集体的多肽上的表位进行识别的检测抗体相接触;以及步骤(c-3),对聚集体-检测抗体复合体进行检测。
这种检测方法利用两种形态的抗体,即,利用捕获抗体及检测抗体。在本说明书中,术语“捕获抗体”是指可与所要检测的用于形成聚集体的多肽相结合的抗体。术语“检测抗体”是指可与通过上述捕获抗体捕获的用于形成聚集体的多肽相结合的抗体。“抗体”是指可与抗原相结合的免疫球蛋白。在本说明书中所利用的抗体不仅包含所要检测的表位、抗原或可与抗原片段相结合的总抗体,而且包含抗体片段(例如,f(ab’)2,fab’,fab,fv)。
作为上述检测方法,利用对用于形成聚集体的多肽上的表位进行特异性识别的一套的捕获抗体及检测抗体,上述捕获抗体及检测抗体特异性识别的上述表位相同或重迭。
在提及与捕获抗体及检测抗体相关的表位而使用的术语“重迭(overlappedwith)”包括完全重迭或部分重迭的氨基酸序列的表位。例如,与6e10、ff51及wo2抗体有关的表位具有分别由人类β-淀粉样蛋白肽序列的氨基酸3~8及氨基酸4~10形成的氨基酸序列。与6e10及ff51抗体有关的表位具有分别由人类β-淀粉样蛋白肽序列的氨基酸3~8及氨基酸1~4形成的氨基酸序列,与1e11及wo2抗体有关的表位具有分别由人类β-淀粉样蛋白肽序列的氨基酸1~8及氨基酸4~10形成的氨基酸序列,与1e11及ff51抗体有关的表位具有分别由氨基酸1~8及氨基酸1~4形成的氨基酸序列。这种表位可利用完全重迭的表位进行说明。
并且,与3b6及3b6生物素(biotin)抗体有关的表位为由α-突触核蛋白蛋白序列的119~140形成的序列。
根据本发明的再一实例,在提及人类β-淀粉样蛋白肽序列而表述的情况下,上述表位具有由氨基酸1~8、氨基酸3~8、氨基酸1~4或氨基酸4~10形成的氨基酸序列,在提及α-突触核蛋白蛋白质序列而表述的情况下,上述表位具有由氨基酸119~140形成的氨基酸序列。
根据本发明的另一实例,上述捕获抗体识别的表位为在上述用于形成聚集体的多肽中不反复的序列,上述检测抗体识别的表位是在上述用于形成聚集体的多肽中不反复的序列。根据本发明的检测方法,与捕获抗体相结合的用于形成聚集体的多肽不能再次与检测抗体相结合,这是因为不存在检测抗体识别的追加的表位。
根据本发明的再一实例,上述捕获抗体及检测抗体相同。即,优选地,与捕获抗体及检测抗体进行特异性结合的表位相同。
根据本发明的另一实例,上述捕获抗体与固体基质相结合。这种形态的公知的物质包含如聚苯乙烯、聚丙烯、玻璃、金属及凝胶等烃类聚合物。上述固体基质能够以试纸条、微teeter板、粒子(例如,微珠)、亲和性柱及免疫印迹膜(例如,聚偏氟乙烯膜)形态存在(参照:美国专利第5143825号、第5374530号、第4908305号及第5498551号)。
根据本发明的再一实例,上述检测抗体具有生成可检测的信号的标志物。上述标志物包含:化合物标志物(例如,生物素);酶标志物(例如,碱性磷酸酶、过氧化物酶、β-半乳糖苷酶及β-葡糖苷酶);放射性标志物(例如,i125及c14),荧光标志物(例如,荧光素)、发光标志物、化学发光标志物及荧光共振能量转移标志物,但并不限定于此。在本领域中公知用于标志物抗体的多种标志物及方法(harlowandlane,eds.antibodies:alaboratorymanual(1988)coldspringharborlaboratorypress,coldspringharbor,n.y.)。
在本发明中,针对于可与用于形成聚集体的多肽相结合的抗体,可根据融合方法(kohlerandmilstein,europeanjournalofimmunology,6:511-519(1976))、重组脱氧核糖核酸(dna)方法(美国专利第481656号或噬菌体抗体图书馆(clacksonetal,nature,352:624-628(1991);及marksetal,j.mol.biol.,222:58,1-597(1991))等现有技术,可利用之前记载的表位作为免疫原来准备。在harlow,e.andlane,d.,antibodies:alaboratorymanual,coldspringharborpress,newyork,1988;zola,h.,monoclonalantibodies:amanualoftechniques,crcpress,inc.,bocaraton,florida,1984;及coligan,currentprotocolsinimmunology,wiley/greene,ny,1991中记载有用于制备上述抗体的通常的方法。
用于制备单克隆抗体的杂交细胞株的准备步骤通过生产无线增值细胞株(immortalcellline)及抗体的淋巴细胞的融合而进行。上述单克隆抗体的制备可利用在本领域中公知的技术来进行。作为多克隆抗体,可向适合的动物注入上述的抗原,并收集包含抗体的抗血清后,根据通过公知的亲和性技术分离抗体的方法制备。
聚集体-检测抗体复合体的检测步骤可利用本领域的公知的方法进行。聚集体-检测抗体复合体的形成呈现在生物样品中聚集体的存在。上述步骤可根据现有的方法,例如,如在enzymeimmunoassay,e.t.maggio,ed.,crcpress,bocaraton,florida,1980及harlowandlane,eds.antibodies:alaboratorymanual(1988)coldspringharborlaboratorypress,coldspringharbor,n.y中记载,利用多种可检测的标志物/基质对,来以定量或定性的方式进行。
在将上述检测抗体作为碱性磷酸酶进行标志物的情况下,可利用5-溴-4-氯-3-吲哚基-磷酸盐(bcip)、氯化硝基四氮唑蓝(nbt)及细胞外液(ecf)作为用于显色反应的基质。在利用辣根过氧化物酶标志物的情况下,作为基质,利用氯萘酚、氨基-乙基咔唑、二氨基联苯胺、d-荧光素、光泽精(硝酸双-n-甲基吖啶翁)、试卤灵苄基酸酯、鲁米诺、armflex红试剂(10-乙酰基-3,7-二羟基吩恶嗪)、3,3’,5,5’-四甲基联苯胺(tmb)、增强化学发光(ecl,enhancedchemiluminescence)及联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(abts)等。
通过这种方法,可使利用具有用于形成聚集体的多肽的多聚体形式参与的疾病的人类的生物样品来产生的信号比利用正常人类的生物样品来产生的信号大1.5~20倍,更优选地,大1.5~10倍,尤其优选地,大1.6~10倍。
根据本发明的再一实施方式,本发明提供如下用于检测生物样品的用于形成聚集体的多肽的聚集体的试剂盒,即,包含:(ⅰ)上述用于形成聚集体的多肽的单体形式或多聚体形式、(ⅱ)上述用于形成聚集体的多肽的疏水性缺失体或(ⅲ)上述用于形成聚集体的多肽的单体形式或多聚体形式和上述用于形成聚集体的多肽的疏水性缺失体。
本发明的试剂盒利用对上述的本发明的生物样品的用于形成聚集体的多肽的聚集体进行检测的方法,为了避免说明书的过度的复杂性,对两者之间共同的内容省略其记载。
根据本发明的再一实例,上述试剂盒还包含:捕获抗体,用于对用于形成聚集体的多肽上的表位进行识别;以及检测抗体,用于对由上述捕获抗体识别的上述表位进行识别。
发明的效果
对本发明的特征及优点进行概括如下:
(a)本发明提供生物样品的用于形成聚集体的多肽的聚集体的检测方法或试剂盒。
(b)在本发明的方法中,由于在生物样品中所要测定的用于形成聚集体的多肽的聚集体(抗原)的量非常少或用于形成聚集体的多肽的聚集体(抗原)的大小非常小,难以进行测定或在人体内的用于形成聚集体的多肽的聚集体(抗原)的量和生物样品中的用于形成聚集体的多肽的聚集体(抗原)的量不成比例的情况下,利用抑制形成多肽的聚集体的防御系统和/或疏水相互作用的差异,来将患者和正常人之间的诊断信号的差异最大化。
(c)本发明能够以便利且迅速的方式进行,这是能够实现生物样品的用于形成聚集体的多肽的聚集体的检测方法的自动化。
附图说明
图1a表示掺加rec.β-淀粉样蛋白1-42后,基于4天的培养时间的β-淀粉样蛋白低聚物的变化。
图1b表示掺加rec.β-淀粉样蛋白1-42后,基于6天的培养时间的β-淀粉样蛋白低聚物的变化。
图1c表示掺加rec.β-淀粉样蛋白1-42后,基于2天、3天、4天、5天的培养时间的β-淀粉样蛋白低聚物的变化。
图1d表示未掺加rec.β-淀粉样蛋白1-42后培养5天,未添加rec.β-淀粉样蛋白1-42后培养0天、5天后的β-淀粉样蛋白低聚物的变化。
图2a表示掺加rec.β-淀粉样蛋白9-42生物素后培养6天后的β-淀粉样蛋白低聚物的变化。
图2b表示掺加与β-淀粉样蛋白捆绑的rec.β-淀粉样蛋白9-42后培养2天、3天、4天后的β-淀粉样蛋白低聚物的变化。
图3表示掺加重组α-突触核蛋白后,培养0天、2天、4天、6天的基于时间的增加的α-突触核蛋白低聚物的变化。
具体实施方式
以下,通过实施例更详细地说明本发明。这些实施例只用于更详细地说明本发明,根据本发明的要旨,本发明的范围并不限制于这些实施例,这对于本发明所属技术领域的普通技术人员来说是显而易见的。
实施例
实施例1:实验材料的准备
从西格马(sigma)公司购买了碳酸盐缓冲液(carbonate-bicarbonatebuffer)、磷酸盐吐温缓冲液(pbst)、tbst及磷酸盐缓冲液(pbs)。从伯乐(bio-rad)公司购买了blockace。在tbst中将blockace稀释为0.4%来制备缓冲液a。以在d.w中稀释1%的blockace的方式制备封闭液(blockingbuffer)。从抗体(biolegend)公司购买了6e10抗体。从novusbiologicals公司购买了3b6。从novusbiologicals公司购买3b6-生物素抗体后在peoplebio公司进行生物素化(biotinylation)。从thermoscientific公司购买了链霉亲和素(streptavidin)-辣根过氧化物酶(hrp)。从scantibodieslaboratory公司购买了hbr1。从株式会社thehlab公司购买了ff51-辣根过氧化物酶(ff51-hrp)。从biolegend公司购买了重组(recombinant)β-淀粉样蛋白1-42。从anaspec公司购买了重组β-淀粉样蛋白9-42生物素。从anaspec公司购买了重组β-淀粉样蛋白9-42。从密理博(milipore)公司购买了重组α-突触核蛋白。从首尔大学盆唐医院及中央大学医院接收血浆样品。从罗克兰(rockland)公司购买了增强化学发光溶液。从nunc公司购买了板。与6e10及ff51抗体有关的表位具有分别由人类β-淀粉样蛋白肽的氨基酸3~8及氨基酸1~4形成的氨基酸序列。与3b6及3b6生物素抗体有关的表位是由α-突触核蛋白蛋白质序列的119~140形成的序列。
实施例2:6e10板的制备
在10ml的碳酸盐缓冲液(西格玛公司)中稀释30μg的6e10抗体(抗β-淀粉样蛋白蛋白质,biolegend公司),在板(nunc公司)中将100μl接种于各孔后,在4℃的冰箱中进行了1天的反应。在磷酸盐缓冲液中将上述板清洗3次,在d.w中接种溶解有1%的blockace的240μl的封闭液后,在常温条件下进行了2小时的反应。利用磷酸盐缓冲液将上述板清洗3次,在常温条件下干燥30分钟后使用。
实施例3:3b6板的制备
在10ml的碳酸盐缓冲液(西格玛公司)中稀释20μg的3b6抗体(抗α-突触核蛋白蛋白质,novusbiologicals公司),在板(nunc公司)中将100μl接种于各孔后,在4℃的冰箱中进行了1天的反应。在磷酸盐缓冲液中将上述板清洗3次,在d.w中接种溶解有1%的blockace的240μl的封闭液后,在常温条件下进行了2小时的反应。利用磷酸盐缓冲液将上述板清洗3次,在常温条件下干燥30分钟后使用。
实施例4:准备对照组
作为阳性对照组(positivecontrol),向10μl的重组β-淀粉样蛋白1-42(rec.β-淀粉样蛋白)(1μg/ml)添加990μl的磷酸盐吐温缓冲液来使用了100μl。作为阳性对照组(positivecontrol)在10μl的重组α-突触核蛋白(1mg/ml)添加990μl的磷酸盐吐温缓冲液来使用了100μl。作为阴性对照组(negativecontrol)使用了100μl的磷酸盐缓冲液。
实施例5:准备样品
将2样品作为基准准备了样品。在37℃的微量恒温仪(heatblock)中,将冷冻的血浆样品溶解15分钟后,进行30秒钟的涡流(vortexing),然后使用。在20μl的血浆中混合8.08μl的hbr1(0.123mg/ml)、180μl的磷酸盐吐温缓冲液及20μl的rec.β-淀粉样蛋白1-42(1ng/10μl)来准备掺加有1ng的rec.β-淀粉样蛋白1-42的样品,使得总体积为228.08μl。在20μl的血浆中混合8.08μl的hbr1(0.123mg/ml)、180μl的磷酸盐吐温缓冲液及20μl的rec.β-淀粉样蛋白9-42生物素(1ng/10μl)来准备掺加有1ng的rec.β-淀粉样蛋白9-42生物素的样品,使得总体积为228.08μl。在20μl的血浆中混合8.08μl的hbr1(0.123mg/ml)、180μl的磷酸盐吐温缓冲液及20μl的rec.β-淀粉样蛋白9-42(1ng/10μl)来准备掺加有1ng的rec.β-淀粉样蛋白9-42的样品,使得总体积为228.08μl。在20μl的血浆中混合8.08μl的hbr1(0.123mg/ml)、180μl的磷酸盐吐温缓冲液及20μl的重组α-突触核蛋白(1μg/10μl)来准备掺加有1μg的重组α-突触核蛋白的样品,使得总体积为228.08μl。并且,在20μl的血浆中混合8.08μl的hbr1(0.123mg/ml)和200μl的磷酸盐吐温缓冲液来准备未掺加重组肽的样品,使得总体积为228.08μl。
实施例6:培养(incubation)
作为在上述实施例5中通过处理rec.β-淀粉样蛋白1-42来准备的样品,在37℃培养箱中分别培养4天、6天。作为在上述实施例5中通过处理rec.β-淀粉样蛋白1-42来准备的样品,在37℃培养箱中分别培养2天、3天、4天、5天。作为未处理rec.β-淀粉样蛋白1-42的样品,在37℃的培养箱中分别培养0天、5天。并且,作为在上述实施例5中通过处理rec.β-淀粉样蛋白9-42生物素来准备的样品,培养了6天。作为在上述实施例5中通过处理rec.β-淀粉样蛋白9-42来准备的样品,分别培养了2天、3天、4天。并且,作为在上述实施例5中通过处理重组α-突触核蛋白来准备的样品,分别培养了0天、2天、4天、6天。
实施例7:在处理rec.β-淀粉样蛋白1-42后培养4天、6天的样品中利用多聚体检测系统(mds,multimerdetectionsystem)的β-淀粉样蛋白低聚物(oligomer)检测
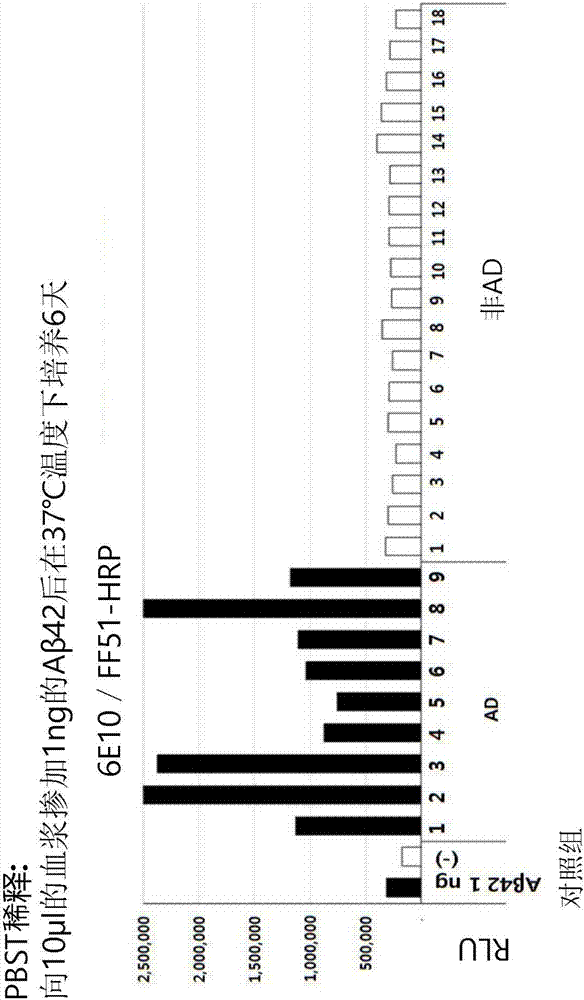
在6e10涂敷板(3μg/ml)分别接种100μl的阳性对照组及阴性对照组及处理rec.β-淀粉样蛋白1-42,来培养4天和6天的样品后,在常温条件下进行了1小时的反应。利用tbst将上述板清洗3次,并在缓冲液a中使ff51-hrp抗体稀释成1/1000来每次接种100μl后,在常温条件下进行了1小时的反应。利用tbst将上述板清洗3次后,接种了100μl的增强化学发光溶液。将与增强化学发光进行反应的板插入于luminometer仪(珀金埃尔默仪器有限公司(perkinelmer)),并测定了发光(uminescent)信号。其结果如图1a所示。
图1a和图1b示出添加rec.β-淀粉样蛋白1-42后,ad样品的信号与nonad样品的信号相比,随着培养时间而增加。示出在培养4天和6天的各个条件下ad和nonad之间的差异。
通过图1a和图1b观察,当与nonad患者样品进行比较时,在ad患者的样品中的β-淀粉样蛋白低聚物的信号呈现得高,这是判断为在ad患者样品中用于抑制形成β-淀粉样蛋白低聚物的防御系统在ad患者样品中与nonad患者相比不太活化。
实施例8:在处理rec.β-淀粉样蛋白1-42后分别培养2天、3天、4天、5天的样品中利用多聚体检测系统的β-淀粉样蛋白低聚物检测
在6e10涂敷板(3μg/ml)分别接种100μl的阳性对照组及阴性对照组及处理rec.β-淀粉样蛋白1-42,来分别培养2天、3天、4天、5天的样品后,在27℃的培养箱中以静置的状态进行了1小时的反应。利用tbst将上述板清洗3次,并在缓冲液a中使ff51-hrp抗体制备成10ng/ml来每次接种100μl。在27℃的培养箱中以静置的状态进行了1小时的反应,利用tbst将上述板清洗3次后,接种了100μl的增强化学发光溶液。将与增强化学发光进行反应的板插入于luminometer仪(珀金埃尔默仪器有限公司),并测定了发光信号。其结果如图1c所示。
图1c示出添加rec.β-淀粉样蛋白1-42后,ad样品的信号与nonad样品的信号相比,随着2天、3天、4天、5天的培养时间而增加1.15倍、1.34倍、1.65倍及1.84倍。示出ad和nonad之间的差异随着培养天数增加而逐渐变大。
通过图1c观察,当与nonad患者样品进行比较时,在ad患者的样品中的β-淀粉样蛋白低聚物的信号呈现得高,这判断为在用于抑制形成β-淀粉样蛋白低聚物的防御系统在ad患者样品中与nonad患者相比不太活化。
实施例9:在处理rec.β-淀粉样蛋白1-42后5天、无处理rec.β-淀粉样蛋白1-42后培养0天、5天的样品中利用多聚体检测系统的β-淀粉样蛋白低聚物检测
在6e10涂敷板(3μg/ml)分别接种100μl的阳性对照组及阴性对照组及处理rec.β-淀粉样蛋白1-42,来培养5天、未处理rec.β-淀粉样蛋白1-42,来分别培养0天、5天的样品后,在27℃的培养箱中以静置的状态进行了1小时的反应。利用tbst将上述板清洗3次,并在缓冲液a中使ff51-hrp抗体制备成10ng/ml来每次接种100μl。在27℃的培养箱中以静置的状态进行了1小时的反应,利用tbst将上述板清洗3次后,接种了100μl的增强化学发光溶液。将与增强化学发光进行反应的板插入于luminometer仪(珀金埃尔默仪器有限公司),并测定了发光信号。其结果如图1d所示。
图1d作为在添加rec.β-淀粉样蛋白1-42后培养5天、不添加rec.β-淀粉样蛋白1-42培养0天、5天的样品中测定β-淀粉样蛋白低聚物的数据,当掺加β-淀粉样蛋白1-42时和未掺加β-淀粉样蛋白1-42时,根据时间ad样品的信号示出nonad样品的信号的增加状态,添加rec.β-淀粉样蛋白1-42后仅在培养5天的样品中示出ad和nonad之间的差异。
通过图1d观察,在ad患者的样品中β-淀粉样蛋白低聚物的信号呈现得高,这是判断为在用于抑制形成β-淀粉样蛋白低聚物的防御系统在ad患者样品中与nonad患者相比不太活化,判断为呈现当掺加β-淀粉样蛋白1-42时与用于抑制形成β-淀粉样蛋白低聚物的防御系统有关的效果。
实施例10:在处理rec.β-淀粉样蛋白9-42生物素后培养6天的样品中利用多聚体检测系统的β-淀粉样蛋白低聚物检测
在6e10涂敷板(3μg/ml)分别接种100μl的处理阳性对照组及阴性对照组及rec.β-淀粉样蛋白9-42生物素,来培养6天的样品后,在常温条件下进行了1小时的反应。利用tbst将上述板清洗3次,并在缓冲液a中使ff51-hrp抗体稀释成1/1000来每次接种100μl后,在常温条件下进行1小时的反应。利用tbst将上述板清洗3次后,接种了100μl的增强化学发光溶液。将与增强化学发光进行反应的板插入于luminometer仪(珀金埃尔默仪器有限公司),并测定了发光信号。其结果整理于图2a所示。
图2a示出当掺加与β-淀粉样蛋白进行捆绑的rec.β-淀粉样蛋白9-42生物素来培养6天时,ad患者组的信号与正常组的信号相比高。
通过图2a观察,判断为rec.β-淀粉样蛋白9-42生物素与β-淀粉样蛋白进行捆绑,来促进聚集,从而借助抗原的数量部分和大小部分的变化来进行区分。
实施例11:在处理rec.β-淀粉样蛋白9-42生物素后培养2天、3天、4天的样品中利用多聚体检测系统的β-淀粉样蛋白低聚物检测
在6e10涂敷板(3μg/ml)分别接种100μl的处理阳性对照组及阴性对照组及rec.β-淀粉样蛋白9-42,来培养2天、3天、4天的样品后,在27℃的培养箱中以静置的状态进行了1小时的反应。利用tbst将上述板清洗3次,并在缓冲液a中使ff51-hrp抗体制备成10ng/ml来每次接种100μl。在27℃的培养箱中以静置的状态使上述板反应1小时,利用tbst将上述板清洗3次后,接种了100μl的增强化学发光溶液。将与增强化学发光进行反应的板插入于luminometer仪(珀金埃尔默仪器有限公司),并测定了发光信号。其结果整理于图2b所示。
图2b示出当掺加与β-淀粉样蛋白进行捆绑的rec.β-淀粉样蛋白9-42生物素来培养2天、3天、4天时,ad患者组的信号与正常组的信号相比,随着时间增加1.1倍、1.52倍、1.84倍。
通过图2b观察,判断为rec.β-淀粉样蛋白9-42生物素与β-淀粉样蛋白进行捆绑,来促进聚集,从而借助抗原的数量部分和大小部分的变化来进行区分。
实施例12:在处理重组α-突触核蛋白后培养0天、2天、4天、6天的样品中利用多聚体形式检测系统的α-突触核蛋白低聚物检测
在3b6涂敷板(2μg/ml)分别接种100μl的处理阳性对照组及阴性对照组及重组α-突触核蛋白,来培养0天、2天、4天、6天的样品后,在27℃的培养箱中以静置的状态进行了1小时的反应。利用tbst将上述板清洗3次,并在缓冲液a中使3b6-生物素抗体制备成2μg/ml来每次接种100μl。在27℃的培养箱中以静置的状态使上述板反应1小时,利用tbst将上述板清洗3次。在缓冲液a中将链霉亲和素-辣根过氧化物酶稀释成1/5000来每次接种100μl后,在27℃的培养箱中以静置的状态使上述板反应1小时,利用tbst将上述板清洗3次。接种了100μl的增强化学发光溶液。作为与增强化学发光进行反应的板插入于luminometer仪(珀金埃尔默仪器有限公司),并测定了发光信号。其结果整理于图3所示。
图3作为示出掺加重组α-突触核蛋白后,培养0天、2天、4天、6天,随着时间增加pd样品的信号与nonpd信号的变化的数据,当培养0天时,示出与nonpd信号相比pd样品的信号的比例(ratio)为0.92倍,当培养2天、4天、6天时示出增加1.34倍、1.76倍、1.78倍。
通过图3观察,当与nonpd患者样品进行比较时,在pd患者的样品中α-突触核蛋白的信号高,这是判断为在用于抑制形成α-突触核蛋白低聚物的防御系统在pd患者样品中与nonad患者相比不太活化。
以上,对本发明的特定部分进行了详细说明,就本发明所属技术领域的普通技术人员来说,这种详细说明只属于优选实例,本发明的范围并不局限于此,这是显而易见的。因此,本发明的实质性的范围应根据所附的发明要求保护范围和其等同技术方案来定义。
- 还没有人留言评论。精彩留言会获得点赞!