一种双硒多肽及其制备方法与流程
本发明属于有机硒制备领域,具体涉及一种双硒多肽及其制备方法。
背景技术:
硒,被国内外营养学界和医药界尊称为“生命的火种”,素有“天然解毒剂”、“抗癌之王”、“长寿元素”、“心脏守护神”之称。它在人体组织内的含量虽然仅为千万分之一,但是对于人类健康有着其他物质无法替代的巨大作用,直接关系到生命的存在。"硒"是人体必需的,又不能自制,因此世界卫生组织建议每天补充200μg硒,可有效预防多种疾病的高发。
补硒主要分为自然补硒和人工补硒。自然补硒:食取野生、天然的硒含量高的自然生长的食品等,补充的为有机硒,相对于无机硒其毒性有所降低,更有益于人体健康吸收。人工补硒:摄取人工添加的各类补硒产品主要分为无机硒和有机硒两类。无机硒主要为亚硒酸钠,有很大的毒性。有机硒与无机硒相比,具有食用安全、无毒副作用、吸收利用率高、营养价值高、生物活性强等优点。
硒是生物体必需的微量元素之一。具有抗脂质过氧化、保护生物膜的作用。缺硒会导致许多疾病如克山病、糖尿病、心血管疾病、白内障、肿瘤、易衰老等。因此,硒在人类防癌抗癌、抗衰老、抗氧化、预防和治疗心血管疾病、克山病和大骨节病等方面起到了重要的作用,微量元素硒与生物体,特别是与人体健康的关系,已经引起了人 们极大的兴趣。动物饲料中硒摄入量为0.1~0.2mg·kg‐1,低于0.05mg·kg‐1就会出现硒缺乏症。适量补硒对提高机体免疫能力、调节机体对自由基的防御功能、抑制衰老、预防疾病等均有重要意义。硒以无机和有机两种形式存在,同其他微量元素一样,动物对于无机硒和有机硒的利用率差别很大。有机硒会主动穿过肠壁,能有效地把硒元素贮存、积累在靶组织内,供机体利用,而无机硒则被动地扩散通过肠壁,具有强的助氧化作用,对脂肪造成氧化性应激而自我抵消,产生毒副作用,人体对其吸收和利用率低。正是因为无机硒化合物的毒性大、活性低,应用受到限制,因此开发有机硒、寻找生物活性高且毒性小的有机硒化合物并成为补硒剂非常必要。制备双硒多肽复合物能够起到补硒的作用,有养颜,预防心血管疾病、肿瘤、白内障、糖尿病、类风湿关节炎等疾病。此发明对促进人体的健康有着重要的意义。作为一种高效安全的补硒剂,其良好的生物学特性,使双硒多肽复合物有着更大的使用价值。
技术实现要素:
为了解决上述问题,本发明提供所述制备方法是以一种双硒多肽的制备方法,所述制备方法是以低分子生物活性多肽为原料,进行巯基化修饰后除去乙酰基,再和硒元素螯合,采用水体系合成法制成双硒多肽;
进一步地,所述制备方法包括:
S1:以生物活性多肽和吗啉丙磺酸缓冲液为原料,所述生物活性多肽与吗啉丙磺酸缓冲液的质量比为1:(5~10),反应温度为20~35 ℃,在搅拌条件下反应0.5~1.5h,同时加入0.5~2mol/L的碱液以控制反应液的pH值为6.0~8.0;
S2:加入S‐乙酰巯基丁二酸酐,所述S‐乙酰巯基丁二酸酐与S1中原料生物活性多肽的质量比为1:(1~4),反应温度为20~35℃,在搅拌条件下反应1.5~5h,同时加入0.5~2mol/L的碱液以控制反应液的pH值为6.0~8.0,对反应液体用凝胶层析纯化后除去多余的盐及杂质;
S3:将S2纯化后的溶液中加入25ml 0.01mol/L的pH为7.3的盐酸羟胺,同时通氮气,反应1~3h,去除复合物中的乙酰基,对反应液体用凝胶层析纯化后除去多余的盐及杂质;
S4:S3纯化处理后的液体中加入硒元素,所述硒元素与S1中原料生物活性多肽的质量比为1:(1~4),反应1~3h,对反应液体用凝胶层析纯化后除去多余的盐及杂质;
S5:S4反应结束后,对反应液进行真空冷冻干燥处理,得到双硒多肽;
进一步地,S1中所述的生物活性多肽为直接从正常山羊肝脏提取的一种低分子生物活性多肽;
进一步地,S1中所述的吗啉丙磺酸缓冲液为3‐吗啉‐丙磺酸或2‐吗啉‐丙磺酸;
进一步地,S1和S2中所述的碱液包括氢氧化钠溶液、氢氧化钾溶液和氢氧化钡溶液;
进一步地,S4中所述的硒元素为亚硒酸钠;
进一步地,一种双硒多肽,所述双硒多肽是由生物活性多肽与硒元素结合后,生成一个双硒连接的多肽链,多肽链与巯基之间通过酰胺键连接,形成的双硒多肽的复合物;
本发明的有益效果如下:本发明所涉及的一种双硒多肽是将硒元素与生物活性多肽结合起来制成的功能性食品,以山羊肝脏直接提取的生物活性多肽经过巯基化修饰和亚硒酸钠为原料,采用水体系合成法制成,具有稳定性良好、生物学效价高、能直接被肠道粘膜吸收从而真正实现高吸收的优势,而且使硒在生物活性多肽的结合下制成有机双硒抗癌剂,最终达到抗癌的目的
附图说明
图1为本发明中生物活性多肽的曲线;
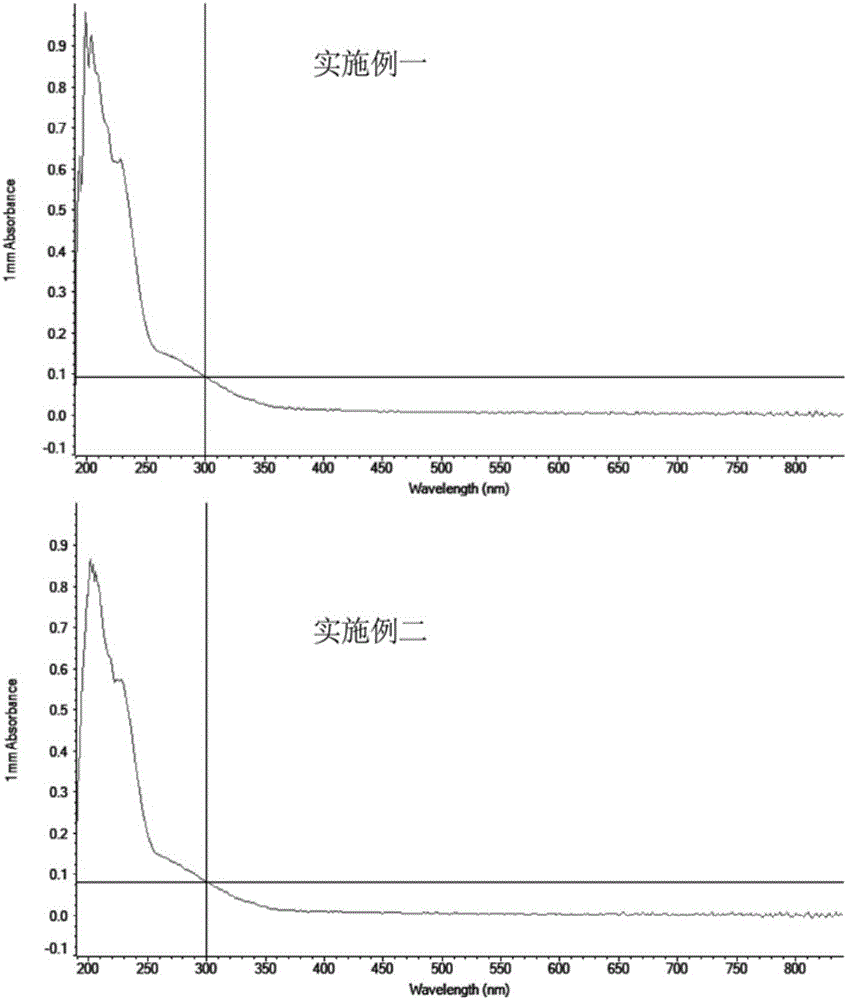
图2为本发明实施例1和实施例2中双硒多肽的紫外吸收曲线;
图3为本发明实施例3和实施例4中双硒多肽的紫外吸收曲线;
图4为本发明实施例5和实施例6中双硒多肽的紫外吸收曲线;
图5为本发明中生物活性多肽的红外吸收曲线;
图6为本发明实施例一、实施例二、实施例三、实施例四、实施例五和实施例六中的双硒多肽的红外吸收曲线;
图7为本发明实施例一、实施例二、实施例三、实施例四、实施例五和实施例六中的双硒多肽的核磁共振氢谱图;
图8为本发明生物活性多肽对人肺癌A549细胞抑制作用的细胞形态图,图中A为RPMI‐1640培养基,图中a为RPMI‐1640培养基对照组,图中B为正常生物活性多肽对人肺癌A549细胞作用24小时后 的细胞形态图,图中b为正常生物活性多肽对人肺癌A549细胞作用24小时后的细胞形态图对照组。
图9为双硒多肽对人肺癌A549细胞抑制作用的细胞形态图,图中C为实施例一对人肺癌A549细胞作用24小时后的细胞形态图,图中D为实施例三对人肺癌A549细胞作用24小时后的细胞形态图,图中E为实施例六对人肺癌A549细胞作用24小时后的细胞形态图,图中c为实施例一对人肺癌A549细胞作用24小时后的细胞形态图对照组,图中d为实施例三对人肺癌A549细胞作用24小时后的细胞形态图对照组,图中e为实施例六对人肺癌A549细胞作用24小时后的细胞形态图对照组。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细描述。应当理解,此处所描述的具体实施例仅仅用于解释本发明,并不用于限定本发明。相反,本发明涵盖任何由权利要求定义的在本发明的精髓和范围上做的替代、修改、等效方法以及方案。进一步,为了使公众对本发明有更好的了解,在下文对本发明的细节描述中,详尽描述了一些特定的细节部分。对本领域技术人员来说没有这些细节部分的描述也可以完全理解本发明。
下面结合附图和具体实施例对本发明作进一步说明,但不作为对本发明的限定。下面为本发明的举出最佳实施例:
如图1‐图9所示,本发明提供一种双硒多肽的制备方法,所述制备方法是以一种低分子生物活性多肽为原料,进行巯基化修饰后除去乙酰基,再和硒元素螯合,采用水体系合成法制成双硒多肽,所述制备方法包括:
S1:以生物活性多肽和吗啉丙磺酸缓冲液为原料,所述生物活性多肽与吗啉丙磺酸缓冲液的质量比为1:(5~10),反应温度为20~35℃,在搅拌条件下反应0.5~1.5h,同时加入0.5~2mol/L的碱液以控制反应液的pH值为6.0~8.0,所述生物活性多肽为直接从正常山羊肝脏提取的一种低分子生物活性多肽,所述吗啉丙磺酸缓冲液为3‐吗啉‐丙磺酸或2‐吗啉‐丙磺酸;
S2:加入S‐乙酰巯基丁二酸酐,所述S‐乙酰巯基丁二酸酐与S1中原料生物活性多肽的质量比为1:(1~4),反应温度为20~35℃,在搅拌条件下反应1.5~5h,同时加入0.5~2mol/L的碱液以控制反应液的pH值为6.0~8.0,对反应液体用凝胶层析纯化后除去多余的盐及杂质;
S3:将S2纯化后的溶液中加入25ml 0.01mol/L的pH为7.3的盐酸羟胺,同时通氮气,反应1~3h,去除复合物中的乙酰基,对反应液体用凝胶层析纯化后除去多余的盐及杂质;
S4:S3纯化处理后的液体中加入硒元素,所述硒元素与S1中原料生物活性多肽的质量比为1:(1~4),反应1~3h,对反应液体用凝胶层析纯化后除去多余的盐及杂质,所述的硒元素为亚硒酸钠;
S5:S4反应结束后,对反应液进行真空冷冻干燥处理,得到双硒多肽。
S1和S2中所述的碱液包括氢氧化钠溶液、氢氧化钾溶液和氢氧化钡溶液。
一种双硒多肽,由上述制备方法制的,所述双硒多肽是由生物活性多肽与硒元素结合后,生成一个双硒连接的多肽链,多肽链与巯基之间通过酰胺键连接,形成的双硒多肽的复合物。
图1中横轴为波长(Wavelength:nm),纵轴为吸光(Absorbance),图2中横轴为波长(cm‐1),纵轴为透过率(%),图3中横轴为化学位移δ(ppm),纵轴为信号强度。
实施例1:
S1:以生物活性多肽和3‐吗啉‐丙磺酸缓冲液为原料,生物活性多肽与3‐吗啉‐丙磺酸缓冲液的质量比为1:5,反应温度为20℃,在搅拌条件下反应0.5h,同时加入0.5mol/L的氢氧化钠以控制反应液的pH值为6.0;
S2:以上反应结束后,加入S‐乙酰巯基丁二酸酐,生物活性多肽与S‐乙酰巯基丁二酸酐的质量比为1:1,反应温度为20℃,在搅拌条件下反应1.5h,同时加入0.5mol/L的氢氧化钠以控制反应液的pH值为6.0;对反应液体用凝胶层析纯化后除去多余的盐及杂质。
S3:将上述纯化后的溶液中加入25ml 0.01mol/L的pH为7.3的盐酸羟胺,同时通氮气,反应1h,去除复合物中的乙酰基。对反应 液体用凝胶层析纯化后除去多余的盐及杂质。
S4:上述纯化处理后的液体中加入硒元素,生物活性多肽与亚硒酸钠的质量比为1:4,反应1h。对反应液体用凝胶层析纯化后除去多余的盐及杂质。
S5:以上反应结束后,对反应液进行真空冷冻干燥处理,得到双硒多肽。
实施例2:
S1:以生物活性多肽和2‐吗啉‐丙磺酸缓冲液为原料,生物活性多肽与2‐吗啉‐丙磺酸缓冲液的质量比为1:6,反应温度为35℃,在搅拌条件下反应1.5h,同时加入2mol/L的氢氧化钾以控制反应液的pH值为8.0;
S2:以上反应结束后,加入S‐乙酰巯基丁二酸酐,生物活性多肽与S‐乙酰巯基丁二酸酐的质量比为1:2,反应温度为35℃,在搅拌条件下反应5h,同时加入2mol/L的氢氧化钾以控制反应液的pH值为8.0;对反应液体用凝胶层析纯化后除去多余的盐及杂质。
S3:将上述纯化后的溶液中加入25ml 0.01mol/L的pH为7.3的盐酸羟胺,同时通氮气,反应3h,去除复合物中的乙酰基。对反应液体用凝胶层析纯化后除去多余的盐及杂质。
S4:上述纯化处理后的液体中加入硒元素,生物活性多肽与亚硒酸钠的质量比为1:3,反应3h。对反应液体用凝胶层析纯化后除去多余的盐及杂质。
S5:以上反应结束后,对反应液进行真空冷冻干燥处理,得到双硒多肽。
实施例3:
S1:以生物活性多肽和3‐吗啉‐丙磺酸缓冲液为原料,生物活性多肽与3‐吗啉‐丙磺酸缓冲液的质量比为1:7,反应温度为20℃,在搅拌条件下反应0.5h,同时加入0.5mol/L的氢氧化钡以控制反应液的pH值为6.0;
S2:以上反应结束后,加入S‐乙酰巯基丁二酸酐,生物活性多肽与S‐乙酰巯基丁二酸酐的质量比为1:3,反应温度为20℃,在搅拌条件下反应1.5h,同时加入1mol/L的氢氧化钡以控制反应液的pH值为6.0;对反应液体用凝胶层析纯化后除去多余的盐及杂质。
S3:将上述纯化后的溶液中加入25ml 0.01mol/L的pH为7.3的盐酸羟胺,同时通氮气,反应1h,去除复合物中的乙酰基。对反应液体用凝胶层析纯化后除去多余的盐及杂质。
S4:上述纯化处理后的液体中加入硒元素,生物活性多肽与亚硒酸钠的质量比为1:2,反应1h。对反应液体用凝胶层析纯化后除去多余的盐及杂质。
S5:以上反应结束后,对反应液进行真空冷冻干燥处理,得到双硒多肽。
实施例4:
S1:以生物活性多肽和2‐吗啉‐丙磺酸缓冲液为原料,生物活性 多肽与2‐吗啉‐丙磺酸缓冲液的质量比为1:8,反应温度为35℃,在搅拌条件下反应1.5h,同时加入2mol/L的氢氧化钠以控制反应液的pH值为8.0;
S2:以上反应结束后,加入S‐乙酰巯基丁二酸酐,生物活性多肽与S‐乙酰巯基丁二酸酐的质量比为1:4,反应温度为35℃,在搅拌条件下反应5h,同时加入2mol/L的氢氧化钠以控制反应液的pH值为8.0;对反应液体用凝胶层析纯化后除去多余的盐及杂质。
S3:将上述纯化后的溶液中加入25ml 0.01mol/L的pH为7.3的盐酸羟胺,同时通氮气,反应3h,去除复合物中的乙酰基。对反应液体用凝胶层析纯化后除去多余的盐及杂质。
S4:上述纯化处理后的液体中加入硒元素,生物活性多肽与亚硒酸钠的质量比为1:1,反应3h。对反应液体用凝胶层析纯化后除去多余的盐及杂质。
S5:以上反应结束后,对反应液进行真空冷冻干燥处理,得到双硒多肽。
实施例5:
S1:以生物活性多肽和2‐吗啉‐丙磺酸缓冲液为原料,生物活性多肽与2‐吗啉‐丙磺酸缓冲液的质量比为1:9,反应温度为30℃,在搅拌条件下反应1h,同时加入1.5mol/L的氢氧化钾以控制反应液的pH值为7;
S2:以上反应结束后,加入S‐乙酰巯基丁二酸酐,生物活性多肽 与S‐乙酰巯基丁二酸酐的质量比为1:2,反应温度为30℃,在搅拌条件下反应4h,同时加入1.5mol/L的氢氧化钾以控制反应液的pH值为8;对反应液体用凝胶层析纯化后除去多余的盐及杂质。
S3:将上述纯化后的溶液中加入25ml 0.01mol/L的pH为7.3的盐酸羟胺,同时通氮气,反应2h,去除复合物中的乙酰基。对反应液体用凝胶层析纯化后除去多余的盐及杂质。
S4:上述纯化处理后的液体中加入硒元素,生物活性多肽与亚硒酸钠的质量比为1:3,反应2h。对反应液体用凝胶层析纯化后除去多余的盐及杂质。
S5:以上反应结束后,对反应液进行真空冷冻干燥处理,得到双硒多肽。
实施例6:
S1:以生物活性多肽和2‐吗啉‐丙磺酸缓冲液为原料,生物活性多肽与2‐吗啉‐丙磺酸缓冲液的质量比为1:10,反应温度为35℃,在搅拌条件下反应1.5h,同时加入2mol/L的氢氧化钡以控制反应液的pH值为8.0;
S2:以上反应结束后,加入S‐乙酰巯基丁二酸酐,生物活性多肽与S‐乙酰巯基丁二酸酐的质量比为1:4,反应温度为20℃,在搅拌条件下反应1.5h,同时加入0.5mol/L的氢氧化钡以控制反应液的pH值为7.0;对反应液体用凝胶层析纯化后除去多余的盐及杂质。
S3:将上述纯化后的溶液中加入25ml 0.01mol/L的pH为7.3的 盐酸羟胺,同时通氮气,反应1h,去除复合物中的乙酰基。对反应液体用凝胶层析纯化后除去多余的盐及杂质。
S4:上述纯化处理后的液体中加入硒元素,生物活性多肽与亚硒酸钠的质量比为1:2,反应1h。对反应液体用凝胶层析纯化后除去多余的盐及杂质。
S5:以上反应结束后,对反应液进行真空冷冻干燥处理,得到双硒多肽。
对以上实施例的产物进行紫外光谱分析、红外光谱分析、核磁共振分析、细胞实验和硒元素含量测定,其分析结果如下:
1、双硒多肽的紫外光谱分析:
图1(生物活性多肽),图2(实施例一和实施例二),图3(实施例三和实施例四)和图4(实施例五和实施例六)中显示,与纯生物活性多肽的最大吸收峰(λmax=206nm)相比,双硒多肽的最大吸收峰(λmax=210~220nm)向长波方向移动了4~14nm,且最大吸收峰的高度明显增加。且在吸收波长为210~220nm范围内,存在两处高的吸收峰,分别代表-RCONHR′中-C=O和-NH,-OH的特征吸收峰,说明可能在生物活性多肽巯基化后去乙酰化后产物中有仲酰胺官能团的形成。
2、双硒多肽的红外光谱分析如图5(生物活性多肽)和图6(实施例一、二、三、四、五和六)所示,具体分析结果为:图6与图5图谱区分非常明显,说明图6是生成一种新的物质,且不同于生物活性多肽:图6中,535cm-1和640cm-1是Se-Se键的振动峰, 736.8cm-1,721cm-1和775cm-1则归属于C-Se键的吸收峰。2336cm-1是硒元素的独特吸收峰。且在2600cm-1是-SH的特征吸收峰。同时3391cm-1,1585.5cm-1和1406.2cm-1是仲酰胺的特征吸收峰,且不同于图5,吸收强度增强。以上结果可能说明生物活性多肽与硒元素结合后,生成一个双硒连接的多肽链,而且多肽链与巯基之间通过酰胺键连接,形成一个双硒多肽的复合物。
3、双硒多肽的核磁共振1HNMR分析如图3所示,具体分析结果如下,在化学位移为δ2.31附件可有‐OH的吸收峰,在δ6~8.2出现‐NH的吸收峰,在δ1.43附件出现‐SH的吸收峰,同时出现不同程度的吸收峰,不同的化学位移,说明不同配比的生物活性多肽与硒元素结合的过程中,有不同程度的结合量。
4、生物活性多肽和双硒多肽对人肺癌A459细胞作用后的细胞形态如图4和图5所示,具体分析结果如下,与正常RPMI‐1640培养液作用后的细胞做对照,正常生物活性多肽可抑制细胞的生长。与正常生物活性多肽相比,双硒多肽作用于A549细胞后明显抑制细胞生长,并引起大量细胞凋亡,效果非常明显。
5、双硒多肽中硒元素的含量测定,分析结果如表1所示,结果显示,不同配比的生物活性多肽与硒元素结合后,硒元素的含量不同。当配比达到一定程度,结合量达到饱和状态。比如实施例五中,每摩尔生物活性多肽分子中的硒元素含量达到9个。
6、双硒多肽作用于人肺癌A549细胞后细胞存活率的测定,分析结果如表2所示,结果显示,双硒多肽作用于A549细胞后明显抑制 细胞生长,并引起大量细胞凋亡,5%、10%、15%、20%浓度的双硒多肽随作用浓度的增加其细胞抑制率逐渐增加,实施例一的IR%为11.50%、17.66%、27.32%、36.04%,IC50为35.72%;实施例三的IR%为11.79%、10.54%、19.34%、24.17%,IC50为116.15%;实施例六的IR%为18.89%、29.98%、31.50%、45.83%,IC50为36.25%。结果显示人肺癌A549细胞对实施例中制备的双硒多肽呈敏感阳性,具有潜在的应用价值。
表1 生物活性多肽与硒元素结合后的硒元素含量测定
表1为双硒多肽中硒元素的含量。分别为实施例(一、二、三、四、五和六)中的双硒多肽中硒元素的含量(n硒/n生物活性多肽),定义为每摩尔生物活性多肽分子中可以结合的硒元素的个数。
表2为双硒多肽对人肺癌A549细胞作用后的细胞存活率测定结果。用酶标仪测定570nm处吸光度(A)值,每个药物浓度设立4个复孔,计算其平均数。按下列公式计算平均细胞抑制率(IR):IR%=(对照组A值一实验组A值)/对照组A值x100%,计算各孔平均值。设定IR值>30%为对药物敏感阳性,反之阴性。
本发明制得的双硒多肽螯合物用于体外培养的人肺癌细胞检测结果表明:与具有相同生物活性多肽浓度的抗癌效果相比,可提高A549细胞的抑瘤率。
以上所述的实施例,只是本发明较优选的具体实施方式的一种,本领域的技术人员在本发明技术方案范围内进行的通常变化和替换都应包含在本发明的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!