快速定量检测猪瘟抗体的试剂盒及其制备方法与流程
本发明涉及猪瘟抗体
技术领域:
,具体指一种快速定量检测猪瘟抗体的试剂盒,用于对猪血清或血浆样本进行猪瘟抗体的检测,属于胶体金层析免疫分析。
背景技术:
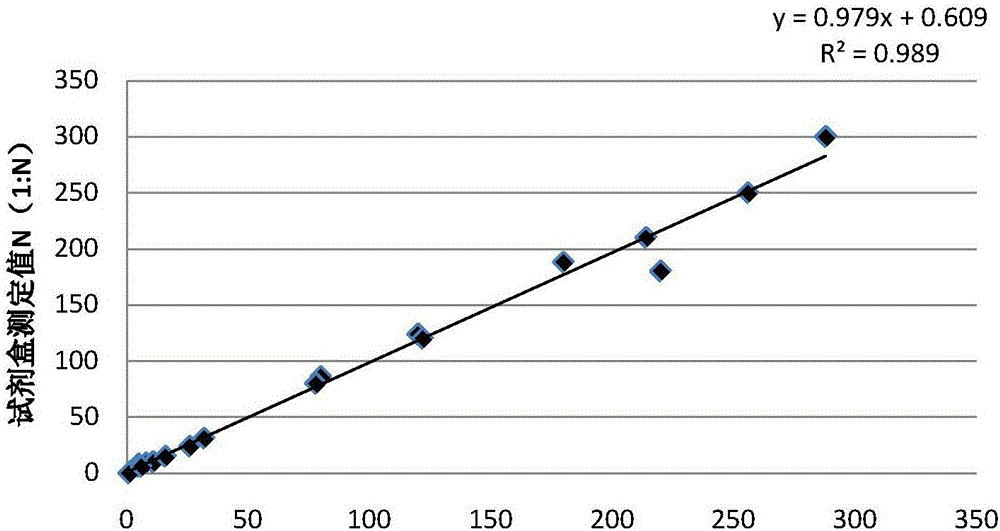
:猪瘟(Classicalswinefever,CSF)是由猪瘟病毒(CSFV)引起的一种高度接触性传染病,对养猪业造成严重危害,是世界动物卫生组织(OIE)确定的应报告疾病(Notifiablediseases)之一。多年来CSF也危害我国养猪业的发展,是我国四大动物疫病之一,被我国农业部法定为一类传染病。CSF是一种急性烈性传染病,死亡率高达80%~90%,接种疫苗是防制本病唯一有效的措施。我国于1954年成功研制的猪瘟兔化弱毒疫苗(CSFLV),在防治CSF工作中发挥了重要作用,取得了显著效果,通过疫苗接种有效的控制了CSF的发生,保障了我国养猪业的发展和养猪户的利益。虽通过加大免疫密度、超量、超前免疫和增加免疫次数等多种途径和办法,仍不能有效控制CSF流行。建立安全有效的实验室和临床评价方法尤为重要,血清学检测通常用于了解猪的群体免疫水平和对疫苗免疫效果进行评价。常用的方法有以下几种:(1)猪瘟正向间接血凝试验,(2)中和试验,(3)间接ELISA试验,(4)胶体金免疫检测等技术,其中,间接ELISA法具有敏感性高、特异性强、重复性好的优点,可用于临床猪瘟血清/血浆抗体的定性和定量检测,为猪瘟免疫效果的监测提供参考。但是,目前的检测手段对猪瘟抗体的检测存在重复性不好,操作技术繁琐的问题。目前检测猪瘟抗体的方法主要是采用酶联免疫(ELISA)试剂盒。ELISA试剂盒虽然能够为每份样本呈现一个吸光度值,但是吸光度值与抗体中和效价并没有很好的相关性,所以ELISA试剂盒还只能算是定性测试。中国发明专利200810000449.2公开了一种快速检测猪瘟抗体的试纸条。该专利是通过肉眼判断检测线的有或无,来对猪瘟抗体进行阴性或阳性的定性检测,而无法准确量化抗体含量,其应用更多的是对猪瘟病毒感染的辅助诊断作用,而并不适用于对免疫效果的评价。传统的猪瘟抗体定量测定方法是病毒中和试验。因为此实验需要培养有感染能力的猪瘟病毒,没有其资质的实验室难以开展此实验。同时,此实验对操作人员的专业素质与经验也要求极高,且费用昂贵,只有极个别的有资质实验室能进行此项检测,根本无法市场化推广。技术实现要素:本发明要解决的技术问题是不仅对猪瘟抗体进行阴性或阳性的定性检测,还能快速的得到血清样品中猪瘟抗体的准确含量,从而提供一种快速定量检测猪瘟抗体的试剂盒及其使用方法。本发明快速定量检测猪瘟抗体的试剂盒,包括:一盒体;设置在盒体内的胶体金免疫层析试纸卡、开设在盒体上的观察窗和加样孔;所述胶体金免疫层析试纸卡包括一底板、设置在底板上的样品垫、猪瘟抗原胶体金复合物垫、硝酸纤维素膜及吸水垫,所述硝酸纤维素膜设有由猪瘟抗原包被而成的检测带和由羊抗猪瘟抗体包被而成的对照带;其中,所述猪瘟抗原胶体金复合物垫上设有胶体金标记的猪瘟E2-E0融合表达抗原,所述胶体金标记的猪瘟E2-E0融合表达抗原是将猪瘟E2-E0融合表达抗原与一定数量的胶体金颗粒溶液通过物理吸附连接合成,所述胶体金颗粒溶液中含有的胶体金颗粒大小的均值在30—35nm。优选的,胶体金颗粒溶液中所含有的胶体金颗粒大小的变异度小于3%。优选的,所述检测带包被的猪瘟抗原为基因工程原核表达的E2-E0融合表达抗原,该抗原是通过连续梯度透析复性的可溶性抗原。优选的,所述标准曲线信息卡记录有检测带光密度值(RLU)与病毒中和试验抗体效价的对数曲线。本发明还提供一种定量检测猪瘟抗体试剂盒的制备方法:本方法提供一设有猪瘟抗原胶体金复合物垫的试剂盒,所述猪瘟抗原胶体金复合物垫上设有胶体金标记的猪瘟E2-E0融合表达抗原,所述胶体金标记的猪瘟E2-E0融合表达抗原是将猪瘟E2-E0融合表达抗原与一定数量的胶体金颗粒溶液通过物理吸附连接合成,所述胶体金颗粒溶液中含有的胶体金颗粒大小的均值在30—35nm,其包括以下制备步骤:1)将浓度1%的氯金酸溶液稀释到体积比100倍的去离子水溶液中;2)将上述氯金酸溶液放入油域加热套加热至90摄氏度,同时匀速搅拌;3)将上述氯金酸溶液与1%浓度柠檬酸钠按18:1000的比例混合,同时进行300rpm速度的搅拌;4)30秒钟后搅拌速度降低至100rpm,继续加热20分钟后,水浴冷却以获得颗粒直径均值为30~35nm的胶体金颗粒溶液。进一步的,上述胶体金定量检测对反应试纸条的批内变异度必须控制在3%以内以为了保证胶体金颗粒的均一度。优选的,所述猪瘟E2-E0融合表达抗原的制备方法为:采用RT-PCR扩增E0和E2蛋白的编码基因,通过PET-32a载体将E0和E2基因串联,形成PET-E0-E2重组质粒,然后将其转入大肠杆菌BL21,经IPTG诱导,表达的目的蛋白经过His亲和柱纯化,后溶解于含有8mol/ml尿素的洗脱液中,再将0.01mol/ml磷酸盐缓冲液依3ml/min的速度加入至上述透析液中,至透析液中的尿素最终浓度低于0.01mol/ml,完成复性。所述胶体金颗粒溶液和猪瘟E2-E0融合表达抗原通过物理吸附连接而成,其具体步骤如下:1)用0.1mol/ml的碳酸钾溶液将胶体金颗粒溶液的PH调至7.2;2)按照10ug/ml浓度计算所需的猪瘟E2-E0融合表达抗原,将猪瘟E2-E0融合表达抗原用去离子水稀释至0.5mg/ml,搅拌下缓慢滴入上述胶体金颗粒溶液;3)搅拌下同样将10%的牛血清白蛋白(BSA)加入上述混合液中;4)在12000rpm离心至少40min后,将上述混合液中的上清除去,剩余的沉淀物用0.01mol/ml的PH7.2磷酸盐缓冲液复溶至原体积的1/40,得到金标复合物;5)将上述金标复合物喷涂在玻璃纤维材质上,待干燥后制备成猪瘟抗原胶体金复合物垫。本发明试剂盒定量检测猪瘟抗体的原理:把待检样本加入到加样孔后,与胶体金标记的猪瘟抗原一起沿层析膜向另一端流动。若样品中存在猪瘟抗体时,此猪瘟抗体先与胶体金标记的猪瘟抗原结合,当流经检测带时,猪瘟抗体又被固定在硝酸纤维素膜上猪瘟抗原捕获,形成“猪瘟抗原-猪瘟抗体-胶体金标记的猪瘟抗原”的复合物,由于胶体金颗粒的富集而显示红色线条,检测样本中抗体含量越高,形成此复合物就越多,因此抗体的含量与产生的信号强度成正比。通过呈色分析仪读取检测带光密度值,并通过与标准曲线的软件计算,得出样本中猪瘟抗体的实际含量。【附图说明】图1为本发明快速定量检测猪瘟抗体的试剂盒的结构示意图;图2为本发明的试剂盒测定结果与细胞中和试验测定结果的相关性示意图;图3为本发明标准曲线信息卡的标准曲线示意图。【具体实施方式】下面结合具体实施例,进一步阐述本发明。参图1所示,为本发明一种快速定量检测猪瘟抗体的试剂盒,包括一盒体100、设置在盒体100内的胶体金免疫层析试纸卡、开设在盒体100上的观察窗120和加样孔110;通常,所述盒体由一个外壳101和与外壳101配用的面板102组成;所述胶体金免疫层析试纸卡包括一底板11、依次叠设在底板11上的样品垫12、猪瘟抗原胶体金复合物垫13、硝酸纤维素膜14以及吸水垫15,所述猪瘟抗原胶体金复合物垫13上设有胶体金标记的猪瘟E2-E0融合表达抗原;所述硝酸纤维素膜14设有一条由猪瘟抗原包被而成的检测带141和由羊抗猪瘟抗体包被而成的对照带142;所述检测带141包被的猪瘟抗原为基因工程原核表达的E2-E0融合表达抗原,该抗原是通过连续梯度透析复性的可溶性抗原。另外,所述加样孔110连通样品垫12,可将待测的血清样品通过加样孔110加载到样品垫12;所述观察窗120连通硝酸纤维素膜14。所述试剂盒还包括一标准曲线信息卡20,所述标准曲线信息卡20记录有检测带光密度值(RLU)与病毒中和试验抗体效价的对数曲线。在该实施例中,所述猪瘟抗原胶体金复合物垫13上设有胶体金标记的猪瘟E2-E0融合表达抗原是将猪瘟E2-E0融合表达抗原与一定数量的胶体金颗粒溶液通过物理吸附连接合成。为了精确的量化待检抗体含量,所述胶体金颗粒溶液中含有的胶体金颗粒大小的均值在30-35nm之间,进一步的,胶体金颗粒溶液中所有胶体金颗粒大小的变异度小于3%。为了满足此要求,在制备过程采用油域精确控温在90摄氏度,同时采用数控的搅拌装置精确控制搅拌速度。所述胶体金颗粒溶液的制备方法如下:1)将制备专用烧瓶用重铬酸钾洗液浸泡过夜,用自来水冲洗干净,去离子水润洗后再用0.22um过滤去离子水润洗三次,备用;其它玻璃器皿也都需清洁干净后再用0.22um过滤去离子水润洗;2)取一定量去离子水加入1%体积的1%浓度氯金酸溶液到专用烧瓶中;3)将上述氯金酸溶液放入油域加热套加热至90摄氏度,同时匀速搅拌;4)待5min后,将上述氯金酸溶液与1%浓度柠檬酸钠按18:1000的比例混合,同时加快搅拌速度至300rpm,30秒后降低搅拌数度至100rpm,待20min后关闭加热装置,水浴冷却;通过上述步骤制备出本实施例中的胶体金颗粒溶液。所述猪瘟E2-E0融合表达抗原为通过基因工程构建并制备的。有别于传统方法与试剂选用天然病毒抗原或单一的E2蛋白作为抗原,将猪瘟病毒刺激机体产生中和抗体的两个蛋白E0和E2通过基因工程技术融合表达,使的检测的靶抗体包含所有中和抗体而不含其它非中和抗体,从而保证了检测结果与中和试验良好的相关性。所述猪瘟E2-E0融合表达抗原的复性有别于传统的梯度透析法,本发明采用蠕动泵缓慢的加入磷酸盐缓冲液来连续的稀释含8mol/ml尿素的透析液,使得尿素的含量连续的缓慢下降,让蛋白的折叠与复性在更加温和的条件下缓慢进行,从而得到更佳的复性效果。具体的制备方法如下:采用RT-PCR扩增E0和E2蛋白的编码基因,通过PET-32a载体将E0和E2基因串联,形成PET-E0-E2重组质粒,然后将其转入大肠杆菌BL21,经IPTG诱导,表达的目的蛋白经过His亲和柱纯化,后溶解于含有8mol/ml尿素的洗脱液中。将含有目的蛋白的洗脱液装入透析袋,放入含有8mol/ml尿素的透析液中,然后将0.01mol/ml磷酸盐缓冲液依3ml/min的速度加入至上述透析液中,至透析液中的尿素最终浓度低于0.01mol/ml,完成复性,从而制备出合格的猪瘟E2-E0融合表达抗原。所述胶体金标记的猪瘟E2-E0融合表达抗原是将上述胶体金颗粒溶液和已经制备合格的猪瘟E2-E0融合表达抗原通过物理吸附连接而成,其具体步骤如下:1)用0.1mol/ml的碳酸钾溶液将上述胶体金颗粒溶液的PH调至7.2;2)按照10ug/ml浓度计算所需的猪瘟E2-E0融合表达抗原,将猪瘟E2-E0融合表达抗原用去离子水稀释至0.5mg/ml,搅拌下缓慢滴入上述胶体金颗粒溶液;3)20分钟后,搅拌下同样将10%的牛血清白蛋白(BSA)加入上述混合液;4)在4℃下,12000rpm离心45min,将上述混合液中的上清除去,剩余的沉淀物用0.01mol/ml的PH7.2磷酸盐缓冲液复溶至原体积的1/40,得到金标复合物;5)将上述金标复合物喷涂在玻璃纤维材质上,待干燥后制备成猪瘟抗原胶体金复合物垫。将制备好的胶体金标记的猪瘟E2-E0融合表达抗原制备在一复合物垫上以形成本发明的猪瘟抗原胶体金复合物垫13。另外,本发明的标准曲线信息卡20记载的标准曲线信息,通过以下步骤制作:1)将猪瘟抗体国家标准血清用SPF猪血清作为稀释液分别稀释制备成:1:256、1:128、1:64、1:32、1:16、1:8、1:4的系列标准血清;2)将上述系列标准血清分别滴加100ul到所述胶体金免疫层析试纸卡的加样孔内,再用呈色分析仪扫描检测带141的光密度信号,得出各标准血清对应的光密度值,以该值为纵坐标,以对应标准血清浓度为横坐标,即绘制出标准曲线信息。在本实施例中,将待检血清样本加入到加样孔110后,与猪瘟抗原胶体金复合物垫13上的胶体金标记的猪瘟E2-E0融合表达抗原沿层析膜移动。若待检血清样本存在猪瘟抗体时,此猪瘟抗体先与胶体金标记的猪瘟E2-E0融合表达抗原结合,当流经检测带141时,猪瘟抗体被固定在硝酸纤维素膜14上检测带141捕获,形成“猪瘟抗原-猪瘟抗体-胶体金标记的猪瘟抗原”的复合物,由于胶体金标记的猪瘟E2-E0融合表达抗原上的胶体金颗粒的富集而显示红色线条,若待检血清样本中猪瘟抗体含量越高,形成此复合物就越多,因此待检血清样本含有的猪瘟抗体含量与观察窗观察到的红色线条的强度成正比,通过呈色分析仪读取检测带141光密度值,并通过与标准曲线信息卡20的比对,得出样本实施例中猪瘟抗体的实际含量,正如附图3所示。正如下述表1所示,为将二十个血清样本用本发明的试剂盒进行检测,与细胞中和实验的检测值比对测定结果。编号试剂盒测定值细胞中和试验值编号试剂盒测定值细胞中和试验值11:321:3111<1:1021:2561:250121:261:2431:1201:124131:51:641:51:814<1:1051:81:9151:2141:21061:801:86161:1801:19071:1221:120171:111:1081:2881:298181:61:691:781:80191:2201:180101:21:2201:161:15由图2显示可知本发明的试剂盒测定结果与细胞中和试验测定结果的相关系数R为0.9894,相关性很高。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。此外应理解,在阅读了本发明讲授的内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 猪瘟病毒抗体竞争AlphaLISA检测试剂盒及检测方法
- 双峰驼源抗猪瘟兔化弱毒疫苗株e2抗原重链抗体vhh和用途
- 用于检测非洲猪瘟病毒抗体的间接elisa试剂盒及其用途的制作方法
- 猪瘟病毒抗体、猪蓝耳病病毒抗体和猪伪狂犬病病毒抗体的elisa检测试剂盒的制作方法
- 一种猪瘟抗体快速金标检测卡的制作方法
- 用于检测非洲猪瘟病毒抗体的竞争elisa试剂盒及其用途的制作方法
- 一种用于检测非洲猪瘟病毒抗体的竞争elisa试剂盒及其用途的制作方法
- 抗非洲猪瘟病毒单克隆抗体的杂交瘤细胞系及其所分泌的单克隆抗体的制作方法
- 一种非洲猪瘟病毒vp73基因的原核表达蛋白及其制备方法
- 一种猪瘟病毒阻断elisa抗体检测试剂盒及应用的制作方法