一种组织透明化液SUT及其制备和应用的制作方法
本发明涉及一种组织透明化液sut及其制备和应用。
背景技术:
在单细胞分辨率水平获取可视化的、完整的组织结构信息是科学家们一直以来的梦想。通过对完整组织进行单细胞分辨率成像,可以获得完整组织的三维立体图像,借此可以在器官和系统水平阐明细胞间连接方式及其动态变化,这将会大大提高我们对疾病发生发展过程的认识,因为疾病中单细胞事件最终会导致整个机体健康状况的改变。但组织器官的不透光性成为实现这一梦想的最大阻碍。
经典的蛋白定性定量(即确定是哪种蛋白,确定某种蛋白的含量多少)技术包括westernblot、免疫组化、免疫荧光等,其中(1)westernblot通过电泳技术将各种蛋白分隔开来,能对蛋白进行基本的定性定量,但无法确定蛋白在组织中的空间分布位置,更无法获取组织内蛋白分布的三维立体图像;(2)由于组织器官的不透光性,传统的免疫组化与免疫荧光是针对组织切片(包括石蜡切片和冰冻切片)进行,切片厚度<8μm,才利于光线透过及荧光染料的穿透。其中免疫组化得到的是二维图片,无法分析蛋白在组织中的三维立体分布;免疫荧光可以通过对组织孵育荧光染料,然后用共聚焦显微镜进行三维重构,得到蛋白分布的三维立体图像,但传统免疫荧光重构的厚度受切片厚度的限制,得到的三维图像厚度太小(<8μm),对一些较大的细胞(如左室心肌细胞,直径10~15μm)则无法显示全貌,而且,如果组织切片太厚,荧光染料(如荧光抗体)则无法穿透组织进行蛋白标记,且共聚焦显微镜的发射光也无法穿透组织全层,因此三维重构在应用上有很大的局限,目前多用于拍摄荧光二维图片。
由于组织器官的不透光性和传统研究技术的种种局限,我们无法获得完整组织中的蛋白分布情况,试想,如果有一种方法能够使组织拥有足够大的光透过度,从而使共聚焦显微镜的发射光能够穿透组织全层,且通过对组织进行特定处理使得荧光染料也能够穿透组织全层,那么,对较厚的完整组织的单细胞分辨率成像以及获取蛋白在完整组织中的时间空间分布即可实现,这将对揭开生命的奥秘提供一种新的路径,大大提高我们对生命体的认识,同时将会大大提高我们对疾病发生发展过程的认识,促进人类的健康事业。
影响组织光透过度的因素有两个:(1)光散射--主要因为不同组织结构层间折射率的差异,其中脂质成分影响最大;(2)光吸收--主要由于内源性生色基团,其中血红蛋白和肌红蛋白占主导。那么提高组织光透过率也相应的有两个途径:(1)尽可能减少不同组织结构层间折射率的差异,尽可能除尽脂质;(2)尽可能除尽组织中的血液及肌红蛋白。
组织透明化首先通过多聚甲醛固定组织蛋白、再与丙烯酰胺交联形成组织凝胶复合物,组织凝胶复合物有两个特点:(1)这种复合物可以将蛋白及核酸固定在原位,并可代替脂质,成为构架起细胞的支撑性结构,因而在后续的透明化液清洗过程中可以减少蛋白的丢失;(2)组织凝胶复合物是带有不同大小孔径的,荧光染料可以通过小孔进入组织内部,与目标蛋白结合,因此能够标记较厚的组织,克服传统免疫荧光的缺点。形成组织凝胶复合物后,再通过透明化液清洗组织,除去脂质和内源性生色基团,从而极大的提高组织的光透过度,通过对透明组织孵育抗体及荧光染料、共聚焦成像及3d重构,得到完整组织结构单细胞分辨率水平的可视化信息。
组织透明化要求在尽可能保持组织原有形态,蛋白丢失量尽可能少的前提下用最短时间实现最大的光透过度,从而尽可能的还原组织真实的微观结构及其变化信息。这种方法最早可追溯至一个世纪前,但是最初的方法对组织的结构和形态造成了很大的破坏,随后各种方法陆续出现,包括clarity,scale,seedb,3disco,cubic,pact-pars等,各种方法均对揭开生命的奥秘做出了很大贡献,且多数方法均发表在国际权威杂志上。然而各种方法的诞生主要用于神经系统(脑组织)的研究,3disco曾被用于其他器官透明,但是它容易引起荧光淬灭。2014年发表在cell杂志上的透明化方法包括cubic和pact-pars,其中cubic的透明化液包含两种试剂,需要两种试剂依次处理组织;pact-pars的透明化液为8%sds,两种透明化液分别通过循环系统灌注都实现了小鼠全身透明化,pact-pars同时进行了脑部的共聚焦扫描成像,形象的展示了脑部神经元的结构,但是对于其他器官的研究仍然很表浅。不同组织的组成成份和结构不同,因此透明化条件略有差异,虽然cubic和pact-pars均实现了小鼠全身透明化,但两者的缺点均较明显:
(1)cubic虽然透明化效果较好,但试剂组成复杂,且涉及到不常用试剂,其中的n,n,n’,n’-tetrakis(2-hydroxypropyl)ethylenediamine(即edtp)很粘稠,配液困难,且其透明化试剂包含两种,需要依次使用,每种试剂处理时间不同,操作步骤相对复杂,而且由于edtp是一种铜离子沉降剂,不能用常规的bca法进行蛋白定量,同时,由于cubic-1较为粘稠,用nanodrop进行蛋白定量也不准确;
(2)8%sds虽然简单,但是透明化效果较差,且组织肿胀严重,蛋白损失较多。
技术实现要素:
为了解决现有技术中的透明化液透明化效果差,蛋白质损失较大等技术弊端,本发明实施例提供如下技术方案。
作为本发明的一个方面,涉及一种组织透明化液sut,该组织透明化液sut主要由sds(sodiumdodecylsulfate)和urea及tritonx-100构成。具体来讲,该组织透明化液sut中,sds、urea和tritonx-100的浓度用量为:4%≤sds(wt/vol)≤12%,15%<urea(wt/vol)≤40%,10%≤tritonx-100(vol/vol)≤20%。作为优选,该组织透明化液sut中,sds、urea和tritonx-100的浓度用量为:8%sds(wt/vol),25%urea(wt/vol),15%tritonx-100(vol/vol)。
作为本发明的另一个方面,涉及上述组织透明化液sut的制备方法,称取固态sds(十二烷基硫酸钠)4~12克,urea(尿素)15~40克于玻璃瓶中,加入适量0.1mpbs(也可用蒸馏水或生理盐水等代替)(少于80ml),搅拌混匀,待两者溶解后,加入液态tritonx-10010~20毫升,加热搅拌均匀,再用0.1mpbs(也可用蒸馏水或生理盐水等代替)定容至100ml,搅拌均匀即可。
作为本发明的再一个方面,涉及上述组织透明化液sut在组织透明化中的应用。具体来讲,涉及上述组织透明化液sut在心脏组织透明化中的应用。
本发明实施例提供的组织透明化液sut至少具有如下优点:
降低了透明化液配制的成本及难度,增加了透明化效果,其对心肌的透明化程度优于部分现有透明化液配方(图2a);
和pact-pars的透明化液8%sds相比,组织透明化过程中蛋白丢失量更少(图2b),更大程度的保留了组织的分子结构;
在得到更佳的组织透明度的同时,尽量保持了组织的原有形态,减轻了组织体积肿胀并减少了组织质量的增加(图2c,图3);
在较短时间内(3—6天)实现了小鼠(icr/cd-1小鼠,10周)左室全层的被动透明,同时,仅用时3天便完成了小鼠(icr/cd-1小鼠,10周)全心透明,且成功完成了小鼠其他器官的被动透明化,并用单光子共聚焦显微镜(single-photonconfocalmicroscope)得到了小鼠多器官清晰的单细胞分辨率3d图像,将各器官的分子结构生动立体的呈现了出来。
和cubic透明化试剂组合相比,降低了透明化液配制的成本及难度,简化了透明化过程,方便了蛋白丢失率的检测,增加了透明化效果,其对心肌的透明化程度优于cubic的透明化液配方。
和pact-pars的透明化液8%sds相比,组织透明化过程中蛋白丢失量更少,更大程度上保留了组织的分子结构;并且在得到更佳的组织透明度的同时,尽量保持了组织的原有形态,减轻了组织体积肿胀,同时减少了组织质量增加。
在较短时间内(3-6天)实现了小鼠(icr/cd-1小鼠,10周)左室全层的被动透明,同时,仅用时3天便完成了小鼠(icr/cd-1小鼠,10周)全心透明,且成功完成了小鼠其他器官的被动透明化,并用单光子共聚焦显微镜(single-photonconfocalmicroscopy)得到了小鼠多器官清晰的单细胞分辨率3d图像,将各器官的分子结构生动立体的呈现了出来。
心脏是致密的肌性器官,脂肪含量相对较少,血红蛋白和肌红蛋白含量高,其透明化条件和脑组织不同。目前专门针对心肌的透明化条件尚未见报道,本发明实施例提供了一种适用于心肌的透明化液配方。
附图说明
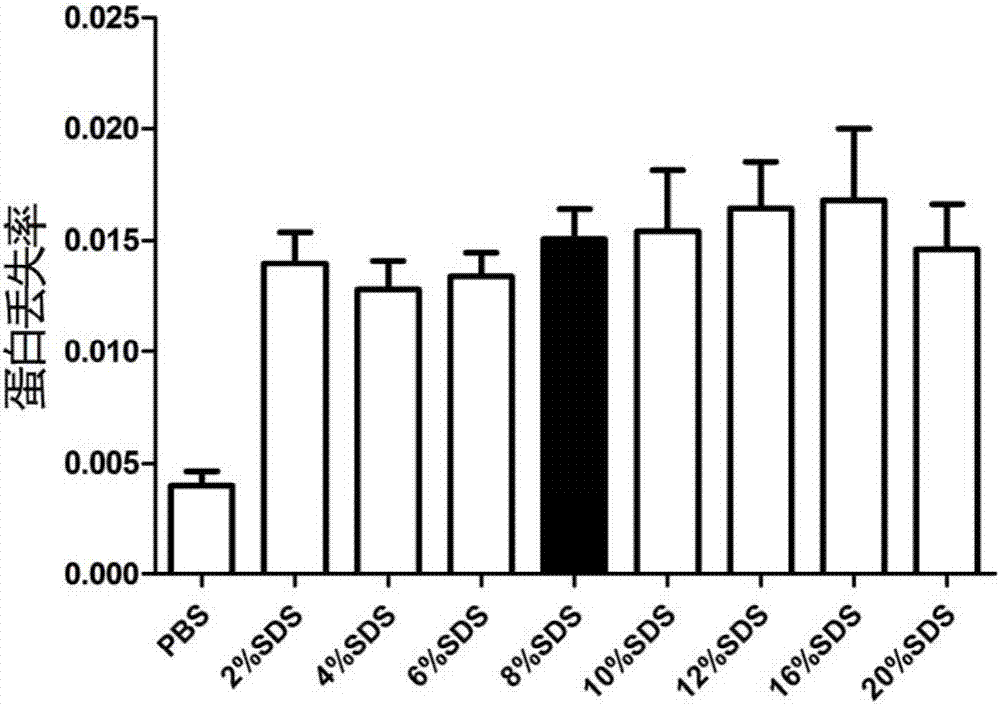
图1:图1的研究对象是10周icr/cd1小鼠1.5mm厚心脏横切片,每组6片,形成组织凝胶复合物后,用不同浓度sds透明5天。我们选定8%sds为参照对象,用spss进行单因素anova分析(排除pbs组),“*”表示该组和8%sds组相比有统计学差异。
图1(a)是处理后组织光透过率的测量结果,8%sds组和4%sds、6%sds、10%sds组相比均无统计学差异,表明8%sds和4%sds、6%sds、10%sds对组织的透明化效果一致,而12%sds、16%sds、20%sds对组织的光透过率更优,仅通过光透过率的比较,我们认为:sds浓度≥4%;
图1(b)是蛋白丢失率的测量结果,和8%sds组相比,其他各组均无统计学差异,表明8%sds处理组织后的蛋白丢失率和其他各浓度sds处理组织后的蛋白丢失率一致;
图1(c)是组织质量增长百分比测量结果,和8%sds组相比,仅10%sds组有统计学差异,且组织质量增长百分比小于8%sds,更接近组织初始状态;
我们认为单纯sds处理组织光透过率较低,且通过配液实践发现,当sds浓度超过12%时,不利于其他透明化试剂的添加,因此,综合以上实验结果,我们设定4%≤sds浓度范围≤12%。
图2:图2的研究对象是10周icr/cd1小鼠1.5mm厚心脏横切片,每组6片,形成组织凝胶复合物后,用不同配比的透明化液透明5天。其中,s=8%sds,sux=8%sds+x%urea,suty=8%sds+25%urea+y%tritonx-100;
(1)s~su40组,我们选定su25组为参照对象,用spss进行单因素anova分析,“*”表示该组和su25组相比有统计学差异。
图2(a)是透光率的测量值,当urea浓度从0增加到15%时,和su25组相比均有统计学差异(su15vssu25,p=0.029),当urea浓度增加到20%时,和su25组相比则无统计学差异(su20vssu25,p=0.066),当urea浓度增加到30%和35%时,和su25组相比均无统计学差异(su25vssu30,p=0.445;su25vssu35,p=0.054),当urea浓度增加到40%时,和su25组相比有统计学差异(su25vssu40,p<0.001),说明urea和8%sds液进行混合时,15%<urea浓度≤35%,对组织的透明化效果一致,且优于当urea浓度≤15%时,当urea浓度增加到40%时,对组织透明化效果更优,由此我们确定,15%<urea最佳浓度范围≤40%;图2(b)是蛋白丢失率的测量结果,s~su15组和su25组相比均有统计学差异(su15vssu25,p=0.028),其他组则均无统计学差异,说明s~su15组处理组织后蛋白丢失率均明显高于su25组,su20~su40处理组和su25组相比蛋白丢失率一致,因此,单从蛋白丢失率角度,urea最佳浓度范围>15%;图2(c)是组织质量增长百分比测量结果,s~su40组与su25组相比均无统计学差异。且在配液过程中发现,urea和8%sds进行混合时,当urea浓度高于40%时,不利于其他透明化试剂的添加,且溶液在温度低时不稳定,综上,我们确定15%<urea最佳浓度范围≤40%;
(2)sut5~sut20,seedb,scalea2,cubic-1组,我们选定cubic-1组为参照对象,用spss进行单因素anova分析,“*”表示该组和cubic-1组相比有统计学差异。
图2(a)是透光率的测量值,cubic是发表在cell杂志上的权威方法,我们通过实践认为,cubic-1试剂对心肌的透明化效果较好,因此我们以cubic-1处理组作为光透过率的参照组,通过统计学分析得出,sut5和cubic-1组有显著统计学差异(p<0.001),即cubic-1对组织的透明化效果远超过sut5,sut15组和cubic-1组有显著统计学差异(p<0.001),即sut15对组织的透明化效果远超过cubic-1,而sut10和sut20组和cubic-1组相比均无统计学差异(sut10vscubic-1,p=0.067;sut20vscubic-1,p=0.169),说明sut10、sut20对心肌组织的透明化效果和cubic-1相当。由此,通过光透过率的比较,我们确定,10%≤tritonx-100最佳浓度范围≤20%;图2(b)是蛋白丢失率的测量结果,sut5、sut10、sut20与sut15相比,均有统计学差异(sut5vssut15,p=0.004;sut10vssut15,p=0.012;sut20vssut15,p=0.004),图2(c)是组织质量增长百分比测量结果,sut5、sut10、sut20与sut15相比,均有统计学差异(sut5vssut15,p<0.001;sut10vssut15,p=0.015;sut20vssut15,p<0.001)。根据实践,我们发现用sut10和sut20处理过的组织均可以进行后续荧光染料的孵育及共聚集显微镜成像,且效果优于发表于权威杂志cell上的透明化液8%sds,因此,我们最终确定,10%≤tritonx-100最佳浓度范围≤20%。
图3:图3的研究对象是10周icr/cd1小鼠左心室全层圆形切片(打孔器切取,直径4.5mm),每组10片,形成组织凝胶复合物后,两组分别用pact-pars的透明化液8%sds及我们所得的透明化液sut(本次所取配比=8%sds+25%urea+15%tritonx-100)进行透明化,然后用imagej计算透明前后组织体积变化,并用spss进行独立样本t检验,得出两组具有显著的统计学差异(p<0.001),说明和8%sds相比,sut透明前后,组织体积变化更小,更接近组织原有形态。
具体实施方式:
下面结合具体实施例对本发明作进一步说明,以使本领域的技术人员可以更好的理解本发明并能予以实施,但所举实施例不作为对本发明的限定。
本发明实施例组织透明化液sut的制备方法如下:
称取固态sds(十二烷基硫酸钠)4~12克,urea(尿素)15~40克于玻璃瓶中,加入适量0.1mpbs(也可用蒸馏水或生理盐水等代替,少于80ml),搅拌混匀,溶解,加入液态tritonx-10010~20毫升,加热搅拌均匀,再用0.1mpbs(也可用蒸馏水或生理盐水等代替)定容至100ml,搅拌均匀即可。
本发明实施例组织透明化液sut的成分如下:
溶质主要包括sds、urea和tritonx-100,溶剂为0.1mpbs(也可用蒸馏水或生理盐水等代替)。
我们选用科学家们已发表的文献yangb,treweekjb,kulkarnirp,etal.single-cellphenotypingwithintransparentintacttissuethroughwhole-bodyclearing[j].cell,2014,158(4):945-958.和chungk,deisserothk.clarityformappingthenervoussystem[j].naturemethods,2013,10(6):508-513.作为参考,用心肌作为透明化对象,重新筛查sds的最佳作用浓度,通过添加多种可能的透明化试剂,包括四二羟丙基乙二胺(edtp)、d-fructose、urea、glycerol、tritonx-100,最终确定添加urea及tritonx-100来探索更优的透明化液,我们切取厚度为1.5mm的心脏横切片作为研究对象,分组,每组6片,先按照文献报道方法,使各个切片形成组织凝胶复合物,用不同组合的透明化液进行为期5天的透明化。我们筛查的目标透明化液要在保证足够光透过度的前提下,尽可能减少蛋白丢失率及组织原有形态的改变。
我们将各浓度梯度的edtp(5%、10%、15%、20%、25%、30%、35%)分别与8%sds混合,经过5天的透明,我们发现,组织发黄明显,且无法用常规bca试剂盒进行蛋白丢失率的测定,故弃用;我们将各浓度梯度的d-fructose(10%、20%、40%、60%、80%)分别与8%sds混合,配液时我们发现,d-fructose较难与8%sds相溶,且当浓度高于60%时,液体不稳定,且各浓度的d-fructose与sds混合液对组织的透明化效果均很差,故弃用;我们将各浓度梯度的glycerol(5%、10%、20%)分别与8%sds混合,经过5天的透明,我们发现各浓度的glycerol与sds混合液对组织的透明化效果均较差,故弃用;在使用各浓度的urea和8%sds混合时,我们发现组织的透明化效果明显增加,加入tritonx-100后,组织透明化效果更优,因此我们最终确定添加urea及tritonx-100。
实验步骤:
1、用3%水合氯醛0.7ml腹腔注射深度麻醉10周icr/cd1小鼠,固定四肢;
2、开腹后行下腔静脉穿刺,剪开腹主动脉,先后从下腔静脉灌注pbsflush40ml和4%paraformaldehyde20ml;
3、开胸取心,用自制的间隔1.5mm的排刀垂直于心脏长轴切取厚度为1.5mm的心脏横切片,每个心脏切取3片,每个实验组6片(为了方便测量组织的体积,我们用直径4.5mm圆形打孔器切取左室壁全层直径4.5mm圆形切片,每个心脏切取1片,两个实验组各10片,此圆形切片边缘经过前后乳头肌根部);
4、将各组织轻轻擦干后称重,拍照,并测量光透过率;
5、将各切片分别放入4%paraformaldehyde中,4℃过夜;
6、将各切片从4%paraformaldehyde转移至含有0.25%va044的4%acrylamide中,4℃过夜;
7、从4℃中取出浸有组织切片的各管4%acrylamide(含有0.25%va044),于冰上依次通入氮气,每管2分钟,然后放入37℃水浴中2-3小时;
8、配制各种浓度配比的透明化液并分装至50ml离心管中,于水浴结束后将组织转移至对应标号的各种透明化液中(透明化液分别是2%~20%sds、su5~su40、sut5~sut20、seedb、scalea2、cubic-1;其中sux=8%sds+x%urea;suty=8%sds+25%urea+y%tritonx-100;seedb=fructose(80.2%wt/wt,inwater)+0.5%α-thioglycerol;scalea2=4murea+10%(wt/vol)glycerol+0.1%(wt/vol)tritonx-100;cubic-1reagent=25wt%urea+25wt%n,n,n’,n’-tetrakis(2-hydroxypropyl)ethylenediamine+15wt%polyethyleneglycolmono-p-isooctylphenylether/tritonx-100),将含有各透明化液及组织的50ml离心管放入37℃摇床,摇动孵育5天后取出组织,进行相应参数的测量及计算(质量增长百分比,蛋白丢失率,组织光透过率,体积增长百分比)。
质量用高精度电子天平称量,精度为0.001g,质量增长百分比(weightincrease%)=(透明后组织质量-透明前组织质量)/透明前组织质量;蛋白丢失率用bca法测定,bca蛋白定量试剂盒(p0010)购自beyotime,蛋白丢失率=透明化液中蛋白总量/透明前组织质量即totalproteinloss/weightofunclearedtissue;1.5mm厚横切片光透过率用光学透过率测量仪(ls108d)测量,每个切片随机取6个位置测量,取平均值;体积增长百分比用canon700d拍照后,imagej软件测得,体积增长百分比=(透明后组织体积-透明前组织体积)/透明前组织体积。
实验结果:
(1)为了筛查最适的sds浓度范围,我们设置了一系列sds浓度梯度,通过比较weightincrease%(质量增长百分比)、totalproteinloss/weightofunclearedtissue(蛋白丢失率)、lighttransmittance(组织光透过率),结合配液实践,得出4%≤sds最适浓度范围(wt/vol)≤12%(图1);
(2)根据文献hamah,kurokawah,kawanoh,etal.scale:achemicalapproachforfluorescenceimagingandreconstructionoftransparentmousebrain[j].natureneuroscience,2011,14(11):1481-1488.报道,urea浓度在4m-8m(即24%-48%)时有较好的透明化效果。且通过我们的实验发现,和8%sds进行混合时:①urea浓度介于15%-40%时,组织透明度较好,且溶液很稳定;②当urea浓度高于40%时,溶液较浓,不利于添加其他透明化试剂;③当urea浓度增加至高于45%时,溶液变得不稳定,在温度较低时(低于20度)易有晶体析出,综合考虑,选取15%<urea最适浓度范围(wt/vol)≤40%(图2);
(3)随着tritonx-100的加入,组织透明度越来越好,至tritonx-100浓度范围为10%-20%时,透明化效果最佳;透明化5天后通过对各组透明化液进行蛋白bca定量,结果显示sut15和sut20组蛋白丢失量最小;我们认为,cubic-1处理后的组织透明度较好,因此在透明度的比较中,我们以cubic-1处理组作为参照。综合透明化效果、蛋白丢失率、质量增长百分比,我们认为,10%≤tritonx-100最适浓度范围(vol/vol)≤20%(图2)。
根据以上结果,sut的溶质包含三种成分,sds(sodiumdodecylsulfate),urea(尿素),tritonx-100,每种试剂的浓度范围分别为:4%≤sds浓度(wt/vol)≤12%,15%<urea浓度(wt/vol)≤40%,10%≤tritonx-100浓度(vol/vol)≤20%;溶剂为0.1mpbs(也可用蒸馏水或生理盐水等代替)。
以上所述实施例仅是为充分说明本发明而所举的较佳的实施例,本发明的保护范围不限于此。本技术领域的技术人员在本发明基础上所作的等同替代或变换,均在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!