一种基于纳米光纤生物传感器检测有毒物质的装置的制作方法
本实用新型属于免疫技术及卫生检测技术领域,具体涉及一种基于纳米光纤生物传感器检测有毒物质的装置。
背景技术:
近年来,我国养殖业的发展越来越迅速,产生了巨大的经济效益。众所周知,饲料是养殖业发展的物质基础,在养殖生产成本中所占比例较大,确保饲料中的营养物质和具有有毒有害物质的检测方法是保证养殖业发展的关键环节之一。在养殖业繁荣发展的背后,我们发现市场上的动物源性产品存在的安全隐患越来越多,对社会造成了很大的负面影响。出现这种现象的主要原因是养殖业所使用的饲料中有毒有害物质严重超标,这种存在于饲料中的有毒有害物质被饲养动物食用后,可能在体内转化为毒性更大的物质并且被蓄积,通过食物链到达人体体内后,对人体的健康造成了极大的危害。通过调查研究发现,饲料中最常见、危害最大的有毒有害物质有三聚氰胺、伏马毒素B1、T-2毒素、黄曲霉毒素B1、赭曲霉毒素A、呕吐毒素及玉米赤霉烯酮,其中,三聚氰胺在体内可形成较大的网状结构,造成结石;赭曲霉素A对人体有强烈的肾脏毒性、肝脏毒性、致癌性和致畸性等;T-2毒素能抑制人体重要器官蛋白质和DNA的合成;玉米赤霉烯酮对人体具有生殖发育毒性,免疫毒性和致癌性等;伏马毒素B1对肝、肾、肺及神经系统具有较大毒性;黄曲霉毒素B1对人体的肝脏具有破坏作用,严重时可导致肝癌甚至死亡;呕吐毒素对人体具有致畸性,神经毒素和胚胎毒性等;上述7种有毒物质在粮谷、饲料中的含量很低时就会对人体产生毒性。
量子点是多电子体系,发光效率远高于单个分子,可以经受多次激发,且标记后对生物大分子的生理活性影响很小,因此为研究生物大分子之间的长期作用提供了可能。量子点可以经受反复多次激发,而不像有机荧光分子那样容易发生荧光漂白或荧光碎灭。因此结合量子点研究上述物质的检测方法对于提高动物源性食品质量,改善人类健康,促进养殖业的发展具有重要意义。
本专利采用的是不同粒径的量子点对粮谷和饲料中的7种有毒有害物质进行检测,这七种量子点在370nm的激发波长下,会在不同的发射波长下呈现不同颜色的荧光,从而可以避免待检测物的相互干扰。
技术实现要素:
本实用新型的目的是提供一种基于纳米光纤生物传感器检测有毒物质的装置。
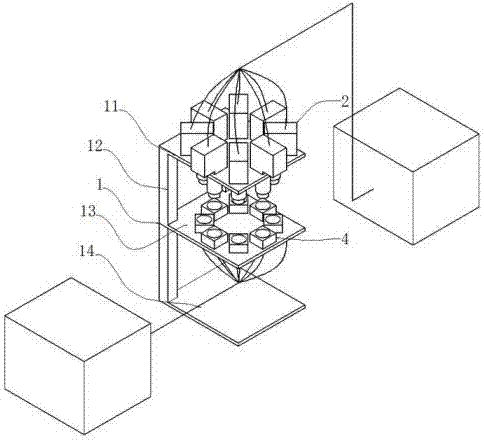
一种基于纳米光纤生物传感器检测有毒物质的装置,它包括:台架1、多个激发光源2、多微孔板3、荧光检测装置4和荧光光谱仪5;所述的多微孔板3上设有微孔31,微孔31为锥形圆柱凹槽,呈圆周排列在八微孔板3上;所述的台架1包括底板14、载物台13、可调支架12、光源固定板11;所述的载物台13、设置在底板14上方,可调支架12固定在载物台13上,光源固定板11设置载物台在上方,固定在可调支架12上;激发光源2固定在光源固定板11;所述的荧光检测装置4固定在载物台13上;所述的荧光检测装置4包括荧光检测探头41、凸透镜42、锥孔;荧光检测装置4上部设有与微孔31外形相对应的锥孔,下部设有荧光检测探头41;
所述的锥孔下部、荧光检测探头41上部设有凸透镜42;
所述的激发光源2、微孔板3的微孔31、荧光检测装置4均为8个;
所述的微孔31为锥形圆柱凹槽,上底面直径为6.8mm,下底面直径为6.21mm,高11.7mm。
本实用新型提供了一种基于纳米光纤生物传感器检测有毒物质的装置,它包括:台架1、多个激发光源2、多微孔板3、荧光检测装置4和荧光光谱仪5;所述的多微孔板3上设有微孔31,微孔31为锥形圆柱凹槽,呈圆周排列在八微孔板3上;所述的台架1包括底板14、载物台13、可调支架12、光源固定板11;所述的载物台13、设置在底板14上方,可调支架12固定在载物台13上,光源固定板11设置载物台在上方,固定在可调支架12上;激发光源2固定在光源固定板11;所述的荧光检测装置4固定在载物台13上;所述的荧光检测装置4包括荧光检测探头41、凸透镜42、锥孔;荧光检测装置4上部设有与微孔31外形相对应的锥孔,下部设有荧光检测探头41;通过荧光强度检测仪,可以同时检测七种有毒物质,操作过程简便,且各检测物彼此并不干扰,检测结果准确度好。
附图说明
图1为本实用新型一种基于纳米光纤生物传感器检测有毒物质的装置整体结构立体图;
图2为本本实用新型一种基于纳米光纤生物传感器检测有毒物质的装置整体结构立体图;
图3为本实用新型一种基于纳米光纤生物传感器检测有毒物质的装置原理图;
图4为本实用新型一种基于纳米光纤生物传感器检测有毒物质的装置局部结构图;
图5为本实用新型一种基于纳米光纤生物传感器检测有毒物质的装置检测检测传感器剖面图;
图6为本实用新型一种基于纳米光纤生物传感器检测有毒物质的装置检测检测八孔板立体图;
图7本实用新型一种基于纳米光纤生物传感器检测有毒物质的装置检测检测八孔板剖面图;
图8 三聚氰胺的标准曲线;
图9伏马毒素B1的标准曲线;
图10 T-2毒素的标准曲线;
图11黄曲霉毒素B1的标准曲线;
图12赭曲霉毒素A的标准曲线;
图13呕吐毒素的标准曲线;
图14玉米赤霉烯酮的标准曲线。
具体实施方式
实施例1 荧光强度检测仪
请参见图1-7;一种基于纳米光纤生物传感器检测有毒物质的装置,包括:台架1、激发光源2、八孔板3、荧光检测装置4;
其中所述的八孔板3上设有微孔31,微孔31为锥形圆柱凹槽,呈圆周排列在八孔板3上;
所述的台架1包括底板14、载物台13、可调支架12、光源固定板11;
所述的载物台13、设置在底板14上方,可调支架12固定在载物台13上,光源固定板11设置载物台在上方,固定在可调支架12上;
所输的可调支架12可以调节载物台13与光源固定板11之间的高度;
所述的载物台13、光源固定板11上均设有与八孔板3位置相对应的通孔;
所述的激发光源2固定在光源固定板11的通孔上;
所述的荧光检测装置4固定在载物台13上的通孔内;
所述的荧光检测装置4包括荧光检测探头41、凸透镜42、锥孔;
荧光检测装置4上部设有与微孔31外形相对应的锥孔,锥孔下部设有凸透镜42,凸透镜42下部设有荧光检测探头41;
所述的荧光检测探头41设置在凸透镜42焦点处;
荧光检测探头41的输出光纤与荧光光谱仪5连接,荧光光谱仪5与电脑6连接;
所述的微孔31为锥形圆柱凹槽,上底面直径为6.8mm,下底面直径为6.21mm,高11.7mm。
使用时,将待测液体注入八孔板3的微孔31中,液面低于微孔31,调节可调支架12,升高激发光源2,将八孔板3放在荧光检测装置4上,使微孔31完全进入锥孔内,节可调支架12,降低激发光源2,使激发光源2的探头位于待测液体上表面;打开激发光源2,待测液体发出的荧光经荧光检测探头42传递至荧光光谱仪5,最后输送至电脑6。
实施例2 量子点和抗体的偶联
1)量子点选择:ZnSe/ZnS(粒径 4nm,紫色)、CdS/ZnS(粒径 8nm,蓝色)、CdSe/ZnS(粒径 10nm,青色)、CdSe/ZnS(粒径 12nm,绿色)、CdSe/ZnS(粒径 5nm,黄色)CdSe/ZnS(粒径 6nm,橙色)、CdSe/ZnS(粒径 7nm,红色)(苏州星烁纳米科技有限公司提供)
2)量子点的活化:
取1mLPBS缓冲溶液,加入量子点ZnSe/ZnS 100μL,加入EDC20μL,加入NHS20μL,涡旋,放于避光处活化30min;
3)量子点与BSA全抗原的偶联:
加入20μLBSA全抗原,30℃,10rpm摇床避光偶联2h;
4)封闭:
加入50μL10%BSA封闭30min;
5)终洗:
15000rpm 离心30min,收集沉淀,向沉淀中加入500μL PBS缓冲溶液后重悬回收,4℃避光备用。
实施例3基底的包被与检测
1)八孔板处理:
在紫外灯下,用254nm波长的紫外光照射八孔板1h;
2)包被:
三聚氰胺单抗包被于八孔板的微孔中,用0.01 M,pH7.4 PBS 缓冲液将三聚氰胺单抗稀释为10μg/mL,每孔加入200μL,4°C包被过夜;
3) 纯化:
由于量子点-BSA全抗原的粒径要比游离的量子点大很多,所以截留分子质量为100000的超滤膜可以使游离的量子点通过,而截留下ZnSe/ZnS -三聚氰胺-BSA全抗原的量子点,加入100μL PBS缓冲溶液后重悬回收,4℃避光备用;
4)封闭:
加入200 μL 5%BSA封闭微孔中未被包被的位点,防止非特异性吸附,37°C孵育2h后取出;PBS洗涤除去多余的BSA溶液,洗涤3次,每次3分钟,甩干,4℃保存。
实施例4 应用荧光强度检测仪检测三聚氰胺
1)应用荧光强度检测仪检测三聚氰胺的方法
加入100μL待测液到采用实施例3中的方法制备的三聚氰胺单抗基底上,37°C下孵育2h,每孔加入200μL由实施例2提供的方法制备的浓度为200ng/mL的ZnSe/ZnS-三聚氰胺-BSA全抗原偶联量子点,经PBS洗涤离心3次,去除未与基底结合的量子点-三聚氰胺-BSA全抗原后每个微孔中加入0.01M,pH7.4的PBS缓冲液200μL,在370nm激发波长下用荧光强度检测仪检测405nm时的发射峰强度。
2)检测灵敏度的确定
采用上述检测方法,分别在基底中加入浓度为0μg/L、0.1μg/L、0.2μg/L、0.3μg/L、0.4μg/L、0.5μg/L、0.6μg/L的三聚氰胺溶液及空白溶液,在370nm激发波长下用荧光强度检测仪检测405nm时的发射峰强度。测试结果如图8所示,检出限为0.1μg/L。
3)特异性试验
根据实施例2和实施例3制备好ZnSe/ZnS -三聚氰胺-BSA全抗原和三聚氰胺单抗基底,将三聚氰胺、伏马毒素B1、T-2毒素、黄曲霉毒素B1、赭曲霉毒素A、呕吐毒素和玉米赤霉烯酮分别配成系列浓度采用上述的检测方法进行特异性交叉试验,同时空白对照。计算各竞争物的 IC50。计算公式为:交叉反应率 (%)=[IC50(三聚氰胺)/IC50(待测药物 )]×100。
测定及计算结果如表 1 所示,结果表明该方法异性较强,只对三聚氰胺发生反应,而对其他毒性化合物没有交叉反应。
4)待测液的制备
用粉碎机粉碎待测谷物,粒度小于2mm。称取5g试样(精确到0.01 g)加入不同浓度的三聚氰胺水平的标准品,置于具塞塑料离心管中,加人PBS溶液25 mL,超声振荡15 min后4000 r/min离心10 min。取上层17. 5 mL PBS溶液于干净的容器,通过微纤维滤纸过滤,将滤液收集于干净的容器(提取液A)。向下层固体样品中加人17. 5 mL甲醇,超声振荡15 min后4 000 r/min离心10 min,取上层溶液10 mL,用90 mL PBS溶液稀释后通过微纤维滤纸过滤,将滤液收集于干净的容器(提取液B)。
将免疫亲和柱连接于10mL玻璃针筒下,准确移取50mL提取液B过免疫亲和柱,以每秒1~2滴的流速全部通过亲和柱,直至空气流经亲和柱;将20mLPBS溶液以每秒1~2滴的流速通过亲和柱,直至空气流经亲和柱;准确移取5mLA以每秒1~2滴的流速全部通过亲和柱,直至空气流经亲和柱;将20mL超纯水以每秒1~2滴的流速淋洗柱子,直至空气流经亲和柱;弃去全部流出液。将1.5mL甲醇以每秒1滴的流速洗脱亲和柱,将洗脱液收集于玻璃试管中,当甲醇大部分过柱后,不要完全过柱,停止加压,静止5min,再将1.5mL甲醇以每秒1滴的流速洗脱亲和柱,将全部洗脱液收集于同一玻璃试管中,待测。
5)准确度和精密度的检测
以重复测定某一浓度样品的检测结果变异系数(CV%)作为精密度评价指标。以回收率作为准确度评价指标。变异系数 CV% 计算公式为:CV% =SD/ X ×100% ;其中 SD 为标准偏差,X 为测定数据的平均值。回收率计算公式为:回收率(%)= 实际测定值/理论值×100%。其中理论值为模拟样品的添加浓度。
采用上述待测液的制备方法,对玉米样品进行三聚氰胺阳性添加,三聚氰胺分别添加0.1μg/kg、0.2μg/kg、0.5μg/kg三个浓度水平的样品,每个添加水平做4个平行,选取PBSS作为空白对照1,再选取未添加的玉米样品做空白对照2,利用实施例1中的荧光强度检测仪,参照实施例4中1)的试验步骤进行添加回收测定。样品的平均回收率及精密度结果见表2。
实验结果表明:平均回收率在90.6~91.5之间。变异系数均小于11%,说明方法精密度和准确度好,检测效果好。
实施例5应用荧光强度检测仪检测伏马毒素B1
1)应用荧光强度检测仪检测伏马毒素B1的方法
加入100μL待测液到采用实施例3中的方法制备的伏马毒素B1单抗基底上,37°C下孵育2h,每孔加入200μL由实施例2提供的方法制备的浓度为200ng/mL的ZnSe/ZnS-伏马毒素B1-BSA全抗原偶联量子点,经PBS洗涤离心3次,去除未与基底结合的量子点-伏马毒素B1-BSA全抗原后,每个微孔中加入0.01M,pH7.4的PBS缓冲液200μL,在370nm激发波长下用荧光强度检测仪检测450nm时的发射峰强度。
2)检测灵敏度的确定
采用上述检测方法,分别在基底中加入浓度为0μg/L、0.25μg/L、0.3μg/L、0.35μg/L、0.4μg/L、0.45μg/L、0.5μg/L的伏马毒素B1溶液及空白溶液,在370nm激发波长下用荧光强度检测仪检测450nm时的发射峰强度。测试结果如图9所示,检出限为0.25μg/L。
3)交叉反应试验
根据实施例2和实施例3制备好CdS/ZnS-伏马毒素B1-BSA全抗原和伏马毒素B1单抗基底,将三聚氰胺、伏马毒素B1、T-2毒素、黄曲霉毒素B1、赭曲霉毒素A、呕吐毒素和玉米赤霉烯酮分别配成系列浓度采用上述的检测方法进行特异性交叉试验,同时空白对照。计算各竞争物的 IC50。计算公式为:交叉反应率 (%) = [IC50(伏马毒素B1)/IC50(待测药物 )]×100。
测定及计算结果如表3所示,结果表明该方法异性较强,只对伏马毒素B1发生反应,而对其他毒性化合物没有交叉反应。
4)待测液的制备
用粉碎机粉碎待测谷物,粒度小于2mm。称取5g试样(精确到0.01 g)加入不同浓度的伏马毒B1水平的标准品,置于具塞塑料离心管中,加人PBS溶液25 mL,超声振荡15 min后4000 r/min离心10 min。取上层17. 5 mL PBS溶液于干净的容器,通过微纤维滤纸过滤,将滤液收集于干净的容器(提取液A)。向下层固体样品中加人17. 5 mL甲醇,超声振荡15 min后4 000 r/min离心10 min,取上层溶液10 mL,用90 mL PBS溶液稀释后通过微纤维滤纸过滤,将滤液收集于干净的容器(提取液B)。
将免疫亲和柱连接于I0mL玻璃针筒下,准确移取50mL提取液B过免疫亲和柱,以每秒1~2滴的流速全部通过亲和柱,直至空气流经亲和柱;将20mLPBS溶液以每秒1~2滴的流速通过亲和柱,直至空气流经亲和柱;准确移取5mLA以每秒1~2滴的流速全部通过亲和柱,直至空气流经亲和柱;将20mL超纯水以每秒1~2滴的流速淋洗柱子,直至空气流经亲和柱;弃去全部流出液。将1.5mL甲醇以每秒1滴的流速洗脱亲和柱,将洗脱液收集于玻璃试管中,当甲醇大部分过柱后,不要完全过柱,停止加压,静止5min,再将1.5mL甲醇以每秒1滴的流速洗脱亲和柱,将全部洗脱液收集于同一玻璃试管中,待测。
5)准确度和精密度的检测
以重复测定某一浓度样品的检测结果变异系数(CV%)作为精密度评价指标。以回收率作为准确度评价指标。变异系数 CV% 计算公式为:CV% =SD/ X ×100% ;其中 SD 为标准偏差,X 为测定数据的平均值。回收率计算公式为:回收率(%)= 实际测定值/理论值×100%。其中理论值为模拟样品的添加浓度。
采用上述待测液的制备方法,对玉米样品进行伏马毒素B1阳性添加,伏马毒素B1分别添加0.25μg/kg、0.35μg/kg、0.45μg/kg三个浓度水平的样品,每个添加水平做4个平行,选取PBS作为空白对照1,再选取未添加的玉米样品做空白对照2,利用实施例1中的荧光强度检测仪,参照实施例5中1)的试验步骤进行添加回收测定。样品的平均回收率及精密度结果见表4。
实验结果表明:平均回收率在87.7~90.5之间。变异系数均小于11%,说明方法精密度和准确度好,检测效果好。
实施例6应用荧光强度检测仪检测T-2毒素
1)应用荧光强度检测仪检测T-2毒素的方法
加入100μL待测液到采用实施例3中的方法制备的T-2毒素单抗基底上,37°C下孵育2h,每孔加入加入200μL浓度为200ng/mL的ZnSe/ZnS-T-2毒素-BSA全抗原偶联量子点,经PBS洗涤离心3次,去除未与基底结合的量子点-T-2毒素-BSA全抗原后每个微孔中加入0.01M,pH7.4的PBS缓冲液200μL,在370nm激发波长下用荧光强度检测仪检测500nm时的发射峰强度。
2)检测灵敏度的确定
采用上述检测方法,分别在基底中加入浓度为0μg/L、0.25μg/L、0.3μg/L、0.35μg/L、0.4μg/L、0.45μg/L、0.5μg/L的T-2毒素溶液及空白溶液,在370nm激发波长下用荧光强度检测仪检测500nm时的发射峰强度。测试结果如图10所示,检出限为0.25μg/L。
3)交叉反应试验
根据实施例2和实施例3制备CdSe/ZnS-T-2毒素-BSA全抗原和-T-2毒素单抗基底,将三聚氰胺、伏马毒素B1、T-2毒素、黄曲霉毒素B1、赭曲霉毒素A、呕吐毒素和玉米赤霉烯酮分别配成系列浓度采用上述的检测方法进行特异性交叉试验,同时空白对照。计算各竞争物的 IC50。计算公式为:交叉反应率 (%) = [IC50(T-2毒素)/IC50( 待测药物 )]×100。
测定及计算结果如表5所示,结果表明该方法异性较强,只对T-2毒素发生反应,而对其他毒性化合物没有交叉反应。
4)待测液的制备
用粉碎机粉碎待测谷物,粒度小于2mm。称取5g试样(精确到0.01 g)加入不同浓度的三聚氰胺水平的标准品,置于具塞塑料离心管中,加人PBS溶液25 mL,超声振荡15 min后4000 r/min离心10 min。取上层17. 5 mL PBS溶液于干净的容器,通过微纤维滤纸过滤,将滤液收集于干净的容器(提取液A)。向下层固体样品中加人17. 5 mL甲醇,超声振荡15 min后4 000 r/min离心10 min,取上层溶液10 mL,用90 mL PBS溶液稀释后通过微纤维滤纸过滤,将滤液收集于干净的容器(提取液B)。
将免疫亲和柱连接于10mL玻璃针筒下,准确移取50mL提取液B过免疫亲和柱,以每秒1~2滴的流速全部通过亲和柱,直至空气流经亲和柱;将20mLPBS溶液以每秒1~2滴的流速通过亲和柱,直至空气流经亲和柱;准确移取5mLA以每秒1~2滴的流速全部通过亲和柱,直至空气流经亲和柱;将20mL超纯水以每秒1~2滴的流速淋洗柱子,直至空气流经亲和柱;弃去全部流出液。将1.5mL甲醇以每秒1滴的流速洗脱亲和柱,将洗脱液收集于玻璃试管中,当甲醇大部分过柱后,不要完全过柱,停止加压,静止5min,再将1.5mL甲醇以每秒1滴的流速洗脱亲和柱,将全部洗脱液收集于同一玻璃试管中,待测。
5)准确度和精密度的检测
以重复测定某一浓度样品的检测结果变异系数(CV%)作为精密度评价指标。以回收率作为准确度评价指标。变异系数 CV% 计算公式为:CV% =SD/ X ×100% ;其中 SD 为标准偏差,X 为测定数据的平均值。回收率计算公式为:回收率(%)= 实际测定值/理论值×100%。其中理论值为模拟样品的添加浓度。
采用上述待测液的制备方法,对玉米样品进行T-2毒素阳性添加,T-2毒素分别添加0.25μg/kg、0.35μg/kg、0.45μg/kg三个浓度水平的样品,每个添加水平做4个平行,选取PBS作为空白对照1,再选取未添加的玉米样品做空白对照2,利用实施例1中的荧光强度检测仪,参照实施例6中1)的试验步骤进行添加回收测定。样品的平均回收率及精密度结果见表6。
实验结果表明:平均回收率在88.2~89.6之间。变异系数均小于11%,说明方法精密度和准确度好,检测效果好。
实施例7应用荧光强度检测仪检测黄曲霉毒素B1
1)应用荧光强度检测仪检测黄曲霉毒素B1的方法
加入100μL待测液到采用实施例3中的方法制备的黄曲霉毒素B1单抗基底上,37°C下孵育2h,每孔加入200μL由实施例2提供的方法制备的浓度为200ng/mL的ZnSe/ZnS-黄曲霉毒素B1-BSA全抗原偶联量子点,经PBS洗涤离心3次,去除未与基底结合的量子点-黄曲霉毒素B1-BSA全抗原后每个微孔中加入0.01M,pH7.4的PBS缓冲液200μL,在370nm激发波长下用荧光强度检测仪检测520nm时的发射峰强度。
2)检测灵敏度的确定
采用上述检测方法,分别在基底中加入浓度为0μg/L、0.3μg/L、0.35μg/L、0.4μg/L、0.45μg/L、0.5μg/L、0.55μg/L的黄曲霉毒素B1溶液及空白溶液,在370nm激发波长下用荧光强度检测仪检测520nm时的发射峰强度。测试结果如图11所示,检出限为0.3μg/L。
3)交叉反应试验
根据实施例2和实施例3的方法制备好CdSe/ZnS-黄曲霉毒素B1-BSA全抗原和-黄曲霉毒素B1单抗基底,将三聚氰胺、伏马毒素B1、T-2毒素、黄曲霉毒素B1、赭曲霉毒素A、呕吐毒素和玉米赤霉烯酮分别配成系列浓度采用上述的检测方法进行特异性交叉试验,同时空白对照。计算各竞争物的 IC50。计算公式为:交叉反应率 (%) = [IC50(黄曲霉毒素B1)/IC50( 待测药物 )]×100。
测定及计算结果,结果表明该方法异性较强,只对黄曲霉毒素B1发生反应,而对其他毒性化合物没有交叉反应。
- 还没有人留言评论。精彩留言会获得点赞!