一种分离测定伊曲康唑光学异构体的方法与流程
本发明涉及一种光学异构体测定方法,特别是一种分离测定伊曲康唑光学异构体的方法。
背景技术:
伊曲康唑是一种三唑类广谱抗真菌药物,对深部真菌和浅表真菌均有抗菌作用,临床主要应用于深部真菌所引起的感染。这种药物一般口服或静脉注射,伊曲康唑的作用机制与其他氮唑类抗真菌药物一样,它抑制细胞膜色素P450氧化酶介导的麦角甾醇的合成。其英文名称为Itraconazole,中文化学名4-[4-[4-[4-[[cis-2-(2,4-二氯苯基)-2-(1H-1,2,4-三唑-1-基甲基)-1,3-二氧戊环-4-基]甲氧基]苯基]哌嗪-1-基]苯基]-2-[(1RS)-1-甲基丙基]-1,2,4-三唑-3-酮。伊曲康唑有4个光学异构体,分别为伊曲康唑2S,4R,2’R(异构体A)、伊曲康唑2S,4R,2’S(异构体C)、伊曲康唑2R,4S,2’R(异构体B)和伊曲康唑2R,4S,2’S(异构体D),分子式为C35H38Cl2N8O4,分子量为705.63,化学结构式为:
由于手性药物中各光学异构体的体内药理活性和药动学性质通常有较大的差异,现有分析技术很难分离出伊曲康唑的光学异构体,也难以对其光学异构体进行含量监控。因此,伊曲康唑光学异构体的测定方法对于最终产品的质量控制是非常重要的。
技术实现要素:
本发明的目的是针对现有技术中伊曲康唑的光学异构体难以分离和测定的技术问题,提供了一种准确分离测定伊曲康唑光学异构体、实现其质量控制的方法。
为实现上述目的,本发明采用的技术方案是:
一种分离测定伊曲康唑光学异构体的方法,所述方法为高效液相色谱法,包括以下步骤:将伊曲康唑溶解于有机溶剂中,得样品溶液;取样品溶液注入采用以多糖类衍生物键合硅胶为填料的手性柱,并以甲基叔丁基醚、甲醇和二乙醇胺的混合溶剂为流动相的高效液相色谱仪内,记录色谱图并进行分析。
所述有机溶剂为二氯甲烷。
所得样品溶液中伊曲康唑浓度为0.15mg~3.0mg/ml。
所述流动相中甲基叔丁基醚、甲醇和二乙醇胺的体积比为75~95:25~5:0~0.1。
进一步的,所述流动相中甲基叔丁基醚、甲醇和二乙醇胺的体积比为92:8:0.1。
所述流动相流速为0.6~1.8ml/min。所述色谱柱的柱温为30~40℃。
采用紫外检测器进行检测,检测波长为220nm~230nm。
有益效果:本发明采用的高效液相色谱法分离测定伊曲康唑光学异构体,在色谱条件下,可以将伊曲康唑的4个光学异构体完全分离,分离度均在1.5以上;并能够达到定量检测;保证生产出来的伊曲康唑光学异构体的含量在安全范围和有效范围内,实现对伊曲康唑光学异构体的原料及制剂的质量控制。
附图说明
图1是空白溶剂色图谱;
图2伊曲康唑2S,4R,2’R(异构体A)原料色谱图;
图3是伊曲康唑2S,4R,2’S(异构体C)原料色谱图;
图4是伊曲康唑2R,4S,2’R(异构体B)原料色谱图;
图5是伊曲康唑2R,4S,2’S(异构体D)原料色谱图;
图6是伊曲康唑供试品溶液色谱图;
图7是实施例2的高效液相色谱图;
图8是实施例3的高效液相色谱图;
图9是实施例4的高效液相色谱图;
图10是实施例5的高效液相色谱图;
图11是实施例6的高效液相色谱图;
图12是实施例7的高效液相色谱图;
图13是实施例8的高效液相色谱图;
图14是实施例9的高效液相色谱图;
图15是实施例10的高效液相色谱图。
具体实施方式
下面结合具体实施例对本发明作出详细说明。
下述实施例均按照高效液相色谱法(中国药典2015年版四部通则0512)进行。
仪器:Thermo Ultimate3000型高效液相色谱仪;
Thermo Ultimate3000紫外检测器。
实施例1
色谱条件
色谱柱:多糖类衍生物键合硅胶(CHIRALPAK IF-3,4.6×250mm,3um)为填料
流动相:甲基叔丁基醚-甲醇-二乙醇胺(80:20:0.1)
柱温:35℃
流速:0.7ml/min
进样体积:10ul
检测波长:225nm
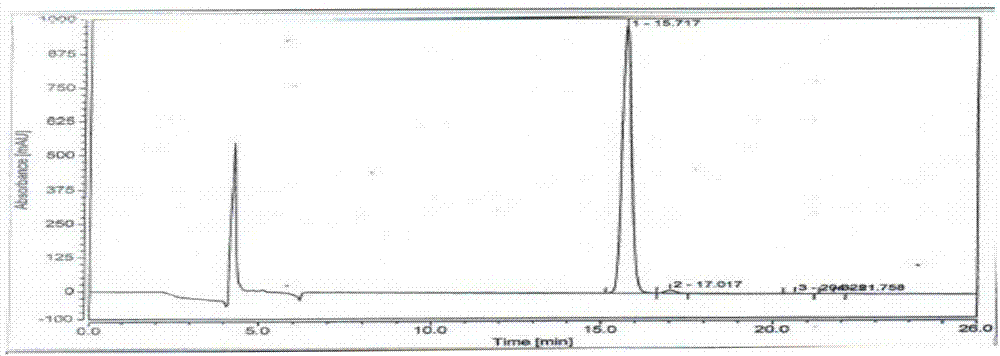
操作步骤:分别取伊曲康唑的4个光学异构体,精密称定,加二氯甲烷溶解并定量稀释制成每1ml中含0.8mg的溶液,作为系统适用性试验溶液;取伊曲康唑适量,加二氯甲烷溶解并定量稀释制成每1ml中含0.8mg的溶液,作为样品溶液。分别量取系统适用性溶液10ul注入液相色谱仪,记录色谱图,结果见图2-5。量取供试品溶液10ul注入液相色谱仪,记录色谱图,各色谱峰之间的分离度应大于1.5。结果见图6。
图1为空白溶剂图谱。图2为伊曲康唑2S,4R,2’R(异构体A)原料色谱图;图3为伊曲康唑2S,4R,2’S(异构体C)原料色谱图;图4为伊曲康唑2R,4S,2’R(异构体B)原料色谱图;图5为伊曲康唑2R,4S,2’S(异构体D)的原料色谱图。
图6中保留时间15.742的色谱峰为伊曲康唑2S,4R,2’R(异构体A),保留时间17.017的色谱峰为伊曲康唑2S,4R,2’S(异构体C),保留时间20.133的色谱峰为伊曲康唑2R,4S,2’R(异构体B),保留时间21.767的色谱峰为伊曲康唑2R,4S,2’S(异构体D)。由此可见,在上述条件下伊曲康唑4个光学异构体可以完全分离,满足中国药典的要求。
实施例2
色谱条件
色谱柱:多糖类衍生物键合硅胶(CHIRALPAK IF-3,4.6×250mm,3um)为填料
流动相:甲基叔丁基醚-甲醇-二乙醇胺(75:25:0.1)
柱温:30℃
流速:0.6ml/min
进样体积:10ul
检测波长:220nm
操作步骤:取伊曲康唑适量,加二氯甲烷溶解并定量稀释制成每1ml中含0.8mg的样品溶液,量取10ul注入液相色谱仪,记录色谱图,各色谱峰之间的分离度应大于1.5。结果见图7。
图7中保留时间13.225的色谱峰为伊曲康唑2S,4R,2’R(异构体A),保留时间14.117的色谱峰为伊曲康唑2S,4R,2’S(异构体C),保留时间16.100的色谱峰为伊曲康唑2R,4S,2’R(异构体B),保留时间17.233的色谱峰为伊曲康唑2R,4S,2’S(异构体D),在上述条件下伊曲康唑4个光学异构体可以完全分离,满足中国药典的要求。
实施例3
色谱条件
色谱柱:多糖类衍生物键合硅胶(CHIRALPAK IF-3,4.6×250mm,3um)为填料
流动相:甲基叔丁基醚-甲醇-二乙醇胺(85:15:0.1)
柱温:40℃
流速:0.7ml/min
进样体积:10ul
检测波长:230nm
操作步骤:取伊曲康唑适量,加二氯甲烷溶解并定量稀释制成每1ml中含0.8mg的样品溶液,量取10ul注入液相色谱仪,记录色谱图,各色谱峰之间的分离度应大于1.5。结果见图8。
图8中保留时间15.792的色谱峰为伊曲康唑2S,4R,2’R(异构体A),保留时间17.067的色谱峰为伊曲康唑2S,4R,2’S(异构体C),保留时间20.100的色谱峰为伊曲康唑2R,4S,2’R(异构体B),保留时间21.717的色谱峰为伊曲康唑2R,4S,2’S(异构体D),在上述条件下伊曲康唑4个光学异构体可以完全分离,满足中国药典的要求。
实施例4
色谱条件
色谱柱:多糖类衍生物键合硅胶(CHIRALPAK IF-3,4.6×250mm,3um)为填料
流动相:甲基叔丁基醚-甲醇-二乙醇胺(92:8:0.1)
柱温:35℃
流速:1.5ml/min
进样体积:10ul
检测波长:225nm
操作步骤:取伊曲康唑适量,加二氯甲烷溶解并定量稀释制成每1ml中含3.0mg的样品溶液,量取10ul注入液相色谱仪,记录色谱图,各色谱峰之间的分离度应大于1.5。结果见图9。
图9中保留时间16.367的色谱峰为伊曲康唑2S,4R,2’R(异构体A),保留时间18.225的色谱峰为伊曲康唑2S,4R,2’S(异构体C),保留时间26.000的色谱峰为伊曲康唑2R,4S,2’R(异构体B),保留时间28.333的色谱峰为伊曲康唑2R,4S,2’S(异构体D),在上述条件下伊曲康唑4个光学异构体可以完全分离,满足中国药典的要求。
实施例5
色谱条件
色谱柱:多糖类衍生物键合硅胶(CHIRALPAK IF-3,4.6×250mm,3um)为填料
流动相:甲基叔丁基醚-甲醇-二乙醇胺(90:10:0.1)
柱温:35℃
流速:1.5ml/min
进样体积:10ul
检测波长:225nm
操作步骤:取伊曲康唑适量,加二氯甲烷溶解并定量稀释制成每1ml中含3.0mg的样品溶液,量取10ul注入液相色谱仪,记录色谱图,各色谱峰之间的分离度应大于1.5。结果见图10。
图10中保留时间12.483的色谱峰为伊曲康唑2S,4R,2’R(异构体A),保留时间13.742的色谱峰为伊曲康唑2S,4R,2’S(异构体C),保留时间18.367的色谱峰为伊曲康唑2R,4S,2’R(异构体B),保留时间19.975的色谱峰为伊曲康唑2R,4S,2’S(异构体D),在上述条件下伊曲康唑4个光学异构体可以完全分离,满足中国药典的要求。
实施例6
色谱条件
色谱柱:多糖类衍生物键合硅胶(CHIRALPAK IF-3,4.6×250mm,3um)为填料
流动相:甲基叔丁基醚-甲醇-二乙醇胺(91:9:0.1)
柱温:35℃
流速:1.5ml/min
进样体积:10ul
检测波长:225nm
操作步骤:取伊曲康唑适量,加二氯甲烷溶解并定量稀释制成每1ml中含3.0mg的样品溶液,量取10ul注入液相色谱仪,记录色谱图,各色谱峰之间的分离度应大于1.5。结果见图11。
图11中保留时间13.933的色谱峰为伊曲康唑2S,4R,2’R(异构体A),保留时间15.358的色谱峰为伊曲康唑2S,4R,2’S(异构体C),保留时间20.833的色谱峰为伊曲康唑2R,4S,2’R(异构体B),保留时间22.658的色谱峰为伊曲康唑2R,4S,2’S(异构体D),在上述条件下伊曲康唑4个光学异构体可以完全分离,满足中国药典的要求。
实施例7
色谱条件
色谱柱:多糖类衍生物键合硅胶(CHIRALPAK IF-3,4.6×250mm,3um)为填料
流动相:甲基叔丁基醚-甲醇-二乙醇胺(93:7:0.1)
柱温:35℃
流速:1.5ml/min
进样体积:10ul
检测波长:225nm
操作步骤:取伊曲康唑适量,加二氯甲烷溶解并定量稀释制成每1ml中含3.0mg的样品溶液,量取10ul注入液相色谱仪,记录色谱图,各色谱峰之间的分离度应大于1.5。结果见图12。
图12中保留时间20.025的色谱峰为伊曲康唑2S,4R,2’R(异构体A),保留时间22.392的色谱峰为伊曲康唑2S,4R,2’S(异构体C),保留时间33.200的色谱峰为伊曲康唑2R,4S,2’R(异构体B),保留时间36.150的色谱峰为伊曲康唑2R,4S,2’S(异构体D),在上述条件下伊曲康唑4个光学异构体可以完全分离,满足中国药典的要求。
实施例8
色谱条件
色谱柱:多糖类衍生物键合硅胶(CHIRALPAK IF-3,4.6×250mm,3um)为填料
流动相:甲基叔丁基醚-甲醇-二乙醇胺(94:6:0.1)
柱温:35℃
流速:1.5ml/min
进样体积:10ul
检测波长:225nm
操作步骤:取伊曲康唑适量,加二氯甲烷溶解并定量稀释制成每1ml中含3.0mg的样品溶液,量取10ul注入液相色谱仪,记录色谱图,各色谱峰之间的分离度应大于1.5。结果见图13。
图13中保留时间23.800的色谱峰为伊曲康唑2S,4R,2’R(异构体A),保留时间26.625的色谱峰为伊曲康唑2S,4R,2’S(异构体C),保留时间40.733的色谱峰为伊曲康唑2R,4S,2’R(异构体B),保留时间44.183的色谱峰为伊曲康唑2R,4S,2’S(异构体D),在上述条件下伊曲康唑4个光学异构体可以完全分离,满足中国药典的要求。
实施例9
色谱条件
色谱柱:多糖类衍生物键合硅胶(CHIRALPAK IF-3,4.6×250mm,3um)为填料
流动相:甲基叔丁基醚-甲醇-二乙醇胺(92:8:0.1)
柱温:35℃
流速:1.8ml/min
进样体积:10ul
检测波长:225nm
操作步骤:取伊曲康唑适量,加二氯甲烷溶解并定量稀释制成每1ml中含3.0mg的样品溶液,量取10ul注入液相色谱仪,记录色谱图,各色谱峰之间的分离度应大于1.5。结果见图14。
图14中保留时间13.308的色谱峰为伊曲康唑2S,4R,2’R(异构体A),保留时间14.800的色谱峰为伊曲康唑2S,4R,2’S(异构体C),保留时间21.000的色谱峰为伊曲康唑2R,4S,2’R(异构体B),保留时间22.875的色谱峰为伊曲康唑2R,4S,2’S(异构体D),在上述条件下伊曲康唑4个光学异构体可以完全分离,满足中国药典的要求。
实施例10
色谱条件
色谱柱:多糖类衍生物键合硅胶(CHIRALPAK IF-3,4.6×250mm,3um)为填料
流动相:甲基叔丁基醚-甲醇(92:8)
柱温:35℃
流速:1.5ml/min
进样体积:10ul
检测波长:225nm
操作步骤:取伊曲康唑适量,加二氯甲烷溶解并定量稀释制成每1ml中含3.0mg的样品溶液,量取10ul注入液相色谱仪,记录色谱图,各色谱峰之间的分离度应大于1.5。结果见图15。
图15中保留时间17.482的色谱峰为伊曲康唑2S,4R,2’R(异构体A),保留时间28.597的色谱峰为伊曲康唑2S,4R,2’S(异构体C),保留时间19.703的色谱峰为伊曲康唑2R,4S,2’R(异构体B),保留时间31.413的色谱峰为伊曲康唑2R,4S,2’S(异构体D),在上述条件下伊曲康唑4个光学异构体可以完全分离,满足中国药典的要求。
- 还没有人留言评论。精彩留言会获得点赞!