一种多孔硅光子晶体生物检测方法与流程
本发明属于生物样品检测领域,具体涉及一种多孔硅光子晶体生物检测方法。
背景技术:
生物传感器是一类特殊形式的传感器,由生物分子识别元件与各类物理、化学换能器组成,用于各种生命物质和化学物质的分析和检测。生物传感器融生物学、化学、物理学、信息科学及相关技术于一体,已经发展成为一个十分活跃的研究领域。
多孔硅作为基底材料用于生物检测已经被广泛的作为实验研究和应用。多孔硅通过电化学腐蚀的时候交替使用不同电流,可以制备出各种多孔硅多层结构,电化学腐蚀技术配合光刻等技术还可以制备出多孔硅波导、多孔硅光栅等各种结构。无论哪种类型的多孔硅生物传感器归根到底原理都是生物分子进入了多孔硅层的多孔结构后增大了多孔硅层的折射率,折射率增大的多少和进入生物分子的多少有关,因此利用多孔硅层的折射率的改变,就可以通过计算机模拟加入生物的实验。
目前报道的基于多孔硅微腔的生物传感器很多,检测方法包括:反射光谱的检测和拉曼、荧光光谱的检测。
多孔硅是一种优良的生物材料,其比表面积大、生物亲和性好、能形成多种光子晶体结构,在生物传感领域具有很好的应用。目前已报道的各种多孔硅生物传感器,主要有基于折射率变化和荧光变化的两类传感器,其中基于折射率变化的生物传感器具有免标记的优点。结合多孔硅光子晶体技术,基于折射率变化检测的生物传感器可以获得极高的检测灵敏度。多孔硅制备工艺简单,通过改变电化学腐蚀的条件,如硅片的类型、掺杂,电解液的配比,腐蚀电流密度等,就能够控制多孔硅的孔洞大小、空隙率和多孔硅层的厚度。多孔硅大的比表面积可以吸附和偶联大量的化学和生物分子。这些优势使得多孔硅成为高灵敏度免标记的光学生物化学传感器的基底材料。生物分子和多孔硅结合可以引起不同结构多孔硅的有效折射率的变化,通过观察反射光谱的变化如单层多孔硅干涉峰的移动,布拉格反射镜禁带中心位置的移动,微腔的缺陷态位置的移动,就能检测到生物化学分子。
技术实现要素:
本发明的目的是提供一种多孔硅光子晶体生物检测方法,以提高生物检测灵敏度。
为了解决上述技术问题,本发明提供了如下的技术方案:
一种多孔硅光子晶体生物检测方法,包括如下步骤:
s1、采用n型重掺杂硅片制备多孔硅微腔;
s2、将目标生物样品与cdse/zns量子点进行偶联;
s3、将多孔硅微腔与dna探针连接;
s4、将步骤s2得到的目标生物样品滴加到连接dna探针的多孔硅微腔上,使目标生物样品与dna探针杂交;用紫外可见分光光谱仪测量样品的反射光谱,通过杂交前后反射谱缺陷态位置的移动,来检测目标生物样品的浓度。
优选地,采用n型重掺杂硅片制备多孔硅微腔的过程如下:
选用电阻率为0.01~0.02ω·cm,晶向为(100)的n型重掺杂硅片,清洗备用;
对清洗后的n型重掺杂硅片进行恒流电化学腐蚀,腐蚀液采用浓度为5wt%的氢氟酸溶液,先分别在14ma/cm2、4.5s和25ma/cm2、4s的条件下交替腐蚀四个周期,每次间隔5s;然后用14ma/cm2腐蚀9s;接着分别在14ma/cm2、4.5s和25ma/cm2、4s的条件下交替腐蚀四个周期,每次间隔5s。
优选地,目标生物样品与cdse/zns量子点偶联的过程如下:
先将羧基修饰的cdse/zns量子点与edc和n-羟基琥珀酰亚胺磺酸钠盐反应,使羧基活化,再加入氨基修饰的目标生物样品,遮光反应,得到偶联cdse/zns量子点的目标生物样品。
优选地,cdse/zns量子点与目标生物样品的摩尔比为1:5。
优选地,将多孔硅微腔与dna探针连接的过程如下:
向醛基功能化的多孔硅微腔上滴加dna探针溶液,反应2小时后,清洗吹干,再用丙烯酸乙酯溶液浸泡,取出清洗吹干。
优选地,多孔硅微腔的醛基功能化过程如下:
先用双氧水浸泡多孔硅微腔,对多孔硅微腔进行氧化处理;
然后将经过氧化处理的多孔硅微腔用3-氨丙基三乙氧基硅烷溶液浸泡,得到硅烷化的多孔硅微腔;
最后将硅烷化的多孔硅微腔用戊二醛溶液浸泡,即得到醛基功能化的多孔硅微腔。
附图说明
附图用来提供对本发明的进一步理解,并且构成说明书的一部分,与本发明的实施例一起用于解释本发明,并不构成对本发明的限制。在附图中:
图1为本发明多孔硅表面的扫描电子显微镜图;
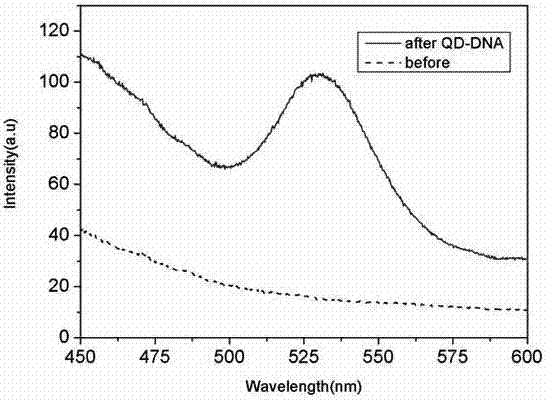
图2为本发明偶联量子点的dna的光致发光光谱图;
图3为本发明的原理图;
图4为本发明多孔硅微腔反射谱缺陷态的位置移动图;
图5为本发明多孔硅微腔缺陷态移动与目标dna浓度的关系图。
具体实施方式
以下结合附图对本发明的优选实施例进行说明,应当理解,此处所描述的优选实施例仅用于说明和解释本发明,并不用于限定本发明。
实施例1
s1、多孔硅微腔(psm)的制备:采用n型重掺杂硅片,电阻率(0.01-0.02欧姆•cm),(100)晶向。硅片切成1×1cm2的小片,经过丙酮、乙醇和去离子水超声清洗各10分钟,吹干备用。用单电解槽恒流电化学腐蚀,腐蚀液采用浓度约为5%的氢氟酸水溶液(25ml40%的hf加入200ml水),通过控制腐蚀电流密度和时间来获得多孔硅微腔,具体腐蚀过程为:先按14ma/cm24.5s和25ma/cm24s交替腐蚀4个周,每次间隔5s;然后进行中间微腔腐蚀,电流密度为14ma,时间为9s;中间微腔腐蚀完成后,再按14ma/cm24.5s和25ma/cm24s交替腐蚀4个周,每次间隔5s。n型多孔硅孔径都比较大,腐蚀电流为14ma和28ma的孔洞分别如图1a和1b所示,孔洞大小分别约为30-40nm和40-50nm。孔洞的大小足够生物分子和量子点进入多孔硅。电流14ma的孔呈圆形,孔壁比较厚;电流28ma的孔洞形状不规则,孔壁较薄。
s2、量子点与目标dna偶联:用羧基修饰的cdse/zns量子点(购于武汉伽源量子点公司,qd525)与氨基修饰的目标dna(由英捷(invitrogen)公司提供)偶联。取50ul水溶性羧基修饰的cdse/zns量子点(浓度为8um),用pbs(ph7.5)稀释至1um。然后依次加入40ul浓度为0.01m的edc(1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐)和40ul浓度为0.01m的sul-nhs(n-羟基琥珀酰亚胺磺酸钠盐)对羧基进行活化,反应10分钟后加入50ul浓度为40um的氨基修饰的目标dna,遮光震荡反应10小时。取出后10000r/min离心10分钟,去上清留下沉淀。用pbs(ph7.5)稀释成不同浓度的目标dna溶液放入4度冰箱保存,备用。也可按现有常规方式对cdse/zns量子点进行羧基修饰,对目标dna进行氨基修饰,本发明对此并无特别的要求。
s3、多孔硅微腔连接dna探针:用微量仪向经过醛基功能化的多孔硅微腔上滴加50ul浓度10um的dna探针(与未修饰的目标dna互补),37℃恒温反应2小时后取出用pbs冲洗去除过量的dna探针,吹干。然后用3m的ea(丙烯酸乙酯)溶于hepes缓冲液(ph9)在37℃恒温浸泡一小时,对多余的和未反应的醛基官能团进行封闭。取出后用pbs(ph7.5)冲洗吹干。
多孔硅微腔的醛基功能化具体操作如下:氧化:已经制备好的多孔硅微腔样品在30wt%的双氧水中浸泡氧化12小时;硅烷化:再把样品浸泡在5wt%的aptes溶液(甲醇和水1:1v/v作为溶剂)50min,用去离子水和甲(乙)醇冲洗,吹干后100℃烘烤10min,取出用去离子水冲洗,氮气下吹干;与戊二醛反应:硅烷化的样品表面带有氨基,可以与戊二醛反应,硅烷化的样品在2.5wt%的戊二醛溶液中浸泡50min。取出用pbs(ph7.5)溶液冲洗,氮气室温吹干。
s4、目标dna的检测:取50ul步骤s2的目标dna滴加到连接dna探针的多孔硅微腔上。37℃恒温反应2小时,使dna进行杂交。取出后用pbs冲洗,洗掉没有杂交连接上的目标dna,吹干。用紫外可见分光光谱仪(hitachiu-4100,入射角5度)测量反射光谱。通过杂交前后反射谱缺陷态位置的移动,来检测目标生物样品的浓度。
图2给出了偶联量子点的dna的光致发光光谱和没有偶联量子点的dna的光致发光光谱。有量子点的目标dna和的多孔硅微腔上的nda探针杂交后,样品会有荧光。
本发明的原理如图3所示,连接dna探针的多孔硅微腔和偶联量子点的dna杂交后样品的反射谱与和没有偶联量子点的对照dna杂交后相比有着更加明显的移动。当分子和多孔硅结合时,多孔硅的有效折射率变大,反射谱发生红移。红移的量和折射率的变化在一定的范围内呈现线性的关系。
多孔硅微腔的反射谱的高反射区中的缺陷态位于650nm附近。当连接dna探针的多孔硅微腔与偶联量子点的目标dna杂交后,反射谱缺陷态位置呈现有规律的红移。反射谱缺陷态位置变化如图4所示,a-e依次为多孔硅微腔功能化过程(氧化,硅烷化,和戊二醛反应),连接dna探针和检测目标dna时的反射谱。通过反射谱的移动可以反映出多孔硅微腔的功能化过程和检测dna时多孔硅微腔折射率的变化。
图5分别给出了偶联量子点的目标dna和未偶联量子点的对照目标dna不同浓度时反射谱共振峰(缺陷态)的红移量。量子点-dna的浓度分别为0.1um,0.5um,1um,2.5um和5um时杂交前后反射谱的红移量分别为11nm,18nm,23.5nm,28nm和31nm。没有量子点修饰的对照dna浓度分别为0.5um,1um,2.5um和5um时杂交前后反射谱的红移量分别为10nm,14nm,18nm,23nm。从图中可以看出浓度相同时量子点-dna的反射谱红移量比对照dna大。如图5中c点所示量子点-dna浓度为1um时的红移量和c′点对照dna浓度为5um时的红移量相当,b点0.5um时量子点-dna的红移量和b′点对照dna浓度2.5um时的红移量相当,a点0.1um时量子点-dna的红移量和a′点对照dna浓度为0.5um时的红移量相当。即量子点-dna的检测灵敏度是常规的dna检测灵敏度的约5倍。从图5可以看出,在dna浓度低于0.5um时,数据点的连线的斜率比浓度在1um到5um区间内的斜率更大。所以从变化趋势可以看出,本发明的检测灵敏度比用常规dna检测要高至少5倍。
目前最新的多孔硅生物光学传感器的检测极限在10nm的水平,本文中用多孔硅微腔检测没有偶联量子点的对照dna时传感器的检测极限也处于这一水平。但偶联量子点后dna的检测灵敏度要提高5倍,在检测更低浓度的dna时传感器仍有比一般方法更大的响应。
最后应说明的是:以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!