基于酶与氧化石墨烯适配体传感器检测凝血酶的方法与流程
本发明涉及凝血酶检测技术领域。更具体地说,本发明涉及一种基于酶与氧化石墨烯适配体传感器检测凝血酶的方法。
背景技术:
抗体虽然用于生物识别元件从发现到发展已有70多年,但是一系列缺陷(储存时间短、易降解、对ph、温度、酸碱度敏感等)不可避免地摆在人们面前。在生物检测中理想的传感器模型应该是响应快、耗时短、灵敏度高、易于小型化的,发展能够克服抗体的缺陷的类抗体物逐渐成为研究的热门。核酸适配体因亲和力强、特异性高、获得途径简单、稳定性好等诸多优点,成为了最具潜力替代抗体的生物分子识别物质,使其在近年得到了快速发展。
目前,研究如何利用适配体作为传感器建立高效、高灵敏、高特异性的的检测目标分子的新方法成为新趋势。本文选用凝血酶作为研究模型,建立利用适配体传感器检测的新方法。凝血酶是一种重要的多功能蛋白酶,催化纤维蛋白原转化撑纤维蛋白,参与凝血联级过程的各个环节,促进凝血,在生物、化学、药理等领域有着广泛的应用,浓度变化异常会导致一些疾病的发生,如血栓、弥散性小管内凝血等,因此血液中凝血酶含量的测定对人体健康非常重要。传统的检测凝血酶方法技术复杂,时间长,近年来,利用适配体凝血酶的检测方法也非常多,但仍存在操作方法复杂、反应时间长、灵敏度不高等缺陷。
技术实现要素:
本发明的一个目的是解决至少上述问题,并提供至少后面将说明的优点。
本发明还有一个目的是提供一种方法操作简单、检测快速且灵敏度高,能进行混合样品溶液中对凝血酶的高灵敏识别,对凝血酶的检出限达0.39×10-9mol/l。
为了实现根据本发明的这些目的和其它优点,提供了一种基于酶与氧化石墨烯适配体传感器检测凝血酶的方法,包括以下步骤:
步骤一、制备n份不同浓度的凝血酶标准溶液,其中,n≥2;
步骤二、制备n份待检测标准溶液,具体为:向双链dna溶液分为n份,并分别一一对应添加相同体积的不同浓度的凝血酶标准溶液,控制温度为35-39℃,混合25-35min后,得多份凝血酶双链dna溶液,向每份凝血酶双链dna溶液中依次加入荧光素标记dna溶液、内切酶nb.bbvci、及cutsmar缓冲液,控制温度为35-39℃,反应110-130min,继续添加氧化石墨烯分散液,静置6-10min后得多份待检测标准溶液。
优选的是,步骤二中双链dna溶液的制备方法具体为:将凝血酶适配体dna溶液加入缓冲溶液中并加入互补单链dna溶液,升温至93-97℃后缓慢冷却至室温,得双链dna溶液,其中,缓冲溶液为ph为7.4,浓度为0.075mol/l的tris-hcl缓冲溶液,凝血酶适配体dna溶液和互补单链dna溶液体积比为1:1,浓度比为1:1。
优选的是,步骤一中,n=10,10份凝血酶标准溶液的浓度分别为:0mol/l,5×10-10mol/l,1×10-9mol/l,2×10-9mol/l,5×10-9mol/l,1×10-8mol/l,2×10-8mol/l,4×10-8mol/l,6×10-8mol/l,1×10-7mol/l;
步骤二中,将双链dna溶液分为10份,每份中加入的凝血酶标准溶液的体积均为20μl,10份待检测标准溶液中双链dna的浓度均为1×10-8mol/l,荧光素标记dna的浓度均为1.5×10-8mol/l,氧化石墨烯的浓度均为65mg/ml,内切酶nb.bbvci为10u。
优选的是,所述的基于酶与氧化石墨烯适配体传感器检测凝血酶的方法,还包括:步骤三、绘制线性方程,具体为:
设定激发波长为496nm,激发狭缝和发射狭缝均为10nm,用rf-6000荧光分光光度计,检测每份待检测标准溶液的荧光光谱图,并得到每份待检测标准溶液在发射波长为522nm处的荧光强度,以每份待检测标准溶液的荧光强度为纵坐标,对应待检测标准溶液的凝血酶浓度为横坐标作标准曲线,得线性方程。
优选的是,升温至93-97℃后缓慢冷却至室温具体为:置于水浴锅中升温至93-97℃后,关闭水浴锅开关,至水浴锅内水体温度冷却至室温。
优选的是,多份标准溶液中cutsmar缓冲液与标准溶液的体积比为1:100,每毫升cutsmar缓冲液中包括:50mmol乙酸钾、20mmol三(羟甲基)氨基甲烷醋酸盐、10mmol乙酸镁、及100μg牛血清白蛋白。
优选的是,氧化石墨烯分散液在添加前超声8-12min。
优选的是,凝血酶标准溶液、凝血酶适配体dna溶液、及互补单链dna溶液的溶剂为蒸馏水或tris-hcl缓冲溶液中的一种。
本发明至少包括以下有益效果:采用本发明的基于酶与氧化石墨烯适的配体传感器对凝血酶的检测,方法操作简单、检测快速且灵敏度高,能进行混合样品(例如血清样品)中对凝血酶的高灵敏识别,对凝血酶的检出限达0.39×10-9mol/l。
本发明的其它优点、目标和特征将部分通过下面的说明体现,部分还将通过对本发明的研究和实践而为本领域的技术人员所理解。
附图说明
图1是本发明的流程示意图;
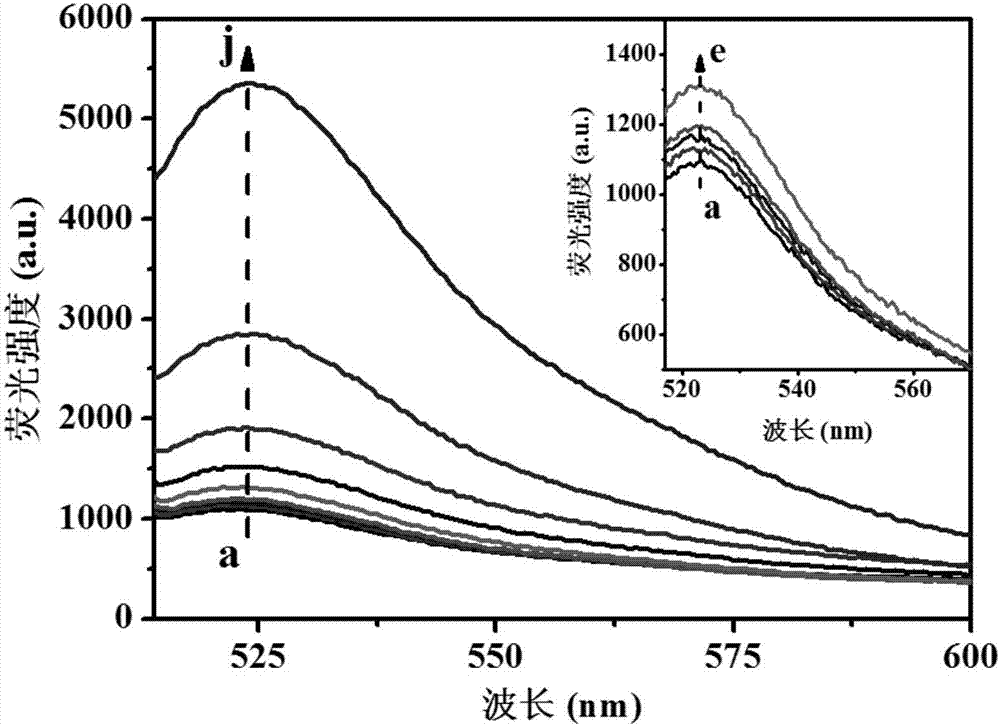
图2是本发明的多份标准溶液在激发波长为496nm时的荧光光谱图;
图3是本发明的所述线性关系图。
具体实施方式
下面结合实施例对本发明做进一步的详细说明,以令本领域技术人员参照说明书文字能够据以实施。
<实施例1>
一种基于酶与氧化石墨烯适配体传感器检测凝血酶的方法,包括以下步骤:
步骤一、制备10份不同浓度的凝血酶标准溶液,10份凝血酶标准溶液的浓度分别为:0mol/l,5×10-10mol/l,1×10-9mol/l,2×10-9mol/l,5×10-9mol/l,1×10-8mol/l,2×10-8mol/l,4×10-8mol/l,6×10-8mol/l,1×10-7mol/l;
步骤二、制备10份待检测标准溶液,具体为:
向凝血酶适配体dna溶液加入缓冲溶液中并加入互补单链dna溶液,置于水浴锅中升温至93℃后,关闭水浴锅开关,至水浴锅内水体温度冷却至室温,得双链dna溶液,其中,缓冲溶液为ph为7.4,浓度为0.075mol/l的tris-hcl缓冲溶液,凝血酶适配体dna溶液和互补单链dna溶液体积比为1:1,浓度比为1:1;
将双链dna溶液分为10份,并分别一一对应添加20μl的不同浓度的凝血酶标准溶液,控制温度为35℃,混合25min后,得多份凝血酶双链dna溶液,向每份凝血酶双链dna溶液中依次加入荧光素标记dna溶液、内切酶nb.bbvci、及cutsmar缓冲液,控制温度为35℃,反应110min,继续添加氧化石墨烯分散液,静置6min后得10份待检测标准溶液,其中,10份待检测标准溶液中双链dna的浓度均为1×10-8mol/l,荧光素标记dna的浓度均为1.5×10-8mol/l,氧化石墨烯的浓度均为65mg/ml,内切酶nb.bbvci为10u,10份待检测标准溶液中cutsmar缓冲液与待检测标准溶液的体积比为1∶100,每毫升cutsmar缓冲液中包括:50mmol乙酸钾、20mmol三(羟甲基)氨基甲烷醋酸盐、10mmol乙酸镁、及100μg牛血清白蛋白,氧化石墨烯分散液加入前置于超声仪器中超声8min,凝血酶标准溶液、凝血酶适配体dna溶液、及互补单链dna溶液的溶剂为蒸馏水;
步骤三、绘制线性方程,具体为:
设定激发波长为496nm,激发狭缝和发射狭缝均为10nm,用rf-6000荧光分光光度计,检测每份待检测标准溶液的荧光光谱图,并得到每份待检测标准溶液在发射波长为522nm处的荧光强度,以每份待检测标准溶液的荧光强度为纵坐标,对应待检测标准溶液的凝血酶浓度为横坐标线性拟合作标准曲线,得线性方程。
<实施例2>
一种基于酶与氧化石墨烯适配体传感器检测凝血酶的方法,包括以下步骤:
步骤一、制备10份不同浓度的凝血酶标准溶液,10份凝血酶标准溶液的浓度分别为:0mol/l,5×10-10mol/l,1×10-9mol/l,2×10-9mol/l,5×10-9mol/l,1×10-8mol/l,2×10-8mol/l,4×10-8mol/l,6×10-8mol/l,1×10-7mol/l;
步骤二、制备10份待检测标准溶液,具体为:
向凝血酶适配体dna溶液加入缓冲溶液中并加入互补单链dna溶液,置于水浴锅中升温至97℃后,关闭水浴锅开关,至水浴锅内水体温度冷却至室温,得双链dna溶液,其中,缓冲溶液为ph为7.4,浓度为0.075mol/l的tris-hcl缓冲溶液,凝血酶适配体dna溶液和互补单链dna溶液体积比为1∶1,浓度比为1∶1;
将双链dna溶液分为10份,并分别一一对应添加20μl的不同浓度的凝血酶标准溶液,控制温度为39℃,混合35min后,得多份凝血酶双链dna溶液,向每份凝血酶双链dna溶液中依次加入荧光素标记dna溶液、内切酶nb.bbvci、及cutsmar缓冲液,控制温度为39℃,反应130min,继续添加氧化石墨烯分散液,静置10min后得10份待检测标准溶液,其中,10份待检测标准溶液中双链dna的浓度均为1×10-8mol/l,荧光素标记dna的浓度均为1.5×10-8mol/l,氧化石墨烯的浓度均为65mg/ml,内切酶nb.bbvci为10u,10份待检测标准溶液中cutsmar缓冲液与待检测标准溶液的体积比为1∶100,每毫升cutsmar缓冲液中包括:50mmol乙酸钾、20mmol三(羟甲基)氨基甲烷醋酸盐、10mmol乙酸镁、及100μg牛血清白蛋白,氧化石墨烯分散液加入前置于超声仪器中超声12min,凝血酶标准溶液、凝血酶适配体dna溶液、及互补单链dna溶液的溶剂为tris-hcl缓冲溶液;
步骤三、绘制线性方程,具体为:
设定激发波长为496nm,激发狭缝和发射狭缝均为10nm,用rf-6000荧光分光光度计,检测每份待检测标准溶液的荧光光谱图,并得到每份待检测标准溶液在发射波长为522nm处的荧光强度,以每份待检测标准溶液的荧光强度为纵坐标,对应待检测标准溶液的凝血酶浓度为横坐标线性拟合作标准曲线,得线性方程。
<实施例3>
一种基于酶与氧化石墨烯适配体传感器检测凝血酶的方法,包括以下步骤:
步骤一、制备10份不同浓度的凝血酶标准溶液,10份凝血酶标准溶液的浓度分别为:0mol/l,5×10-10mol/l,1×10-9mol/l,2×10-9mol/l,5×10-9mol/l,1×10-8mol/l,2×10-8mol/l,4×10-8mol/l,6×10-8mol/l,1×10-7mol/l;
步骤二、制备10份待检测标准溶液,具体为:
向凝血酶适配体dna溶液加入缓冲溶液中并加入互补单链dna溶液,置于水浴锅中升温至95℃后,关闭水浴锅开关,至水浴锅内水体温度冷却至室温,得双链dna溶液,其中,缓冲溶液为ph为7.4,浓度为0.075mol/l的tris-hcl缓冲溶液,凝血酶适配体dna溶液和互补单链dna溶液体积比为1∶1,浓度比为1∶1;
将双链dna溶液分为10份,并分别一一对应添加20μl的不同浓度的凝血酶标准溶液,控制温度为37℃,混合30min后,得多份凝血酶双链dna溶液,向每份凝血酶双链dna溶液中依次加入荧光素标记dna溶液、内切酶nb.bbvci、及cutsmar缓冲液,控制温度为37℃,反应120min,继续添加氧化石墨烯分散液,静置8min后得10份待检测标准溶液,其中,10份待检测标准溶液中双链dna的浓度均为1×10-8mol/l,荧光素标记dna的浓度均为1.5×10-8mol/l,氧化石墨烯的浓度均为65mg/ml,内切酶nb.bbvci为10u,10份待检测标准溶液中cutsmar缓冲液与待检测标准溶液的体积比为1∶100,每毫升cutsmar缓冲液中包括:50mmol乙酸钾、20mmol三(羟甲基)氨基甲烷醋酸盐、10mmol乙酸镁、及100μg牛血清白蛋白,氧化石墨烯分散液加入前置于超声仪器中超声10min,凝血酶标准溶液、凝血酶适配体dna溶液、及互补单链dna溶液的溶剂为蒸馏水或tris-hcl缓冲溶液中的一种;
步骤三、绘制线性方程,具体为:
如图2所示,设定激发波长为496nm,激发狭缝和发射狭缝均为10nm,用rf-6000荧光分光光度计,检测每份待检测标准溶液的荧光光谱图,如图2所示,凝血酶标准溶液中凝血酶浓度由小至大依次对应图1中a-j线,并得到每份待检测标准溶液在发射波长为522nm处的荧光强度,以每份待检测标准溶液的荧光强度为纵坐标,对应待检测标准溶液的凝血酶浓度为横坐标线性拟合作标准曲线,如图3所示,得线性方程,线性方程具体为y=1113.86+42.69q,其中,y为荧光强度,q为凝血酶标准溶液中凝血酶浓度,单位为nmol/l,待检测标准溶液对应的荧光强度随加入的凝血酶标准溶液中凝血酶浓度的增加而增强,且荧光强度与凝血酶标准溶液中凝血酶浓度有良好的线性关系,r2=0.9992,对凝血酶的检出限达0.39×10-9mol/l。
其中,实施例1、实时例2以及实施例3中凝血酶适配体dna溶液中凝血酶适配体dna的序列均为:5′-tatagtccgtggtagggcaggttggggtgact-3′;(seqidno.1)
互补单链dna溶液中互补单链dna的序列均为:
5′-agtcacacggactatacctcagcaat-3′;(seqidno.2)
荧光素标记dna溶液中荧光素标记dna的序列均为:
5′-fam-attgctgaggtat-3′,(seqidno.3)其中,gctgagg是识别序列。
<检测血清样品中凝血酶浓度>
在实施例3的基础上,以待检测血清样品20μl代替凝血酶标准溶液,加入与实施例3相同体积的双链dna溶液中,后续按照配置待检测标准溶血的方式配置待检测血清溶液,设定激发波长为496nm,激发狭缝和发射狭缝均为10nm,用rf-6000荧光分光光度计,检测待检测血清溶液的荧光光谱,并得到待检测血清溶液在发射波长为522nm处的荧光强度y,带入实施例3中得到的线性方程,即可得到20μl待检测血清样品中凝血酶的浓度。
本发明的反应基理:
如图1所示,在无凝血酶(thrombin)存在的情况下,由凝血酶适配体dna(thrombinaptamer)与互补单链dna(link-dna)混合制备的双链dna(dsdna-aptamer)与荧光素标记dna(fam-dna)能共存于缓冲溶液中,加入氧化石墨烯(go),fam-dna与go间能够通过π-π堆积作用发生结合,从而发生荧光共振能量转移,进而使fam-dna产生的荧光发生猝灭。而当thrombin存在的情况下,dsdna-aptamer中的thrombinaptamer会与thrombin特异性识别和绑定,于此同时释放出link-dna,link-dna与fam-dna进行互补配对,形成荧光素标记的双链dna(fam-dsdna),在溶液中含有内切酶nb.bbvci时,fam-dsdna的底链会被内切酶nb.bbvci识别和切割,从而得到只有5个碱基数量的短链荧光素标记dna。由于go对于小于6个碱基数量的dna表现出的亲和力很微弱,则go与短链荧光素标记dna之间不能发生荧光共振能量转移,体系中的荧光信号增强,即,当fam-dsdna的底链被内切酶nb.bbvci识别和切割时,link-dna将会从不稳定的fam-dsdna中解离并释放出来,重新回到溶液中与另一个fam-dna互补配对,进而再次被nb.bbvci识别和切割。如此循环,可达到荧光信号放大的效果。随着加入凝血酶浓度的增大,更多的link-dna会被释放出来,荧光信号也会不断地增强。因此,该方法可以灵敏地检测凝血酶的含量;
其中,适配体对目标物具有很高特异性和亲和力,其本身也具有较好的稳定性,因此适配体广泛应用于药物检测、生物传感器、医学诊断等方面,go在生物传感器应用上可作为荧光的猝灭剂,因go表面丰富的含氧官能团,使其表现出超强的亲水性,能够均匀分散在水溶液中,增加了go与分子之间相互作用的可能性,另一方面go拥有较大的比表面和共轭π结构,能使单链dna快速吸附到其表面。
这里说明的设备数量和处理规模是用来简化本发明的说明的。对本发明的应用、修改和变化对本领域的技术人员来说是显而易见的。
尽管本发明的实施方案已公开如上,但其并不仅仅限于说明书和实施方式中所列运用,它完全可以被适用于各种适合本发明的领域,对于熟悉本领域的人员而言,可容易地实现另外的修改,因此在不背离权利要求及等同范围所限定的一般概念下,本发明并不限于特定的细节和这里示出与描述的图例。
sequencelisting
<110>广西师范学院
<120>基于酶与氧化石墨烯适配体传感器检测凝血酶的方法
<160>3
<170>patentinversion3.5
<210>1
<211>32
<212>dna
<213>人工序列
<400>1
tatagtccgtggtagggcaggttggggtgact32
<210>2
<211>26
<212>dna
<213>人工序列
<400>2
agtcacacggactatacctcagcaat26
<210>3
<211>13
<212>dna
<213>人工序列
<400>3
attgctgaggtat13
- 还没有人留言评论。精彩留言会获得点赞!