一种检测循环肿瘤细胞的太赫兹超材料器件的制作方法
本实用新型涉及医疗检测
技术领域:
,特别涉及一种检测循环肿瘤细胞的太赫兹超材料器件。
背景技术:
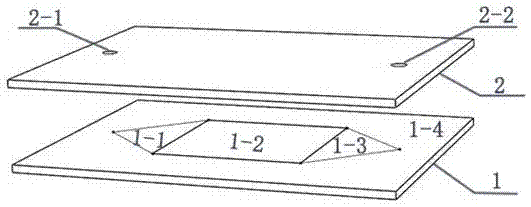
:循环肿瘤细胞是存在于肿瘤患者外周血中的一类数量稀少却具有重要临床意义的稀有细胞。它是由肿瘤病灶播散进入外周血循环的肿瘤细胞,并在一定条件下可发展为肿瘤转移性病灶。血液中的循环肿瘤细胞提示了体内肿瘤的存在以及可能的转移,而临床上超过90%的癌症死亡都是由转移造成的;同时血液中的循环肿瘤细胞提供了体内除了肿瘤病灶以外的肿瘤细胞的来源,因此从血液中捕获并检测循环肿瘤细胞越来越引起人们的重视。目前从血液中分离循环肿瘤细胞已经是一道难题,益善生物公司研发的CanpatrolCTC检测技术可以解决这一问题,其步骤为先通过红细胞裂解去除红细胞,再利用磁珠分离的方法耗尽白细胞,继而分离出尺寸最大的循环肿瘤细胞。可以看出这一过程分多个步骤,较为繁琐。目前对于分离获得的循环肿瘤细胞的性状表征仍主要以显微镜观测为主,依赖于人工,耗时较多。分离获得的循环肿瘤细胞聚集在一起,仅能够分析其群体特征,很难分析单个癌细胞在脱离了细胞组织之后的个体行为特征。目前大多采用平面结构的太赫兹超材料器件用作感应生物样本的传感器,一方面,不利于利用器件本身的结构特征来捕捉感应物,也不利于将感应物限定在器件的敏感位置(如开口谐振环的开口处),对于微米级球形感应物,如生物细胞,平面结构中的谐振环结构只能感应到球形的底部,这些问题都会导致传感灵敏度降低;另一方面,平面的太赫兹超材料结构同样不具备过滤分离大小细胞(微粒)的能力,不能从复杂环境中捕获感应物,因此用作传感器,其自动化程度较低。如何开发出能够检测循环肿瘤细胞的光谱器件,是本实用新型急需解决的。技术实现要素:为了解决上述技术问题,本实用新型提供了一种检测循环肿瘤细胞的太赫兹超材料器件,其技术方案为:包括底片(1)和盖片(2),所述盖片(2)两端分别设有入口孔(2-1)和出口孔(2-2),在底片(1)的上表面分为四个区域,其中外围为封装区(1-4),用于与盖片(2)使用粘合胶封装,内部为微通道,从左至右依次为入口导流区(1-1)、捕捉区(1-2)和出口导流区(1-3),该三个区域依次相连,且均由立体微米结构构成,其微米结构上表面与封装区(1-4)的上表面齐平,微通道底部与封装区的上表面纵向距离为1~31μm,所述入口导流区(1-1)与出口导流区(1-3)均为形状、大小相同的三角形结构,且从顶角至底角分布若干形状相同的微米结构,且每行微米结构等距离排列,相邻两行微米结构交错分布;所述捕捉区(1-2)设置在入口导流区(1-1)和出口导流区(1-3)之间,捕捉区(1-2)为立体太赫兹超材料设计,每个单元结构由一个或多个开口谐振环构成,每个单元结构中设一个卡位,且卡位指向入口导流区,所述单元结构按蜂窝结构规律周期性排布形成阵列,每一行单元结构彼此相接重复排列,且相邻两行的单元结构交错分布;捕捉区(1-2)为正方形,捕捉区(1-2)相对的两个边分别与入口导流区(1-1)和出口导流区(1-3)的底边重合;所述入口导流区(1-1)的顶角与入口孔(2-1)相对,所述出口导流区(1-3)的顶角与出口孔(2-2)相对。入口孔(2-1)和出口孔(2-2)的直径为0.5~1mm,为插入导管所设。进一步地,所述盖片(2)由0.5~1cm厚的石英片组成。进一步地,所述入口导流区(1-1)和出口导流区(1-3)三角形的高为0.3~1cm。进一步地,所述入口导流区(1-1)和出口导流区(1-3)中形状相同的微米结构采用圆柱体结构,其中圆柱体直径为20~100μm,相邻两个圆柱体之间间隙为30~100μm。进一步地,所述捕捉区(1-2)的边长为0.5~1.2cm。进一步地,所述捕捉区(1-2)的单元结构包括单元结构为一对开口相对的谐振环、单元结构为双开口的谐振环和单元结构为多个开口谐振环,相邻两个单元结构中的谐振环之间的最近距离为20~50μm。进一步地,所述单元结构为一对开口谐振环时,其线宽为2~20μm,开口为2~8μm,外环边长或者直径为20~80μm,该对开口谐振环中间间距为8~20μm。进一步地,所述单元结构为双开口谐振环时,其线宽为5~15μm,开口为8~20μm,外环直径为70~90μm。进一步地,所述单元结构为多个开口谐振环时,单元结构由一对开口相对的大谐振环和它们之间的一个或多个小谐振环构成,所述小谐振环用于阻挡癌细胞。进一步地,所述底片(1)的微通道中的微米结构均由1~30μm高的硅和其上层0.1~1μm厚的铝薄膜层构成,封装区(1-4)表层也覆盖同样厚度的铝薄膜层,且入口导流区(1-1)、捕捉区(1-2)、出口导流区(1-3)和封装区(1-4)四个区域的铝薄膜层高度齐平。进一步地,盖片(2)长、宽、高等于底片(1)长、宽、高。本实用新型还提供了一种检测循环肿瘤细胞的太赫兹超材料器件的制备方法,其底片由0.5cm厚的硅片按照如下步骤制备而成:s1、在清洗好的本征硅(100)衬底上,旋涂光刻胶,采用紫外曝光方法在所述光刻胶上获得具有预定图形的光刻胶结构;s2、采用镀膜方法在所述悬浮的微米结构上沉积一层铝金属薄膜,经过剥离工艺,获得光刻所定义图形的金属结构;s3、采用干法刻蚀方法将所述图形转移至所述本征硅衬底上,得到THz超材料。进一步地,所述s1中本征硅(100)衬底清洗依次采用丙酮、酒精、去离子水进行超声清洗,清洗时间各5~10min,最后用氮气吹干;本征硅(100)衬底清洗后放置于加热板上烘烤5~10min;s1中所述光刻胶为对紫外光敏感光刻胶;旋涂所述光刻胶后,放置于加热板上烘烤1~2min;烘烤温度为180℃;s1中通过修改所述紫外曝光的剂量调节所述THz超材料结构的尺寸精度;曝光后进行显影和定影,显影时间为60s,定影时间为30s。进一步地,所述s2中所述金属薄膜的厚度为0.1~1μm;进一步地,所述s3中所述干法刻蚀方法采用电感耦合等离子体反应刻蚀技术以SF6和O2作为工艺气体;进一步地,腔内气压为20微米汞柱的压强(mTorr),SF6流量为40毫升/分钟(sccm),O2流量为8毫升/分钟(sccm),射频功率为550W,刻蚀时间为6~8min。本实用新型的有益效果为:本实用新型提供了一种检测循环肿瘤细胞的太赫兹超材料器件,器件以立体太赫兹超材料为主要特征,辅以液体导流区,仅需将少量的血液样本从盖片的入口孔导入,即可利用结构特征过滤掉其中尺寸较小的血液细胞,并将尺寸较大的癌细胞固定在超材料谐振结构的敏感位置,即卡位上。通过比较通入样品前后的光谱变化,即可检测到本样品中的癌细胞。此外,该器件能够实现对癌细胞的单个分离,可用于后续对单个癌细胞的生物研究,继续从光谱中分析获知单个癌细胞在受到外界条件刺激后的性状变化。与现有技术相比,本实用新型方案传感灵敏度高,用作定点捕获或者监测较大细胞具有显著成效。附图说明图1为本实用新型器件结构示意图;图2为本实用新型实施例1(1-1和1-4毗邻区域)局部放大图;图3为图2中1-1部分的俯视图;图4为本实用新型实施例1(1-2)立体图;图5为图4俯视图;图6为本实用新型实施例2(1-1)俯视图;图7为本实用新型实施例2(1-2)俯视图;图8为图7虚线部分局部放大图;图9为本实用新型实施例3(1-2)俯视图;图10为本实用新型实施例4(1-2)俯视图;图11为图10虚线部分局部放大图;图12为本实用新型实施例1每对开口谐振环之间捕捉到一个癌细胞前后的光谱对比模拟图;图13为本实用新型实施例2每对方形环开口之间捕捉到一个癌细胞前后的光谱对比模拟图;图14为本实用新型实施例3每个双开口谐振环在朝向入口导流区(1-1)方向的开口间捕捉到一个癌细胞前后的光谱对比模拟图;图15为本实用新型实施例4以多个开口谐振环为单元结构且在每个单元结构的卡位处捕捉到一个癌细胞前后的光谱对比模拟图;如图所示,1底片,2盖片,1-1入口导流区,1-2捕捉区,1-3出口导流区,1-4封装区,2-1入口孔,2-2出口孔。具体实施方式须知,本说明书附图式所绘示的结构、比例、大小等,均仅用以配合说明书所揭示的内容,以供熟悉此技术的人士了解与阅读,并非用以限定本实用新型可实施的限定条件,故不具技术上的实质意义,任何结构的修饰、比例关系的改变或大小的调整,在不影响本实用新型所能产生的功效及所能达成的目的下,均应仍落在本实用新型所揭示的技术内容能涵盖的范围内。同时,本说明书中所引用的如“上”、“下”、“左”、“右”、“中间”及“一”等的用语,亦仅为便于叙述的明了,而非用以限定本实用新型可实施的范围,其相对关系的改变或调整,在无实质变更技术内容下,当亦视为本实用新型可实施的范畴。以下由特定的具体实施例说明本实用新型的实施方式,熟悉此技术的人士可由本说明书所揭露的内容轻易地了解本实用新型的其他优点及功效。本实用新型为一种检测循环肿瘤细胞的太赫兹超材料器件,器件的设计针对血液中的红血球与癌细胞过滤分离,并定点捕获癌细胞。已知红血球的直径为8μm左右。实施例中仅以直径为20um的人乳腺癌细胞MCF7来说明器件功效,其他尺寸的癌细胞在对实施例中器件尺寸做相应调整后同样适用。以下实施例中液体依次流经入口孔----入口导流区----捕捉区----出口导流区----出口孔,单元结构开口谐振环的卡位均指向入口导流区,且每行开口谐振环阵列与相邻行开口谐振环阵列交错分布。本实用新型包括底片1和盖片2,所述盖片2两端分别设有入口孔2-1和出口孔2-2,位于底片1上表面的封装区1-4用于与盖片2使用粘合胶封装,盖片2主要完成器件封装,使形成封闭的微流体通道。其中封装区1-4最窄部分宽度建议为0.3~1cm,易于粘合操作。粘合胶的厚度(下层结构为15μm硅+0.5μm铝时):5~20μm。换言之,胶的厚度加下层结构高度应大于20μm,且胶的厚度应小于20μm,方便20μm的癌细胞通过,同时限制其必须经过微流体通道通过。底片1上表面除外围封装区1-4外,中心部分从左至右依次为入口导流区1-1、捕捉区1-2和出口导流区1-3,该三个区域依次相连,所述入口导流区1-1与出口导流区1-3均为形状、大小相同的三角形结构,宏观三角形的底边长随捕捉区1-2的边长而定,宏观三角形的高为0.3~1cm,方便液体扩散。从顶角至底角分布若干形状相同的微米结构,且每行微米结构等距离排列,相邻两行微米结构交错分布,微米结构(圆柱/三角形等)的直径/边长等为:20~100μm,本实用新型采用圆柱形结构,可有效分散水流,且对水流阻力小,微米结构之间的间隙为30~100μm,方便20μm的癌细胞通过。所述捕捉区1-2设置在入口导流区1-1和出口导流区1-3之间,捕捉区1-2以若干开口谐振环为单元结构形成阵列,组成太赫兹超材料,从而在透射光谱的谐振频率处形成透射波谷,且该谐振频率会随着结构周围介电环境的变化而变化。每个单元结构中设一个卡位,且卡位指向入口导流区,所述单元结构按蜂窝结构规律周期性排布形成阵列,每一行单元结构彼此相接重复排列,且相邻两行单元结构交错分布;捕捉区1-2为正方形,其边长为:0.5~1.2cm。使用太赫兹激光束直径约0.5cm,光束照射区域全部为捕捉区1-2的开口谐振环结构。捕捉区1-2相对的两条边分别与入口导流区1-1和出口导流区1-3的底边重合,所述入口导流区1-1的顶角与入口孔2-1相对,所述出口导流区1-3的顶角与出口孔2-2相对,方便液体流入和流出。进一步地,所述捕捉区1-2的单元结构包括单元结构为一对开口相对的谐振环、单元结构为双开口的谐振环和单元结构为多个开口谐振环,相邻两个单元结构中的谐振环之间的最近距离为20~50μm。进一步地,所述单元结构为一对开口谐振环时,其线宽为2~20μm,开口为2~8μm,外环边长或者直径为20~80μm,该对开口谐振环中间间距为8~20μm。进一步地,所述单元结构为双开口谐振环时,其线宽为5~15μm,开口为8~20μm,外环直径为70~90μm。进一步地,所述单元结构为多个开口谐振环时,单元结构由一对开口相对的大谐振环和它们之间的一个或多个小谐振环构成,所述小谐振环用于阻挡癌细胞。进一步地,所述底片1的微通道中的微米结构均由1~30μm高的硅和其上层0.1~1μm厚的铝薄膜层构成,封装区1-4表层也覆盖同样厚度的铝薄膜层,且四个区域的铝薄膜层高度齐平。进一步地,盖片2长、宽、高等于底片1长、宽、高,易于封装。检测循环肿瘤细胞的太赫兹超材料器件在制备时,其底片由0.5cm厚的硅片,按照如下步骤制备而成:s1、在清洗好的本征硅(100)衬底上,旋涂光刻胶,采用紫外曝光方法在所述光刻胶上获得具有预定图形的光刻胶结构;s2、采用镀膜方法在所述悬浮的微米结构上沉积一层铝金属薄膜,经过剥离工艺,获得光刻所定义图形的金属结构;s3、采用干法刻蚀方法将所述图形转移至所述本征硅衬底上,得到THz超材料。进一步地,所述s1中本征硅(100)衬底清洗依次采用丙酮、酒精、去离子水进行超声清洗,清洗时间各5~10min,最后用氮气吹干;本征硅(100)衬底清洗后放置于加热板上烘烤5~10min;s1中所述光刻胶为对紫外光敏感光刻胶;旋涂所述光刻胶后,放置于加热板上烘烤1~2min;烘烤温度为180℃;s1中通过修改所述紫外曝光的剂量调节所述THz超材料结构的尺寸精度;曝光后进行显影和定影,显影时间为60s,定影时间为30s。进一步地,所述s2中所述金属薄膜的厚度为0.1~1um;进一步地,所述s3中所述干法刻蚀方法采用电感耦合等离子体反应刻蚀技术以SF6和O2作为工艺气体;进一步地,腔内气压为20微米汞柱的压强(mTorr),SF6流量为40毫升/分钟(sccm),O2流量为8毫升/分钟(sccm),射频功率为550W,刻蚀时间为6~8min。本实用新型提供了一种检测循环肿瘤细胞的太赫兹超材料器件,器件以立体太赫兹超材料为主要特征,辅以液体导流区,仅需将少量的血液样本从盖片的入口孔导入,即可利用结构特征过滤掉其中尺寸较小的血液细胞,并将尺寸较大的癌细胞固定在超材料谐振结构的敏感位置,即卡位上。通过比较通入样品前后的光谱变化,即可检测到本样品中的癌细胞。此外,该器件能够实现对癌细胞的单个分离,可用于后续对单个癌细胞的生物研究,继续从光谱中分析获知单个癌细胞在受到外界条件刺激后的性状变化。与现有技术相比,本实用新型方案传感灵敏度高,用作定点捕获或者监测较大细胞具有显著成效。下列光谱模拟使用LumericalFDTDsolutions软件。癌细胞的折射率设定为2.6。模拟仅针对太赫兹超材料结构部分,即捕捉区1-2.模拟中设定微米结构由15μm高的硅和其上层0.5μm厚的铝薄膜层构成,以实现器件的最大灵敏度。其他实施例结构如下:一、实施例1和实施例2:捕捉区1-2中的单元结构为一对开口谐振环(如图4、5、7、8所示)。其中每个开口谐振环尺寸如表一所示。(以下尺寸1.保证谐振频率在太赫兹范围。2.开口范围保证尺寸较小的红细胞不会误入而无法过滤。)表一线宽(微米)开口(微米)外环边长(直径)(微米)最小2220最大20880该对开口谐振环的中间间距最窄处应保证8μm的红血球通过,20μm的癌细胞卡住。所以最窄处8~20μm。与周围相邻的开口谐振环对的最近距离:20~50μm。太小,则癌细胞也无法通过;太大,相同面积下谐振结构过少,光谱谐振强度弱。(1)实施例1如图2和图3所示,底片入口导流区1-1和出口导流区1-3采用直径为50μm的圆柱体作为分散液体的间隔物。图3中(虚线部分)相邻的四个圆柱体的圆心连线组成边长为100μm的正方形,并以此规律形成阵列。如图4和图5所示,捕捉区1-2由一对开口相对的环状柱体作为单元结构,每对开口谐振环之间作为一个卡位,按照图4和5所示规律形成阵列组成。开口环的外径为30μm,内径为24μm,开口宽5μm,环心相距45μm。阵列重复周期(图5中的虚线框)为105μmx60μm。相邻行与行之间单元结构横向错开52.5μm。模拟时,以图5为参照,THz入射光的偏振方向沿图5中的纵向。模拟结果如图12,捕捉前,透射波谷频率为1.241THz,捕捉后的透射波谷频率为1.217THz。可见当器件每个卡位捕捉到一个癌细胞时,灵敏度为24GHz。(2)实施例2:如图6所示,底片入口导流区1-1和出口导流区1-3采用直径为70μm的圆柱体作为分散液体的间隔物。如图6所示(虚线部分)相邻的三个圆柱体的圆心连线组成边长为140μm的正三角形,并以此规律形成阵列。如图7所示,捕捉区1-2由一对开口相对的方形环状柱体作为单元结构,每对方形环开口处作为一个卡位,按照图7所示规律形成阵列组成。如图8所示,方形环的外边长为30μm,内边长为24μm,开口处的内边长为20μm,环心相距42μm。阵列重复周期(图7中的虚线框)为102μmx60μm。相邻行与行之间单元结构横向错开51μm。模拟时,以图7为参照,THz入射光的偏振方向沿图7中的横向。模拟结果如图13,捕捉前,透射波谷频率为1.073THz,捕捉后的透射波谷频率为1.053THz。可见当器件每个卡位捕捉到一个癌细胞时,灵敏度为20GHz。二、实施例3:捕捉区1-2中的单元结构为双开口谐振环(图9)。单元结构外环直径70~90μm,线宽5~15μm。开口8~20μm以通过较小的红血球留住较大的癌细胞,上下开口不要求对称。单元结构与相邻单元结构之间的间距:20~50μm。太小,则癌细胞也无法通过;太大,相同面积下谐振结构过少,光谱谐振强度弱。如图9所示,与实施例1不同的是捕捉区1-2由单个双开口环状柱体作为单元结构,环朝向入口导流区一侧的开口处即为卡位。按照图9所示规律形成阵列。双开口环的外径为80μm,内径为72μm,开口与圆心的连线夹角为30°。阵列重复周期(图9中的虚线框)为110μmx110μm。相邻行与行之间的单元结构横向错开55μm。模拟时,以图9为参照,THz入射光的偏振方向沿图9中的横向。模拟结果如图14,捕捉前,透射波谷频率为1.843THz,捕捉后的透射波谷频率为1.819THz。可见当器件每个卡位捕捉到一个癌细胞时,灵敏度为24GHz。三、实施例4:捕捉区1-2中的单元结构为多个开口谐振环(图10、11所示)。其中决定谐振频率的开口谐振环(对)尺寸与表一一致。(如图11中两侧的一对大环)其他谐振环(或任意结构)仅起到增加障碍的作用,用于控制整个单元结构中的间隙,使之让较小的红血球通过,留下较大的癌细胞。(如图10中中间的小谐振环)单元结构与相邻单元结构之间的间距:20~50μm。太小,则癌细胞也无法通过;太大,相同面积下谐振结构过少,光谱谐振强度弱。如图10和图11所示,与实施例1不同的是捕捉区1-2由一对大开口谐振环和一个小开口谐振环作为单元结构(其布局和尺寸如图11所示)。两个大开口谐振环尺寸相同,对称分布。其外部左(右)边长为30μm,上宽为18μm,下宽为15μm,内部左(右)边长为24μm,上宽等于下宽即9μm,开口为5μm;小环设置在一对大环之间,且开口朝向入口导流区,其尺寸为外部左边长等于右边长为9μm,下宽为8μm,内部左边长等于右边长为6μm,下宽为2μm,开口为2μm。大环之间的间隙和其间的小环共同形成一个卡位,按照图10所示规律形成阵列。阵列重复周期(图10中的虚线框)为88μmx60μm。相邻行与行之间的单元结构横向错开44μm。模拟时,以图10为参照,THz入射光的偏振方向沿图10中的纵向。模拟结果如图15所示。捕捉前,透射波谷频率为1.290THz,捕捉后的透射波谷频率为1.260THz。可见当器件每个卡位捕捉到一个癌细胞时,灵敏度为30GHz。采用实施例1~4,每个卡位可过滤分离并捕获单个癌细胞,用于监测循环肿瘤细胞取得显著成就。本领域的技术人员容易理解,以上所述仅为本实用新型的较佳实施例而已,并不用以限制本实用新型,凡在本实用新型的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本实用新型的保护范围之内。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1