一种荧光纳米传感器标记的拟胚体的制备方法及毒性筛查应用与流程
本发明属于纳米生物学技术领域,具体涉及一种荧光纳米传感器标记的拟胚体的制备方法及毒性筛查应用。
背景技术:
随着工业的不断发展进步,人们对环境安全的议论越发高涨。例如持久性有机污染物(persistentorganicpollutants,简称pops)作为一种有机化学物质越发频繁的出现在人们生活中,由于其化学性质及其稳定,因此具有持久性,生物累积性,和长距离迁移性因而严重威胁人类健康并造成全球性的生态环境问题。多溴联苯醚(pbdes)作为一种持久性的有机污染物,在许多国家被用作为阻燃剂。2001年全球pfdes需求量达到76000吨,并保持逐年上升的趋势。作为阻燃剂,pbdes经常被添加到办公室家具,电器等与我们生活息息相关的材料中。环境种的pbdes主要通过空气,水及食物这三条途径进入人体。作为一种环境内分泌干扰化合物,它具有类雌激素的作用,可对人体的内分泌系统,神经系统以及甲状腺,大脑,肾脏,肝脏等组织器官产生严重的副作用。对于怀孕群体,子宫内暴露于这种化学污染物会损害胚胎发育,导致发育迟缓或严重出生缺陷,严重可致胚胎死亡。所以建立一个有效的体外有机物毒性筛选平台至关重要。
胚胎干细胞(esc)是一种具有自我更新能力的多能干细胞,它能通过分化转化为完整三个胚层的细胞类型。由胚胎干细胞体外悬浮培养衍生的拟胚体是细胞的三维聚集体,他包含了胚胎在早期发育过程包含的关键生长变化机制,拟胚体能分化成三个胚层(外胚层,中胚层,内胚层),各个胚层拥有不同细胞的分化能力。拟胚体的这种性能为我们研究体外有机物毒性提供了一个完美的筛选平台。与二维的胚胎干细胞相比,基于三维的拟胚体具有更好的生理相关性。与动物层面相比,拟胚体实验更加简便,成本更低。
但是拟胚体在成型的过程中,它的外层细胞会分泌细胞外基质(ecm),致密的胶原基质壳会严重阻碍环境外的信号分子进入,使对拟胚体内层生物分子的检测变得困难,且目前的研究多为终点式,难以长期实时检测。
技术实现要素:
为解决致密细胞外基质阻碍信号分子进入的问题,本发明提供了一种荧光纳米传感器标记的拟胚体的制备方法及毒性筛查应用。本发明提供的这种用于毒性筛查的拟胚体平台,满足长期实时监测的需求且检测功能灵活。
为解决上述技术问题,本发明提供一种荧光纳米传感器标记的拟胚体的制备方法,预先将荧光纳米传感器与小鼠胚胎干细胞共孵育,再诱导形成拟胚体,保证纳米传感器的有效摄入。
进一步地,所述荧光纳米传感器的外层壳为聚乳酸羟基乙酸共聚物,通过利用其较好的降解性能,持续释放信号分子,达到长期监测的目的。所述的荧光纳米传感器可以灵活更换装载的信号分子达到不同检测功能的目的。
进一步地,所述荧光纳米传感器的尺寸为1μm,易于降解,生物相容性好。
进一步地,所述荧光纳米传感器与小鼠胚胎干细胞共孵育12h。
进一步地,所述拟胚体的诱导方法为:将小鼠胚胎干细胞在体外悬浮培养,形成大小尺寸均一的拟胚体,单个拟胚体保持1500-2000个细胞数量。
进一步地,所述拟胚体的具体诱导方法包括:
将小鼠胚胎成纤维细胞放置在细胞贴壁培养瓶中培养;
将小鼠胚胎干细胞接种到铺被了小鼠胚胎成纤维细胞的培养瓶中;
小鼠胚胎干细胞与小鼠胚胎成纤维细胞分离;
把分离后的小鼠胚胎干细胞混于拟胚体成型培养基中,混匀后转移至悬浮细胞培养板中,诱导拟胚体形成。
所述拟胚体具体制备步骤如下:
(1)饲养层mef(小鼠胚胎成纤维细胞)的铺被:取出一管经γ射线灭活的icr小鼠胚胎成纤维细胞作为饲养层。把小鼠胚胎成纤维细胞从-80℃冰箱取出后迅速放置于预先打开的37℃恒温水浴箱种,轻微摇晃1-2分钟,让细胞快速消融。细胞完全融化后,将冻存管内的细胞悬液取出,混于5ml的mef细胞培养基中,在750rpm下离心3分钟。随后取出上清液加入4ml的mef细胞培养基后反复轻微吹打混匀转移到t25的细胞贴壁培养瓶中,并放在37℃、5%co2环境中孵育24小时。24小时后,观察小鼠胚胎成纤维细胞是否全部贴壁,待全部贴壁后开展后续的实验。
(2)小鼠胚胎干细胞的接种:将小鼠胚胎干细胞从-80冰箱中取出后迅速放置于预先打开的37℃恒温水浴箱中,轻微摇晃1-2分钟,让细胞快速消融。细胞完全融化后,将冻存管内的细胞悬液取出,混于5ml的小鼠胚胎干细胞完全培养基中,在750rpm下离心3分钟。随后取出上清液加入4ml的小鼠胚胎干细胞完全培养基后反复轻微吹打混匀。取出铺被了mef细胞的t25培养瓶,吸出里面的细胞培养液,将小鼠胚胎干细胞悬液加入到此t25细胞培养瓶中,在37℃、5%co2环境中孵育。
(3)小鼠胚胎干细胞与mef细胞分离:待小鼠胚胎干细胞扩增至80%左右时,吸取t25细胞培养瓶中剩余的细胞培养基,加入2ml的0.25%trypsin-edta(1x)胰蛋白消化酶,静置消化2-3分钟后,加入3ml小鼠胚胎干细胞完全培养基后反复吹打混匀后转移至15ml灭菌离心管中,在750rpm下离心3分钟。去上清,加入4ml小鼠胚胎干细胞完全培养基反复吹打混匀。将混匀后的细胞悬液转移至新的t25细胞贴壁培养瓶中,置于37℃、5%co2环境中孵育30分钟后取出,取上清液置于15ml的离心管中在750rpm下离心3分钟。去上清,加入4ml小鼠胚胎干细胞完全培养基反复吹打混匀。将混匀后的细胞悬液转移至新的t25细胞贴壁培养瓶中,置于37℃、5%co2环境中孵育30分钟后取出,取上清液再离心,重复此步骤3-5次,根据小鼠胚胎干细胞与小鼠成纤维细胞之间的粘附性能差异将他们分离开。
(4)拟胚体的诱导形成:把小鼠胚胎干细胞与小鼠成纤维细胞分离后,把离心后的小鼠胚胎干细胞混于8ml的拟胚体成型培养基中,混匀后转移至96孔的悬浮细胞培养板中,每个孔加入200μl细胞悬液,隔天换液。
本发明提供一种上述的制备方法制备得到的拟胚体在毒性筛查中的应用。
一种荧光纳米传感器标记的拟胚体需预先将纳米传感器集成到小鼠胚胎干细胞内,再诱导形成拟胚体,进行相关功能的检测。plga的降解性可以保证所述平台的长期实时可持续性检测。
上述平台的运行机理:预先将纳米传感器与小鼠胚胎干细胞共孵育,保证传感器的稳定摄入后,再诱导形成拟胚体,这样便克服了致密的细胞外基质对信号分子阻碍进入的影响。易于降解的plga保证信号分子或分子信标在拟胚体内的稳定释放。
本发明合理调整了细胞摄入传感器的顺序及充分利用了plga的降解机制,提出了一个合理的荧光纳米传感器标记的拟胚体用于毒性筛查的平台。本发明达到了以下的有益效果:
(1)预先将纳米传感器与小鼠胚胎干细胞共孵育,克服致密的细胞外基质对信号分子阻碍进入的影响。
(2)采用生物相容性且易降解的plga作为传感器载体,保证足够的生物安全,保证信号分子的稳定释放,达到长期检测的目的。
(3)功能性纳米传感器可以灵活设计,装载的信号分子可以根据需求进行替换,为检测拟胚体各项生物指标提供了多种可能。
(4)利用这种荧光纳米传感器标记的拟胚体做的毒性检测实验打破了终点式的惯例,可以可持续监测。
附图说明
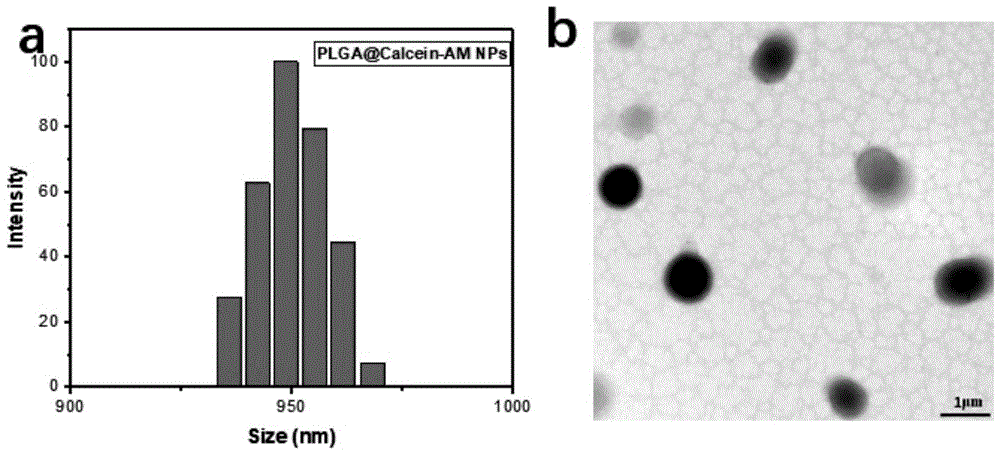
图1a是本发明实施例1中plga@calceinam纳米传感器的动态光散射(dls)测量的粒径尺寸示意图。
图1b是本发明实施例1中plga@calceinam纳米传感器的透射电子显微镜(tem)示意图。scalebar:1μm。
图2是本发明实施例2验证细胞外基质阻碍分子探针进入拟胚体示意图。scalebar:200μm。
图3是本发明实施例3验证plga的包裹能保证长期监测示意图。scalebar:200μm。
图4是本发明实施例4验证plga@calceinam纳米传感器响应拟胚体细胞活性示意图。scalebar:200μm。
图5是本发明实施例5验证plga@cellrox纳米传感器响应拟胚体内活性氧变化示意图。scalebar:200μm。
图6是本发明实施例6验证plga@pax-6mb,plga@β-actinmb在拟胚体中的功能性示意图。scalebar:50μm。
上述图中:dmso:二甲基亚砜;tbhp:叔丁基过氧化氢;gsh:还原型谷胱甘肽;target:靶标链。
具体实施方式
下面结合附图对本发明作进一步描述。以下实施例仅用于更加清楚地说明本发明的技术方案,而不能以此来限制本发明的保护范围。
实施例1
本实施例是通过动态光散射与投射电子显微镜检测合成传感器的尺寸,以1μm左右的为优。具体操作如下:
取20mg的plga超声溶解于0.93ml的二氯甲烷(dcm)中,待溶解完全后分别加入calceinam(20μl,1mg/ml)、cellrox(50μl,2.5mm)、pax6mb(20μl,50μl)、β-actinmb(20μl,50μl),在冰浴环境中,使用均质器(24000rpm/min,3min)搅拌0.4ml的聚乙烯醇pva,并逐滴加入plga溶液,待形成乳化溶液后,进行旋蒸去除多余的有机溶剂,加入一定量的磷酸缓冲溶液(pbs)重悬,并在(6000rpm/min,5min)下离心,重复此步骤3-5次,将离心后的纳米颗粒溶解于200μl的pbs中混匀。取出5μl纳米传感器混于1ml的超纯水中。将混合后的溶液置于一次性比色皿中,进行动态光散射测试,重复3-5次。或将混合后溶液滴于铜网上制备样品进行透射电子显微镜测试。
实施例2
本实例验证细胞外基质阻碍分子探针进入拟胚体。具体操作如下:
(1)准备两个t25细胞培养瓶的小鼠胚胎干细胞,一组正常培养,一组在细胞培养瓶密度达到60%时,加入β-actin(20μl,50μm),共孵育20h后,将细胞消化离心后,加入8mleb成型培养基,转移至96孔的悬浮细胞培养板中培养,每个孔加入200μl细胞悬液。隔天换液。
(2)分别在eb成型的第1,4,6,8天,取样于共聚焦皿中,在未预先标记组加入β-actin(5μl,50μm),继续共孵育4h后,进行共聚焦拍摄。
(3)参照图2,未预先标记组在拟胚体成型6天后难以有效的进入拟胚体内部,反观预先标记组内部常亮。
实施例3
本实例验证包裹plga相对于单纯的信号分子能保证长期监测的目的,具体操作如下
(1)准备四个t25细胞培养瓶的小鼠胚胎干细胞,分别预先用20μlplga@calceinam,20μlplga@β-actinmb,5μlcalceinam,5μlβ-actinmb标记,共孵育20小时后,四组细胞同时消化离心后,两种纳米传感器各选一组加入8mleb成型培养基,转移至96孔的悬浮细胞培养板中培养,每个孔加入200μl细胞悬液。剩下的两组加入pbde-47浓度为10μm的eb成型培养基。隔天换液,注意每次换液保证pbde组加入的pbde浓度保持一致。
(2)分别在eb成型的第1,3,5,7,9,11,13,15天取样进行共聚焦拍摄。
实施例4
本实施例验证plga@calceinam纳米传感器可以灵活响应拟胚体细胞活性变化。具体操作如下:
(1)当小鼠胚胎干细胞在t25贴壁细胞培养瓶密度达到60%时,加入20μlplga@calceinam纳米传感器,共孵育20小时后,将细胞消化离心后,加入8mleb成型培养基,转移至96孔的悬浮细胞培养板中培养,每个孔加入200μl细胞悬液。隔天换液。
(2)待上述悬浮细胞培养板在恒温细胞培养箱中培养4天后,将拟胚体取出置于共聚焦皿中,每三个孔为一个样,加入1ml的新鲜培养基,再分别加入0%dmso、0.5%dmso、1%dmso后置于恒温培养箱中共孵育6h。6h后取出共聚焦皿进行共聚焦显微镜拍摄。
实施例5
本实施例验证plga@cellrox纳米传感器可以灵活响应拟胚体内的活性氧变化。具体操作如下:
(1)当小鼠胚胎干细胞在t25贴壁细胞培养瓶密度达到60%时,加入20μlplga@calceinam纳米传感器,共孵育20小时后,将细胞消化离心后,加入8mleb成型培养基,转移至96孔的悬浮细胞培养板中培养,每个孔加入200μl细胞悬液。隔天换液。
(2)待上述悬浮细胞培养板在恒温细胞培养箱中培养4天后,将拟胚体取出置于共聚焦皿中,每三个孔为一个样,加入1ml的新鲜培养基,再分别加入0%tbhp、0.5%tbhp、1%tbhp后置于恒温培养箱中共孵育6h。其中1%tbhp组准备两份样品。6h后留下一份1%tbhp的样品加入0.0015ggsh继续孵育3h。其他的样品进行共聚焦显微镜拍摄。3h后取出最后一份样品进行共聚焦显微镜拍摄。
实施例6
本实施例验证plga@pax-6mb,plga@β-actinmb在拟胚体中的功能性示意图。具体操作如下:
(1)准备两个t25细胞培养瓶的小鼠胚胎干细胞,一组用plga@pax-6mb标记,一组用plga@β-actinmb标记,共孵育20h后,将细胞消化离心后,加入8mleb成型培养基,转移至96孔的悬浮细胞培养板中培养,每个孔加入200μl细胞悬液。隔天换液。
(2)在第四天,对照组不变,一组加入包含ra的拟胚体神经分化培养基,一组加入pbde-47浓度为0.1μm包含ra的拟胚体神经分化培养基,一组加入pbde-47浓度为10μm包含ra的拟胚体神经分化培养基。隔天换液。
(3)在eb成型的第8天,将eb取出后进行共聚焦拍摄。
原理解释:分子信标在遇到靶标链后,自身的发卡结构会逐渐打开,两端修饰的淬灭基团与荧光基团逐渐分离,荧光基团恢复荧光。参照图4,配置相同浓度的分子信标与不同浓度的靶标,配置不同浓度的分子信标与相同的浓度的靶标,我们通过检测荧光发现荧光强度随着浓度的变化呈梯度变化,验证了两种分子信标的功能性。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明技术原理的前提下,还可以做出若干改进和变形,这些改进和变形也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!