食道鳞癌患者外周血循环肿瘤细胞E-Cadherin表达的免疫荧光试剂盒及检测方法与流程
本发明提供了一种食道鳞癌患者外周血循环肿瘤细胞e-cadherin表达的免疫荧光试剂盒及检测方法,属于分子生物学技术领域。
背景技术:
食管癌是世界上最常见的消化道恶性肿瘤之一,约占所有恶性肿瘤的2%。食管癌的病理类型主要包括食管鳞状细胞癌(esophagealsquamouscarcinomaescc)和食管腺癌(esophagealadenocarcinomaeadc),在我国的食管癌患者中约90%以上均为食管鳞状细胞癌。近年来随着食管癌诊断技术的不断提高,手术操作技能的不断改进,术前新辅助化疗的应用,再加上术后规律放、化疗的施行,食管癌患者的生活质量在一定程度上逐步得到了改善,但是从整体上而言,食管癌治疗的效果仍然不尽如人意,我国食管癌患者术后的5年总体生存率仅为20%一30%。
e-钙粘蛋白(e—cadherin)是上皮细胞表型最经典的标志物,e-cadherin表达的下调标志着细胞之间粘附能力的下降,因此e-cadherin被当做鉴定食管鳞癌emt发生的主要手段之一,作为一类细胞表面糖蛋白,e-cadherein在细胞-细胞之间的粘附中发挥重要作用,并参与组织器官的维持。近年来有关于食管鳞癌emt和肿瘤耐药之间的关系日益受到重视,大量研究显示在不同的肿瘤当中由于emt的发生而同时耐药性的升高,并且都伴随着e-cadherin表达的改变。目前,国内外食管鳞癌诊治指南均认为:食管鳞癌患者e-cadherin突变检测的时间点包括初诊时及争取在疾病进展时再次检测,应通过重复检测减少假阳性和假阴性。而目前临床实践中,食管鳞癌患者e-cadherin检测的标本主要为肿瘤组织,来源于手术或穿刺活检,很难做到多次或实时检测。
循环肿瘤细胞(circulatingtumorcell,ctc)是从实体肿瘤脱落进入外周血液循环的肿瘤细胞,自1989年被发现以来,目前已有多种方法用于外周血循环肿瘤细胞的检测。近期研究表明,其检测对于评估肿瘤患者尤其是晚期肿瘤患者的预后以及选择合适的个体化治疗具有重要的临床意义。因ctc检测具有微创、实时检测等特点,被称为肿瘤的“液态活检”。
免疫荧光分析技术即将免疫学方法(抗原抗体特异结合)与荧光标记技术结合起来用以研究特异蛋白抗原在细胞内分布的方法。由于荧光素所发出的荧光可在荧光显微镜下检出,荧光素受激发光的照射而发出明亮的荧光(黄绿色或橘红色),可以看见荧光所在的细胞或组织,利用定量技术测定含量,从而对抗原进行细胞定性和定位分析。
针对目前临床实践中,食道鳞癌患者e-cadherin表达检测的标本主要为肿瘤组织,来源于手术或穿刺活检,很难做到多次或实时检测。因此,检测循环肿瘤细胞(ctc)e-cadherin表达情况对食道鳞癌预后及免疫治疗疗效评估具有重要价值。
目前,山东省第一医科大学、山东省药物研究院联合山东凯歌智能机器有限公司就循环肿瘤细胞检测鉴定关键技术、检测设备、试剂盒开发与生产进行合作,山东祺欣生物科技有限公司、山东喻晓生物科技有限公司、济南杏恩生物科技有限公司、山东发现生物技术有限公司等单位进行推广应用,本项目为山东省重大科技创新工程项目,以山东第一医科大学济南校区的山东省药物研究院为核心,落实注册人制度,依托循环肿瘤细胞检测鉴定核心诊断技术,进一步注册鉴定诊断试剂盒,以包括pd1、pd-l1、er、pr、her-2、gpc-3、vegf、p53、vimentin、tki-egfr、ras、ck、alk-d5f3、cd20、alk/eml4、beta-catenin、e-cadherin、ep-cam、hpv、idh-1、psa、psma、vegf、gfap、细胞角蛋白、ae1/ae3、雌激素受体、孕激素受体、bca-225、ca125、cea、ema、ercc1、hpv、ki-67、p53、top2a等作为ctcs表达的示踪剂,注册超灵敏、超快速、高覆盖、低成本、准确特异的鉴定诊断试剂盒,通过与在济南注册的山东凯歌智能机器有限公司、山东祺欣生物科技有限公司、山东喻晓生物科技有限公司、济南杏恩生物科技有限公司、山东发现生物技术有限公司合作进行研发与推广。
技术实现要素:
针对现有技术中的检测肿瘤晚期或复发食道鳞癌患者无法实时或反复穿刺获取组织标本、进而不能评估患者e-cadherin表达实时动态状态,及现有检测方法容易出现假阳性和假阴性的缺点,本发明提供了一种食道鳞癌患者外周血循环肿瘤细胞e-cadherin表达的免疫荧光试剂盒及检测方法,利用膜过滤装置分离获得晚期食道鳞癌患者外周血中的循环肿瘤细胞(ctc),进一步运用免疫荧光技术检测ctc上e-cadherin表达情况。
本发明通过以下技术方案实现:
一种检测食道鳞癌患者外周血循环肿瘤细胞e-cadherin表达的免疫荧光试剂盒,包括稀释液45ml,脱色液1ml,染色液a0.5ml,染色液b1ml,200μl甲醇、200μl2%pfa,100μl10%山羊血清,小鼠抗ck、大鼠抗cd45和兔抗e-cadherin组成的一抗混悬液100μl,荧光标记的羊抗小鼠、荧光标记的羊抗大鼠、荧光标记的羊抗兔组成的二抗混悬液100μl,dapi封片剂;
一抗混悬液中小鼠抗ck、大鼠抗cd45和兔抗e-cadherin分别按1:100、1:400和1:500稀释,总体积为100μl;
二抗混悬液中荧光标记的羊抗小鼠、荧光标记的羊抗大鼠、荧光标记的羊抗兔按1:500稀释。
其中,所述稀释液是由1mmol/ledta+1mmol月硅酸盐+0.1%bsa+0.2%泊洛沙姆组成。
其中,所述脱色液是由95%酒精与100%二甲苯按体积比1:1组成。
其中,所述染色液a为dab染色液;所述染色液b为苏木素染色液。
上述的试剂盒非诊断目的检测食道鳞癌患者外周血循环肿瘤细胞e-cadherin表达的方法,其特征在于,包括以下步骤:
(1)利用膜过滤装置分离获取无法获得组织标本的晚期或复发食道鳞癌患者外周血:采集无法获取组织标本的晚期或复发食道鳞癌患者肘正中静脉外周血5ml;
(2)外周血样预处理:将采集的外周血样采用稀释液进行10倍稀释,稀释后加多聚甲醛固定外周血样10分钟,固定终浓度为0.25%;
(3)利用膜过滤分离肿瘤细胞装置过滤外周血样,分离获得外周血ctc:将预处理的外周血样加入到膜过滤分离肿瘤细胞装置的血样容器中,使其依靠重力自然过滤;
(4)过滤结束后,从膜过滤分离肿瘤细胞装置中取下滤器,将循环肿瘤细胞染色液a液0.5ml加入到滤器中,染色3min,pbs缓冲液冲洗干净;滤液过滤完全后加入染色液b液1ml,染色2min,纯水1ml冲洗2次;
(5)向滤器中加入200μl2%pfa,室温固定5min,完成后0.5mlpbs漂洗3次,每次2min;
(6)再向滤器中加入200μl预冷的甲醇,4℃固定15min,取下滤膜,放置在载玻片上,干燥后在显微镜下观察,确定是否存在ctc;
(7)运用免疫荧光方法检测外周血ctc的e-cadherin表达情况。
其中,所述的步骤(7)运用免疫荧光方法检测外周血ctc的e-cadherin表达的具体方法如下:
(1)脱色:将带有ctc的滤膜从载玻片上取下,置于脱色液中浸泡4-6小时,脱去ctc染色液,pbs洗2min×3次;
(2)封闭:向滤膜上滴加100μl10%山羊血清,室温放置30min,完成后吸去多余的血清(注:羊血清用pbs稀释);
(3)一抗孵育:向滤膜上滴加100μl小鼠抗ck、大鼠抗cd45和兔抗e-cadherin组成的一抗混悬液,37℃孵育1h或4℃过夜,完成后pbs洗3min×3次;
(4)二抗孵育:向滤膜上滴加100μl荧光标记的羊抗小鼠、荧光标记的羊抗大鼠、荧光标记的羊抗兔组成的二抗混悬液,室温孵育30min,完成后pbs洗2min×3次;
(5)使用含dapi的封片剂封片,阅片,采图;
(6)采照完成后,脱片后进行瑞氏吉姆萨染色,与if结果进行对比。
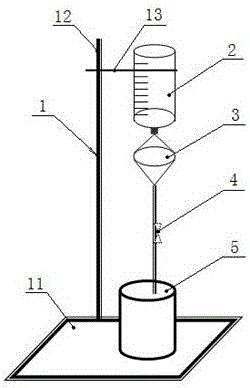
本发明所使用的膜过滤分离循环肿瘤细胞装置,包括滤器、血样容器、废液缸和铁架台,所述铁架台设有底座、立架和支架,所述血样容器通过支架设置于铁架台上部,血样容器的下方为滤器,滤器通过输液器联通至废液缸,废液缸设置于底座上。
所述滤器包括滤器上口、滤膜、载滤膜平台和滤器下口,滤膜置于载滤膜平台上;滤器上口接血样容器,滤器下口通过输液器接废液缸。
所述滤膜为疏水材料制成,其上均匀布满口径为8微米的滤孔;肿瘤细胞直径一般大于15微米,而血细胞(包括红细胞、白细胞)直径一般小于8微米,因此当含有ctc的外周血经过滤后,血细胞因直径小于滤孔的能够被滤过,而ctc因直径大于滤孔的被截留在滤膜上。
有益效果
(1)本发明提供的检测方法,不用穿刺活检获取组织标本即可检测到晚期或复发食道鳞癌患者e-cadherin表达情况,利用微创技术,能够实现实时动态检测。
(2)本发明提供的方法,循环肿瘤细胞分离好,能够避免血细胞的干扰,能够避免染色过程中可能产生的边缘效应导致的假阳性结果,稳定性好,降低细胞的损失,提高检测的准确性。
附图说明
图1为本发明的膜过滤装置结构示意图;
图2为本发明膜过滤装置的滤器的结构示意剖视图;
图3为本发明膜过滤装置的滤器滤膜的结构示意图;
图4为食道鳞癌患者外周血分离获取的循环肿瘤细胞影像图;
图5为晚期食道鳞癌患者外周血循环肿瘤细胞e-cadherin免疫荧光染色图像,其中,a为merge,b显色目标基因表达(红),c显色为ck(绿),d显色为cd45(蓝)。
图中:1铁架台、2血样容器、3滤器、4输液器、5废液缸、6滤器上口、7滤膜、8载滤膜平台、9滤器下口、10滤孔、11底座、12立架、13支架。
具体实施方式
下面结合附图和实施例对本发明阐述如下。
本发明实施例所使用的免疫荧光试剂盒具体规格如表1所示:
所述的一抗混悬液由鼠抗ck、大鼠抗cd45和兔抗e-cadherin组成,鼠抗ck、大鼠抗cd45和兔抗e-cadherin分别用bdwashbuffer按1:100、1:500和1:400稀释,稀释后取10μl小鼠抗ck、50μl大鼠抗cd45和40μl兔抗e-cadherin组成一抗混悬液;
所述的二抗混悬液由荧光标记的羊抗小鼠、荧光标记的羊抗大鼠、荧光标记的羊抗兔组成,分别为市售alexafluor546goatanti-mouse,alexafluor488goatanti-rat和alexafluor647goatanti-rabbit,取等量的上述三种荧光标记二抗,分别用bdwashbuffer分别按1:500稀释并混匀得二抗混悬液。
运用此技术方法分离获取并鉴定5例食道鳞癌患者(同时检测5例正常人样本做对照)外周血循环肿瘤细胞的实施例。
实施例1
一、利用膜过滤装置分离获取无法获得组织标本的晚期或复发食道鳞癌患者外周血中的ctc,确定ctc是否存在:
自肘正中静脉采集空腹8-12小时的空腹血5ml,用45ml稀释液稀释外周血,然后加入3ml的4%多聚甲醛固定稀释后的血样10分钟;
在固定的间期,组装膜过滤装置:如附图1、图2、图3所示,该过滤装置由滤器3、滤膜7、血样容器2、废液缸5、铁架台1构成;
用10mlpbs润湿滤器3,然后将固定好的外周血样加入到膜过滤装置的血样容器2中,使其依靠重力自然过滤,ctc被截留在滤膜7上;
肿瘤细胞直径一般大于15微米,而血细胞(包括红细胞、白细胞)直径一般小于8微米,因此当含有ctc的外周血经过滤后,血细胞因直径小于滤孔10能够被滤过,而ctc因直径大于滤孔10被截留在滤膜7上。此处需要说明的是,稀释液起到了去黏连分散的作用,月桂酸盐和泊洛沙姆配合使用,保证血细胞和ctc不黏连,并充分分散在稀释液中,从而有效的通过滤膜7被截留。
过滤结束后,从过滤装置中取下滤器3,打开并移走滤器上口6,将循环肿瘤细胞染色液a液0.5ml加入到滤器中,染色3min,pbs缓冲液冲洗干净;滤液过滤完全后加入b液,1ml,染色2min,纯水1ml,pbs缓冲液将滤器3冲洗干净,用眼科镊子取下滤膜7,细胞面朝上,放置在载玻片上;
将滤膜干燥后在显微镜下观察,确定是否存在ctc,检测结果如表2所示。
通过观察,5例健康志愿者均未查到ctc;除1例食道鳞癌患者未检测到ctc外(其为复发食道鳞癌患者),其余4例均检测到ctc(表1),本次检测阳性率为80%。
表2实施例ctc检测结果
二、运用免疫荧光技术检测ctc的e-cadherin表达情况:
将载玻片上载有ctc的滤膜7从载玻片上取下,置于95%酒精与100%二甲苯按容积比1:1混匀的脱色液中浸泡4-6小时,脱去ctc染色液,pbs洗2min×3次;滴加100μl10%山羊血清,室温放置30min,完成后吸去多余的血清,向滤膜上滴加100μl一抗混悬液,37℃孵育1h,完成后pbs洗3min×3次;然后向滤膜上滴加100μl二抗混悬液,室温孵育30min,完成后pbs洗2min×3次;使用含dapi的封片剂封片,阅片,采图;采照完成后,脱片后进行瑞氏吉姆萨染色,与if结果进行对比。
图5为晚期食道鳞癌患者外周血循环肿瘤细胞免疫荧光染色图像,根据免疫学及形态学表现,发现肿瘤细胞细胞体积大,核质比异常,免疫学表现为典型的ctcs。
所检测的循环肿瘤细胞应用免疫荧光证实e-cad并与食道鳞癌大体标本e-cad结果对比,观察其差异,主要针对大体标本e-cad阴性而循环肿瘤细胞表达阳性的患者,指导食道鳞癌的靶向治疗,为食道鳞癌靶向治疗提供新的思路。
- 还没有人留言评论。精彩留言会获得点赞!