高效率的有机发光元件的制作方法
本发明涉及一种具有高效率和长寿命的有机发光元件,尤其涉及一种包括用于有机发光元件内的发光层的特定结构的主剂材料和掺杂剂材料的有机发光元件。
背景技术:
有机发光元件(organic light emitting diode)作为自发光型元件,具有以下优点:可视角度宽、对比度优秀、响应速度快、亮度、驱动电压以及响应速度特性优秀、且可以实现多彩化。
通常的有机发光元件包括用于发射光的有机发光层,与以中间夹着有机发光层的方式相向的阳极(anode)和阴极(Cathode)。
更为详细地,有机发光元件可以具有如下的结构:在所述阳极的上部依次形成有空穴传输层、发光层、电子传输层以及阴极。其中,空穴传输层、发光层以及电子传输层是由有机化合物形成的有机薄膜。
具有上述结构的有机发光元件的驱动原理如下:如果在所述阳极和阴极之间施加电压,则从阳极注入的空穴经过空穴传输层而移动至发光层,从阴极注入的电子经过电子传输层而移动至发光层。所述空穴和电子等载体在发光层区域再结合而生成激子(exciton)。所述激子从激发态变成基态并生成光。
另外,在有机发光元件中被用作有机物层的材料根据功能可以分为:发光材料以及电荷传输材料,例如空穴注入材料、空穴传输材料、电子传输材料、电子注入材料等。所述发光材料可以根据发光原理而被分为从电子的单重激发态起源的荧光材料和从电子的三重激发态起源的磷光材料。
并且,仅将一个物质作为发光材料使用的情况下,存在着最大发光波长因为分子间的相互作用移动至长波长侧,色纯度降低或者发光衰减效应引起元件的效率降低的问题,所以为了提高色纯度并通过能量转移提高发光效率,可以使用主剂-掺杂剂系统作为发光材料。其原理为:如果在发光层混合少量比形成发光层的主剂的能带间隙更小的掺杂剂,从发光层产生的激子被传输至掺杂剂而发出高效率的光。此时,主剂的波长迁移至掺杂剂的波长带,所以可以根据使用的掺杂剂的种类得到所需波长的光。
对于所述有机发光元件的效率而言,如上所述,三重激发态和单重激发态以25%:75%的比例发生。因此,利用由单重态激子发出的光的荧光EL元件中的内部量子效率的极限值为25%。
为了解决上述缺点,韩国公开专利公报第10-2012-0092555号(2012.08.21)中记载了通过设计如下的有机发光元件而提高荧光发光的效率的有机发光元件:为了更有效地引起由2个三重态激子的冲撞和融合而产生单重态激子的TTF(Triplet-Triplet Fusion,三重态-三重态融合)现象,在发光层和电子注入层之间设置阻挡层,并将三重态激子关在发光层,以使阻挡层的三重态能量满足大于发光层主剂的三重态能量的条件,从而更有效地引起TTF现象,且包括使电子注入层和阻挡层的亲和力值在特定范围内。
但是,所述现有文件相当于通过使TTF现象更有效地产生而提高发光效率的方法,该方法具有如下局限性:为了实现该方法,需要在阻挡层中使用具有比主剂的三重态能量更高的三重态能量的阻挡层材料以防止生成的三重态激子的消亡,并且阻挡层中需要包括特定的缩合环形态的芳香族杂环化合物。
并且,作为用于改善有机发光元件效率的其他现有技术,韩国公开专利公报第10-2006-0022676号(2006.03.10.)中记载了一种有机发光元件,其特征在于,在发光层和电子传输层之间设置用于调节电子量的抑制层。
但是,即使包括上述现有文献的现有技术中,为了制造具有更高效率的发光特性的有机发光元件而尝试了多种方法,目前却依然需要开发具有更高发光效率的有机发光元件。
[现有技术文献]
韩国公开专利公报第10-2012-0092555号(2012.08.21.)
韩国公开专利公报第10-2006-0022676号(2006.03.10.)
技术实现要素:
本发明的目的在于解决上述问题,其旨在提供如下的改良的有机发光元件:在有机发光元件内的发光层使用特定结构的化合物作为主剂,并且导入包括特定结构的化合物的电子密度调节层,从而提高有机发光元件的效率。
为了解决上述技术问题,本发明提供一种有机发光元件,包括:第一电极;第二电极,与所述第一电极相向;发光层和电子密度调节层,依次夹设于所述第一电极与所述第二电极之间,其中,所述电子密度调节层包括用下述[化学式A]至[化学式D]表示的化合物中的一种以上,所述发光层包括用下述[化学式H]表示的一种以上的蒽系化合物:
在所述[化学式A]至[化学式D]中各个符号的含义如下:
R1至R8、R11至R23、R31至R38、R41至R53分别相同或相异,并相互独立地选自:氢、重氢、被取代或未被取代的碳原子数为1至30的烷基、被取代或未被取代的碳原子数为2至30的烯基、被取代或未被取代的碳原子数为2至30的炔基、被取代或未被取代的碳原子数为3至30的环烷基、被取代或未被取代的碳原子数为5至30的环烯基、被取代或未被取代的碳原子数为1至30的烷氧基、被取代或未被取代的碳原子数为6至30的芳氧基、被取代或未被取代的碳原子数为1至30的硫代烷基、被取代或未被取代的碳原子数为6至30的硫代芳基、被取代或未被取代的碳原子数为1至30的烷胺基、被取代或未被取代的碳原子数为6至30的芳胺基、被取代或未被取代的碳原子数为6至50的芳基、被取代或未被取代且具有O、N或S杂原子的碳原子数为2至50的杂芳基、氰基、硝基、卤基、被取代或未被取代的碳原子数为1至30的硅烷基、被取代或未被取代的碳原子数为1至30的锗基、被取代或未被取代的碳原子数为1至30的硼基、被取代或未被取代的碳原子数为1至30的铝基、羰基、磷酰基、氨基、硫醇基、羟基、硒基、碲基、酰胺基、醚基以及酯基。
取代基Ar1和Ar2为被取代或未被取代的碳原子数为6至50的芳基或者被取代或未被取代的碳原子数为2至50的杂芳基。
连接基L选自单键、被取代或未被取代的碳原子数为6至60的亚芳基或者被取代或未被取代的碳原子数为2至60的杂亚芳基。
所述化学式B中,取代基R12和R13、或者取代基R14至R17中彼此相邻的两个取代基为如下的单键:用于分别形成包括连接到结构式Q1内的取代基R22和取代基R23的碳原子的五元环,从而形成缩合环。
化学式D中,取代基R41至R43中彼此相邻的两个取代基、或者取代基R44至R47中彼此相邻的两个取代基为如下的单键:用于分别形成包括连接到结构式Q2内的取代基R52和取代基R53的碳原子的五元环,从而形成缩合环。
所述取代基R22和R23、取代基R52和R53相互连接而形成环。
在所述[化学式H]中各个符号的含义如下:
取代基R61至R65分别相同或相异,且相互独立地选自:氢、重氢、被取代或未被取代的碳原子数为1至30的烷基、被取代或未被取代的碳原子数为2至30的烯基、被取代或未被取代的碳原子数为2至30的炔基、被取代或未被取代的碳原子数为3至30的环烷基、被取代或未被取代的碳原子数为5至30的环烯基、被取代或未被取代的碳原子数为1至30的烷氧基、被取代或未被取代的碳原子数为6至30的芳氧基、被取代或未被取代的碳原子数为1至30的硫代烷基、被取代或未被取代的碳原子数为6至30的硫代芳基、被取代或未被取代的碳原子数为1至30的烷胺基、被取代或未被取代的碳原子数为6至30的芳胺基、被取代或未被取代的碳原子数为6至50的芳基、被取代或未被取代且具有O、N或S杂原子的碳原子数为2至50的杂芳基、氰基、硝基、卤基、被取代或未被取代的碳原子数为1至30的硅烷基、被取代或未被取代的碳原子数为1至30的锗基、被取代或未被取代的碳原子数为1至30的硼基、被取代或未被取代的碳原子数为1至30的铝基、羰基、磷酰基、氨基、硫醇基、羟基、硒基、碲基、酰胺基、醚基以及酯基。
在所述R61至R65的并非结合有取代基的芳香族环的碳上结合有氢。
连接基L′是单键、被取代或未被取代的碳原子数为6至60的亚芳基。
j是0至2的整数,在j为2的情况下,各个L′相同或相异。
k是1至5的整数。
l至n分别彼此相同或相异,且相互独立地为1至4的整数。
o是1至3的整数。
在所述k至o分别为2以上的情况下,各个R61至R65彼此相同或相异。
X的“***”是与连接基L′结合的键位。
其中,发光层内使用的以[化学式H]表示的蒽系化合物与电子密度调节层内使用的以[化学式A]至[化学式D]表示的化合物是彼此相异的化合物。
并且,本发明的所述有机发光元件的特征在于,第一电极为阳极,第二电极为阴极,在所述阳极与发光层之间包括空穴传输层,在电子密度调节层与阴极之间包括电子传输层。
根据本发明的有机发光元件包括在发光层和电子传输层之间具有特定结构的电子密度调节层,通过与作为发光层材料而具有特定结构的蒽衍生物的组合,相比根据现有技术而制造的有机发光元件,可以具有高效率和低电压驱动的特性。
附图说明
图1是示出根据本发明的一实施例的有机发光元件的结构的图。
图2是示出根据本发明的,包括电子密度调节层的情况和不包括电子密度调节层的情况下的有机发光元件的结构的图。
图3是示出在本发明的有机发光元件内,随着发光层内激子的偶极子位置(dipole location)的变化的有机发光元件的电流效率(左)和EL强度(右)的变化的模拟结果的图。
图4是示出根据本发明的一实施例的,电子密度调节层的三重态能量低于发光层主剂的三重态能量的情况下的有机发光元件的能级结构的图。
图5是示出本发明的有机发光元件在形成有电子密度调节层的情况和没有形成所述电子密度调节层的情况下的,随着电压变化的电流密度变化的图。
图6是示出本发明的有机发光元件在形成有电子密度调节层的情况和没有形成所述电子密度调节层的情况下的,根据电场的电子迁移率值的图。
图7是示出本发明的有机发光元件在形成有电子密度调节层的情况和没有形成所述电子密度调节层的情况下的,根据电流密度变化的外量子效率的变化的图。
具体实施方式
以下,参照附图而对优选实施例进行详细的说明以使本发明的所属技术领域中具有基本知识的人员能够容易地实施本发明。在本发明的各个附图中,将结构物的大小或尺寸放大或缩小示出以提高本发明的明确性,并且为了显露特定构成而省略了公知的构成而示出,所以不限于附图中的内容。在对本发明的优先实施例的原理进行详细说明时,在判断为对相关公知功能或者构成的具体说明会不必要地模糊本发明的宗旨的情况下,省略其详细说明。
并且,为了说明的便利而任意地示出了附图中的各个构成的大小和厚度,所以本发明不限于图示的内容,并且附图中为了明确地表现多个层和区域而放大示出了厚度。并且,在附图中,为了说明的便利而夸张地示出了部分层和区域的厚度。在提到层、膜、区域、板等部分位于其他部分“上”时,不仅包括“紧贴在上面”的情况,还包括中间夹设有其他部分的情况。
并且,在说明书全文中,表示某个部分“包括”某些构成要素时,在没有特殊相反的记载的情况下,不排出其他构成要素,而意味着还可以包括其他构成要素。并且,在说明书全文中,“在~上”表示在对象部分的上方或者下方,而非意味着必须在以重力方向为基准的上方。
本发明提供如下的有机发光元件,包括:第一电极;第二电极,与所述第一电极相向;发光层和电子密度调节层,依次夹设于所述第一电极与所述第二电极之间。所述电子密度调节层包括用下述[化学式A]至[化学式D]表示的化合物中的一种以上,并且所述发光层包括用下述[化学式H]表示的一种以上的蒽系化合物。
在所述[化学式A]至[化学式D]中各个符号的含义如下:
R1至R8、R11至R23、R31至R38、R41至R53分别相同或相异,并彼此独立地选自:氢、重氢、被取代或未被取代的碳原子数为1至30的烷基、被取代或未被取代的碳原子数为2至30的烯基、被取代或未被取代的碳原子数为2至30的炔基、被取代或未被取代的碳原子数为3至30的环烷基、被取代或未被取代的碳原子数为5至30的环烯基、被取代或未被取代的碳原子数为1至30的烷氧基、被取代或未被取代的碳原子数为6至30的芳氧基、被取代或未被取代的碳原子数为1至30的硫代烷基、被取代或未被取代的碳原子数为6至30的硫代芳基、被取代或未被取代的碳原子数为1至30的烷胺基、被取代或未被取代的碳原子数为6至30的芳胺基、被取代或未被取代的碳原子数为6至50的芳基、被取代或未被取代且具有O、N或S杂原子的碳原子数为2至50的杂芳基、氰基、硝基、卤基、被取代或未被取代的碳原子数为1至30的硅烷基、被取代或未被取代的碳原子数为1至30的锗基、被取代或未被取代的碳原子数为1至30的硼基、被取代或未被取代的碳原子数为1至30的铝基、羰基、磷酰基、氨基、硫醇基、羟基、硒基、碲基、酰胺基、醚基以及酯基。
所述取代基Ar1和Ar2为被取代或未被取代的碳原子数为6至50的芳基,或者被取代或未被取代的碳原子数为2至50的杂芳基。
所述连接基L选自单键、被取代或未被取代的碳原子数为6至60的亚芳基、被取代或未被取代的碳原子数为2至60的杂亚芳基。
所述化学式B中,取代基R12和R13、或者R14至R17中彼此相邻的两个取代基为如下的单键:用于分别形成包括连接到所述结构式Q1内的取代基R22和取代基R23的碳原子的五元环,从而形成缩合环。
所述化学式D中,取代基R41至R43中彼此相邻的两个取代基、或者取代基R44至R47中彼此相邻的两个取代基为如下的单键:用于分别形成包括连接到所述结构式Q2内的取代基R52和取代基R53的碳原子的五元环,从而形成缩合环。
所述取代基R22和R23、取代基R52和R53可以彼此连接而形成环。
在所述[化学式H]中各个符号的含义如下:
取代基R61至R65分别相同或相异,且彼此独立地选自:氢、重氢、被取代或未被取代的碳原子数为1至30的烷基、被取代或未被取代的碳原子数为2至30的烯基、被取代或未被取代的碳原子数为2至30的炔基、被取代或未被取代的碳原子数为3至30的环烷基、被取代或未被取代的碳原子数为5至30的环烯基、被取代或未被取代的碳原子数为1至30的烷氧基、被取代或未被取代的碳原子数为6至30的芳氧基、被取代或未被取代的碳原子数为1至30的硫代烷基、被取代或未被取代的碳原子数为6至30的硫代芳基、被取代或未被取代的碳原子数为1至30的烷胺基、被取代或未被取代的碳原子数为6至30的芳胺基、被取代或未被取代的碳原子数为6至50的芳基、被取代或未被取代且具有O、N或S杂原子的碳原子数为2至50的杂芳基、氰基、硝基、卤基、被取代或未被取代的碳原子数为1至30的硅烷基、被取代或未被取代的碳原子数为1至30的锗基、被取代或未被取代的碳原子数为1至30的硼基、被取代或未被取代的碳原子数为1至30的铝基、羰基、磷酰基、氨基、硫醇基、羟基、硒基、碲基、酰胺基、醚基以及酯基。
在所述R61至R65的并非结合有取代基的芳香环的碳上结合有氢。
所述连接基L′是单键、被取代或未被取代的碳原子数为6至60的亚芳基。
j是0至2的整数,在j为2的情况下,各个L′相同或相异。
k是1至5的整数。
l至n分别彼此相同或相异,且彼此独立地为1至4的整数。
o是1至3的整数。
在所述k至o分别为2以上的情况下,各个R61至R65彼此相同或相异。
X的“***”是与连接基L′结合的键位。
但是,用于发光层内的用[化学式H]表示的蒽系化合物和用于电子密度调节层内的用[化学式A]至[化学式D]表示的化合物是彼此相异的化合物。
其中,所述“被取代或未被取代”中的“取代”指被从由以下取代基组成的取代基群中选择的一个以上的取代基所取代:重氢、氰基、卤基、羟基、硝基、碳原子数为1至24的烷基、碳原子数为1至24的卤化烷基、碳原子数为2至24的烯基、碳原子数为2至24的炔基、碳原子数为1至24的杂烷基、碳原子数为6至24的芳基、碳原子数为7至24的芳烷基、碳原子数为2至24的杂芳基、碳原子数为2至24的杂芳烷基、碳原子数为1至24的烷氧基、碳原子数为1至24的烷氨基、碳原子数为6至24的芳氨基、碳原子数为1至24的杂芳氨基、碳原子数为1至24的硅烷基、碳原子数为6至24的硅芳基、碳原子数为6至24的芳氧基。
另外,对于本发明中的所述“被取代或未被取代的碳原子数为1至30的烷基”、“被取代或未被取代的碳原子数为5至50的芳基”等中的所述烷基或者芳基的范围而言,所述碳原子数为1至30的烷基以及碳原子数为5至50的芳基的碳原子数的范围指不考虑各个所述取代基被取代的部分,而看成未被取代时的构成烷基部分或者芳基部分的整体碳原子数。例如,对位被丁基取代的苯基相当于被碳原子数为4的丁基取代的碳原子数为6的芳基。
并且,本发明的化合物中使用的芳基是经过一次脱氢而从芳香烃衍生的有机自由基,且包括具有5至7元,优选5或者6元的单环或融合环系,并且,在所述芳基中具有取代基的情况下,可以与相邻的取代基彼此融合(fused)而形成额外的环。
所述芳基的具体示例有:苯基、萘基、联苯基、三联苯基、蒽基、茚基(indenyl)、芴基、菲基、亚三苯基、芘基、苝基、草基、并四苯基、荧蒽基等,但不限于此。
所述芳基中的一个以上的氢原子可以被以下基团取代:重氢原子、卤原子、羟基、硝基、氰基、硅烷基、氨基(-NH2、-NH(R)、-N(R')(R″);其中R'和R"彼此独立地为碳原子数为1至10的烷基,在此情况下,称为“烷氨基”)、脒基、肼基、腙基、羧基、磺酸基、磷酸基、碳原子数为1至24的烷基、碳原子数为1至24的卤化烷基、碳原子数为1至24的烯基、碳原子数为1至24的炔基、碳原子数为1至24的杂烷基、碳原子数为6至24的芳基、碳原子数为6至24的芳烷基、碳原子数为2至24的杂芳基或者碳原子数为2至24的杂芳烷基。
本发明的化合物中使用的作为取代基的杂芳基指:能够在所述芳基的各个环内包括选自N、O、P、Se、Te、Si、Ge或S中的1至4个杂原子的碳原子数2至24的杂芳族有机自由基,所述环可以融合(fused)而形成环。并且,所述杂芳基中的一个以上的氢原子与上述芳基的情形相同地,可以被取代基所取代。
本发明中使用的作为取代基的烷基的具体示例有:甲基、乙基、丙基、异丙基、异丁基、仲丁基、叔丁基、戊基、异戊基、己基等,所述烷基中的一个以上的氢原子与上述芳基的情形相同地,可以被取代基所取代。
本发明的化合物中使用的作为取代基的烷氧基的具体示例有:甲氧基、乙氧基、丙氧基、异丁氧基、仲丁氧基、戊氧基、异戊氧基、己氧基等,所述烷氧基中的一个以上的氢原子与上述芳基的情形相同地,可以被取代基所取代。
本发明的化合物中使用的作为取代基的硅烷基的具体示例有:三甲基硅、三乙基硅、三苯基硅、三甲氧基硅、二甲氧基苯基硅、二苯基甲基硅、二苯基乙烯硅、甲基环丁基硅、二甲基呋喃基硅等,所述甲硅烷基中的一个以上的氢原子与上述芳基的情形相同地,可以被取代基所取代。
本发明中,所谓的“(有机层)包括一种以上的有机化合物”可以被解释为,“(有机层)可以包括属于本发明的范围内的一种有机化合物或者属于所述有机化合物的范围内的彼此不同的2种以上的化合物”。
本发明中,在有机发光元件内依次包括发光层和电子密度调节层,所述电子密度调节层中使用利用所述[化学式A]至[化学式D]表示的化合物中的1种以上,在发光层中使用利用[化学式H]表示的化合物,在上述情况下可以提高有机发光元件的效率。
其中,根据本发明的有机发光元件的发光层包括主剂和掺杂剂,用所述[化学式H]表示的化合物可被使用为发光层内的主剂。
其中,所述有机发光元件的特征在于,用所述化学式H表示的蒽系化合物中,在蒽的9号位置结合有被取代或未被取代的苯基,并且在蒽环的10号位置结合有连接基L′,如下图形式所示,所述连接基L′结合于二苯并呋喃环的1号位置或2号位置。
作为一个示例,所述化学式H中的连接基L′可以是单键或者选自下述[结构式1]或[结构式2]中的一个以上,在此情况下,所述连接基L′中,在芳香族环的碳位可以结合有氢或重氢。
本发明中,用所述化学式H表示的化合物的具体示例有,选自下述[化学式1]至[化学式156]的化合物中的一个,但不限于此。
另外,对应于本发明中被使用为电子密度调节层材料的以所述[化学式A]至[化学式D]表示的化合物的特征在于,在蒽环的10号位置结合有被取代或未被取代的碳原子数为6至50的亚芳基、或者被取代或未被取代的碳原子数为2至50的杂亚芳基,并且如下图所示,在蒽环的9号位置结合有连接基L,所述连接基L与二苯并呋喃环的1号位置或者2号位置结合。
作为一个示例,所述[化学式A]至[化学式D]中的取代基Ar1和取代基Ar2分别可以是被取代或未被取代的碳原子数为6至18的芳基,用所述[化学式A]至[化学式D]表示的化合物或者用所述[化学式H]表示的化合物可以包含重氢。
另外,如所述化学式B和化学式D所示,根据本发明的蒽衍生物的结合有蒽基的一侧(与连接基L结合的一侧)形成有二苯并呋喃环。在化学式B中,二苯并呋喃环内的取代基R12和R13或者取代基R14至R17中的相邻的两个取代基是一种用于分别形成包含有连接于所述结构式Q1内的取代基R22和R23的碳原子在内的五元环以形成缩合环的单键,而且在化学式D中,取代基R41至R43中相邻的两个取代基或者取代基R44至R47中相邻的两个取代基是一种用于分别形成包含有连接于所述结构式Q2内的取代基R52和取代基R53的碳原子在内的五元环以形成缩合环的单键,于是作为二苯并呋喃环内的连接基L未结合的环内碳原子,彼此相邻的两个碳原子可额外形成缩合环。
作为一个示例,本发明中的化学式B内所述结构式Q1内的取代基R22和取代基R23可以分别相同或相异,且可以彼此独立地为被取代或未被取代的碳原子数为6至24的芳基;并且,所述化学式D内所述结构式Q2内的取代基R52和取代基R53可以彼此相同或相异,且可以彼此独立地为被取代或未被取代的碳原子数为6至24的芳基。
另外,所述[化学式B]内结构式Q1内的取代基R22和R23可以彼此连接而形成环,并且[化学式D]内结构式Q2内的取代基R52和R53可以彼此连接而形成环,因此可以包括额外的环。
作为示例,在所述取代基R52和R53彼此连接的情况下,用化学式D表示的化合物如图形式2所示,可以包括被取代或未被取代的螺二芴环,相同地,在所述取代基R22和R23彼此连接的情况下,用化学式B表示的化合物可以包括被取代或未被取代的螺二芴环。
更为具体地,可以用在所述电子密度调节层中的用[化学式A]至[化学式D]表示的化合物可以是选自化合物201至化合物304中的任一个,但不限于此。
并且,发光层内使用的用[化学式H]表示的蒽系化合物与在电子密度调节层内使用的用[化学式A]至[化学式D]表示的化合物可以彼此相同。
另外,本发明的有机发光元件中,第一电极为阳极,第二电极为阴极,且在所述阳极与发光层之间可以包括空穴传输层,并且可以在电子密度调节层与阴极之间包括电子传输层。
另外,本发明中,作为发光层的另一构成要素的掺杂剂化合物可以包括用下述[化学式I]至[化学式K]中的某一个表示的化合物中的一种以上的化合物。
在所述[化学式I]至[化学式K]中各个符号的含义如下:
所述[化学式I]内的A选自:被取代或未被取代的碳原子数为5至50的芳基、被取代或未被取代且具有O、N或S杂原子的碳原子数为3至50的杂芳基、被取代或未被取代的碳原子数为6至60的亚芳基、被取代或未被取代且具有O、N或S杂原子的碳原子数为3至50的杂亚芳基。
优选为蒽、芘、菲、茚并菲、并四苯、苉、三亚苯、苝、并五苯。
所述[化学式I]中,X1和X2彼此相同或相异,分别独立地为被取代或未被取代的碳原子数为6至30的亚芳基或者选自单键中的某一个;X1和X2可以彼此结合。
Y1至Y2分别彼此相同或相异,并可独立地选自以下基群:被取代或未被取代的碳原子数为6至24的芳基、被取代或未被取代的碳原子数为2至24的杂芳基、被取代或未被取代的碳原子数为1至24的烷基、被取代或未被取代的碳原子数为1至24的杂烷基、被取代或未被取代的碳原子数为3至24的环烷基、被取代或未被取代的碳原子数为1至24的烷氧基、氰基、卤基、被取代或未被取代的碳原子数为6至24的芳氧基、被取代或未被取代的碳原子数为1至40的烷基硅烷基、被取代或未被取代的碳原子数为6至30的硅芳基、锗、磷、硼、重氢和氢,其中,可以与彼此相邻的基团形成脂肪族、芳香族、脂肪族杂环、或者芳杂环的缩合环。
所述l、m分别为1至20的整数,n为1至4的整数。
并且,在[化学式J]和[化学式K]中各个符号的含义如下:
A1、A2、E和F分别相同或相异,且彼此独立地为被取代或未被取代的碳原子数为6至50的芳香烃环、或者被取代或未被取代的碳原子数为2至40的芳香族杂环。
所述A1的芳香环内的彼此相邻的两个碳原子、所述A2的芳香环内的彼此相邻的两个碳原子可以与连接到所述取代基R1和R2的碳原子形成5元环,从而分别形成缩合环。
所述连接基L1至L12分别彼此相同或相异,且彼此独立地选自:单键、被取代或未被取代的碳原子数为1至60的亚烃基、被取代或未被取代的碳原子数为2至60的亚烯基、被取代或未被取代的碳原子数为2至60的亚炔基、被取代或未被取代的碳原子数为3至60的环亚烃基、被取代或未被取代的碳原子数为2至60的杂环亚烃基、被取代或未被取代的碳原子数为6至60的亚芳基、被取代或未被取代的碳原子数为2至60的杂亚芳基。
所述M是选自N-R3、CR4R5、SiR6R7、GeR8R9、O、S、Se中某一个。
所述取代基R1至R9、Ar1至Ar8分别彼此相同或者相异,并相互独立地选自:氢、重氢、被取代或未被取代的碳原子数为1至30的烷基、被取代或未被取代的碳原子数为6至50的芳基、被取代或未被取代的碳原子数为2至30的烯基、被取代或未被取代的碳原子数为2至20的炔基、被取代或未被取代的碳原子数为3至30的环烷基、被取代或未被取代的碳原子数为5至30的环烯基、被取代或未被取代的碳原子数为2至50的杂芳基、被取代或未被取代的碳原子数为2至30的杂环烷基、被取代或未被取代的碳原子数为1至30的烷氧基、被取代或未被取代的碳原子数为6至30的芳氧基、被取代或未被取代的碳原子数为1至30的硫代烷基、被取代或未被取代的碳原子数为5至30的硫代芳基、被取代或未被取代的碳原子数为1至30的烷基胺、被取代或未被取代的碳原子数为5至30的芳基胺、被取代或未被取代的碳原子数为1至30的硅烷基、被取代或未被取代的碳原子数为6至30的硅芳基、被取代或未被取代的碳原子数为1至30的锗烷基、被取代或未被取代的碳原子数为1至30的锗芳基、氰基、硝基、卤基。
所述R1和R2可以彼此连接而形成脂环族、芳香族的单环或者多环环,且如上所述形成的脂环族、芳香族的单环或者多环环的碳原子可被选自N、O、P、Si、S、Ge、Se、Te中的一个以上的杂原子所取代。
所述p1至p4、r1至r4、s1至s4分别为1至3的整数,在它们分别为2以上的情况下,各个连接基L1至L12彼此相同或者相异。
所述x是1或者2的整数,y和z分别相同或者相异,且相互独立地为0至3的整数。
所述Ar1和Ar2、Ar3和Ar4、Ar5和Ar6、Ar7和Ar8可以分别彼此连接而形成环。
所述化学式J中,A2环内彼此相邻的两个碳原子与所述结构式Q1的“*”结合而形成缩合环。
所述化学式K中,在所述A1环内彼此相邻的两个碳原子与所述结构式Q2的“*”结合而形成缩合环,在所述A2环内彼此相邻的两个碳源子与所述结构式Q1的“*”结合而形成缩合环。
并且,所述发光层除了包括所述掺杂剂和主剂之外,还可以额外包括多种主剂和多种掺杂剂。
以下,参照附图而对根据本发明的实施例的有机发光显示装置进行说明。
图1是示出本发明的一实施例的有机发光元件的构造的图。
如图1所示,根据本发明的实施例的有机发光元件依次包括:阳极20、空穴传输层40、包含主剂和掺杂剂的有机发光层50、电子传输层60以及阴极80,其中,在所述发光层与电子传输层之间包括用[化学式A]至[化学式D]表示的电子密度调节层,并且在发光层内包含用[化学式H]表示的主剂。
并且,根据本发明的实施例的有机发光元件可以在所述阳极20和空穴传输层40之间包括空穴注入层30,且在所述电子传输层60和阴极80之间包括电子注入层70。
参照图1,对本发明的有机发光元件及其制造方法进行如下说明。首先,在基板10上部涂覆阳极(anode)电极用物质而形成阳极20。其中,使用通常用于有机EL元件的基板作为基板10,其中优选透明性、表面平滑性、易处理性以及防水性优秀的有机基板或者透明塑料基板。并且,阳极电极用物质使用透明且导电性优秀的氧化铟锡(ITO)、氧化铟锌(IZO)、氧化锡(SnO2)、氧化锌(ZnO)等。
通过在所述阳极20电极上部真空热蒸镀或者旋转涂覆空穴注入层物质而形成空穴注入层30。然后,在所述空穴注入层30的上部真空热蒸镀或者旋转涂覆空穴传输层物质而形成空穴传输层40。
所述空穴注入层材料只要是本领域中通常使用的材料,就可以不受特殊限制地使用,例如可以使用2-TNATA[4,4',4"-tris(2-naphthylphenyl-phenylamino)-triphenylamine]、NPD[N,N'-di(1-naphthyl)-N,N'-diphenylbenzidine)]、TPD[N,N'-diphenyl-N,N'-bis(3-methylphenyl)-1,1'-biphenyl-4,4'-diamine]、DNTPD[N,N'-diphenyl-N,N'-bis-[4-(phenyl-m-tolyl-amino)-phenyl]-biphenyl-4,4'-diamine]等。但是本发明不必受限于此。
并且,所述空穴传输层的材料只要是本领域中通常使用的材料,就可以不受特殊限制地使用,例如可以使用N,N'-二(3-甲基苯基)-N,N'-二苯基-[1,1-联苯基]-4、4'-二胺(TPD)或者N,N'-二(1-萘基)-N,N'-二苯基联苯胺(a-NPD)等。但本发明不限于此。
接着,可以在所述空穴传输层40的上部通过真空沉积法或者旋涂法层叠有机发光层50,并在所述有机发光层50的上部通过真空沉积法或旋涂法而形成根据本发明的电子密度调节层55薄膜。
其中,所述发光层可以由主剂和掺杂剂形成。
并且,根据本发明的具体示例,所述发光层的厚度优选50至
另外,在本发明中,在所述发光层可以使用主剂以及掺杂剂材料。在所述发光层包括主剂和掺杂剂的情况下,掺杂剂的含量通常以主剂约100重量份为基准,在大约0.01至20重量份的范围内选择,但不限于此。
另外,在所述发光层上形成根据本发明的电子密度调节层55,通过真空沉积法或旋涂法在其沉积电子传输层60,然后形成电子注入层70,并在所述电子注入层70的上部真空热沉积阴极形成用金属而形成阴极80电极,从而完成有机EL元件。
另外,本发明中,所述电子密度调节层的亲和力(affinity)Aed(eV)可以在发光层内主剂亲和力(affinity)Ah(eV)与所述电子传输层的亲和力Ae(eV)之间的范围(Ah≥Aed≥Ae)内取值。
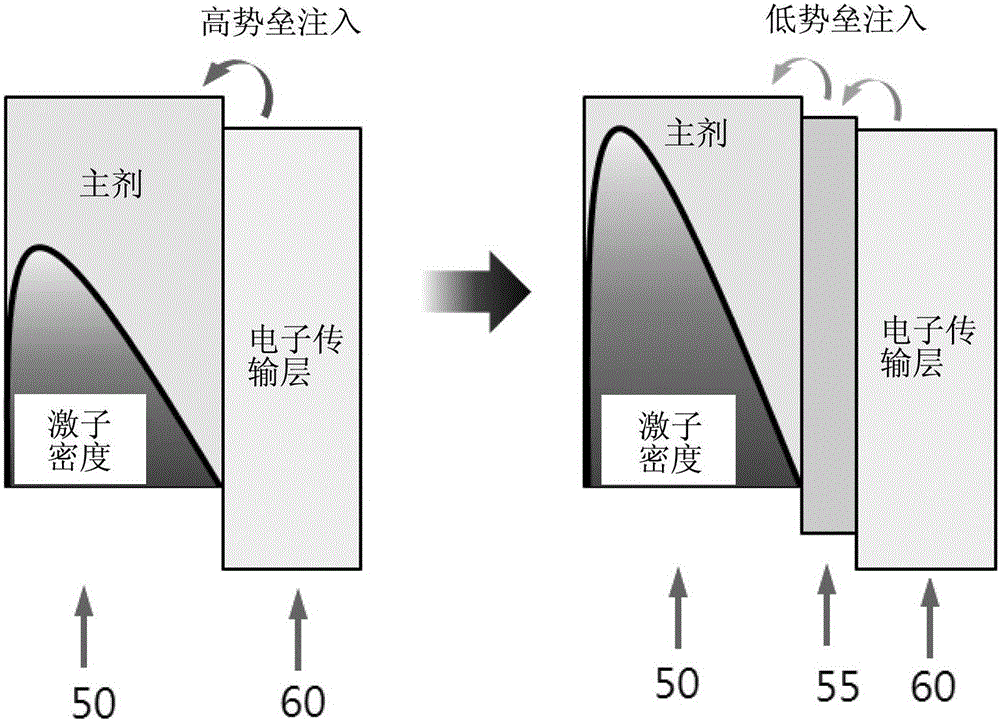
可以通过图2对此进行更详细的说明。图2是示出不包括电子密度调节层的情形(左侧)和包括根据本发明的一实施例的电子密度调节层的情形(右侧)的有机发光元件的结构的图。
如所述图2的左侧图中所示,在电子传输层60直接与发光层50相邻的情况下,在从阴极提供的电子经过电子传输层60而移动至发光层的主剂50的情况下,电子注入势垒(Electron injection barrier)较大,因此变成发光层内主剂的激子密度不大的状态,如本发明,在使所述电子密度调节层的亲和力(affinity)Aed(eV)在发光层内主剂亲和力(affinity)Ah(eV)和所述电子传输层的亲和力Ae(eV)之间的范围(Ah≥Aed≥Ae)内的情况下,各个层之间的电子注入势垒(Electron injection barrier)变得更小,并可以增加发光层内主剂的激子密度。
即,可以借助于所述电子密度调节层而降低电子注入势垒,从而使电子更顺利地注入发光层,因此可以增加发光层的电子密度,因此可以增加在发光层生成的激子的密度,且可以据此提供能够提高外量子效率(EQE)的有机发光元件。
可以通过图3对此进行追加说明。图3是示出在本发明的有机发光元件内,随着发光层内激子的偶极子位置(dipole location)的变化的有机发光元件的电流效率(左)和EL强度(右)的变化的模拟结果的图。
根据所述图3,在发光层内形成的激子的位置以空穴传输层侧为0基准,而将电子传输层侧设为1的情况下,激子的再结合偶极子位置(Dipole location zone)越靠近空穴传输层侧,电流效率(Current efficiency)和EL强度越高。
在所述图3中的效率和EL强度遵循狄拉克函数(Delta function)的情况下(左侧),或者遵循高斯函数(Gaussian function)的情况下,也表现出类似的形态。
即,对于根据本发明的有机发光元件而言,可以通过使电子密度调节层的亲和力(affinity)Aed(eV)在发光层内主剂亲和力(affinity)Ah(eV)和所述电子传输层的亲和力Ae(eV)之间的范围(Ah≥Aed≥Ae)内,使发光层内的电子密度增加,并使激子的再结合区域向空穴传输层侧移动,从而可以提高电流效率(Current efficiency)和EL强度。
另外,本发明中的有机发光元件具有以下优点:无须像现有技术中的韩国公开专利公报第10-2012-0092555那样使用电子密度调节层(现有技术中为阻挡层)材料的三重态能值高于主剂的三重态能值的材料以更有效地引起TTF现象。
可以通过图4而对此进行更详细的观察。所述图4是根据本发明的一实施例的,示出电子密度调节层的三重态能量(ETed)低于发光层主剂的三重态能量(ETh)的情况下的有机发光元件的能级结构的图,如图4所示,根据本发明的电子密度调节层的材料三重态能值可以在小于发光层内主剂的三重态能值的范围内取值。
作为一个示例,所述发光层内主剂的三重态能量(ETh(eV))和电子密度调节层内蒽衍生物的三重态能量(ETed(eV))的差可以在0至0.4的范围(0.4eV≥ETh-ETed≥0eV)内,优选在0至0.3的范围(0.3eV≥ETh-ETed≥0eV)内。
另外,本发明中的所述电子密度调节层内蒽衍生物的电子迁移率(Electron mobility)可以大于或等于电子传输层内材料的电子迁移率。即,通过使所述电子密度调节层材料的电子迁移率不小于电子传输层材料的电子迁移率,可以防止从所述电子传输层供应的电子在调节层被延迟,从而更迅速地供应至发光层,于是可以增加发光层内激子的密度。
可以通过图5而对此进行更详细的观察。
图5是示出本发明的有机发光元件在形成有电子密度调节层的情况和没有形成所述电子密度调节层的情况(Ref.)下的,随着电压变化的电流密度变化的图,为了计算根据电子密度调节层的导入与否的电子迁移率,制造了如图5的下图所示的电子专用装置(Electron only device;EOD),然后施加直流电压并测量了元件的电流密度,根据其结果,如图5的上方的图所示,在相同电压下,电子密度调节层的导入使电流密度得到增加。
仅通过上述测量结果,可知如果导入电子密度调节层,则可以提高元件的电子注入特性。
为了进行更准确的算术比较,可以计算各个元件的电子迁移率(μ)值。为此,将构成元件的整体厚度与电子密度调节层的存在与否无关地相同地制造,从而排除了电子迁移率的计算误差因素。
为了求算电子迁移率,利用了EOD元件测量数据以及下述迁移率和导电率(σ)的关联式(G.Paasch et al.Synthetic Metals Vol.132,pp.97-104(2002))。
首先,从电流-电压数据计算元件的电阻值(R),并利用元件的整体厚度(d)和像素面积值(A)以及下述式(1)计算了导电率。基于通过上述方法得到的导电率以及式(2)计算了电子迁移率值。
μ(cm2/Vs)=σ0.76(S/cm) 式(2)
图6是示出本发明的有机发光元件在形成有电子密度调节层的情况和没有形成所述电子密度调节层的情况下的,根据电场的电子迁移率值的图。
如所述图6所示,可知通过使电子密度调节层材料的电子迁移率不小于电子传输层材料的电子迁移率,可以使从所述电子传输层供应的电子不在电子密度调节层产生延迟而迅速供应至发光层,从而增加发光层内激子的密度。
本发明中使用的电子密度调节层材料以及电子传输层的电子迁移率例如可以为电场强度0.04MV/cm至0.5MV/cm下的至少10-6cm2/Vs。
另外,本发明中所述电子传输材料的功能是将从电子注入电极(Cathode,阴极)注入的电子稳定地传输的功能,其可以使用公知的电子传输物质。公知的电子传输物质的示例有喹啉衍生物,尤其可以使用三(8-羟基喹啉)铝(Alq3)、Liq、TAZ、Balq、beryllium bis(benzoquinolin-10-olate:Bebq2)、AND、化合物201、化合物202、BCP、作为恶二唑衍生物的PBD、BMD、BND等材料,但不限于此。
并且,本发明中的有机发光元件可以层叠有电子注入层(EIL)。所述电子注入层具有以下功能:使电子容易从阴极注入所述电子传输层上的部。且不对其材料进行特殊限定。
所述电子注入层形成材料可以使用作为电子注入层的形成材料而公知的CsF、NaF、LiF、NaCl、Li2O、BaO等任意物质。所述电子注入层的沉积条件根据使用的化合物而不同,但是通常可以在与空穴注入层的形成几乎相同的条件范围内选择。
所述电子注入层的厚度可以为约至约约至在所述电子注入层的厚度满足上述范围的情况下,可以在不使驱动电压实质地上升的前提下,得到令人满意的程度的电子注入特性。
并且,本发明中,所述阴极可以使用锂(Li)、镁(Mg)、铝(Al)、铝-锂(Al-Li)、钙(Ca)、镁-铟(Mg-In)、镁-银(Mg-Ag)等阴极形成用金属,或者可以为了得到全面发光元件而使用利用ITO、IZO的穿透型阴极。
并且,本发明中的有机发光元件还可以包括在380nm至800nm的波长范围内发光的蓝色发光材料、绿色发光材料或者红色发光材料的发光层。即,本发明中的发光层为复数发光层,并且所述追加形成的发光层内的蓝色发光材料、绿色发光材料或者红色发光材料可以是荧光材料或者磷光材料。
并且,本发明中,从所述空穴注入层、空穴传输层、发光层、电子密度调节层、电子传输层和电子注入层选择的一个以上的层可以通过单分子沉积工艺或者溶液工艺而形成。
其中,所述沉积工艺指将作为用于形成所述各个层的材料而使用的物质在真空低电压状态下通过加热等而蒸发并形成薄膜的方法;所述溶液工艺指将作为用于形成所述各个层的材料而使用的物质与溶液混合,并通过喷墨印刷、辊涂(roll to roll coating)、丝印、喷涂、浸涂、旋转涂覆等方法而形成薄膜的方法。
并且,本发明中所述有机发光元件可以应用于从以下装置中选择的一个装置:平板显示装置、柔性显示装置、单色或者白色的平板照明用装置、以及单色或者白色的柔性照明用装置。
以下,通过实施例而对具体化的有机发光元件进行更具体的说明,但是本发明不限于下述实施例。
[实施例]
发光层内主剂化合物的制造例
合成例1:化学式76的合成
合成例1-(1):<中间体1-a>的合成
在500ml的圆底烧瓶反应器中放入(10-苯基(d5)-蒽-9-硼酸(38.6g,127mmol)、1-溴-4-碘苯(35.3g,106mmol)、四(三苯基膦)钯(3.43g,3mmol)、碳酸钾(27.35g,197.9mmol),然后放入150ml的甲苯、150ml的四氢呋喃、60ml的水。使反应器的温度提高到90度,然后进行连夜搅拌。在反应停止,然后使反应器的温度降低至室温,然后用乙酸乙酯萃取而分离有机层。将有机层减压浓缩,然后用柱层析法分离而得到了<中间体1-a>(34.1g,69.3%)。
合成例1-(2):<中间体1-b>的合成
在2L的圆底烧瓶反应器中放入2-溴二苯并呋喃(70.0g,0.283mol)、双(频哪醇合)二硼(86.3g,0.340mol)、1,1′-双(二苯基膦)二茂铁-二氯化钯(II)(4.6g,0.006mol)、醋酸钾(56.6g,0.567mol)、1,4-二恶烷700ml,然后进行连夜换流搅拌。在反应完成,然后通过硅藻土片而将滤液减压浓缩。用柱层析法分离提纯物质而得到了<中间体1-b>(66.4g,79%)。
合成例1-(3):<化学式76>的合成
在250ml的圆底烧瓶反应器中放入<中间体1-a>(6.0g,13mmol)、<中间体1-b>(4.7g,16mmol)、四(三苯基膦)钯(0.46g,3mmol)、碳酸钾(3.67g,26.5mmol),然后放入30ml的甲苯、30ml的1,4-二恶烷、11ml的水。使反应器的温度上升至90度,然后进行连夜搅拌。在反应停止,然后使反应器的温度降低至室温,然后用乙酸乙酯萃取而分离有机层。将有机层减压浓缩,然后用甲苯和丙酮再结晶而得到了<化学式76>(3.4g,48%)。
MS:m/z 551.23[M+]
合成例2:化学式103的合成
合成例2-(1):<化学式103>的合成
除了用9-溴-10苯基蒽代替所述合成例1-(3)中使用的<中间体1-a>,通过相同的方法合成而得到了<化学式103>(3.5g,57%)。
MS:m/z 420.15[M+]
合成例3:化学式140的合成
合成例3-(1):<中间体3-a>的合成
在氮氛围下,在1L的圆底烧瓶反应器中放入2-溴-1,4-二甲氧基苯(50g,230mmol)、四氢呋喃400ml并融化。使温度降低至零下78度,然后滴加正丁基锂(167ml,280mmol)。在相同温度下搅拌2个小时,然后放入三甲基硼酸(36ml,320mmol),然后在室温下进行连夜搅拌。在反应完成,然后缓慢滴加2正盐酸而使其酸化。用水和乙酸乙酯萃取而分离有机层,然后用硫酸镁去除水分。将物质减压浓缩,然后用庚烷和甲苯再结晶而得到了<中间体3-a>(20.8g,50%)。
合成例3-(2):<中间体3-b>的合成
除了用1-溴-3-氟-4-碘苯来代替所述合成例1-(3)中使用的<中间体1-a>、用<中间体3-a>来代替<中间体1-b>,通过相同的方法合成而得到了<中间体3-b>(22.3g,63%)。
合成例3-(3):<中间体3-c>的合成
除了用<中间体3-b>来代替所述合成例1-(3)中使用的<中间体1-a>、用苯基硼酸来代替<中间体1-b>,通过相同的方法合成而得到了<中间体3-c>(16.3g,74%)。
合成例3-(4):<中间体3-d>的合成
在500ml的圆底烧瓶反应器中放入<中间体3-c>(16.3g,53mmol)、氢溴酸(48ml,260mmol)、乙酸100ml,然后搅拌12个小时。在反应完成,然后冷却至常温,然后倒进水并进行搅拌。用水和乙酸乙酯萃取反应物而分离有机层。将有机层减压浓缩,然后用庚烷再结晶,然后过滤并干燥而得到了<中间体3-d>(14g,95%)。
合成例3-(5):<中间体3-e>的合成
在500ml的圆底烧瓶反应器中放入<中间体3-d>(14g,50mmol)、碳酸钾(20.7g,150mmol)、N-甲基-2-吡咯烷酮112ml,然后搅拌12个小时。在反应完成,然后用水和乙酸乙酯萃取而分离有机层。将物质减压浓缩后用庚烷再结晶而得到了<中间体3-e>(10.5g,81%)。
合成例3-(6):<中间体3-f>的合成
在氮氛围下,在500ml的圆底烧瓶反应器中放入<中间体3-e>(13.6g,52mmol)以及136ml的二氯甲烷,然后使其融化。将反应溶液冷却至0度,然后放入吡啶(10ml,110mmol),然后在维持相同温度的前提下,滴加三氟甲磺酰基酐(12.7g,68mmol)。在常温下搅拌12个小时,然后在反应溶液中放入20ml的水后进行搅拌。用水和二氯甲烷萃取而分离有机层,然后减压浓缩,然后用庚烷再结晶而得到了<中间体3-f>(7.5g,37%)。
合成例3-(7):化学式140的合成
在250ml的圆底烧瓶反应器中放入<中间体3-f>(7.5g,19mmol)、10-苯基(d5)-蒽-9-硼酸(7g,23mmol)、四(三苯基膦)钯(0.66g,0.6mmol)、碳酸钾(7.9g,57mmol),然后放入53ml的甲苯、23ml的乙醇、23ml的水,然后搅拌12个小时。在反应停止,然后使反应物降至常温,然后倒入甲醇并搅拌,然后分离有机层。将有机层减压浓缩,然后用甲苯和丙酮再结晶而得到了<化学式140>(6g,63%)。
MS:m/z 501.21[M+]
合成例4:化学式150的合成
合成例4-(1):<中间体4-a>的合成
除了用2-溴-1,4-二甲氧基苯来代替所述合成例1-(3)中使用的<中间体1-a>、用2-氟-(4,6-二苯基)-苯基-1-硼酸来代替<中间体1-b>,通过相同的方法合成而得到了<中间体4-a>(22.6g,54%)。
合成例4-(2):<中间体4-b>的合成
除了用<中间体4-a>来代替所述合成例3-(4)中使用的<中间体3-c>,通过相同的方法合成而得到了<中间体4-b>(15.7g,75%)。
合成例4-(3):<中间体4-c>的合成
除了用<中间体4-b>来代替所述合成例3-(5)中使用的<中间体3-d>,通过相同的方法合成而得到了<中间体4-c>(11.4g,77%)。
合成例4-(4):<中间体4-d>的合成
除了用<中间体4-c>来代替所述合成例3-(6)中使用的<中间体3-e>,通过相同的方法合成而得到了<中间体4-d>(9.9g,62%)。
合成例4-(5):化学式150的合成
除了用<中间体4-d>来代替所述合成例3-(7)中使用的<中间体3-f>,通过相同的方法合成而得到了<化学式150>(7.6g,62%)。
MS:m/z 577.25[M+]
合成例5:化学式151的合成
合成例5-(1):<中间体5-a>的合成
除了用2-溴-1,3-二甲氧基苯来代替所述合成例3-(1)中使用的2-溴-1,4-二甲氧基,通过相同的方法合成而得到了<中间体5-a>(23g,55%)。
合成例5-(2):<中间体5-b>的合成
除了用4-溴-1-氟-2-碘苯来代替所述合成例1-(3)中使用的<中间体1-a>、用<中间体5-a>来代替<中间体1-b>,通过相同的方法合成而得到了<中间体5-b>(21.3g,54%)。
合成例5-(3):<中间体5-c>的合成
除了用<中间体5-b>来代替所述合成例1-(3)中使用的<中间体1-a>、用苯基硼酸来代替<中间体1-b>,通过相同的方法合成而得到了<中间体5-c>(15.8g,75%)。
合成例5-(4):<中间体5-d>的合成
除了用<中间体5-c>来代替所述合成例3-(4)中使用的<中间体3-c>,通过相同的方法合成而得到了<中间体5-d>(11g,77%)。
合成例5-(5):<中间体5-e>的合成
除了用<中间体5-d>来代替所述合成例3-(5)中使用的<中间体3-d>,通过相同的方法合成而得到了<中间体5-e>(9.3g,91%)。
合成例5-(6):<中间体5-f>的合成
除了用<中间体5-e>来代替所述合成例3-(6)中使用的<中间体3-e>,通过相同的方法合成而得到了<中间体5-f>(7.9g,56%)。
合成例5-(7):<化合物151>的合成
除了用<中间体5-f>来代替所述合成例3-(7)中使用的<中间体3-f>,通过相同的方法合成而得到了<化合物151>(7.1g,70%)。
MS:m/z 501.21[M+]
电子密度调节层用化合物的制造例
合成例6:化学式203的合成
合成例6-(1):<中间体6-a>的合成
在2L的圆底烧瓶反应器中放入4-溴二苯并呋喃(150.0g,0.607mol)、乙酰胺(53.8g,0.911mol)、碘化亚铜(57.8g,0.30mol)、(±)反式1,2-二氨基环己烷(63.9g,0.60mol)、碳酸钾(167.8g,1.21mol)、甲苯1500ml,然后进行连夜换流搅拌。反应完成后在硅胶片过滤,然后用热的甲苯清洗多次。将滤液减压浓缩,然后在生成固体,然后用乙腈结晶化并过滤而得到了<中间体6-a>(70.0g,51%)。
合成例6-(2):<中间体6-b>的合成
在2L的圆底烧瓶反应器中放入<中间体6-a>(70.0g,0.311mol)和乙酸630ml并融化。混合溴(49.7g,0.311mol)和乙酸280ml,然后滴加到反应器中。在常温下搅拌2个小时,然后当反应完成时,放入100ml的水并进行搅拌。将500ml的乙醇放入生成的灰色固体,然后搅拌并过滤。固体在乙醇悬浮,然后过滤干燥而得到了<中间体6-b>(86.0g,91%)。
合成例6-(3):<中间体6-c>的合成
在2L的圆底烧瓶反应器中放入<中间体6-b>(86.0g,0.283mol)、乙醇600ml、四氢呋喃430ml,然后搅拌。将氢氧化钾(47.6g,0.848mol)溶于260ml的水,然后缓慢放入反应器中,然后进行连夜换流搅拌。在反应完成,然后冷却至常温。用乙酸乙酯和水萃取而将有机层减压浓缩。在生成的固体中放入过量的乙醇,然后搅拌并过滤。用二氯甲烷和庚烷再结晶而得到了<中间体6-c>(73.0g,98%)。
合成例6-(4):<中间体6-d>的合成
在2L的圆底烧瓶反应器中放入<中间体6-c>(73.0g,0.279mol)、盐酸90ml和水440ml,然后冷却至0度并进行搅拌。将亚硝酸钠(25.0g,0.362mol)溶于90ml的水中,然后缓慢滴加到反应溶液中,然后在相同温度下搅拌1个小时。将碘化钾(92.5g,0.557mol)溶于90ml的水而滴加到反应溶液中,然后在常温下进行搅拌。在反应完成,然后用乙酸乙酯和水萃取。用五水硫代硫酸钠水溶液清洗有机层,然后进行分离减压浓缩。用柱层析法将物质分离提纯而得到了<中间体6-d>(52.3g,50.3%)。
合成例6-(5):<中间体6-e>的合成
在2L的圆底烧瓶反应器中放入<中间体6-d>(15.0g,40mmol)、苯基硼酸(5.4g,44mmol)、四(三苯基膦)钯(0.9g,1mmol)、碳酸钾(11.1g,80mmol),然后放入100ml的甲苯、45ml的甲醇、30ml的水。将反应器连夜换流搅拌。在反应停止,然后使反应器的温度降低至室温,然后用乙酸乙酯进行萃取。将有机层减压浓缩,然后用柱层析法进行分离。用庚烷将固体再结晶而得到了<中间体6-e>(7.0g,53.9%)。
合成例6-(6):<化合物203>的合成
在250ml的圆底烧瓶反应器中放入<中间体6-e>(7.0g,22mmol)、(10-苯基(d5)-蒽-9-硼酸(7.9g,26mmol)、四(三苯基膦)钯(0.5g,1mmol)、碳酸钾(6.0g,43mmol),然后放入50ml的甲苯、21ml的乙醇、14ml的水。使反应器的温度上升至90度,然后进行连夜搅拌。在反应停止,然后使反应器的温度降低至室温,然后放入50ml的甲醇并在常温下进行搅拌。过滤生成的固体,然后用甲醇清洗。用甲苯和丙酮使固体再结晶而得到了<化合物203>。
MS(MALDI-TOF):m/z 501.21[M+]
合成例7:化学式209的合成
合成例7-(1):<中间体7-a>的合成
在500ml的圆底烧瓶反应器中放入甲基2-溴苯甲酸(30.0g,0.140mol)、4-二苯基硼酸(32.5g,0.153mol)、四(三苯基膦)钯(3.2g,3mmol)、碳酸钾(38.6g,0.279mol),然后放入210ml的甲苯、90ml的甲醇、60ml的水。将反应器连夜换流搅拌。在反应停止,然后使反应器的温度降低至室温,然后用乙酸乙酯萃取并分离有机层。将有机层减压浓缩,然后用柱层析法分离而得到了<中间体7-a>(25.0g,59.1%)。
合成例7-(2):<中间体7-b>的合成
在500ml的圆底烧瓶反应器中放入溴本(28.6g,182mmol)和四氢呋喃220ml,然后在氮氛围下冷却至-78度。在相同温度下,在冷却的反应溶液中滴加正丁基锂(104.6ml,167mmol)。将反应溶液搅拌2个小时,然后缓慢放入<中间体7-a>(22.0g,73mmol),然后在常温下进行搅拌。在反应结束,然后放入50ml的H2O而停止反应,然后用乙酸乙酯和水进行萃取。将有机层分离并减压浓缩而得到了<中间体7-b>(28.0g,90%)。
合成例7-(3):<中间体7-c>的合成
在500ml的圆底烧瓶反应器中放入<中间体7-b>(28.0g,66mmol)和乙酸310ml,然后放入2ml的盐酸并换流搅拌1个小时。在生成固体,然后用薄膜色谱法停止反应,然后冷却至室温。将生成的固体过滤,然后用H2O、甲醇清洗并干燥,从而得到了<中间体7-c>。(22.3g,83.2%)
合成例7-(4):<中间体7-d>的合成
在2L的圆底烧瓶反应器中放入<中间体7-c>(22.3g,55mmol)、二氯甲烷500ml并融化。将溴(8.72g,55mmol)和二氯甲烷250ml混合而缓慢滴加到反应器,然后在常温下搅拌3个小时。在反应完成之后,用碳酸氢钠水溶液清洗反应溶液。将固体过滤,然后用甲苯和丙酮再结晶而得到了<中间体7-d>(25.0g,94%)。
合成例7-(5):<化合物209>的合成
在250ml的圆底烧瓶反应器中放入<中间体7-d>(7.0g,14mmol)、(10-苯基-蒽-9-硼酸(5.1g,17mmol)、四(三苯基膦)钯(0.3g,3mmol)、碳酸钾(4.0g,29mmol),然后放入甲苯49ml、乙醇21ml、水14ml。使反应器的温度上升至90度,然后进行连夜搅拌。在反应停止,然后使反应器的温度降低至室温,然后用乙酸乙酯萃取。将有机层分离并进行减压浓缩,然后用柱层析法分离提纯,然后用二氯甲烷和丙酮再结晶而得到了<化合物209>。
MS(MALDI-TOF):m/z 660.25[M+]
合成例8:化学式213的合成
合成例8-(1):<中间体8-a>的合成
除了用4-联苯硼酸来代替所述合成例6-(5)中的苯基硼酸,利用相同的方法得到了<中间体8-a>(8.5g,55.9%)。
合成例8-(2):<化合物213>的合成
除了用<中间体8-a>来代替所述合成例7-(5)中的<中间体7-d>,利用相同的方法得到了<化合物213>(6.3g,51%)。
MS(MALDI-TOF):m/z 572.21[M+]
合成例9:化学式299的合成
合成例9-(1):<中间体9-a>的合成
除了用1,4-二溴萘来代替所述合成例1-(1)中的1-溴-4碘苯,利用相同的方法得到了<中间体9-a>(29g,59.5%)。
合成例9-(2):<化合物299>的合成
除了用<中间体9-a>来代替所述合成例1-(3)中的<中间体1-a>,利用相同的方法得到了<化合物299>(4.0g,67.4%)。
MS:m/z 552.2[M+]
掺杂剂化合物的制造
合成例10:BD2的合成
合成例10-(1):[中间体10-a]的合成
在500ml的圆底烧瓶反应器中放入甲基5-溴-2-碘苯甲酸(25.0g,73mmol)、4-二苯并呋喃硼酸(18.7g,88mmol)、四(三苯基膦)钯(1.7g,0.15mmol)、碳酸钾(20.2g,146.7mmol),然后放入甲苯125ml、四氢呋喃125ml、水50ml。使反应器的温度上升至80度,然后搅拌10小时。在反应结束,然后使反应器的温度降低至室温,并用乙酸乙酯萃取而分离了有机层。将有机层减压浓缩,然后用柱层析法分离而得到了<中间体10-a>(75.0g,60.1%)。
合成例10-(2):[中间体10-b]的合成
在500ml的圆底烧瓶反应器中放入<中间体10-a>(17.0g,45mmol)、氢氧化钠(2.14g,54mmol)、乙醇170ml,然后换流搅拌48小时。用薄膜色谱法确认反应停止,然后冷却至室温。在冷却的溶液中滴加2-正盐酸而酸化,然后将生成的固体过滤30分钟。用二氯甲烷和正己烷再结晶而得到了<中间体10-b>(14.5g,88.6%)。
合成例10-(3):[中间体10-c]的合成
在250ml的圆底烧瓶反应器中放入<中间体10-b>(14.5g,39mmol)、甲磺酸145ml,然后将温度提高至80度后搅拌3个小时。用薄膜色谱法确认反应停止,然后冷却至室温。将反应溶液缓慢滴加到150ml的冰水,然后搅拌30分钟。用水和甲醇清洗生成的固体而得到了<中间体10-c>(11.50g,83.4%)。
合成例10-(4):[中间体10-d]的合成
在1L的圆底烧瓶反应器中放入<中间体10-c>(11.5g,33mmol)、二氯甲烷300ml,然后在常温下搅拌。滴加用50ml的二氯甲烷稀释后的溴(3.4ml,66mmol),然后在常温下搅拌8小时。在反应完成,然后在反应容器中放入丙酮100ml后进行搅拌。将生成的固体过滤,然后用丙酮进行清洗。用氯苯再使固体结晶而得到了<中间体10-d>(11.0g,78%)。
合成例10-(5):[中间体10-e]的合成
在250ml的圆底烧瓶反应器中放入2-溴联苯(8.4g,0.036mol)和四氢呋喃110ml,然后在氮氛围下冷却至-78度。在同一温度下,在冷却后的反应溶液中滴加正丁基锂(19.3ml,0.031mol)。将反应溶液搅拌2个小时,然后缓慢放入<中间体7-d>(11.0g,0.026mol),并在常温下进行搅拌。在反应溶液的颜色产生变化,然后用TLC确认了反应的停止。放入50ml的H2O而停止反应,然后用乙酸乙酯和水进行萃取。将有机层分离并减压浓缩,然后用乙腈再结晶而得到了<中间体10-e>(12.2g,81.5%)。
合成例10-(6):[中间体10-f]的合成
在250ml的圆底烧瓶反应器中放入<中间体10-e>(12.0g,0.021mol)和乙酸120ml、硫酸2ml,然后换流搅拌5个小时。在生成固体,然后用薄膜色谱法确认反应停止,然后冷却至室温。将生成的固体过滤,然后用H2O、甲醇清洗,然后在氯苯中融化并进行硅胶过滤、浓缩,然后得到了<中间体10-f>(10.7g,90%)。
合成例10-(7):[BD 2]的合成
在250ml的圆底烧瓶反应器中放入<中间体10-f>(5.0g,0.009mol)、(4-叔丁基苯基)-苯胺(4.7g,0.021mol)、醋酸钯(II)(0.08g,0.4mmol)、叔丁醇钠(3.4g,0.035mol)、三叔丁基膦(0.07g,0.4mmol)、甲苯60ml,然后换流搅拌2个小时。在反应完成,然后冷却至常温。用二氯甲烷和水萃取反应溶液。将有机层分离并用硫酸镁进行无水处理,然后进行减压浓缩。用柱层析法分离提纯,然后用二氯甲烷和丙酮再结晶而得到了<BD 2>(2.9g,38%)。
MS(MALDI-TOF):m/z 852.41[M+]
实施例1~6:有机发光元件的制造
通过图案化而使ITO玻璃的发光面积成为2mm×2mm的大小后进行清洗。将所述ITO玻璃安装在真空腔内,然后使基准压力成1×10-7torr,然后在所述ITO上以DNTPDα-NPD的顺序成膜。然后使用下表1中记载的主剂化合物以及作为掺杂剂的BD1(重量比97:3),将主剂和掺杂剂混合后成膜而作为发光层,然后使下表1中记载的化合物成膜而作为电子密度调节层,然后以作为电子传输层而使[化学式E-1]取定作为电子注入层而使[化学式E-2]取定Al的顺序成膜而制造了有机发光元件。并在10mA/cm2下测量了所述有机发光元件的发光特性。
实施例7至13:有机发光元件的制造
除了用[BD2]来代替所述实施例1至6中使用的[BD1]而作为发光层内掺杂剂,通过相同的方法制造了有机发光元件,并在10mA/cm2下测量了所述有机发光元件的发光特性。所述[BD2]的结构如下。
比较例1
除了将[ET2]使用为所述实施例3中使用的电子密度调节层,通过相同的方法制造了有机发光元件,并在10mA/cm2下测量了所述有机发光元件的发光特性。
比较例2和3:有机发光元件的制造
除了将[BH1]和[BH2]使用为所述实施例1至6中使用的发光层内主剂,通过相同的方法制造了有机发光元件,并在10mA/cm2下测量了所述有机发光元件的发光特性。所述[BH1]和[BH2]的结构如下。
比较例4至8
在与所述实施例1至6相同的条件下制造了有机发光元件,但是制造了没有形成电子密度调节层的有机发光元件。
[表1]
并且,所述图5中,为了示出本发明的有机发光元件形成电子密度调节层的情况和没有形成所述电子密度调节层的情况下的,根据电压变化的电流密度的变化,而示出了实施例3至5的结果(装置1至装置3)和比较例4的结果(参照)。图6中为了示出本发明的有机发光元件形成电子密度调节层的情况和没有形成所述电子密度调节层的情况下的根据电场的电子迁移率值,而示出了实施例3至5的结果(装置1至装置3)和比较例4的结果(参照)。
并且,图7中示出了根据本发明的实施例3至5的结果(装置1至装置3)和比较例4的结果(参照)的根据电流密度变化的外量子效率的变化。
如上表1和图7所示,对于根据本发明的有机发光元件而言,可知相比没有配备电子密度调节层的比较例4至5的有机发光元件,具有低电压驱动以及优秀的外量子效率,并且,根据本发明的有机发光元件虽然在比较例2至3中配备有电子密度调节层,但是相比不使用本发明的发光层中使用的主剂而使用其他种类的主剂的情况下的有机发光元件,可知其外量子效率更优秀,因此可以提供效率进一步改善的有机发光元件。
- 还没有人留言评论。精彩留言会获得点赞!