PRRSV感染诱导的小鼠体内氧化胁迫模型的建立方法与流程
本发明属于病毒体内接种动物诱导氧化胁迫模型的建立方法,尤其涉及一种PRRSV处理诱导的小鼠体内氧化胁迫模型的建立方法。
背景技术:
在病毒感染与细胞氧化应激状态相关性的研究中,人们发现HIV感染时,患者血浆中SOD活性明显低于正常组,而且血浆和单核细胞内SOD的活性与CD4+T淋巴细胞数呈正相关,说明HIV感染时能通过改变SOD活性影响CD4+/CD8+细胞比例从而降低免疫细胞清楚病毒能力。患者通过长期服用具有抗氧化作用的多酚能够提升淋巴细胞繁殖能力,恢复T淋巴细胞的动态平衡。麻疹病毒感染时B淋巴细胞MnSOD增多,但并不向外运送SOD,而加入MnSOD的同构体后能降低细胞内病毒浓度,说明MnSOD可能具有调节麻疹病毒患者免疫功能的作用。
目前,国内外学者对PRRSV感染的动物模型做了很多研究,但PRRSV单独接种的小动物实验模型却鲜有报道,有关PRRSV感染与小鼠免疫器官氧化应激之间的研究尚未见报道。在PRRSV感染时,外周血T淋巴细胞表型的变化对反映机体免疫状态和抵抗病毒处理有重要意义。PRRSV感染能降低机体CD4+/CD8+细胞比例,抑制细胞清除病毒能力。
技术实现要素:
本发明要解决的技术问题是提供一种PRRSV诱导的小鼠体内氧化胁迫模型的建立方法处理,为PRRSV感染机体后体内免疫细胞在抗病毒处理和免疫致病过程中的作用机制提供较为理想的动物模型。
为解决上述技术问题,本发明采用以下技术方案:PRRSV诱导的小鼠体内氧化胁迫模型的建立方法,采用PRRSV通过口服灌胃、滴鼻、腹腔注射三种途径联合接种处理小鼠,病毒浓度为TCID50是10-5.5/0.1mL的PRRSV病毒原液的100-10-1。
接种时间为第1、2、3天,其接种剂量为0.2-0.5mL,处理时间为7-21天。
上述PRRSV诱导的小鼠体内氧化胁迫模型的建立方法,包括以下步骤:
将试验用昆明小鼠随机分成3组,即空白对照组、低稀释度病毒液组和高稀释度病毒液组,每组6只;将PRRSV病毒液用RPMI 1640培养液作10倍稀释,作为低稀释度病毒液组的接种浓度,高稀释度病毒液组用病毒原液进行处理,空白对照组选用等量的无菌RPMI 1640培养液进行接种;每天观察小鼠状况,分别于接种后7、14、21天解剖两只小鼠,检测病毒核酸;
将试验用昆明小鼠随机分成2组,即空白对照组和病毒处理组,每组30只;将PRRSV病毒液用RPMI 1640培养液按(1)的实验结果进行稀释,作为病毒处理组的接种浓度,空白对照组选用等量的无菌RPMI 1640培养液进行处理;每天观察小鼠状况,分别在处理第7、14、21天后,解剖20只小鼠,每组10只,无菌分离小鼠脾脏及朐腺,称重并计算小鼠免疫器官指数;将脾脏放入加有PBS缓冲液,并贴有标签的EP管内,无菌分离小鼠脾淋巴细胞备用,用于测定表征氧化胁迫模型的相关指标。
昆明小鼠为SPF级。
理化指标包括NO、ROS、GSH、GSSG、XOD、MPO和iNOS等指标。
发明人以小鼠为研究对象,建立了一种PRRSV诱导的小鼠体内氧化胁迫模型的建立方法,采用PRRSV通过口服灌胃、滴鼻、腹腔注射三种途径联合接种小鼠,病毒浓度为TCID50是10-5.5/0.1mL的PRRSV病毒原液的100-10-1。应用本发明,利用不同浓度PRRSV处理不同时间,通过检测细胞存活率,NO释放,细胞内ROS水平,GSH和GSSG含量,XOD、MPO和iNOS活性等指标,可以确定最佳处理病毒浓度和处理时间。本发明的模型建立方法操作简单、科学合理、成本低廉,通过研究病毒诱导的小鼠脾脏氧化应激状态的变化,可为进一步研究PRRSV处理提供较理想的动物模型,为改变病毒感染后机体的免疫状态提供新思路,进而相关动物疾病的免疫和治疗提供一些新方法。
附图说明
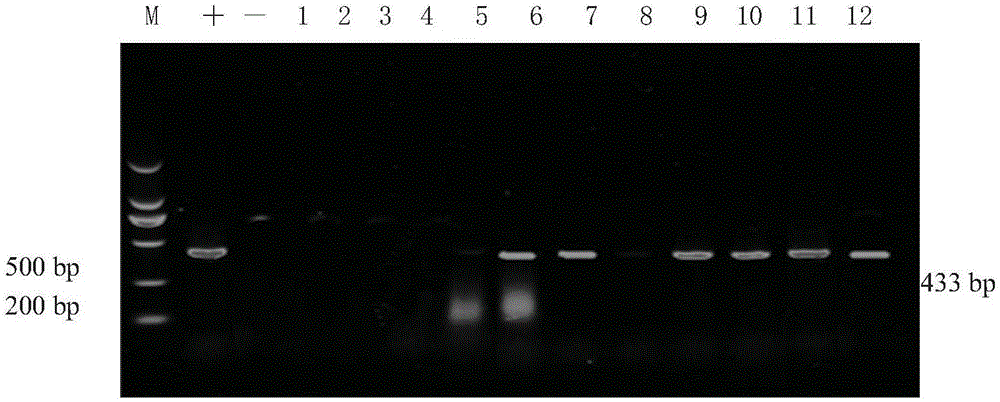
图1是PRRSV处理第7天脾脏和肺部病毒核酸电泳图。
图2是PRRSV处理第14天脾脏和肺部病毒核酸电泳图。
图3是PRRSV处理第21天脾脏和肺部病毒核酸电泳图。
图1至图3中:M:DNA Marker DL2000;-:阴性对照;+:阳性对照;1-4:空白组小鼠脾脏及肺;5-8:低浓度组小鼠脾脏及肺;9-12:高浓度组小鼠脾脏及肺。
图4是PRRSV对小鼠脾脏指数的影响图。
图5是PRRSV对小鼠朐腺指数的影响图。
图6是PRRSV处理对小鼠脾细胞内ROS水平的影响图。
图7是PRRSV处理对小鼠脾细胞内GSH含量的影响图。
图8是PRRSV处理对小鼠脾细胞内GSSG含量的影响图。
图9是PRRSV处理对小鼠脾细胞内GSH/GSSG的影响图。
图10是PRRSV处理对小鼠脾细胞内XOD活力的影响图。
图11是PRRSV处理对小鼠脾细胞内MPO活力的影响图。
图12是PRRSV处理对小鼠脾细胞内iNOS活力的影响图。
具体实施方式
一、实验方法
(1)处理的病毒浓度筛选
将试验用昆明小鼠(SPF级)随机分成3组,即空白对照组、低稀释度病毒液组和高稀释度病毒液组,每组6只,雌雄各半,分别编号。将PRRSV病毒液用RPMI 1640培养液做10倍稀释,作为低稀释度病毒液组的接种浓度,高稀释度病毒液组用病毒原液进行接种,空白对照组选用等量的无菌RPMI 1640培养液进行处理。通过口服灌胃、滴鼻、腹腔注射三种途径联合接种小鼠,PRRSV病毒原液的TCID50为10-5.5/0.1mL,接种时间为第1、2、3天,其接种剂量分别为0.3、0.2、0.5mL。每天观察小鼠状况,分别于处理后7、14、21天解剖两只小鼠,检测病毒核酸。
(2)病毒的作用时间筛选
将试验用昆明小鼠随机分成2组,即空白对照组和病毒处理组,每组30只,雌雄各半,分别编号。将PRRSV病毒液用RPMI 1640培养液按(1)实验结果进行稀释,作为病毒处理组的处理浓度,空白对照组选用等量的无菌RPMI 1640培养液进行处理。参照前述处理方式接种。每天观察小鼠状况,分别在接种第7、14、21天后,解剖20只小鼠,每组10只,无菌分离小鼠脾脏及朐腺,称重并记录,计算小鼠免疫器官指数;将脾脏放入加有PBS缓冲液,并贴有标签的EP管内,无菌分离小鼠脾淋巴细胞备用。
(3)RNA提取
(a)取上清液300μL至新的EP管中,加入700μL Trizol溶液,上下颠倒混匀10下,室温静止5分钟;
(b)每管加入200μL氯仿,盖紧EP管,上下颠倒用力摇晃15秒,使其充分混匀,室温静置5分钟后,4℃,12000g离心10分钟;
(c)将上层水相转入新的1.5mL EP管中(约400-500μL),加入等量异丙醇,混匀后静置10分钟,4℃,12000g离心10分钟;
(d)小心吸弃上清,留取沉淀。加入800μL无水乙醇洗涤沉淀后4℃,12000g离心5分钟;
(e)小心弃去上清,将EP管倒扣于超净工作台开风机吹干,约20分钟后RNA沉淀变至透明,向EP管中加入30μL DEPC水溶解;
(f)提取的RNA立即用于反转录或分装后保存于-80℃超低温冰箱。
(4)RT-PCR实验
(a)RT-PCR反应体系
(b)RT-PCR反应条件
42℃ 40min
85℃ 5min
4℃ Forever
(c)PCR反应体系
(d)PCR反应条件
(e)凝胶电泳:PCR产物经1%琼脂糖凝胶电泳观察扩增片段进行鉴定。
(5)荧光探针测定细胞内ROS水平
将脾细胞铺于24孔细胞培养板,加入500μl DCFH-DA荧光探针24,37℃,5%CO2孵育60min,PBS洗3次,加入2ml PBS,吹下细胞,于荧光分光光度计测定荧光值。
(6)酶标法测定脾脏内GSH、GSSG含量
每只小鼠取相同重量脾脏,按试剂盒说明书处理后分装保存于-80℃,用于GSH、GSSG含量检测。使用酶标仪严格按照总谷胱甘肽(T-GSH)/氧化型谷胱甘肽(GSSG)检测试剂盒说明书进行操作,所有样品均在同一批测定中完成。
(7)分光光度法测定细胞内XOD、MPO和iNOS活性
每只小鼠取相同重量脾脏,加入等量PBS,冰水浴超声破碎1分钟,4℃,12000g离心10分钟,吸取上清分装保存于-80℃,用于XOD、MPO和iNOS活力检测。使用紫外分光光度计严格按照XOD、MPO和iNOS测定试剂盒说明书进行操作,所有样品均在同一批测定中完成。
(8)数据统计分析
所测得数据用SPSS 21.0统计软件进行统计学处理。所有实验结果以均数±标准差表示,采用单因素方差分析进行统计学分析。以P<0.05表示为差异显著,P<0.01为差异极显著,P>0.05为差异不显著。肩标*表示与对照组相比P<0.05,肩标**表示与对照组相比P<0.01。
二、实验结果
1.不同浓度病毒处理不同时间后各脏器内病毒核酸检测
结果如图1至3所示,各处理时间段空白对照组均无目的条带,处理第7天高浓度病毒接种组目的条带明显亮于低浓度病毒接种组;处理第14天低浓度病毒接种组小鼠目的条带逐渐变量,部分条带与高浓度病毒接种组亮度一样;接种第21天低浓度病毒处理组与高浓度病毒处理组目的条带亮度一样。说明高浓度病毒效果较低浓度病毒明显,后续建模实验选用病毒原液作为接种浓度。
2.PRRSV接种对小鼠免疫器官指数的影响
小鼠免疫器官指数结果如图4和图5所示,不同稀释度PRRSV接种小鼠均能一定程度上降低小鼠脾脏指数及朐腺指数,但与对照组相比差异不显著。
3.PRRSV接种对小鼠脾细胞内ROS水平的影响
小鼠脾细胞内ROS水平结果如图6所示,PRRSV接种能升高小鼠脾细胞内ROS水平,并随着处理天数的增加而升高。与对照组相比病毒组处理第7天和21天细胞内ROS水平显著升高(P<0.05);处理第14天时极显著升高(P<0.01)细胞内ROS水平。
4.PRRSV接种对小鼠脾脏内GSH和GSSG含量的影响
病毒处理后小鼠脾脏内谷胱甘肽含量结果如图7、图8和图9所示,PRRSV处理降低了小鼠脾脏内GSH和GSSG含量,其中处理7天和14天显著降低小鼠脾脏GSH含量(P<0.05);处理7天显著降低小鼠脾脏GSSG含量(P<0.05);处理7天和14天显著降低GSH/GSSG比值(P<0.05)。说明PRRSV接种能降低小鼠脾脏抗氧化能力及自由基清除能力,使小鼠处于氧化应激状态。
5.PRRSV接种对小鼠脾脏内XOD、MPO和iNOS活力的影响
结果如图10、图11和图12所示,PRRSV处理不同时间均能升高小鼠脾脏XOD、MPO和iNOS活力。在一定时间范围内,XOD活力随处理时间增加而升高,与空白组相比,PRRSV处理7天、14天和21天均能极显著升高小鼠脾脏XOD活力(P<0.01);处理7天显著升高脾脏MPO活力(P<0.05);iNOS活力也随处理时间增加而逐渐升高,处理21天是达到峰值,与空白组相比差异极显著(P<0.01)。
三、研究结论
(1)PRRSV成功接种小鼠
本研究选用昆明种小鼠,采用滴鼻、灌胃和腹腔注射的方法制备PRRSV小鼠模型,通过取小鼠肺脏和脾脏用RT-PCR法检测发现,病毒原液在处理7天、14天和21天均能检测到高亮度条带,而做10倍稀释的病毒处理时,RT-PCR条带随处理时间增加而逐渐变亮,说明病毒原液在处理初就能取得良好的效果,病毒在小鼠脾脏和肺脏有一定量的增殖,而稀释后的病毒处理初期,脾脏和肺脏检测到的病毒量较少,但随处理时间增加,病毒数量逐渐增多。伴随着病毒的增殖,还可以发现小鼠的免疫力有所下降,说明PRRSV处理对小鼠具有一定的免疫抑制作用。
(2)PRRSV处理上调XOD、MPO、iNOS活力和ROS水平
PRRSV病毒原液处理小鼠能上调脾脏XOD、MPO和iNOS活力,在处理7天、14天和21天小鼠脾脏XOD活力逐渐升高,且极显著高于空白对照组;MPO活力随处理时间增加逐渐降低,处理7天时,小鼠脾脏MPO活力显著高于空白对照组,在处理14天和21天时虽然高于空白对照组,但差异不显著。伴随XOD和MPO共同作用,病毒处理组小鼠脾细胞内ROS水平高于空白对照组,处理7天和21天显著高于空白对照组,处理14天极显著高于空白对照组。ROS水平检测结果我们还可以发现,随着处理时间的增加,细胞内ROS水平逐渐升高,但空白组也表现出同样的趋势,这可能是由于每次检测时活细胞数量不同造成的。分析iNOS活力检测结果我们发现,随着病毒处理时间增加,iNOS活力也逐渐升高,但处理7天和14天与空白组相比,差异不显著,当处理21天时极显著高于空白对照组,因此,我们猜测在病毒处理初期,病毒主要通过刺激脾细胞上调XOD和MPO活力导致细胞产生大量ROS从而引起机体氧化应激,随着病毒的持续处理,脾细胞内iNOS活力逐渐升高,诱导产生如NO等自由基造成机体损伤。
(3)PRRSV处理通过降低GSH/GSSG比值改变脾脏氧化应激状态
病毒处理初期能显著降低脾脏GSH含量,随着处理时间增加,GSH含量逐渐升高,但始终低于空白对照组;脾脏GSSG含量也有着同样的变化趋势,病毒处理组脾脏GSSG含量均低于空白对照组,处理7天时显著低于空白对照组,处理14天和21天则与空白对照组相比差异不显著;分析GSH/GSSG时,与空白对照组相比,病毒处理能降低GSH/GSSG比值,处理7天和14天表现为显著降低,21天时则差异不显著,且呈先下降再上升的趋势。说明PRRSV处理能改变小鼠脾脏氧化还原状态,引起小鼠脾脏氧化应激,且在一定范围内,随着处理时间增加,氧化和还原逐渐恢复平衡。
综上所述,PRRSV成功接种小鼠,并通过上调细胞XOD、MPO和iNOS活力,上调ROS水平,降低GSH/GSSG比值改变脾脏氧化还原状态,诱导小鼠氧化应激,成功建立PRRSV处理小鼠氧化胁迫模型,并确立病毒原液处理14天是建立模型的最佳条件。
- 还没有人留言评论。精彩留言会获得点赞!