一种抑制α-葡萄糖苷酶和降低食物GI值的复配糖醇的制作方法
本发明涉及一种复配糖醇,尤其是一种抑制α-葡萄糖苷酶和降低食物gi值的复配糖醇。
背景技术:
随着环境和生活方式变化,人类疾病谱发生了很大转变,糖尿病、心血管疾病、肥胖症等慢性疾病比例不断上升,已成为目前全球性重大的公共卫生问题。其中,糖尿病已成为继心脑血管病、肿瘤之后位居第三的慢性非传染疾病,在临床上以高血糖为主要特征,若血糖控制不佳则会导致全身多系统、多脏器损害,引发各种急慢性并发症。预防和控制上述疾病发生的关键在于科学合理的膳食结构。为此,加拿大科学家jenkin’s等(1981)提出了血糖生成指数(gi),gi表示当食用含50g可利用的碳水化合物的食物后,在一定时间内(一般为2h)体内血糖水平应答与食用相当量的葡萄糖或白面包引起的血糖应答水平的比值。用公式表示为:gi=含有50g可利用的碳水化合物的餐后血糖应答曲线下面积/50g葡萄糖(或白面包)的餐后血糖应答曲线下面积×100。gi最初的提出,主要用于糖尿病患者对富含淀粉食物的选择上,使膳食血糖指数维持在一定的合理范围内,以达到控制血糖的目的,提供糖尿病患者健康的饮食。
研究表明,血糖主要来源于食物中的糖类,α-葡萄糖苷酶是调节食物来源血糖的关键酶,食物中的碳水化合物经过口腔、胃到达小肠时,被小肠上皮绒毛膜刷状缘上的多种α-葡萄糖苷酶(如蔗糖酶、麦芽糖酶、淀粉葡萄糖苷酶等)分解为单糖,最终被机体吸收利用。目前,临床上多采用药物疗法,如阿卡波糖和伏格列波糖作为α-葡萄糖苷酶抑制剂来控制血糖,但其制备工艺复杂,生产成本高昂且副作用明显。因此,设计筛选安全有效的功能糖来开发降糖营养食品,通过饮食疗法控制血糖成为目前抗糖尿病的热点之一。
关于功能性糖对血糖值的影响国外报道较多,而国内多通过研究植物多糖组分探究其对α-葡萄糖苷酶的抑制作用。目前,有关糖醇对α-葡萄糖苷酶抑制作用的探究鲜见报道,且关于寡糖与糖醇的复配物对α-葡萄糖苷酶抑制作用的研究未见报道。故本研究对部分单糖、寡糖、糖醇及其复配物的α-葡萄糖苷酶抑制活性进行探究,筛选出具有降糖特性的糖及糖醇复配物,并将其运用到糖尿病患者饮食中,如制备糖尿病患者食用的谷物食品、焙烤食品、甜味剂和牛奶等食物,检测其血糖生成指数,以期为降糖食品的开发提供参考,鉴于此提出本发明。
技术实现要素:
本发明的目的在于克服现有技术的不足,提供一种安全且无副作用的抑制α-葡萄糖苷酶的复配糖醇。
为了实现该目的,本发明采用如下技术方案:
一种抑制α-葡萄糖苷酶和降低食物gi值的复配糖醇,由赤藓糖醇、海藻糖和/或异麦芽酮糖醇组成。
所述复配糖醇由赤藓糖醇和海藻糖组成,且所述赤藓糖醇与海藻糖的混合比例按重量比为1∶2~1∶4。
所述复配糖醇由赤藓糖醇和l-阿拉伯糖组成,且所述赤藓糖醇与l-阿拉伯糖的混合比例按重量比为1∶2~1∶4。
所述复配糖醇由赤藓糖醇和棉籽糖组成,且所述赤藓糖醇与棉籽糖的混合比例按重量比为1∶2~1∶4。
所述复配糖醇由赤藓糖醇和水苏糖组成,且所述赤藓糖醇与水苏糖的混合比例按重量比为1∶2~1∶4。
所述复配糖醇由赤藓糖醇和d-木糖组成,且所述赤藓糖醇与d-木糖的混合比例按重量比为1∶2~1∶4。
所述复配糖醇由赤藓糖醇和d-山梨糖醇组成,且所述赤藓糖醇与d-山梨糖醇的混合比例按重量比为1∶2~1∶4。
所述复配糖醇由赤藓糖醇和木糖醇组成,且所述赤藓糖醇与木糖醇的混合比例按重量比为1∶2~1∶4。
所述复配糖醇由赤藓糖醇和麦芽糖醇组成,且所述赤藓糖醇与麦芽糖醇的混合比例按重量比为1∶2~1∶4。
所述复配糖醇包括赤藓糖醇和异麦芽酮糖醇,且所述赤藓糖醇与异麦芽酮糖醇的混合比例按重量比为1∶2~1∶4。
所述复配糖醇包括赤藓糖醇、海藻糖和异麦芽酮糖醇,且所述赤藓糖醇、海藻糖和异麦芽酮糖醇的混合比例按重量比为1∶2∶2~1∶4∶4。
所述赤藓糖醇、海藻糖和异麦芽酮糖醇均可购自商品化产品。
本发明还涉及一种利用上述复配糖醇在制备具有降低食物gi值的食品,如作为食品添加剂应用到面包、馒头等食品中。
在选取本发明的各项糖醇进行复配时,应考虑各自所能发挥的作用以及将它们进行复配时所能产生的联合效果。
采用本发明所述的技术方案后,带来以下有益效果:
本发明的一种抑制α-葡萄糖苷酶和降低食物gi值的复配糖醇,不只依靠赤藓糖醇、海藻糖、异麦芽酮糖醇来控制血糖,在赤藓糖醇、海藻糖、异麦芽酮糖醇的协同作用下达到更佳的抑制α-葡萄糖苷酶的作用。因此可以有效抑制因摄入蔗糖(在小肠蔗糖酶的作用下分解成葡萄糖和果糖而被吸收)而导致的血糖升高,并且本发明所含的糖醇,由于人体肠胃内没有水解这些糖醇的酶系统,它们很难或不被人体消化吸收,因此本发明的复配糖醇本身不能引起人体血糖的升高,对人体几乎没有任何副作用,十分安全。
附图说明
图1:糖及糖醇对α-葡萄糖苷酶分解蔗糖能力的影响;
其中,a:蔗糖+酶;b:l-阿拉伯糖+蔗糖+酶;c:d-木糖+蔗糖+酶;d:海藻糖+蔗糖+酶;e.棉籽糖+蔗糖+酶;f:水苏糖+蔗糖+酶;g:异麦芽酮糖醇+蔗糖+酶;h:山梨糖醇+蔗糖+酶;i:赤藓糖醇+蔗糖+酶;j:麦芽糖醇+蔗糖+酶;k:木糖醇+蔗糖+酶;
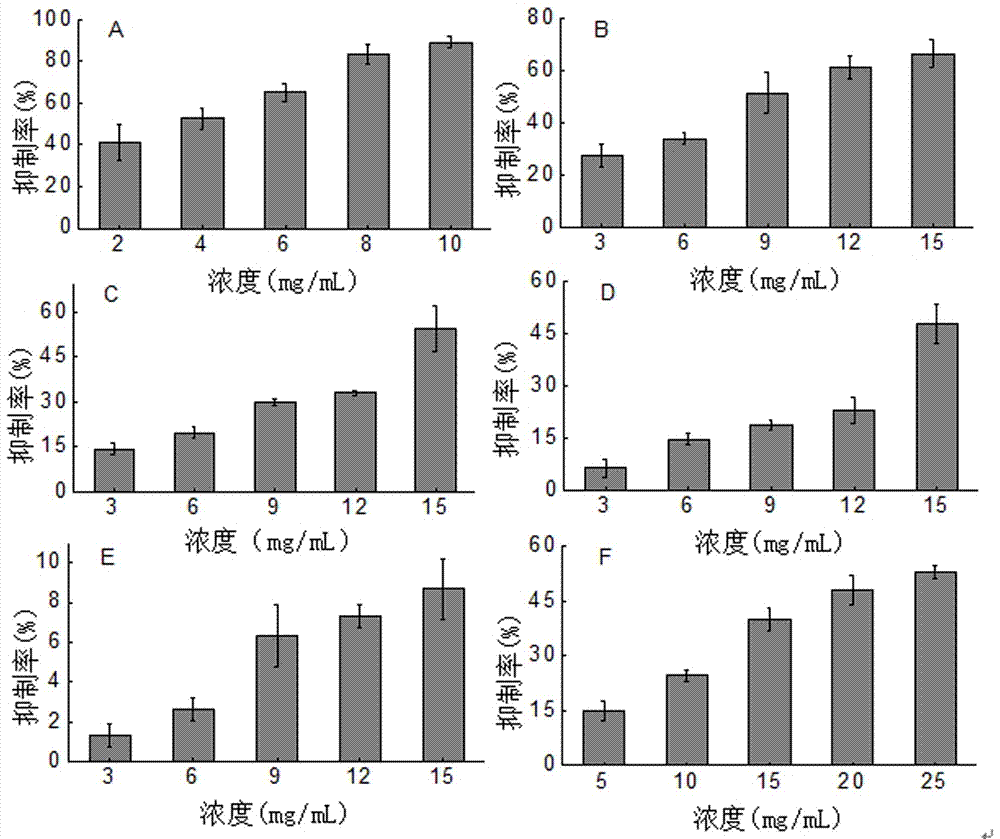
图2:不同浓度下赤藓糖醇(a)、海藻糖(b)、l-阿拉伯糖(c)、d-木糖
(d)、山梨糖醇(e)、异麦芽酮糖醇(f)对α-葡萄糖苷酶的抑制作用;
图3:赤藓糖醇与各种糖及糖醇不同配比对α-葡萄糖苷酶的抑制作用比较;
图4:葡萄糖浓度随消化时间的变化曲线。
具体实施方式
下面对本发明的具体实施方式作进一步详细的描述。
一、复配糖醇对α-葡萄糖苷酶抑制作用研究
(1)材料:
糖醇:麦芽糖醇、异麦芽酮糖醇、赤藓糖醇、木糖醇、山梨糖醇;单糖:d-木糖、l-阿拉伯糖;二糖:海藻糖;三糖:棉籽糖,以上原料均来自上海士丰生物科技有限公司,纯度>98%;四糖:水苏糖,中国食品发酵工业研究院制备,纯度>97%;α-葡萄糖苷酶:50u/mg,上海士丰生物科技有限公司;蔗糖:化学纯;乙腈、甲醇:均为色谱纯或优级纯。
(2)仪器:
lc-20at型高压液相色谱仪(日本岛津公司);rid-10a示差折光检测器(日本岛津公司);gl-20g-ii型高速冷冻离心机(上海安亭科学仪器厂);dk-8d三温三控水槽(上海博迅实业有限公司);kq-250de型数控超声波清洗器(昆山市超声仪器有限公司);分析天平(梅特勒-托利多仪器有限公司)。
(3)样品制备
1.母液的配制:精确称取0.50g蔗糖、赤藓糖醇、异麦芽酮糖醇、麦芽糖醇、木糖醇、d-山梨糖醇、d-木糖、l-阿拉伯糖、海藻糖、棉籽糖、水苏糖样品,用去离子水定容于10ml容量瓶中,制成浓度为50mg/ml的母液,备用。
2.样品溶液的配制:用移液管分别吸取配制好的母液,用去离子水定容至10ml容量瓶中,分别配制浓度为2、4、6、8、10mg/ml的赤藓糖醇溶液,3、6、9、12、15mg/ml的海藻糖溶液、d-木糖溶液、l-阿拉伯糖溶液、山梨糖醇溶液以及浓度为5、10、15、20、25mg/ml的异麦芽酮糖醇溶液。
3.两种复配物溶液的配制:用移液管分别吸取配制好的母液,分别配制赤藓糖醇溶液终浓度为0.5、1.0、1.5、2.0、2.5mg/ml,海藻糖、d-木糖、l-阿拉伯糖、异麦芽酮糖醇以及山梨糖醇样品相应终浓度为1.5、3.0、4.5、6.0、7.5mg/ml的混合溶液。
4.三种复配物溶液的配制:用移液管分别吸取配制好的母液,配制赤藓糖醇、海藻糖及异麦芽酮糖醇三种样品混合液终浓度为2、4、6、8、10mg/ml的混合溶液。
5.α-葡萄糖苷酶溶液的配制:精密称取20.0mgα-葡萄糖苷酶于10ml容量瓶中,用去离子水定容,得到0.1u/μl的α-葡萄糖苷酶溶液。
(4)α-葡萄糖苷酶抑制活性测定:
以α-葡萄糖苷酶为酶源,以蔗糖为底物,试验分组如下,依次加入去离子水、样品溶液、蔗糖溶液混合均匀,于37℃保温10min,结束后,取出,加入37℃酶溶液,充分混匀,于37℃反应40min后,沸水浴灭酶,而后10000rpm离心10min,取上清液过0.45μm微孔滤膜后上高效液相色谱测定。
试验共设定2个组,每组3个平行,分别为:
样品对照组(850μl去离子水+100μl蔗糖溶液+50μl酶液)
样品测定组(750μl去离子水+100μl样品溶液+100μl蔗糖溶液+50μl酶液)
抑制率的计算如以下公式:
式中:c对为样品对照组蔗糖浓度;c测为样品测定组蔗糖浓度;c初为初始蔗糖浓度。
(5)结果
1.糖及糖醇对α-葡萄糖苷酶分解蔗糖能力的影响
由图1可知,l-阿拉伯糖、d-木糖、海藻糖、赤藓糖醇、异麦芽酮糖醇能极显著(p<0.01)抑制α-葡萄糖苷酶的活性,山梨糖醇能显著(p<0.05)抑制α-葡萄糖苷酶的活性,从而使蔗糖分解减少,浓度增加;实验结果表明,糖及糖醇抑制体外α-葡萄糖苷酶活性试验中,海藻糖、赤藓糖醇、l-阿拉伯糖、异麦芽酮糖醇、d-木糖、山梨糖醇均能较好的抑制α-葡萄糖苷酶活性,而其它的糖及糖醇对该酶的抑制活性表现较差。为研究各种糖及糖醇抑制α-葡萄糖苷酶活性强弱,选取上述有酶抑制作用的糖及糖醇,设计浓度梯度,计算相应的酶抑制率,从而得到抑制α-葡萄糖苷酶的最佳糖及糖醇样品。(注:a:蔗糖+酶;b:l-阿拉伯糖+蔗糖+酶;c:d-木糖+蔗糖+酶;d:海藻糖+蔗糖+酶;e:棉籽糖+蔗糖+酶;f:水苏糖+蔗糖+酶;g:异麦芽酮糖醇+蔗糖+酶;h:山梨糖醇+蔗糖+酶;i:赤藓糖醇+蔗糖+酶;j:麦芽糖醇+蔗糖+酶;k:木糖醇+蔗糖+酶)
2.不同浓度的糖及糖醇对α-葡萄糖苷酶的抑制作用
由图2可以看出,赤藓糖醇、海藻糖、d-木糖、l-阿拉伯糖以及异麦芽酮糖醇随着浓度的增加,对酶的抑制率逐渐增强。得到赤藓糖醇、海藻糖、d-木糖、l-阿拉伯糖以及异麦芽酮糖醇的ic50值分别为3.19mg/ml、9.75mg/ml、23.89mg/ml、15.03mg/ml、20.64mg/ml,与其它小分子糖及糖醇比较,赤藓糖醇作用浓度较低且有较好的酶抑制效果,ic50值较小,因此,本试验选用赤藓糖醇与其它糖及糖醇复配。(注:a:赤藓糖醇、b:海藻糖、c:l-阿拉伯糖、d:d-木糖、e:山梨糖醇、f:异麦芽酮糖醇)
3.赤藓糖醇与海藻糖及异麦芽酮糖醇复配后对α-葡萄糖苷酶的抑制作用
由图3可以看出,随着浓度的增加,赤藓糖醇分别与海藻糖、d-木糖、l-阿拉伯糖、异麦芽酮糖醇以及山梨糖醇复配后对酶的抑制率逐渐增强,表现出一定的剂量依赖性,利用calcμsyn软件计算赤藓糖醇分别与海藻糖、异麦芽酮糖醇、d-木糖、l-阿拉伯糖以及山梨糖醇复配后的ci,并比较终浓度分别为2、4、6、8、10mg/ml时赤藓糖醇与其它糖及糖醇的联合作用,试验结果如表1所示:
表1赤藓糖醇与其它糖及糖醇复配后对α-葡萄糖苷酶的联合作用
注:dm代表中效剂量即ic50值
由表1可知,终浓度分别为2、4、6、8、10mg/ml时,赤藓糖醇、海藻糖、异麦芽酮糖醇两两复配后,ci值<1,表现出协同作用,即两者复配后抑制率高于两者单独作用时抑制率之和,然后将赤藓糖醇、海藻糖、异麦芽酮糖醇三种样品复配在一起检测联合作用,ci值<1,即三者复配后抑制率高于三者单独作用时抑制率之和。
综上,赤藓糖醇、海藻糖、异麦芽酮糖醇均能抑制α-葡萄糖苷酶的活性,且赤藓糖醇与海藻糖和/或异麦芽酮糖醇复配后有助于增强对α-葡萄糖苷酶的抑制作用。通过研究糖与糖醇及其复配物的特殊功能,从而为降糖营养食品的开发提供参考,降低食品中糖对特殊人群的影响,对于研究糖尿病的预防和饮食治疗具有重要意义。
二、复配糖醇体外消化过程中降低食物gi值的研究
本发明还涉及一种利用上述复配糖醇在制备具有降低血糖生成指数功能的食品或药品中的用途,如做为食品添加剂应用到面包、馒头等食品中。
本发明通过体外消化实验模拟食物在人体中的消化过程,主要模拟人口腔、胃、肠道的消化过程,一般研究在特定环境(ph和酶液)下对淀粉类物质的降解作用。包含食物在口腔中的咀嚼分解,碳水化合物类物质在唾液淀粉酶的作用下降解过程,糖类物质在胃肠道中的降解过程等。
(1)实验试剂:
α-淀粉酶、胃蛋白酶、α-葡萄糖苷酶和胰酶:美国sigma公司;乙腈、甲醇:色谱纯或优级纯;95%乙醇、磷酸二氢钠、磷酸氢二钠、盐酸、氢氧化钠、瓜尔豆胶:国产分析纯;赤藓糖醇、异麦芽酮糖醇、海藻糖:上海士丰生物科技有限公司,纯度>98%。
溶液的配制:
1)0.1mol/l的磷酸缓冲液(ph6.9):精密称取20.75g磷酸氢二钠和3.12g磷酸二氢钠,用去离子水分别配制成浓度为20.75g/l的磷酸氢二钠溶液和3.12g/l的磷酸二氢钠溶液,将两种溶液互调至ph为6.9。
2)2mol/l的盐酸溶液:移液管移取16.7ml浓盐酸,用去离子水定容至100ml备用。
3)胰酶(40g/l)的配制:4g胰酶粉加入100ml去离子水,在35℃,150rpm中保持20min,然后在1500rpm,离心15min,上清液即为40g/l的胰酶。
4)mgcl2-cacl2溶液:称取1.22gmgcl2和4.41gcacl2溶于100ml去离子水中,配制成mgcl2为0.06mol/l、cacl2为0.3mol/l的溶液。
5)淀粉酶溶液:称取0.05g胰酶溶于20ml去离子水中。
6)葡萄糖标准溶液配制:精确称取0.5g葡萄糖,用去离子水定容于10ml容量瓶中,制成浓度为50mg/ml的母液,用移液管各分别取0.2、0.4、0.6、1、2ml上述母液,用去离子水定容于10ml容量瓶中,配制浓度分别为1、2、3、5、10mg/ml的标准溶液。
试验共设定4个组,每组3个平行,每个平行都含有1g可利用的碳水化合物,分别为:
白面包组
白面包+赤藓糖醇+海藻糖组(两种糖醇复配物含量为10%)
白面包+赤藓糖醇+异麦芽酮糖醇组(两种糖醇复配物含量为10%)
白面包+赤藓糖醇+异麦芽酮糖醇+海藻糖组(三种糖醇复配物含量为10%)
(3)体外消化实验步骤:
第一步,口腔模拟:
将上述含有1g可利用的碳水化合物的各样品组(已粉碎过20目筛网)分别放入烧杯中,加入3mlph6.9的磷酸缓冲液和1ml预先加热到37℃的淀粉酶,用研钵棒轻轻上下敲打15次(保持在37℃的环境中)。
第二步,胃部模拟:
用4mlph6.9的磷酸缓冲液冲洗研钵棒,保证研钵棒上的样品都转移至烧杯中,加入6ml含有0.4g/l的nacl、0.05g胃蛋白酶和0.05g瓜尔豆胶的0.1mol/l磷酸缓冲液,用2mol/lhcl调ph至1.5,放入3~5颗玻璃球,然后放在37℃摇床中保温30min。
第三步,小肠模拟:
将10ml磷酸缓冲液加入到上述溶液中,用50%naoh调节ph为6.9;然后加入125μlmgcl2-cacl2溶液、125μl胰液、400μl淀粉转葡萄糖苷酶和100μl异丙醇,补充蒸馏水至50ml,在37℃摇床中保温180min。不同时间取1ml样品溶液放入含有4ml95%的乙醇溶液中(预热至60℃),自然冷却。
第四步,葡萄糖的测定:
葡萄糖的测定采用高效液相法,测定条件为:hypersil-nh2柱(250mm×4.6mm,5μm),示差检测器,流动相为乙腈∶水=70∶30(v/v),流速:1.0ml/min,柱温:40℃。
(4)计算方法:
按照葡萄糖的生成量,计算碳水化合物的水解率,绘制碳水化合物水解率和时间关系图,模拟方程,计算曲线下面积。
(5)结果
以葡萄糖的标准曲线为基础,对未添加复配糖醇的白面包组和添加复配糖醇的面包测试组体外消化过程中葡萄糖的变化进行检测。如图4所示,随着消化时间的延长,白面包组和糖醇面包组酶解后的葡萄糖浓度都在不断增加。相比白面包组来讲,糖醇面包组葡萄糖浓度增加速度比较缓慢,对血糖浓度影响较小。定义面包的水解率为100,计算样品的水解率,按照gi与hi的关系式:gi=0.862hi+8.189计算样品的gi。经计算得知,白面包组gi值为94.38,白面包+赤+海(赤藓糖醇与海藻糖复配物)组gi值为62.81,白面包+赤+异(赤藓糖醇与异麦芽酮糖醇复配物)组gi值为68.35,白面包+赤+海+异(赤藓糖醇、海藻糖、异麦芽酮糖醇复配物)组gi值为29.82,根据国际食品gi的分类,gi>70为高gi食物,55<gi<70为中gi食物,gi<55的食物为低gi食物,则加入两种糖醇复配物的面包属于中gi食品,加入三种糖醇复配物的面包属于低gi食品。以上结果表明该复配糖醇可以有效抑制因摄入可溶性碳水化合物而导致的血糖升高,并且可以作为食品添加剂添加到富含蔗糖、淀粉等易引起人体血糖升高的食物中,十分适合糖尿病人食用。
以上所述为本发明的实施方式,应当指出,对于本领域的普通技术人员而言,在不脱离本发明原理前提下,还可以做出多种变形和改进,这也应该视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!