一种提高多糖/蛋白复合物乳化稳定性的方法与流程
本发明涉及一种提高多糖/蛋白复合物乳化稳定性方法,具体涉及利用乳化-溶剂挥发法制备多糖/蛋白复合物与脂肪酸的壳核结构复合物微粒。
背景技术:
多糖和蛋白是食品中最常用的乳化剂,是影响乳液物理化学稳定性的重要因素之一。在水包油型乳液中,蛋白质可在油滴表面吸附形成具有一定粘弹性的界面膜,防止乳滴聚集或絮凝导致的乳液分层;而多糖可增加连续相的粘度,通过阻碍乳滴的运动提高乳液稳定性。因此,多糖-蛋白相互作用以赋形和提高其稳定性被广泛应用到食品科学与生物医学中,其形成的非共价静电复合物具有重要的生物学意义,且易于在产品配方中使用,引起了广大的关注。
静电力是蛋白质和多糖相互作用的最主要推动力,在ph值低于蛋白质等电点时,蛋白质带净正电荷,可与阴离子多糖形成复合物。研究表明,蛋白质与多糖在静电作用下结合,使蛋白质界面层得到保护;而多糖的高分子量和高亲水性,使乳滴之间存在空间斥力,防止乳滴的聚结;但蛋白质和多糖的相互作用受到许多因素的影响,如ph、离子强度、混合比例等。如随着蛋白与多糖混合比例的不同,可形成可溶性分子内复合物、可溶性分子间复合物、不溶性分子间复合物等。
现有技术中,对多糖/蛋白复合物的研究较多,如利用明胶和果胶间的静电作用,制备与低热量淀粉颗粒类似尺寸和功能性的水凝胶颗粒;如在益生菌微囊包封技术中,利用多糖-蛋白复合物改善在不同应力下益生菌的活性;如利用大豆分离蛋白/海藻酸钠共聚物制备番茄红素胶束,解决了番茄红素溶解性及稳定性差等问题。多糖/蛋白复合物兼具蛋白质优越的乳化活性和多糖的空间稳定性,有效提高食品乳液的稳定性,但多糖/蛋白分子内复合物对ph敏感,当乳液体系ph变化时,分子内复合物会发生解离、或由凝聚导致的沉淀,从而引起乳液稳定性下降,这也制约了多糖/蛋白分子内复合物的应用。
技术实现要素:
针对现有技术的不足,本发明的目的在于提供一种以多糖/蛋白分子内复合物为乳化剂,采用乳化-溶剂挥发法,制备多糖/蛋白复合物与脂肪酸的壳核结构复合物微粒,解决现有多糖/蛋白复合物ph不稳定的问题。
一种提高多糖/蛋白复合物乳化稳定性的方法,通过乳化-溶剂挥发法制备多糖/蛋白复合物与脂肪酸的壳核结构复合物微粒,提高多糖/蛋白复合物的ph稳定性,所述的乳化-溶剂挥发法包括如下步骤:
(1)称取多糖、蛋白溶于纯水之中,置于滚轴混合器并在室温下混合12h,使其充分溶解混匀,调节ph为4.0-4.4,继续搅拌1h,得多糖/蛋白复合物,所述的多糖和蛋白的质量比为1-2:2-1。
(2)制备100mg/ml的脂肪酸乙醇溶液,搅拌1h;
(3)将步骤(2)的脂肪酸乙醇溶液缓慢逐滴加入高速剪切搅拌的步骤(1)的多糖/蛋白复合物水溶液中,45℃、0.1mpa下旋转蒸发,快速除去乙醇,即得脂肪酸微粒分散液,所述高速剪切的转速为20000rpm/min;
(4)将步骤(3)制得的脂肪酸微粒分散液进行冷冻干燥,即得到多糖/蛋白复合物与脂肪酸的壳核结构复合物微粒,当脂肪酸微粒的终浓度为2%,多糖/蛋白分子内复合物的终浓度为0.1%、0.5%、1%、2%和5%。
优选地,如上所述的一种提高多糖/蛋白复合物乳化稳定性的方法,其步骤(1)所述的多糖为阿拉伯胶、甜菜果胶、大豆多糖中的任一种,优选阿拉伯胶;所述的蛋白为乳清分离蛋白、大豆分离蛋白、酪蛋白中的任一种。。
优选地,如上所述的所述的一种提高多糖/蛋白复合物乳化稳定性的方法,其步骤(2)的脂肪酸为油酸、亚麻酸、共轭亚油酸中的任一种。
与现有技术相比,本发明的优点为:本发明以多糖/蛋白复合物为乳化剂,采用乳化-溶剂挥发法,制备多糖/蛋白复合物与脂肪酸的壳核结构复合物微粒,利用溶剂乙醇的挥发,使脂肪酸微粒界面上的多糖/蛋白分子内复合物发生界面聚集,脂肪酸微粒界面出现塌陷皱缩,界面层变厚,有效提高了多糖/蛋白分子内复合物的ph稳定性,使其具备良好的脂肪酸胃肠输送特性,提高了多糖/蛋白质静电复合物的应用价值。
附图说明
图1在ga/wpi的化学计量比为2,ph=4.4时,不同浓度下ga-wpi的gla颗粒的平均粒径和粒度关系图;由图可知,随着ga/wpi分子内复合物浓度的提高,新鲜cla微粒平均粒径呈现先减小后增大趋势,0.1%ga/wpi分子内复合物的粒径较大,0.5-2%浓度下制备的cla微粒粒径分布接近,平均粒径达到趋于恒定,意味着ga/wpi分子内复合物在cla微粒界面吸附已达到饱和。当浓度增大到5%时,平均粒径呈现增大趋势,cla微粒发生轻微絮凝。这是由于水相中游离的过量乳化剂会导致由排空效应造成的微粒絮凝。
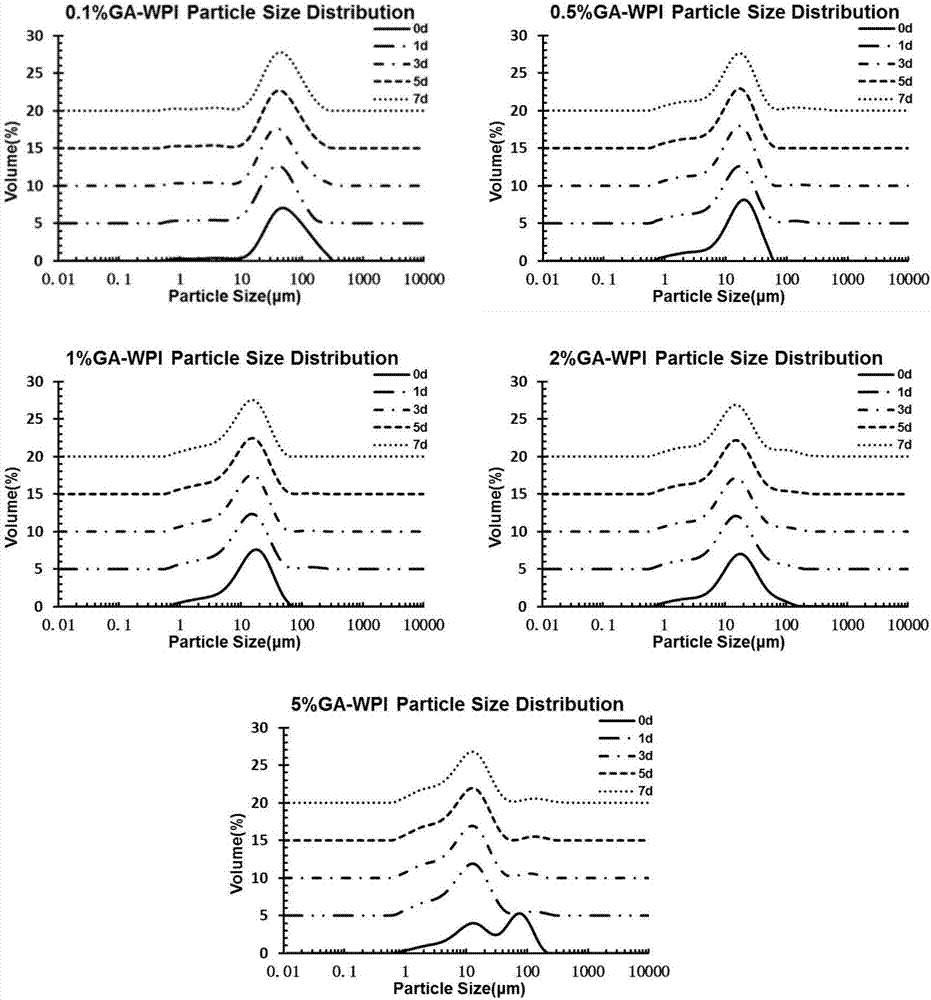
图2为不同浓度ga/wpi分子内复合物制备的gla微粒在40℃下贮存的粒径变化。由图可知,各浓度下的cla微粒在7d贮存期内粒径分布无明显变化,5%ga/wpi分子内复合物制备的cla微粒随着贮存期的延长出现少量的颗粒絮凝,表明cla微粒具有较好的物理稳定性。
图3在2%ga/wpi分子内复合物制备的cla微粒的微观形貌图;由图可知,乳化-溶剂挥发法制备的cla微粒,分布较均匀,颗粒表面皱褶塌陷,具有较厚的界面层。这是由于乳化后进行的溶剂挥发,导致包裹在cla微粒内部的乙醇逸去,使乳化形成的圆形颗粒发生塌陷和界面皱缩。
图4在ga/wpi的化学计量比为2,ph=4.4时,不同浓度下ga-wpi分子内复合物制备的cla微粒的冻干图及复溶粒径分布图;由图可知,当ga/wpi分子内复合物浓度为0.1%时,制备的cla微粒基本无法冻干,出油严重,ga/wpi在界面无法完全包覆cla液滴,导致冻干过程中cla大量溢出;当ga/wpi分子内复合物浓度为0.5%时,cla微粒冻干后出现明显聚结而形成块状;当ga/wpi分子内复合物浓度升高至1%以上,cla微粒冻干后呈现粉末状,以5%ga/wpi分子内复合物制备的cla微粒粉末状最为细腻,贮存分散性最好。将冻干后的cla微粒粉末溶解还原至新鲜制备的分散液浓度,进行粒径分析,发现1%ga/wpi分子内复合物制备的cla微粒粉末复溶后出现部分颗粒聚集,粒径变大,2%和5%的ga/wpi分子内复合物制备的cla微粒粉末复溶后的粒径分布与新鲜制备的相接近,cla微粒粉末复溶效果较好。
图5在2%ga/wpi分子内复合物制备的cla微粒在模拟胃肠道中的粒径变化和cla释放率图。由图可知,乳化-溶剂挥发法制备的cla微粒,由于ga/wpi分子内复合物在界面的聚集,提高了复合物的ph稳定性。cla微粒在模拟胃液中较为稳定,基本保持单峰分布,随着在模拟胃液中时间的延长,出现大颗粒聚集峰,cla的释放率缓慢增加。推测是由于cla微粒界面上的ga/wpi分子内复合物在胃蛋白酶的作用下开始逐渐被酶解,导致cla微粒的界面保护屏障降低,因此cla向体系扩散的速率逐渐增大,在胃液180min时释放率达到36.0%。在模拟肠液中,随着时间延长cla微粒的大颗粒聚集峰增加明显,cla释放率也呈现迅速增大的趋势,在180min时cla的释放率达到约62.2%。与模拟胃液相比,cla在模拟肠液中的释放速率较快。这是由于cla微粒在模拟肠液中出现明显的大颗粒聚集,推测是小肠内的胆盐取代了微粒界面的cla,加速了胰蛋白酶在界面的吸附和微粒界面保护屏障的破坏,相对更易出现微粒间的聚集,导致cla释放率显著增大。
具体实施方式
为能清楚说明本发明方案的技术特点,下面结合具体实施例,对本发明进行阐述。但是本发明的保护范围并不限于这些实施例。凡是不背离本发明构思的改变或等同替代均包括在本发明的保护范围之内。
实施例1
多糖为阿拉伯胶、蛋白为乳清分离蛋白,脂肪酸为共轭亚油酸,具体制备方法如下:
(1)称取阿拉伯胶、蛋白为乳清分离蛋白并溶于纯水之中,二者的质量比为2:1,置于滚轴混合器并在室温下混合12h,使其充分溶解混匀,调节ph为4.4,继续搅拌1h,得多糖/蛋白复合物。
(2)取适量cla于无水乙醇中,制备100mg/ml的cla乙醇溶液,搅拌1h。
(3)将cla乙醇溶液缓慢逐滴加入高速剪切搅拌(20000rpm/min)的ga/wpi水溶液中,45℃、0.1mpa下旋转蒸发,快速除去乙醇,即得wpi/ga复合物与共轭亚油酸的壳核结构复合物微粒的分散液,将新鲜制备的样品进行冷冻干燥,可得到粉末状wpi/ga复合物与共轭亚油酸的壳核结构复合物微粒。其中,以共轭亚油酸(cla)乳液总质量100%计,共轭亚油酸的终浓度为2%,wpi/ga分子内复合物的终浓度为1%,其余为水。
实施例2
多糖为阿拉伯胶、蛋白为乳清分离蛋白,脂肪酸为共轭亚油酸,具体制备方法如下:
(1)称取阿拉伯胶、蛋白为乳清分离蛋白并溶于纯水之中,二者的质量比为2:1,置于滚轴混合器并在室温下混合12h,使其充分溶解混匀,调节ph为4.4,继续搅拌1h,得多糖/蛋白复合物。
(2)取适量cla于无水乙醇中,制备100mg/ml的cla乙醇溶液,搅拌1h。
(3)将cla乙醇溶液缓慢逐滴加入高速剪切搅拌(20000rpm/min)的ga/wpi水溶液中,45℃、0.1mpa下旋转蒸发,快速除去乙醇,即得wpi/ga复合物与共轭亚油酸的壳核结构复合物微粒的分散液,将新鲜制备的样品进行冷冻干燥,可得到粉末状wpi/ga复合物与共轭亚油酸的壳核结构复合物微粒。其中,以共轭亚油酸(cla)乳液总质量100%计,共轭亚油酸的终浓度为2%,wpi/ga分子内复合物的终浓度为5%,其余为水。
实施例3
多糖为阿拉伯胶、蛋白为乳清分离蛋白,脂肪酸为共轭亚油酸,具体制备方法如下:
(1)称取阿拉伯胶、蛋白为乳清分离蛋白并溶于纯水之中,二者的质量比为2:1,置于滚轴混合器并在室温下混合12h,使其充分溶解混匀,调节ph为4.4,继续搅拌1h,得多糖/蛋白复合物。
(2)取适量cla于无水乙醇中,制备100mg/ml的cla乙醇溶液,搅拌1h。
(3)将cla乙醇溶液缓慢逐滴加入高速剪切搅拌(20000rpm/min)的ga/wpi水溶液中,45℃、0.1mpa下旋转蒸发,快速除去乙醇,即得wpi/ga复合物与共轭亚油酸的壳核结构复合物微粒的分散液,将新鲜制备的样品进行冷冻干燥,可得到粉末状wpi/ga复合物与共轭亚油酸的壳核结构复合物微粒。其中,以共轭亚油酸(cla)乳液总质量100%计,共轭亚油酸的终浓度为2%,wpi/ga分子内复合物的终浓度为3%,其余为水。
实施例4
多糖为阿拉伯胶、蛋白为乳清分离蛋白,脂肪酸为共轭亚油酸,具体制备方法如下:
(1)称取阿拉伯胶、蛋白为乳清分离蛋白并溶于纯水之中,二者的质量比为2:1,置于滚轴混合器并在室温下混合12h,使其充分溶解混匀,调节ph为4.4,继续搅拌1h,得多糖/蛋白复合物。
(2)取适量cla于无水乙醇中,制备100mg/ml的cla乙醇溶液,搅拌1h。
(3)将cla乙醇溶液缓慢逐滴加入高速剪切搅拌(20000rpm/min)的ga/wpi水溶液中,45℃、0.1mpa下旋转蒸发,快速除去乙醇,即得wpi/ga复合物与共轭亚油酸的壳核结构复合物微粒的分散液,将新鲜制备的样品进行冷冻干燥,可得到粉末状wpi/ga复合物与共轭亚油酸的壳核结构复合物微粒。其中,以共轭亚油酸(cla)乳液总质量100%计,共轭亚油酸的终浓度为2%,wpi/ga分子内复合物的终浓度为1%,其余为水。
实施例5
多糖为阿拉伯胶、蛋白为乳清分离蛋白,脂肪酸为共轭亚油酸,具体制备方法如下:
(1)称取阿拉伯胶、蛋白为乳清分离蛋白并溶于纯水之中,二者的质量比为2:1,置于滚轴混合器并在室温下混合12h,使其充分溶解混匀,调节ph为4.4,继续搅拌1h,得多糖/蛋白复合物。
(2)取适量cla于无水乙醇中,制备100mg/ml的cla乙醇溶液,搅拌1h。
(3)将cla乙醇溶液缓慢逐滴加入高速剪切搅拌(20000rpm/min)的ga/wpi水溶液中,45℃、0.1mpa下旋转蒸发,快速除去乙醇,即得多糖/蛋白复合物与共轭亚油酸的壳核结构复合物微粒的分散液,将新鲜制备的样品进行冷冻干燥,可得到粉末状多糖/蛋白复合物与共轭亚油酸的壳核结构复合物微粒。其中,以共轭亚油酸(cla)乳液总质量100%计,共轭亚油酸的终浓度为2%,wpi/ga分子内复合物的终浓度为0.5%,其余为水。
实施例6
多糖为甜菜果胶、蛋白为大豆分离蛋白,脂肪酸为亚麻酸,具体制备方法如下:
(1)称取甜菜果胶、蛋白为大豆分离蛋白并溶于纯水之中,二者的质量比为1:2,置于滚轴混合器并在室温下混合12h,使其充分溶解混匀,调节ph为4.2,继续搅拌1h,得多糖/蛋白复合物。
(2)取适量亚麻酸于无水乙醇中,制备100mg/ml的cla乙醇溶液,搅拌1h。
(3)将亚麻酸乙醇溶液缓慢逐滴加入高速剪切搅拌(20000rpm/min)的甜菜果胶/大豆分离蛋白水溶液中,45℃、0.1mpa下旋转蒸发,快速除去乙醇,即得甜菜果胶/大豆分离蛋白复合物与亚麻酸的壳核结构复合物微粒的分散液,将新鲜制备的样品进行冷冻干燥,可得到粉末状甜菜果胶/大豆分离蛋白复合物与亚麻酸的壳核结构复合物微粒。其中,以亚麻酸乳液总质量100%计,亚麻酸的终浓度为2%,甜菜果胶/大豆分离蛋白分子内复合物的终浓度为1.0%,其余为水。
实施例7
多糖为大豆多糖、蛋白为酪蛋白,脂肪酸为油酸,具体制备方法如下:
(1)称取大豆多糖、蛋白为酪蛋白并溶于纯水之中,二者的质量比为1:1,置于滚轴混合器并在室温下混合12h,使其充分溶解混匀,调节ph为4.2,继续搅拌1h,得多糖/蛋白复合物。
(2)取适量油酸于无水乙醇中,制备100mg/ml的cla乙醇溶液,搅拌1h。
(3)将油酸乙醇溶液缓慢逐滴加入高速剪切搅拌(20000rpm/min)的大豆多糖/酪蛋白水溶液中,45℃、0.1mpa下旋转蒸发,快速除去乙醇,即得大豆多糖/酪蛋白复合物与油酸的壳核结构复合物微粒的分散液,将新鲜制备的样品进行冷冻干燥,可得到粉末状大豆多糖/酪蛋白复合物与油酸的壳核结构复合物微粒。其中,以油酸乳液总质量100%计,油酸的终浓度为2%,大豆多糖/酪蛋白分子内复合物的终浓度为2.0%,其余为水。
实施例8
多糖为大豆多糖、蛋白为大豆分离蛋白,脂肪酸为共轭亚油酸,具体制备方法如下:
(1)称取大豆多糖、蛋白为大豆分离蛋白并溶于纯水之中,二者的质量比为2:1,置于滚轴混合器并在室温下混合12h,使其充分溶解混匀,调节ph为4.0,继续搅拌1h,得多糖/蛋白复合物。
(2)取适量共轭亚油酸于无水乙醇中,制备100mg/ml的cla乙醇溶液,搅拌1h。
(3)将共轭亚油酸乙醇溶液缓慢逐滴加入高速剪切搅拌(20000rpm/min)的大豆多糖/大豆分离蛋白水溶液中,45℃、0.1mpa下旋转蒸发,快速除去乙醇,即得大豆多糖/大豆分离蛋白复合物与共轭亚油酸的壳核结构复合物微粒的分散液,将新鲜制备的样品进行冷冻干燥,可得到粉末状大豆多糖/大豆分离蛋白与共轭亚油酸的壳核结构复合物微粒。其中,以共轭亚油酸乳液总质量100%计,共轭亚油酸的终浓度为2%,大豆多糖/大豆分离蛋白分子内复合物的终浓度为5.0%,其余为水。
实施例9
多糖为甜菜果胶、蛋白为乳清分离蛋白,脂肪酸为油酸,具体制备方法如下:
(1)称取甜菜果胶、蛋白为乳清分离蛋白并溶于纯水之中,二者的质量比为2:1,置于滚轴混合器并在室温下混合12h,使其充分溶解混匀,调节ph为4.4,继续搅拌1h,得多糖/蛋白复合物。
(2)取适量油酸于无水乙醇中,制备100mg/ml的cla乙醇溶液,搅拌1h。
(3)将油酸乙醇溶液缓慢逐滴加入高速剪切搅拌(20000rpm/min)的甜菜果胶/乳清分离蛋白水溶液中,45℃、0.1mpa下旋转蒸发,快速除去乙醇,即得甜菜果胶/乳清分离蛋白复合物与油酸的壳核结构复合物微粒的分散液,将新鲜制备的样品进行冷冻干燥,可得到粉末状甜菜果胶/乳清分离蛋白与油酸的壳核结构复合物微粒。其中,以油酸乳液总质量100%计,油酸的终浓度为2%,甜菜果胶/乳清分离蛋白分子内复合物的终浓度为0.5%,其余为水。
对比实施例1
多糖为阿拉伯胶、蛋白为乳清分离蛋白,脂肪酸为共轭亚油酸,具体制备方法如下:
(1)ga和wpi质量比为2:1,ph为4.4,搅拌1h,形成稳定的wpi/ga可溶性分子内复合物。
(2)取适量cla于无水乙醇中,制备100mg/ml的cla乙醇溶液,搅拌1h。
(3)将cla乙醇溶液缓慢逐滴加入高速剪切搅拌(20000rpm/min)的ga/wpi水溶液中。45℃、0.1mpa下旋转蒸发,快速除去乙醇,即得cla微粒分散液,将新鲜制备的样品进行冷冻干燥。其中,以共轭亚油酸(cla)乳液总质量100%计,共轭亚油酸的终浓度为2%,wpi/ga分子内复合物的终浓度为0.1%,其余为水。
对比实施例2
多糖为阿拉伯胶、蛋白为乳清分离蛋白,脂肪酸为共轭亚油酸,具体制备方法如下:
(1)ga和wpi质量比为2:1,ph为4.4,搅拌1h,形成稳定的wpi/ga可溶性分子内复合物。
(2)将cla缓慢逐滴加入高速剪切搅拌(20000rpm/min)的ga/wpi水溶液中,即得cla微粒分散液,将新鲜制备的样品进行冷冻干燥。其中,以cla乳液总质量100%计,共轭亚油酸的终浓度为2%,wpi/ga分子内复合物的终浓度为5%,其余为水。
对比实施例3
(1)ga和wpi质量比为2:1,ph为4.4,搅拌1h,形成稳定的wpi/ga可溶性分子内复合物。
(2)取适量cla于无水乙醇中,制备100mg/ml的cla乙醇溶液,搅拌1h。
(3)将cla乙醇溶液缓慢逐滴加入高速剪切搅拌(20000rpm/min)的ga/wpi水溶液中,即得cla微粒分散液,将新鲜制备的样品进行冷冻干燥。其中,以共轭亚油酸(cla)乳液总质量100%计,共轭亚油酸的终浓度为2%,wpi/ga分子内复合物的终浓度为2%,乙醇含量为18%,其余为水。
乳液1-9及比较乳液1-3的各项性能数据见表1,本发明采用的检测方法:
(1)测定cla微粒的粒径测定:
采用mastersizer2000型激光粒度仪测定不同浓度的ga微粒的粒径尺寸分布。将乳液轻微振荡摇匀,逐滴加至分散剂中,通过hydro2000mu型湿法进样器进样。用超纯水做分散剂,分散相和连续相的折光率分别是1.52和1.33,样品的吸收率是0.01,泵速为2000rpm。添加样品至激光指数略大于10%,即可开始测定。乳液的平均粒径用表面积加权平均值d[3,2]表示,按下式计算:
d[3,2]=(σnidi3/σnidi2),
其中ni表示粒径大小为di的颗粒数目。
(2)cla微粒的物理稳定性评价:
将制备得到的新鲜cla微粒分散液置于40oc恒温培养箱中,放置0d、3d、5d、7d后进行乳液粒径测定。
(3)cla微粒微观形貌观察:
取极少量cla微粒粉末于扫描电镜样品台上,喷金,置于扫描电镜jsm-6390lv下观察,拍照记录。
(4)cla微粒在模拟胃肠环境下的释放率测定:
取1.0mlcla微粒混悬液置于37℃预温的29.0ml模拟胃液(2mg/mlnacl、3.2mg/ml胃蛋白酶、hcl调ph至2.0)中,37℃恒温水浴,搅拌速度为100rpm,消化3h,期间每30min调一次ph值使其稳定于2.0,分别于30、60、90、120、150、180min取样品测定cla的释放率。取1.0ml用于测定粒径,1.0ml加等量正己烷萃取,并定容至10.0ml,测定234nm处的吸光值,并计算含量。胃消化阶段结束后,用1mol/lnaoh调ph值至7.0,转移至30ml模拟肠液(8mg/mlnacl,40mg/mlcacl2,5mg/ml胆盐,10mg/ml胰蛋白酶)中,继续37oc恒温水浴,搅拌速度为100rpm,消化3h,期间每30min调一次ph值使其稳定于7.0,分别于30、60、90、120、150、180min取样品测定cla的释放率。取1.0ml用于测定粒径,1.0ml加等量正己烷萃取,并定容至10.0ml,测定234nm处的吸光值,并计算含量。
表1乳液1-9及比较乳液1-3的粒径和冻干性能
- 还没有人留言评论。精彩留言会获得点赞!