猪胎盘冻干粉的制备方法及其促免疫用途与流程
本发明属于食品加工
技术领域:
,具体涉及一种猪胎盘冻干粉的制备方法及其促免疫用途。
背景技术:
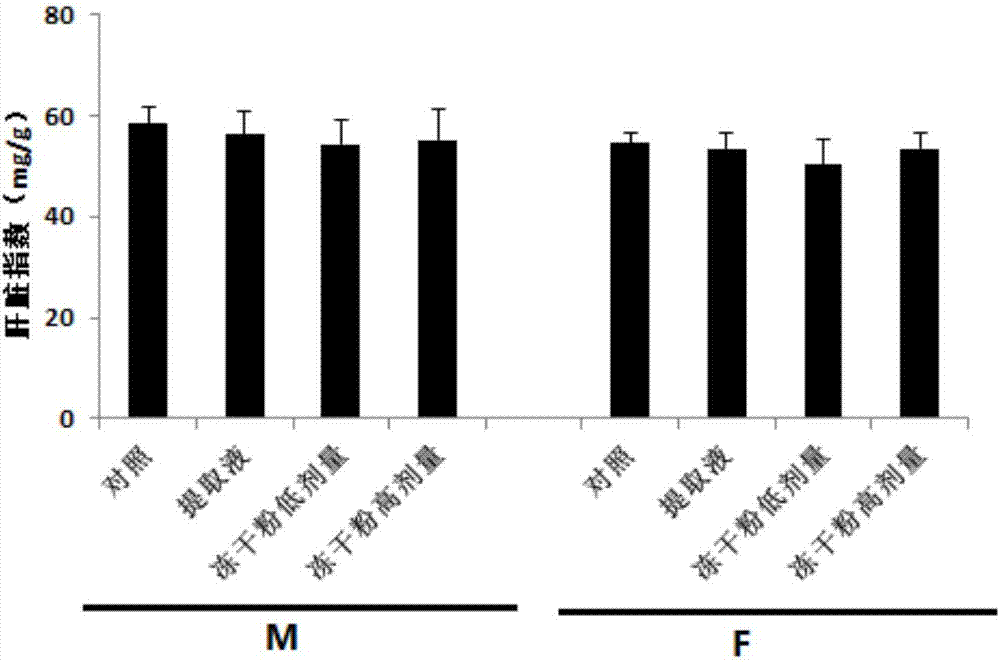
:祖国医学中称人胎盘为紫河车,它具有增强体质,益气养血之效。现代生物医药研究表明,人胎盘中含有丰富的铁、锌、锰等微量元素和18种常见氨基酸、磷脂、多糖,以及多种抗体、干扰素、催乳素、促性腺激素等生物活性物质,是一种较为理想的免疫调节剂和营养美容保健品。目前,临床上已有由紫河车、刺五加、麦芽、陈皮等中药经过现代技术及科学方法提取其有效成分精制而成的胎盘粉制剂,用于虚劳消瘦、咳嗽气喘、肝炎、小儿营养发育不良以及病后体虚等疾病的治疗,且疗效显著。然而,人胎盘获取的有限性及伦理学等问题严重阻碍了人们对人胎盘的开发和应用。于是,人们将目光集中在动物胎盘上。已有研究表明,牛胎盘粉盐酸水解液除蛋氨酸含量低于人的外,总氨基酸含量和缬氨酸、蛋氨酸、亮氨酸、苯丙氨酸、赖氨酸等含量均高于人胎盘,因此,牛胎盘粉在氨基酸品质方面完全可以代替人胎盘粉。猪、牛、羊等动物胎盘不仅具有与人胎盘结构相似的细胞组织,其生物学功能也相似,其中猪胎盘因来源广泛、成本低廉,具有更为重要的研究价值和广阔的市场前景。有研究表明,将洗净切碎的新鲜胎盘以5%~8%的比例拌入切碎的鱼、虾或畜禽下脚料投喂;或将洗净的新鲜胎盘烘干,粉碎,按3%~4%的比例与切碎的其他动物性饲料拌和均匀,装入医用胶囊,密封后投入龟池.任其飘浮,让龟自行采食后,青、成年龟的增重率比对照组提高1l5%,亲龟繁殖期加喂胎盘和雌龟产卵量比对照组提高17.3%,孵化成活率比对照组提高14.6%,由此可见,直接干燥粉碎的猪胎盘可以增强动物的生长性能和繁殖性能,但对免疫性能没有报道。冷冻干燥是快速冻结、真空冰状脱水的一种食物特殊加工方法,可以最大限度地保持原新鲜食品的色香味及营养成分、物料外观等,无须防腐剂就可在常温下保存5年以上,且成品重量轻,便于携带、运输和加工。现有技术还未曾有冷冻干燥的猪胎盘对动物免疫功能的影响相关报道。技术实现要素:本发明要解决的技术问题为:现有方法制备的猪胎盘粉活性成分损失大,利用率低等问题。本发明解决技术问题的技术方案为:提供一种猪胎盘冻干粉的制备方法。该方法包括以下步骤:a、取-50℃~-30℃下冷冻的猪胎盘,于4~10℃下解冻,解冻后洗净表面血水;b、将步骤a得到的猪胎盘经组织捣碎机粉碎后,倒入冷冻干燥盘,进行第一次冷冻干燥,先于-50℃~-40℃预冻1.5~2.5h,转入升华温度为-40℃~-35℃的条件下冷冻干燥14~16h,之后转入10~15℃干燥3~5h,再于25~30℃干燥3~5h;c、待步骤b完成后,将冷冻干燥盘中的猪胎盘完整翻面,进行第二次冷冻干燥,先于-50℃~-40℃预冻0.5~1.5h;转入升华温度为-40℃~-35℃的条件下冷冻干燥6~10h,之后转入10~15℃干燥3~5h,再于25~30℃干燥3~5h;d、将步骤c中干燥后的猪胎盘装入铝箔袋,抽真空,于0~10℃保存待用。其中,上述猪胎盘冻干粉的制备方法中,步骤b中冷冻干燥盘中的猪胎盘厚度为3~7cm。其中,上述猪胎盘冻干粉的制备方法中,步骤b中所述的粉碎时组织捣碎机的转速为800~1200r/min,粉碎时间为25~45s。其中,上述猪胎盘冻干粉的制备方法中,步骤b中所述的第一次冷冻干燥具体操作为:-45℃预冻2h,转入升华温度为-38℃条件下冷冻干燥15h,之后转入10℃干燥4h,再于30℃干燥4h。其中,上述猪胎盘冻干粉的制备方法中,步骤c中所述的第二次冷冻干燥具体操作为:-45℃预冻1h;转入升华温度为-38℃条件下冷冻干燥8h,之后转入10℃干燥4h,再于30℃干燥4h。本发明还提供一种采用本发明的制备方法得到的猪胎盘冻干粉的用途,用于制备提高免疫力的免疫增强制剂。其中,上述制备方法得到的猪胎盘冻干粉的用途中,所述免疫增强制剂包括散剂、颗粒剂、胶囊剂或片剂。其中,上述制备方法得到的猪胎盘冻干粉的用途中,所述提高免疫力包括提高腹腔巨噬细胞吞噬活性和外周血t淋巴母细胞转化率。本发明的有益效果为:本发明提供一种猪胎盘冻干粉的制备方法,该方法操作简单,可最大限度地保持猪胎盘中的营养成分,制备的猪胎盘冻干粉铅、砷、汞等重金属含量在国标gb2762-2012要求范围内,且钙、磷含量比猪胎盘鲜重提高了近十倍。并且,本发明制备得到的猪胎盘冻干粉有效的保持了猪胎盘中促进免疫力的有效成分,猪胎盘冻干粉具有促免疫的功效,成品重量轻,便于携带、运输和加工,具有重要的经济效益。说明书附图图1所示为猪胎盘灌胃给药对小鼠免疫器官指数的影响,a图为脾脏指数;b图为胸腺指数;图2所示为猪胎盘灌胃给药对小鼠肝脏指数的影响,以肝脏重量(mg)与体重(g)之比作肝脏指数,(指数单位mg/g);图3所示为鼠腹腔细胞悬液涂片(10×100目);图4所示为猪胎盘灌胃给药对小鼠腹腔巨噬细胞吞噬百分率的影响,油镜下计数,每片计100个巨噬细胞,计算吞噬率。吞噬率(%)=吞噬红细胞的巨噬细胞数/100个巨噬细胞×100;图5所示为小鼠t淋巴细胞转化,a图为未转化淋巴细胞;b图为转化淋巴细胞;图6所示为猪胎盘灌胃给药对小鼠t淋巴细胞转化率的影响,在油镜下检查细胞涂片的头、体、尾三部分,并记录转化、未转化的淋巴细胞数。转化率%=转化的淋巴细胞数/(转化的淋巴细胞数+未转化的淋巴细胞数)×100。具体实施方式下面通过实施例对本发明的具体实施方式做进一步的解释说明,但不表示将本发明的保护范围限制在实施例所述范围内。实施例用本发明方法制备猪胎盘冻干粉制备方法如下:a、取新鲜猪胎盘,于-40℃下冷冻,制备时置于4℃下完全解冻后,洗净表面血水;b、将洗净后的猪胎盘采用高速组织捣碎机粉碎30s后,倒入冷冻干燥盘,将胎盘平铺至厚度为5cm,进行第一次冷冻干燥:置于-45℃预冻2h,升华温度为-38℃冷冻干燥15h,10℃干燥4h,再于30℃干燥4h;c、待步骤b完成后,将冷冻干燥盘中的猪胎盘翻面,进行第二次冷冻干燥:-45℃预冻1h;升华温度为-38℃冷冻干燥8h,10℃干燥4h,再于30℃干燥4h;d、将步骤c中干燥后的猪胎盘装入铝箔袋,抽真空,于4℃保存待用。所述粉碎采用浙江荣浩工贸有限公司生产的rh-600a型粉碎机进行;所述的冷冻干燥采用北京松源华兴科技发展有限公司生产的lgj-30f冷冻干燥机;所述的抽真空采用上海凯鸣电子机械有限公司生产的dz-400真空包装机进行。取实施例制备得到的猪胎盘冻干粉,测定其中矿物质含量,得到如下表1所示的实验结果。其中,铅含量采用石墨炉原子吸收法测定,砷含量采用icp-ms法测定,汞含量采用原子荧光法测定,钙含量采用火焰原子吸收法测定,磷含量采用icp-oes法进行测定。表1采用本发明方法制备的猪胎盘冻干粉成分微量元素鲜样冻干样gb2762-2012要求铅(mg/kg)0.02±0.000.115±0.060.2总砷(mg/kg)-0.047±0.030.5总汞(mg/kg)-0.011±0.000.05钙(mg/100g)30.53±47453±77.95/磷(mg/kg)537.52±96.656430.94±871.66/由表1可知,采用本发明方法制备的冻干粉,铅、砷、汞含量都在标准规定的范围内,钙、磷含量显著提高。本发明制备的猪胎盘冻干粉对小鼠免疫功能的影响取110只昆明小鼠,按照空白对照组20只、阳性对照组30只、高剂量实验组30只和低剂量实验组30只,分成四组,每组中雄鼠(m)和雌鼠(f)各占一半。所述空白对照组为饲喂基础饲粮+饮水+0.1ml生理盐水,阳性对照组为饲喂基础饲粮+饮水+0.1ml猪胎盘提取液,高剂量组为饲喂基础饲粮+饮水+0.3ml猪胎盘冻干粉悬液,低剂量组为饲喂基础饲粮+饮水+0.1ml猪胎盘冻干粉悬液。所述的生理盐水、猪胎盘提取液、冻干粉悬液均采用灌胃的方式处理小鼠,每天定时灌胃一次。其中,猪胎盘提取液的制备方法如下:收集的新鲜猪胎盘,用无菌pbs反复冲洗去除残留淤血,并减去筋、膜等组织。再将胎盘尽可能的剪碎,加入适量pbs后放入组织匀浆机,充分匀浆组织,3min/次,进行6-8次。再将获得的组织匀浆于-80℃冻存20min后,马上置入42℃水浴20min,每5min摇匀1次,反复此过程4次后,再进行8000r/min、离心10min,之后收集上清液保存于-20℃、备用。注意:每次使用前需用0.22μm微孔过滤器过滤灭菌,得到猪胎盘提取液。所述猪胎盘冻干粉悬液是指采用实施例制备得到的猪胎盘冻干粉溶于生理盐水中,配成浓度为2mg/ml的猪胎盘冻干粉悬液。观察并记录小鼠在实验期间的进食、饮水,行为等变化;实验初始,对每只小鼠进行标记并称取、记录小鼠的初始体重;实验过程中,每隔6天再次称取、记录每只小鼠的体重;末次灌胃后,处死小白鼠,取出小鼠的胸腺、脾脏等免疫器官,称量并计算其胸腺、脾脏及肝脏指数;观察并计算小鼠腹腔巨噬细胞的吞噬率;以及淋巴细胞转化率;实验数据以平均数±标准差(x±s)表示,各组之间的差异显著性采用t检验,以p<0.05表示差异有统计学意义。实验结果如下所示:(1)小鼠行为整个实验期间,实验小鼠的采食、饮水情况无异常,精神良好,行为反应敏捷,毛发有光泽,呼吸正常。(2)脾脏和胸腺指数:所有高剂量组脾脏指数显著提升(p<0.05),但其胸腺指数变化不明显(p>0.05),低剂量组脾脏指数和胸腺指数均无显著提升(p<0.05),雄鼠(m)和雌鼠(f)趋势相同,如图1。(3)肝脏指数:各组肝脏指数无显著差异(p>0.05),雄鼠(m)和雌鼠(f)趋势相同,图2,说明灌胃冻干粉不会增加小鼠肝脏负担。(4)腹腔巨噬细胞吞噬实验:取鸡翼下的静脉血,按体积比1:1的量与alsever液混合,制备鸡红细胞悬液,于4℃保存待用。临用前,用生理盐水洗涤两次后,稀释至20%。连续灌胃35天后,每只小鼠腹腔注射1ml鸡红细胞悬液,轻揉小鼠腹部30min,用颈椎脱臼法处死小鼠。再取2ml灭菌生理盐水注入小鼠腹腔,混合均匀后吸取其腹腔洗液1ml,滴于载玻片上,制备细胞涂片。瑞氏染液染色后,在油镜下计数,每片计100个巨噬细胞,计算吞噬率。公式如下:吞噬率(%)=吞噬红细胞的巨噬细胞数/100个巨噬细胞×100。将小鼠腹腔巨噬细胞涂片,染色,进行显微拍照。在显微镜下,可清楚分辨出鸡红细胞(crbc)、巨噬细胞以及吞噬多个鸡红细胞的巨噬细胞,见图3。每片计100个巨噬细胞,计算吞噬率,结果图4所示,冻干粉及提取液组灌胃35天,均显著提高其腹腔巨噬细胞的吞噬活性(p<0.05),其中雄性组以及雌性冻干粉高剂量组差异极显著(p<0.01)。(5)淋巴细胞转化实验:连续灌胃35天后,将0.3mgcona注射于每只小鼠的腹腔,再继续饲养72h后,取尾尖血于装有3%柠檬酸钠的试管中,混匀。再取1滴于载玻片上,均匀涂开,制备细胞涂片,瑞氏染液染色后,在油镜下检查细胞涂片的头、体、尾三部分。并记录转化、未转化的淋巴细胞数,计算淋巴细胞转化率。公式如下:转化率%=转化的淋巴细胞数/(转化的淋巴细胞数+未转化的淋巴细胞数)×100。小鼠t淋巴细胞转化水平检测:细胞涂片经瑞氏染液染色后,在油镜下进行显微拍照,明显可见转化后的淋巴细胞,如图5所示。每张血细胞涂片检查涂片头、体、尾三部分,记录转化和未转化淋巴细胞数,结果如图6所示,由cona诱导的小鼠外周血t淋巴母细胞转化率均显著提高(p<0.05),其中雄性组差异极显著(p<0.01)。由实施例可知,将本发明方法制备得到的猪胎盘冻干粉连续灌胃给药小鼠35天后,能够显著提升高剂量组小鼠脾脏指数,以及腹腔巨噬细胞吞噬活性及外周血t淋巴母细胞转化率,能够提高小鼠免疫功能。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1