一种提高鱼类肌原纤维蛋白凝胶特性的方法与流程
本发明涉及食品加工技术领域,特别涉及一种提高鱼类肌原纤维蛋白凝胶强度的方法。
背景技术:
鱼类肌原纤维蛋白是鱼肉的主要组分,该蛋白具有凝胶特性,可用于开发各类鱼肠、鱼丸、鱼松糕、鱼布丁、鱼肉浓汤等食品,营养丰富、风味鲜美,受消费者的喜爱,具有良好的市场前景。然而,不少鱼类肌原纤维蛋白的凝胶性能较弱,不能满足加工中质构形态的需求。为了提升鱼类肌原纤维蛋白(mfp)的凝胶特性,添加淀粉、胶体、大豆蛋白、乳清蛋白等非鱼肉蛋白成分,导致其制品的蛋白含量下降,营养价值降低,风味弱化,并引入一定致敏风险,使鱼类肌原纤维蛋白食品走向低端。
没食子酸是具有酚羟基结构的酚类物质,广泛存在于果蔬等植物中,是食品加工中常用的抗氧化剂和保鲜剂。本发明采用超声协同没食子酸技术改变鱼类肌原纤维蛋白特性,进而促进多酚与肌原纤维蛋白相互作用,提升鱼类肌原纤维蛋白的凝胶特性,为开发鱼肉蛋白食品提供新方法。
技术实现要素:
本发明的目的在于开发一种高效率、高营养、低能耗、低成本、的没食子酸和超声协同作用的鱼类肌原纤维蛋白凝胶增强方法,有效提高鱼蛋白制品的凝胶强度。
为了达到上述目的,本发明提供一种提高鱼类肌原纤维蛋白凝胶特性的方法,具体步骤为:
s1、制备鱼肌原纤维蛋白溶液:原料鱼取肉,制备鱼肌原纤维蛋白溶液,于4℃备用;
s2、制备蛋白多酚混合液:取没食子酸溶液和步骤s1所得鱼肌原纤维蛋白溶液,在4~6℃混合均匀,得蛋白多酚混合液;
其中,所述没食子酸的添加量为肌原纤维蛋白总量的0.05~3.00‰;根据没食子酸所需添加量计算没食子酸溶液的取用体积;所述鱼肉肌原纤维蛋白溶液中肌原纤维蛋白的含量采用双缩脲比色法测定;没食子酸与肌原纤维蛋白溶液在4℃冷室下混合均匀;
s3、超声处理:取步骤s2所述蛋白多酚混合液,在4℃~6对所述蛋白多酚混合液进行超声处理,超声功率为200~400w、超声时间为2.5~5min,得超声后蛋白多酚复合体系;
s4、熟化:将步骤s3所述超声后蛋白多酚复合体系进行加热、冷却,得凝胶强度增强的肌原纤维蛋白凝胶。
可采用流变仪进行升温过程的弹性模量测定,间接考察肌原纤维蛋白凝胶的凝胶特性;流变仪升温范围为20~80℃。
优选方式下,步骤s1所述鱼类为马鲛鱼或草鱼,也可选取其他鱼类;所述肌原纤维蛋白溶液中肌原纤维蛋白的浓度为40mg/ml,所述肌原纤维蛋白含量依照《双缩脲比色法》进行测定;所述制备肌原纤维蛋白溶液的方法为:4℃环境下,取20g鱼肉,加入40ml0.1mol/ltris-nacl溶液,1100rpm转速匀浆1min,10000g离心10min,去掉上清液,取沉淀a;将所述沉淀a加入40ml0.1mol/ltris-nacl溶液,1100rpm转速匀浆1min,10000g离心10min,去掉上清液,取沉淀b;将沉淀b用50ml0.1mol/ltris-nacl溶液溶解,用普通的脱脂棉纱布过滤,取滤液,用离心机10000g离心10min,去掉上清液,取沉淀c,然后用20ml0.6mol/ltris-nacl溶解所述沉淀c,制备成浓度为40mg/ml的肌原纤维蛋白溶液,该肌原纤维蛋白溶液12h内使用;
优选方式下,步骤s2所述没食子酸溶液的制备方法为:称取一定量的没食子酸,溶于去离子水,使用1mol/l的naoh溶液调节ph8,获得浓度为0.05~0.10g/ml的没食子酸溶液。
优选方式下,步骤s3所述超声处理的超声探头直径为6mm;超声时间模式为超声工作时间2s,间隔时间2s,用于防止超声引起的局部升温,所述间隔时间不计入超声时间;所述超声处理的蛋白多酚混合液体积为100ml,所述超声处理所用容器为直径3cm圆柱形器皿,超声探头置于蛋白多酚混合液中心部位施加超声作用;
优选方式下,步骤s4所述熟化具体为:将超声后蛋白多酚复合体系置于30~50℃加热10~20min,80~100℃加热5~15min,然后置于4~7℃冷却20~30min。
优选方式下,所述提高鱼类肌原纤维蛋白凝胶特性的方法,包括步骤:
s1、制备鱼肌原纤维蛋白溶液:4℃环境下,取20g鱼肉,加入40ml0.1mol/ltris-nacl溶液,1100rpm转速匀浆1min,10000g离心10min,去掉上清液,取沉淀a;将所述沉淀a加入40ml0.1mol/ltris-nacl溶液,1100rpm转速匀浆1min,10000g离心10min,去掉上清液,取沉淀b;将沉淀b用50ml0.1mol/ltris-nacl溶液溶解,用普通的脱脂棉纱布过滤,取滤液,用离心机10000g离心10min,去掉上清液,取沉淀c,然后用20ml0.6mol/ltris-nacl溶解所述沉淀c,制备成浓度为40mg/ml的肌原纤维蛋白溶液,该肌原纤维蛋白溶液12h内使用;
s2、制备蛋白多酚混合液:取6.8μl0.05g/ml的没食子酸溶液和100ml步骤s1所得40mg/ml的鱼肌原纤维蛋白溶液在4℃冷室下混合均匀,得蛋白多酚混合液;
其中,所述没食子酸溶液的制备方法为:取没食子酸,溶于水,使用1mol/l的naoh溶液调节ph8,获得浓度为0.05mg/ml的没食子酸溶液;所述没食子酸添加量为鱼肌原纤维蛋白总量的0.085‰;根据没食子酸所需添加量,计算相应没食子酸溶液的取用体积;100ml的40mg/ml的鱼肌原纤维蛋白溶液中,含有4000mg鱼肌原纤维蛋白,取用6.8μl没食子酸溶液;所述鱼肌原纤维蛋白含量的测定采用双缩脲比色法进行测定;
s3、超声处理:取步骤s2中的蛋白多酚混合液100ml置于直径3cm圆柱形器皿中,使用超声细胞破碎仪在4℃冷室下超声处理,将超声探头置于所述蛋白多酚混合液中心部位施加超声作用,超声功率400w,每超声工作2s,停止时间2s,超声工作时间为5min,所述停止时间不计入超声时间;得超声后的蛋白多酚复合体系;所述蛋白多酚复合体系呈溶液状态;
s4、熟化:将步骤s3所得超声后的蛋白多酚复合体系40℃加热20min,90℃加热15min,4℃冷却30min,得凝胶强度增强的鱼肌原纤维蛋白凝胶。
优选方式下,步骤s1所述鱼肉为马鲛鱼肉或草鱼肉。
本发明的优势在于:
1、本发明采用超声技术协同低浓度没食子酸作用于鱼肉mfp,显著改变了鱼肉mfp的结构特性和理化特性,促进了鱼肉肌原纤维蛋白的凝胶作用,改善了肌原纤维蛋白的凝胶强度,效果好;
2、本发明提供的超声协同低浓度没食子酸技术显著降低了单独使用没食子酸提高鱼肉肌原纤维蛋白凝胶特性所需的剂量,且凝胶特性提升效果优于原先高剂量没食子酸的提升效果;
3、本发明能耗低,无污染,安全性高,且成本低,操作简单,易于实现工业化生产应用;
4、本发明未引入高剂量的非鱼蛋白组分,在提高鱼类肌原纤维蛋白凝胶特性的同时保持了鱼蛋白的营养价值与风味特性,满足了鱼类肌原纤维蛋白产品的品质需求。
综上,本发明所采用的工艺简单,降低能耗和试剂用量,可有效提高鱼肉肌原纤维蛋白制品的凝胶性能并保持产品风味和营养,具有良好的应用前景。
附图说明
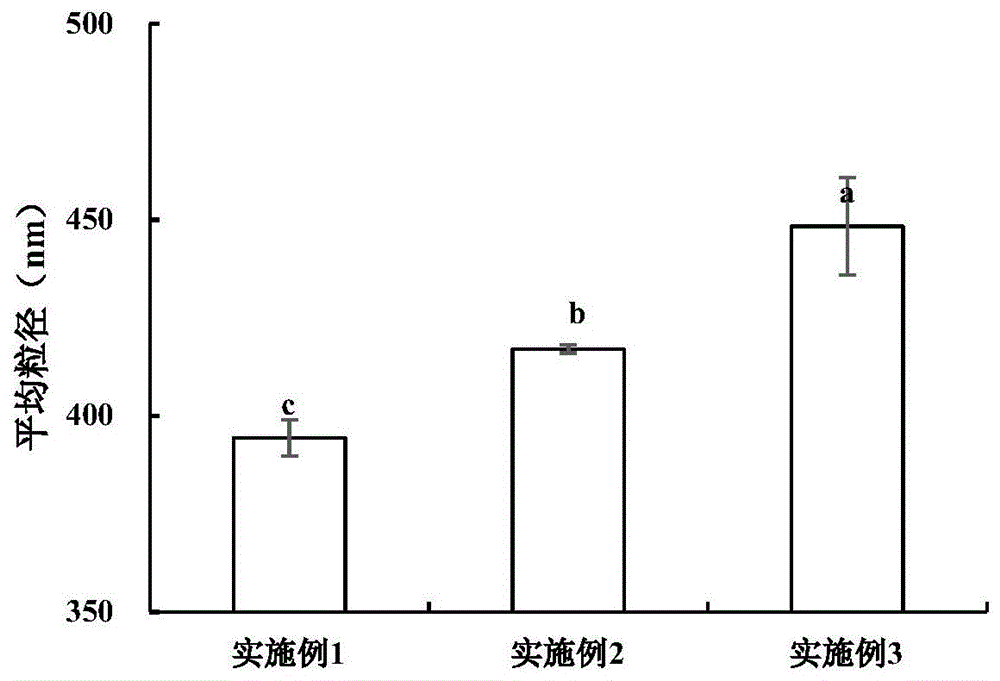
图1是本发明实施例1~3制备的超声后的蛋白多酚复合体系的平均粒径分析图;
图2是本发明对比例1~5制备的溶液的平均粒径分析图;其中,a表示对比例1步骤s1制备的胶原纤维蛋白溶液;b表示对比例2步骤s2制备的蛋白多酚混合液;c表示对比例3步骤s2制备的蛋白多酚混合液;d表示对比例4步骤s2制备的蛋白多酚混合液;e表示对比例5步骤s2制备的超声后蛋白溶液;
图3是本发明实施例1~3制备的超声后的蛋白多酚复合体系的平均表面疏水性变化分析图;
图4是本发明对比例1~5制备的溶液的表面疏水性变化分析图;其中,a表示对比例1步骤s1制备的及原纤维蛋白溶液;b表示对比例2步骤s2制备的蛋白多酚混合液;c表示对比例3步骤s2制备的蛋白多酚混合液;d表示对比例4步骤s2制备的蛋白多酚混合液;e表示对比例5步骤s2制备的超声后的蛋白溶液;
图5是本发明实施例1~3制备的超声后的蛋白多酚复合体系的流变特性变化分析图;
图6是本发明对比例1~5制备的溶液的流变特性变化分析图;其中,a表示对比例1步骤s1制备的及原纤维蛋白溶液;b表示对比例2步骤s2制备的蛋白多酚混合液;c表示对比例3步骤s2制备的蛋白多酚混合液;d表示对比例4步骤s2制备的蛋白多酚混合液;e表示对比例5步骤s2制备的超声后的蛋白溶液;
图7是本发明实施例1~3制备的超声后的蛋白多酚复合体系的凝胶强度变化分析图;
图8是本发明对比例1~5制备的凝胶的凝胶强度变化分析图;其中,a表示对比例1步骤s2制备的凝胶强度增强的肌原纤维蛋凝胶;b表示对比例2步骤s3制备的凝胶强度增强的肌原纤维蛋凝胶;c表示对比例3步骤s3制备的凝胶强度增强的肌原纤维蛋凝胶;d表示对比例4步骤s3制备的凝胶强度增强的肌原纤维蛋凝胶;e表示对比例5步骤s3制得的凝胶强度增强的肌原纤维蛋凝胶;
图9是本发明实施例1制备的凝胶强度增强的肌原纤维蛋凝胶的微观结构变化分析图;
图10是本发明实施例2制备的凝胶强度增强的肌原纤维蛋凝胶的微观结构变化分析图;
图11是本发明实施例3制备的凝胶强度增强的肌原纤维蛋凝胶的微观结构变化分析图;
图12是本发明对比例1制备的凝胶强度增强的肌原纤维蛋凝胶的微观结构变化分析图;
图13是本发明对比例2制备的凝胶强度增强的肌原纤维蛋凝胶的微观结构变化分析图;
图14是本发明对比例3制备的凝胶强度增强的肌原纤维蛋凝胶的微观结构变化分析图;
图15是本发明对比例4制备的凝胶强度增强的肌原纤维蛋凝胶的微观结构变化分析图;
图16是本发明对比例5制备的凝胶强度增强的肌原纤维蛋凝胶的微观结构变化分析图;
图17是本发明实施例4~6制备的超声后的蛋白多酚复合体系的平均粒径分析图;
图18是本发明对比例6~10制备的溶液的平均粒径分析图;其中,f表示对比例6步骤s1制备的及原纤维蛋白溶液;g表示对比例7步骤s2制备的蛋白多酚混合液;h表示对比例8步骤s2制备的蛋白多酚混合液;i表示对比例9步骤s2制备的蛋白多酚混合液;j表示对比例10步骤s2制备的超声后的蛋白溶液;
图19是本发明实施例4~6制备的超声后的蛋白多酚复合体系的平均表面疏水性变化分析图;
图20是本发明对比例6~10制备的溶液的表面疏水性变化分析图;其中,f表示对比例6步骤s1制备的及原纤维蛋白溶液;g表示对比例7步骤s2制备的蛋白多酚混合液;h表示对比例8步骤s2制备的蛋白多酚混合液;i表示对比例9步骤s2制备的蛋白多酚混合液;j表示对比例10步骤s2制备的超声后蛋白溶液;
图21是本发明实施例4~6制备的超声后的蛋白多酚复合体系的流变特性变化分析图;
图22是本发明对比例6~10制备的溶液的流变特性变化分析图;其中,f表示对比例7步骤s1制备的及原纤维蛋白溶液;g表示对比例8步骤s2制备的蛋白多酚混合液;h表示对比例9步骤s2制备的蛋白多酚混合液;i表示对比例10步骤s2制备的蛋白多酚混合液;j表示对比例5步骤s2制备的超声后蛋白溶液;
图23是本发明实施例4~6制备的凝胶强度增强的肌原纤维蛋凝胶的凝胶强度变化分析图;
图24是本发明对比例6~10制备的凝胶强度增强的肌原纤维蛋凝胶变化分析图;其中,f表示对比例6步骤s2制备的凝胶强度增强的肌原纤维蛋凝胶;g表示对比例7步骤s3制备的凝胶强度增强的肌原纤维蛋凝胶;h表示对比例8步骤s3制备的凝胶强度增强的肌原纤维蛋凝胶;i表示对比例9步骤s3制备的凝胶强度增强的肌原纤维蛋凝胶;j表示对比例10步骤s3制得的凝胶强度增强的肌原纤维蛋凝胶;
图25是本发明实施例4制备的凝胶强度增强的肌原纤维蛋凝胶的微观结构变化分析图;
图26是本发明实施例5制备的凝胶强度增强的肌原纤维蛋凝胶的微观结构变化分析图;
图27是本发明实施例6制备的凝胶强度增强的肌原纤维蛋凝胶的微观结构变化分析图;
图28是本发明对比例6制备的凝胶强度增强的肌原纤维蛋凝胶的微观结构变化分析图;
图29是本发明对比例7制备的凝胶强度增强的肌原纤维蛋凝胶的微观结构变化分析图;
图30是本发明对比例8制备的凝胶强度增强的肌原纤维蛋凝胶的微观结构变化分析图;
图31是本发明对比例9制备的凝胶强度增强的肌原纤维蛋凝胶的微观结构变化分析图;
图32是本发明对比例10制备的制备的凝胶强度增强的肌原纤维蛋凝胶的微观结构变化分析图。
具体实施方式
以下实施例对本发明的技术方案做进一步的说明,有助于了解本专利,但本发明的实施方案不受所述实施例的限制,本发明的保护范围有权利要求来决定。
下述各例使用的超声破碎仪为:scientz-ⅱd超声波细胞粉碎仪,购自于:宁波新芝生物科技股份有限公司。
为了达到上述目的,本发明提供一种提高鱼蛋白凝胶强度的方法,具体步骤为:
s1、原料鱼取肉,切块提取鱼肌原纤维蛋白,制备浓度为40~100mg/ml的鱼肌原纤维蛋白溶液溶液,于4℃备用;
其中,鱼肌原纤维蛋白溶液的提取方法如下:4℃环境下,取20g鱼肉,加入40ml0.1mol/ltris-nacl溶液,1100rpm转速匀浆1min,10000g离心10min,去掉上清液,取沉淀a;将所述沉淀a加入40ml0.1mol/ltris-nacl溶液,1100rpm转速匀浆1min,10000g离心10min,去掉上清液,取沉淀b;将沉淀b用50ml0.1mol/ltris-nacl溶液溶解,用普通的脱脂棉纱布过滤,取滤液,用离心机10000g离心10min,去掉上清液,取沉淀c,然后用20ml0.6mol/ltris-nacl溶解所述沉淀c,制备成浓度为40mg/ml的肌原纤维蛋白溶液,该肌原纤维蛋白溶液12h内使用;
s2、取质量分数0.05~0.10g/ml的没食子酸溶液和步骤s1所得鱼肌原纤维蛋白溶液,混合均匀;
其中,步骤s2所述没食子酸溶液的制备方法为:称取一定量的没食子酸,溶于去离子水,使用1mol/l的naoh溶液调节ph8~10,获得浓度为0.05~0.10mg/ml的没食子酸溶液;所述没食子酸添加量为鱼肌原纤维蛋白含量的0.05~3.00‰;根据没食子酸所需添加量计算没食子酸溶液的取用体积;所述鱼肉鱼肌原纤维蛋白含量采用双缩脲比色法测定;没食子酸与肌原纤维蛋白溶液在4℃冷室下混合均匀;
s3、取步骤s2蛋白多酚混合液,使用超声破碎仪在4℃冷室下超声处理,超声功率为200~400w、超声时间为5~10min,得超声后蛋白多酚复合体系;
其中,所述超声破碎仪的探头直径为6mm;超声时间模式为工作时间2s,间隔时间2s;
s4、将超声后鱼肌原纤维蛋白溶液多酚复合体系进行加热熟化、冷却,得凝胶强度增强的鱼肌原纤维蛋白凝胶,亦可采用流变仪进行升温过程的弹性模量测定,间接考察鱼肌原纤维蛋白的凝胶特性。
优选方式下,步骤s1所述鱼类为马鲛鱼,也可选取其他鱼类;所述鱼肉鱼肌原纤维蛋白溶液含量为40~100mg/ml,鱼蛋白含量依照《双缩脲比色法》进行测定。
优选方式下,步骤s2所述没食子酸溶液的制备方法为:称取一定量的没食子酸,溶于去离子水,使用1mol/l的naoh溶液调节ph8~10,获得备用没食子酸溶液。
优选方式下,步骤s3接收超声处理的样品体积为100ml,样品超声所用容器为直径3cm圆柱形器皿,超声探头置于样品中心部位施加超声作用;
优选方式下,步骤s4的肌原纤维蛋白多酚复合体系加热条件为:30~50℃加热10~20min,80~100℃加热5~15min,冷却条件为:4~7℃冷却20~30min;流变仪升温范围为20~80℃。
第一组(马鲛鱼)
实施例1:
提高马鲛鱼肌原纤维蛋白凝胶特性的方法,包括以下步骤:
s1、制备鱼肌原纤维蛋白溶液:取马鲛鱼肉,切块,制备鱼肌原纤维蛋白溶液,于4℃备用;
其中,鱼肌原纤维蛋白溶液的制备方法如下:4℃环境下,取20g鱼肉,加入40ml0.1mol/ltris-nacl溶液,1100rpm转速匀浆1min,10000g离心10min,去掉上清液,取沉淀a;将所述沉淀a加入40ml0.1mol/ltris-nacl溶液,1100rpm转速匀浆1min,10000g离心10min,去掉上清液,取沉淀b;将沉淀b用50ml0.1mol/ltris-nacl溶液溶解,用普通的脱脂棉纱布过滤,取滤液,用离心机10000g离心10min,去掉上清液,取沉淀c,然后用20ml0.6mol/ltris-nacl溶解所述沉淀c,制备成浓度为40mg/ml的肌原纤维蛋白溶液,该肌原纤维蛋白溶液12h内使用;所述鱼肌原纤维蛋白溶液中鱼肌原纤维蛋白的含量依照《双缩脲比色法》进行测定;
s2、制备蛋白多酚混合液:取6.8μl0.05g/ml的没食子酸溶液和100ml步骤s1所得40mg/ml的鱼肌原纤维蛋白溶液在4℃冷室下混合均匀,得蛋白多酚混合液;
其中,步骤s2所述没食子酸溶液的制备方法为:称取一定量的没食子酸,溶于去离子水,使用1mol/l的naoh溶液调节ph8,获得浓度为0.05mg/ml的没食子酸溶液;所述没食子酸添加量为鱼肌原纤维蛋白总量的0.085‰;根据没食子酸所需添加量,计算相应没食子酸溶液的取用体积;100ml的40mg/ml的鱼肌原纤维蛋白溶液中,含有4000mg鱼肌原纤维蛋白,取用6.8μl没食子酸溶液;所述鱼肌原纤维蛋白含量的测定采用双缩脲比色法进行测定;
s3、超声处理:取步骤s2中的蛋白多酚混合液,使用超声细胞破碎仪在4℃冷室下超声处理,得超声后的蛋白多酚复合体系;所述蛋白多酚复合体系呈溶液状态;
其中,所述的超声处理的蛋白多酚混合液体积100ml,蛋白多酚混合液超声所用容器为直径3cm圆柱形器皿,超声探头置于蛋白多酚混合液中心部位施加超声作用;超声条件:功率400w,超声时间为5min(每超声工作时间2s,停止时间2s,以防超声引起局部升温,所述停止时间不计入超声时间);
s4、熟化:将步骤s3所得超声后蛋白多酚复合体系进行加热、冷却,得凝胶强度增强的鱼肌原纤维蛋白凝胶;其中,所述的鱼肌原纤维蛋白多酚复合体系加热条件为:40℃加热20min,90℃加热15min,冷却条件为:4℃冷却30min。
取本实施例步骤s3制得的超声后的蛋白多酚复合体系分别测溶液状态的平均粒径、蛋白质表面疏水性,结果分别如图1、图3所示;取本实施例步骤s3制备的超声后的蛋白多酚复合体系采用流变仪进行升温过程的弹性模量测定,间接考察肌原纤维蛋白的凝胶特性;流变仪升温范围为20~80℃,结果如图5所示;取本实施例步骤s4制得的凝胶强度增强的肌原纤维蛋凝胶分别测的凝胶强度、微观结构,结果分别如图7和图9所示。
实施例2
提高马鲛鱼肌原纤维蛋白凝胶特性的方法,包括以下步骤:
s1、制备鱼肌原纤维蛋白溶液:取马鲛鱼肉,切块,提取鱼肌原纤维蛋白,制备鱼肌原纤维蛋白溶液,于4℃备用;
其中,鱼肌原纤维蛋白溶液的制备方法如下:4℃环境下,取20g鱼肉,加入40ml0.1mol/ltris-nacl溶液,1100rpm转速匀浆1min,10000g离心10min,去掉上清液,取沉淀a;将所述沉淀a加入40ml0.1mol/ltris-nacl溶液,1100rpm转速匀浆1min,10000g离心10min,去掉上清液,取沉淀b;将沉淀b用50ml0.1mol/ltris-nacl溶液溶解,用普通的脱脂棉纱布过滤,取滤液,用离心机10000g离心10min,去掉上清液,取沉淀c,然后用20ml0.6mol/ltris-nacl溶解所述沉淀c,制备成浓度为40mg/ml的肌原纤维蛋白溶液,该肌原纤维蛋白溶液12h内使用;所述鱼肌原纤维蛋白溶液中鱼肌原纤维蛋白的含量依照《双缩脲比色法》进行测定;
s2、制备蛋白多酚混合液:取21.25μl0.08g/ml的没食子酸溶液和100ml步骤s1所得40mg/ml的鱼肌原纤维蛋白溶液在4℃冷室下混合均匀,得蛋白多酚混合液;
其中,步骤s2所述没食子酸溶液的制备方法为:称取一定量的没食子酸,溶于去离子水,使用1mol/l的naoh溶液调节ph8,获得浓度为0.08mg/ml的没食子酸溶液;所述没食子酸添加量为鱼肌原纤维蛋白总量的0.425‰;根据没食子酸所需添加量,计算相应没食子酸溶液的取用体积;100ml的40mg/ml的鱼肌原纤维蛋白溶液中,含有4000mg鱼肌原纤维蛋白,取用21.25μl没食子酸溶液;所述鱼肌原纤维蛋白含量的测定采用双缩脲比色法进行测定;
s3、超声处理:取步骤s2中的蛋白多酚混合液,使用超声细胞破碎仪在4℃冷室下超声处理,得超声后的蛋白多酚复合体系;所述蛋白多酚复合体系呈溶液状态;
其中,所述的超声处理的蛋白多酚混合液体积100ml,蛋白多酚混合液超声所用容器为直径3cm圆柱形器皿,超声探头置于蛋白多酚混合液中心部位施加超声作用;超声条件:功率400w,超声时间为5min(每超声工作时间2s,停止时间2s,以防超声引起局部升温,所述停止时间不计入超声时间);
s4、熟化:将步骤s3所得超声后蛋白多酚复合体系进行加热熟化、冷却,得凝胶强度增强的鱼肌原纤维蛋白凝胶;其中,所述的鱼肌原纤维蛋白多酚复合体系加热条件为:40℃加热20min,90℃加热15min,冷却条件为:4℃冷却30min。
取本实施例步骤s3制得的超声后的蛋白多酚复合体系分别测溶液状态的平均粒径、蛋白质表面疏水性,结果分别如图1、图3所示;取本实施例步骤s3制备的超声后的蛋白多酚复合体系采用流变仪进行升温过程的弹性模量测定,间接考察肌原纤维蛋白的凝胶特性,流变仪升温范围为20~80℃,结果如图5所示;取本实施例步骤s4制得的凝胶强度增强的肌原纤维蛋凝胶分别测的凝胶强度、微观结构,结果分别如图7和图10所示。
实施例3:
提高马鲛鱼肌原纤维蛋白凝胶特性的方法,包括以下步骤:
s1、制备鱼肌原纤维蛋白溶液:马鲛鱼取肉,切块,提取鱼肌原纤维蛋白,制备鱼肌原纤维蛋白溶液溶液,于4℃备用;
其中,鱼肌原纤维蛋白溶液的制备方法如下:4℃环境下,取20g鱼肉,加入40ml0.1mol/ltris-nacl溶液,1100rpm转速匀浆1min,10000g离心10min,去掉上清液,取沉淀a;将所述沉淀a加入40ml0.1mol/ltris-nacl溶液,1100rpm转速匀浆1min,10000g离心10min,去掉上清液,取沉淀b;将沉淀b用50ml0.1mol/ltris-nacl溶液溶解,用普通的脱脂棉纱布过滤,取滤液,用离心机10000g离心10min,去掉上清液,取沉淀c,然后用20ml0.6mol/ltris-nacl溶解所述沉淀c,制备成浓度为40mg/ml的肌原纤维蛋白溶液,该肌原纤维蛋白溶液12h内使用;所述鱼肌原纤维蛋白溶液中鱼肌原纤维蛋白的含量依照《双缩脲比色法》进行测定;
s2、制备蛋白多酚混合液:取85μl0.10g/ml的没食子酸溶液和100ml步骤s1所得40mg/ml的mfp溶液在4℃冷室下混合均匀,得蛋白多酚混合液;
其中,步骤s2所述没食子酸溶液的制备方法为:称取一定量的没食子酸,溶于去离子水,使用1mol/l的naoh溶液调节ph8,获得浓度为0.10mg/ml的没食子酸溶液;所述没食子酸添加量为鱼肌原纤维蛋白总量的2.125‰;根据没食子酸所需添加量,计算相应没食子酸溶液的取用体积;100ml的40mg/ml的鱼肌原纤维蛋白溶液中,含有4000mg鱼肌原纤维蛋白,取用85μl没食子酸溶液;所述鱼肌原纤维蛋白含量的测定采用双缩脲比色法进行测定;
s3、超声处理:取步骤s2中的蛋白多酚混合液,使用超声细胞破碎仪在4℃冷室下超声处理,得超声后的蛋白多酚复合体系;所述蛋白多酚复合体系呈溶液状态;
其中,所述的超声处理的蛋白多酚混合液体积100ml,蛋白多酚混合液超声所用容器为直径3cm圆柱形器皿,超声探头置于蛋白多酚混合液中心部位施加超声作用;超声条件:功率400w,超声时间为5min(每超声工作时间2s,停止时间2s,以防超声引起局部升温,所述停止时间不计入超声时间);
s4、熟化:将步骤s3所得超声后蛋白多酚复合体系进行加热熟化、冷却,得凝胶强度增强的mfp凝胶;其中,所述的鱼肌原纤维蛋白多酚复合体系加热条件为:40℃加热20min,90℃加热15min,冷却条件为:4℃冷却30min
取本实施例步骤s3制得的超声后的蛋白多酚复合体系分别测溶液状态的平均粒径、蛋白质表面疏水性,结果分别如图1、图3所示;取本实施例步骤s3制备的超声后的蛋白多酚复合体系采用流变仪进行升温过程的弹性模量测定,间接考察肌原纤维蛋白的凝胶特性,流变仪升温范围为20~80℃,结果如图5所示;取本实施例步骤s4制得的凝胶强度增强的肌原纤维蛋凝胶分别测的凝胶强度、微观结构,结果分别如图7和图11所示。
对比例1:
提高马鲛鱼肌原纤维蛋白凝胶特性的方法,包括以下步骤:
s1、制备鱼肌原纤维蛋白溶液:马鲛鱼取肉,切块,提取肌原纤维蛋白,制备鱼肌原纤维蛋白溶液,于4℃备用;
其中,鱼肌原纤维蛋白溶液的提取方法如下:4℃环境下,取20g鱼肉,加入40ml0.1mol/ltris-nacl溶液,1100rpm转速匀浆1min,10000g离心10min,去掉上清液,取沉淀a;将所述沉淀a加入40ml0.1mol/ltris-nacl溶液,1100rpm转速匀浆1min,10000g离心10min,去掉上清液,取沉淀b;将沉淀b用50ml0.1mol/ltris-nacl溶液溶解,用普通的脱脂棉纱布过滤,取滤液,用离心机10000g离心10min,去掉上清液,取沉淀c,然后用20ml0.6mol/ltris-nacl溶解所述沉淀c,制备成浓度为40mg/ml的肌原纤维蛋白溶液,该肌原纤维蛋白溶液12h内使用;所述鱼肌原纤维蛋白溶液中鱼肌原纤维蛋白的含量依照《双缩脲比色法》进行测定;
s2、熟化:将浓度为40mg/ml鱼肌原纤维蛋白溶液进行加热熟化、冷却,得凝胶强度增强的肌原纤维蛋白凝胶;其中,所述的鱼肌原纤维蛋白溶液加热条件为:40℃加热20min,90℃加热15min,冷却条件为:4℃冷却30min
取本对比例步骤s1制得的肌原纤维蛋白溶液分别测溶液状态的平均粒径、蛋白质表面疏水性,结果分别如图2、图4所示;取本对比例步骤s1制得的肌原纤维蛋白溶液采用流变仪进行升温过程的弹性模量测定,间接考察肌原纤维蛋白的凝胶特性;流变仪升温范围为20~80℃,结果如图6所示;取本实施例步骤s2制得的凝胶强度增强的肌原纤维蛋凝胶分别测的凝胶强度、微观结构,结果分别如图8和图12所示。
对比例2:
提高马鲛鱼肌原纤维蛋白凝胶特性的方法,包括以下步骤:
s1、制备鱼肌原纤维蛋白溶液:马鲛鱼取肉,切块,提取肌原纤维蛋白,制备鱼肌原纤维蛋白溶液,于4℃备用;
其中,鱼肌原纤维蛋白溶液的提取方法如下:4℃环境下,取20g鱼肉,加入40ml0.1mol/ltris-nacl溶液,1100rpm转速匀浆1min,10000g离心10min,去掉上清液,取沉淀a;将所述沉淀a加入40ml0.1mol/ltris-nacl溶液,1100rpm转速匀浆1min,10000g离心10min,去掉上清液,取沉淀b;将沉淀b用50ml0.1mol/ltris-nacl溶液溶解,用普通的脱脂棉纱布过滤,取滤液,用离心机10000g离心10min,去掉上清液,取沉淀c,然后用20ml0.6mol/ltris-nacl溶解所述沉淀c,制备成浓度为40mg/ml的肌原纤维蛋白溶液,该肌原纤维蛋白溶液12h内使用;所述鱼肌原纤维蛋白溶液中鱼肌原纤维蛋白的含量依照《双缩脲比色法》进行测定;
s2、制备蛋白多酚混合液:取6.8μl0.05g/ml的没食子酸溶液和100ml步骤s1所得40mg/ml的肌原纤维蛋白溶液在4℃冷室下混合均匀,得蛋白多酚混合液;
其中,步骤s2所述没食子酸溶液的制备方法为:称取一定量的没食子酸,溶于去离子水,使用1mol/l的naoh溶液调节ph8,获得浓度为0.05mg/ml的没食子酸溶液;所述没食子酸添加量为鱼肌原纤维蛋白总量的0.085‰;根据没食子酸所需添加量,计算相应没食子酸溶液的取用体积;100ml的40mg/ml的鱼肌原纤维蛋白溶液中,含有4000mg鱼肌原纤维蛋白,取用6.8μl没食子酸溶液;所述鱼肌原纤维蛋白含量的测定采用双缩脲比色法进行测定;
s3、熟化:将蛋白多酚混合液进行加热熟化、冷却,得凝胶强度增强的肌原纤维蛋凝胶;其中,所述的肌原纤维蛋白多酚复合体系加热条件为:40℃加热20min,90℃加热15min,冷却条件为:4℃冷却30min;
取本对比例步骤s2制得的蛋白多酚混合液分别测溶液状态的平均粒径、蛋白质表面疏水性,结果分别如图2、图4所示;取本对比例步骤s2制得的蛋白多酚混合液采用流变仪进行升温过程的弹性模量测定,间接考察肌原纤维蛋白的凝胶特性;流变仪升温范围为20~80℃,结果如图6所示;取本实施例步骤s3制得的凝胶强度增强的肌原纤维蛋凝胶分别测的凝胶强度、微观结构,结果分别如图8和图13所示。
对比例3:
提高马鲛鱼肌原纤维蛋白凝胶特性的方法,包括以下步骤:
s1、制备鱼肌原纤维蛋白溶液:马鲛鱼取肉,切块,提取肌原纤维蛋白,制备鱼肌原纤维蛋白溶液,于4℃备用;
其中,鱼肌原纤维蛋白溶液的提取方法如下:4℃环境下,取20g鱼肉,加入40ml0.1mol/ltris-nacl溶液,1100rpm转速匀浆1min,10000g离心10min,去掉上清液,取沉淀a;将所述沉淀a加入40ml0.1mol/ltris-nacl溶液,1100rpm转速匀浆1min,10000g离心10min,去掉上清液,取沉淀b;将沉淀b用50ml0.1mol/ltris-nacl溶液溶解,用普通的脱脂棉纱布过滤,取滤液,用离心机10000g离心10min,去掉上清液,取沉淀c,然后用20ml0.6mol/ltris-nacl溶解所述沉淀c,制备成浓度为40mg/ml的肌原纤维蛋白溶液,该肌原纤维蛋白溶液12h内使用;所述鱼肌原纤维蛋白溶液中鱼肌原纤维蛋白的含量依照《双缩脲比色法》进行测定;
s2、制备蛋白多酚混合液:取21.25μl0.08g/ml的没食子酸溶液和100ml步骤s1所得40mg/ml的肌原纤维蛋白溶液在4℃冷室下混合均匀,得蛋白多酚混合液;
其中,步骤s2所述没食子酸溶液的制备方法为:称取一定量的没食子酸,溶于去离子水,使用1mol/l的naoh溶液调节ph8,获得浓度为0.08mg/ml的没食子酸溶液;所述没食子酸添加量为鱼肌原纤维蛋白总量的0.425‰;根据没食子酸所需添加量,计算相应没食子酸溶液的取用体积;100ml的40mg/ml的鱼肌原纤维蛋白溶液中,含有4000mg鱼肌原纤维蛋白,取用21.25μl没食子酸溶液;所述鱼肌原纤维蛋白含量的测定采用双缩脲比色法进行测定;
s3、熟化:将蛋白多酚混合液进行加热熟化、冷却,得凝胶强度增强的肌原纤维蛋凝胶;其中,所述的肌原纤维蛋白多酚复合体系加热条件为:40℃加热20min,90℃加热15min,冷却条件为:4℃冷却30min。
取本对比例步骤s2制得的蛋白多酚混合液分别测溶液状态的平均粒径、蛋白质表面疏水性,结果分别如图2、图4所示;取本对比例步骤s2制得的蛋白多酚混合液采用流变仪进行升温过程的弹性模量测定,间接考察肌原纤维蛋白的凝胶特性;流变仪升温范围为20~80℃,结果如图6所示;取本实施例步骤s3制得的凝胶强度增强的肌原纤维蛋凝胶分别测的凝胶强度、微观结构,结果分别如图8和图14所示。
对比例4:
提高马鲛鱼肌原纤维蛋白凝胶特性的方法,包括以下步骤:
s1、制备鱼肌原纤维蛋白溶液:马鲛鱼取肉,切块,提取肌原纤维蛋白,制备鱼肌原纤维蛋白溶液,于4℃备用;
其中,鱼肌原纤维蛋白溶液的提取方法如下:4℃环境下,取20g鱼肉,加入40ml0.1mol/ltris-nacl溶液,1100rpm转速匀浆1min,10000g离心10min,去掉上清液,取沉淀a;将所述沉淀a加入40ml0.1mol/ltris-nacl溶液,1100rpm转速匀浆1min,10000g离心10min,去掉上清液,取沉淀b;将沉淀b用50ml0.1mol/ltris-nacl溶液溶解,用普通的脱脂棉纱布过滤,取滤液,用离心机10000g离心10min,去掉上清液,取沉淀c,然后用20ml0.6mol/ltris-nacl溶解所述沉淀c,制备成浓度为40mg/ml的肌原纤维蛋白溶液,该肌原纤维蛋白溶液12h内使用;所述鱼肌原纤维蛋白溶液中鱼肌原纤维蛋白的含量依照《双缩脲比色法》进行测定;
s2、制备蛋白多酚混合液:取85μl0.10g/ml的没食子酸溶液和100ml步骤s1所得40mg/ml的肌原纤维蛋白溶液在4℃冷室下混合均匀,得蛋白多酚混合液;
其中,步骤s2所述没食子酸溶液的制备方法为:称取一定量的没食子酸,溶于去离子水,使用1mol/l的naoh溶液调节ph8,获得浓度为0.10mg/ml的没食子酸溶液;所述没食子酸添加量为鱼肌原纤维蛋白总量的2.125‰;根据没食子酸所需添加量,计算相应没食子酸溶液的取用体积;100ml的40mg/ml的鱼肌原纤维蛋白溶液中,含有4000mg鱼肌原纤维蛋白,取用85μl没食子酸溶液;所述鱼肌原纤维蛋白含量的测定采用双缩脲比色法进行测定;
s3、熟化:将蛋白多酚混合液进行加热熟化、冷却,得凝胶强度增强的肌原纤维蛋凝胶;其中,所述的肌原纤维蛋白多酚复合体系加热条件为:40℃加热20min,90℃加热15min,冷却条件为:4℃冷却30min;
取本对比例步骤s2制得的蛋白多酚混合液分别测溶液状态的平均粒径、蛋白质表面疏水性,结果分别如图2、图4所示;取本对比例步骤s2制得的蛋白多酚混合液采用流变仪进行升温过程的弹性模量测定,间接考察肌原纤维蛋白的凝胶特性;流变仪升温范围为20~80℃,结果如图6所示;取本实施例步骤s3制得的凝胶强度增强的肌原纤维蛋凝胶分别测的凝胶强度、微观结构,结果分别如图8和图15所示。
对比例5:
提高马鲛鱼肌原纤维蛋白凝胶特性的方法,包括以下步骤:
s1、制备鱼肌原纤维蛋白溶液:马鲛鱼取肉,切块,提取肌原纤维蛋白,制备肌原纤维蛋白溶液,于4℃备用;
其中,鱼肌原纤维蛋白溶液的提取方法如下:4℃环境下,取20g鱼肉,加入40ml0.1mol/ltris-nacl溶液,1100rpm转速匀浆1min,10000g离心10min,去掉上清液,取沉淀a;将所述沉淀a加入40ml0.1mol/ltris-nacl溶液,1100rpm转速匀浆1min,10000g离心10min,去掉上清液,取沉淀b;将沉淀b用50ml0.1mol/ltris-nacl溶液溶解,用普通的脱脂棉纱布过滤,取滤液,用离心机10000g离心10min,去掉上清液,取沉淀c,然后用20ml0.6mol/ltris-nacl溶解所述沉淀c,制备成浓度为40mg/ml的肌原纤维蛋白溶液,该肌原纤维蛋白溶液12h内使用;所述鱼肌原纤维蛋白溶液中鱼肌原纤维蛋白的含量依照《双缩脲比色法》进行测定;
s2、制备超声后鱼肌原纤维蛋白溶液:取步骤s1所述浓度为40mg/ml的鱼肌原纤维蛋白溶液,使用超声细胞破碎仪在4℃冷室下超声处理,得超声后的蛋白溶液;
其中,所述的超声处理的蛋白溶液体积100ml,蛋白溶液超声所用容器为直径3cm圆柱形器皿,超声探头置于蛋白溶液中心部位施加超声作用;超声条件:功率400w,超声时间为5min(每超声工作时间2s,停止时间2s,以防超声引起局部升温,所述停止时间不计入超声时间);
s3、熟化:将超声后鱼肌原纤维蛋白溶液进行加热熟化、冷却,得凝胶强度增强的肌原纤维蛋白凝胶;其中,所述的超声后鱼肌原纤维蛋白溶液加热条件为:40℃加热20min,90℃加热15min,冷却条件为:4℃冷却30min
取本对比例步骤s2制得超声后的蛋白溶液分别测溶液状态的平均粒径、蛋白质表面疏水性,结果分别如图2、图4所示;取本对比例步骤s2制得的超声后的蛋白溶液采用流变仪进行升温过程的弹性模量测定,间接考察肌原纤维蛋白的凝胶特性,流变仪升温范围为20~80℃,结果如图6所示;取本实施例步骤s3制得的凝胶强度增强的肌原纤维蛋凝胶分别测的凝胶强度、微观结构,结果分别如图8和图16所示。
第二组(草鱼)
实施例4:
提高草鱼肌原纤维蛋白凝胶特性的方法,包括以下步骤:
s1、制备鱼肌原纤维蛋白溶液:草鱼取肉,切块,提取鱼肌原纤维蛋白,制备鱼肌原纤维蛋白溶液,于4℃备用;
其中,鱼肌原纤维蛋白溶液的制备方法如下:4℃环境下,取20g鱼肉,加入40ml0.1mol/ltris-nacl溶液,1100rpm转速匀浆1min,10000g离心10min,去掉上清液,取沉淀a;将所述沉淀a加入40ml0.1mol/ltris-nacl溶液,1100rpm转速匀浆1min,10000g离心10min,去掉上清液,取沉淀b;将沉淀b用50ml0.1mol/ltris-nacl溶液溶解,用普通的脱脂棉纱布过滤,取滤液,用离心机10000g离心10min,去掉上清液,取沉淀c,然后用20ml0.6mol/ltris-nacl溶解所述沉淀c,制备成浓度为40mg/ml的肌原纤维蛋白溶液,该肌原纤维蛋白溶液12h内使用;所述鱼肌原纤维蛋白溶液中鱼肌原纤维蛋白的含量依照《双缩脲比色法》进行测定;
s2、制备蛋白多酚混合液:取6.8μl0.05g/ml的没食子酸溶液和100ml步骤s1所得40mg/ml的鱼肌原纤维蛋白溶液在4℃冷室下混合均匀,得蛋白多酚混合液;
其中,步骤s2所述没食子酸溶液的制备方法为:称取一定量的没食子酸,溶于去离子水,使用1mol/l的naoh溶液调节ph8,获得浓度为0.05mg/ml的没食子酸溶液;所述没食子酸添加量为鱼肌原纤维蛋白总量的0.085‰;根据没食子酸所需添加量,计算相应没食子酸溶液的取用体积;100ml的40mg/ml的鱼肌原纤维蛋白溶液中,含有4000mg鱼肌原纤维蛋白,取用6.8μl没食子酸溶液;所述鱼肌原纤维蛋白含量的测定采用双缩脲比色法进行测定;
s3、超声处理:取步骤s2中的蛋白多酚混合液,使用超声细胞破碎仪在4℃冷室下超声处理,得超声后的蛋白多酚复合体系;所述蛋白多酚复合体系呈溶液状态;
其中,所述的超声处理的蛋白多酚混合液体积100ml,蛋白多酚混合液超声所用容器为直径3cm圆柱形器皿,超声探头置于蛋白多酚混合液中心部位施加超声作用;超声条件:功率400w,超声时间为5min(每超声工作时间2s,停止时间2s,以防超声引起局部升温,所述停止时间不计入超声时间);
s4、熟化:将步骤s3所得超声后蛋白多酚复合体系进行加热熟化、冷却,得凝胶强度增强的鱼肌原纤维蛋白凝胶;其中,所述的鱼肌原纤维蛋白多酚复合体系加热条件为:40℃加热20min,90℃加热15min,冷却条件为:4℃冷却30min。
取本实施例步骤s3制得的超声后的蛋白多酚复合体系分别测溶液状态的平均粒径、蛋白质表面疏水性,结果分别如图17、图19所示;取本实施例步骤s3制备的超声后的蛋白多酚复合体系采用流变仪进行升温过程的弹性模量测定,间接考察肌原纤维蛋白的凝胶特性,流变仪升温范围为20~80℃,结果如图21所示;取本实施例步骤s4制得的凝胶强度增强的肌原纤维蛋凝胶分别测的凝胶强度、微观结构,结果分别如图23和图25所示。
实施例5
提高草鱼肌原纤维蛋白凝胶特性的方法,包括以下步骤:
s1、制备鱼肌原纤维蛋白溶液:草鱼取肉,切块,提取鱼肌原纤维蛋白,制备鱼肌原纤维蛋白溶液,于4℃备用;
其中,鱼肌原纤维蛋白溶液的制备方法如下:4℃环境下,取20g鱼肉,加入40ml0.1mol/ltris-nacl溶液,1100rpm转速匀浆1min,10000g离心10min,去掉上清液,取沉淀a;将所述沉淀a加入40ml0.1mol/ltris-nacl溶液,1100rpm转速匀浆1min,10000g离心10min,去掉上清液,取沉淀b;将沉淀b用50ml0.1mol/ltris-nacl溶液溶解,用普通的脱脂棉纱布过滤,取滤液,用离心机10000g离心10min,去掉上清液,取沉淀c,然后用20ml0.6mol/ltris-nacl溶解所述沉淀c,制备成浓度为40mg/ml的肌原纤维蛋白溶液,该肌原纤维蛋白溶液12h内使用;所述鱼肌原纤维蛋白溶液中鱼肌原纤维蛋白的含量依照《双缩脲比色法》进行测定;
s2、制备蛋白多酚混合液:取21.25μl0.08g/ml的没食子酸溶液和100ml步骤s1所得40mg/ml的鱼肌原纤维蛋白溶液在4℃冷室下混合均匀,得蛋白多酚混合液;
其中,步骤s2所述没食子酸溶液的制备方法为:称取一定量的没食子酸,溶于去离子水,使用1mol/l的naoh溶液调节ph8,获得浓度为0.08mg/ml的没食子酸溶液;所述没食子酸添加量为鱼肌原纤维蛋白总量的0.425‰;根据没食子酸所需添加量,计算相应没食子酸溶液的取用体积;100ml的40mg/ml的鱼肌原纤维蛋白溶液中,含有4000mg鱼肌原纤维蛋白,取用21.25μl没食子酸溶液;所述鱼肌原纤维蛋白含量的测定采用双缩脲比色法进行测定;
s3、超声处理:取步骤s2中的蛋白多酚混合液,使用超声细胞破碎仪在4℃冷室下超声处理,得超声后的蛋白多酚复合体系;所述蛋白多酚复合体系呈溶液状态;
其中,所述的超声处理的蛋白多酚混合液体积100ml,蛋白多酚混合液超声所用容器为直径3cm圆柱形器皿,超声探头置于蛋白多酚混合液中心部位施加超声作用;超声条件:功率400w,超声时间为5min(每超声工作时间2s,停止时间2s,以防超声引起局部升温,所述停止时间不计入超声时间);
s4、熟化:将步骤s3所得超声后蛋白多酚复合体系进行加热熟化、冷却,得凝胶强度增强的鱼肌原纤维蛋白凝胶;其中,所述的鱼肌原纤维蛋白多酚复合体系加热条件为:40℃加热20min,90℃加热15min,冷却条件为:4℃冷却30min
取本实施例步骤s3制得的超声后的蛋白多酚复合体系分别测溶液状态的平均粒径、蛋白质表面疏水性,结果分别如图17、图19所示;取本实施例步骤s3制备的超声后的蛋白多酚复合体系采用流变仪进行升温过程的弹性模量测定,间接考察肌原纤维蛋白的凝胶特性;流变仪升温范围为20~80℃,结果如图21所示;取本实施例步骤s4制得的凝胶强度增强的肌原纤维蛋凝胶分别测的凝胶强度、微观结构,结果分别如图23和图26所示。
实施例6:
提高草鱼肌原纤维蛋白凝胶特性的方法,包括以下步骤:
s1、制备鱼肌原纤维蛋白溶液:草鱼取肉,切块,提取鱼肌原纤维蛋白,制备鱼肌原纤维蛋白溶液溶液,于4℃备用;
其中,鱼肌原纤维蛋白溶液的制备方法如下:4℃环境下,取20g鱼肉,加入40ml0.1mol/ltris-nacl溶液,1100rpm转速匀浆1min,10000g离心10min,去掉上清液,取沉淀a;将所述沉淀a加入40ml0.1mol/ltris-nacl溶液,1100rpm转速匀浆1min,10000g离心10min,去掉上清液,取沉淀b;将沉淀b用50ml0.1mol/ltris-nacl溶液溶解,用普通的脱脂棉纱布过滤,取滤液,用离心机10000g离心10min,去掉上清液,取沉淀c,然后用20ml0.6mol/ltris-nacl溶解所述沉淀c,制备成浓度为40mg/ml的肌原纤维蛋白溶液,该肌原纤维蛋白溶液12h内使用;所述鱼肌原纤维蛋白溶液中鱼肌原纤维蛋白的含量依照《双缩脲比色法》进行测定;
s2、制备蛋白多酚混合液:取85μl0.10g/ml的没食子酸溶液和100ml步骤s1所得40mg/ml的mfp溶液在4℃冷室下混合均匀,得蛋白多酚混合液;
其中,步骤s2所述没食子酸溶液的制备方法为:称取一定量的没食子酸,溶于去离子水,使用1mol/l的naoh溶液调节ph8,获得浓度为0.10mg/ml的没食子酸溶液;所述没食子酸添加量为鱼肌原纤维蛋白总量的2.125‰;根据没食子酸所需添加量,计算相应没食子酸溶液的取用体积;100ml的40mg/ml的鱼肌原纤维蛋白溶液中,含有4000mg鱼肌原纤维蛋白,取用85μl没食子酸溶液;所述鱼肌原纤维蛋白含量的测定采用双缩脲比色法进行测定;
s3、超声处理:取步骤s2中的蛋白多酚混合液,使用超声细胞破碎仪在4℃冷室下超声处理,得超声后的蛋白多酚复合体系;所述蛋白多酚复合体系呈溶液状态;
其中,所述的超声处理的蛋白多酚混合液体积100ml,蛋白多酚混合液超声所用容器为直径3cm圆柱形器皿,超声探头置于蛋白多酚混合液中心部位施加超声作用;超声条件:功率400w,超声时间为5min(每超声工作时间2s,停止时间2s,以防超声引起局部升温,所述停止时间不计入超声时间);
s4、熟化:将步骤s3所得超声后蛋白多酚复合体系进行加热熟化、冷却,得凝胶强度增强的肌原纤维蛋白凝胶;其中,所述的鱼肌原纤维蛋白多酚复合体系加热条件为:40℃加热20min,90℃加热15min,冷却条件为:4℃冷却30min
取本实施例步骤s3制得的超声后的蛋白多酚复合体系分别测溶液状态的平均粒径、蛋白质表面疏水性,结果分别如图17、图19所示;取本实施例步骤s3制备的超声后的蛋白多酚复合体系采用流变仪进行升温过程的弹性模量测定,间接考察肌原纤维蛋白的凝胶特性;流变仪升温范围为20~80℃,结果如图21所示;取本实施例步骤s4制得的凝胶强度增强的肌原纤维蛋凝胶分别测的凝胶强度、微观结构,结果分别如图23和图27所示。
对比例6:
提高草鱼肌原纤维蛋白凝胶特性的方法,包括以下步骤:
s1、制备鱼肌原纤维蛋白溶液:草鱼取肉,切块,提取肌原纤维蛋白,制备鱼肌原纤维蛋白溶液,于4℃备用;
其中,鱼肌原纤维蛋白溶液的提取方法如下:4℃环境下,取20g鱼肉,加入40ml0.1mol/ltris-nacl溶液,1100rpm转速匀浆1min,10000g离心10min,去掉上清液,取沉淀a;将所述沉淀a加入40ml0.1mol/ltris-nacl溶液,1100rpm转速匀浆1min,10000g离心10min,去掉上清液,取沉淀b;将沉淀b用50ml0.1mol/ltris-nacl溶液溶解,用普通的脱脂棉纱布过滤,取滤液,用离心机10000g离心10min,去掉上清液,取沉淀c,然后用20ml0.6mol/ltris-nacl溶解所述沉淀c,制备成浓度为40mg/ml的肌原纤维蛋白溶液,该肌原纤维蛋白溶液12h内使用;所述鱼肌原纤维蛋白溶液中鱼肌原纤维蛋白的含量依照《双缩脲比色法》进行测定;
s2、熟化:将40mg/ml鱼肌原纤维蛋白溶液进行加热熟化、冷却,得凝胶强度增强的肌原纤维蛋白凝胶;其中,所述的鱼肌原纤维蛋白溶液加热条件为:40℃加热20min,90℃加热15min,冷却条件为:4℃冷却30min
取本对比例步骤s1制得的肌原纤维蛋白溶液分别测溶液状态的平均粒径、蛋白质表面疏水性,结果分别如图18、图20所示;取本对比例步骤s1制得的肌原纤维蛋白溶液采用流变仪进行升温过程的弹性模量测定,间接考察肌原纤维蛋白的凝胶特性;流变仪升温范围为20~80℃,结果如图22所示;取本实施例步骤s2制得的凝胶强度增强的肌原纤维蛋凝胶分别测的凝胶强度、微观结构,结果分别如图24和图28所示。
对比例7:
提高草鱼肌原纤维蛋白凝胶特性的方法,包括以下步骤:
s1、制备鱼肌原纤维蛋白溶液:草鱼取肉,切块,提取肌原纤维蛋白,制备鱼肌原纤维蛋白溶液,于4℃备用;
其中,鱼肌原纤维蛋白溶液的提取方法如下:4℃环境下,取20g鱼肉,加入40ml0.1mol/ltris-nacl溶液,1100rpm转速匀浆1min,10000g离心10min,去掉上清液,取沉淀a;将所述沉淀a加入40ml0.1mol/ltris-nacl溶液,1100rpm转速匀浆1min,10000g离心10min,去掉上清液,取沉淀b;将沉淀b用50ml0.1mol/ltris-nacl溶液溶解,用普通的脱脂棉纱布过滤,取滤液,用离心机10000g离心10min,去掉上清液,取沉淀c,然后用20ml0.6mol/ltris-nacl溶解所述沉淀c,制备成浓度为40mg/ml的肌原纤维蛋白溶液,该肌原纤维蛋白溶液12h内使用;所述鱼肌原纤维蛋白溶液中鱼肌原纤维蛋白的含量依照《双缩脲比色法》进行测定;
s2、制备蛋白多酚混合液:取6.8μl0.05g/ml的没食子酸溶液和100ml步骤s1所得40mg/ml的肌原纤维蛋白溶液在4℃冷室下混合均匀,得蛋白多酚混合液;
其中,步骤s2所述没食子酸溶液的制备方法为:称取一定量的没食子酸,溶于去离子水,使用1mol/l的naoh溶液调节ph8,获得浓度为0.05mg/ml的没食子酸溶液;所述没食子酸添加量为鱼肌原纤维蛋白总量的0.085‰;根据没食子酸所需添加量,计算相应没食子酸溶液的取用体积;100ml的40mg/ml的鱼肌原纤维蛋白溶液中,含有4000mg鱼肌原纤维蛋白,取用6.8μl没食子酸溶液;所述鱼肌原纤维蛋白含量的测定采用双缩脲比色法进行测定;
s3、熟化:将蛋白多酚混合液进行加热熟化、冷却,得凝胶强度增强的肌原纤维蛋凝胶;其中,所述的肌原纤维蛋白多酚复合体系加热条件为:40℃加热20min,90℃加热15min,冷却条件为:4℃冷却30min;
取本对比例步骤s2制得的蛋白多酚混合液分别测溶液状态的平均粒径、蛋白质表面疏水性,结果分别如图18、图20所示;取本对比例步骤s2制得的蛋白多酚混合液采用流变仪进行升温过程的弹性模量测定,间接考察肌原纤维蛋白的凝胶特性;流变仪升温范围为20~80℃,结果如图22所示;取本实施例步骤s3制得的凝胶强度增强的肌原纤维蛋凝胶分别测的凝胶强度、微观结构,结果分别如图24和图29所示。
对比例8:
提高草鱼肌原纤维蛋白凝胶特性的方法,包括以下步骤:
s1、制备鱼肌原纤维蛋白溶液:草鱼取肉,切块,提取肌原纤维蛋白,制备鱼肌原纤维蛋白溶液,于4℃备用;
其中,鱼肌原纤维蛋白溶液的提取方法如下:4℃环境下,取20g鱼肉,加入40ml0.1mol/ltris-nacl溶液,1100rpm转速匀浆1min,10000g离心10min,去掉上清液,取沉淀a;将所述沉淀a加入40ml0.1mol/ltris-nacl溶液,1100rpm转速匀浆1min,10000g离心10min,去掉上清液,取沉淀b;将沉淀b用50ml0.1mol/ltris-nacl溶液溶解,用普通的脱脂棉纱布过滤,取滤液,用离心机10000g离心10min,去掉上清液,取沉淀c,然后用20ml0.6mol/ltris-nacl溶解所述沉淀c,制备成浓度为40mg/ml的肌原纤维蛋白溶液,该肌原纤维蛋白溶液12h内使用;所述鱼肌原纤维蛋白溶液中鱼肌原纤维蛋白的含量依照《双缩脲比色法》进行测定;
s2、制备蛋白多酚混合液:取21.25μl0.08g/ml的没食子酸溶液和100ml步骤s1所得40mg/ml的肌原纤维蛋白溶液在4℃冷室下混合均匀,得蛋白多酚混合液;
其中,步骤s2所述没食子酸溶液的制备方法为:称取一定量的没食子酸,溶于去离子水,使用1mol/l的naoh溶液调节ph8,获得浓度为0.08mg/ml的没食子酸溶液;所述没食子酸添加量为鱼肌原纤维蛋白总量的0.425‰;根据没食子酸所需添加量,计算相应没食子酸溶液的取用体积;100ml的40mg/ml的鱼肌原纤维蛋白溶液中,含有4000mg鱼肌原纤维蛋白,取用21.25μl没食子酸溶液;所述鱼肌原纤维蛋白含量的测定采用双缩脲比色法进行测定;
s3、熟化:将蛋白多酚混合液进行加热熟化、冷却,得凝胶强度增强的肌原纤维蛋凝胶;其中,所述的肌原纤维蛋白多酚复合体系加热条件为:40℃加热20min,90℃加热15min,冷却条件为:4℃冷却30min。
取本对比例步骤s2制得的蛋白多酚混合液分别测溶液状态的平均粒径、蛋白质表面疏水性,结果分别如图18、图20所示;取本对比例步骤s2制得的蛋白多酚混合液采用流变仪进行升温过程的弹性模量测定,间接考察肌原纤维蛋白的凝胶特性;流变仪升温范围为20~80℃,结果如图22所示;取本实施例步骤s3制得的凝胶强度增强的肌原纤维蛋凝胶分别测的凝胶强度、微观结构,结果分别如图24和图30所示。
对比例9:
提高马鲛鱼肌原纤维蛋白凝胶特性的方法,包括以下步骤:
s1、制备鱼肌原纤维蛋白溶液:草鱼取肉,切块,提取肌原纤维蛋白,制备鱼肌原纤维蛋白溶液,于4℃备用;
其中,鱼肌原纤维蛋白溶液的提取方法如下:4℃环境下,取20g鱼肉,加入40ml0.1mol/ltris-nacl溶液,1100rpm转速匀浆1min,10000g离心10min,去掉上清液,取沉淀a;将所述沉淀a加入40ml0.1mol/ltris-nacl溶液,1100rpm转速匀浆1min,10000g离心10min,去掉上清液,取沉淀b;将沉淀b用50ml0.1mol/ltris-nacl溶液溶解,用普通的脱脂棉纱布过滤,取滤液,用离心机10000g离心10min,去掉上清液,取沉淀c,然后用20ml0.6mol/ltris-nacl溶解所述沉淀c,制备成浓度为40mg/ml的肌原纤维蛋白溶液,该肌原纤维蛋白溶液12h内使用;所述鱼肌原纤维蛋白溶液中鱼肌原纤维蛋白的含量依照《双缩脲比色法》进行测定;
s2、制备蛋白多酚混合液:取85μl0.10g/ml的没食子酸溶液和100ml步骤s1所得40mg/ml的肌原纤维蛋白溶液在4℃冷室下混合均匀,得蛋白多酚混合液;
其中,步骤s2所述没食子酸溶液的制备方法为:称取一定量的没食子酸,溶于去离子水,使用1mol/l的naoh溶液调节ph8,获得浓度为0.10mg/ml的没食子酸溶液;所述没食子酸添加量为鱼肌原纤维蛋白总量的2.125‰;根据没食子酸所需添加量,计算相应没食子酸溶液的取用体积;100ml的40mg/ml的鱼肌原纤维蛋白溶液中,含有4000mg鱼肌原纤维蛋白,取用85μl没食子酸溶液;所述鱼肌原纤维蛋白含量的测定采用双缩脲比色法进行测定;
s3、熟化:将蛋白多酚混合液进行加热熟化、冷却,得凝胶强度增强的肌原纤维蛋凝胶;其中,所述的肌原纤维蛋白多酚复合体系加热条件为:40℃加热20min,90℃加热15min,冷却条件为:4℃冷却30min;
取本对比例步骤s2制得的蛋白多酚混合液分别测溶液状态的平均粒径、蛋白质表面疏水性,结果分别如图18、图20所示;取本对比例步骤s2制得的蛋白多酚混合液采用流变仪进行升温过程的弹性模量测定,间接考察肌原纤维蛋白的凝胶特性;流变仪升温范围为20~80℃,结果如图22所示;取本实施例步骤s3制得的凝胶强度增强的肌原纤维蛋凝胶分别测的凝胶强度、微观结构,结果分别如图24和图31所示。
对比例10:
提高马草鱼肌原纤维蛋白凝胶特性的方法,包括以下步骤:
s1、制备鱼肌原纤维蛋白溶液:原料鱼取肉,切块,提取肌原纤维蛋白,制备肌原纤维蛋白溶液,于4℃备用;
其中,鱼肌原纤维蛋白溶液的提取方法如下:4℃环境下,取20g鱼肉,加入40ml0.1mol/ltris-nacl溶液,1100rpm转速匀浆1min,10000g离心10min,去掉上清液,取沉淀a;将所述沉淀a加入40ml0.1mol/ltris-nacl溶液,1100rpm转速匀浆1min,10000g离心10min,去掉上清液,取沉淀b;将沉淀b用50ml0.1mol/ltris-nacl溶液溶解,用普通的脱脂棉纱布过滤,取滤液,用离心机10000g离心10min,去掉上清液,取沉淀c,然后用20ml0.6mol/ltris-nacl溶解所述沉淀c,制备成浓度为40mg/ml的肌原纤维蛋白溶液,该肌原纤维蛋白溶液12h内使用;所述鱼肌原纤维蛋白溶液中鱼肌原纤维蛋白的含量依照《双缩脲比色法》进行测定;
s2、制备超声后鱼肌原纤维蛋白溶液:取步骤s1所述浓度为40mg/ml的鱼肌原纤维蛋白溶液,使用超声细胞破碎仪在4℃冷室下超声处理,得超声后的蛋白溶液;
其中,所述的超声处理的蛋白溶液体积100ml,蛋白溶液超声所用容器为直径3cm圆柱形器皿,超声探头置于蛋白溶液中心部位施加超声作用;超声条件:功率400w,超声时间为5min(每超声工作时间2s,停止时间2s,以防超声引起局部升温,所述停止时间不计入超声时间);
s3、熟化:将超声后鱼肌原纤维蛋白溶液进行加热熟化、冷却,得凝胶强度增强的肌原纤维蛋白凝胶;其中,所述的超声后鱼肌原纤维蛋白溶液加热条件为:40℃加热20min,90℃加热15min,冷却条件为:4℃冷却30min
取本对比例步骤s2制得的超声后蛋白溶液分别测溶液状态的平均粒径、蛋白质表面疏水性,结果分别如图18、图20所示;取本对比例步骤s2制得的超声后蛋白溶液采用流变仪进行升温过程的弹性模量测定,间接考察肌原纤维蛋白的凝胶特性;流变仪升温范围为20~80℃,结果如图22所示;取本实施例步骤s3制得的凝胶强度增强的肌原纤维蛋凝胶分别测的凝胶强度、微观结构,结果分别如图24和图32所示。
将第一组(马鲛鱼)各实施例和对比例的蛋白结构、理化性质和凝胶特性进行系统比较,结果如图1~图16所示。
图1中超声协同没食子酸作用下的实施例1~实施例3步骤s3所得的超声后的蛋白多酚复合体系的(溶液状态)平均粒径在380~450nm范围,实施例1步骤s3所得超声后的蛋白多酚复合体系的平均粒径最小,为394.4nm;图2中a为对比例1步骤s1制备的肌原纤维蛋白溶液,b、c、d分别为对比例2~对比例4步骤s2制备的蛋白多酚混合液、e为对比例5步骤s2所得超声后的蛋白溶液(溶液状态),图2所示各样品溶液的平均粒径在380~1800nm范围内,d对比例4步骤s2制备的蛋白多酚混合液平均粒径最大,为1757.4nm,e对比例5步骤s2制备的超声后的蛋白溶液平均粒径最小,为380.9nm。对比图1与图2,可见超声可使聚集的蛋白颗粒分散,聚集蛋白粒径变小;
图3超声协同没食子酸作用下的实例1~实施例3步骤s3所得的超声后的蛋白多酚复合体系的(溶液状态)的表面疏水性显著增加,实施例3步骤s3所得超声后的蛋白多酚复合体系的的表面疏水性最大,达14.0μg;图4中a对比例1步骤s1制备的肌原纤维蛋白溶液表面疏水性最低,为3.5μg,e对比例5步骤s2制备的超声后的蛋白溶液表面疏水性最高,为7.5μg。结果表明没食子酸使蛋白质解折叠,表面疏水性增加,而超声会促进蛋白质进一步解折叠,使表面疏水性大为增加;
图5超声协同没食子酸作用下的实施例1步骤s3所得的超声后的蛋白多酚复合体系的(溶液状态)的弹性模量g’最高,达14137.4pa,远高于其它实施例,表明超声作用下没食子酸对mfp弹性模量的提升呈现低剂量选择性;图6中a为对比例1步骤s1制备的肌原纤维蛋白溶液,b、c、d分别为对比例2~4对比例4步骤s2制备的蛋白多酚混合液、e为对比例5步骤s2所得超声后的蛋白溶液的(溶液状态)的弹性模量的提升呈现典型的剂量效应,d对比例4步骤s2制备的蛋白多酚混合液的弹性模量g’最高,为723.1pa,e对比例5步骤s2制备的超声后的蛋白溶液的弹性模量g’为1339.9pa;
图7中实施例1步骤s4所得的凝胶强度增强的肌原纤维蛋凝胶的(凝胶状态)的凝胶强度达180.2mm*g,高于实施例2和3中步骤s4所得的凝胶强度增强的肌原纤维蛋凝胶的(凝胶状态)的凝胶强度,表明超声作用下高浓度的没食子酸会导致蛋白质提前发生交联,加热时实施例2和3中步骤s4所得的凝胶强度增强的肌原纤维蛋凝胶的(凝胶状态)不能很好地交联,导致低凝胶强度;图8中d对比例4步骤s3制备的凝胶强度增强的肌原纤维蛋凝胶的凝胶强度最大,为102.7mm*g,高于对比例2、3步骤s3制备的凝胶强度增强的肌原纤维蛋凝胶的凝胶强度,e对比例5步骤s3制备的凝胶强度增强的肌原纤维蛋凝胶的凝胶强度为98.8mm*g;
图9中实施例1步骤s4所得的凝胶强度增强的肌原纤维蛋凝胶的(凝胶状态)的凝胶微观结构优于实施例2和3中步骤s4所得的凝胶强度增强的肌原纤维蛋凝胶的(凝胶状态)的微观结构,凝胶孔洞小,且均匀致密;图15中d对比例4步骤s3制备的凝胶强度增强的肌原纤维蛋凝胶的凝胶微观结构优于对比例2、3中步骤s3所得的凝胶强度增强的肌原纤维蛋凝胶(凝胶状态)的微观结构,凝胶孔洞较均匀致密;与对d比例4步骤s3制备的凝胶强度增强的肌原纤维蛋凝胶的凝胶微观结构相比,实施例1步骤s4所得的凝胶强度增强的肌原纤维蛋凝胶的(凝胶状态)的凝胶微观结构更致密;
以上结果表明,单独没食子酸作用下马鲛鱼肌原纤维蛋白溶液的弹性模量g’和肌原纤维蛋白凝胶的凝胶特性随没食子酸剂量增加而升高,而在超声协同没食子酸的实施例中(实施例1、2、3),使用低剂量没食子酸(实施例1)凝胶特性最佳,高剂量没食子酸(实施例2、3)不利于凝胶提升,且超声协同低剂量没食子酸的提升效果远优于单独使用高剂量没食子酸(对比例2、3、4)。
将第二组(草鱼)各实施例和对比例的蛋白结构、理化性质和凝胶特性进行系统比较,结果如图17~图32所示。
图17中超声协同没食子酸作用下的实施例4~实施例6步骤s3所得的超声后的蛋白多酚复合体系的(溶液状态)平均粒径在380~480nm范围,实施例4步骤s3所得超声后的蛋白多酚复合体系的平均粒径最小,为402.9nm;图18中f为对比例6步骤s1制备的肌原纤维蛋白溶液,g、h、i分别为对比例7~对比例9步骤s2制备的蛋白多酚混合液,j为对比例10步骤s2所得超声后的蛋白溶液,图18所示各样品溶液的(溶液状态)平均粒径在380~2000nm范围内,i对比例9步骤s2制备的蛋白多酚混合液平均粒径最大,为1900.1nm,j对比例10步骤s2所得超声后的蛋白溶液的平均粒径最小,为380.9nm。对比图17与图18,可见超声可使聚集的蛋白颗粒分散,聚集蛋白粒径变小;
图19超声协同没食子酸作用下的实施例4~实施例6步骤s3所得的超声后的蛋白多酚复合体系的(溶液状态)的表面疏水性显著增加,实施例6步骤s3所得的超声后的蛋白多酚复合体系的的表面疏水性最大,达17.5μg;图20中f对比例6步骤s1制备的肌原纤维蛋白溶液表面疏水性最低,为4.1μg,j对比例10步骤s2所得超声后的蛋白溶液的(溶液状态)表面疏水性最高,为8.9μg。结果表明没食子酸使蛋白质解折叠,表面疏水性增加,而超声会促进蛋白质进一步解折叠,使表面疏水性大为增加;
图21超声协同没食子酸作用下的实施例4步骤s3所得的超声后的蛋白多酚复合体系的(溶液状态)的弹性模量g’最高,达19054.0pa,远高于实施例5、6步骤s3所得的超声后的蛋白多酚复合体系的(溶液状态)的弹性模量g’,表明超声作用下没食子酸对肌原纤维蛋白弹性模量的提升呈现低剂量选择性;图22中g、h、i分别对应对比例7、8、9中步骤s2制备的蛋白多酚混合液的弹性模量的提升呈现典型的剂量效应,i对比例9步骤s2制备的蛋白多酚混合液的弹性模量g’在对比例7、8、9三组中最高,为745.0pa;j对比例10步骤s2所得超声后的蛋白溶液的(溶液状态)的弹性模量g’为1485.7pa;
图23中实施例4步骤s4所得的凝胶强度增强的肌原纤维蛋凝胶的(凝胶状态)的凝胶强度达230.9mm*g,高于实施例5和6步骤s4所得的凝胶强度增强的肌原纤维蛋凝胶的(凝胶状态)凝胶强度,表明超声作用下高浓度的没食子酸会导致蛋白质提前发生交联,加热时实施例5和6中步骤s4所得的凝胶强度增强的肌原纤维蛋凝胶的(凝胶状态)不能很好地交联,导致低凝胶强度;图24中i对比例9步骤s3所得凝胶强度增强的肌原纤维蛋凝胶(凝胶状态)的凝胶强度为110.9mm*g,高于对比例组7和8步骤s3所得凝胶强度增强的肌原纤维蛋凝胶(凝胶状态)的凝胶强度,j对比例10步骤s3所得凝胶强度增强的肌原纤维蛋凝胶的(凝胶状态)的凝胶强度为119.8mm*g;
图25实施例4步骤s4所得的凝胶强度增强的肌原纤维蛋凝胶的(凝胶状态)的凝胶微观结构优于实施例5和6步骤s4所得的凝胶强度增强的肌原纤维蛋凝胶的(凝胶状态)的微观结构,其凝胶孔洞较小,且均匀致密;图31中i对比例9步骤s3所得凝胶强度增强的肌原纤维蛋凝胶(凝胶状态)的凝胶微观结构优于g、h对比例7、8中步骤s3所得凝胶强度增强的肌原纤维蛋凝胶(凝胶状态)的凝胶微观结构,其凝胶孔洞较均匀致密;与i对比例9步骤s3所得凝胶强度增强的肌原纤维蛋凝胶(凝胶状态)的凝胶微观结构相比,实施例4步骤s4所得的凝胶强度增强的肌原纤维蛋凝胶的(凝胶状态)的凝胶微观结构优于i对比例9步骤s3所得凝胶强度增强的肌原纤维蛋凝胶(凝胶状态)的凝胶微观结构更致密;
以上结果表明,单独没食子酸作用下草鱼肌原纤维蛋白溶液的弹性模量g’和肌原纤维蛋白凝胶的凝胶特性随没食子酸剂量增加而升高,而在超声协同没食子酸的实施例中(实施例4、5、6),使用低剂量没食子酸(实施例4)凝胶特性最佳,高剂量没食子酸(实施例5、6)不利于凝胶提升,且超声协同低剂量没食子酸的提升效果远优于单独使用高剂量没食子酸(对比例7、8、9)。
综合马鲛鱼与草鱼肌原纤维蛋白的实施例和对比例研究结果,本发明的超声协同低剂量没食子酸技术显著降低了没食子酸所需剂量,且凝胶特性提升效果优于原先高剂量没食子酸的提升效果。本发明使用超声技术协同没食子酸作用不仅仅适用于以马鲛鱼为代表的海水鱼,也适用于以草鱼为代表的淡水鱼的肌原纤维蛋白的凝胶特性的提升。
以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明披露的技术范围内,根据本发明的技术方案及其发明构思加以等同替换或改变,都应涵盖在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!