化合物ID45在制备治疗或预防流感病毒药物中的应用的制作方法
本发明涉及化合物ID45在制备治疗或预防流感病毒药物中的应用。
背景技术:
流感病毒属于正粘病毒科(Orthomyxoviridae)流感病毒属。根据病毒粒子核蛋白(NP)和基质蛋白(M)的抗原特性及基因特性的不同,流感病毒分为A、B、C三型。A型流感病毒全基因组由8条大小不等的单股负链RNA组成,分别以节段1至节段8命名。根据病毒粒子表面糖蛋白血凝素(HA)和神经氨酸酶(NA)的不同,A型流感病毒可进一步分为17个H(H1-H17)和10个N(N1-N10)亚型。人流感病毒主要是H1、H2和H3亚型。而目前危害严重的高致病性禽流感多为H5、H7和H9亚型,其中以H5N1亚型致死率最高。
流感病毒的整个生活周期需要在细胞质和细胞核内完成。感染的起始是病毒颗粒表面的刺突HA识别和结合宿主细胞表面的唾液酸受体,与受体结合后病毒粒子以内吞体的形式进入到宿主细胞。在内吞体的酸性pH条件下病毒HA蛋白的构象发生变化,位于轻链N端的融合肽暴露,病毒囊膜与细胞膜融合。低pH环境也致使大量H+经由M2离子通道进入病毒粒子内部,导致M1蛋白与vRNP的解离。两者的共同结果致使病毒粒子的vRNP释放到被感染细胞的胞浆。vRNP随后转到细胞核内进行基因组的复制和转录,复制时病毒首先以自身RNA为模板合成互补RNA(cRNA),然后以cRNA为模板再合成vRNA。转录生成的mRNA由核内转移到胞浆,翻译出病毒的结构蛋白和非结构蛋白。一部分合成蛋白(如NP)需要重新转移到核内与新生成的vRNA组成vRNP,vRNP出核后与其余的病毒蛋白开始组装成新的病毒粒子,新生成的子代病毒通过神经氨酸酶(NA)水解细胞表面的糖蛋白,释放N-乙酰神经氨酸,促使病毒粒子从出芽位点释放出来。
防治流感的基本手段分为疫苗注射以及药物治疗两种。疫苗的有效性建立在制备疫苗的毒株与环境中存在的或者是将要造成流行的流感病毒毒株的相似性,而由于流感病毒极易发生变异,给预测的准确性增加了困难,进而使疫苗防治的效果受到极大的影响。在疫苗有效性难以把握的情况下,抗流感病毒的药物研究就显得尤为重要。而目前FDA批准上市的抗流感药物只有四种:金刚烷胺、金刚乙胺、奥司他韦、扎那米韦。前两种属于M2离子通道抑制剂,通过抑制病毒RNA释放到胞质抑制病毒的复制。后两种属于NA活性抑制剂,通过抑制病毒粒子的释放和扩散抑制病毒的复制。 然而,随着病毒对这些药物抗药性的产生以及这些药物引起的副反应等问题使得新型抗流感病毒药物的研发迫在眉睫。
技术实现要素:
本发明的目的是提供化合物ID45在制备治疗或预防流感病毒药物中的应用。
化合物ID45即为式(Ⅰ)所示化合物。
本发明首先要求保护式(Ⅰ)所示化合物在制备抑制流感病毒的药物中的应用。所述抑制流感病毒可体现为抑制流感病毒复制和/或抑制流感病毒合胞体形成。所述流感病毒可为A型流感病毒,具体可为A型流感病毒H1N1亚型,更具体可为A/WSN/33毒株。
本发明还保护一种抑制流感病毒的药物,其活性成分为式(Ⅰ)所示化合物。所述抑制流感病毒体现为抑制流感病毒复制和/或抑制流感病毒合胞体形成。所述流感病毒可为A型流感病毒,具体可为A型流感病毒H1N1亚型,更具体可为A/WSN/33毒株。
本发明还保护式(Ⅰ)所示化合物在制备药物中的应用;所述药物的功能为如下(a)和/或(b)和/或(c):(a)抗流感病毒;(b)治疗流感;(c)预防流感。所述(a)中,所述流感病毒可为A型流感病毒,具体可为A型流感病毒H1N1亚型,更具体可为A/WSN/33毒株。所述(b)和/或(c)中,所述流感可为A型流感病毒引起的流感,具体可为A型流感病毒H1N1亚型引起的流感,更具体可为A/WSN/33毒株引起的流感。
本发明还保护一种药物,其活性成分为式(Ⅰ)所示化合物;所述药物的功能为如下(a)和/或(b)和/或(c):(a)抗流感病毒;(b)治疗流感;(c)预防流感。所述(a)中,所述流感病毒可为A型流感病毒,具体可为A型流感病毒H1N1亚型,更具体可为A/WSN/33毒株。所述(b)和/或(c)中,所述流感可为A型流感病毒引起的流感,具体可为A型流感病毒H1N1亚型引起的流感,更具体可为A/WSN/33毒株 引起的流感。
本发明对于流感病毒的防治具有重大价值。
附图说明
图1为实施例3的结果。
图2为实施例4的结果。
图3为实施例5的结果。
具体实施方式
以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。
PBS缓冲液(pH7.0-7.2):NaCl 8g、KCl 0.2g、Na2HPO4·12H2O 3.58g、KH2PO40.27g,超纯水定容至1L。
Hela细胞(子宫颈癌细胞):ATCC,编号为CCL-2。293T细胞(人肾上皮细胞):ATCC,编号为CRL-11268。DMEM培养基(Dulbecco’s Modified Eagle’s Medium):Gibco公司。转染试剂PEI(按说明书操作):Polyscience公司。荧光素酶活性测量试剂盒:Promega公司。MTT:Sigma。蛋白酶抑制剂:购自Roche公司。
A/WSN/33流感病毒毒株(简称A/WSN/33毒株):为A型流感病毒H1N1亚型毒株,该毒株记载于“Neumann G1,Watanabe T,Ito H,et al.Generation of influenza A viruses entirely from cloned cDNAs.PNAS,1999(16):9345-9350”一文,公众可从中国科学院微生物学研究所获得。
pREP4载体:记载于“李云芳,张幼怡,侯嵘等.质粒转染对HEK293和DDT1—MF2细胞天然β2—肾上腺素受体表达的影响.北京大学学报:医学版,2001年底5期”一文,公众可从中国科学院微生物学研究所获得。
pHH21载体:参考文献:Generation of influenza A viruses entirely from cloned cDNAs。
实施例1、293T-IAV-Luc细胞的制备
一、pREP4-IAV-Luc质粒的构建
人工合成序列表中序列1所示DNA片段。序列1共由1748个核苷酸组成,第14-58位记为片段1,第59-1711位为萤火虫荧光素酶编码基因(报告基因),第1712-1734 位记为片段2,两端为BsmB I的识别位点序列。其中,片段1和片段2均为流感病毒NP蛋白的启动子,在流感病毒存在的情况下,位于该融合质粒上的该启动子可被启动,萤火虫荧光素酶才能够表达。
用限制性内切酶BsmBI酶切序列表中序列1所示的DNA片段,回收酶切片段后与经过同样酶切的pHH21载体的骨架大片段正向相连,将测序验证正确的中间质粒命名为pHH21-IAV-Luc质粒。将pHH21-IAV-Luc质粒以NheI和PciI内切酶(Takara)酶切,回收酶切片段,以Klenow酶(购自Takara公司)补平末端后连入PvuII内切酶消化的pREP4载体,将测序验证正确的重组质粒命名为pREP4-IAV-Luc。
二、293T-IAV-Luc细胞的制备
将重组质粒pREP4-IAV-Luc导入293T细胞,得到重组细胞,命名为293T-IAV-Luc细胞。
实施例2、化合物ID45的制备和表征
一、化合物ID45的制备
按照如下文献中的方法制备化合物ID45:Antiviral Activity of an Isatin Derivative via Induction of PERK-Nrf2-Mediated Suppression of Cap-Independent Translation.dx.doi.org/10.1021/cb400775z|ACS Chem.Biol.2014,9,1015-1024。
二、化合物ID45的表征
化合物ID45的形态为:红色晶体。
化合物ID45的表征数据见表1。
表1化合物ID45的1H NMR数据
以上表征数据表明,化合物ID45的化学式为C22H13Br2F2N3O2,分子量为549.16,结构式如下:
将化合物ID45溶于DMSO,得到浓度为10μM的ID45溶液。后续实施例中的化合物ID45均是以ID45溶液的形式加入的。
实施例3、化合物ID45抑制H1N1亚型流感病毒的复制
1、将A/WSN/33毒株、DMEM培养基和化合物ID45混合,得到化合物ID45浓度为10μmol/L的混合液。
2、将293T-IAV-Luc细胞均匀铺于96孔板上(每孔20000个细胞),37℃静置培养12小时,弃上清,用PBS缓冲液清洗孔中的细胞。
3、完成步骤2后,取所述96孔板,加入步骤1得到的混合液(MOI=0.5),37℃静置孵育1小时,弃上清。
4、完成步骤3后,取所述96孔板,加入含10%(体积比)胎牛血清和10μmol/L化合物ID45的DMEM培养基,37℃静置培养12小时,弃上清,用PBS缓冲液清洗孔中的细胞。
5、完成步骤4后,取所述96孔板,加入荧光素酶活性测量试剂盒中的裂解液,37℃静置孵育30分钟,取上清。
6、取步骤5得到的上清,采用荧光素酶活性测量试剂盒检测荧光素酶报告基因的表达水平。
将DMSO作为化合物ID45的阴性对照。
进行三次重复试验,结果取平均值。
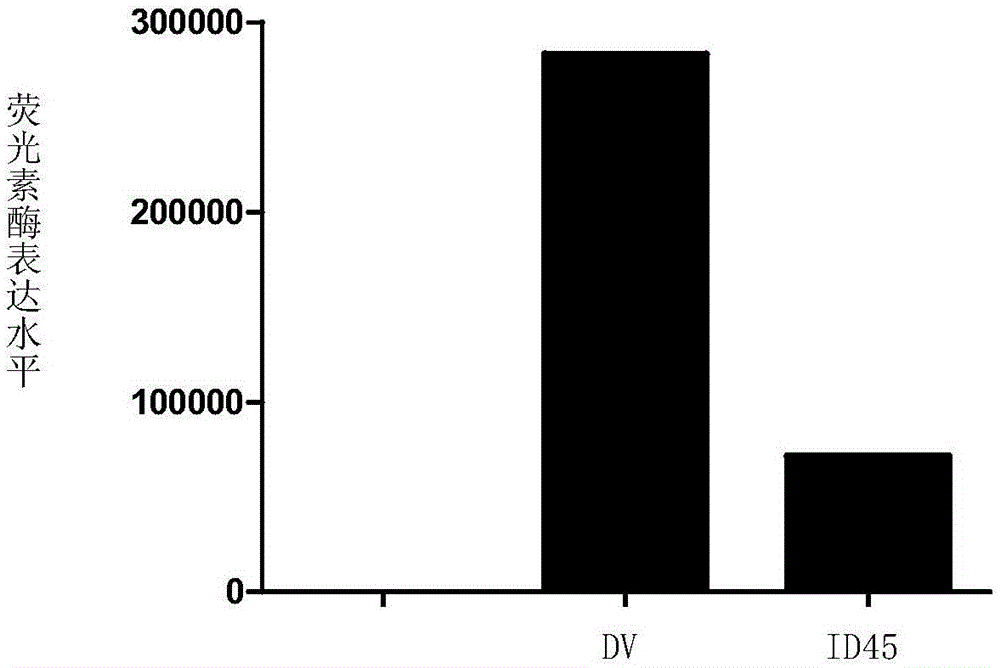
结果见图1(图1中,DV代表阴性对照)。结果表明,化合物ID45可以抑制流感病毒的复制。
实施例4、化合物ID45抑制HA假病毒的活性
一、制备HA假病毒
将293T细胞接种至细胞培养皿,达到80%密度后借助转染试剂PEI共转染6μg pNLLucE-R-HIV-Luc质粒、6μg pEWSN-HA质粒和6μg pCAGGS-NA质粒,6小时后更换为含10%(体积分数)胎牛血清的DMEM完全培养基,48小时后将整个培养体系转移15ml离心管中,吹散细胞,冻融一次后用0.22μm滤膜过滤,收集滤液,即为HA假病毒的病毒液,-80℃保存。
提及pNLLucE-R-HIV-Luc质粒、pEWSN-HA质粒和pCAGGS-NA质粒的文献如下:Junjie Zhang,Ting Liu,Xiaomei Tong,Jinghua Yan,Xin Ye,et al.Identification of novel virus inhibitors by influenza A virus specific reporter cell screening.Antivirus Research.2011;93:48-54.。
二、化合物ID45抑制HA假病毒的活性
1、将293T-IAV-Luc细胞均匀铺于24孔板上(每孔16万个细胞),37℃静置培养15小时,弃上清。
2、完成步骤1后,取所述24孔板,每孔加入100μL步骤一制备的HA假病毒的病毒液和400μl含化合物ID45的DMEM培养基(使得化合物ID45在体系中的浓度为10μM),37℃静置孵育18小时,用PBS缓冲液清洗孔中的细胞。
3、完成步骤2后,取所述96孔板,加入荧光素酶活性测量试剂盒中的裂解液,37℃静置孵育30分钟,取上清。
4、取步骤3得到的上清,采用荧光素酶活性测量试剂盒检测荧光素酶报告基因的表达水平。
将DMSO作为化合物ID45的阴性对照。
进行三次重复试验,结果取平均值。
结果见图2(图1中,DV代表阴性对照)。化合物ID45具有抑制HA假病毒复制 的活性。
实施例5、化合物ID45抑制流感病毒合胞体形成
1、取6孔板,接种Hela细胞(每个孔16万个细胞),37℃静置培养12小时,细胞达到约50%汇合。
2、完成步骤1后,取所述6孔板,每孔转染1μg pEWSN-HA质粒,然后37℃静置培养30h,吸弃上清。
3、完成步骤2后,取所述6孔板,加入含10μM化合物ID45的DMEM培养基,37℃静置孵育15min,吸弃上清。
4、完成步骤3后,取所述6孔板,加入含10μM化合物ID45的PBS缓冲液,37℃静置孵育3min,吸弃上清。
5、完成步骤4后,取所述6孔板,加入含10%胎牛血清的DMEM培养基,37℃静置孵育4小时,使合胞体形成。
6、完成步骤5后,用4%的多聚甲醛固定10min,然后用结晶紫溶液染色镜下观察结果。
将DMSO作为化合物ID45的阴性对照。
结果见图3。化合物ID45可以抑制流感病毒合胞体形成。
实施例6、细胞毒性试验
1、将293T-IAV-Luc细胞铺于96孔板(每孔10000个细胞),37℃静置培养14小时,弃上清。
2、完成步骤1后,取所述96孔板,加入含梯度浓度化合物ID45的DMEM培养基,37℃静置培养48小时,弃上清。
3、完成步骤2后,取所述96孔板,加入含0.5mg/ml MTT的DMEM培养基,37℃静置孵育4小时,弃上清。
4、完成步骤3后,取所述96孔板,每孔加入100μl DMSO,避光裂解10min,然后采用酶标仪检测570nm处的吸光值。
CC50(50%的细胞发生病变时的药物浓度)=34.5μM。
- 还没有人留言评论。精彩留言会获得点赞!