用于修复尿道损伤的生物修复材料及其制备方法与应用与流程
本发明涉及生物医学领域中用于修复尿道损伤的生物修复材料及其制备方法与应用。
背景技术:
尿道损伤是一种常见的泌尿系统疾病,通常分为尿道内损伤和外损伤。尿道内损伤绝大多数是在应用经尿道器械操作或排出异物(如结石)时发生,少数由于异物插入尿道而引起;尿道误注某些化学药物如硝酸银、硫酸铜、石炭酸等可引起化学灼伤。经尿道行电切除术时可致尿道电灼伤。尿道外暴力损伤较多见,可为贯通伤或闭合伤。前者主要见于战场,尿道被火器或利器所穿破。受伤部位大多在球、膜部。海绵体部和前列腺部则少见。闭合性尿道损伤,在战时和平时均可见到。会阴部骑跨伤或踢伤时受损部位多见于球部尿道,而伴骨盆骨折,时常伴膜部尿道损伤。
严重的尿道损伤往往需要重建手术来恢复其结构和功能。由于缺乏适当的重建材料,目前在临床上进行尿道重建始终非常困难,尤其是大面积损伤尿道的重建在临床治疗上仍面临挑战,目前阴茎皮肤和粘膜是最常用的尿道重建替代物,不仅造成病人二次损伤,而且自体组织替代物随着时间推移常常会萎缩,造成尿道再狭窄及其他一些并发症。据统计,治疗五年内的并发症发生率超过21%,包括尿道再狭窄、尿道瘘、感染、勃起功能障碍等。而且如果尿道损伤长度超过4厘米,自体组织移植的尿道成形术往往不能成功。
技术实现要素:
本发明所要解决的技术问题是如何修复损伤尿道。
为解决上述技术问题,本发明首先提供了能修复尿道损伤的生物修复材料。
本发明所提供的生物修复材料,为用胶原结合血管内皮生长因子(CBD-VEGF)修饰胶原支架材料得到的生物材料;
所述胶原结合血管内皮生长因子为下述A1)或A2)或A3)的蛋白质:
A1)氨基酸序列为SEQ ID No.1的第1-184位氨基酸所示的蛋白质;
A2)在SEQ ID No.1的第1-184位氨基酸序列中经过取代和/或缺失和/或添加一个或几个氨基酸残基得到的具有相同功能的由A1)衍生的蛋白质;
A3)在A1)或A2)的N端或/和C端连接标签得到的融合蛋白质。
其中,SEQ ID No.1由192个氨基酸组成,SEQ ID No.1的第1-166位氨基酸为血管内皮生长因子的序列;SEQ ID No.1的第178-184位氨基酸为胶原结合域的序列;SEQ ID No.1的第187-192位氨基酸为His标签的序列。
上述A2)中的蛋白质可人工合成,也可先合成其编码基因,再进行生物表达得到。上述A2)中的蛋白质的编码基因可通过将序列表中SEQ ID No.2的第1-184位核苷酸所示的DNA序列中缺失一个或几个氨基酸残基的密码子,和/或进行一个或几个碱基对的错义突变得到。上述A3)中的蛋白质可在SEQ ID No.2的第1-184位核苷酸所示的DNA序列的5′端和/或3′端连上标签的编码序列得到。所述标签可为His标签。
其中,SEQ ID No.2由576个核苷酸组成。SEQ ID No.2的第1-498位核苷酸编码SEQ ID No.1的第1-166位氨基酸所示的血管内皮生长因子。
上述生物修复材料中,所述胶原支架材料可由如下方法制备:
1)用氢氧化钠水溶液处理离体的动物皮肤,得到氢氧化钠处理的材料;
2)用去污剂处理所述氢氧化钠处理的材料,得到去污剂处理的材料;
3)除去所述去污剂处理的材料中的杂质,得到所述胶原支架材料。
上述生物修复材料中,所述生物修复材料可为用于修复尿道损伤的生物修复材料。所述标签可为His标签。
所述胶原支架材料可通过钴源照射灭菌。
所述1)可重复1-4次。所述氢氧化钠水溶液中氢氧化钠的浓度可为2-5mol/L。
所述胶原结合血管内皮生长因子可通过表达含有所述胶原结合血管内皮生长因子的编码基因的重组细胞得到;
所述胶原结合血管内皮生长因子的编码基因可为如下a1)或a2)或a3)所示的基因:
a1)核苷酸序列是序列表中SEQ ID No.2的第1-552位或SEQ ID No.2的cDNA分子或DNA分子;
a2)与a1)限定的核苷酸序列具有75%或75%以上同一性,且编码所述胶原结合血管内皮生长因子的cDNA分子或基因组DNA分子;
a3)在严格条件下与a1)限定的核苷酸序列杂交,且编码所述胶原结合血管内皮生长因子的cDNA分子或基因组DNA分子。
其中,所述核酸分子可以是DNA,如cDNA、基因组DNA或重组DNA;所述核酸分子也可以是RNA,如mRNA或hnRNA等。SEQ ID No.2由576个核苷酸组成。SEQ ID No.2的第1-498位核苷酸编码SEQ ID No.1的第1-166位氨基酸所示的血管内皮生长因子;SEQ ID No.2的第532-552位核苷酸编码SEQ ID No.1的第178-184位氨基酸所示的胶原结合域;SEQ ID No.2的第559-576位核苷酸编码SEQ ID No.1的第187-192位氨基酸所示的His标签。
本领域普通技术人员可以很容易地采用已知的方法,例如定向进化和点突变的方法,对本发明的编码所述胶原结合血管内皮生长因子的核苷酸序列进行突变。那些经 过人工修饰的,具有与本发明分离得到的所述胶原结合血管内皮生长因子的核苷酸序列75%或者更高同一性的核苷酸,只要编码所述胶原结合血管内皮生长因子且具有相同功能,均是衍生于本发明的核苷酸序列并且等同于本发明的序列。
这里使用的术语“同一性”指与天然核酸序列的序列相似性。“同一性”包括与本发明的编码SEQ ID No.1的第1-184位或SEQ ID No.1所示的氨基酸序列组成的蛋白质的核苷酸序列具有75%或更高,或85%或更高,或90%或更高,或95%或更高同一性的核苷酸序列。同一性可以用肉眼或计算机软件进行评价。使用计算机软件,两个或多个序列之间的同一性可以用百分比(%)表示,其可以用来评价相关序列之间的同一性。
上述生物修复材料中,所述严格条件是在2×SSC,0.1%SDS的溶液中,在68℃下杂交并洗膜2次,每次5min,又于0.5×SSC,0.1%SDS的溶液中,在68℃下杂交并洗膜2次,每次15min;或,0.1×SSPE(或0.1×SSC)、0.1%SDS的溶液中,65℃条件下杂交并洗膜。
上述75%或75%以上同一性,可为80%、85%、90%或95%以上的同一性。
上述生物修复材料中,所述动物可为哺乳动物;所述去污剂为吐温-80或其水溶液、或吐温-20或其水溶液、或Triton X-100或其水溶液。
上述生物修复材料中,所述哺乳动物可为猪、牛、羊、马或兔。
上述生物修复材料中,所述吐温-80水溶液中吐温-80的质量百分浓度可为1-5%;
所述吐温-20水溶液中吐温-20的质量百分浓度可为1-5%;
所述Triton X-100水溶液中Triton X-100的质量百分浓度可为1-5%。
上述生物修复材料中,所述胶原支架材料的制备方法还可包括在用所述氢氧化钠水溶液处理所述离体的动物皮肤前去除所述动物皮肤粘附的肌肉组织和/或脂肪。
上述生物修复材料中,所述用氢氧化钠水溶液处理所述离体的动物皮肤的时间可为10-60分钟;
和/或,
所述用去污剂处理所述氢氧化钠处理的材料的时间可为1-5小时。
上述生物修复材料中,所述除去所述去污剂处理的材料中的杂质可为用去热原水清洗去污剂处理的材料,得到所述胶原支架材料。
上述生物修复材料中,所述生物修复材料可按照如下方法制备:将所述胶原支架材料浸泡在含有所述胶原结合血管内皮生长因子的溶液中得到所述生物修复材料。
上述生物修复材料中,所述胶原支架材料与所述溶液中所述胶原结合血管内皮生长因子的比例关系可为1cm2:(5-15)μg,如1cm2:10μg。
上述生物修复材料中,所述浸泡的时间可为20-40分钟,如30分钟。
为解决上述技术问题,本发明还提供了所述生物修复材料的制备方法。
本发明所提供的所述生物修复材料的制备方法,包括用所述胶原结合血管内皮生长因子修饰所述胶原支架材料得到所述生物修复材料。
上述方法中,所述用所述胶原结合血管内皮生长因子修饰所述胶原支架材料得到的生物材料的方法可包括将所述胶原支架材料浸泡在含有所述胶原结合血管内皮生长因子的溶液中得到所述生物修复材料。
上述方法中,所述胶原支架材料与所述溶液中所述胶原结合血管内皮生长因子的比例关系可为1cm2:(5-15)μg,如1cm2:10μg。
上述方法中,所述浸泡的时间可为20-40分钟,如30分钟。
上述方法中,所述方法还可包括利用所述胶原支架材料的制备方法制备所述胶原支架材料。
上述处理的温度均可为2-8℃,优选是4℃。
为解决上述技术问题,本发明还提供了用于制备所述生物修复材料的成套试剂。
本发明所提供的用于制备所述生物修复材料的成套试剂,为下述M或N:
M、用于制备所述生物修复材料的成套试剂,由所述胶原结合血管内皮生长因子和所述胶原支架材料组成;
N、用于制备所述生物修复材料的成套试剂,由与所述胶原结合血管内皮生长因子相关的生物材料和所述胶原支架材料组成;
所述与所述胶原结合血管内皮生长因子相关的生物材料,为B1)至B16)中的任一种:
B1)编码所述胶原结合血管内皮生长因子的核酸分子;
B2)含有B1)所述核酸分子的表达盒;
B3)含有B1)所述核酸分子的重组载体;
B4)含有B2)所述表达盒的重组载体;
B5)含有B1)所述核酸分子的重组微生物;
B6)含有B2)所述表达盒的重组微生物;
B7)含有B3)所述重组载体的重组微生物;
B8)含有B4)所述重组载体的重组微生物;
B9)含有B1)所述核酸分子的转基因动物细胞系;
B10)含有B2)所述表达盒的转基因动物细胞系;
B11)含有B3)所述重组载体的转基因动物细胞系;
B12)含有B4)所述重组载体的转基因动物细胞系;
B13)含有B1)所述核酸分子的转基因植物细胞系;
B14)含有B2)所述表达盒的转基因植物细胞系;
B15)含有B3)所述重组载体的转基因植物细胞系;
B16)含有B4)所述重组载体的转基因植物细胞系。
上述成套试剂中,B1)所述核酸分子可为所述胶原结合血管内皮生长因子的编码基因。
上述成套试剂中,B2)所述的含有编码所述胶原结合血管内皮生长因子的核酸分子的表达盒,是指能够在宿主细胞中表达所述胶原结合血管内皮生长因子的DNA,该DNA不但可包括启动所述胶原结合血管内皮生长因子基因转录的启动子,还可包括终止所述胶原结合血管内皮生长因子基因转录的终止子。进一步,所述表达盒还可包括增强子序列。
可用现有的表达载体构建含有所述胶原结合血管内皮生长因子基因表达盒的重组载体。
上述成套试剂中,所述载体可为质粒、黏粒、噬菌体或病毒载体。
上述成套试剂中,所述微生物可为酵母、细菌、藻或真菌,如大肠杆菌。所述大肠杆菌具体可为BL21(DE3)。
上述成套试剂中,所述转基因植物细胞系和转基因动物细胞系均不包括繁殖材料。
为解决上述技术问题,本发明还提供了下述任一应用:
X1、所述生物修复材料在制备促进尿道损伤修复的材料中的应用;
X2、所述生物修复材料在制备促进尿道血管再生的材料中的应用;
X3、所述生物修复材料在制备促进尿道上皮再生的材料中的应用;
X4、所述生物修复材料在制备促进尿道平滑肌再生的材料中的应用;
X5、所述成套试剂在制备生物修复材料中的应用;
X6、所述成套试剂在制备促进尿道损伤修复的材料中的应用;
X7、所述成套试剂在制备促进尿道血管再生的材料中的应用;
X8、所述成套试剂在制备促进尿道上皮再生的材料中的应用;
X9、所述成套试剂在制备促进尿道平滑肌再生的材料中的应用;
X10、所述方法在制备生物修复材料中的应用;
X11、所述方法在制备促进尿道损伤修复的材料中的应用;
X12、所述方法在制备促进尿道血管再生的材料中的应用;
X13、所述方法在制备促进尿道上皮再生的材料中的应用;
X14、所述方法在制备促进尿道平滑肌再生的材料中的应用。
上述应用中,所述尿道可为哺乳动物尿道。所述哺乳动物可为大鼠。
实验证明,本发明的生物修复材料可以修复尿道的损伤,并促进尿道上皮、尿道 血管及尿道平滑肌的再生与尿道功能的恢复:
(1)植入生物修复材料的术后实验组比格犬中出现排尿困难,植入胶原支架材料的术后对照组比格犬全部出现了排尿困难症状。
(2)术后对照组比格犬和植入生物修复材料的术后实验组比格犬的平均再造尿道直径分别为0.92±0.13mm和1.86±0.19mm,术后实验组比格犬的平均再造尿道直径显著大于术后对照组比格犬的平均再造尿道直径(p<0.05);术后对照组比格犬出现尿道瘘,术后实验组比格犬均没有尿道瘘的出现。
(3)术前实验组比格犬尿道的最大尿道压在阴茎骨包绕的尿道部位;术后实验组比格犬再造尿道的尿道压普遍显著升高,甚至高于术前实验组比格犬尿道的阴茎骨包绕的尿道部位,而新的最大尿道压通常位于再造尿道和原尿道连接部位。
(4)植入生物修复材料的术后实验组比格犬的没有后尿道扩张出现,而术后对照组比格犬出现后尿道扩张。术后实验组比格犬再造尿道的平均长度是4.6±0.3cm,显著高于术后对照组比格犬的再造尿道的平均长度3.4±0.8cm(p<0.05);实验组比格犬的再造尿道软而光滑,而对照组比格犬则硬而粗糙,且对照组比格犬的再造尿道周围出现更多的瘢痕组织。术后对照组有80%的比格犬出现尿道闭塞,术后实验组比格犬均没有出现尿道闭塞。
(5)植入生物修复材料的术后实验组比格犬的尿道上皮细胞覆盖了整个再造尿道,而对照组比格犬的尿道上皮细胞层在再造尿道中间部分常是不完整的,且对照组比格犬的尿道上皮细胞层比实验组薄。
(6)植入生物修复材料的术后实验组比格犬再造尿道的上皮由8-10层上皮细胞组成,覆盖整个再造尿道,细胞排列整齐,具有正常尿道组织上皮细胞的形态特征;而对照组比格犬再造尿道的上皮由3-5层上皮细胞组成,细胞排列松散,未能完整覆盖再造尿道,且有尿道瘘出现。实验组比格犬再造尿道的上皮层的厚度为99.60±11.37μm,与健康雄性比格犬尿道上皮层厚度(95.32±22.41μm)无显著差异(P>0.05),但与比格犬尿道损伤处的上皮层厚度(42.66±3.77μm)有显著性差异(P<0.01)。
(7)术后对照组比格犬尿道重建处的血管平均荧光强度为0.026±0.003,术后实验组比格犬尿道重建处的血管平均荧光强度为0.038±0.008,健康雄性比格犬尿道的血管平均荧光强度为0.041±0.008。术后实验组比格犬尿道重建处的血管平均荧光强度高于术后对照组比格犬尿道重建处的血管平均荧光强度,并且二者具有显著性差异(P<0.01)。
(8)术后对照组比格犬尿道重建处的平滑肌组织平均荧光强度2.58±1.50,术后实验组比格犬尿道重建处的平滑肌组织平均荧光强度为65.04±4.85,术后实验组 比格犬尿道重建处的平滑肌组织平均荧光强度高于术后对照组比格犬尿道重建处的平滑肌组织平均荧光强度,并且二者具有显著性差异(P<0.01)。
实验证明,本发明的生物修复材料可以用来修复尿道损伤。
附图说明
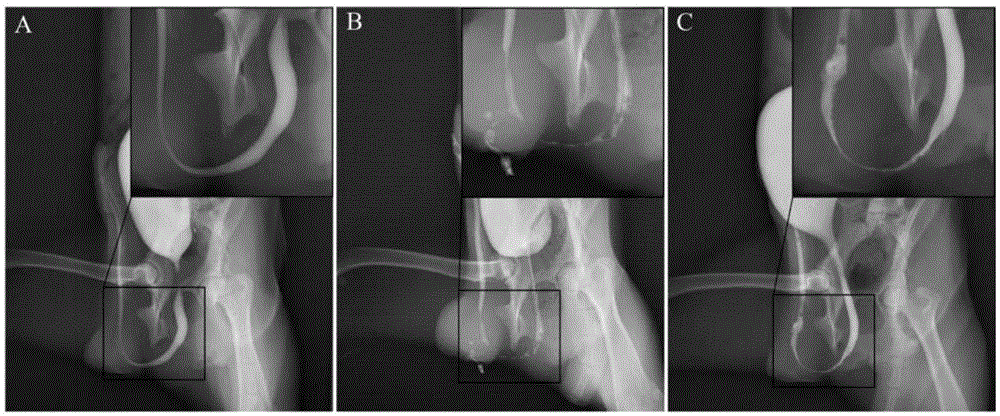
图1为术后6个月对照组比格犬和术后6个月实验组比格犬的逆行尿道造影。其中,A为未经行任何手术的健康雄性比格犬;B为术后6个月对照组比格犬;C为术后6个月实验组比格犬。
图2为术前和术后6个月的实验组比格犬的尿动力学测定。其中,A为术前实验组比格犬,B为术后6个月的实验组比格犬。
图3为术后6个月实验组比格犬和术后6个月对照组比格犬泌尿系统的形态观察。其中A为术后6个月对照组比格犬的完整泌尿系统;B为术后6个月对照组比格犬的尿道;C为术后6个月对照组纵形剖开后的比格犬的再造尿道;D为术后6个月实验组比格犬的完整泌尿系统;E为术后6个月实验组比格犬的尿道;F为术后6个月实验组纵形剖开后的比格犬的再造尿道。
图4为术后6个月实验组比格犬和术后6个月对照组比格犬尿道重建处的HE染色结果。其中,A为未经行任何手术的健康雄性比格犬的尿道的横向切片,B为术后6个月实验组比格犬尿道重建处的横向切片,C为术后6个月对照组比格犬尿道重建处的横向切片,D为未经行任何手术的健康雄性比格犬的尿道的纵向切片,E为术后6个月实验组比格犬尿道重建处的纵向切片,F为术后6个月对照组比格犬尿道重建处的纵向切片。
图5为术后6个月实验组比格犬和术后6个月对照组比格犬尿道重建处的免疫荧光染色结果。其中,A为未经行任何手术的健康雄性比格犬的尿道的横向切片,B为术后6个月实验组比格犬尿道重建处的横向切片,C为术后6个月对照组比格犬尿道重建处的横向切片,D为未经行任何手术的健康雄性比格犬的尿道的纵向切片,E为术后6个月实验组比格犬尿道损重建的纵向切片,F为术后6个月对照组比格犬尿道重建处的纵向切片。
图6为术后6个月实验组比格犬和术后6个月对照组比格犬尿道重建处的上皮层的厚度。
图7为术后6个月实验组比格犬和术后6个月对照组比格犬尿道重建处的血管再生情况。其中,A为未经行任何手术的健康雄性比格犬的尿道的横向切片,B为术后6个月实验组比格犬尿道重建处的横向切片,C为术后6个月对照组比格犬尿道重建处的横向切片,D为未经行任何手术的健康雄性比格犬的尿道的纵向切片,E为术后6个月实验组比格犬尿道重建处的纵向切片,F为术后6个月对照组比格犬尿道重建处 的纵向切片。
图8为术后6个月实验组比格犬和术后6个月对照组比格犬尿道重建处的血管组织平均荧光强度。
图9为术后6个月实验组比格犬和术后6个月对照组比格犬尿道重建处的平滑肌再生情况。其中,A为未经行任何手术的健康雄性比格犬的尿道的横向切片,B为术后6个月实验组比格犬尿道重建处的横向切片,C为术后6个月对照组比格犬尿道重建处的横向切片,D为未经行任何手术的健康雄性比格犬的尿道的纵向切片,E为术后6个月实验组比格犬尿道重建处的纵向切片,F为术后6个月对照组比格犬尿道重建处的纵向切片。
图10为术后6个月实验组比格犬和术后6个月对照组比格犬尿道损重建的平滑肌组织平均荧光强度。
具体实施方式
下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。
下述实施例中的实验方法,如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
下述实施例中的比格犬为四川养麝研究所产品。
实施例1、生物修复材料的制备
本发明所提供的生物修复材料为用胶原结合血管内皮生长因子(CBD-VEGF)修饰胶原支架材料得到的生物材料;胶原结合血管内皮生长因子为氨基酸序列是序列表中SEQ ID No.1的蛋白质,其编码序列为序列表中SEQ ID No.2。
其中,SEQ ID No.1的第1-166位氨基酸为血管内皮生长因子的序列,其编码序列为SEQ ID No.2的第1-498位核苷酸;SEQ ID No.1的第178-184位氨基酸为胶原结合域的序列,其编码序列为SEQ ID No.2的第532-552位核苷酸;SEQ ID No.1的第187-192位氨基酸为His标签的序列,其编码序列为SEQ ID No.2的第559-576位核苷酸。
一、胶原结合血管内皮生长因子(CBD-VEGF)的制备
将中国专利CN 101671396B的重组表达载体pET28a-VEGF-CBD-6His导入大肠杆菌BL21(DE3)(Novagen产品,货号为VDN0199)中,得到重组菌,将该重组菌命名为BL21-T-CBD-VEGF,BL21-T-CBD-VEGF能表达SEQ ID No.1所示的CBD-VEGF。
将BL21-T-CBD-VEGF接种至LB培养基中进行培养,得到BL21-T-CBD-VEGF培养液;按2%的接种量将BL21-T-CBD-VEGF培养液转接至LB培养基中扩大培养后加入IPTG,得到诱导前液,诱导前液中IPTG的浓度为1mM;将诱导前液在37℃下培养5小时,得 到BL21-T-CBD-VEGF诱导液。将BL21-T-CBD-VEGF诱导液在8000rpm、4℃下进行离心,弃上清液,得到BL21-T-CBD-VEGF菌体。将BL21-T-CBD-VEGF菌体进行超声并进行离心,得到含有CBD-VEGF的上清液,超声条件为(超声5s,工作5s,共15min,功率100w)。
将CBD-VEGF的上清液进行镍柱亲和层析纯化目的蛋白CBD-VEGF,最后将目的蛋白CBD-VEGF收集在PBS中,得到CBD-VEGF溶液,CBD-VEGF溶液中CBD-VEGF的浓度为300μg/ml,-80℃下保存。
聚丙烯酰胺凝胶电泳检测CBD-VEGF溶液中的目的蛋白CBD-VEGF,结果显示,CBD-VEGF溶液中含有预期蛋白大小相符的目的蛋白CBD-VEGF。
二、胶原支架材料的制备
胶原支架材料按照如下的胶原支架材料的制备方法制备:
1)用2-5mol/L氢氧化钠水溶液处理动物体表皮肤,得到氢氧化钠处理的材料;
2)用去污剂处理氢氧化钠处理的材料,得到去污剂处理的材料;
3)除去去污剂处理的材料中的杂质,得到胶原支架材料。
具体制备方法如下:
a1)剥取猪体表皮肤;机械去掉猪体表皮肤表皮下附带成分(如肌肉、脂肪等)得到猪上皮组织;去离子水清洗猪上皮组织,得到清洗后的猪上皮组织;
a2)将步骤a1)得到的清洗后的猪上皮组织完全浸泡在2-5mol/L氢氧化钠水溶液中,处理30分钟,弃液体,重复3次,得到氢氧化钠处理的材料;
a3)将步骤a2)得到的氢氧化钠处理的材料完全浸泡在吐温-80水溶液(吐温-80水溶液吐温-80的质量百分浓度为3%)中,处理3小时,弃液体,得到去污剂处理的材料;
a4)用去热原水充分清洗步骤a3)得到的去污剂处理的材料,去掉化学成分残留,得到胶原支架材料,将其保存于生理盐水中;
a5)用生理盐水漂洗步骤a4)得到的胶原支架材料2小时,然后于冻干机中冷冻干燥,最后用钴源照射后进行密封保存。
三、生物修复材料的制备
利用步骤一得到的CBD-VEGF和步骤二得到的胶原支架材料制备生物修复材料,具体方法如下:
选取步骤二得到的胶原支架材料,将其浸泡在步骤一得到的CBD-VEGF溶液中,胶原支架材料与CBD-VEGF溶液中CBD-VEGF的比例关系为1cm2:10μg,室温孵育30分钟,使CBD-VEGF溶液中的CBD-VEGF被胶原支架材料吸收,得到生物修复材料。
实施例2、生物修复材料对尿道损伤的修复
实验重复三次,每次重复实验的具体步骤如下:
1、动物分组
将10只12-14个月的健康雄性比格犬(平均体重11±1.2kg)随机分为两组,即对照组和实验组,每组5只。
2、手术过程:
对实验组的每只比格犬用腹腔注射戊巴比妥钠(30mg戊巴比妥钠/kg体重)进行麻醉,仰卧位固定于手术台上。纵行切开会阴部暴露尿道海绵体,将阴茎骨和尿道球部之间的尿道海绵体从阴茎海绵体部切除。通过将整个前尿道切除5cm来制作大面积尿道缺陷模型。实施例1的生物修复材料用可吸收线通过间断缝合术与自体尿道两端吻合。在缝合之前用12F的导管通过新建的尿道插入膀胱中,用灭菌丝线将该导管与尿道口固定。术后两周将12F的导管去除,得到术后实验组比格犬。观察比格犬有无任何排尿困难、膀胱膨胀、胃肠症状或其他不良状态。
按照上述方法,将实验组替换为对照组,并将实施例1的生物修复材料替换为实施例1的胶原支架材料,其他步骤均不变,得到术后对照组比格犬。
3、术后排尿状况
观察步骤2的术后实验组和对照组比格犬的排尿情况,结果显示,5只术后对照组比格犬都出现了排尿困难症状。5只术后实验组比格犬中,有两只没有出现排尿困难,一只出现轻微排尿困难,两只出现排尿困难。
4、逆行尿道造影术
将步骤2的术后实验组与对照组比格犬,在正常相同条件下喂养6个月,得到术后6个月对照组比格犬和术后6个月实验组比格犬。对术后6个月对照组比格犬和术后6个月实验组比格犬行逆行尿道造影术,将未经行任何手术的健康雄性比格犬作为对照。结果显示(图1),健康雄性比格犬尿道光滑通畅(图1中A),平均尿道直径为5.94±0.65mm;术后6个月对照组比格犬(图1中B)和术后6个月实验组比格犬(图1中C)都出现不同程度的尿道狭窄,术后6个月对照组比格犬尿道狭窄更严重,术后6个月对照组比格犬和术后6个月实验组比格犬的平均再造尿道直径分别为0.92±0.13mm和1.86±0.19mm,术后6个月实验组比格犬的平均再造尿道直径显著大于术后6个月对照组比格犬的平均再造尿道直径(p<0.05)。术后6个月对照组比格犬出现尿道瘘,出现尿道瘘的比格犬占术后6个月对照组比格犬的60%;术后6个月实验组比格犬均没有尿道瘘的出现。说明本发明的生物修复材料可以修复尿道的损伤,并促进尿道的再生。
5、尿动力学
由于严重尿道狭窄会致使尿动力测量导管无法通过再造尿道插入膀胱,所以无法 测量术后6个月对照组比格犬的尿动力学。对步骤4的术前和术后6个月的实验组比格犬进行尿动力学测试,结果如图2所示。结果显示,术前实验组比格犬尿道的最大尿道压在阴茎骨包绕的尿道部位(图2中A);术后实验组比格犬再造尿道的尿道压普遍显著升高,甚至高于术前实验组比格犬尿道的阴茎骨包绕的尿道部位,而新的最大尿道压通常位于再造尿道和原尿道连接部位(图2中B)。充盈性旁观测压表明最大膀胱容量和膀胱顺应性在术后6个月实验组比格犬和未经行任何手术的健康雄性比格犬间没有显著性差异,表明用实施例1的生物修复材料修复尿道损伤后尽管有尿道狭窄出现,但对膀胱功能几乎没有影响。说明,本发明的生物修复材料可以修复尿道的损伤,并促进损伤尿道功能的恢复。
6、再造尿道的形态观察
对步骤4的术后6个月对照组比格犬和术后6个月实验组比格犬的泌尿系统进行形态观察,结果如图3所示。术后6个月对照组比格犬和术后6个月实验组比格犬的上泌尿道都没有出现扩张和肾盂积水,而术后6个月对照组比格犬出现后尿道扩张。术后6个月实验组比格犬再造尿道的平均长度是4.6±0.3cm,显著高于术后6个月对照组比格犬的再造尿道的平均长度3.4±0.8cm(p<0.05),表明对照组比格犬的尿道出现了严重的萎缩。从形态上来看,实验组比格犬的再造尿道软而光滑,而对照组比格犬则硬而粗糙,且对照组比格犬的再造尿道周围出现瘢痕组织。术后6个月对照组比格犬出现尿道瘘,出现尿道瘘的比格犬占术后6个月对照组比格犬的60%;术后6个月实验组比格犬均没有尿道瘘的出现。术后6个月对照组有80%的比格犬出现尿道闭塞,术后6个月实验组比格犬均没有出现尿道闭塞。
表明,本发明的生物修复材料可以修复尿道的损伤,并促进尿道的再生。
7、组织学观察
对步骤4的术后6个月对照组比格犬和术后6个月实验组比格犬的再造尿道进行HE染色和组织切片。具体方法如下:在再造尿道的中心处将其一分为二,再造尿道的一半用于HE染色,另一半用于免疫用光染色。
每只比格犬的尿道HE染色的方法均为:将再造尿道的一半置于4%中性甲醛中固定24h,石蜡包埋,连续切片,片厚2.5μm,脱蜡,苏木精-伊红染色(HE染色),镜下观察再生尿道的组织结构,将未经行任何手术的健康雄性比格犬作为对照,结果如图4所示。
HE染色结果显示,在对照组比格犬尿道重建处植入的实施例1的胶原支架材料和实验组比格犬尿道重建处植入的实施例1的生物修复材料在术后6个月均完全降解并被再生组织替代。实验组比格犬的尿道上皮细胞覆盖了整个再造尿道,而对照组比格犬的尿道上皮细胞层在尿道重建处是不完整的,且对照组比格犬的尿道上皮细胞层比 实验组薄。实验组比格犬尿道重建处的上皮细胞层下面的血管多于对照组比格犬尿道重建处的上皮细胞层下面的血管,并且对照组比格犬尿道损伤处出现尿道瘘。说明,本发明的生物修复材料可以修复尿道的损伤。
8、免疫荧光染色观察上皮组织再生情况
将步骤7得到的每只再造尿道的另一半进行冰冻切片,片厚5μm。用pan cytokeratin AE1/AE3抗体(Abcam产品,货号为ab86734)检测尿道重建处上皮细胞的再生情况(图5),将未经行任何手术的健康雄性比格犬作为对照。结果显示,实验组比格犬尿道重建处的上皮由8-10层上皮细胞组成,覆盖整个再造尿道,细胞排列整齐,具有正常尿道组织上皮细胞的形态特征;而对照组比格犬尿道重建处的上皮由3-5层上皮细胞组成,细胞排列松散,未能完整覆盖再造尿道,且有尿道瘘出现。实验组比格犬尿道重建处的上皮层的厚度为99.60±11.37μm,与健康雄性比格犬正常尿道上皮层厚度(95.32±22.41μm)无显著差异(P>0.05),但与对照组比格犬尿道重建处的上皮层厚度(42.66±3.77μm)有显著性差异(P<0.01)(图6)。说明,本发明的生物修复材料可以修复尿道的损伤,并促进尿道上皮的再生。
9、血管再生情况
观察步骤4的术后6个月对照组比格犬和术后6个月实验组比格犬的再造尿道的血管再生情况。将比格犬再造尿道进行冰冻切片,用vWF单抗(Abcam产品,货号为ab6994,该抗体标记有荧光物质)检测血管组织再生情况(图7)及血管平均荧光强度(图8),将未经行任何手术的健康雄性比格犬作为对照。
结果显示,术后6个月对照组比格犬尿道重建处的血管平均荧光强度为0.026±0.003,术后6个月实验组比格犬尿道重建处的血管平均荧光强度为0.038±0.008,健康雄性比格犬尿道的血管平均荧光强度为0.041±0.008。术后6个月实验组比格犬尿道重建处的血管密度高于术后6个月对照组比格犬尿道重建处的血管密度,并且二者具有显著性差异(P<0.01)。说明,本发明的生物修复材料可以修复尿道的损伤,并促进尿道血管的再生。
10、平滑肌再生情况
观察步骤4的术后6个月对照组比格犬和术后6个月实验组比格犬的再造尿道的平滑肌细胞再生情况。将比格犬再造尿道进行冰冻切片,用α-SMA单抗(Abcam产品,货号为ab119952,该抗体标记有荧光物质)检测平滑肌再生情况(图9)及平滑肌组织平均荧光强度(图10),将未进行任何手术的健康雄性比格犬作为对照。
结果显示,健康雄性比格犬尿道的平滑肌组织平均荧光强度为76.16±12.47,术后6个月对照组比格犬尿道重建处的平滑肌组织平均荧光强度为2.58±1.50,术后6个月实验组比格犬尿道重建处的的平滑肌组织平均荧光强度为65.04±4.85,术 后6个月实验组比格犬尿道重建处的平滑肌组织平均荧光强度高于术后6个月对照组比格犬尿道损伤处的平滑肌组织平均荧光强度,并且二者具有显著性差异(P<0.01)。说明,本发明的生物修复材料可以修复尿道的损伤,并促进尿道平滑肌的再生。
- 还没有人留言评论。精彩留言会获得点赞!