Hedgehog通路抑制剂和纳米药物递送系统的药物组合物及其用途的制作方法
本发明属生物技术领域,涉及肿瘤靶向治疗的药物组合物,具体涉及一种Hedgehog通路抑制剂和纳米药物递送系统的药物组合物及其用途,该药物组合物以Hedgehog通路为靶点调控肿瘤基质增加纳米药物瘤内递送用于治疗胰腺癌。
背景技术:
纳米递药系统是当今肿瘤治疗领域的研究热点之一。其治疗基础是肿瘤的增强渗透与滞留(EPR)效应,即实体瘤组织中的血管壁间隙较宽、结构完整性差、淋巴系统回流障碍,从而促进大分子类物质或微粒系统在肿瘤组织选择性分布。利用肿瘤的EPR效应,纳米递药系统比小分子药物具有更好的治疗效果(参见文献J Control Release.2012;164:138-44.Adv Drug Deliv Rev.2010;63:170-83)。然而对于某些纤维化严重的肿瘤,如胰腺癌等,纳米递药系统的疗效甚微(Gut.2012;62:112-20.ACS Nano.2013;7:2078-89),其主要原因在于:①胰腺癌血管稀少,肿瘤基质纤维化严重,丰富的基质挤压血管,使本已稀少的血管血流灌注量进一步下降,直接影响药物的递送;②丰富的基质还使纳米递药系统难以有效穿过肿瘤基质到达肿瘤细胞,降低了药物治疗的效果。因此,采用新的策略有效地治疗这一类型的肿瘤,是纳米递药研究领域急需攻克的难题。
目前认为,肿瘤的细胞外基质纤维化是一系列肿瘤内信号转导途径的异常激活所导致的,包括Hedgehog通路,TGF-β通路,PDGF通路等。其中,Hedgehog通路在胚胎发育及创伤修复中发挥重要作用,其介导的肿瘤信号转导途径异常激活是许多肿瘤共有的特征,以基质中纤维丰富的胰腺癌尤其明显。经典的Hedgehog信号通路由肿瘤细胞释放的Hedgehog配体与相应的肿瘤内成纤维细胞表面的patch-1或patch-2受体结合,激活跨膜蛋白Smoothened,促发一系列的信号转导最终引起激活的转录因子GLI-1进入细胞核内调控靶基因的表达。 Hedgehog途径激活后,成纤维细胞会产生大量的基质,挤压血管并使胰腺癌细胞被环绕在肿瘤基质内,构成一道小分子和普通纳米药物几乎无法逾越的屏障。因此,Hedgehog通路抑制剂的使用可以抑制胰腺癌肿瘤细胞外基质的纤维化,解除细胞外基质对血管的挤压,增加肿瘤内的血流灌注,从而增加肿瘤内的药物递送。此外,肿瘤基质减少还可以减少纳米递药系统穿过胰腺癌肿瘤基质时所遇到的阻力,增加药物到达肿瘤细胞的机会。
目前,已有一些研究采用药物抑制TGF-β通路或PDGF通路调控肿瘤内基质成份改善药物瘤内递送的研究。如采用氯沙坦通过抑制血管紧张素受体Ⅱ-1下游的基质纤维化相关因子如TGF-β-1,CCN2and ET-1,抑制透明质酸和胶原蛋白的形成,从而扩张肿瘤血管,增加游离药物的递送,抑制原位胰腺癌的生长延长动物的生存时间(参见文献Nature Communications.2013;4:2516.)。如采用TGF-beta抑制剂减少周细胞的对内皮的覆盖,增加瘤内的血流灌注,从而在一定程度上改善载吉西他滨纳米药物对胰腺癌的治疗(参见文献ACS Nano.2013Nov 26;7(11):10048-65.)。但是目前暂无应用Hedgehog通路抑制剂增加胰腺癌内的血流灌注和纳米递药系统的瘤内穿透,实现更为有效的肿瘤细胞递药的相关研究。亦无调节胰腺癌细胞外基质联合纳米药物用于胰腺癌治疗的相关专利申请。
根据以上背景,考虑到Hedgehog通路在胰腺癌基质纤维化过程中的重要作用,本发明采用Hedgehog通路抑制剂调控胰腺癌肿瘤微环境的基质成分,通过增加瘤内血流灌注和纳米粒的瘤内穿透,增加纳米药物瘤内递送,提高胰腺癌的治疗效果。该策略不仅可用于胰腺癌的治疗,而且也可用于Hedgehog通路异常激活的其他肿瘤,如胆管癌等。
技术实现要素:
本发明的目的在于提供肿瘤靶向治疗的药物组合物,涉及一种Hedgehog通路抑制剂和纳米药物递送系统的药物组合物及其用途,该药物组合物以Hedgehog通路为靶点调控肿瘤基质增加纳米药物瘤内递送用于治疗胰腺癌。
本发明为临床实践提供了一种针对胰腺癌的干预策略,具体涉及该策略通过抑制Hedgehog通路调控胰腺癌的基质形成并增加肿瘤内的血流灌注,增加纳米 药物穿透达到肿瘤局部,并减弱纳米药物在瘤内均一分布所遇到的阻力,从而提高纳米药物对胰腺癌的治疗效果。
具体的,本发明提供了一种Hedgehog通路抑制剂和纳米药物递送系统的药物组合物及其用途;所述的药物组合物由Hedgehog通路抑制剂和纳米药物递送系统组成。
本发明中,Hedgehog通路抑制剂为Smoothened蛋白的小分子抑制剂;Hedgehog配体所对应的蛋白抗体;针对GLI-1基因的干扰RNA或反义DNA序列以及可以抑制GLI-1基因转录的小分子药物;
本发明中,纳米药物为载抗肿瘤药物的纳米递药系统;该递药系统中抗肿瘤药物为小分子抗肿瘤药物,纳米载体为表面聚乙二醇修饰的脂质体、纳米粒、聚合物泡囊、聚合物胶束、固体脂质纳米粒,药物以包裹或共价连接的方式包载在纳米载体内,所述的纳米递药系统粒径为10-300nm。
优选的,本发明中所述的Hedgehog通路抑制剂,包括环巴胺及其衍生物,IPI-269609,维生素D3,SANT1-4和Cur61414;Hedgehog配体所对应的蛋白抗体;针对GLI-1基因的干扰RNA或反义DNA序列以及可以抑制GLI-1基因转录的小分子药物,如GANT61和GANT58;Hedgehog通路抑制剂的给药形式可以是注射,也可是口服;
所述环巴胺是从藜芦属植物内分离得到的一种异甾体类生物碱,能与Hedgehog信号通路中的Smoothened蛋白结合,从而抑制该蛋白的活性,是经典的Hedgehog通路抑制剂,可以特异性地抑制胰腺癌内过度激活的Hedgehog通路,有效地抑制胰腺癌肿瘤细胞外基质的纤维化(参见文献Science.2009;324:1400-1.Nature.2003;425:846-51.),本发明的实施例中,更优选的Hedgehog通路抑制剂为Smoothened蛋白的小分子抑制剂是环巴胺及其衍生物;
优选的,本发明中纳米药物为载抗肿瘤药物的纳米递药系统,其中,药物以包裹或共价连接的方式包载在纳米载体内,所述的纳米递药系统粒径为10-300nm;纳米递药系统表面可以连接靶向功能分子以增加纳米药物对肿瘤细胞的选择性,提高肿瘤细胞对纳米药物的摄取。
本发明中,抗肿瘤药物为小分子抗肿瘤药物,选自阿霉素、表阿霉素、紫杉醇、多烯紫杉醇、吉西他滨、喜树碱、羟基喜树碱、长春碱、长春新碱、长春地 辛、长春瑞滨、博来霉素、柔红霉素、正定霉素、丝裂霉素、阿克拉霉素、甲氨蝶呤、舒尼替尼、伊马替尼、吉非替尼、厄罗替尼、索拉非尼和拉帕替尼等;本发明中优选的药物为阿霉素、表阿霉素、紫杉醇、多烯紫杉醇、羟基喜树碱、长春新碱、吉西他滨、拉帕替尼。
本发明中,纳米载体为表面聚乙二醇修饰的脂质体、纳米粒、聚合物泡囊、聚合物胶束、固体脂质纳米粒;其中优选的纳米载体为表面聚乙二醇修饰的脂质体、纳米粒和聚合物胶束。
本发明中,制备纳米载体的材料为白蛋白、聚乳酸(PLA)、聚乳酸-羟基乙酸(PLGA)、聚己内酯(PCL)、磷脂、聚乙二醇聚乳酸共聚物(PEG-PLA)、聚乙二醇聚乳酸-羟基乙酸共聚物(PEG-PLGA)、聚乙二醇聚己内酯共聚物(PEG-PCL)、聚乙二醇二硬脂酰磷脂酰乙醇胺(PEG-DSPE)中的一种和几种。
本发明中,聚乙二醇分子量为1000-20000Da,优选2000-5000Da。
进一步,本发明通过以下技术方案实现针对胰腺癌的纳米药物递药干预策略研究:
(1)建立皮下荷Capan-2胰腺癌动物模型,Hedgehog通路抑制剂使用后,通过western blot和PCR技术评价Hedgehog通路抑制剂对Hedgehog通路的抑制作用;
(2)采用免疫荧光和超声成像法评价Hedgehog通路抑制剂给药后,肿瘤内部基质及灌流的变化情况;
(3)制备纳米药物并对其理化性质进行表征,如采用Zeta/激光粒度仪测定纳米粒的平均粒径和电位,透射电镜观察其形态;
(4)采用红外染料DiR标记纳米药物后,通过小动物活体成像仪评价Hedgehog通路抑制剂给药后,纳米药物在实验组和对照组的肿瘤内富集差异;
(5)采用绿色荧光探针香豆素-6标记纳米药物后,通过冰冻切片观察Hedgehog通路抑制剂使用后,纳米药物在实验组和对照组的肿瘤内分布差异;
(6)通过肿瘤生长抑制实验,评价Hedgehog通路抑制后联合纳米药物对胰腺癌的递药研究。
本发明提供了一种Hedgehog通路抑制剂和纳米药物递送系统的药物组合物及其用途,该药物组合物以Hedgehog通路为靶点调控肿瘤基质增加纳米药物瘤 内递送用于治疗胰腺癌;进一步,本发明为临床实践提供了一种针对胰腺癌的干预策略,该策略包括通过抑制Hedgehog通路调控胰腺癌的基质形成并增加肿瘤内的血流灌注,增加纳米药物穿透达到肿瘤局部,并减弱纳米药物在瘤内均一分布所遇到的阻力,从而提高纳米药物对胰腺癌的治疗效果。
为了便于理解,以下将通过具体的附图和实施例对本发明的进行详细地描述。需要特别指出的是,具体实例和附图仅是为了说明,本领域的普通技术人员可以根据本文说明,在本发明的范围内对本发明做出各种各样的修正和改变,这些修正和改变也纳入本发明的范围内。
附图说明
图1,以Hedgehog通路为靶点调控肿瘤基质增加纳米药物瘤内递送干预胰腺癌的示意图:其中,(A),瘤内基质丰富表达,挤压肿瘤血管,降低瘤内血流灌注和纳米药物的穿透,(B),采用Hedgehog通路抑制剂抑制Hedgehog通路后,瘤内基质减少,肿瘤血管挤压解除,瘤内血流灌注增加和纳米药物的穿透与分布增加,(C),Hedgehog通路激活后,瘤内基质丰富表达,(D),采用抑制剂抑制Hedgehog通路,瘤内基质表达关闭。
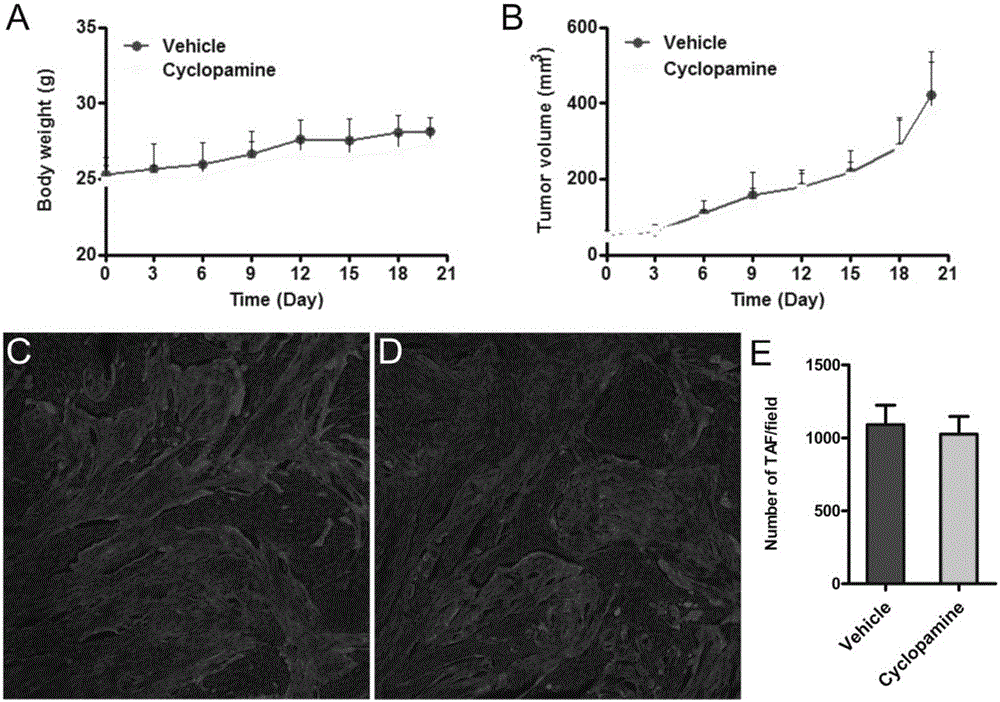
图2,建立Capan-2荷胰腺癌细胞的皮下肿瘤模型,环巴胺给药后对Capan-2肿瘤生长和动物体重的影响,其中,(A),动物体重变化曲线,(B),肿瘤体积变化曲线,(C),环巴胺组和(D)对照组瘤内肿瘤相关成纤维细胞的表达情况(红色为成纤维细胞活化蛋白fibroblast-activated protein-α,蓝色为细胞核),(E),单显微镜视野下相关成纤维细胞的数目。
图3,环巴胺处理后对胰腺癌hedgehog通路关键基因和蛋白表达的抑制作用,其中A为western blot分析GIL-1蛋白的表达(左:western bolt图谱,右:半定量分析结果),B为定量PCR分析GIL-1mRNA的表达,*P<0.05与vehicle组相比。
图4,环巴胺抑制肿瘤基质的形成,其中上行为对照组(vehicle处理组),下行为环巴胺组,蓝色标记为细胞核,红色为荧光标记的FNs。
图5,环巴胺对肿瘤内血流灌注的影响,其中,上行为对照组(vehicle处 理组),下行为环巴胺组,蓝色标记为细胞核,绿色为lectin标记的功能化血管,表征存在血流灌注,红色为CD31标记的血管。
图6,超声成像法观察环巴胺处理后增加肿瘤内的血流灌注,瘤内超声成像图:(A)环巴胺处理组,(B)vehicle处理组。
图7,纳米药物的表征结果,图A为电镜结果,图B为粒径仪测试结果。
图8,环巴胺处理后对纳米药物瘤内分布的影响,其中,(A)环巴胺处理结束后静脉注射红外染料DiR标记的纳米粒(NP-DiR),24h活体成像图;(B)NP-DiR注射24h后离体肿瘤的荧光成像图和对应的半定量结果(C),(D)DiR-NP注射24h后离体器官的荧光成像图和对应的定量结果(E);**P<0.01与vehicle组相比。
图9,环巴胺处理后对纳米药物瘤内穿透的影响,其中,显示了环巴胺处理结束后静脉注射香豆素-6标记的纳米粒(NP-Cou-6),4h取瘤冰冻切片,观察纳米粒在肿瘤内的分布,蓝色标记为细胞核,绿色为纳米粒,红色为CD31标记的血管。
图10显示了环巴胺提高紫杉醇纳米粒对胰腺癌的治疗效果,其中,A为肿瘤的体积变化,B为动物体重变化,C为处死动物后剥离的肿瘤图片,D为剥离肿瘤的重量,E为上述剥离的肿瘤行石蜡包埋切片后的TUNEI凋亡染色(放大倍数分别为100倍),*P<0.05,#P<0.01,与对照组或环巴胺组比较;**P<0.01,与NP-PTX组比较。
图11显示了环巴胺提高紫杉醇胶束对胰腺癌的治疗效果,其中,A为肿瘤的体积变化,B为剥离肿瘤的重量,*P<0.05,#P<0.01,与对照组或环巴胺组比较;**P<0.01,与NP-PTX组比较。
具体实施方式:
本实验例选择环巴胺作为Hedgehog通路抑制剂的代表,探讨Hedgehog通路抑制剂使用后对Hedgehog通路、肿瘤基质形成、瘤内血液灌注和纳米药物递送的影响(如图1所示);
本实验例采用实验数据统计方法:多组比较采用一步ANOVA法,两组比较采用双侧t检验法。
实施例1:Hedgehog通路抑制剂使用后对Hedgehog通路的抑制作用
将人源的胰腺癌capan-2细胞系按5×106个细胞/动物皮下注射建立皮下荷胰腺癌裸鼠模型,待皮下肿瘤直径达到4-5mm,荷瘤模型小鼠经过环巴胺连续三周灌胃或腹腔注(剂量为50mg/kg/d)处理,对照组同法给予不含环巴胺的空白制剂(采用vehicle表示),同时每隔3d记录一次荷瘤小鼠的体重及肿瘤的大小,以初步评价环巴胺的毒副作用及对肿瘤生长的作用;
免疫荧光染色法分析肿瘤成纤维细胞的生长:环巴胺给药结束后,二氧化碳窒息法处死模型小鼠,迅速用PBS及4%多聚甲醛溶液灌流,剥离肿瘤组织,并制备冰冻切片,采用免疫荧光法标记肿瘤成纤维细胞,观察环巴胺处理后对成纤维细胞的生长的影响;
荧光定量PCR分析分析GIL-1基因mRNA的表达:环巴胺给药结束后,二氧化碳窒息法处死模型小鼠,迅速剥离肿瘤组织,切取一小块采用TRIzol法提取总RNA(备用的肿瘤组织迅速置于-80℃保存),采用核酸测定仪检测样品的RNA浓度,选取OD260/OD280在1.7-2.1之间的样品进行下述实验。按照 RT reagent Kit说明书进行逆转录制备cDNA(反应体积为20μl,反应条件为:42℃ 30min;85℃ 10min),然后采用SYBR法进行实时定量PCR反应(反应体系为20μl,反应条件为:预变性95℃ 30s,95℃ 12s和60℃ 40s共40个循环)。记录对照组和环巴胺处理组GIL-1和GAPDH▲▲CT值,计算▲▲CT值并进行统计学分析;
western blot法检测GIL-1蛋白的变化:环巴胺给药结束后,二氧化碳窒息法处死模型小鼠,迅速剥离肿瘤组织,切取小块肿瘤组织,加入300μl组织细胞裂解液(备用的肿瘤组织迅速置于-80℃保存),研磨均匀,4℃ 12000rpm离心5min后取上清,采用BCA法检测各组总蛋白浓度;样品使用10%SDS-PAGE分离,上样量为20μl蛋白/孔;电泳结束后,使用Semi-Dry Cell进行半干电泳转移,转移条件为30mA 100min,使用Blocking Buffer封闭转印膜,4℃过夜,第二天用1×TBST洗涤3次,每次15min。加入稀释好的一抗(1:500),37℃温育2h。用1×TBST洗涤4次,每次10min。加入稀释好的二抗(1:2000),37℃温育2h,用1×TBST洗涤4次,每次10min。用Super-GL ECL超敏发光液进行化学发光检测,并对X光片曝光。经显影定影处理后,晾干的胶片最后 用凝胶成像分析系统拍照,并采用Gel-Pro Analyzer软件进行分析;
实验结果显示,环巴胺的处理不影响动物的体重(如图2A所示),不影响肿瘤的生长(如图1B所示,对瘤内肿瘤相关成纤维细胞的表达没有影响(如图2C,D所示);
Western blot及荧光定量PCR结果显示:环巴胺处理后,GIL-1相关蛋白表达显著降低,半定量结果显示仅为对照组的40.3%左右(如图3A所示),GIL-1基因mRNA下调了44.4±0.9%(如图3B所示),GIL-1基因和相关蛋白是Hedgehog通路的主要标志物,说明环巴胺的处理有效抑制了Hedgehog通路。
实施例2:Hedgehog通路抑制剂使用后对肿瘤基质形成的影响
环巴胺给药结束后,取瘤制备冰冻切片,采用免疫荧光法标记纤维连接蛋白(FNs),以纤维连接蛋白(FNs)作为细胞外基质的标记物,观察肿瘤基质的形成情况,结果显示,空白制剂处理组中FNs分布广泛,呈束带状,包绕隔离肿瘤实质细胞(如图4第一行所示),而环巴胺处理组的肿瘤组织中,FNs呈断裂,散在分布于肿瘤基质中(如图4第二行所示),表明Hedgehog通路抑制剂的处理可以有效减少肿瘤细胞外基质的形成。
实施例3:Hedgehog通路抑制剂使用后对瘤内血流灌注的影响
环巴胺给药结束后尾静脉给予488标记的凝集素(488-lectin),剂量为5mg/kg,1h后二氧化碳窒息处死动物后迅速用PBS及4%多聚甲醛溶液灌流,并制备冰冻切片;采用CD31抗体对血管内皮细胞免疫荧光染色后,共聚焦显微镜下120×视野下随机选择5个视野进行观察并采用Image J软件计算分析功能化血管(488+CD31+)占所有血管(CD31+)的比例,以该指标来评价肿瘤组织内的血流灌注情况,结果显示,环巴胺处理后,肿瘤内部功能化的血管明显增多,从处理前的32.6±4.4%增加到了72.9±5.8%,大大提升了肿瘤内的血流灌注(如图5所示);
环巴胺给药结束后尾静脉注射超声造影剂微泡,超声成像法观察瘤内血流灌注,结果显示,环巴胺处理后,肿瘤内部血流灌注的速度增加了25%以上(如图6所示);
结果表明,由于环巴胺破坏了肿瘤内的基质的形成,解除了以FNs为代表的丰富的肿瘤基质对肿瘤血管的挤压,使得部分受挤压的血管在挤压解除后重新获得灌流,成为有功能的血管,从而增加了肿瘤的瘤内灌注,为纳米药物的有效递送建立了条件。
实施例4:纳米药物的制备与表征
本实施例采用常见的可生物降解聚合物之一PEG3000-PLA30000和代表性小分子抗肿瘤药物紫杉醇(PTX)制备纳米药物(NP-PTX)。制备方法为单次乳化溶酶蒸发法;具体操作如下:24mg聚乙二醇-聚乳酸(MPEG-PLA)和2mg PTX用1mL二氯甲烷溶解后加入到5mL 0.6%的胆酸钠溶液中,然后冰水浴5s/5s脉冲超声15次,功率为200W。旋转蒸发除去二氯甲烷后浓缩至合适浓度即得未修饰纳米粒(NP),电镜下纳米粒子大小均一,分散性好,表面光滑呈规则圆球形(如图7A所示),粒度/电位测定仪结果显示纳米粒粒径为109.9±4.7nm(如图7B所示),电位为10.6±0.9mv,适合肿瘤的体内递药;荧光标记的纳米药物制备方法同上,只需要将一定量的荧光素替代PTX和PEG-PLA用1mL二氯甲烷溶解后同法制备纳米药物;
紫杉醇胶束的制备与表征:采用薄膜水化制备载紫杉醇胶束,20mg聚乙二醇-聚乳酸(MPEG2000-PLA1000)和2mg PTX用4mL乙腈溶解后旋转蒸发成膜,除去乙腈,加去离子水水化,粒度/电位测定仪结果显示胶束粒径为20.3±1.2nm,电位为-5.5±0.3mv,适合肿瘤的体内递药。
实施例5,Hedgehog通路抑制剂使用后对纳米药物瘤内分布的影响
荷瘤鼠采用环巴胺处理结束后,用近红外染料DiR标记纳米粒,按10μg/kg剂量尾静脉给药24h后给药24h后置于小动物活体成像仪中行活体成像观察NP-DiR在肿瘤内的分布,随后二氧化碳窒息法处死小动物模型后PBS及4%多聚甲醛溶液心脏灌流,获取肿瘤组织及其他正常器官(包括肝,脾,心,肺,肾和脑),将离体组织再次置于小动物活体成像仪内,获取荧光信号并分析离体组织内的荧光分布,实验结果显示,环巴胺处理更有利于纳米粒在肿瘤内聚(图8A),离体组织成像及半定量结果证实,环巴胺处理组的肿瘤组织内平均荧光强 度是空白制剂处理组肿瘤组织的1.8倍左右,而正常器官中的平均荧光值与空白制剂处理组相比没有显著性差异(图8B和C),说明环巴胺的处理可以有效增加纳米粒在肿瘤组织内的分布,但是对正常器官内的纳米粒分布没有影响。
实施例6,Hedgehog通路抑制剂使用后对纳米药物瘤内穿透的影响
荷瘤鼠采用环巴胺处理结束后,用绿色荧光探针香豆素-6标记纳米粒,按0.05mg/kg剂量尾静脉给药,4h后二氧化碳窒息法处死动物,PBS及4%多聚甲醛溶液灌流小鼠并取瘤制备冰冻切片并采用免疫荧光染色的方法对血管内皮细胞染色;采用羊来源的多克隆CD31抗体(1:100)为一抗标记肿瘤血管内皮细胞,二抗采用Cy3TM标记的驴抗羊二抗(1:100),染色结束后Hochest33342染细胞核并用抗荧光淬灭剂封片,并通过共聚焦显微镜观察纳米粒在肿瘤内的分布,并分析其与肿瘤内血管的关系,共聚焦显微镜观察结果显示,环巴胺处理组纳米粒子可以广泛地分布在肿瘤内部,并可穿透血透到达距离血管较远处的肿瘤部位(如图9F-J所示),而空白制剂处理组中,纳米粒子主要部分在血管附近,未能有效地分穿透布到整个肿瘤实质中(如图9A-E所示),由于环巴胺的作用破坏了肿瘤基质,一方面减少了纳米药物瘤内穿透的阻力,可以使纳米药物有效递送到肿瘤组织深处,另一方面增加了肿瘤内血流灌注区域,可使纳米药物较为均一地分布到整个肿瘤组织中。
实施例7,Hedgehog通路抑制剂提高了纳米药物对胰腺癌的治疗效果
制备包载经典化疗药物紫杉醇的纳米粒(NP-PTX)。待肿瘤直径达到4-5mm时,将24只荷胰腺癌裸鼠模型随机平均分成四组,每组6只。a,对照组(三周空白制剂灌胃,从第二周开始尾静脉给予生理盐水);b,环巴胺组(三周环巴胺制剂灌胃,从第二周开始尾静脉给予生理盐水);c,NP-PTX组(三周空白制剂灌胃,从第二周开始尾静脉给予NP-PTX);d,环巴胺+NP-PTX组(三周环巴胺制剂灌胃,从第二周开始尾静脉给予NP-PTX)。尾静脉给药开始计为第0d,尾静脉给药后继续给予环巴胺灌胃一周,每三天给予一次NP-PTX(PTX剂量为6mg/kg),每三天记录一次肿瘤的体积及荷瘤小鼠体重,给药五次后继续观察三天后采用二氧化碳窒息法处死模型小鼠,取瘤称重并制备冰冻切片,采用TUNEL 染色观察肿瘤细胞的凋亡,实验结果显示,环巴胺组(b组)与对照组(a组)之间在肿瘤大小及肿瘤重量方面没有显著性差异,表明环巴胺的处理不影响肿瘤的生长。与对照组及环巴胺组相比,环巴胺+NP-PTX组(d组)和NP-PTX组(c组)对肿瘤生长产生了一定的抑制作用,而且环巴胺+NP-PTX组肿瘤生长抑制作用显著优于NP-PTX组(如图10A,C,D所示),按肿瘤体积抑制率和肿瘤重量抑制率计算,NP-PTX组,对肿瘤的生长抑制率分别为26.3%和29.5%,而环巴胺+NP-PTX组对肿瘤的生长抑制率分别为55.2%和63.3%。肿瘤TUNEL染色结果显示,对照组和环巴胺组仅能检测到散在的个别凋亡细胞,NP-PTX组可以见到略多的凋亡细胞,但仍然呈散在分布,而环巴胺给药后联合NP-PTX给药组可以见到比例明显增多的凋亡细胞(如图10E所示),与肿瘤生长的体积变化曲线相一致。说明环巴胺的处理可以有效增加纳米药物对肿瘤的生长抑制作用,而仅仅依靠EPR效应的普通纳米粒药物对胰腺癌肿瘤的抑制作用很有限;
将紫杉醇纳米粒替换为紫杉醇胶束(Micelle-PTX),同上开展紫杉醇胶束的药效学实验,实验分组情况如下:对照组(三周空白制剂灌胃,从第二周开始尾静脉给予生理盐水);环巴胺组(三周环巴胺制剂灌胃,从第二周开始尾静脉给予生理盐水);Micelle-PTX组(三周空白制剂灌胃,从第二周开始尾静脉给予Micelle-PTX);环巴胺+Micelle-PTX组(三周环巴胺制剂灌胃,从第二周开始尾静脉给予Micelle-PTX),实验结果如图11所示,与对照组及环巴胺组相比,环巴胺+Micelle-PTX组对肿瘤生长产生了显著的抑制作用,而且显著优于NP-PTX组。
- 还没有人留言评论。精彩留言会获得点赞!