抑制坏死性凋亡的方法与流程
本发明涉及抑制坏死性凋亡的方法,用于鉴定抑制坏死性凋亡的化合物的筛选方法以及用于抑制坏死性凋亡的化合物。
背景技术:
在许多疾病中,细胞死亡通过凋亡和/或坏死途径介导。虽然已知很多关于控制凋亡的作用机制,但对控制坏死还不太清楚。了解调节细胞坏死和细胞凋亡两者的机制对于能够治疗如神经变性疾病、中风、冠心病、肾病、肝病、AIDS以及与AIDS相关病症的疾病是必要的。
根据形态特征,细胞死亡传统上被归类为凋亡或坏死(Wyllie等人,Int.Rev.Cytol.68:251(1980))。这两种模式的细胞死亡最初也被认为分别通过调节过程(半胱天冬酶依赖)和非调节过程发生。然而,更多最近的研究表明,导致这两种表型的潜在细胞死亡机制要复杂得多,并且在某些情况下是相互关联的。此外,导致坏死的条件可以通过调节的半胱天冬酶非依赖性的或非调节过程发生。
已经描述了一种伴有类似坏死的形态学特征,称为坏死性凋亡的调节的半胱天冬酶非依赖的细胞死亡途径(Degterev等人,Nat.Chem.Biol.1:112,2005)。这种细胞死亡方式可在大量细胞类型(例如单核细胞、成纤维细胞、淋巴细胞、巨噬细胞、上皮细胞和神经元)中由各种刺激(例如TNF-[α]和Fas配体)启动。在涉及过度细胞应激、快速能量损失和大量氧化物质产生的病理条件下,坏死性凋亡可能代表细胞死亡的主要原因并且在一些情况下是主要模式,此时高度能量依赖性细胞凋亡过程不起作用。
能够抑制坏死性凋亡的低分子量分子的鉴定和优化将有助于阐明其在疾病病理生理学中的作用,并且可以提供用于治疗抗坏死性凋亡的化合物。防止半胱天冬酶依赖性细胞死亡(例如坏死或坏死性凋亡)的化合物的发现也将为治疗或预防发生坏死的病症提供有用的治疗剂。这些化合物和方法将对治疗神经变性疾病、缺血性脑和心脏损伤、头部创伤和炎性病症特别有用。
已经包括在本说明书中的文档、疗法、材料、装置、制品等的任何讨论不应因为它存在于本申请的每个权利要求的优先权日之前而被视为承认这些中的任何一个或全部形成现有技术基础的一部分或者是与本发明相关的本领域公知常识。
发明简述
在一方面,提供了用于在有需要的受试者中抑制坏死性凋亡的方法,所述方法包括给予治疗有效量的化合物,所述化合物结合混合系列激酶域样(MLKL)蛋白的假激酶结构域的ATP结合位点。
在另一方面,提供了一种用于鉴定抑制坏死性凋亡的化合物的筛选方法,所述方法包括:
a)在允许MLKL和候选化合物相互作用的条件下,将含有MLKL的蛋白质溶液与候选化合物接触;和
b)将存在候选化合物时获得的解折叠转变温度(Tm)与不存在候选化合物时获得的解折叠转变温度(Tm)进行比较,以确定解折叠转变温度的变化(ΔTm);
其中MLKL和候选化合物通过候选化合物与MLKL的假激酶结构域的ATP结合位点的结合相互作用;和
其中正ΔTm值表示候选化合物稳定蛋白质防止其变性并抑制其在坏死性凋亡中的作用。
在另一方面,提供了一种用于鉴定抑制坏死性凋亡的化合物的筛选方法,所述方法包括:
a)在允许MLKL假激酶结构域和候选化合物相互作用的条件下,将MLKL假激酶结构域与浓度渐增的候选化合物接触;和
b)测定结合亲和力(Kd);
其中MLKL假激酶结构域和候选化合物通过候选化合物与MLKL的假激酶结构域的ATP结合位点的结合相互作用,和
其中与候选化合物的结合表明候选化合物能够抑制坏死性凋亡。
在另一方面,提供了用于鉴定抑制坏死性凋亡的化合物的筛选方法,所述方法包括:
a)将含有MLKL假激酶结构域的蛋白质溶液与核苷酸和候选化合物接触,并进行STD-NMR;和
b)将候选化合物存在时获得的STD-NMR谱图和不存在候选化合物时获得的STD-NMR谱图进行比较;
其中MLKL假激酶结构域和候选化合物通过候选化合物与MLKL的假激酶结构域的ATP结合位点的结合相互作用;和
其中STD-NMR谱图中信号强度的消失或减少表明候选化合物能够抑制坏死性凋亡。
已经发现US2005/0085637中描述的具体化合物适合于抑制坏死性凋亡。
因此,一方面,提供了在有需要的受试者中抑制坏死性凋亡的方法,所述方法包括给予治疗有效量的式(I)的化合物,或其盐、溶剂合物,或生理功能性衍生物:
其中:
W是N或C-R,其中R是氢、卤素或氰基;
J是氢、C1-C4烷基、C1-C4卤代烷基、芳烷基、氰基烷基、-(CH2)pC=CH(CH2)tH、-(CH2)pC≡CH(CH2)tH,或C3-C7环烷基;
p为1、2或3;
t为0或1;
D是-N(H)(X);
X是由-(X1)-(X2)q-(X3)定义的基团,其中,
X1是C(O)或C(S)并且q是1,或
X1是-C(O)或-S(O)2并且q是0,
X2是N(H)或O,以及
X3是烷基、环烷基、杂环基、烷氧基、芳氧基、芳烷氧基、芳基、芳烷基,或杂芳基,或
被至少一个由-(X4)z-(X5)定义的基团所取代的烷基、环烷基、杂环基、烷氧基、芳氧基、芳烷氧基、芳基、芳烷基或杂芳基,
X4是C(H)2,其中z是0、1、2、3或4,和
X5是氢、C1-C6烷基、C1-C6卤代烷基、环烷基、杂环基、芳基、杂芳基、烷氧基、卤代烷氧基、羟基、芳氧基、芳烷氧基、卤素、-CN、-NR’R’、N(H)C(O)R”、N(H)C(O)OR”、N(H)C(O)NR’R’、N(H)S(O)2R”、OR”、OC(O)RR”、C(O)R”、SR”、-S(O)R”’、S(O)2R”’,或-S(O)2NR’R’,其中,
R’是氢、烷基、环烷基、杂环基、-OR1、-SR1、-S(O)2R1、-S(O)R1或C(O)R1;
R”是氢、烷基、环烷基、杂环基、-OR1、-NR3R4、-S(O)2R1、-S(O)R1或C(O)R1;以及
R”’是氢、烷基、环烷基、杂环基、-OR1或-NR3R4;
Q1是氢、卤素、C1-C2卤代烷基、C1-C2烷基、C1-C2烷氧基或C1-C2卤代烷氧基;
Q2是A1或A2;
当Q2是A2时Q3是A1,当Q2是A1时Q3是A2;
其中,
A1是氢、卤素、C1-C3烷基、C1-C3卤代烷基,-OR1,和
A2是由-(Z)m-(Z1)-(Z2)定义的基团,其中,
Z是CH2且m是0、1、2或3,或
Z是NR2且m是0或1,或
Z是氧且m是0或1,或
Z是CH2NR2且m是0或1;
Z1是S(O)2、S(O)或C(O);和
Z2是C1-C4烷基、环烷基、杂环基、NR3R4、芳基、芳基氨基、芳烷基、芳烷氧基或杂芳基;
R1是氢、烷基、杂环基和-NR3R4;
R2、R3和R4各自独立地选自氢、羟基、烷氧基、芳氧基、芳烷氧基、氨基、烷基氨基、芳基氨基、芳烷基氨基、C1-C4烷基、C3-C7环烷基、杂环基、-S(O)2R5和-C(O)R5;和
R5是C1-C4烷基或C3-C7环烷基。
另一方面,提供了在有需要的受试者中抑制坏死性凋亡的方法,所述方法包括给予治疗有效量的式(II)的化合物,或其盐、溶剂合物,或生理功能性衍生物:
其中:
D是-N(H)(X);
X是由-(X1)-(X2)q-(X3)定义的基团,其中,
X1是C(O)或C(S)并且q是1,或
X1是-C(O)或-S(O)2并且q是0,
X2是N(H)或O,以及
X3是烷基、环烷基、杂环基、烷氧基、芳氧基、芳烷氧基、芳基、芳烷基,或杂芳基,或
被至少一个由-(X4)z-(X5)定义的基团所取代的烷基、环烷基、杂环基、烷氧基、芳氧基、芳烷氧基、芳基、芳烷基或杂芳基,
X4是C(H)2,其中z是0、1、2、3或4,和
X5是氢、C1-C6烷基、C1-C6卤代烷基、环烷基、杂环基、芳基、杂芳基、烷氧基、卤代烷氧基、羟基、芳氧基、芳烷氧基、卤素、-CN、-NR’R’、N(H)C(O)R”、N(H)C(O)OR”、N(H)C(O)NR’R’、N(H)S(O)2R”、OR”、OC(O)RR”、C(O)R”、SR”、-S(O)R”’、S(O)2R”’,或-S(O)2NR’R’,其中,
R’是氢、烷基、环烷基、杂环基、-OR1、-SR1、-S(O)2R1、-S(O)R1或C(O)R1;
R”是氢、烷基、环烷基、杂环基、-OR1、-NR3R4、-S(O)2R1、-S(O)R1或C(O)R1;以及
R”’是氢、烷基、环烷基、杂环基、-OR1或-NR3R4;
Q1是氢、卤素、C1-C2卤代烷基、C1-C2烷基、C1-C2烷氧基或C1-C2卤代烷氧基;
Q2是A1或A2;
当Q2是A2时Q3是A1,当Q2是A1时Q3是A2;
其中,
A1是氢、卤素、C1-C3烷基、C1-C3卤代烷基,-OR1,和
A2是由-(Z)m-(Z1)-(Z2)定义的基团,其中,
Z是CH2且m是0、1、2或3,或
Z是NR2且m是0或1,或
Z是氧且m是0或1,或
Z是CH2NR2且m是0或1;
Z1是S(O)2、S(O)或C(O);和
Z2是C1-C4烷基、环烷基、杂环基、NR3R4、芳基、芳基氨基、芳烷基、芳烷氧基或杂芳基;
R1是氢、杂环基和-NR3R4;
R2、R3和R4各自独立地选自氢、羟基、烷氧基、芳氧基、芳烷氧基、氨基、烷基氨基、芳基氨基、芳烷基氨基、C1-C4烷基、C3-C7环烷基、杂环基、-S(O)2R5和-C(O)R5;和
R5是C1-C4烷基或C3-C7环烷基。
另一方面,提供了在有需要的受试者中抑制坏死性凋亡的方法,所述方法包括给予治疗有效量的式(I)的化合物,或其盐、溶剂合物,或生理功能性衍生物:
其中,
W是N或C-R,其中R是氢、卤素或氰基;
J是氢、C1-C4烷基、C1-C4卤代烷基、芳烷基、氰基烷基、-(CH2)pC=CH(CH2)tH、-(CH2)pC≡CH(CH2)tH,或C3-C7环烷基;
p为1、2或3;
t为0或1;
D为
q为1、2或3;
Q1是氢、卤素、C1-C2卤代烷基、C1-C2烷基、C1-C2烷氧基或C1-C2卤代烷氧基;
Q2是A1或A2;
当Q2是A2时Q3是A1,当Q2是A1时Q3是A2;
其中,
A1是氢、卤素、C1-C3烷基、C1-C3卤代烷基,-OR1,和
A2是由-(Z)m-(Z1)-(Z2)定义的基团,
其中,
Z是CH2且m是0、1、2或3,或
Z是NR2且m是0或1,或
Z是O且m是0或1,或
Z是CH2NR2且m是0或1;
Z1是S(O)2、S(O)或C(O);和
Z2是C1-C4烷基、环烷基、杂环基、NR3R4、芳基、芳基氨基、芳烷基、芳烷氧基或杂芳基;
R2、R3和R4各自独立地选自氢、羟基、烷氧基、芳氧基、芳烷氧基、氨基、烷基氨基、芳基氨基、芳烷基氨基、C1-C4烷基、C3-C7环烷基、杂环基、-S(O)2R5和-C(O)R5;
R5是C1-C6烷基或C3-C7环烷基;和
R6为由-(X4)z-(X5)定义的基团,
其中,
X4是C(H)2,其中z是0、1、2、3或4,和
X5是氢、C1-C6烷基、C1-C6卤代烷基、环烷基、杂环基、芳基、杂芳基、烷氧基、卤代烷氧基、羟基、芳氧基、芳烷氧基、卤素、CN、-NR7R7、-N(H)C(O)R7、-N(H)C(O)ORR7R7N(H)S(O)2R7、N(H)S(O)2NR7R7、-OC(O)R7、OC(O)NR7R7、-C(O)R7、-C(O)NR7R7、-SR7、-S(O)R7、-S(O)2R7R7、或-S(O)2NR7R7;和
R7为氢、C1-C6烷基、C1-C6卤代烷基、环烷基、杂环基、烷基氨基。
另一方面,提供了在有需要的受试者中抑制坏死性凋亡的方法,所述方法包括给予治疗有效量的式(II)的化合物,或其盐、溶剂合物,或生理功能性衍生物:
其中:
D为
q为1、2或3;
Q1是氢、卤素、C1-C2卤代烷基、C1-C2烷基、C1-C2烷氧基或C1-C2卤代烷氧基;
Q2是A1或A2;
当Q2是A2时Q3是A,当Q2是A1时Q3是A2;
其中,
A1是氢、卤素、C1-C3烷基、C1-C3卤代烷基,-OR1,和
A2是由-(Z)m-(Z1)-(Z2)定义的基团,
其中,
Z是CH2且m是0、1、2或3,或
Z是NR2且m是0或1,或
Z是O且m是0或1,或
Z是CH2NR2且m是0或1;
Z1是S(O)2、S(O)或C(O);和
Z2是C1-C4烷基、环烷基、杂环基、NR3R4、芳基、芳基氨基、芳烷基、芳烷氧基或杂芳基;
R2、R3和R4各自独立地选自氢、羟基、烷氧基、芳氧基、芳烷氧基、氨基、烷基氨基、芳基氨基、芳烷基氨基、C1-C4烷基、C3-C7环烷基、杂环基、-S(O)2RS和-C(O)R5;
R5是C1-C6烷基或C3-C7环烷基;和
R6为由-(X4)z-(X5)定义的基团,其中,
X4是C(H)2,其中z是0、1、2、3或4,和
X5是氢、C1-C6烷基、C1-C6卤代烷基、环烷基、杂环基、芳基、杂芳基、烷氧基、卤代烷氧基、羟基、芳氧基、芳烷氧基、卤素、CN、-NR7R7、-N(H)C(O)R7、-N(H)C(O)OR7、-N(H)C(O)NR7R7、N(H)S(O)2R7、N(H)S(O)2NR7R7、-OC(O)R7、OC(O)NR7R7、-C(O)R7、-O)NR7R7、-SR7、-S(O)R7、-S(O)2R7R7、或-S(O)2NR7R7;和
R7为氢、C1-C6烷基、C1-C6卤代烷基、环烷基、杂环基、烷基氨基、烷氧基、芳氧基、芳烷氧基、芳基氨基、芳烷基氨基、芳基或杂芳基。
另一方面,提供了在有需要的受试者中抑制坏死性凋亡的方法,所述方法包括给予治疗有效量的式(I)的化合物,或其盐、溶剂合物,或生理功能性衍生物:
其中:
W是N或C-R,其中R是氢、卤素或氰基;
J是氢、C1-C4烷基、C1-C4卤代烷基、芳烷基、氰基烷基、-(CH2)pC=CH(CH2)tH、-(CH2)pC≡CH(CH2)tH,或C3-C7环烷基;
p为1、2或3;
t为0或1;
D为-N(R8)(X);
X是由-(X1)-(X2)q-(X3)定义的基团,
其中,
X1是C(O)或C(S)并且q是1,或
X1是-C(O)或-S(O)2并且q是0,
X2是N(H)或O,以及
X3是烷基、环烷基、杂环基、烷氧基、芳氧基、芳烷氧基、芳基、芳烷基,或杂芳基,或
被至少一个由-(X4)z-(X5)定义的基团所取代的烷基、环烷基、杂环基、烷氧基、芳氧基、芳烷氧基、芳基、芳烷基或杂芳基,
X4是C(H)2,其中z是0、1、2、3或4,和
X5是氢、C1-C6烷基、C1-C6卤代烷基、环烷基、杂环基、芳基、杂芳基、烷氧基、卤代烷氧基、羟基、芳氧基、芳烷氧基、卤素、-CN、-NR’R’、N(H)C(O)R”、N(H)C(O)OR”、N(H)C(O)NR’R’、N(H)S(O)2R”、OR”、OC(O)R”、C(O)R”、SR”、-S(O)R”’、-S(O)2R”’、或-S(O)2NR’R’,
其中,
R’是氢、烷基、环烷基、杂环基、-OR1、-SR1、-S(O)2R1、-S(O)R1、或C(O)R1;
R”是氢、烷基、环烷基、杂环基、-OR1、-NR3R4、-S(O)2R1、-S(O)R1、或C(O)R1;和
R”’是氢、烷基、环烷基、杂环基、-OR1或-NR3R4;
Q1是氢、卤素、C1-C2卤代烷基、C1-C2烷基、C1-C2烷氧基或C1-C2卤代烷氧基;
Q2是A1或A2;
当Q2是A2时Q3是A1,当Q2是A1时Q3是A2;
其中,
A1是氢、卤素、C1-C3烷基、C1-C3卤代烷基,-OR1,和
A2是由-(Z)m-(Z1)-(Z2)定义的基团,
其中,
Z是CH2且m是0、1、2或3,或
Z是NR2且m是0或1,或
Z是氧且m是0或1,或
Z是CH2NR2且m是0或1;
Z1是S(O)2、S(O)或C(O);和
Z2是C1-C4烷基、环烷基、杂环基、NR3R4、芳基、芳基氨基、芳烷基、芳烷氧基或杂芳基;
R1是氢、烷基、杂环基和-NR3R4;
R2、R3和R4各自独立地选自氢、羟基、烷氧基、芳氧基、芳烷氧基、氨基、烷基氨基、芳基氨基、芳烷基氨基、C1-C4烷基、C3-C7环烷基、杂环基、-S(O)2R5和-C(O)R5;
R5是C1-C4烷基或C3-C7环烷基;和
R8为氢或C1-C3烷基。
另一方面,进一步提供了式(I)、(II)和/或(III)的新化合物。
另一方面,提供了式(I)、(II)和/或(III)的化合物在制备用于抑制受试者中坏死性凋亡的药物的用途。
另一方面,提供了式(I)、(II)和/或(III)的化合物用于抑制坏死性凋亡的用途。
另一方面,提供了用于抑制坏死性凋亡的式(I)、(II)和/或(III)的化合物。
另一方面,提供了当用于抑制坏死性凋亡时的式(I)、(II)和/或(III)的化合物。
除非另有明确说明,本文的任何实施例应被作必要修改以适用于任何其它实施例。
本发明不限于本文所描述的具体实施例的范围,这些实施例仅用于示例的目的。如本文所述,功能等同的产品、组合物和方法显然在本发明的范围内。
在整个说明书中,除非另有特别说明或上下文另有要求,提及单个步骤、物质组成、步骤组或物质组合物组应被认为包括一个和多个(即一个或多个)那些步骤、物质组合物、步骤组或物质组合物组。
下文通过以下非限制性实施例并参考附图描述本发明。
附图说明
图1:化合物1抑制MLKL-诱导的坏死性凋亡的机理研究。(A):使用热稳定性位移测定法化合物1被鉴定为小鼠MLKL相互作用物。(B):通过表面等离子体共振(SPR)验证与小鼠MLKL假激酶结构域结合的化合物1。(C):化合物1以剂量依赖性方式抑制用TSQ刺激的野生型MDF的坏死性死亡。所示数据是3次独立实验的平均值±SEM。(D):化合物1阻滞蓝色非变性PAGE的抗MLKL印迹中的膜部分的易位。通过对于GADPH和VDAC1的对照印迹说明细胞质和膜部分纯度和蛋白质丰度。
图2:(A):显示与小鼠MLKL结合的核苷酸的饱和度转移差异(STD)NMR光谱。数据显示,化合物1可以与(i)ATP和(ii)ADP竞争结合小鼠MLKL假激酶结构域。偏离共振光谱的低场区域显示检测到在不存在蛋白质时200μM ATP(i)或ADP(ii)的峰。在2μM小鼠MLKL(179-464)存在下,在ATP(i)或ADP(ii)上进行的STD-NMR实验中观察到用星号标记的峰,确认核苷酸结合。这些峰在200μM化合物1的存在下减少,证实通过加入化合物1从小鼠MLKL(179-464)中置换出ATP和ADP和化合物1。(B):浓度≥5μM的化合物1的毒性诱导野生型MDF死亡。显示三次重复实验的平均值±SEM。(C):体外激酶测试,证明化合物1相对于DMSO对照(“0”泳道)对重组RIPK3激酶活性没有影响。化合物1浓度≥10μM可重复地导致小鼠MLKL(179-464)的磷酸化增加。所示的实验是三种独立测试的代表。左图,干燥考马斯染色4-12%Bis-Tris凝胶;右图,相同凝胶的放射自显影。
图3:(A):显示与人MLKL结合的核苷酸的STD NMR光谱。数据显示化合物1可以与(i)ATP和(ii)ADP竞争结合人MLKL假激酶结构域。偏离共振光谱的低场区显示检测到在不存在蛋白质时200μM ATP(i)或ADP(ii)的峰。在2μM人MLKL(190-471)存在时,在ATP(i)或ADP(ii)上进行的STD-NMR实验中观察到用星号标记的峰,确认核苷酸结合。这些峰在200μM化合物1存在时减少,证实通过加入化合物1从人MLKL(190-471)中置换出ATP和ADP和化合物1。(B):通过SPR验证化合物1结合人MLKL(190-471)。(C):化合物1以剂量依赖性方式抑制用TSQ刺激的野生型U937细胞系的坏死性死亡。所示数据是5次独立实验的平均值±SD。(D):化合物1在基因编辑以删除MLKL的U937细胞中的毒性。在不存在MLKL时,TSQ刺激的细胞与未受刺激的细胞表现等同。TS处理说明细胞保留了经历凋亡死亡的能力,并且这不受化合物1处理的影响。所示数据是2次独立实验的平均值±SD。
图4:(A):索拉非尼,具有与化合物1类似的蛋白激酶靶标谱的蛋白激酶抑制剂,在相同于或小于1μM浓度,不抑制野生型MDF中TSQ-诱导的细胞死亡。显示三次重复实验的平均值±SEM。(B):索拉非尼,具有与化合物1相似的蛋白激酶靶标谱的蛋白激酶抑制剂,在野生型U937细胞中不抑制TSQ-诱导的坏死性凋亡。显示两次重复实验的平均值±SEM。
图5:(A)和(B):化合物3和人MLKL的复合物,证明化合物3在人MLKL的ATP结合位点内结合。
图6:显示化合物1抑制聚肌胞(Poly(I:C))-诱导的RIP1非依赖性坏死性凋亡的图。
图7:SEQ ID NO:1是MLKL蛋白的人全长同种型(isoform)的氨基酸序列。
图8:SEQ ID NO:2是MLKL蛋白的人短同种型的氨基酸序列。
图9:SEQ ID NO:3是MLKL蛋白的小鼠全长同种型的氨基酸序列。
图10:SEQ ID NO:4是464-氨基酸MLKL蛋白的小鼠短同种型的氨基酸序列。
序列表要点
SEQ ID NO:1是MLKL蛋白的人全长同种型的氨基酸序列。
SEQ ID NO:2是MLKL蛋白的人短同种型的氨基酸序列。
SEQ ID NO:3是MLKL蛋白的小鼠全长同种型的氨基酸序列。
SEQ ID NO:4是464-氨基酸MLKL蛋白的小鼠短同种型的氨基酸序列。
具体实施方式
应当理解,在本说明书中公开和定义的本发明延伸到文本或附图提及的或从中显而易见获得的两个或更多个单独特征的所有替代组合。所有这些不同的组合构成本发明的各种替代方面。
在过去5年中,已经出现程序性坏死或“坏死性凋亡”作为细胞死亡机制,补充了多细胞生物体中凋亡这一常规细胞死亡途径。与凋亡相反,坏死性凋亡看起来不在多细胞生物体发育中起重要作用,但在对抗病原体的防御中起作用,并且在许多破坏性炎症状况中是可能的罪魁祸首。2009年,受体相互作用蛋白激酶-3(RIPK3)被确定为坏死性凋亡的关键效应子,2012年确定其底物,假激酶混合系列激酶域样(MLKL),但诱导细胞死亡所需的RIPK3-介导的MLKL磷酸化后的分子事件尚不清楚。已经声称RIPK1/RIPK3/MLKL坏死(necrosome)激活PGAM5和Drp1以引起线粒体片段化和细胞死亡,但是对于用于坏死的PGAM5、Drp1和线粒体的需求已被质疑。MLKL是在坏死性凋亡细胞死亡途径中必需的效应子蛋白(Sun等人,Cell,148(1-2),213-227,2012;Zhao等人,PNAS,109(14),5322-5327;Murphy等人,Immunity,39(3),443-453,2013)。
MLKL含有通过两个螺旋接头(“支架(brace)”螺旋)连接的C-末端假激酶结构域和N-末端四螺旋束(4HB)结构域。本发明是基于我们的突变和生物化学分析,其证明MLKL 4HB结构域足以诱导坏死性凋亡,其中几个带电残基聚集在4HB结构域的两个面上,是该功能所需的。令人惊奇的是,这些带电荷残基中的几个的极性在小鼠和人MLKL之间不守恒,并且在4HB结构域的α4螺旋上的带负电残基的丙氨酸取代破坏功能。这一发现挑战了结合至杀伤活性4HB结构域的磷脂的重要性,并且说明膜结合不能仅仅归因于MLKL 4HB结构域内较差保守碱性残基之间的相互作用。有趣的是,4HB结构域上第二个残基簇的突变不妨碍寡聚和膜定位,说明尽管膜易位可能是4HB结构域的杀伤功能的基础,但其不足以诱导细胞死亡。
不希望受理论束缚,这些数据支持MLKL功能的模型,其中MLKL的假激酶结构域抑制4HB结构域,直到被RIPK3磷酸化,其引起假激酶结构域中的构象变化以释放4HB结构域以进行寡聚并与膜结合。MLKL活化中的这个步骤可以被靶向MLKL假激酶结构域内的ATP结合位点的小分子阻碍,从而阻碍MLKL易位到膜并防止坏死性凋亡。靶向假激酶的ATP结合位点或“假活性”位点是迄今未开发的一类治疗靶标。因此,通过靶向MLKL防止坏死性凋亡的化合物的鉴定将有利于治疗与失调的坏死性凋亡相关的病症。
本发明证明MLKL寡聚和膜易位可以被化合物抑制,所述化合物基于其对MLKL假激酶结构域的ATP结合位点的亲和力来鉴定。此外,本发明证明了通过小分子抑制MLKL寡聚和膜易位实现了抑制坏死作用。
本发明的一方面,提供了在有需要的受试者中抑制坏死性凋亡的方法,所述方法包括给予治疗有效量的结合混合系列激酶域样(MLKL)蛋白的假激酶结构域的ATP结合位点的化合物。
如上所述,认为MLKL的假激酶结构域抑制4HB结构域直到被RIPK3磷酸化,其引起假激酶结构域中的构象变化以释放4HB结构域,从而寡聚并与膜结合,从而导致坏死性凋亡。因此,在本发明的一实施例中,给予所述化合物抑制MLKL的构象变化。在另一个实施例中,所述MLKL的构象变化涉及MLKL的四螺旋束(4HB)结构域的释放。在另一实施例中,给予所述化合物抑制MLKL寡聚。在另一实施例中,给予所述化合物抑制MLKL易位至细胞膜。在另一实施例中,给予所述化合物抑制MLKL的构象变化,抑制MLKL寡聚并抑制MLKL易位至细胞膜。
人和小鼠MLKL都具有通过选择性剪接产生的两种转录同种型。人MLKL同种型1是较长的人转录物并编码471-氨基酸蛋白(SEQ ID NO:1)的全长同种型。人同种型2缺少外显子4-8并且编码263-氨基酸蛋白(SEQ ID NO:2)的短同种型。虽然人MLKL的两种同种型具有相同的N和C末端(如WO2010/122135中所述),但全长人MLKL而不是该基因的短同种型,具有一个蛋白激酶样结构域(如在WO2010/122135中所述;人MLKL的190-471(SEQ ID NO:1);Murphy等人,Biochem J,457(3):369-77,2004)。小鼠MLKL的两种同种型都含有一个蛋白激酶样结构域(氨基酸179-472(SEQ ID NO:3),179-464(SEQ ID NO:4))。因此,本发明涵盖的化合物结合人MLKL同种型1(SEQ ID NO:1),小鼠MLKL同种型1(SEQ ID NO:3)和2(SEQ ID NO:4)及其各种已知的天然变体。在人MLKL的蛋白激酶样结构域内存在ATP结合位点(SEQ ID NO:1的氨基酸209-217),其结合ATP和其它核苷酸(包括但不限于AMP,ADP和AMPPNP)。在人MLKL中,ATP(和其他核苷酸)结合不连续残基的袋(状结构),该不连续残基的袋(状结构)包括来自N端半段结构(N-lobe)的β3链的K230和来自常规蛋白激酶的“催化”环的对应物的K331(Murphy等人,Biochem J,457(3):369-77,2014)。MLKL还具有N末端四螺旋束(4HB)结构域(在SEQ ID NO:1、2、3、4的氨基酸1-125内;Murphy等人,免疫(Immunity),39(3),443-453,2013)。4HB是MLKL中的死亡效应子结构域,其具有依赖于4HB的寡聚化以及质膜结合的MLKL的细胞杀伤功能。
设想本发明的化合物可以结合各物种的MLKL并抑制坏死性凋亡。例如,本发明的化合物可以结合人MLKL(SEQ ID NO:1、或其变体、或类似物;Murphy等人,The Biochemical Journal,457(3),369-377,2014)并抑制坏死性凋亡。在另一个实施例中,本发明的化合物可以结合小鼠MLKL(SEQ ID NO:3,SEQ ID NO:4,或其变体,或类似物;Murphy等人,Immunity,39(3),443-453,2013)和抑制坏死性凋亡。
如本文所用,术语“假激酶结构域”,如本领域技术人员所理解的,是指含有催化惰性或催化缺陷的激酶结构域的蛋白质。“假激酶结构域”通常被称为“蛋白激酶样结构域”,因为这些结构域缺乏已知催化磷酰基转移的保守残基。本领域技术人员应当理解,尽管预测假激酶结构域主要作为催化独立的蛋白相互作用模块起作用,但几个假激酶结构域被归因于意想不到的催化功能。因此,在本发明中,术语“假激酶结构域”包括缺乏激酶活性的“假激酶结构域”和具有弱激酶活性的“假激酶结构域”。
如本文所用,术语“ATP结合位点”,如本领域技术人员所理解的,是指促进ATP与靶蛋白附着的蛋白质亚基的特定序列。ATP结合位点是一种蛋白质微环境,其中ATP被捕获并水解为ADP,从而释放通过改变蛋白质形状和/或使酶具有催化活性而被蛋白质利用的能量。在假激酶结构域中,“ATP结合位点”通常称为“假活性位点”。术语“ATP结合位点”也可以称为“核苷酸结合位点”,因为在该位点的结合包括除ATP以外的核苷酸的结合。本领域技术人员应当理解,术语“核苷酸”包括任何核苷酸。示例性核苷酸包括但不限于AMP、ADP、ATP、AMPPNP、GTP、CTP和UTP。
如本文所述,抑制坏死性凋亡包括完全和部分抑制坏死性凋亡。在一实施例中,抑制坏死性凋亡是完全抑制。在另一个实施例中,抑制坏死性凋亡是部分抑制。
化合物与MLKL的假激酶结构域的ATP结合位点的结合可以通过本领域技术人员认为适合这种用途的任何方法来确定。在本发明的一实施例中,化合物与MLKL的假激酶结构域的ATP结合位点的结合通过一种或多种选自下组的测试来确定,所述测试包括但不限于热位移测试,表面等离子体共振(SPR)和饱和度转移差异NMR(STD-NMR)。在另一实施例中,化合物与MLKL的假激酶结构域的ATP结合位点的结合通过热位移测试确定。在另一实施例中,化合物与MLKL的假激酶结构域的ATP结合位点的结合通过SPR确定。在另一实施例中,化合物与MLKL的假激酶结构域的ATP结合位点的结合通过STD-NMR确定。在另一个实施例中,化合物与MLKL的假激酶结构域的ATP结合位点的结合通过热位移测试和一个或多个另外的测试来确定。在另一个实施例中,另外的测试选自下组,包括但不限于,SPR和STD-NMR。
热位移测试(也称为差示扫描荧光法(DSF))是热变性测试,其测量靶蛋白的热稳定性和配体与蛋白结合后蛋白熔融温度的后续升高。低分子量配体的结合可以增加蛋白质的热稳定性,并且通过在荧光染料的存在下进行热变性曲线来测量热稳定性变化。所用的荧光染料通常是非特异性染料(例如SYPRO橙),并非特异性地结合到疏水表面,并且水强烈地淬灭荧光染料的荧光。当蛋白质解折叠时,暴露的疏水性表面结合染料,导致荧光增加。通过逐渐升高温度以展开蛋白质并测量每个点的荧光,获得蛋白质解折叠转变(熔解温度,Tm)的稳定性曲线及其中点值。仅测量蛋白质和蛋白质加配体的曲线,并计算ΔTm。正ΔTm值表明配体稳定蛋白质免于变性,并因此结合蛋白质。基于荧光的热位移测试可以在结合样品温度控制和染料荧光检测的仪器上进行,例如容易获得的实时聚合酶链反应(RT-PCR)机器。
表面等离子体共振(SPR)技术是用于测量结合到表面的分子和定量在不使用标签的溶液中表面固定化蛋白和如其他蛋白质,肽,核酸,脂质或小分子的分析物之间的结合常数的公认方法。SPR效应依赖于与固定化表面相邻的溶液的折射率的变化,并且极其敏感。结合反应以共振单位(RU)测量,并与传感器芯片表面上的分子质量成比例,因此与表面上的分子数量成比例。相互作用的亲和力可以从速率常数的比率(Kd=kdiss/kass)或通过不同浓度的分析物在平衡时响应的线性或非线性拟合来计算。
饱和度转移差异NMR(STD-NMR)可以检测小分子配体与大分子受体如蛋白质的瞬时结合。在STD-NMR中,通过直接观察来自配体本身的NMR信号来测量从受体转移到其结合的配体的磁化。低功率照射应用于包含蛋白质信号但不包含配体信号的(1)H NMR光谱区。这种辐射通过自旋扩散过程迅速扩散遍及膜蛋白,并饱和所有蛋白质(1)H NMR信号。来自与膜蛋白瞬时结合的配体的(1)H NMR信号变得饱和,并且在解离时用于降低测量自游离配体池的(1)H NMR信号的强度。用放置在蛋白质和配体的光谱区域外的照射脉冲重复实验,该条件不导致对配体的饱和转移。减去所得的两个谱产生差谱。所得到的差谱仅产生那些经历饱和的共振,即受体的那些和与受体结合的化合物的那些。因此,STD-NMR可用于测定化合物的结合表位。竞争STD-NMR方法将STD-NMR与竞争结合实验组合,以检测在NMR时标上经历缓慢化学交换的高亲和力配体。使用该技术,化合物混合物中竞争的高亲和力配体的存在可以通过低亲和性指示剂配体的STD信号的消失或减少来检测。因此,该方法可用于基于STD指示剂的信号强度的降低得到化合物的结合亲和力(Kd)。
如本文所述,结合MLKL蛋白的假激酶结构域的ATP结合位点的化合物可以是发挥所述功能从而实现抑制坏死性凋亡的任何化合物。要强调的是,该化合物不限于任何特定的化学类型、形式、大小、形状或构象。因此,该化合物可以选自合成化合物、有机合成药物、小分子有机药物、天然小分子化合物、其它小分子化合物和肽。
这样的化合物可以以本领域技术人员已知适合的任何方式鉴定。可以通过靶向药物开发或通过商业库的筛选来鉴定化合物。这种商业库的筛选将包括中或高通量筛选。在一实施例中,通过筛选一个或多个商业库来鉴定化合物。
化合物与MLKL的假激酶结构域的ATP结合位点的结合可以通过效应子激酶抑制MLKL的磷酸化,或者化合物与MLKL的假激酶结构域的ATP结合位点的结合可以不通过效应子激酶抑制MLKL的磷酸化。本发明证明,如本文所述,结合MLKL蛋白的假激酶结构域的ATP结合位点的化合物可以抑制坏死性凋亡,而不通过效应子激酶抑制MLKL的磷酸化。在一实施例中,化合物与MLKL的假激酶结构域的ATP结合位点的结合不通过效应子激酶抑制MLKL的磷酸化。在另一实施例中,化合物与MLKL的假激酶结构域的ATP结合位点的结合通过效应子激酶抑制MLKL的磷酸化。
本文所述的化合物可以是任何合适的化学类型、形式、大小、形状和构象。在一实施例中,所述化合物具有高达且包含约的体积。在一实施例中,所述化合物具有高达且包含约的体积。在一实施例中,所述化合物具有高达且包含约的体积。在一实施例中,所述化合物具有高达且包含约的体积。在一实施例中,所述化合物具有高达且包含约的体积。在另一实施例中,所述化合物具有从约至约的体积。在另一实施例中,所述化合物具有从约至约的体积。在另一实施例中,所述化合物具有从约至约的体积。在另一实施例中,所述化合物具有从约至约的体积。在另一实施例中,所述化合物具有从约至约的体积。在另一实施例中,所述化合物具有从约至约的体积。在另一实施例中,所述化合物具有从约至约的体积。在另一实施例中,所述化合物具有从约至约的体积。在另一实施例中,所述化合物具有从约至约的体积。在另一实施例中,所述化合物具有从约至约的体积。在另一实施例中,所述化合物具有从约至约的体积。
在本发明的一实施例中,所述化合物具有下式
其中,R1选自下组:3-MeSO2CH2-、4-MeSO2CH2-、3-H2NSO2-和4-H2NSO2-;和
R2是0-2个取代基,所述取代基独立地选自下组:OCF3、CF3、氟、氯、溴、碘和COMe,
或其药学上可接受的衍生物、多晶型物、盐或前药。在一实施例中,R1为3-H2NSO2-。在另一实施例中,R1为4-H2NSO2-。
在一实施例中,R2为0个取代基。在另一实施例中,R2为4-OCF3。在另一实施例中,R2为2个取代基,且其中所述2个取代基为3-CF3和6-氟。
在另一实施例中,式III化合物选自化合物1-4的组,
在另一实施例中,式III化合物为化合物1,
在一方面,用于抑制坏死性凋亡的化合物具有式(I)所示的结构式,或其盐、溶剂合物、或生理功能性衍生物:
其中:
W是N或C-R,其中R是氢、卤素或氰基;
J是氢、C1-C4烷基、C1-C4卤代烷基、芳烷基、氰基烷基、-(CH2)pC=CH(CH2)tH、-(CH2)pC≡CH(CH2)tH,或C3-C7环烷基;
p为1、2或3;
t为0或1;
D为-N(H)(X);
X是由-(X1)-(X2)q-(X3)定义的基团,其中,
X1是C(O)或C(S)并且q是1,或
X1是-C(O)或-S(O)2并且q是0,
X2是N(H)或O,以及
X3是烷基、环烷基、杂环基、烷氧基、芳氧基、芳烷氧基、芳基、芳烷基,或杂芳基,或
被至少一个由-(X4)z-(X5)定义的基团所取代的烷基、环烷基、杂环基、烷氧基、芳氧基、芳烷氧基、芳基、芳烷基或杂芳基,
X4是C(H)2,其中z是0、1、2、3或4,和
X5是氢、C1-C6烷基、C1-C6卤代烷基、环烷基、杂环基、芳基、杂芳基、烷氧基、卤代烷氧基、羟基、芳氧基、芳烷氧基、卤素、-CN、-NR’R’、N(H)C(O)R”、N(H)C(O)OR”、N(H)C(O)NR’R’、N(H)S(O)2R”、OR”、OC(O)RR”、C(O)R”、SR”、-S(O)R”’、S(O)2R”’或S(O)2NR’R’,其中,
R’是氢、烷基、环烷基、杂环基、-OR1、–SR1、-S(O)2R1、-S(O)R1、或C(O)R1;
R”是氢、烷基、环烷基、杂环基、-OR1、-NR3R4、-S(O)2R1、-S(O)R1或C(O)R1;和
R”’是氢、烷基、环烷基、杂环基、-OR1或-NR3R4;
Q1是氢、卤素、C1-C2卤代烷基、C1-C2烷基、C1-C2烷氧基或C1-C2卤代烷氧基;
Q2是A1或A2;
当Q2是A2时Q3是A1,当Q2是A1时Q3是A2;
其中,
A1是氢、卤素、C1-C3烷基、C1-C3卤代烷基,-OR1,和
A2是由-(Z)m-(Z1)-(Z2)定义的基团,其中
Z是CH2且m是0、1、2或3,或
Z是NR2且m是0或1,或
Z是氧且m是0或1,或
Z是CH2NR2且m是0或1;
Z1是S(O)2、S(O)或C(O);和
Z2是C1-C4烷基、环烷基、杂环基、NR3R4、芳基、芳基氨基、芳烷基、芳烷氧基或杂芳基;
R1是氢、烷基、杂环基和-NR3R4;
R2、R3和R4各自独立地选自氢、羟基、烷氧基、芳氧基、芳烷氧基、氨基、烷基氨基、芳基氨基、芳烷基氨基、C1-C4烷基、C3-C7环烷基、杂环基、-S(O)2R5和-C(O)R5;和
R5是C1-C4烷基或C3-C7环烷基。
另一方面,用于抑制坏死性凋亡的化合物具有式(II)所示的结构式,或其盐、溶剂合物、或生理功能性衍生物:
其中:
D为-N(H)(X);
X是由-(X1)-(X2)q-(X3)定义的基团,其中,
X1是C(O)或C(S)并且q是1,或
X1是-C(O)或-S(O)2并且q是0,
X2是N(H)或O,以及
X3是烷基、环烷基、杂环基、烷氧基、芳氧基、芳烷氧基、芳基、芳烷基,或杂芳基,或
被至少一个由-(X4)z-(X5)定义的基团所取代的烷基、环烷基、杂环基、烷氧基、芳氧基、芳烷氧基、芳基、芳烷基或杂芳基,
X4是C(H)2,其中z是0、1、2、3或4,和
X5是氢、C1-C6烷基、C1-C6卤代烷基、环烷基、杂环基、芳基、杂芳基、烷氧基、卤代烷氧基、羟基、芳氧基、芳烷氧基、卤素、-CN、-NR’R’、N(H)C(O)R”、N(H)C(O)OR”、N(H)C(O)NR’R’、N(H)S(O)2R”、OR”、OC(O)R”、C(O)R”、SR”、-S(O)R”’、S(O)2R”’、或S(O)2NR’R’,其中,
R’是氢、烷基、环烷基、杂环基、-OR1、-SR1、-S(O)2R1、-S(O)R1、或C(O)R1;
R”是氢、烷基、环烷基、杂环基、-OR1、-NR3R4、-S(O)2R1、-S(O)R1、或C(O)R1;和
R”’是氢、烷基、环烷基、杂环基、-OR1或-NR3R4;
Q1是氢、卤素、C1-C2卤代烷基、C1-C2烷基、C1-C2烷氧基或C1-C2卤代烷氧基;
Q2是A1或A2;
当Q2是A2时Q3是A1,当Q2是A1时Q3是A2;
其中,
A1是氢、卤素、C1-C3烷基、C1-C3卤代烷基,-OR1,和
A2是由-(Z)m-(Z1)-(Z2)定义的基团,其中,
Z是CH2且m是0、1、2或3,或
Z是NR2且m是0或1,或
Z是氧且m是0或1,或
Z是CH2NR2且m是0或1;
Z1是S(O)2、S(O)或C(O);和
Z2是C1-C4烷基、环烷基、杂环基、NR3R4、芳基、芳基氨基、芳烷基、芳烷氧基或杂芳基;
R1是氢、杂环基和-NR3R4;
R2、R3和R4各自独立地选自氢、羟基、烷氧基、芳氧基、芳烷氧基、氨基、烷基氨基、芳基氨基、芳烷基氨基、C1-C4烷基、C3-C7环烷基、杂环基、-S(O)2R5和-C(O)R5;和
R5是C1-C4烷基或C3-C7环烷基。
另一方面,用于抑制坏死性凋亡的化合物具有式(I)所示的结构式,或其盐、溶剂合物、或生理功能性衍生物:
其中,
W是N或C-R,其中R是氢、卤素或氰基;
J是氢、C1-C4烷基、C1-C4卤代烷基、芳烷基、氰基烷基、-(CH2)pC=CH(CH2)tH、-(CH2)pC≡CH(CH2)tH,或C3-C7环烷基;
p为1、2或3;
t为0或1;
D为
q为1、2或3;
Q1是氢、卤素、C1-C2卤代烷基、C1-C2烷基、C1-C2烷氧基或C1-C2卤代烷氧基;
Q2是A1或A2;
当Q2是A2时Q3是A1,当Q2是A1时Q3是A2;
其中,
A1是氢、卤素、C1-C3烷基、C1-C3卤代烷基,-OR1,和
A2是由-(Z)m-(Z1)-(Z2)定义的基团,
其中,
Z是CH2且m是0、1、2或3,或
Z是NR2且m是0或1,或
Z是O且m是0或1,或
Z是CH2NR2且m是0或1;
Z1是S(O)2、S(O)或C(O);和
Z2是C1-C4烷基、环烷基、杂环基、NR3R4、芳基、芳基氨基、芳烷基、芳烷氧基或杂芳基;
R2、R3和R4各自独立地选自氢、羟基、烷氧基、芳氧基、芳烷氧基、氨基、烷基氨基、芳基氨基、芳烷基氨基、C1-C4烷基、C3-C7环烷基、杂环基、-S(O)2R5和-C(O)R5;
R5是C1-C6烷基或C3-C7环烷基;和
R6为由-(X4)z-(X5)定义的基团,
其中,
X4是C(H)2,其中z是0、1、2、3或4,和
X5是氢、C1-C6烷基、C1-C6卤代烷基、环烷基、杂环基、芳基、杂芳基、烷氧基、卤代烷氧基、羟基、芳氧基、芳烷氧基、卤素、CN、-NR7R7、-N(H)C(O)R7、-N(H)C(O)OR R7R7N(H)S(O)2R7、N(H)S(O)2NR7R7、-OC(O)R7、OC(O)NR7R7、-C(O)R7、-C(O)NR7R7、-SR7,-S(O)R7、S(O)2R7R7、或-S(O)2NR7R7;和
R7为氢、C1-C6烷基、C1-C6卤代烷基、环烷基、杂环基、烷基氨基、烷氧基、芳氧基、芳烷氧基、芳基氨基、芳烷基氨基、芳基或杂芳基。
另一方面,用于抑制坏死性凋亡的化合物具有式(II)所示的结构式,或其盐、溶剂合物、或生理功能性衍生物:
其中:
D为
q为1、2或3;
Q1是氢、卤素、C1-C2卤代烷基、C1-C2烷基、C1-C2烷氧基或C1-C2卤代烷氧基;
Q2是A1或A2;
当Q2是A2时Q3是A,当Q2是A1时Q3是A2;其中,
A1是氢、卤素、C1-C3烷基、C1-C3卤代烷基,-OR1,和
A2是由-(Z)m-(Z1)-(Z2)定义的基团,
其中,
Z是CH2且m是0、1、2或3,或
Z是NR2且m是0或1,或
Z是O且m是0或1,或
Z是CH2NR2且m是0或1;
Z1是S(O)2、S(O)或C(O);和
Z2是C1-C4烷基、环烷基、杂环基、NR3R4、芳基、芳基氨基、芳烷基、芳烷氧基或杂芳基;
R2、R3和R4各自独立地选自氢、羟基、烷氧基、芳氧基、芳烷氧基、氨基、烷基氨基、芳基氨基、芳烷基氨基、C1-C4烷基、C3-C7环烷基、杂环基、-S(O)2RS和-C(O)R5;
R5是C1-C6烷基或C3-C7环烷基;和
R6为由-(X4)z-(X5)定义的基团,其中,
X4是C(H)2,其中z是0、1、2、3或4,和
X5是氢、C1-C6烷基、C1-C6卤代烷基、环烷基、杂环基、芳基、杂芳基、烷氧基、卤代烷氧基、羟基、芳氧基、芳烷氧基、卤素、CN、-NR7R7、-N(H)C(O)R7、-N(H)C(O)OR7、-N(H)C(O)NR7R7、N(H)S(O)2R7、N(H)S(O)2NR7R7、-OC(O)R7、OC(O)NR7R7、-C(O)R7、-O)NR7R7、-SR7、-S(O)R7、-S(O)2R7R7、或-S(O)2NR7R7;和
R7为氢、C1-C6烷基、C1-C6卤代烷基、环烷基、杂环基、烷基氨基、烷氧基、芳氧基、芳烷氧基、芳基氨基、芳烷基氨基、芳基或杂芳基。
另一方面,用于抑制坏死性凋亡的化合物具有式(I)所示的结构式,或其盐、溶剂合物、或生理功能性衍生物:
其中:
W是N或C-R,其中R是氢、卤素或氰基;
J是氢、C1-C4烷基、C1-C4卤代烷基、芳烷基、氰基烷基、-(CH2)pC=CH(CH2)tH、-(CH2)pC≡CH(CH2)tH,或C3-C7环烷基;
p为1、2或3;
t为0或1;
D为-N(R8)(X);
X是由-(X1)-(X2)q-(X3)定义的基团,
其中,
X1是C(O)或C(S)并且q是1,或
X1是-C(O)或-S(O)2并且q是0,
X2是N(H)或O,以及
X3是烷基、环烷基、杂环基、烷氧基、芳氧基、芳烷氧基、芳基、芳烷基,或杂芳基,或
被至少一个由-(X4)z-(X5)定义的基团所取代的烷基、环烷基、杂环基、烷氧基、芳氧基、芳烷氧基、芳基、芳烷基或杂芳基,
X4是C(H)2,其中z是0、1、2、3或4,和
X5是氢、C1-C6烷基、C1-C6卤代烷基、环烷基、杂环基、芳基、杂芳基、烷氧基、卤代烷氧基、羟基、芳氧基、芳烷氧基、卤素、-CN、-NR’R’、N(H)C(O)R”、N(H)C(O)OR”、N(H)C(O)NR’R’、N(H)S(O)2R”、OR”、OC(O)R”、C(O)R”、SR”、-S(O)R”’、-S(O)2R”’、或-S(O)2NR’R’,其中,
R’是氢、烷基、环烷基、杂环基、-OR1、-SR1、-S(O)2R1、-S(O)R1、或C(O)R1;
R”是氢、烷基、环烷基、杂环基、-OR1、-NR3R4、-S(O)2R1、-S(O)R1、或C(O)R1;和
R”’是氢、烷基、环烷基、杂环基、-OR1或-NR3R4;
Q1是氢、卤素、C1-C2卤代烷基、C1-C2烷基、C1-C2烷氧基或C1-C2卤代烷氧基;
Q2是A1或A2;
当Q2是A2时Q3是A1,当Q2是A1时Q3是A2;
其中,
A1是氢、卤素、C1-C3烷基、C1-C3卤代烷基,-OR1,和
A2是由-(Z)m-(Z1)-(Z2)定义的基团,
其中,
Z是CH2且m是0、1、2或3,或
Z是NR2且m是0或1,或
Z是氧且m是0或1,或
Z是CH2NR2且m是0或1;
Z1是S(O)2、S(O)或C(O);和
Z2是C1-C4烷基、环烷基、杂环基、NR3R4、芳基、芳基氨基、芳烷基、芳烷氧基或杂芳基;
R1是氢、烷基、杂环基和-NR3R4;
R2、R3和R4各自独立地选自氢、羟基、烷氧基、芳氧基、芳烷氧基、氨基、烷基氨基、芳基氨基、芳烷基氨基、C1-C4烷基、C3-C7环烷基、杂环基、-S(O)2R5和-C(O)R5;
R5是C1-C4烷基或C3-C7环烷基;和
R8为氢或C1-C3烷基。
另一方面,本发明提供了在有需要的受试者中抑制坏死性凋亡的方法,所述方法包括给予治疗有效量的式(I)的化合物,或其盐、溶剂合物,或生理功能性衍生物:
其中:
W是N或C-R,其中R是氢、卤素或氰基;
J是氢、C1-C4烷基、C1-C4卤代烷基、芳烷基、氰基烷基、-(CH2)pC=CH(CH2)tH、-(CH2)pC≡CH(CH2)tH,或C3-C7环烷基;
p为1、2或3;
t为0或1;
D为-N(H)(X);
X是由-(X1)-(X2)q-(X3)定义的基团,其中,
X1是C(O)或C(S)并且q是1,或
X1是-C(O)或-S(O)2并且q是0,
X2是N(H)或O,以及
X3是烷基、环烷基、杂环基、烷氧基、芳氧基、芳烷氧基、芳基、芳烷基,或杂芳基,或
被至少一个由-(X4)z-(X5)定义的基团所取代的烷基、环烷基、杂环基、烷氧基、芳氧基、芳烷氧基、芳基、芳烷基或杂芳基,
X4是C(H)2,其中z是0、1、2、3或4,和
X5是氢、C1-C6烷基、C1-C6卤代烷基、环烷基、杂环基、芳基、杂芳基、烷氧基、卤代烷氧基、羟基、芳氧基、芳烷氧基、卤素、-CN、-NR’R’、N(H)C(O)R”、N(H)C(O)OR”、N(H)C(O)NR’R’、N(H)S(O)2R”、OR”、OC(O)RR”、C(O)R”、SR”、-S(O)R”’、S(O)2R”’、或S(O)2NR’R’,其中,
R’是氢、烷基、环烷基、杂环基、-OR1、–SR1、-S(O)2R1、-S(O)R1、或C(O)R1;
R”是氢、烷基、环烷基、杂环基、-OR1、-NR3R4、-S(O)2R1、-S(O)R1或C(O)R1;和
R”’是氢、烷基、环烷基、杂环基、-OR1或-NR3R4;
Q1是氢、卤素、C1-C2卤代烷基、C1-C2烷基、C1-C2烷氧基或C1-C2卤代烷氧基;
Q2是A1或A2;
当Q2是A2时Q3是A1,当Q2是A1时Q3是A2;
其中,
A1是氢、卤素、C1-C3烷基、C1-C3卤代烷基,-OR1,和
A2是由-(Z)m-(Z1)-(Z2)定义的基团,其中,
Z是CH2且m是0、1、2或3,或
Z是NR2且m是0或1,或
Z是氧且m是0或1,或
Z是CH2NR2且m是0或1;
Z1是S(O)2、S(O)或C(O);和
Z2是C1-C4烷基、环烷基、杂环基、NR3R4、芳基、芳基氨基、芳烷基、芳烷氧基或杂芳基;
R1是氢、烷基、杂环基和-NR3R4;
R2、R3和R4各自独立地选自氢、羟基、烷氧基、芳氧基、芳烷氧基、氨基、烷基氨基、芳基氨基、芳烷基氨基、C1-C4烷基、C3-C7环烷基、杂环基、-S(O)2R5和-C(O)R5;和
R5是C1-C4烷基或C3-C7环烷基。
另一方面,本发明提供了在有需要的受试者中抑制坏死性凋亡的方法,所述方法包括给予治疗有效量的式(II)的化合物,或其盐、溶剂合物、或生理功能性衍生物:
其中:
D为-N(H)(X);
X是由-(X1)-(X2)q-(X3)定义的基团,其中,
X1是C(O)或C(S)并且q是1,或
X1是-C(O)或-S(O)2并且q是0,
X2是N(H)或O,以及
X3是烷基、环烷基、杂环基、烷氧基、芳氧基、芳烷氧基、芳基、芳烷基,或杂芳基,或
被至少一个由-(X4)z-(X5)定义的基团所取代的烷基、环烷基、杂环基、烷氧基、芳氧基、芳烷氧基、芳基、芳烷基或杂芳基,
X4是C(H)2,其中z是0、1、2、3或4,和
X5是氢、C1-C6烷基、C1-C6卤代烷基、环烷基、杂环基、芳基、杂芳基、烷氧基、卤代烷氧基、羟基、芳氧基、芳烷氧基、卤素、-CN、-NR’R’、N(H)C(O)R”、N(H)C(O)OR”、N(H)C(O)NR’R’、N(H)S(O)2R”、OR”、OC(O)R”、C(O)R”、SR”、-S(O)R”’、-S(O)2R”’、或-S(O)2NR’R’,其中,
R’是氢、烷基、环烷基、杂环基、-OR1、-SR1、-S(O)2R1、-S(O)R1、或C(O)R1;
R”是氢、烷基、环烷基、杂环基、-OR1、-NR3R4、-S(O)2R1、-S(O)R1、或C(O)R1;和
R”’是氢、烷基、环烷基、杂环基、-OR1或-NR3R4;
Q1是氢、卤素、C1-C2卤代烷基、C1-C2烷基、C1-C2烷氧基或C1-C2卤代烷氧基;
Q2是A1或A2;
当Q2是A2时Q3是A1,当Q2是A1时Q3是A2;
其中,
A1是氢、卤素、C1-C3烷基、C1-C3卤代烷基,-OR1,和
A2是由-(Z)m-(Z1)-(Z2)定义的基团,
其中,
Z是CH2且m是0、1、2或3,或
Z是NR2且m是0或1,或
Z是氧且m是0或1,或
Z是CH2NR2且m是0或1;
Z1是S(O)2、S(O)或C(O);和
Z2是C1-C4烷基、环烷基、杂环基、NR3R4、芳基、芳基氨基、芳烷基、芳烷氧基或杂芳基;
R1是氢、杂环基和-NR3R4;
R2、R3和R4各自独立地选自氢、羟基、烷氧基、芳氧基、芳烷氧基、氨基、烷基氨基、芳基氨基、芳烷基氨基、C1-C4烷基、C3-C7环烷基、杂环基、-S(O)2R5和-C(O)R5;和
R5是C1-C4烷基或C3-C7环烷基。
另一方面,本发明提供了在有需要的受试者中抑制坏死性凋亡的方法,所述方法包括给予治疗有效量的式(I)的化合物,或其盐、溶剂合物、或生理功能性衍生物:
其中,
W是N或C-R,其中R是氢、卤素或氰基;
J是氢、C1-C4烷基、C1-C4卤代烷基、芳烷基、氰基烷基、-(CH2)pC=CH(CH2)tH、-(CH2)pC≡CH(CH2)tH,或C3-C7环烷基;
p为1、2或3;
t为0或1;
D为
q为1、2或3;
Q1是氢、卤素、C1-C2卤代烷基、C1-C2烷基、C1-C2烷氧基或C1-C2卤代烷氧基;
Q2是A1或A2;
当Q2是A2时Q3是A1,当Q2是A1时Q3是A2;
其中,
A1是氢、卤素、C1-C3烷基、C1-C3卤代烷基,-OR1,和
A2是由-(Z)m-(Z1)-(Z2)定义的基团,
其中,
Z是CH2且m是0、1、2或3,或
Z是NR2且m是0或1,或
Z是O且m是0或1,或
Z是CH2NR2且m是0或1;
Z1是S(O)2、S(O)或C(O);和
Z2是C1-C4烷基、环烷基、杂环基、NR3R4、芳基、芳基氨基、芳烷基、芳烷氧基或杂芳基;
R2、R3和R4各自独立地选自氢、羟基、烷氧基、芳氧基、芳烷氧基、氨基、烷基氨基、芳基氨基、芳烷基氨基、C1-C4烷基、C3-C7环烷基、杂环基、-S(O)2R5和-C(O)R5;
R5是C1-C6烷基或C3-C7环烷基;和
R6为由-(X4)z-(X5)定义的基团,
其中,
X4是C(H)2,其中z是0、1、2、3或4,和
X5是氢、C1-C6烷基、C1-C6卤代烷基、环烷基、杂环基、芳基、杂芳基、烷氧基、卤代烷氧基、羟基、芳氧基、芳烷氧基、卤素、CN、-NR7R7、-N(H)C(O)R7、-N(H)C(O)OR R7R7N(H)S(O)2R7、N(H)S(O)2NR7R7、-OC(O)R7、OC(O)NR7R7、-C(O)R7、-C(O)NR7R7、-SR7,-S(O)R7、-S(O)2R7R7、或-S(O)2NR7R7;和
R7为氢、C1-C6烷基、C1-C6卤代烷基、环烷基、杂环基、烷基氨基。
另一方面,本发明提供了在有需要的受试者中抑制坏死性凋亡的方法,所述方法包括给予治疗有效量的式(II)的化合物,或其盐、溶剂合物、或生理功能性衍生物:
其中:
D为
q为1、2或3;
Q1是氢、卤素、C1-C2卤代烷基、C1-C2烷基、C1-C2烷氧基或C1-C2卤代烷氧基;
Q2是A1或A2;
当Q2是A2时Q3是A,当Q2是A1时Q3是A2;其中,
A1是氢、卤素、C1-C3烷基、C1-C3卤代烷基,-OR1,和
A2是由-(Z)m-(Z1)-(Z2)定义的基团,
其中,
Z是CH2且m是0、1、2或3,或
Z是NR2且m是0或1,或
Z是O且m是0或1,或
Z是CH2NR2且m是0或1;
Z1是S(O)2、S(O)或C(O);和
Z2是C1-C4烷基、环烷基、杂环基、NR3R4、芳基、芳基氨基、芳烷基、芳烷氧基或杂芳基;
R2、R3和R4各自独立地选自氢、羟基、烷氧基、芳氧基、芳烷氧基、氨基、烷基氨基、芳基氨基、芳烷基氨基、C1-C4烷基、C3-C7环烷基、杂环基、-S(O)2RS和-C(O)R5;
R5是C1-C6烷基或C3-C7环烷基;和
R6为由-(X4)z-(X5)定义的基团,其中,
X4是C(H)2,其中z是0、1、2、3或4,和
X5是氢、C1-C6烷基、C1-C6卤代烷基、环烷基、杂环基、芳基、杂芳基、烷氧基、卤代烷氧基、羟基、芳氧基、芳烷氧基、卤素、CN、-NR7R7、-N(H)C(O)R7、-N(H)C(O)OR7、-N(H)C(O)NR7R7、N(H)S(O)2R7、N(H)S(O)2NR7R7、-OC(O)R7、OC(O)NR7R7、-C(O)R7、-O)NR7R7、-SR7、-S(O)R7、-S(O)2R7R7、或-S(O)2NR7R7;和
R7为氢、C1-C6烷基、C1-C6卤代烷基、环烷基、杂环基、烷基氨基、烷氧基、芳氧基、芳烷氧基、芳基氨基、芳烷基氨基、芳基或杂芳基。
另一方面,本发明提供了在有需要的受试者中抑制坏死性凋亡的方法,所述方法包括给予治疗有效量的式(I)的化合物,或其盐、溶剂合物、或生理功能性衍生物:
其中:
W是N或C-R,其中R是氢、卤素或氰基;
J是氢、C1-C4烷基、C1-C4卤代烷基、芳烷基、氰基烷基、-(CH2)pC=CH(CH2)tH、-(CH2)pC≡CH(CH2)tH,或C3-C7环烷基;
p为1、2或3;
t为0或1;
D为-N(R8)(X);
X是由-(X1)-(X2)q-(X3)定义的基团,
其中,
X1是C(O)或C(S)并且q是1,或
X1是-C(O)或-S(O)2并且q是0,
X2是N(H)或O,以及
X3是烷基、环烷基、杂环基、烷氧基、芳氧基、芳烷氧基、芳基、芳烷基,或杂芳基,或
被至少一个由-(X4)z-(X5)定义的基团所取代的烷基、环烷基、杂环基、烷氧基、芳氧基、芳烷氧基、芳基、芳烷基或杂芳基,
X4是C(H)2,其中z是0、1、2、3或4,和
X5是氢、C1-C6烷基、C1-C6卤代烷基、环烷基、杂环基、芳基、杂芳基、烷氧基、卤代烷氧基、羟基、芳氧基、芳烷氧基、卤素、-CN、-NR’R’、N(H)C(O)R”、N(H)C(O)OR”、N(H)C(O)NR’R’、N(H)S(O)2R”、OR”、OC(O)R”、C(O)R”、SR”、-S(O)R”’、-S(O)2R”’、或-S(O)2NR’R’,其中,
R’是氢、烷基、环烷基、杂环基、-OR1、-SR1、-S(O)2R1、-S(O)R1、或C(O)R1;
R”是氢、烷基、环烷基、杂环基、-OR1、-NR3R4、-S(O)2R1、-S(O)R1、或C(O)R1;和
R”’是氢、烷基、环烷基、杂环基、-OR1或-NR3R4;
Q1是氢、卤素、C1-C2卤代烷基、C1-C2烷基、C1-C2烷氧基或C1-C2卤代烷氧基;
Q2是A1或A2;
当Q2是A2时Q3是A1,当Q2是A1时Q3是A2;
其中,
A1是氢、卤素、C1-C3烷基、C1-C3卤代烷基,-OR1,和
A2是由-(Z)m-(Z1)-(Z2)定义的基团,
其中,
Z是CH2且m是0、1、2或3,或
Z是NR2且m是0或1,或
Z是氧且m是0或1,或
Z是CH2NR2且m是0或1;
Z1是S(O)2、S(O)或C(O);和
Z2是C1-C4烷基、环烷基、杂环基、NR3R4、芳基、芳基氨基、芳烷基、芳烷氧基或杂芳基;
R1是氢、烷基、杂环基和-NR3R4;
R2、R3和R4各自独立地选自氢、羟基、烷氧基、芳氧基、芳烷氧基、氨基、烷基氨基、芳基氨基、芳烷基氨基、C1-C4烷基、C3-C7环烷基、杂环基、-S(O)2R5和-C(O)R5;
R5是C1-C4烷基或C3-C7环烷基;和
R8为氢或C1-C3烷基。
另一方面,另外提供了新的式(I)、(II)和/或(III)的化合物。
另一方面,提供了式(I)、(II)和/或(III)的化合物在制备用于在受试者中抑制坏死性凋亡的药物的用途。
另一方面,提供了式(I)、(II)和/或(III)的化合物用于抑制坏死性凋亡的用途。
另一方面,提供了用于抑制坏死性凋亡的式(I)、(II)和/或(III)的化合物。
另一方面,提供了当用于抑制坏死性凋亡时的式(I)、(II)和/或(III)的化合物。
式I、II和III的化合物的盐优选是药学上可接受的,但是应当理解,非药学上可接受的盐也落在本发明的范围内,因为它们可用作制备药学上可接受的盐的中间体。
术语“药学上可接受的”可用于描述任何药学上可接受的盐、水合物或前药,或任何其它化合物,其在给予受试者后能够提供(直接或间接)式I、II和/或III的化合物或其活性代谢物或残余物。
合适的药学上可接受的盐包括但不限于药学上可接受的无机酸(如盐酸、硫酸、磷酸、硝酸、碳酸、硼酸、氨基磺酸和氢溴酸)的盐,或药学上可接受的有机酸(例如乙酸、丙酸、丁酸、酒石酸、马来酸、羟基马来酸、富马酸、苹果酸、柠檬酸、乳酸、粘酸、葡萄糖酸、苯甲酸、琥珀酸、草酸、苯乙酸、甲磺酸、甲苯磺酸、苯磺酸、水杨酸、磺胺酸、天冬氨酸、谷氨酸、依地酸、硬脂酸、棕榈酸、油酸、月桂酸、泛酸、丹宁酸、抗坏血酸和戊酸)的盐。
碱盐包括但不限于与药学上可接受的阳离子形成的盐,如钠盐、钾盐、锂盐、钙盐、镁盐、锌盐、铵盐、烷基铵盐(例如由三乙胺形成的盐)、烷氧基铵盐(例如与乙醇胺形成的盐和由乙二胺形成的盐)、胆碱盐或或氨基酸(如精氨酸、赖氨酸或组氨酸)盐。关于药学上可接受的盐的类型及其形成的一般信息是本领域技术人员已知的,并且通常如文献例如“药用盐手册(Handbook of Pharmaceutical salts)”P.H.斯特尔,C.G.韦穆特,第1版,2002,Wiley-VCH中所述。
碱性含氮基团可用诸如低级烷基(如甲基,乙基,丙基和丁基)卤化物(如氯化物,溴化物和碘化物),二烷基硫酸盐(如二甲基硫酸盐和二乙基硫酸盐)等的试剂季铵化。
前药包括化合物,其中氨基酸残基或两个或多个(例如两个,三个或四个)氨基酸残基的多肽链与式I、II和/或III化合物的游离氨基和酰胺基共价连接。所述氨基酸残基包括通常由三字母符号表示的20种天然存在的氨基酸,并且还包括4-羟基脯氨酸、羟基赖氨酸、锁链赖氨酸(demosine)、异锁链赖氨酸、3-甲基组氨酸、正缬氨酸(norvlin)、β-丙氨酸、γ-氨基丁酸、瓜氨酸、高半胱氨酸、高丝氨酸、鸟氨酸和甲硫氨酸砜。前药还包括化合物,其中碳酸酯、氨基甲酸酯、酰胺和烷基酯通过羰基碳前药侧链与式I、II和/或III的上述取代基共价键合。前药可以包括共价不可逆和可逆抑制剂。
在化合物为固体的情况下,本领域技术人员将理解,本发明的化合物、试剂和盐可以以不同的结晶或多晶型形式存在,所有这些形式都在本发明的范围和指定的化学式内。
术语“多晶型物”包括式I、II和/或III的化合物的任何结晶形式,例如无水形式、含水形式、溶剂合物形式和混合溶剂合物形式。
式(I)、式(II)和/或式(III)旨在适用时涵盖化合物的溶剂化以及非溶剂化形式。因此,式(I)、式(II)和/或式(III)包括具有所示结构的化合物,包括水合或溶剂化形式,以及非水合和非溶剂化形式。
药物组合物可以由式(I)、式(II)和/或式(III)化合物配制用于任何合适的给药途径,包括例如局部(例如透皮或眼部),口服,口腔,鼻,阴道,直肠或肠胃外给药。本文所用的术语肠胃外包括皮下,皮内,血管内(例如静脉内),肌内,脊髓,颅内,鞘内,眼内,眼周,眶内,滑膜内和腹膜内注射以及任何类似的注射或输注技术。在某些实施方案中,优选适合于口服使用或肠胃外使用的形式的组合物。合适的口服形式包括例如片剂,糖剂(troche),锭剂(lozenge),水性或油性混悬剂,可分散粉剂或颗粒剂,乳剂,硬或软胶囊剂或糖浆剂或酏剂。对于静脉内,肌内,皮下或腹膜内给予,一种或多种化合物可以与无菌水性溶液组合,该溶液优选与接受者的血液等渗。这样的制剂可以通过将固体活性成分溶解在含有生理上相容的物质(例如氯化钠或甘氨酸)并且具有与生理条件相容的缓冲pH的水中以产生水溶液并使所述溶液无菌来制备。制剂可以存在于单位或多剂量容器(例如密封的安瓿或小瓶)中。组分的实例描述于马西德尔外药典(Martindale-The Extra Pharmacopoeia)(医药出版社Pharmaceutical Press,伦敦1993)和马丁(编辑),雷明顿药学大全(Remington's Pharmaceutical Sciences)中。
在本说明书的上下文中,术语“给予”和该术语的变化包括“给予”和“给药”包括通过任何适当的方式将本发明的化合物或组合物接触、施用、递送或提供至生物体或表面。
关于抑制坏死性凋亡,本发明的生物活性化合物的剂量可以在宽范围内变化,并且可以根据个体需要进行调整。本发明的活性化合物通常以治疗有效量给予。优选的剂量范围5为每天每千克体重约0.1mg至约140mg(例如每个患者每天约0.5mg至约7g)。日剂量可以作为单一剂量或多剂量给予。可与载体材料组合以产生单一剂型的活性成分的量将根据所治疗的受试者和具体的给药方式而变化。剂量单位形式通常含有约1mg至约500mg的活性成分。
然而,应当理解,任何特定受试者的具体剂量水平将取决于多种因素,包括所用具体化合物的活性,年龄,体重,一般健康状况,性别,饮食,给药时间,给药途径和排泄速率,药物组合(即用于治疗受试者的其它药物),以及正在进行治疗的特定病症的严重程度。如果化合物局部给予而不是全身给予,并且为了预防而不是治疗,则剂量通常较低。这样的治疗可以根据需要经常施用,以及施用一段由治疗医师判断的必需时间。本领域技术人员将理解,待给予的式(I)化合物的剂量方案或治疗有效量可能需要针对每个个体进行优化。药物组合物可以含有约0.1至2000mg,优选约0.5至500mg,最优选约1至200mg范围内的活性成分。约0.01至100mg/kg体重,优选约0.1至约50mg/kg体重的日剂量可能是合适的。日剂量可以每天一至四个剂量给予。
还将理解,可能需要不同的剂量来治疗不同的疾病。药剂的有效量是引起坏死性凋亡的统计学上显著减少的量。
对于体外分析,可以通过用于测量TSQ-诱导的坏死性凋亡的测试来测定坏死性凋亡的抑制作用,如本文定义的生物学测试中所述。
术语“治疗有效量”或“有效量”是指导致改善或修复坏死性凋亡症状和/或相关疾病或它们的症状的式(I)化合物的量。
如本文所用,术语“治疗的”、“治疗”和“疗法”是指治愈性治疗、预防性治疗(prophylactic therapy)和防止性治疗(preventative therapy)。因此,在本公开的上下文中,术语“治疗”包括治愈、改善或缓和坏死性凋亡和/或相关疾病或它们的症状的严重性。
“预防”或“防止”是指如果在给予本发明的化合物或药物组合物后有所发展,则防止坏死性凋亡的发生或缓和坏死性凋亡的严重程度。
“受试者”包括任何人或非人动物。因此,除了可用于人类治疗之外,本发明的化合物还可用于兽医治疗哺乳动物,包括伴侣动物和农场动物,例如但不限于狗、猫、马、牛、羊、和猪。
术语“抑制”用于描述导致预防、减少或其他改善坏死性凋亡的任何形式的抑制,包括完全和部分抑制。
本发明的方法可以用于预防或治疗受试者的以下疾病:
·骨、关节、结缔组织和软骨疾病,例如骨质疏松,骨髓炎,关节炎,包括例如骨关节炎,类风湿性关节炎和银屑病关节炎,无血管坏死,进行性骨化性纤维发育不良(fibrodysplasia ossificans),佝偻病,库兴氏综合征;
·肌肉疾病,例如肌营养不良,例如杜兴氏肌营养不良,肌强直性营养不良,肌病和肌无力;
·皮肤疾病,例如皮炎,湿疹,牛皮癣,衰老或甚至瘢痕形成的改变;
·心血管疾病,如心脏和/或血管缺血,心肌梗死,缺血性心脏病,慢性或急性充血性心力衰竭,心脏失常,心房纤维性颤动,心室纤维性颤动,阵发性心动过速,充血性心力衰竭,肥厚性心脏病,缺氧(anoxia),低氧(hypoxia),由于用抗癌剂的治疗的次生效应;
·循环系统疾病,如动脉粥样硬化(Lin等人,Cell Rep,2013),动脉硬化和外周血管疾病,脑血管性中风,动脉瘤;
·血液病和血管疾病,例如:贫血,血管淀粉样变性,出血,镰状细胞病,红细胞碎裂综合征,中性粒细胞减少,白细胞减少,髓质发育不全,全血细胞减少,血小板减少,血友病;
·肺疾病,包括肺炎,哮喘;肺部阻塞性慢性疾病,例如慢性支气管炎和肺气肿;
·胃肠道疾病,如溃疡;
·肝脏疾病,例如肝炎,特别是病毒来源或具有病原体其它感染因子的肝炎,自身免疫性肝炎,暴发性肝炎,某些遗传性代谢性疾病,威尔逊氏病,肝硬化,非酒精性肝脂肪变性,由于毒素和药物的肝脏疾病,如药物诱导的肝损伤(Wang等人,Mol Cell,2014);
·胰腺疾病,例如急性或慢性胰腺炎(He等人,Cell,2009;Zhang等人,Science,2009;Wu等人,Cell Res,2013);
·代谢疾病,如糖尿病和单纯性糖尿病,甲状腺炎;
·肾脏疾病,例如急性肾脏疾病或肾小球肾炎;
·病毒和细菌感染,如败血症;
·化学品,毒素或药物引起的严重中毒;
·与获得性免疫缺陷综合征(AIDS)相关的变性疾病;
·与衰老相关的疾病,如加速衰老综合征;
·炎性疾病,例如末梢回肠炎(Gunther等,Nature,2011;Welz等,Nature,2011),包括克罗恩病,类风湿性多发性关节炎,TNF-诱导的全身炎症综合征(Duprez等,免疫(Immunity),2011);
·自身免疫性疾病,如红斑狼疮;
·牙科疾病,例如导致组织降解的疾病,例如牙周炎;
·眼科疾病或症状,包括糖尿病视网膜病变,青光眼,黄斑变性,视网膜变性,色素性视网膜炎,视网膜孔或眼泪(retinal holes or tears),视网膜脱离(Trichonas等人,PNAS,2010),视网膜缺血,与创伤相关的急性视网膜病变,炎性变性,手术后并发症,药物性视网膜病,白内障,视锥细胞变性(Murakami等人,PNAS,2012);
·听觉(audition tracts)疾病,例如耳硬化和抗生素引起的耳聋;
·缺血性再灌注损伤(Linkermann等人,Kydney Int,2012;Oerlemans等人,in vivo Bas Res Cardiol,2012);
·神经元丢失(Vitner等人,Nat Med,2014);
·与线粒体(线粒体病理)相关的疾病,如弗里德里希共济失调,结构性线粒体异常的先天性肌营养不良,某些肌病(MELAS综合征,MERFF综合征,皮尔逊综合征),MIDD(线粒体糖尿病和耳聋)综合征,沃尔弗拉姆综合征(Wolfram's syndrome),肌张力障碍;和
·癌症和转移,包括但不限于肺和支气管癌,包括非小细胞肺癌(NSCLC),鳞状肺癌,细支气管肺泡癌(BAC),肺腺癌和小细胞肺癌(SCLC);前列腺癌,包括雄激素依赖性和雄激素非依赖性前列腺癌;乳腺癌,包括转移性乳腺癌;胰腺癌;结肠和直肠癌;甲状腺癌;肝和肝内胆管癌;肝细胞癌;胃癌;子宫内膜癌;黑素瘤;肾、肾盂、膀胱、子宫体和子宫颈的癌症;卵巢癌,包括进行性上皮或原发性腹膜癌;多发性骨髓瘤;食道癌,包括食管的鳞状细胞癌和腺癌;急性骨髓性白血病(AML);慢性髓性白血病(CML),包括加速的CML和CML急变期(CML-BP);淋巴细胞性白血病;骨髓性白血病;急性淋巴细胞性白血病(ALL);慢性淋巴细胞性白血病(CLL);霍奇金病(HD);非霍奇金淋巴瘤(NHL),包括滤泡淋巴瘤和套细胞淋巴瘤;B细胞淋巴瘤,包括弥漫性大B细胞淋巴瘤(DLBCL);T细胞淋巴瘤;多发性骨髓瘤(MM);淀粉样变性;瓦尔登斯特伦巨球蛋白血症;骨髓增生异常综合征(MDS),包括难治性贫血(RA),难治性贫血伴环状铁幼粒细胞增多(RARS),(难治性贫血伴有母细胞增多(RAEB)和在转化中的RAEB(RAEB-T));和骨髓增生性综合征;脑癌,包括神经胶质瘤/胶质母细胞瘤,间变性少突胶质细胞瘤和成熟间变性星形细胞瘤;神经内分泌癌,包括转移性神经内分泌肿瘤;头颈癌,包括例如头颈部鳞状细胞癌,和鼻咽癌;口腔癌、咽癌和小肠癌;骨癌;软组织肉瘤;和绒毛结肠腺瘤。
所述方法还可用于在移植之前、期间(移除、运输和/或再植入)或之后保护细胞、组织和/或移植器官。
在一实施例中,本发明的方法中,所述受试者不患有与过度血管生成相关的增殖性病症。在另一实施例中,所述增生性疾病为癌症。
本发明也提供了用于鉴定通过与MLKL假激酶结构域的ATP结合位点结合抑制坏死性凋亡的化合物的筛选方法。因此,另一方面,本发明提供了一种用于鉴定抑制坏死性凋亡的化合物的筛选方法,所述方法包括:
a)在允许MLKL和候选化合物相互作用的条件下,将含有MLKL的蛋白质溶液与候选化合物接触;和
b)将存在候选化合物时获得的解折叠转变温度(Tm)与不存在候选化合物时获得的解折叠转变温度(Tm)进行比较,以确定解折叠转变温度的变化(ΔTm);
其中MLKL假激酶结构域和候选化合物通过候选化合物与MLKL的假激酶结构域的ATP结合位点的结合相互作用;和
其中正ΔTm值表示候选化合物稳定蛋白质防止其变性并抑制其在坏死性凋亡中的作用。
在一实施例中,所述筛选方法包括包含荧光染料的蛋白质溶液。所述荧光染料可以是适于本领域技术人员确定的用途的任何染料。在一实施例中,所述荧光染料为SYPRO橙。
所述筛选方法可以在已知的适于本领域技术人员确定的这种用途的任何仪器上进行。在一实施例中,所述仪器组合了样品温度对照和染料荧光检测。在另一实施例中,所述仪器是实时聚合酶链反应(RT-PCR)机。
另一方面,提供了一种用于鉴定抑制坏死性凋亡的化合物的筛选方法,所述方法包括:
a)在允许MLKL假激酶结构域和候选化合物相互作用的条件下,将MLKL假激酶结构域与浓度渐增的候选化合物接触;和
b)测定结合亲和力(Kd);
其中MLKL假激酶结构域和所述候选化合物通过候选化合物与MLKL的假激酶结构域的ATP结合位点的结合相互作用,和
其中与候选化合物的结合表明候选化合物能够抑制坏死性凋亡。
所述筛选方法可以以已知的适于本领域技术人员确定的这种用途的任何方式进行。此外,所述筛选方法可以在已知的适于本领域技术人员确定的这种用途的任何仪器上进行。在一实施例中,所述筛选方法包括SPR并在SPR机上进行。在另一实施例中,所述筛选方法包括使用固定在传感器芯片上的MLKL假激酶结构域。在另一实施例中,所述固定的MLKL假激酶结构域为双His标记的。在另一实施例中,所述筛选方法包括SPR并在SPR机器上进行,并涉及使用固定在传感器芯片上的MLKL假激酶结构域。
在本发明中,术语“在允许MLKL假激酶结构域和候选化合物相互作用的条件下”包括这样的相互作用是可能的所有条件。这样的条件将是已知的或由本领域技术人员容易地确定。
另一方面,提供了一种用于鉴定抑制坏死性凋亡的化合物的筛选方法,所述方法包括:
a)将含有MLKL假激酶结构域的蛋白质溶液与核苷酸和候选化合物接触,并进行STD-NMR;和
b)将候选化合物存在时获得的STD-NMR谱图和不存在候选化合物时获得的STD-NMR谱图进行比较;
其中MLKL和候选化合物通过候选化合物与MLKL的假激酶结构域的ATP结合位点的结合相互作用;和
其中STD-NMR谱图中信号强度的消失或减少表明候选化合物能够抑制坏死性凋亡。
所述筛选方法可以以已知的适于本领域技术人员确定的这种用途的任何方式进行。
在一实施例中,所述筛选方法包括采用选自下组的核苷酸:AMP、AMPPNP、ADP和ATP。在另一实施例中,所述筛选方法包括采用选自下组的核苷酸:ATP和ADP。在另一实施例中,所述核苷酸为ATP。在另一实施例中,所述核苷酸为ADP。
在本发明中,术语“蛋白质溶液”包括含有MLKL蛋白或其部分的任何溶液,以合适的方式以进行筛选方法。合适的“蛋白质溶液”是本领域技术人员已知的或容易确定的。在一实施例中,所述“蛋白质溶液”可以包括另外的组分。另外的组分包括所采用的筛选方法所需的任何组分。
本发明的筛选方法可以用来自任何物种的MLKL进行。在一实施例中,MLKL是如上文所定义的小鼠MLKL。在另一实施例中,MLKL为上文定义的人MLKL。
本发明的筛选方法还可以包括细胞死亡测试以确定候选化合物抑制细胞中坏死性凋亡的能力。所述细胞死亡测试可以在细胞或组织培养物上进行。在该筛选方法中使用的细胞可以是能够表达MLKL的任何细胞,而不管天然基因和重组基因之间的差异。此外,MLKL的衍生没有特别限制。此外,也可以使用含有包含编码MLKL的核酸序列的表达载体的转化细胞。
所述细胞可以是人细胞的或非人细胞。在一实施例中,所述细胞为人细胞。在另一实施例中,所述细胞为非人细胞。在另一实施例中,所述细胞为非人哺乳动物细胞。
合适的人细胞的实例包括癌症和非癌细胞。在一实施例中,人细胞是非癌细胞系。在另一实施例中,人细胞是癌细胞系。在一实施例中,人细胞是白血病细胞系。白血病细胞系可以选自但不限于包括急性骨髓性白血病(AML)、骨髓单核细胞性白血病和T细胞白血病的组。白血病细胞系可以选自但不限于包含Jurkat T细胞、Jurkat细胞的FADD缺陷型变体、Mv4;11细胞、OCI-AML-3细胞和U937细胞的组。在一实施例中,人细胞是U937细胞。在另一实施例中,人细胞是人结肠腺癌细胞系。在一实施例中,人结肠腺癌细胞系是HT29。
合适的非人哺乳动物细胞包括但不限于来自啮齿动物(例如,小鼠、大鼠、仓鼠和豚鼠),兔,马类动物(例如马),犬类动物(例如狗),猫科动物(例如猫),牛科动物(例如牛),绵羊类动物(例如绵羊和山羊),灵长类动物(例如猴),禽类动物(例如鸡)等的细胞。非人哺乳动物细胞和禽类细胞的实例包括诸如CHO细胞、NIH3T3细胞、COS细胞、DT40细胞、BHK细胞、MDCK细胞、CRFK细胞、CV-1细胞、LMTK细胞和Vero细胞的培养细胞;原代培养细胞;造血干细胞;造血细胞和血细胞(如B细胞、T细胞、胸腺细胞、白细胞、单核细胞和巨噬细胞,红细胞和血小板);受精卵母细胞;和ES细胞。此外,也可以使用其它细胞,例如各种组织细胞、肾细胞、成纤维细胞和骨髓瘤细胞。在一实施例中,细胞是啮齿动物细胞。在另一实施例中,细胞是小鼠细胞。在另一实施例中,细胞是小鼠真皮成纤维细胞(MDF)。
因此,本发明一实施例中提供了如本文所述的筛选方法,其还包括测试所述候选化合物拯救因坏死性凋亡的细胞死亡的能力。在一实施例中,所述测试在体外基于细胞的测试中进行。在另一实施例中,细胞是小鼠真皮成纤维细胞(MDF)。
所述细胞死亡测试可以以本领域技术人员确定的任何已知适合的方式进行。在一实施例中,所述细胞死亡测试包括使用流式细胞术在缺乏或存在坏死性刺激物时测定碘化丙啶(PI)摄取。
在本发明的细胞死亡测试中,可以以已知的本领域技术人员确定合适的任何方式在细胞中诱导坏死性凋亡。在一实施例中,由选自以下任一种或多种的因子刺激坏死性凋亡:TNF(T);Smac模拟物(S);和泛胱天蛋白酶抑制剂Q-VD-OPh(Q)。在另一实施例中,所述细胞死亡测试包括TNF(T),Smac模拟物(S)和泛胱天蛋白酶抑制剂Q-VD-OPh(Q)的坏死刺激物,这种坏死性凋亡刺激物的组合被称为“TSQ”。
通过以下说明性和非限制性实施例描述本发明所述的方法和化合物。
实施例
1.1材料与方法
化合物
在商业库筛选中鉴定化合物1。
所有涉及的温度单位为℃。
如下化合物的名称获自ChemDraw Ultra 12.0。
缩写
AcOH 醋酸
(Boc)2O 二-叔-丁基二碳酸酯
CDCl3 氘代氯仿
CDI 1,1’-羰基二咪唑
Cs2CO3 碳酸铯
DMSO-d6 氘代二甲基亚砜
DCC 二环己基碳二亚胺
DCM 二氯甲烷
DIPEA 二异丙基乙胺
DMF N,N-二甲基甲酰胺
DMSO 二甲基亚砜
TEA 三乙胺
EtOAc 乙酸乙酯
EtOH 乙醇
hr 小时
HATU 1-[二(二甲基氨基)亚甲基]-1H-1,2,3-三唑[4,5-b]吡啶3-氧化物六氟磷酸盐
HCl 盐酸/氯化氢
HPLC 高效液相色谱
K2CO3 碳酸钾
LCMS 液相色谱-质谱
M 摩尔(浓度)
MeOH 甲醇
min 分钟
M/Z 质/荷比(质谱)
Na2CO3 碳酸钠
NaH 氢化钠
NaHCO3 碳酸氢钠
NaOH 氢氧化钠
Na2SO4 硫酸钠
NH4Cl 氯化铵
NMP N-甲基-2-吡咯烷酮
NMR 核磁共振
Pd/C 活性炭上的钯
Rt 保留时间
rt 室温
SOCl2 氯化亚砜
TFA 三氟醋酸
THF 四氢呋喃
TsOH 对甲基苯磺酰氯
LCMS方法
使用以下方法进行电喷雾质谱(MS):
方法A(10分钟方法):使用反相高效液相色谱(HPLC)分析的菲尼根(Finnigan)LCQ Advantage Max(柱:Gemini 3μC18 20×4.0mm 110A);溶剂A:水,0.1%甲酸;溶剂B:乙腈,0.1%甲酸;梯度:10-100%B,历时10分钟;检测:100-600nm,使用电喷雾电离(ESI)正模式,源温度:300℃。
方法B(5分钟方法):LC型号:安捷伦(Agilent)1200(泵型:二元泵,检测器类型:DAD),MS型号:安捷伦G6110A四极杆。柱:Xbridge-C18,2.5μm,2.1×30mm。柱温:30℃。波长的获得:214nm,254nm。流动相:A:0.07%HCOOH水溶液,B:MeOH。运行时间:5分钟。MS:离子源:ES+(或ES-)。MS范围:碰撞诱导解离(电压):60。干燥气体流量:10L/min。雾化器压力:35psi。干燥气体温度:350℃。毛细管电压:3.5kV。
制备型质量-导向LC
方法A:
仪器:
沃特斯(Waters)ZQ 3100质量检测器(Mass Detector),沃特斯2545-泵;沃特斯SFO系统应用流体组织器(System Fluidics Organizer),沃特斯2996二极管阵列检测器,沃特斯2767样品管理器(Sample Manager)
LC条件:
反相HPLC分析
柱:XBridge TM C18 5μm 19x50mm。注射体积:500μL
溶剂A:水,0.1%甲酸。溶剂B:MeCN,0.1%甲酸
梯度:5%B,历时4min,然后5-100%B历时8min,然后100%B历时4min
流速:19mL/min。检测:100-600nm
MS条件:
离子源:单四极杆。离子模式:ES正极。源温:150℃
去溶剂温度:350℃。检测:离子计数。毛细管(KV)-3.00。锥孔(V):30
提取器(V):3RF镜头(V):0.1扫描范围:100-1000Amu扫描时间:0.5秒
获取时间:10min
气流:
去溶剂化L/小时-650
锥孔L/小时-100
制备型HPLC
仪器类型:
瓦里安(VARIAN)940LC。泵类型:二元泵。检测器类型:PDA
LC条件:
柱:沃特斯SunFire prep C18OBD,5μm,19×100mm。波长获得:214nm,254nm。流动相:A:0.07%TFA水溶液,B:MeOH,0.07%TFA。
NMR
除非另有说明,否则核磁共振(1H NMR,600MHz或400MHz)谱图在300K以CDCl3作为溶剂获得。化学位移在δ标度上以ppm报道并参考合适的溶剂峰。
中间体A的合成
步骤1:N-甲基-4-硝基苯胺
向1-氟-4-硝基苯(50.0g,354mmol)的DMSO(200mL)溶液中加入甲胺盐酸盐(47.1g,709mmol)和碳酸钾(98.0g,709mmol)。所得混合物在氮气气氛中在70℃下搅拌过夜。TLC分析显示反应完成。混合物倒入水中得到沉淀,将沉淀过滤,然后用另外的水洗涤和干燥得到为黄色固体的所需产物(50g,93%)。LCMS(方法B):1.63min[MH]+=153.1,[MNa]+=175.1。
步骤2:2-氯-N-甲基-N-(4-硝基苯基)嘧啶-4-胺
向N-甲基-4-硝基苯胺(30.0g,197mmol)的DMF(150mL)溶液中加入2,4-二氯嘧啶(29.4g,197mmol)和碳酸钾(40.88g,296mmol)。所得混合物在80℃下搅拌过夜。混合物用乙酸乙酯(300mL)和水(200mL)稀释,合并的有机相用水、盐水洗涤,用硫酸钠干燥并浓缩得到残留物,残留物用硅胶柱层析纯化(石油醚/乙酸乙酯,10:1至3:1)得到为黄色固体的所需产物(20g,38%)。LCMS(方法B):2.34min[MH]+=265.0,267.0,[MNa]+=287.0,289.0。
步骤3:3-((4-(甲基(4-硝基苯基)胺基)嘧啶-2-基)胺基)苯磺酰胺
向2-氯-N-甲基-N-(4-硝基苯基)嘧啶-4-胺(1.0g,3.8mmol)的1.4-二氧六环(10mL)溶液中加入3-氨基苯磺酰胺(651mg,3.8mmol)和浓HCl(0.5mL)。所得混合物在微波条件下在160℃下搅拌2小时。LCMS和TLC分析显示反应完成。减压除去溶剂得到残留物。残留物溶解于NaOH水溶液(4M)和DCM。有机层用水、盐水洗涤,用硫酸钠干燥并浓缩得到残留物,残留物用硅胶柱层析纯化(DCM/MeOH,30:1至10:1)得到为黄色固体的所需产物(1g,67%)。LCMS(方法B):0.96min[MH]+=401.1。
步骤4:(中间体A)3-((4-(甲基(4-(3-(4-(三氟甲氧基)苯基)脲基)苯基)胺基)嘧啶-2-基)胺基)苯磺酰胺
向3-((4-(甲基(4-硝基苯基)胺基)嘧啶-2-基)胺基)苯磺酰胺(800mg,2.0mmol)的EtOH(20mL)溶液中加入锌(1.3g,20mmol)和NH4Cl(水性,30ml)。反应混合物在90℃下搅拌2小时。LCMS和TLC分析显示反应完成。过滤混合物,滤液真空浓缩除去EtOH,然后过滤混合物得到为白色固体的所需产物(320mg,43%)。1H NMR(400MHz,DMSO-d6):δppm 3.34(s,3H)5.22(s,2H)5.68(d,J=6.0Hz,1H)6.65(d,J=8.4Hz,2H)6.95(d,J=8.4Hz,2H)7.23(s,2H)7.41(m,2H)7.81(m,2H)8.57(s,1H)8.42(s,1H)。LCMS(方法B):0.37min[MH]+=370.1
中间体B的合成
步骤1:(中间体B)3-(4-(甲基(4-(3-苯基脲基)苯基)胺基)嘧啶-2-基胺基)苯磺酰胺
在(圆)底烧瓶中,将3-((4-((4-氨基苯基)(甲基)胺基)嘧啶-2-基)胺基)苯磺酰胺(中间体A(1.5g,4.1mmol)溶于THF(20mL)。然后加入吡啶(320mg,12.2mmol)。将氯甲酸苯酯(698mg,4.5mmol)缓慢加入混合物中。反应混合物在室温下搅拌过夜。除去溶剂。粗品用水(2x 50mL)、乙醚(2x 50mL)洗涤,并干燥得到为黄色固体的苯基(4-(甲基(2-((3-氨基磺酰基苯基)胺基)嘧啶-4-基)胺基)苯基)氨基甲酸酯(1.5g,76%)。1H NMR(400MHz,MeOD-d4):δppm 3.54(s,3H),5.87(d,J=6.4Hz,1H),7.28(m,5H),7.45(m,5H),7.68(m,4H),7.82(d,J=6.4Hz,1H),8.62(br s,1H)。LCMS(方法B):2.17[M+H]+=491.2。
中间体C的合成
步骤1:N1-(2-氯嘧啶-4-基)-N1-甲基苯-1,4-二胺
2-氯-N-甲基-N-(4-硝基苯基)嘧啶-4-胺(来自中间体A制备的步骤2,100mg,0.38mmol)溶于甲醇(10mL)和水性NH4Cl(10mL)。加入锌(粉末,245mg,3.0mmol)。反应混合物在室温下搅拌过夜。混合物减压浓缩。残留物用EtOAc萃取(3x 20mL)。合并的有机层用盐水(20mL)洗涤、用Na2SO4干燥。减压除去溶剂得到为黄色固体的N1-(2-氯嘧啶-4-基)-N1-甲基苯-1,4-二胺(80mg,90%),直接用于下一步骤。LCMS(方法B):1.10[M+H]+=235.1
步骤2:(中间体C)1-(4-((2-氯嘧啶-4-基)(甲基)胺基)苯基)-3-(4-(三氟甲氧基)苯基)脲
在(圆)底烧瓶中,N1-(2-氯嘧啶-4-基)-N1-甲基苯-1,4-二胺(776mg,3.31mmol)溶于DCM(4mL)。向混合物中加入1-异氰酸基-4-(三氟甲氧基)苯(672mg,3.31mmol)。反应混合物在室温下搅拌过夜。过滤白色固体并用DCM(20mL)洗涤,并干燥得到为白色固体的1-(4-((2-氯嘧啶-4-基)(甲基)胺基)苯基)-3-(4-(三氟甲氧基)苯基)脲(1.06g,73%)。1H NMR(400MHz,DMSO-d6):δppm 3.40(s,3H)6.27(d,J=6.0Hz,1H)7.31(m,4H)7.60(m,4H)7.98(d,J=6.0Hz,1H)8.90(s,1H)8.93(s,1H)。LCMS(方法B):3.09[M+H]+=438.2。
合成脲的通用方法A:
在N2下,向中间体A(1mmol)在干燥的DMF(0.2mL)中的溶液中滴加异氰酸酯(1mmol)。反应混合物室温下搅拌16小时,减压浓缩,残留物用制备型质量导向的LC纯化得到相应的化合物。
合成脲的通用方法B:
在N2下,向中间体B(1mmol)在干燥的THF中的溶液中加入芳胺(2mmol),随后加入DIEA(2mmol)。反应混合物60℃加热16小时,减压浓缩,残留物通过制备型HPLC纯化得到相应的化合物。
向2-氯嘧啶中添加苯胺的通用方法C:
向苯胺(1mmol)和中间体C(1mmol)在2-丙醇(10mL)的溶液中加入浓HCl的溶液(2滴)。反应混合物80℃加热16小时。除去溶剂,粗产品通过柱层析纯化得到相应的化合物。
化合物1
3-((4-(甲基(4-(3-(4-(三氟甲氧基)苯基)脲基)苯基)胺基)嘧啶-2-基)胺基)苯磺酰胺
按照通用方法A采用中间体A(100mg,0.27mmol)和(4-三氟甲氧基苯基)异氰酸酯(55mg,0.27mmol),得到3-((4-(甲基(4-(3-(4-(三氟甲氧基)苯基)脲基)苯基)胺基)嘧啶-2-基)胺基)苯磺酰胺(17mg,12%),为白色固体。1H NMR(400MHz,DMSO-d6):δppm3.50(s,3H),5.96(br s,1H),7.21(m,1H),7.32(m,3H),7.40(s,2H),7.63(m,7H),7.90(d,J=7.20Hz,1H),8.37(br s,1H),9.33(m,2H),10.66(br s,1H)。LCMS(方法B):2.42min[MH]+=574.1。
化合物2
3-(3-(甲基(4-(3-苯基脲基)苯基)胺基)苯基胺基)苯-磺酰胺。
按照通用方法A采用中间体A(50mg,0.135mmol)和苯基异氰酸酯,得到3-(3-(甲基(4-(3-苯基脲基)苯基)胺基)苯基胺基)苯磺酰胺(2.5mg,2%)为白色固体。1H NMR(600MHz,MeOD-d4):δppm 3.51(s,3H),5.92(s,1H),7.02(m,1H),7.23(d,J=8.7Hz,2H),7.25-7.30(m,2H),7.41-7.44(m,3H),7.52(m,1H),7.56(d,J=8.7Hz,2H),7.67(d,J=8.5Hz,1H),7.96(s,1H),8.58(s,1H)。LCMS(方法A):4.10min[MH]+=490.4。
化合物3
3-(3-((4-(3-(2-氟-5-(三氟甲基)苯基)脲基)苯基)(甲基)胺基)苯基胺基)苯磺酰胺。
按照通用方法A采用中间体A(50mg,0.135mmol)和2-氟-5-三氟甲基苯基异氰酸酯(10.9mg,0.135mmol),得到3-(3-((4-(3-(2-氟-5-(三氟甲基)苯基)脲基)苯基)(甲基)胺基)苯基胺基)苯磺酰胺(9mg,7%),为白色固体。1H NMR(600MHz,MeOD-d4):δppm3.52(s,3H),5.88(m,1H),7.26(d,J=9.0Hz,2H),7.33(d,J=9.0Hz,1H),7.42(m,1H),7.51(m,1H),7.60(d,J=9.0Hz,1H),7.68(m,1H),7.76(br d,J=7.8Hz,1H),8.17(m,1H),8.57(s,1H),8.60(m,1H)。LCMS(方法A):4.60min[MH]+=576.3。
化合物4
步骤1:N-(4-硝基苯基)乙酰胺。
0℃下,向4-硝基苯胺(5.0g,36.2mmol)在EtOAc(70mL)的溶液中滴加乙酸酐(3.77mL,39.8mmol)。反应混合物在室温下搅拌16小时并减压浓缩得到标题化合物,为白色固体(6.36g,97%)。1H NMR(600MHz,MeOD-d4):δppm 2.15(s,3H),7.80(d,2H),8.19(d,2H)。
步骤2:N-(4-氨基苯基)乙酰胺。
硼氢化钠(2.87g,75.9mmol)溶于甲醇/H2O(180mL/90mL)混合物,并冷至0℃。在N2气流下,小量添加Pd/C(0.443mg,10mol%),然后添加MeOH(3mL)中的N-(4-硝基苯基)乙酰胺(4.55g,25.3mmol)。反应混合物在室温下搅拌72小时,通过硅藻土过滤并用MeOH冲洗3次.合并的滤液真空浓缩并在EtOAc/H2O之间分层。分离有机层,水层用EtOAc萃取两次。合并的有机层用盐水洗涤,用MgSO4干燥并减压浓缩得到标题化合物(4.39g,80%),为淡黄色固体。1H NMR(600MHz,DMSO-d6):δppm 1.95(s,3H),4.80(br s,2H),6.48(d,2H),7.18(d,2H),9.46(s,1H)。LCMS(方法A):0.82min[MH]+=151.3。
步骤3:N-(4-(2-氯嘧啶-4-基胺基)苯基)乙酰胺
将N-(4-氨基苯基)乙酰胺(3.91g,26.0mmol)溶于EtOH/THF(345mL/115mL)混合物中和溶液在冰浴中冷却至0℃。分批添加2,4-二氯嘧啶(4.65g,31.2mmol),然后添加NaHCO3(4.37g,52.0mmol)。反应混合物室温搅拌16小时,并减压浓缩.加入EtOAc,分离有机层,水层用EtOAc萃取两次。合并的有机层用盐水洗涤,用MgSO4干燥,并真空浓缩得到标题化合物(6.83g),为粗固体。1H NMR(600MHz,DMSO-d6):δppm2.01(s,3H),6.66(d,J=8.7Hz,1H),7.42-7.54(m,4H),8.08(d,J=9.0Hz 1H),9.92(s,2H)。LCMS(方法A):4.88min[MH]+=263.2。
步骤4:N-(4-((2-氯嘧啶-4-基)(甲基)胺基)苯基)乙酰胺
在N2下,将N-(4-(2-氯嘧啶-4-基胺基)苯基)乙酰胺(6.83g,26.0mmol)溶于DMF(150mL)并加入K2CO3(5.39g,39.0mmol),然后滴加MeI(1.78mL,28.6mmol)。反应混合物室温搅拌72小时并在EtOAc和水(350mL/350mL)之间分层。有机层用盐水洗涤,用MgSO4干燥,并真空浓缩。残留物用快速柱层析纯化(洗脱:DCM/MeOH 98/2)得到标题化合物(2.49g,34%两步),为淡黄色固体。1H NMR(600MHz,DMSO-d6):δppm2.03(s,3H)3.32(s,3H)6.21(m,1H)7.24(d,2H)7.66(d,2H)7.93(m,1H)10.08(s,1H)。LCMS(酸性,10min):4.70min[MH]+=413.3
步骤5:N-(4-(甲基(2-(4-氨基磺酰基苯基胺基)嘧啶-4-基)胺基)苯基)乙酰胺。
将N-(4-((2-氯嘧啶-4-基)(甲基)胺基)苯基)乙酰胺(1.34g,4.84mmol)和对氨基苯磺酰胺(sulfanilamide,0.84g,4.84mmol)溶于i-PrOH(45mL)。滴加浓HCl(10滴)至搅拌的溶液中。反应混合物在80℃下搅拌40小时并冷至室温。过滤收集形成的灰白色沉淀,用EtOAc洗涤并真空干燥得到标题化合物(1.54g,77%),为白色固体。1H NMR(600MHz,DMSO-d6):δppm 2.06(s,3H),3.48(s,3H),6.65(s,1H),7.27-7.35(m,6H),7.46(m,2H),7.73(d,J=8.7Hz,2H),10.26(br s,1H)。LCMS(方法A):2.97min[MH]+=413.3。
步骤6:4-(4-((4-氨基苯基)(甲基)胺基)嘧啶-2-基胺基)苯-磺酰胺
将N-(4-(甲基(2-(4-氨基磺酰基苯基胺基)嘧啶-4-基)胺基)苯基)乙酰胺(1.54g,3.73mmol)溶于MeOH(40mL)。滴加乙酰氯(2.65mL,37.3mmol),反应混合物室温搅拌48小时并真空浓缩得到标题化合物(1.40g,100%),为白色固体。1H NMR(600MHz,DMSO-d6):δppm 3.48(s,3H),6.72(d,J=8.7Hz,2H),7.32(m,2H),7.39(m,2H),7.77(m,2H)。LCMS(方法A):0.72min[MH]+=371.2。
步骤7:4-(4-(甲基(4-(3-(4-(三氟甲氧基)苯基)脲基)苯基)胺基)嘧啶-2-基胺基)苯磺酰胺。
按照通用方法A采用4-(4-((4-氨基苯基)(甲基)胺基)嘧啶-2-基胺基)苯磺酰胺(100mg,0.27mmol)和(4-三氟甲氧基苯基)异氰酸酯(0.27mmol),得到标题化合物(18mg,14%),为白色固体。1H NMR(600MHz,MeOD-d4):δppm 3.47(s,3H),5.96(br d,J=5.4Hz,1H),7.20(d,J=9.0Hz,1H),7.24(d,J=9.0Hz,1H),7.53(d,J=9.0Hz,2H),7.57(d,J=9.0Hz,2H),7.73-7.77(m,4H),7.84(m,1H)。LCMS(方法A):4.64min[MH]+=574.4。
化合物5
步骤1:N-(4-(甲基(2-(2-氨基磺酰基苯基胺基)嘧啶-4-基)胺基)苯基)-乙酰胺
将N-(4-((2-氯嘧啶-4-基)(甲基)胺基)苯基)乙酰胺(1.15g,4.16mmol)和2-氨基苯磺酰胺(716mg,4.16mmol)溶于i-PrOH(40mL)。滴加浓HCl(10滴)至搅拌的溶液中。反应混合物80℃下搅拌16小时并冷至室温。过滤收集形成的淡粉色沉淀,用EtOAc洗涤并真空干燥得到标题化合物(1.48g,86%),为白色固体。1H NMR(600MHz,DMSO-d6):δppm 2.05(s,3H),3.35(s,3H),7.28(d,J=8.7Hz,2H),7.30-7.45(m,3H),7.50-7.65(m,2H),7.70(d,J=8.7Hz,2H),7.92(m,1H),10.28(br s,1H)。LCMS(方法A):3.80min[MH]+=413.4。
步骤2:2-(4-((4-氨基苯基)(甲基)胺基)嘧啶-2-基胺基)苯-磺酰胺
将N-(4-(甲基(2-(2-氨基磺酰基苯基胺基)嘧啶-4-基)胺基)苯基)乙酰胺(1.47g,3.56mmol)溶于MeOH(40mL)。滴加乙酰氯(5.07mL,71.3mmol),反应混合物室温搅拌48小时并真空浓缩得到标题化合物(1.21g,92%),为白色固体。1H NMR(600MHz,MeOD-d4):δppm 3.51(s,3H),6.00(br s,1H),7.48-8.06(m,14H)。LCMS(方法A):1.08min[MH]+=371.1。
步骤3:2-(4-(甲基(4-(3-(4-(三氟甲氧基)苯基)脲基)苯基)胺基)嘧啶-2-基胺基)苯磺酰胺。
按照通用方法A采用2-(4-((4-氨基苯基)(甲基)胺基)嘧啶-2-基胺基)苯磺酰胺(100mg,0.27mmol)和(4-三氟甲氧基苯基)异氰酸酯(0.27mmol),得到标题化合物(28mg,21%),为白色固体。1H NMR(600MHz,MeOD-d4):δppm 3.46(s,3H),6.01(br s,1H),6.77(d,J=9.0Hz,1H),7.00(d,J=9.0Hz,1H),7.20(d,J=8.4Hz,2H),7.25(d,J=9.0Hz,2H),7.27(m,1H),7.53(d,J=9.0Hz,2H),7.59(d,J=8.4Hz,2H),7.79(m,1H),7.92-7.97(m,2H)。LCMS(方法A):4.71min[MH]+=574.4。
化合物6
3-(3-((4-(3-(2-氟-5-甲基苯基)脲基)苯基)(甲基)胺基)苯基胺基)苯磺酰胺。
按照通用方法A采用中间体A(100mg,0.27mmol)和2-氟-5-甲基苯基异氰酸酯(41mg,0.27mmol),得到3-(3-((4-(3-(2-氟-5-甲基苯基)脲基)苯基)(甲基)胺基)苯基胺基)苯磺酰胺(9.8mg,7%),为白色固体。1H NMR(600MHz,MeOD-d4):δppm 3.52(s,3H),5.88(d,J=5.4Hz,1H),6.82(m,1H),6.99(m,1H),7.24(d,J=9.0Hz,2H),7.42(m,1H),7.52(d,J=7.8Hz,1H),7.60(d,J=9.0Hz,2H),7.66(d,J=10.2Hz,1H),7.76(d,J=7.8Hz,1H),7.90(8.17(m,1H),8.17(s,1H),8.57(br s,1H)。LCMS(方法A):4.37min[MH]+=522.2。
化合物7
2-(4-(甲基(4-(3-(4-(三氟甲氧基)苯基)脲基)苯基)胺基)嘧啶-2-基胺基)苯磺酰胺。
按照通用方法A采用2-(4-((4-氨基苯基)(甲基)-胺基)嘧啶-2-基胺基)苯磺酰胺(100mg,0.27mmol)和苯基异氰酸酯(32mg,0.27mmol),得到标题化合物(3.5mg,3%),为白色固体。1H NMR(600MHz,MeOD-d4):δppm 3.46(s,3H),6.01(br s,1H),6.77(d,J=9.0Hz,1H),7.00(d,J=9.0Hz,1H),7.20(d,J=8.4Hz,2H),7.25(d,J=9.0Hz,2H),7.27(m,1H),7.53(d,J=9.0Hz,2H),7.59(d,J=8.4Hz,2H),7.79(m,1H),7.92-7.97(m,2H)。LCMS(酸性,10min):4.71min[MH]+=574.4。
化合物8
步骤1:3-(4-(N-甲基-N-(4-硝基苯基)胺基)嘧啶-2-基胺基)苯甲酰胺
将2-氯-N-甲基-N-(4-硝基苯基)嘧啶-4-胺(来自中间体A的制备的步骤2,200mg,0.77mmol)和3-氨基苯甲酰胺(110mg,0.80mmol)溶于t-BuOH(5mL),添加浓HCl(2滴)。反应混合物于160℃加热2小时。除去溶剂,粗品用石油醚:乙酸乙酯(2:1)冲洗从而得到3-(4-(N-甲基-N-(4-硝基苯基)胺基)嘧啶-2-基胺基)苯甲酰胺(180mg,64%),为黄色固体,不纯化直接用于下一步骤。LCMS(方法B):0.67min[MH]+=365.2。
步骤2:3-(4-(N-甲基-N-(4-酰胺苯基)胺基)嘧啶-2-基胺基)苯甲酰胺
将3-(4-(N-甲基-N-(4-硝基苯基)胺基)嘧啶-2-基胺基)苯甲酰胺(180mg,0.5mmol)溶于乙醇(20mL)并将10%湿Pd/C(20mg)添加至溶液中。反应混合物在氢气氛中搅拌过夜。过滤除去催化剂并减压除去溶剂得到3-((4-((4-氨基苯基)(甲基)胺基)嘧啶-2-基)胺基)苯甲酰胺(150mg,88%),为黄色固体,不纯化直接用于下一步骤。LCMS(方法B):0.36min[MH]+=335.1。
步骤3:3-((4-(甲基(4-(3-(4-(三氟甲氧基)苯基)脲基)苯基)胺基)嘧啶-2-基)胺基)苯甲酰胺
向3-(4-(N-甲基-N-(4-酰胺苯基)胺基)嘧啶-2-基胺基)苯甲酰胺(150mg,0.45mmol)的THF(20mL)的溶液中加入1-异氰酸基-4-(三氟甲氧基)苯(95mg,0.47mmol)和DIEA(116mg,0.9mmol)。反应室温搅拌过夜。混合物真空浓缩,粗品用洗脱剂(DCM:甲醇,100至100:2)柱层析纯化得到3-((4-(甲基(4-(3-(4-(三氟甲氧基)苯基)脲基)苯基)胺基)嘧啶-2-基)胺基)苯甲酰胺(152mg,63%),为黄色固体。1H NMR(400MHz,DMSO-d6):δppm 3.43(s,3H),5.79(d,J=6.0Hz,1H),7.38(m,7H),7.59(m,4H),7.88(m,3H),8.33(s,1H),8.99(m,2H),9.28(s,1H),9.47(s,1H)。LCMS(方法B):2.47min[MH]+=538.3。
化合物9
步骤1:N-甲基-3-硝基苯磺酰胺
向3-硝基苯-1-磺酰氯(1.0g,4.52mmol)的THF(15mL)的溶液中加入甲胺盐酸盐(366mg,5.42mmol)和N,N-二异丙基乙胺(1.75g,13.6mmol)。混合物室温搅拌过夜。将反应混合物倒入水(20mL)中。过滤收集形成的沉淀。旋转蒸发干燥固体得到N-甲基-3-硝基苯磺酰胺(800mg,82%),为白色固体。LCMS(方法B):0.75min[MH]+=217.1。
步骤2:3-氨基-N-甲基苯磺酰胺
向N-甲基-3-硝基苯磺酰胺(800mg,3.70mmol)的甲醇(20mL)的溶液中加入钯碳(10%,80mg)。混合物在氢气气氛中室温搅拌过夜。过滤反应混合物除去固体并减压浓缩滤液至干得到3-氨基-N-甲基苯磺酰胺(630mg,92%),为淡棕色固体。LCMS(方法B):0.33min[MH]+=187.2。
步骤3:N-甲基-3-((4-(甲基(4-硝基苯基)胺基)嘧啶-2-基)胺基)苯磺酰胺
向3-氨基-N-甲基苯磺酰胺(180mg,0.97mmol)的叔丁醇(5mL)的溶液中加入2-氯-N-甲基-N-(4-硝基苯基)嘧啶-4-胺(来自化合物1的制备的步骤2,244mg,0.92mmol)和浓缩HCl水溶液(2滴)。于160℃搅拌所得混合物5小时。TLC和LCMS分析显示反应完成。混合物冷至室温。过滤收集固体并减压干燥得到N-甲基-3-((4-(甲基(4-硝基苯基)胺基)嘧啶-2-基)胺基)苯磺酰胺(300mg,79%),为淡黄色固体。LCMS(方法B):2.15min[MH]+=415.1。
步骤4:N-甲基-3-((4-(甲基(4-(3-(4-(三氟甲氧基)苯基)脲基)-苯基)胺基)嘧啶-2-基)胺基)苯磺酰胺
向N-甲基-3-((4-(甲基(4-硝基苯基)胺基)嘧啶-2-基)胺基)苯磺酰胺(300mg,0.72mmol)的甲醇(25mL)的溶液中加入锌粉(1.0g)和饱和氯化铵水溶液(25mL)。所得混合物室温搅拌过夜。过滤固体并减压除去溶剂得到残留物,将残留物在水和乙酸乙酯之间分层。分离有机相并用水、盐水洗涤,用硫酸钠干燥并浓缩至干得到3-((4-((4-氨基苯基)(甲基)胺基)嘧啶-2-基)胺基)-N-甲基苯-磺酰胺(250mg,90%),为深棕色固体。LCMS(方法B):1.27min[MH]+=385.2。
步骤5:N-甲基-3-((4-(甲基(4-(3-(4-(三氟甲氧基)苯基)脲基)-苯基)胺基)嘧啶-2-基)胺基)苯磺酰胺
N-甲基-3-((4-(甲基(4-(3-(4-(三氟甲氧基)苯基)脲基)苯基)胺基)-嘧啶-2-基)胺基)苯磺酰胺。向3-((4-((4-氨基苯基)(甲基)胺基)嘧啶-2-基)胺基)-N-甲基苯磺酰胺(250mg,0.65mmol)的四氢呋喃(25mL)的溶液中加入4-(三氟甲氧基)苯基异氰酸酯(158mg,0.78mmol)和N,N-二异丙基乙胺(168mg,1.30mmol)。混合物室温搅拌过夜。反应混合物减压浓缩至干得到残留物,该残留物用硅胶层析纯化(二氯甲烷/甲醇,30:1)得到N-甲基-3-((4-(甲基(4-(3-(4-(三氟甲氧基)苯基)脲基)苯基)胺基)嘧啶-2-基)胺基)苯磺酰胺(210mg,55%),为白色固体。1H NMR(400MHz,DMSO-d6):δppm 2.45(d,J=5.0Hz,3H),3.50(s,3H),5.95(br s,1H),7.32(t,J=8.5Hz,4H),7.49-7.45(m,2H),7.68-7.54(m,5H),7.77(dd,J=8.0and 1.2Hz,1H),7.89(d,J=6.8Hz,1H),8.39(s,1H),9.19(s,2H),10.49(s,1H)。LCMS(方法B):2.57min[MH]+=588.2。
化合物10
步骤1:N,N-二甲基-3-硝基苯磺酰胺
在(圆)底烧瓶中,将Me2NH2.HCl(442mg,5.42mmol)和DIEA(1.75g,13.6mmol)加入THF(15mL)并溶液冷却至0℃。缓慢加入3-硝基苯-1-磺酰氯(1g,4.52mmol)并室温搅拌反应混合物。混合物倒入水中(50mL),用EtOAc(3x 30mL)萃取。合并的有机层用水(3x 30mL)洗涤,用Na2SO4干燥。减压除去溶剂得到N,N-二甲基-3-硝基苯磺酰胺(850mg,83%),为黄色固体,直接用于下一步骤。LCMS(方法B):1.31[M+H]+=231.1
步骤2:3-氨基-N,N-二甲基苯磺酰胺
将N,N-二甲基-3-硝基苯磺酰胺(850mg,3.7mmol)溶于甲醇(20mL)。将湿Pd/C(85mg)加至混合物中。反应混合物在氢气气氛中搅拌过夜。过滤除去催化剂并减压除去溶剂得到3-氨基-N,N-二甲基苯磺酰胺(600mg,80%),为白色固体。LCMS(方法B):0.48[M+H]+=201.1
步骤3:N,N-二甲基-3-((4-(甲基(4-硝基苯基)胺基)嘧啶-2-基)胺基)苯磺酰胺
将2-氯-N-甲基-N-(4-硝基苯基)嘧啶-4-胺(来自化合物1的制备的步骤2,200mg,0.77mmol)和3-氨基-N,N-二甲基苯磺酰胺(158mg,0.79mmol)溶于t-BuOH(5mL),然后加入浓HCl(2滴)。反应混合物160℃加热2小时。除去溶剂,粗品用石油醚/乙酸乙酯,1:1重结晶纯化,得到所需化合物(220mg,68%),为黄色固体。LCMS(方法B):2.16min[MH]+=429.2。
步骤4:3-((4-((4-氨基苯基)(甲基)胺基)嘧啶-2-基)胺基)-N,N-二甲基苯磺酰胺
将N,N-二甲基-3-((4-(甲基(4-硝基苯基)胺基)嘧啶-2-基)胺基)苯磺酰胺(220mg,0.51mmol)溶于乙醇(30mL),然后添加湿Pd/C(10%,22mg)。反应混合物在氢气气氛中搅拌过夜。过滤除去催化剂,滤液减压浓缩得到3-((4-((4-氨基苯基)(甲基)胺基)嘧啶-2-基)胺基)-N,N-二甲基苯磺酰胺(150mg,75%),为黄色固体,直接用于下一步骤。LCMS(方法B):1.87min[MH]+=399.2。
步骤5:N,N-二甲基-3-((4-(甲基(4-(3-(4-(三氟甲氧基)苯基)脲基)-苯基)胺基)嘧啶-2-基)胺基)苯磺酰胺
N,N-二甲基-3-((4-(甲基(4-(3-(4-(三氟甲氧基)苯基)脲基)苯基)-胺基)嘧啶-2-基)胺基)苯磺酰胺。向3-((4-((4-氨基苯基)(甲基)胺基)嘧啶-2-基)胺基)-N,N-二甲基苯磺酰胺(150mg,0.38mmol)的THF(20mL)的溶液中加入1-异氰酸基-4-(三氟甲氧基)苯(80mg,0.4mmol)和DIEA(98mg,0.76mmol)。反应室温搅拌过夜。混合物真空浓缩,粗品用洗脱剂(DCM/甲醇,100至100/2)柱层析纯化得到不纯产品,用石油醚/乙醇,1:1重结晶得到N,N-二甲基-3-((4-(甲基(4-(3-(4-(三氟甲氧基)苯基)脲基)苯基)胺基)嘧啶-2-基)胺基)苯磺酰胺(42.6mg,19%),为白色固体。1H NMR(400MHz,DMSO-d6):δppm 2.63(s,6H)3.45(s,3H),5.81(d,J=6.0Hz,1H),7.32(m,5H),7.50(t,J=8.0Hz,1H),7.59(m,4H),7.93(m,2H),8.53(s,1H),8.89(s,1H),8.94(s,1H),9.60(s,1H)。LCMS(方法B):2.66min[MH]+=602.3。
化合物11
步骤1:(4-氨基苯基)氨基甲酸叔丁酯
将苯-1,4-二胺(3.24g,30mmol)溶于THF(30mL)、DMF(10mL)和水(5mL),然后添加碳酸钾(1.52g,11mmol)和Boc2O(2.18g,10mmol)。反应混合物室温搅拌过夜。混合物倒入水中(50mL),所得混合物用乙酸乙酯(50mL)萃取三次。合并的有机层用水(50mL)洗涤三次,用Na2SO4干燥,得到(4-氨基苯基)氨基甲酸叔丁酯(1.6g,77%),为黄色固体。LCMS(方法B):0.51min[MH]+=209.1。
步骤2:(4-((2-氯嘧啶-4-基)胺基)苯基)氨基甲酸叔丁酯
4-氨基苯基氨基甲酸叔丁酯(800mg,3.84mmol)、2,4-二氯嘧啶(744mg,5.00mmol)和NaHCO3(967mg,11.5mmol)溶于2-丙醇(20mL)。反应混合物90℃加热过夜。过滤热的反应混合物除去固体。浓缩滤液得到残留物。向残留物中加入DCM(80mL),搅拌悬浮液30min。过滤收集析出的固体得到(4-((2-氯嘧啶-4-基)胺基)苯基)氨基甲酸叔丁酯(1g,63%),为白色固体。LCMS(方法B):2.63min[MH]+=321.1。
步骤3:(4-((2-((3-氨基磺酰基苯基)胺基)嘧啶-4-基)胺基)苯基)氨基甲酸叔丁酯
将4-(2-氯嘧啶-4-基胺基)苯基氨基甲酸叔丁酯(200mg,0.62mmol)和3-氨基-苯磺酰胺(107mg,0.62mmol)溶于1,4-二氧六环(4mL),然后添加TsOH(95mg,0.5mmol)。反应混合物微波120℃加热2小时。TLC分析显示反应结束。除去溶剂,粗品用石油醚:EtOAc(2:1)洗涤和干燥得到(4-((2-((3-氨基磺酰基苯基)胺基)嘧啶-4-基)胺基)苯基)-氨基甲酸叔丁酯(120mg,42.3%),为黄色固体。
步骤4:3-((4-((4-氨基苯基)胺基)嘧啶-2-基)胺基)苯磺酰胺
(4-((2-((3-氨基磺酰基苯基)胺基)嘧啶-4-基)胺基)苯基)氨基甲酸叔丁酯(120mg,0.26mmol)溶于DCM(10mL),然后添加TFA(1mL)。反应混合物室温搅拌过夜。除去溶剂得到粗品,将粗品用NaHCO3水溶液洗涤,干燥得到3-((4-((4-氨基苯基)胺基)嘧啶-2-基)胺基)苯磺酰胺(80mg,86.3%),为黄色固体。LCMS(方法B):0.29min[MH]+=357.1。
步骤5:3-((4-((4-(3-(4-(三氟甲氧基)苯基)脲基)苯基)胺基)嘧啶-2-基)胺基)苯磺酰胺
3-((4-((4-(3-(4-(三氟甲氧基)苯基)脲基)苯基)胺基)嘧啶-2-基)胺基)苯磺酰胺。向3-((4-((4-氨基苯基)胺基)嘧啶-2-基)胺基)苯磺酰胺(80mg,0.22mmol)的THF(20mL)的溶液中加入1-异氰酸基-4-(三氟甲氧基)苯(48mg,0.24mmol)和DIEA(57mg,0.44mmol)。反应室温搅拌过夜。真空浓缩混合物,粗品经柱层析纯化(DCM:甲醇,100:0至100:5)得到3-((4-((4-(3-(4-(三氟甲氧基)苯基)脲)苯基)胺基)嘧啶-2-基)胺基)苯磺酰胺(17.8mg,14.5%),为黄色固体。1H NMR(400MHz,DMSO-d6):δppm 6.38(d,J=6.8Hz,1H),7.58(m,13H),7.98(m,3H),8.84(s,1H),8.98(s,1H),10.24(s,1H)。LCMS(方法B):2.46min[MH]+=560.1[MNa]+=582.1
化合物12
步骤1:N1-(2-氯嘧啶-4-基)-N1,N4-二甲基苯-1,4-二胺
将N1-(2-氯嘧啶-4-基)-N1-甲基苯-1,4-二胺(来自中间体C的制备的步骤2,700mg,2.98mmol),多聚甲醛(98.4mg,3.28mmol)溶于1,2-二氯乙烷(16mL)和甲醇(8mL),然后添加醋酸(3滴)。反应混合物40℃加热过夜,然后加入NaBH3CN(281mg,4.47mmol)。除去溶剂,粗品通过柱层析(石油醚:乙酸乙酯,3:1)纯化得到N1-(2-氯嘧啶-4-基)-N1,N4-二甲基苯-1,4-二胺(250mg,30%)为白色固体。LCMS(方法B):2.22min[MH]+=249.1。
步骤2:3-((4-(甲基(4-(甲基胺基)苯基)胺基)嘧啶-2-基)胺基)苯磺酰胺
将N1-(2-氯嘧啶-4-基)-N1,N4-二甲基苯-1,4-二胺(50mg,0.20mmol),3-氨基-苯磺酰胺(35mg,0.20mmol)溶于1,4-二氧六环(3mL),然后添加TsOH(30mg,0.16mmol)。反应混合物微波120℃加热2小时。除去溶剂,粗品柱层析纯化(DCM/甲醇,100:0至100:2),然后用制备型HPLC纯化,得到3-((4-(甲基(4-(甲基胺基)苯基)胺基)嘧啶-2-基)胺基)苯磺酰胺(16mg,21%),为黄色固体。1H NMR(400MHz,DMSO-d6):δppm 2.72(s,3H),3.48(s,3H),5.89(s,1H),6.67(d,J=8.0Hz,2H),7.13(m,2H),7.73(m,6H),7.85(d,J=6.8Hz,1H),8.37(s,1H),10.73(s,1H)。LCMS(方法B):0.86min[MH]+=385.1
步骤3:3-((4-(甲基(4-(1-甲基-3-(4-(三氟甲氧基)苯基)脲基)苯基)胺基)嘧啶-2-基)胺基)苯磺酰胺
3-((4-(甲基(4-(1-甲基-3-(4-(三氟甲氧基)苯基)脲基)苯基)胺基)嘧啶-2-基)胺基)苯磺酰胺。向3-((4-(甲基(4-(甲基胺基)苯基)胺基)嘧啶-2-基)胺基)苯磺酰胺(来自上述步骤2,150mg,0.39mmol)的THF(10mL)的溶液中加入1-异氰酸基-4-(三氟甲氧基)苯(87mg,0.43mmol)和DIEA(101mg,0.78mmol)。反应室温搅拌过夜。混合物真空浓缩,粗品通过柱层析纯化(DCM:甲醇,100至100:5),得到黄色固体,用制备型HPLC纯化得到3-((4-(甲基(4-(1-甲基-3-(4-(三氟甲氧基)苯基)脲基)苯基)胺基)嘧啶-2-基)胺基)苯-磺酰胺(40mg,17%),为白色固体。1H NMR(400MHz,DMSO-d6):δppm 3.34(s,3H),3.53(s,3H),6.09(d,J=6.4Hz,1H),7.28(d,J=8.8Hz,2H),7.45(m,4H),7.59(m,6H),7.75(m,1H),7.96(d,J=7.2Hz,1H),8.39(s,1H),8.58(s,1H),10.51(s,1H)。LCMS(方法B):2.40min[MH]+=588.2[MNa]+=610.1。
化合物13
步骤1:(3-硝基苯基)甲磺酰胺
向(3-硝基苯基)甲磺酰氯(700mg,2.97mmol)在乙腈(3mL)中的混合物中加入经碳酸铵饱和的浓缩氨水。所得混合物室温搅拌2小时。浓缩混合物,残留物用冷水稀释形成沉淀,经过滤并用水洗涤得到(3-硝基苯基)甲磺酰胺(642mg,100%),为白色固体。LCMS(方法B):0.47min[MNa]+=239.0。
步骤2:(3-氨基苯基)甲磺酰胺
向(3-硝基苯基)甲磺酰胺(150mg,0.69mmol)在甲醇(4mL)和NH4Cl溶液(4mL)中的混合物中加入锌(453mg,6.9mmol)。混合物65℃搅拌3小时。用碳酸氢钠溶液调节混合物至pH=7。过滤固体。滤液用乙酸乙酯(3x)萃取。合并的有机层用硫酸钠干燥并浓缩得到(3-氨基苯基)甲磺酰胺(100mg,78%),为黄色油。LCMS(方法B):0.28min[MH]+=187.0。
步骤3:(3-((4-(甲基(4-(3-(4-(三氟甲氧基)苯基)脲基)苯基)胺基)嘧啶-2-基)胺基)苯基)甲磺酰胺
按照通用方法C采用中间体C(117mg,0.27mmol)和3-氨基苯基甲磺酰胺(50mg,0.27mmol),得到(3-((4-(甲基(4-(3-(4-(三氟甲氧基)苯基)脲基)苯基)胺基)嘧啶-2-基)胺基)苯基)甲磺酰胺(100mg,45%),为白色固体。1H NMR(400MHz,MeOD-d4):δppm3.59(s,3H),4.41(s,2H),5.97(d,J=7.4Hz,1H),7.36-7.15(m,6H),7.47(d,J=7.9Hz,1H),7.57(m,2H),7.72-7.61(m,3H),7.84(s,1H)。LCMS(方法B):2.48min[MH]+=588.2。
化合物14
步骤1:N-甲基-3-硝基苯胺
向3-硝基苯胺(5g,36.2mmol)的丙酮(30mL)的溶液中加入碘甲烷(5.65g,39.8mmol)和碳酸钾(10g,72.4mmol)。混合物50℃搅拌过夜。混合物减压浓缩至干。残留物通过柱层析纯化(石油醚:乙酸乙酯,10:1)得到N-甲基-3-硝基苯胺(1.6g,29%),为红色固体。LCMS(方法B):3.01min[MH]+=153.1。
步骤2:2-氯-N-甲基-N-(3-硝基苯基)嘧啶-4-胺
向N-甲基-3-硝基苯胺(1.6g,10.5mmol)的N,N-二甲基甲酰胺(10mL)的溶液中加入2,4-二氯吡啶(1.72g,11.6mmol)和碳酸钾(2.18g,15.8mmol)。于130℃搅拌混合物3小时。反应混合物在乙酸乙酯和水之间分层,分离有机层并用水、盐水洗涤,用硫酸钠干燥并浓缩得到残留物,其用柱层析纯化(石油醚:乙酸乙酯,5:1)得到2-氯-N-甲基-N-(3-硝基苯基)嘧啶-4-胺(1.0g,36%),为淡黄色固体。LCMS(方法B):3.01min[MH]+=265.1。
步骤3:3-((4-(甲基(3-硝基苯基)胺基)嘧啶-2-基)胺基)苯-磺酰胺
向2-氯-N-甲基-N-(3-硝基苯基)嘧啶-4-胺(1g,3.78mmol)的1,4-二氧六环(20mL)的溶液中加入3-氨基苯磺酰胺(683mg,3.97mmol)和一水合对甲基苯磺酸(575mg,3.02mmol)。混合物120℃搅拌3小时。减压除去溶剂,加入氨水溶液(30mL)形成沉淀。过滤收集固体并减压干燥得到3-((4-(甲基(3-硝基苯基)胺基)嘧啶-2-基)胺基)苯磺酰胺(1.4g,93%产率),为棕色固体。LCMS(方法B):1.24min[MH]+=401.1。
步骤4:3-((4-((3-氨基苯基)(甲基)胺基)嘧啶-2-基)胺基)苯磺酰胺
向3-((4-(甲基(3-硝基苯基)胺基)嘧啶-2-基)胺基)苯磺酰胺(700mg,1.75mmol)的甲醇(30mL)的溶液中加入锌粉(3.0g)和饱和氯化铵水溶液(30mL)。混合物室温搅拌过夜。过滤固体并减压除去溶剂得到残留物,残留物在水和乙酸乙酯之间分层。分离有机相并用水、盐水洗涤,用硫酸钠干燥并减压浓缩得到3-((4-((3-氨基苯基)(甲基)胺基)嘧啶-2-基)胺基)苯磺酰胺(600mg,92%),为淡黄色固体。LCMS(方法B):0.49min[MH]+=371.1。
步骤5:3-((4-(甲基(3-(3-(4-(三氟甲氧基)苯基)脲基)苯基)胺基)嘧啶-2-基)胺基)苯磺酰胺
3-((4-(甲基(3-(3-(4-(三氟甲氧基)苯基)脲基)苯基)胺基)嘧啶-2-基)胺基)苯磺酰胺。向3-((4-((3-氨基苯基)(甲基)胺基)嘧啶-2-基)胺基)苯磺酰胺(200mg,0.54mmol)的四氢呋喃(20mL)的溶液中加入4-(三氟甲氧基)苯基异氰酸酯(121mg,0.54mmol)和N,N-二异丙基乙胺(140mg,1.08mmol)。混合物室温搅拌3小时。反应混合物减压浓缩得到残留物,其用硅胶层析纯化(二氯甲烷/甲醇,35:1)得到3-((4-(甲基(3-(3-(4-(三氟甲氧基)苯基)脲基)苯基)胺基)嘧啶-2-基)胺基)苯磺酰胺(190mg,65%),为淡棕色固体。1H NMR(400MHz,DMSO-d6):δppm 3.47(s,3H),5.89(d,J=6.0Hz,1H),6.97(d,J=8.0Hz,1H),7.32-7.24(m,4H),7.44-7.33(m,4H),7.55(s,1H),7.55(d,J=8.8Hz,2H),7.81(d,J=8.0Hz,1H),7.91(d,J=6.0Hz,1H),8.56(s,1H),9.07(s,1H),9.10(s,1H),9.57(s,1H)。LCMS(方法B):2.50min[MH]+=574.2,[MNa]+=596.2。
化合物15
步骤1:2-氯-N-甲基吡啶-4-胺
向密封管中加入2,4-二氯吡啶(2g,13.5mmol)和2M甲胺的甲醇溶液。混合物85℃加热过夜。除去溶剂,粗品通过柱层析(石油醚/乙酸乙酯,3:1)纯化得到2-氯-N-甲基吡啶-4-胺(1.58g,82%),为白色固体。LCMS(方法B):1.54min[MH]+=143.0。
步骤2:2-氯-N-甲基-N-(4-硝基苯基)吡啶-4-胺
将2-氯-N-甲基吡啶-4-胺(200mg,1.4mmol),4-氟-硝基苯(217mg,1.54mmol)和K2CO3(368mg,2.8mmol)加至DMSO(5mL)中。反应混合物120℃加热至起始原料消失。将反应混合物倒入水(20mL)。过滤收集固体,并干燥得到2-氯-N-甲基-N-(4-硝基苯基)吡啶-4-胺(280mg,75.9%),为黄色固体。LCMS(方法B):2.37min[MH]+=264.0。
步骤3:3-((4-(甲基(4-硝基苯基)胺基)吡啶-2-基)胺基)苯-磺酰胺
将2-氯-N-甲基-N-(4-硝基苯基)吡啶-4-胺(400mg,1.52mmol)、3-氨基苯甲酰胺(261mg,1.52mmol)、Cs2CO3(991mg,3.04mmol)和4,5-双二苯基膦-9,9-二甲基氧杂蒽(xantphos)(174mg,0.3mmol)加至1,4-二氧六环(15mL)中,然后添加Pd2(dba)3(139mg,0.152mmol)。反应混合物在氮气气氛中120℃加热过夜。混合物真空浓缩,粗品通过柱层析纯化(DCM/甲醇,100:0至98:2)得到3-((4-(甲基(4-硝基苯基)胺基)吡啶-2-基)胺基)苯磺酰胺(303mg,50%),为黄色固体。LCMS(方法B):0.75min[MH]+=400.1。
步骤4:3-((4-((4-氨基苯基)(甲基)胺基)吡啶-2-基)胺基)苯磺酰胺
将3-((4-((4-氨基苯基)(甲基)胺基)吡啶-2-基)胺基)苯磺酰胺(300mg,0.75mmol)溶于DMF(30mL)和饱和NH4Cl(30mL)的混合溶剂中,然后添加锌粉(487mg,7.5mmol)。反应混合物室温搅拌过夜。过滤除去固体,并用甲醇(30mL)洗涤3次。收集滤液并浓缩得到残留物。粗品用水(30mL)洗涤三次。收集黄色固体并干燥得到3-((4-((4-氨基苯基)(甲基)胺基)吡啶-2-基)胺基)苯磺酰胺(200mg,72%)。LCMS(方法B):0.35min[MH]+=370.1。
步骤5:3-((4-(甲基(4-(3-(4-(三氟甲氧基)苯基)脲基)苯基)胺基)吡啶-2-基)胺基)苯磺酰胺
3-((4-(甲基(4-(3-(4-(三氟甲氧基)苯基)脲基)苯基)胺基)吡啶-2-基)胺基)苯磺酰胺。向3-((4-((4-氨基苯基)(甲基)胺基)吡啶-2-基)胺基)苯磺酰胺(200mg,0.54mmol)的THF(10mL)的溶液中加入1-异氰酸基-4-(三氟甲氧基)苯(115mg,0.57mmol)和DIEA(140mg,1.08mmol)。反应室温搅拌过夜。混合物真空浓缩,粗品经柱层析(DCM/甲醇,100:0至97.5:2.5)纯化得到3-((4-(甲基(4-(3-(4-(三氟甲氧基)苯基)脲基)苯基)胺基)吡啶-2-基)胺基)苯磺酰胺(120mg,39%),为黄色固体。1H NMR(400MHz,DMSO-d6):δppm 3.24(s,3H),6.03(d,J=2.0Hz,1H),6.20(dd,J=6.0and 2.1Hz,1H),7.39-7.18(m,8H),7.57(t,J=9.5Hz,4H),7.86-7.77(m,2H),8.21(s,1H),9.04(br s,2H),9.12(s,1H)。LCMS(方法B):2.43min[MH]+=573.2,[MNa]+=595.2。
化合物16
步骤1:N-(4-(甲基(2-((3-氨基磺酰基苯基)胺基)嘧啶-4-基)胺基)苯基)-2-(4-(三氟-甲氧基)苯基)乙酰胺
将2-(4-(三氟甲氧基)苯基)醋酸(63mg,0.28mmol)、中间体A(100mg,0.27mmol)和DIEA(70mg,0.54mmol)加至DMF(3mL)中。然后加入HATU(123mg,0.324mmol)。反应混合物室温搅拌过夜。粗品用洗脱剂(DCM/甲醇,100:0至97:3)柱层析纯化得到白色固体,其用制备型HPLC纯化得到N-(4-(甲基(2-((3-氨基磺酰基苯基)胺基)嘧啶-4-基)胺基)苯基)-2-(4-(三氟-甲氧基)苯基)乙酰胺(15mg,10%),为白色固体。1H NMR(400MHz,CDCl3):δ3.55(s,3H),3.70(s,2H),5.82(s,1H),6.18(s,1H),7.17(m,4H),7.38(d,J=8.5Hz,2H),7.50(br s,2H),7.68(m,3H),7.84(br s,1H),8.41(s,1H)。LCMS(方法B):2.42min[MH]+=573.2。
化合物17
步骤1:2-(4-((2-氯嘧啶-4-基)胺基)苯基)乙酸甲酯
10℃下,缓慢地将DIEA(2.2g,16.8mmol)加至2,4-二氯嘧啶(500mg,3.36mmol)和2-(4-氨基苯基)乙酸甲酯(664mg,4mmol)的乙醇(20mL)的溶液中。然后,混合物回流加热48小时。浓缩混合物并用柱层析纯化(石油醚/乙酸乙酯,3:1)得到2-(4-((2-氯嘧啶-4-基)胺基)苯基)乙酸甲酯(740mg,79%),为红色油。LCMS(方法B):2.37min[MH]+=278.0。
步骤2:2-(4-((2-氯嘧啶-4-基)(甲基)胺基)苯基)乙酸甲酯
将2-(4-((2-氯嘧啶-4-基)胺基)苯基)乙酸甲酯(490mg,1.76mmol)溶于DMF(6mL)和碳酸铯(1.7g,5.3mmol)。15min之后,加入碘甲烷(376mg,2.65mmol),混合物室温搅拌16小时。加入水淬灭反应,所得混合物用乙酸乙酯萃取。合并的有机相用硫酸钠干燥,浓缩并用柱层析(石油醚/乙酸乙酯,7:1)纯化得到2-(4-((2-氯嘧啶-4-基)(甲基)胺基)苯基)乙酸甲酯(260mg,61%),为黄色油。1H NMR(400MHz,DMSO-d6):δppm3.38(s,3H),3.65(s,3H),3.77(s,2H),6.30(d,J=6.0Hz,1H),7.35(m,2H),7.42(d,J=8.4Hz,2H),8.00(d,J=6.0Hz,1H)。LCMS(方法B):2.48min[MH]+=292.1。
步骤3:2-(4-((2-氯嘧啶-4-基)(甲基)胺基)苯基)醋酸
向2-(4-((2-氯嘧啶-4-基)(甲基)胺基)苯基)乙酸甲酯(320mg,1.1mmol)的THF(16mL)和甲醇(8mL)的溶液中加入1M氢氧化钠(4.8mL)。反应混合物室温搅拌2小时。用1M HCl溶液调节混合物至pH=2并用乙酸乙酯萃取多次。合并的有机层用硫酸钠干燥,浓缩得到2-(4-((2-氯嘧啶-4-基)(甲基)胺基)苯基)醋酸(304mg,定量),为白色固体。LCMS(方法B):2.32min[MH]+=278.2。
步骤4:2-(4-((2-氯嘧啶-4-基)(甲基)胺基)苯基)-N-(4-(三氟甲氧基)苯基)乙酰胺
室温搅拌二氯甲烷(8mL)中2-(4-((2-氯嘧啶-4-基)(甲基)胺基)苯基)醋酸(304mg,1.1mmol)的混合物。加入4-(三氟甲氧基)苯胺(195mg,1.1mmol)和TEA(222mg,2.2mmol),然后添加EDC.HCl(211mg,1.1mmol)和HOBt(148mg,1.1mmol)。混合物室温搅拌16小时。浓缩混合物并用柱层析(石油醚/乙酸乙酯,3:1至1:1)纯化得到2-(4-((2-氯嘧啶-4-基)(甲基)胺基)苯基)-N-(4-(三氟-甲氧基)苯基)乙酰胺(380mg,79%),为白色固体。LCMS(方法B):2.97min[MH]+=437.1。
步骤5:2-(4-(甲基(2-((3-氨基磺酰基苯基)胺基)嘧啶-4-基)胺基)苯基)-N-(4-(三氟甲氧基)苯基)乙酰胺
将2-(4-(甲基(2-((3-氨基磺酰基苯基)胺基)嘧啶-4-基)胺基)苯基)-N-(4-(三氟-甲氧基)苯基)乙酰胺。将2-(4-((2-氯嘧啶-4-基)(甲基)胺基)苯基)-N-(4-(三氟甲氧基)苯基)乙酰胺(100mg,0.23mmol)和3-氨基苯基磺酰胺(39mg,0.23mmol)溶于DMF(3mL)。向该混合物中加入p-TsOH.H2O(85mg,0.23mmol)。反应混合物60℃搅拌16小时。然后用碳酸钠溶液调节混合物至pH=9。所得混合物用乙酸乙酯萃取多次。合并的萃取液用硫酸钠干燥,浓缩并用柱层析纯化(石油醚/乙酸乙酯,30:1)得到2-(4-(甲基(2-((3-氨基磺酰基苯基)胺基)嘧啶-4-基)胺基)苯基)-N-(4-(三氟甲氧基)苯基)乙酰胺(100mg,76%),为白色固体。1H NMR(400MHz,DMSO-d4):δppm 3.45(s,3H),3.72(s,2H),5.83(d,J=6.0Hz,1H),7.27(s,2H),7.33(m,5H),7.39(t,J=7.9Hz,1H),7.46(d,J=8.3Hz,2H),7.74(d,J=8.8Hz,2H),7.79(d,J=8.3Hz,1H),7.89(d,J=6.0Hz,1H),8.54(s,1H),9.55(s,1H),10.45(s,1H)。LCMS(方法B):2.32min[MH]+=573.2,[MNa]+=595.2。
化合物18
步骤1:2-氟-5-((4-(甲基(4-(3-(4-(三氟甲氧基)苯基)脲基)苯基)胺基)嘧啶-2-基)胺基)苯磺酰胺。
按照通用方法C采用中间体B(60mg,0.14mmol)和3-氨基-4-氟磺酰胺(26mg,0.14mmol),得到2-氟-5-((4-(甲基(4-(3-(4-(三氟甲氧基)苯基)脲基)苯基)胺基)嘧啶-2-基)胺基)苯-磺酰胺(50mg,60%),为白色固体。1H NMR(400MHz,DMSO-d4):δ3.60(s,3H),5.93(s,1H),7.34(m,5H),7.69(s,2H),7.61(m,4H),7.96-7.74(m,2H),8.36(s,1H),9.32(s,2H),10.49(s,1H)。LCMS(方法B):2.50min[MH]+=592.2,[MNa]+=614.1。
化合物19
步骤1:N,N,2-三甲基-5-硝基苯甲酰胺
将2-甲基-5-硝基苯甲酸(1g,5.5mmol)溶于SOCl2(15mL),然后添加DMF(1滴)。反应混合物回流4小时。减压除去溶剂。加入DCM(10mL),然后减压浓缩反应混合物。添加DCM/浓缩循环重复三次得到白色固体。将Me2NH.HCl(490mg,6.08mmol)和TEA(1.67g,16.6mmol)溶于DCM(20mL)。0℃下将DCM(5mL)中2-甲基-5-硝基苯甲酰氯(1.09g,5.5mmol)缓慢加至该混合物中。反应混合物室温搅拌16小时,用水(3x 30mL)洗涤和干燥有机相(Na2SO4)并浓缩得到N,N,2-三甲基-5-硝基苯甲酰胺(600mg,52.2%),为白色固体。LCMS(方法B):1.06min[MH]+=208.4。
步骤2:5-氨基-N,N,2-三甲基苯甲酰胺
将N,N,2-三甲基-5-硝基苯甲酰胺(300mg,1.44mmol)溶于甲醇(20mL),然后添加湿Pd/C(10%,30mg)。氢气下搅拌反应混合物过夜。过滤除去催化剂,滤液减压浓缩得到5-氨基-N,N,2-三甲基苯甲酰胺(180mg,70%),为黄色固体,直接用于下一步骤。LCMS(方法B):0.30min[MH]+=179.1。
步骤3:N,N,2-三甲基-5-((4-(甲基(4-硝基苯基)胺基)嘧啶-2-基)胺基)苯甲酰胺
将2-氯-N-甲基-N-(4-硝基苯基)嘧啶-4-胺(来自中间体A的制备的步骤2,223mg,0.84mmol)和5-氨基-N,N,2-三甲基苯甲酰胺(150mg,0.84mmol)溶于1,4-二氧六环(4mL),然后添加浓HCl(2滴)。反应混合物120℃加热3小时。除去溶剂,粗品用石油醚/DCM,1:1洗涤得到N,N,2-三甲基-5-((4-(甲基(4-硝基苯基)胺基)嘧啶-2-基)胺基)苯甲酰胺(250mg,73%),为黄色固体,其不需进一步纯化用于下一步骤。LCMS(方法B):1.96min[MH]+=407.2。
步骤4:5-((4-((4-氨基苯基)(甲基)胺基)嘧啶-2-基)胺基)-N,N,2-三甲基苯甲酰胺
向N,N,2-三甲基-5-((4-(甲基(4-硝基苯基)胺基)嘧啶-2-基)胺基)苯甲酰胺(250mg,0.62mmol)的甲醇(10mL)溶液中加入锌(400mg,6.2mmol)和NH4Cl饱和水溶液(10mL)。反应混合物室温搅拌过夜。过滤除去固体并用甲醇(20mL)洗涤三次。收集滤液,除去有机溶剂得到残留物,其用DCM(3x50mL)萃取。合并的有机层用水洗涤并用Na2SO4干燥。减压除去溶剂得到5-((4-((4-氨基苯基)(甲基)胺基)嘧啶-2-基)胺基)-N,N,2-三甲基苯甲酰胺(150mg,64%),为黄色固体。LCMS(方法B):1.12min[MH]+=377.2。
步骤5:N,N,2-三甲基-5-((4-(甲基(4-(3-(4-(三氟甲氧基)苯基)脲基)苯基)胺基)嘧啶-2-基)胺基)苯甲酰胺
向5-((4-((4-氨基苯基)(甲基)胺基)嘧啶-2-基)胺基)-N,N,2-三甲基苯甲酰胺(150mg,0.40mmol)的THF(15mL)溶液中加入1-异氰酸基-4-(三氟甲氧基)苯(80mg,0.40mmol)和DIEA(155mg,1.2mmol)。反应混合物室温搅拌过夜。混合物真空浓缩,粗品用柱层析(DCM:甲醇,100至100:2)纯化得到N,N,2-三甲基-5-((4-(甲基(4-(3-(4-(三氟甲氧基)苯基)脲基)苯基)胺基)嘧啶-2-基)胺基)苯甲酰胺(82mg,35%),为黄色固体。1H NMR(400MHz,DMSO-d4):δ2.16(m,3H),2.77(m,3H),3.01(m,3H),3.44(m,3H),6.00-6.37(m,1H),7.89-7.21(m,12H),9.32(s,1H),9.50(s,1H),10.56-10.78(m,1H)。LCMS(方法B):2.54min[MH]+=580.3。
化合物20
3-((4-(甲基(4-(3-(2-甲基-4-(三氟甲氧基)苯基)脲基)苯基)-胺基)嘧啶-2-基)胺基)苯磺酰胺
按照通用方法A采用中间体A(60mg,0.12mmol)和2-甲基-4-三氟甲氧基苯胺(24mg,0.13mmol),经柱层析(DCM/MeOH,100:0至98:2)纯化后得到3-((4-(甲基(4-(3-(2-甲基-4-(三氟-甲氧基)苯基)脲基)苯基)胺基)嘧啶-2-基)胺基)苯磺酰胺(4mg,4%),为白色固体。1H NMR(400MHz,MeOD-d4):δppm 2.25(s,3H),3.32(s,3H),5.86(d,J=6.8Hz,1H),7.03(m,2H),7.12(d,J=8.4Hz,2H),7.65(m,6H),7.83(m,2H),8.41(s,1H)。LCMS(方法B):2.48min[MH]+=588.2,[MNa]+=610.2。
化合物21
步骤1:2-甲基-5-((4-(甲基(4-(3-(4-(三氟甲氧基)苯基)脲基)苯基)胺基)嘧啶-2-基)胺基)苯磺酰胺
按照通用方法C采用中间体A(100mg,0.43mmol)和3-氨基-4-甲基苯磺酰胺(43mg,0.23mmol),得到2-甲基-5-((4-(甲基(4-(3-(4-(三氟甲氧基)苯基)脲基)苯基)胺基)嘧啶-2-基)胺基)苯磺酰胺(100mg,75%),为白色固体。1H NMR(400MHz,DMSO-d6):δppm 2.56(s,3H),3.50(s,3H),5.99(m,1H),7.38(m,7H),7.65(m,5H),7.87(d,J=7.2Hz,1H),8.36(s,1H),9.24(d,J=3.6Hz,2H),10.50(s,1H)。LCMS(方法B):2.52min[MH]+=588.2。
化合物22
步骤1:2-甲基-2-(4-(三氟甲氧基)苯基)丙酸甲酯
向NaH(60%,362mg,9.1mmol)在DMF(8mL)的混合物中加入2-(4-(三氟甲氧基)苯基)乙酸甲酯(530mg,2.26mmol)。混合物0℃搅拌30分钟,然后加入碘甲烷(1.29g,9.1mmol)。反应室温搅拌过夜。用106mg2-(4-(三氟甲氧基)苯基)乙酸甲酯重复另一批次。合并两个批次并倒入水中。所得混合物用乙酸乙酯萃取。有机层用硫酸钠干燥,浓缩并用柱层析(石油醚/乙酸乙酯,30:1)纯化得到2-甲基-2-(4-(三氟甲氧基)苯基)丙酸甲酯,为黄色油(440mg,60%)。LCMS(方法B):2.85min[MH]+=263.1。
步骤2:2-甲基-2-(4-(三氟甲氧基)苯基)丙酸
将氢氧化钠溶液(1M,1.5mL)添加至2-甲基-2-(4-(三氟甲氧基)苯基)丙酸甲酯(50mg,0.19mmol)的甲醇(1.0mL)和THF(2.0mL)溶液中。反应混合物室温搅拌过夜,然后加入HCl溶液(1M)使得pH=1-2。所得混合物用乙酸乙酯萃取。有机层用硫酸钠干燥并浓缩得到2-甲基-2-(4-(三氟甲氧基)苯基)丙酸(42mg,89%),为棕色油。LCMS(方法B):2.80min[MH]+=271.0。
步骤3:2-甲基-N-(4-(甲基(2-((3-氨基磺酰基苯基)胺基)嘧啶-4-基)胺基)苯基)-2-(4-(三氟甲氧基)苯基)丙酰胺
氮气下,将2-甲基-2-(4-(三氟甲氧基)苯基)丙酸(270mg,1.09mmol)溶于SOCl2(4mL),然后添加DMF(1滴)。于80℃搅拌所得混合物3小时。蒸去多余的SOCl2,所得残留物溶于DCM(6mL)。0℃下,将该溶液缓慢地加至N1-(2-氯嘧啶-4-基)-N1-甲基苯-1,4-二胺(来自中间体C的制备的步骤2,255mg,1.09mmol)和TEA(275mg,2.72mmol)的DCM(6mL)的溶液中。反应室温搅拌过夜。然后将混合物在1M HCl溶液和乙酸乙酯之间分层。分离有机层,用硫酸钠干燥并浓缩得到残留物,其用柱层析(DCM/MeOH,20:1)纯化得到所需中间体(50mg,10%),为黄色固体。LCMS(方法B):3.14min[MH]+=465.1。
步骤4:2-甲基-N-(4-(甲基(2-((3-氨基磺酰基苯基)胺基)嘧啶-4-基)胺基)苯基)-2-(4-(三氟甲氧基)苯基)丙酰胺。
按照通用方法C采用2-甲基-N-(4-(甲基(2-((3-氨基磺酰基苯基)胺基)嘧啶-4-基)胺基)苯基)-2-(4-(三氟甲氧基)苯基)丙酰胺(步骤3)(50mg,0.107mmol)和3-氨基苯磺酰胺(18mg,0.107mmol),得到2-甲基-N-(4-(甲基(2-((3-氨基磺酰基苯基)胺基)嘧啶-4-基)胺基)苯基)-2-(4-(三氟-甲氧基)苯基)丙酰胺(30mg,47%),为白色固体。1H NMR(400MHz,DMSO-d6):δppm 1.60(s,6H),3.47(s,3H),5.94(br s,1H),7.38(m,6H),7.44(m,6H),7.52(m,4H),7.79(m,3H),7.88(d,J=6.8Hz,1H),8.39(s,1H),9.41(s,1H),10.07(s,1H),10.40(s,1H)。LCMS(方法B):2.52min[MH]+=601.2。
化合物23
步骤1:N-(2-甲氧基乙基)-3-硝基苯磺酰胺。
0℃下,向预冷的3-硝基苯-1-磺酰氯(5.0g,22.6mmol)的DCM(100mL)的溶液中加入三乙胺(12.6mL,90.4mmol),然后滴加2-甲氧基乙胺(3.9mL,45.1mmol)。反应混合物室温搅拌2小时,然后用水(50mL)稀释。分离有机层并用DCM萃取水层两次。合并的有机层用盐水洗涤,用MgSO4干燥并减压浓缩得到标题化合物(5.05g,86%),为淡黄色油。1H NMR(600MHz,CDCl3):δppm 3.18(t,J=7.5Hz,2H),3.24(s,3H),3.41(t,J=7.5Hz,2H),7.72(dd,J=7.8and 7.8Hz,1H),8.17(d,J=7.8Hz,1H),8.40(d,J=7.80Hz,1H),8.69(s,1H)。LCMS(方法A):4.73min[MH]+=259.5。
步骤2:3-氨基-N-(2-甲氧基乙基)苯磺酰胺。
将N-(2-甲氧基乙基)-3-硝基苯磺酰胺(2.0g,7.68mmol)溶于MeOH(100mL)并用Pt/C筒(cartridge)在H-立方体(cube)装置中氢化(满H2模式,40℃,1mL/min,运行2次)。减压浓缩溶剂得到标题化合物(1.8g,100%),为淡黄色油。使用时未经任何进一步纯化。LCMS(方法A):3.87min[MH]+=231.2。
步骤3:N-(4-((2-(3-(N-(2-甲氧基乙基)氨基磺酰基)苯基胺基)嘧啶-4-基)(甲基)胺基)苯基)乙酰胺。
将N-(4-((2-氯嘧啶-4-基)(甲基)胺基)苯基)乙酰胺(化合物5的制备的步骤3的产物,100mg,0.361mmol)和3-氨基-N-(2-甲氧基乙基)苯磺酰胺(来自上述步骤2,166mg,0.723mmol)溶于i-PrOH(5mL),滴加浓缩HCl(5滴)至该搅拌的溶液中。反应混合物80℃搅拌3小时,然后冷至室温。过滤收集灰白色沉淀,并用EtOAc洗涤以及真空干燥得到标题化合物(90mg,53%),为黄色固体。LCMS(方法A):4.25min[MH]+=471.8
步骤4:3-(4-((4-氨基苯基)(甲基)胺基)嘧啶-2-基胺基)-N-(2-甲氧基乙基)苯磺酰胺。
将N-(4-((2-(3-(N-(2-甲氧基乙基)氨基磺酰基)苯基胺基)嘧啶-4-基)(甲基)胺基)苯基)乙酰胺(来自上述的步骤3,30mg,0.064mmol)溶于MeOH(1mL)。滴加乙酰氯(0.45mL,0.64mmol),反应混合物室温搅拌16小时并真空浓缩得到标题化合物(25mg,89%),为白色固体。LCMS(方法A):3.88min[MH]+=429.4。
步骤5:N-(2-甲氧基乙基)-3-(4-(甲基(4-(3-(4-(三氟甲氧基)苯基)-脲基)苯基)胺基)嘧啶-2-基胺基)苯磺酰胺。
按照通用方法A采用3-(4-((4-氨基苯基)(甲基)胺基)嘧啶-2-基胺基)-N-(2-甲氧基乙基)苯磺酰胺得到标题化合物,为淡黄色固体(4mg,10%)。1H NMR(600MHz,MeOD-d4):δppm 3.05(t,J=8.0Hz,2H),3.24(s,3H),3.37(t,J=8.0Hz,2H),3.50(s,3H),5.86(m,1H),7.20(d,J=9.0Hz,1H),7.23(d,J=8.4Hz,1H),7.42(d,J=9.0Hz,2H),7.53(d,J=9.0Hz,2H),7.56(d,J=8.4Hz,2H),7.70(m,1H),7.78(m,1H),8.56(br s,1H)。LCMS(方法A):4.75min[MH]+=632.5。
化合物24
步骤1:N-环丙基-4-硝基苯胺
向4-氟-1-硝基苯(5.0g,35.4mmol)的DMSO(15mL)溶液中加入环丙胺(4.0g,70.9mmol)和碳酸钾(9.8g,70.9mmol)。于70℃搅拌反应混合物16小时。冷却混合物并将其倒入水中。过滤固体并干燥得到N-环丙基-4-硝基苯胺(6.1g,97%),为黄色固体。LCMS(方法B):2.42[MH]+=179.1。
步骤2:2-氯-N-环丙基-N-(4-硝基苯基)嘧啶-4-胺
在90℃搅拌2-氯-N-环丙基-N-(4-硝基苯基)嘧啶-4-胺(500mg,2.81mmol)、2,4-二氯嘧啶(836mg,5.61mmol)、碳酸铯(1.82g,5.61mmol)在DMSO(10mL)中的混合物16小时。反应混合物在乙酸乙酯和水之间分层。水相用乙酸乙酯萃取。合并的有机相用盐水洗涤,硫酸钠干燥,浓缩并用柱层析纯化(石油醚/乙酸乙酯,4:1)得到2-氯-N-环丙基-N-(4-硝基苯基)嘧啶-4-胺(500mg,61%),为黄色固体。LCMS(方法B):2.57[MH]+=291.1。
步骤3:N-1-(2-氯嘧啶-4-基)-N1-环丙基苯-1,4-二胺
向2-氯-N-环丙基-N-(4-硝基苯基)嘧啶-4-胺(500mg,1.72mmol)在甲醇(15mL)的混合物中加入锌粉(1.12g,17.2mmol)和NH4Cl溶液(10mL)。于60℃搅拌反应混合物3小时。除去甲醇,且混合物在乙酸乙酯和1M氢氧化钠溶液之间分层。过滤固体。有机相用盐水洗涤并干燥。除去溶剂得到N-1-(2-氯嘧啶-4-基)-N1-环丙基苯-1,4-二胺(440mg,98%),为淡黄色固体。LCMS(方法B):1.06[MH]+=261.1。
步骤4:1-(4-((2-氯嘧啶-4-基)(环丙基)胺基)苯基)-3-(4-(三氟甲氧基)苯基)脲
按照通用方法A采用N-1-(2-氯嘧啶-4-基)-N1-环丙基-苯-1,4-二胺(440mg,1.69mmol)和1-异氰酸基-4-(三氟甲氧基)苯(384mg,1.69mmol),得到4-1-(4-((2-氯嘧啶-4-基)(环丙基)胺基)苯基)-3-(4-(三氟甲氧基)-苯基)脲(500mg,61%)。LCMS(方法B):3.09[MH]+=464.1。
步骤5:3-((4-(环丙基(4-(3-(4-(三氟甲氧基)苯基)脲基)-苯基)胺基)-嘧啶-2-基)胺基)苯磺酰胺。
按照通用方法C采用1-(4-((2-氯嘧啶-4-基)(环丙基)胺基)苯基)-3-(4-(三氟甲氧基)苯基)脲(93mg,0.20mmol)和3-氨基苯基磺酰胺(35mg,0.20mmol),经制备型TLC(DCM/MeOH,10:1)纯化后,得到3-((4-(环丙基(4-(3-(4-(三氟-甲氧基)苯基)脲基)苯基)胺基)嘧啶-2-基)胺基)苯磺酰胺(40mg,33%),为黄色固体。1H NMR(400MHz,DMSO-d6):δppm 0.56(m,2H),0.97(m,2H),3.22(m,1H),6.17(br s,1H),7.18(d,J=8.4Hz,2H),7.32(m,6H),7.61(m,4H),7.91(d,J=8.0Hz,1H),8.02(d,J=6.0Hz,1H),8.17(s,1H),8.99(s,1H),9.07(s,1H),9.59(s,1H)。LCMS(方法B):2.52min[MH]+=600.2,[MNa]+=622.2。
化合物25
1-(4-(甲基(2-((3-(甲基磺酰基)苯基)胺基)嘧啶-4-基)胺基)苯基)-3-(4-(三氟甲氧基)苯基)脲
按照通用方法C采用中间体C(100mg,0.23mmol)和3-甲基磺酰基苯胺(47mg,0.23mmol),经柱层析(DCM/MeOH,100:1至60:1)纯化后,得到1-(4-(甲基(2-((3-(甲基磺酰基)苯基)胺基)嘧啶-4-基)胺基)苯基)-3-(4-(三氟甲氧基)苯基)脲(80mg,61%),为白色固体。1H NMR(400MHz,DMSO-d6):δppm 3.17(s,3H),3.45(s,3H),5.82(d,J=6Hz,1H),7.32(m,4H),7.52(m,2H),7.60(m,4H),7.91(m,2H),8.70(s,1H),8.94(s,1H),8.98(s,1H),9.67(s,1H)。LCMS(方法B):2.57min[MH]+=573.2,[MNa]+=595.2。
化合物26
步骤1:N-乙基-4-硝基苯胺
在底烧瓶中,将1-氟-4-硝基苯(3g,21.3mmol)、EtNH2.HCl(3.46g,42.5mmol)、K2CO3(6.46g,46.3mmol)溶于DMSO(20mL)。反应混合物85℃搅拌过夜。将反应混合物倒入水(200mL)和混合物搅拌0.5小时。过滤收集固体,并干燥得到N-乙基-4-硝基苯胺(2.9g,82%),为黄色固体。LCMS(酸性,5min):2.25[M+H]+=167.1。
步骤2:2-氯-N-乙基-N-(4-硝基苯基)嘧啶-4-胺
将N-乙基-4-硝基苯胺(1g,6.02mmol)、2,4-二氯嘧啶(896mg,6.02mmol)和Cs2CO3(3.9g,12.04mmol)溶于DMSO(15mL)。于85℃加热反应混合物过夜。将反应混合物倒入水(70mL)中,所得混合物用EtOAc萃取三次。合并的有机层用水洗涤三次并用Na2SO4干燥。除去溶剂得到2-氯-N-乙基-N-(4-硝基苯基)嘧啶-4-胺(1g,60%),为黄色固体,其直接用于下一步。LCMS(酸性,5min):2.60[M+H]+=279.0。
步骤3:N1-(2-氯嘧啶-4-基)-N1-乙基苯-1,4-二胺
将2-氯-N-乙基-N-(4-硝基苯基)嘧啶-4-胺(1g,3.59mmol)溶于甲醇(15mL)和饱和NH4Cl溶液(15mL)。加入锌(粉末,2.13g,35.9mmol)。反应混合物室温搅拌过夜。减压除去有机层。混合物用EtOAc(50mL)萃取三次,合并的有机层用水性NaCl(30mL)洗涤并用Na2SO4干燥。减压除去溶剂,粗品残留物用柱层析(DCM/甲醇,100至100:1)纯化得到N1-(2-氯嘧啶-4-基)-N1-乙基苯-1,4-二胺(200mg,23%),为黄色固体。LCMS(酸性,5min):2.08[M+H]+=249.0。
步骤4:1-(4-((2-氯嘧啶-4-基)(乙基)胺基)苯基)-3-(4-(三氟-甲氧基)苯基)脲
按照通用方法A采用N1-(2-氯嘧啶-4-基)-N1-乙基苯-1,4-二胺和4-三氟苯基-异氰酸酯得到1-(4-((2-氯嘧啶-4-基)(乙基)胺基)苯基)-3-(4-(三氟甲氧基)-苯基)脲。LCMS(酸性,5min):3.23min[MH]+=452.1
步骤5:3-((4-(乙基(4-(3-(4-(三氟甲氧基)苯基)脲基)苯基)-胺基)嘧啶-2-基)胺基)苯磺酰胺。
按照通用方法C采用1-(4-((2-氯嘧啶-4-基)(乙基)胺基)苯基)-3-(4-(三氟甲氧基)苯基)脲(220mg,0.487mmol)和3-氨基苯磺酰胺(84mg,0.487mmol),经柱层析(DCM/MeOH,100:0至97.5/2.5)纯化后,得到3-((4-(乙基(4-(3-(4-(三氟甲氧基)苯基)脲基)苯基)胺基)嘧啶-2-基)胺基)苯磺酰胺(68mg,24%),为白色固体。1H NMR(400MHz,DMSO-d6):δppm 1.19(t,J=7.2Hz,3H),4.00(t,J=7.2Hz,2H),5.65(d,J=6.0Hz,1H),7.43(m,8H),7.60(m,4H),7.86(m,2H),8.51(s,1H),8.91(s,1H),8.95(s,1H),9.50(s,1H)。LCMS(酸性,5min):2.50min[MH]+=588.2。
化合物27
步骤1:甲基(3-硝基苄基)硫烷
将3-硝基苄溴(3.72g,17.2mmol)的乙醇(50mL)溶液冷至0℃。加入甲硫醇钠(1.45g,20.7mmol),反应混合物室温搅拌3小时。减压浓缩反应混合物并在水和乙酸乙酯之间分层。分离有机层并用硫酸钠干燥得到甲基(3-硝基苄基)硫烷(被约26%的1-(乙氧基甲基)-3-硝基苯污染,3.22g,26%),为黄色油。LCMS(方法B):2.48min[MNa]+=206.0。
步骤2:1-((甲基磺酰基)甲基)-3-硝基苯
将甲基(3-硝基苄基)硫烷(70%,3.22g,5.27mmol的纯化合物)溶于DMF(50mL)。加入过硫酸氢钾(Oxone)(9.72g,15.8mmol),反应室温搅拌3天。所得混合物倒入水中,然后加入乙酸乙酯。分离有机层并用水和盐水洗涤,用硫酸钠干燥并浓缩得到残留物,其用柱层析(石油醚/乙酸乙酯,5:1至1:1)纯化得到1-((甲基磺酰基)甲基)-3-硝基苯(940mg,29%),为白色固体。LCMS(方法B):0.51min[MNa]+=238.0。
步骤3:3-((甲基磺酰基)甲基)苯胺
将1-((甲基磺酰基)甲基)-3-硝基苯(50mg,0.23mmol)溶于乙酸乙酯(3mL)并加入Pd/C(10%,7mg)。氢气下室温搅拌反应混合物过夜。滤去Pd/C,浓缩滤液得到3-((甲基磺酰基)甲基)苯胺(46mg,定量),为灰色固体,直接用于下一步。LCMS(方法B):0.26min[MH]+=186.1。
步骤4:1-(4-(甲基(2-((3-((甲基磺酰基)甲基)苯基)胺基)嘧啶-4-基)胺基)苯基)-3-(4-(三氟甲氧基)苯基)脲
按照通用方法C采用中间体C(108.7mg,0.248mmol)和(甲基磺酰基)甲基)苯胺(46mg,0.248mmol),经柱层析(DCM/MeOH,20:1)纯化后,得到1-(4-(甲基(2-((3-((甲基磺酰基)甲基)苯基)胺基)嘧啶-4-基)胺基)苯基)-3-(4-(三氟-甲氧基)苯基)脲(57.7mg,40%),为白色固体。1H NMR(400MHz,DMSO-d6):δppm 2.92(s,3H),3.42(s,3H),4.38(s,2H),5.81(d,J=6Hz,1H),6.96(d,J=8.0Hz,1H),7.31(m,5H),7.59(m,4H),7.62(d,J=8Hz,1H),7.89(m,2H),8.89(s,1H),8.95(s,1H),9.29(m,1H)。LCMS(方法B):2.55min[MH]+=587.2。
表达构建物
通过沉默取代(DNA2.0,CA),合成编码小鼠(残基1-464)或人(残基1-471)MLKL的cDNA,以便消除几个限制性位点。将编码MLKL的cDNA连入多西环素可诱导的嘌呤霉素选择性的载体pF TRE3G PGK puro中,如Moujalled DM等人,(2014),Cell Death Dis 5:e1086;Moujalled DM等人,(2013)Cell Death Dis 4:e465;和Murphy JM等人,(2013),Immunity 39(3):443-453中所述。通过Sanger测序(Micromon DNA测序中心,VIC,澳大利亚,或通过DNA2.0),对序列进行验证。
通过用1.2μg载体DNA和两种辅助质粒(0.8μg pVSVg和2μg pCMVΔR8.2)一起转染接种在10cm培养皿中的HEK293T细胞,以产生慢病毒颗粒,如Vince JE等人,(2007),Cell 131(4):682-693中所述。使用病毒上清液感染靶细胞,其中被转染细胞在5μg/mL嘌呤霉素中进行选择和维持。
试剂和抗体
在实验室生产重组hTNF-Fc,如Bossen C等人,(2006),生物化学杂志(The Journal of biological chemistry)281(20):13964-13971。嘌呤霉素、多西环素和坏死抑素-1(Necrostatin-1)购自西格玛-奥德里奇公司(Sigma-Aldrich)。Smac模拟物,即化合物A,先前已经在Vince JE等人,(2007),Cell 131(4):682-693中描述。Q-VD-OPh-OPH购自安迪生物公司(R&D systems)。单克隆的大鼠抗小鼠MLKL抗体(克隆3H1)由沃尔特和伊莱扎学院的单克隆中心(Walter and Eliza Hall Institute Monoclonal Facility)在实验室制备(现在可从密理博公司(Millipore)获得,目录号MABC604)。抗β-肌动蛋白抗体购自西格玛-奥德里奇;抗VDAC1抗体(AB10527)购自密理博公司(Millipore);抗GAPDH抗体来自细胞信号技术公司(Cell Signaling Technologies);抗FLAG抗体(M2)来自西格玛。将一抗用于对携带转移蛋白的膜进行蛋白质印迹分析,并使用购自GE Healthcare和Jackson Immunoresearch的HRP-偶联的二抗和ECL检测方法(密理博公司)进行检测。
细胞系和细胞死亡测试
从三种Mlk1-/-小鼠和三种同类(congenic)野生型小鼠中分离小鼠真皮成纤维细胞(MDF),然后通过SV40大T抗原进行永生化,从而产生三种生物学上独立的细胞系,如Murphy JM等人,(2013),Immunity,39(3):443-453中所述。从三个Ripk3-/-小鼠和同类野生型小鼠类似地制备永生化MDF。将MDF和HEK293T保持在补充有8-10%v/v胎牛血清(FCS)和5μg/mL嘌呤霉素的Dulbecco改良的Eagle培养基(DMEM)中,以便细胞系用MLKL的诱导型表达构建物进行稳定转导。U937细胞在补充有8%v/v FCS的RPMI1640中培养。在24孔板中进行细胞死亡测试,每孔接种1×105个细胞。然后在10ng/mL或20ng/mL多西环素存在下在4小时内贴壁的细胞,用坏死抑素(50μM)和Q-VD-OPh(5μM)的各种组合进行处理,30分钟后加入TNF(100ng/mL)和Smac模拟物(500nM)。在MDF细胞处理24小时或U937细胞处理48小时后,收获细胞,并使用BD FACSCalibur流式细胞仪定量PI阳性细胞(1μg/mL)。
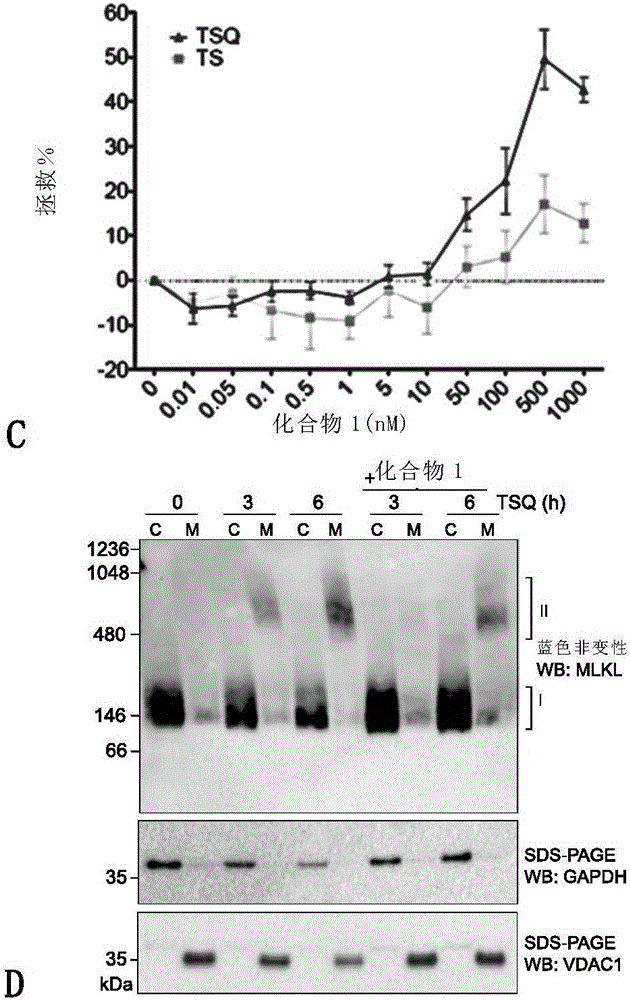
图1(C)证明化合物1从TSQ-诱导的坏死性凋亡中拯救了约50%的wtMDF,其中IC50为约500nM。
图3(C)证明化合物1从TSQ-诱导的坏死性凋亡中拯救了约50%的wt U937细胞,其中IC50为50-100nM。
测试化合物1-4从TSQ-诱导的坏死性凋亡中拯救wt U937细胞的能力,在表1中示出。
图2(B)证明,化合物1在浓度≥5μM时的毒性会诱导野生型MDF的死亡。显示了三次重复实验的平均值±SEM。
图3(D)显示了化合物1经基因编辑从而删除MLKL的U937细胞中的毒性。在不存在MLKL时,经TSQ刺激的细胞与未刺激的细胞表现相当。TS处理说明细胞保留了发生凋亡死亡的能力,并且这不受化合物1处理的影响。数据显示为2次独立实验的平均值±SD。图4(A)表明,索拉非尼(一种具有与化合物1类似的蛋白激酶靶标谱的蛋白激酶抑制剂)在野生型MDF中不抑制TSQ-诱导的坏死性凋亡。显示了三次重复实验的平均值±SEM。
图4(B)证明索拉非尼(一种具有与化合物1类似的蛋白激酶靶标谱的蛋白激酶抑制剂)在野生型U937细胞中不抑制TSQ-诱导的坏死性凋亡。显示了重复实验的平均值±SEM。
统计分析
误差条代表指定数目的独立和/或生物学重复(不是技术重复)的平均值±SD或SEM(在图例中指定)。
组分分离和蓝色非变性PAGE
将MDF接种在6孔板中(每孔5×105个细胞),并贴壁过夜。在1μM测试化合物或DMSO对照的存在下,用TSQ刺激细胞达6小时。通过刮擦收获细胞,在PBS中洗涤一次,并在含有0.025%洋地黄皂苷(BIOSYNTH,Staad,瑞士)且补充有无EDTA的完全蛋白酶抑制剂混合物(Roche)、2μM N-乙基马来酰亚胺和磷酸酶抑制剂(5mMβ-甘油磷酸盐、1mM钼酸钠、1mM焦磷酸钠和100μM氟化钠)的缓冲液(20mM Hepes(pH 7.5),100mM KCl,2.5mM MgCl2和100mM蔗糖)中进行渗透化处理。通过台盼蓝吸收证实渗透化作用,并通过在11,000×g离心5分钟分离胞质和粗膜组分。将洋地黄皂苷加入细胞质部分至终浓度为1%,将粗膜组分进一步溶解于渗透化缓冲液(添加1%洋地黄皂苷)中,并在冰上孵育20分钟。将粗膜悬浮液以11,000×g离心5分钟,将上清液与细胞质部分一起上样于4-16%Bis-Tris非变性PAGE凝胶(LifeTechnologies)上。在将蛋白转移到PVDF后,对PVDF进行脱色,并通过将PVDF膜在室温下浸泡在6M盐酸胍、10mM Tris-HCl pH 7.5和5mM 2-巯基乙醇中2小时,来显示MLKL表位。通过如上所述的抗-MLKL抗体(3H1)的蛋白质印迹法,检测含有MLKL的复合物。
图1(D)证明,在蓝色非变性PAGE的抗-MLKL印迹分析中,化合物1阻滞易位至膜组分。通过对于GADPH和VDAC1的对照印迹,来说明细胞质和膜组分的纯度和蛋白质丰度。
重组蛋白表达和纯化
具有由pFastBac HTb载体编码的常规N-末端His6标签或在pFastBac1载体中引入经修饰的2xHis6标签(MSHHHHHHGSAGSAKKKGSAGSAHHHHHHGSA)的重组小鼠(残基179-464)和人(190-471)MLKL假激酶结构域,根据Murphy JM等人,(2013),Immunity 39(3):443-453和Murphy JM等人,(2014),The Biochemical journal 457(2):323-334中建立的程序,在Sf21昆虫细胞中进行表达并加以纯化。简言之,通过Ni2+-亲和层析(罗氏His标签树脂),从Sf21裂解物中纯化这些蛋白质。然后在广泛透析之前,通过在25℃下与TEV蛋白酶温育1小时以切割掉常规的His6标签;进一步进行Ni2+-层析以消除未消化的蛋白质和TEV蛋白酶,随后进行Superdex-200凝胶过滤层析(GE Healthcare)。蛋白质在200mM NaCl、20mM HEPES pH 7.5(用于热稳定性位移测试)或100mM NaCl、20mM HEPES pH 7.5(用于NMR研究)中洗脱。未切割的带2xHis6标记的假激酶Ni2+-洗脱液,通过离心超滤进行浓缩并进行Superdex-200凝胶过滤层析(GE Healthcare),其中用200mM NaCl、20mM Tris pH8、10%甘油、0.5mM TCEP进行洗脱,然后用于表面等离子共振实验。如先前在Murphy JM等人(2013),Immunity 39(3):443-453和Cook WD等人,(2014)Cell Death Diff(出版中)中所述,在Sf21细胞中表达和纯化重组mRIPK3激酶结构域。
使用如Hercus TR等人,(2013),PloS one 8(8):e74376和Murphy JM等人,(2010),Growth factors 28(2):104-110所述的已建立的策略,从大肠杆菌(BL21Codon Plus)制备重组小鼠MLKL(1-169)。简言之,将编码mMLKL(1-169)的cDNA,按读框连入卡那霉素选择性载体pETNusH HTb,以便能够表达具有N端的TEV蛋白酶可切割的NusA-His6标签的融合蛋白。将细菌在含有50μg/mL卡那霉素的超级肉汤培养基(Super Broth)中在37℃下培养直至达到OD595为约0.6-0.8,然后将温度降至18℃,20分钟后通过加入1mM IPTG诱导表达。将细胞在18℃下再培养16小时,通过离心收获细胞,重悬于补充有1mM PMSF的0.2M NaCl、5mM咪唑、20mM HEPES pH7.5、5mM 2-巯基乙醇中,通过超声裂解并通过离心去除碎片。通过注射器驱动的0.45μM过滤,澄清上清液,并通过蠕动泵将其加到NiMAC柱(Novagen,Madison,WI)上。在用7-10倍柱体积的裂解缓冲液(裂解缓冲液含有35mM咪唑,pH7.5)洗涤后,NusA-His6-mMLKL(1-169)用0.2M NaCl,250mM咪唑,20mM HEPES pH7.5,5mM 2-巯基乙醇进行洗脱,并在20℃下用0.5mg TEV蛋白酶温育2小时以便将mMLKL(1-169)与融合标签切开。除了TEV蛋白酶切割步骤之外,所有其它纯化步骤均在4℃下进行。接着,在0.2M NaCl、20mM HEPES pH 7.5中彻底透析裂解反应以除去咪唑,然后进行回收透析液,并重新上样于经重整的NiMAC盒,并用裂解缓冲液进行洗涤。将流出物通过离心超滤进行浓缩,并上样于Superdex-200、24mL凝胶过滤柱(GE Healthcare),并在100mM KCl、10mM Tris-HCl pH 8.0中洗脱,以用于AUC研究。
热位移测试法以筛选小分子相互作用物
在150mM NaCl、20mM Tris pH 8.0、1mM DTT中稀释蛋白质至2.6μM,总反应体积为25μL后,如先前在Murphy JM等人(2013),Immunity 39(3):443-453、Murphy JM等人(2014),生物化学杂志(The Biochemical journal)457(2):323-334和Murphy JM,等人(2014),生物化学杂志(The Biochemical journal)457(3):369-377中所述,使用Corbett Real Time PCR仪进行热位移测试。使用SYPRO橙(Molecular Probes,CA),通过在530nm检测荧光来检测蛋白质热解折叠。加入0.2mM的ATP并用作配体结合的阳性对照。以40μM的最终浓度加入测试化合物。正ΔTm值表示配体结合于蛋白质并赋予免于变性的保护。所示数据代表三个独立实验。
图1(A)显示化合物1的热位移测试,它证实了化合物1是MLKL的相互作用物。
表面等离子体共振(SPR)结合实验
通过在Biacore T200仪器(GE Healthcare)上的SPR,测定化合物1结合于小鼠MLKL假激酶结构域的动力学。根据制造商的说明,将带有双His标签的MLKL和不相关的阴性对照参照蛋白固定在负载Ni2+的NTA捕获芯片上。在一些情况下,通过Ni2+/NTA螯合,在含有预先固定有次氮基三乙酸(NTA)的羧甲基化葡聚糖表面的系列S传感器芯片上捕获双His-标记的蛋白质。然后将表面活化并用NHS/EDC混合物进行增强,然后His捕获的蛋白质以琥珀酰胺酯形式共价偶联到表面的。稍后注入乙醇胺以封闭任何未反应的酯。未结合的Ni2+和非共价结合的蛋白通过注射EDTA进行洗脱。
典型的固定水平为2000-3000响应单位(RU)。将流动池1留空作为参考表面。在25℃下,在含有20mM HEPES(pH 8.0)、200mM NaCl和0.005%(v/v)表面活性剂P20的运行缓冲液中进行固定实验。
在运行缓冲液(添加2%v/v DMSO)中进行结合实验。化合物1的6个浓度范围为3.125μM至200μM(溶于添加了2%v/v DMSO的运行缓冲液中),以100μL/min的流速流过固定的蛋白质,结合阶段为30s,解离阶段为90s。用Biacore T200评估软件,对数据进行简化、进行溶剂校正以及并进行双重参考。将数据整体拟合至两状态动力学相互作用模型,并由(kd/ka)比确定Kd。从稳态结合曲线和最大观察响应单位(RU)水平推断出1:1结合化学计量。
图1(B)证明化合物1以9.3μM的Kd值结合于小鼠MLKL(179-464)假激酶结构域。
图3(B)证明化合物1以4.4μM的Kd值结合人MLKL(190-471)假激酶结构域。
也通过SPR测定化合物2-4以确定结合亲和力。化合物2-4的结合亲和力示于表1中。
饱和度转移差(STD)NMR光谱
在STD实验的每个样品中,核苷酸溶于NMR缓冲液(20mM HEPES,pH 7.5、200mM NaCl、90%D2O、10%H2O),终浓度为200μM。对于每种核苷酸制备三种不同的样品:(1)ATP或ADP,加入与含蛋白质样品的等体积的蛋白质缓冲液;(2)ATP或ADP,添加MLKL假性激酶结构域,终浓度为2μM;(3)ATP或ADP,添加MLKL假激酶结构域(2μM)与测试化合物(200μM)。在装配有CryoprobeTM的Bruker AVANCE Ultrashield 600MHz光谱仪上,在283K下记录NMR光谱。1H化学位移参照4.70ppm的1H2O信号。蛋白质共振的饱和性通过以-0.5ppm为中心的4s系列的高斯脉冲实现。对于参考光谱,在中心为20,000Hz偏共振的频率处应用类似的饱和脉冲。在采集之前,使用15ms T2-自旋锁定时间段,以允许残留的蛋白质信号衰减。NMR数据在3.2版本TOPSPIN(Bruker BioSpin)中处理。
图2(A)显示化合物1的STD NMR测试。STD NMR光谱显示了与小鼠MLKL结合的核苷酸。数据显示,化合物1可以与(i)ATP和(ii)ADP竞争结合于小鼠MLKL假激酶结构域。偏离共振光谱的低场区域显示,在不存在蛋白质时检测到200μM ATP(i)或ADP(ii)的峰。在2μM小鼠MLKL(179-464)存在时,在ATP(i)或ADP(ii)上进行的STD-NMR实验中观察到用星号标记的峰,这确认了核苷酸结合。在200μM化合物1存在下,这些峰减少,这证实在化合物1的存在下ATP和ADP被从小鼠MLKL(179-464)中置换掉。
图3(A)显示化合物1的STD NMR测定。STD NMR光谱显示了核苷酸与人MLKL的结合。数据显示,化合物1可以与(i)ATP和(ii)ADP竞争结合于人MLKL假激酶结构域。偏离共振光谱的低场区域显示,在不存在蛋白质时检测到200μM ATP(i)或ADP(ii)的峰。在2μM人MLKL(190-471)存在时,在ATP(i)或ADP(ii)上进行的STD-NMR实验中观察到用星号标记的峰,这确认了核苷酸结合。在200μM化合物1存在下,这些峰减少,这证实在化合物1的存在下ATP和ADP被从人MLKL(190-471)中置换掉。
体外激酶测试
如先前在Murphy JM等人,(2013),Immunity 39(3):443-453和Cook WD等人,(2014)Cell Death Diff(出版中)所述,进行体外激酶测试,不同点在于:加入DMSO对照或在0.5%v/v的最终DMSO中加入高达12.5μM的试验化合物。
图2(C)证明,相对于DMSO对照(“0”泳道),化合物1对重组RIPK3激酶活性没有影响。≥10μM的化合物1浓度,可重复地导致小鼠MLKL(179-464)的磷酸化增加。所示的实验表示了三次独立测定。左图,干燥的考马斯染色的4-12%Bis-Tris凝胶;右图,相同凝胶的放射自显影。
1.2测试结果
如上所述测试本发明描述的化合物。测试结果列于下表中。
表1:该表显示了通过SPR测定的测试化合物的结合亲和力和测试化合物从TSQ诱导的坏死性凋亡中拯救U937细胞的能力
化合物3(衍生自化合物1的类似物)与MLKL蛋白的ATP结合位点的结合,描述于图5(A)和(B)中。
使用体外激酶测试,检查化合物1结合于MLKL假激酶结构域对通过上游激活剂RIPK3的MLKL磷酸化的作用。测定表明,重组RIPK3的催化活性和RIPK3介导的MLKL磷酸化都不被化合物1抑制。相反,在>5μM化合物1存在下,RIPK3-介导的MLKL磷酸化增强。图2(D)证明,相对于DMSO对照(“0”泳道),化合物1对重组RIPK3激酶活性没有影响。≥10μM的化合物1浓度,可重复地导致MLKL(179-464)磷酸化增加。所示的实验表示了三次独立测定。左图,干燥的考马斯染色的4-12%Bis-Tris凝胶;右图,相同凝胶的放射自显影。
筛选用于抑制TSQ诱导的坏死性凋亡的化合物,96孔板格式。
细胞系ID:U937人组织细胞白血病细胞系。
细胞浓度(细胞/孔):在120μL培养基中每孔35,000个,在加入抑制剂和死亡刺激物之前,立即计数并铺板。加入化合物和死亡刺激物后,最终孔体积150μL。
细胞生长培养基:补充有7.4%v/v FCS(Gibco,Precision Plus,货号#1221437)的HTRPMI(WEHI培养基,含有L-谷氨酰胺和青霉素、链霉素)
孵育时间(小时):加入化合物和死亡刺激物后,孵育48小时
DMSO终浓度(%v/v):0.2%
化合物浓度-log效价:
10000nM、5000nM、1000nM、500nM、100nM、50nM、10nM、5nM、1nM、0.5nM、0.1nM;
死亡刺激混合物中的化合物及其最终浓度:
hTNF-Fc(100ng/mL)-由Silke lab,WEHI生产
化合物A(500nM)-Simac模拟物,Tetrelogic公司
Q-VD-OPh(10μM)-MP Biomedicals
分析:
细胞用PI染色(1μg/ml)处理并通过流式细胞术分析
结果解读:
涉及TSQ混合物的测试(T:TNF;S:Smac模拟物;Q:Q-VD-OPh):TSQ处理确保细胞特异性地发生坏死性细胞死亡。TNF激活TNF受体,Smac模拟物将信号导离促炎症信号传导并朝向RIP1/RIP3-介导的细胞死亡途径,而Q-VD-OPh确保凋亡反应被阻断,仅留下程序性坏死反应。在PI染色后,通过流式细胞术测量它们阻断细胞死亡的能力,来评价在该TSQ-诱导测试中测得的所述化合物(在DMSO中的溶液)的活性。
计数筛选:平行地,测试所有化合物影响细胞活力的能力。在无TSQ混合物情况下,用化合物在DMSO中溶液处理相同的U937细胞。此计数筛选可以评估脱靶效果。在这种情况下,也在PI染色后通过流式细胞术测量细胞活力。
上述化合物的筛选结果示于下表2中。
表2:该表显示了上述化合物和对比化合物的基于细胞的测试结合数据的结果
聚肌胞(Poly(I:C))实验
将转化的iBMDM分在24孔板(60.000细胞/孔)中,48小时后用不同浓度的化合物1处理。0.5小时后,加入聚肌胞(poly:IC)(50ug/mL)和zVAD(25uM)。48小时后收获细胞。通过碘化丙啶染色和流式细胞术分析细胞死亡。
图6的结果证明,化合物1抑制聚肌胞和zVAD诱导的坏死性凋亡。已知聚肌胞和zVAD诱导的细胞死亡独立于RIPK1发生,这表明化合物1通过靶向MLKL而抑制坏死性凋亡。
在整个说明书中,词语“包括”或其变体例如“包括(comprises)”或“包括(comprising)”将被理解为暗示包括所述元素、整数或步骤,或者所述元素、整数或步骤的组,但不排除任何其它元素、整数或步骤,或其它元素、整数或步骤的组。
本领域技术人员将理解,在不脱离本发明的广泛通用范围的情况下,可以对上述实施例进行多种变化和/或修改。因此,在所有方面,这些实施例都被认为是说明性的而不是限制性的。
序列表
<110> 催化剂治疗私人有限公司
<120> 抑制坏死性凋亡的方法
<130> 515172
<160> 4
<170> PatentIn version 3.5
<210> 1
<211> 471
<212> PRT
<213> 智人
<400> 1
Met Glu Asn Leu Lys His Ile Ile Thr Leu Gly Gln Val Ile His Lys
1 5 10 15
Arg Cys Glu Glu Met Lys Tyr Cys Lys Lys Gln Cys Arg Arg Leu Gly
20 25 30
His Arg Val Leu Gly Leu Ile Lys Pro Leu Glu Met Leu Gln Asp Gln
35 40 45
Gly Lys Arg Ser Val Pro Ser Glu Lys Leu Thr Thr Ala Met Asn Arg
50 55 60
Phe Lys Ala Ala Leu Glu Glu Ala Asn Gly Glu Ile Glu Lys Phe Ser
65 70 75 80
Asn Arg Ser Asn Ile Cys Arg Phe Leu Thr Ala Ser Gln Asp Lys Ile
85 90 95
Leu Phe Lys Asp Val Asn Arg Lys Leu Ser Asp Val Trp Lys Glu Leu
100 105 110
Ser Leu Leu Leu Gln Val Glu Gln Arg Met Pro Val Ser Pro Ile Ser
115 120 125
Gln Gly Ala Ser Trp Ala Gln Glu Asp Gln Gln Asp Ala Asp Glu Asp
130 135 140
Arg Arg Ala Phe Gln Met Leu Arg Arg Asp Asn Glu Lys Ile Glu Ala
145 150 155 160
Ser Leu Arg Arg Leu Glu Ile Asn Met Lys Glu Ile Lys Glu Thr Leu
165 170 175
Arg Gln Tyr Leu Pro Pro Lys Cys Met Gln Glu Ile Pro Gln Glu Gln
180 185 190
Ile Lys Glu Ile Lys Lys Glu Gln Leu Ser Gly Ser Pro Trp Ile Leu
195 200 205
Leu Arg Glu Asn Glu Val Ser Thr Leu Tyr Lys Gly Glu Tyr His Arg
210 215 220
Ala Pro Val Ala Ile Lys Val Phe Lys Lys Leu Gln Ala Gly Ser Ile
225 230 235 240
Ala Ile Val Arg Gln Thr Phe Asn Lys Glu Ile Lys Thr Met Lys Lys
245 250 255
Phe Glu Ser Pro Asn Ile Leu Arg Ile Phe Gly Ile Cys Ile Asp Glu
260 265 270
Thr Val Thr Pro Pro Gln Phe Ser Ile Val Met Glu Tyr Cys Glu Leu
275 280 285
Gly Thr Leu Arg Glu Leu Leu Asp Arg Glu Lys Asp Leu Thr Leu Gly
290 295 300
Lys Arg Met Val Leu Val Leu Gly Ala Ala Arg Gly Leu Tyr Arg Leu
305 310 315 320
His His Ser Glu Ala Pro Glu Leu His Gly Lys Ile Arg Ser Ser Asn
325 330 335
Phe Leu Val Thr Gln Gly Tyr Gln Val Lys Leu Ala Gly Phe Glu Leu
340 345 350
Arg Lys Thr Gln Thr Ser Met Ser Leu Gly Thr Thr Arg Glu Lys Thr
355 360 365
Asp Arg Val Lys Ser Thr Ala Tyr Leu Ser Pro Gln Glu Leu Glu Asp
370 375 380
Val Phe Tyr Gln Tyr Asp Val Lys Ser Glu Ile Tyr Ser Phe Gly Ile
385 390 395 400
Val Leu Trp Glu Ile Ala Thr Gly Asp Ile Pro Phe Gln Gly Cys Asn
405 410 415
Ser Glu Lys Ile Arg Lys Leu Val Ala Val Lys Arg Gln Gln Glu Pro
420 425 430
Leu Gly Glu Asp Cys Pro Ser Glu Leu Arg Glu Ile Ile Asp Glu Cys
435 440 445
Arg Ala His Asp Pro Ser Val Arg Pro Ser Val Asp Glu Ile Leu Lys
450 455 460
Lys Leu Ser Thr Phe Ser Lys
465 470
<210> 2
<211> 263
<212> PRT
<213> 智人
<400> 2
Met Glu Asn Leu Lys His Ile Ile Thr Leu Gly Gln Val Ile His Lys
1 5 10 15
Arg Cys Glu Glu Met Lys Tyr Cys Lys Lys Gln Cys Arg Arg Leu Gly
20 25 30
His Arg Val Leu Gly Leu Ile Lys Pro Leu Glu Met Leu Gln Asp Gln
35 40 45
Gly Lys Arg Ser Val Pro Ser Glu Lys Leu Thr Thr Ala Met Asn Arg
50 55 60
Phe Lys Ala Ala Leu Glu Glu Ala Asn Gly Glu Ile Glu Lys Phe Ser
65 70 75 80
Asn Arg Ser Asn Ile Cys Arg Phe Leu Thr Ala Ser Gln Asp Lys Ile
85 90 95
Leu Phe Lys Asp Val Asn Arg Lys Leu Ser Asp Val Trp Lys Glu Leu
100 105 110
Ser Leu Leu Leu Gln Val Glu Gln Arg Met Pro Val Ser Pro Ile Ser
115 120 125
Gln Gly Ala Ser Trp Ala Gln Glu Asp Gln Gln Asp Ala Asp Glu Asp
130 135 140
Arg Arg Ala Phe Gln Met Leu Arg Arg Asp Asn Glu Lys Ile Glu Ala
145 150 155 160
Ser Leu Arg Arg Leu Glu Ile Asn Met Lys Glu Ile Lys Glu Thr Leu
165 170 175
Arg Gln Ser Leu Glu Ser Ser Ser Gly Lys Ser Pro Leu Glu Ile Ser
180 185 190
Arg Phe Lys Val Lys Asn Val Lys Thr Gly Ser Ala Ser Gly Cys Asn
195 200 205
Ser Glu Lys Ile Arg Lys Leu Val Ala Val Lys Arg Gln Gln Glu Pro
210 215 220
Leu Gly Glu Asp Cys Pro Ser Glu Leu Arg Glu Ile Ile Asp Glu Cys
225 230 235 240
Arg Ala His Asp Pro Ser Val Arg Pro Ser Val Asp Glu Ile Leu Lys
245 250 255
Lys Leu Ser Thr Phe Ser Lys
260
<210> 3
<211> 472
<212> PRT
<213> 小鼠
<400> 3
Met Asp Lys Leu Gly Gln Ile Ile Lys Leu Gly Gln Leu Ile Tyr Glu
1 5 10 15
Gln Cys Glu Lys Met Lys Tyr Cys Arg Lys Gln Cys Gln Arg Leu Gly
20 25 30
Asn Arg Val His Gly Leu Leu Gln Pro Leu Gln Arg Leu Gln Ala Gln
35 40 45
Gly Lys Lys Asn Leu Pro Asp Asp Ile Thr Ala Ala Leu Gly Arg Phe
50 55 60
Asp Glu Val Leu Lys Glu Ala Asn Gln Gln Ile Glu Lys Phe Ser Lys
65 70 75 80
Lys Ser His Ile Trp Lys Phe Val Ser Val Gly Asn Asp Lys Ile Leu
85 90 95
Phe His Glu Val Asn Glu Lys Leu Arg Asp Val Trp Glu Glu Leu Leu
100 105 110
Leu Leu Leu Gln Val Tyr His Trp Asn Thr Val Ser Asp Val Ser Gln
115 120 125
Pro Ala Ser Trp Gln Gln Glu Asp Arg Gln Asp Ala Glu Glu Asp Gly
130 135 140
Asn Glu Asn Met Lys Val Ile Leu Met Gln Leu Gln Ile Ser Val Glu
145 150 155 160
Glu Ile Asn Lys Thr Leu Lys Gln Cys Ser Leu Lys Pro Thr Gln Glu
165 170 175
Ile Pro Gln Asp Leu Gln Ile Lys Glu Ile Pro Lys Glu His Leu Gly
180 185 190
Pro Pro Trp Thr Lys Leu Lys Thr Ser Lys Met Ser Thr Ile Tyr Arg
195 200 205
Gly Glu Tyr His Arg Ser Pro Val Thr Ile Lys Val Phe Asn Asn Pro
210 215 220
Gln Ala Glu Ser Val Gly Ile Val Arg Phe Thr Phe Asn Asp Glu Ile
225 230 235 240
Lys Thr Met Lys Lys Phe Asp Ser Pro Asn Ile Leu Arg Ile Phe Gly
245 250 255
Ile Cys Ile Asp Gln Thr Val Lys Pro Pro Glu Phe Ser Ile Val Met
260 265 270
Glu Tyr Cys Glu Leu Gly Thr Leu Arg Glu Leu Leu Asp Arg Glu Lys
275 280 285
Asp Leu Thr Met Ser Val Arg Ser Leu Leu Val Leu Arg Ala Ala Arg
290 295 300
Gly Leu Tyr Arg Leu His His Ser Glu Thr Leu His Arg Asn Ile Ser
305 310 315 320
Ser Ser Ser Phe Leu Val Ala Gly Gly Tyr Gln Val Lys Leu Ala Gly
325 330 335
Phe Glu Leu Ser Lys Thr Gln Asn Ser Ile Ser Arg Thr Ala Lys Ser
340 345 350
Thr Lys Ala Glu Arg Ser Ser Ser Thr Ile Tyr Val Ser Pro Glu Arg
355 360 365
Leu Lys Asn Pro Phe Cys Leu Tyr Asp Ile Lys Ala Glu Ile Tyr Ser
370 375 380
Phe Gly Ile Val Leu Trp Glu Ile Ala Thr Gly Lys Ile Pro Phe Glu
385 390 395 400
Gly Cys Asp Ser Lys Lys Ile Arg Glu Leu Val Ala Glu Asp Lys Lys
405 410 415
Gln Glu Pro Val Gly Gln Asp Cys Pro Glu Leu Leu Arg Glu Ile Ile
420 425 430
Asn Glu Cys Arg Ala His Glu Pro Ser Gln Arg Pro Ser Val Asp Gly
435 440 445
Arg Ser Leu Ser Gly Arg Glu Arg Ile Leu Glu Arg Leu Ser Ala Val
450 455 460
Glu Glu Ser Thr Asp Lys Lys Val
465 470
<210> 4
<211> 464
<212> PRT
<213> 小鼠
<400> 4
Met Asp Lys Leu Gly Gln Ile Ile Lys Leu Gly Gln Leu Ile Tyr Glu
1 5 10 15
Gln Cys Glu Lys Met Lys Tyr Cys Arg Lys Gln Cys Gln Arg Leu Gly
20 25 30
Asn Arg Val His Gly Leu Leu Gln Pro Leu Gln Arg Leu Gln Ala Gln
35 40 45
Gly Lys Lys Asn Leu Pro Asp Asp Ile Thr Ala Ala Leu Gly Arg Phe
50 55 60
Asp Glu Val Leu Lys Glu Ala Asn Gln Gln Ile Glu Lys Phe Ser Lys
65 70 75 80
Lys Ser His Ile Trp Lys Phe Val Ser Val Gly Asn Asp Lys Ile Leu
85 90 95
Phe His Glu Val Asn Glu Lys Leu Arg Asp Val Trp Glu Glu Leu Leu
100 105 110
Leu Leu Leu Gln Val Tyr His Trp Asn Thr Val Ser Asp Val Ser Gln
115 120 125
Pro Ala Ser Trp Gln Gln Glu Asp Arg Gln Asp Ala Glu Glu Asp Gly
130 135 140
Asn Glu Asn Met Lys Val Ile Leu Met Gln Leu Gln Ile Ser Val Glu
145 150 155 160
Glu Ile Asn Lys Thr Leu Lys Gln Cys Ser Leu Lys Pro Thr Gln Glu
165 170 175
Ile Pro Gln Asp Leu Gln Ile Lys Glu Ile Pro Lys Glu His Leu Gly
180 185 190
Pro Pro Trp Thr Lys Leu Lys Thr Ser Lys Met Ser Thr Ile Tyr Arg
195 200 205
Gly Glu Tyr His Arg Ser Pro Val Thr Ile Lys Val Phe Asn Asn Pro
210 215 220
Gln Ala Glu Ser Val Gly Ile Val Arg Phe Thr Phe Asn Asp Glu Ile
225 230 235 240
Lys Thr Met Lys Lys Phe Asp Ser Pro Asn Ile Leu Arg Ile Phe Gly
245 250 255
Ile Cys Ile Asp Gln Thr Val Lys Pro Pro Glu Phe Ser Ile Val Met
260 265 270
Glu Tyr Cys Glu Leu Gly Thr Leu Arg Glu Leu Leu Asp Arg Glu Lys
275 280 285
Asp Leu Thr Met Ser Val Arg Ser Leu Leu Val Leu Arg Ala Ala Arg
290 295 300
Gly Leu Tyr Arg Leu His His Ser Glu Thr Leu His Arg Asn Ile Ser
305 310 315 320
Ser Ser Ser Phe Leu Val Ala Gly Gly Tyr Gln Val Lys Leu Ala Gly
325 330 335
Phe Glu Leu Ser Lys Thr Gln Asn Ser Ile Ser Arg Thr Ala Lys Ser
340 345 350
Thr Lys Ala Glu Arg Ser Ser Ser Thr Ile Tyr Val Ser Pro Glu Arg
355 360 365
Leu Lys Asn Pro Phe Cys Leu Tyr Asp Ile Lys Ala Glu Ile Tyr Ser
370 375 380
Phe Gly Ile Val Leu Trp Glu Ile Ala Thr Gly Lys Ile Pro Phe Glu
385 390 395 400
Gly Cys Asp Ser Lys Lys Ile Arg Glu Leu Val Ala Glu Asp Lys Lys
405 410 415
Gln Glu Pro Val Gly Gln Asp Cys Pro Glu Leu Leu Arg Glu Ile Ile
420 425 430
Asn Glu Cys Arg Ala His Glu Pro Ser Gln Arg Pro Ser Val Asp Gly
435 440 445
Ile Leu Glu Arg Leu Ser Ala Val Glu Glu Ser Thr Asp Lys Lys Val
450 455 460
- 还没有人留言评论。精彩留言会获得点赞!