包含半胱氨酸白三烯受体拮抗剂及银杏叶提取物的感音神经性听力损失的治疗或预防用药物组合物的制作方法
本发明涉及包含半胱氨酸白三烯受体拮抗剂(cysteinyl leukotriene receptor antagonist)及银杏叶提取物的感音神经性听力损失(sensorineural hearing loss)的治疗或预防用药物组合物。
背景技术:
感音神经性听力损失直接关系到生活质量,因此成为全世界急速升起的健康相关问题。全世界人口的约5%正承受因高强度的噪声暴露而产生的听力损失带来的痛苦,随着寿命的增加,因老化而产生的感音神经性听力损失的发病率也处于逐渐增加的趋势。噪声性听力损失(noise-induced hearing loss,NIHL)在发达国家和发展中国家均成为最普通的职业病中的一种。通过了解因噪音而产生的耳蜗内细胞凋亡的疾病生理学机制,而进行用于NIHL的预防及治疗的大量研究。
根据累积大量的研究,在产生感音神经性听力损失的过程中,主要病因中的代表病因是因在作为听觉器官的耳蜗(cochlea)中产生的炎症反应而诱导的毛细胞(hair cell)的细胞凋亡。在耳蜗中,炎症反应为如下的反应,即,当因病毒或细菌等的外部物质的浸透或者噪音等的强压而产生组织结构的损伤时,可使存在于耳蜗的螺旋韧带的纤维细胞或柯替氏器官的支持细胞或位于血流中的巨噬细胞和白细胞等的免疫细胞作用于损伤部位,从而通过去除抗原或损伤的组织来使损伤部位恢复到正常状态。在急性炎症的情况下,虽然可在短时间内治愈,但是,若在某种情况下持续维持感染或损伤,则随着免疫细胞持续停留会分泌趋化因子、细胞因子等的媒介物质,从而引起周围组织的损伤,并且诱导过敏、自身免疫、胰腺癌等的慢性炎症性疾病。炎症反应媒介物质为在炎症反应过程中促进炎症反应的物质。炎症反应媒介物质在中性粒细胞、巨噬细胞等的免疫细胞和血小板中生成,并且包括趋化因子、细胞因子、脂溶性媒介物质等。类二十烷酸(eicosanoid)作为来源于细胞膜的脂溶性媒介物质,用于促进炎症反应。类二十烷酸从花生四烯酸合成,环氧酶(cyclooxygenase,COX)路径生成多种前列腺素(prostaglandins,PGs)及凝血噁烷(thromboxane,TXs),而且脂氧合酶(lipoxygenase,LOX)路径生成白三棱(leukotrienes,LTs)及脂氧素(lipoxins,LXs)。LTs区分为半胱氨酸白三烯(cysteinyl leukotrienes,CysLTs;LTC4、LTD4、LTE4)和LTB4,众所周知,CysLTs为过敏性鼻炎、哮喘的代表病因,根据最近报告,CysLTs参与退行性脑部疾病及心血管疾病的发病。但是,类二十烷酸并不是诱导或持续所有炎症性疾病,在PGD2或15d-PGJ2的情况下,有报告称类二十烷酸具有抗炎作用,因此相对于广泛地抑制类二十烷酸的生成,基于疾病别或组织别特性的下位路径隔绝可成为有效的治疗法。
目前,在噪声暴露的情况下,配戴听力保护装置(hearing protection device,HPD)为仅有的预防法,但由于存在在噪音情况下隔断作业人员之间的沟通的问题,而局限了在实际产业现场中的佩戴。因此,许多研究人员为了克服这种局限,而持续研究了用于治疗及预防听力损失的口服给药药物,但目前还没有开发对噪声性听力损失或老年性听力损失具有明确的效果的口服给药药物。
技术实现要素:
技术问题
为此,本发明目的在于,开发及挖掘根据目前为止的药物还未实现预防和治疗的感音神经性听力损失的新型治疗药剂,并且提供可通过下调半胱氨酸白三烯受体来抑制听力损失的进程的孟鲁斯特(montelukast)的新型用途。并且,当与上述半胱氨酸白三烯受体拮抗剂一同处理银杏叶提取物时,具有改善听力损失的效果,由此,提供相应的同时给药的新型用途。
解决问题的方案
本发明提供具有通过下调半胱氨酸白三烯受体(cysteinyl leukotriene receptor)来预防及/或治疗耳蜗(及前庭)毛细胞及螺旋神经节神经元的损伤或变性的效果的化合物。尤其,本发明的化合物可作为预防或治疗感音神经性听力损失的组合物提供。
并且,本发明提供包含上述半胱氨酸白三烯受体及银杏叶提取物作为有效成分的感音神经性听力损失的预防或治疗用组合物。
作为本发明的一实施例,提供包含由化学式1表示化合物作为有效成分的感音神经性听力损失的预防或治疗用药物组合物。
[化学式1]
由上述化学式1表示的化合物起到半胱氨酸白三烯受体的拮抗剂的作用。尤其,本发明的特征在于,在半胱氨酸白三烯受体中也作为1型受体的拮抗剂。
上述药物组合物可作为噪音伤害后处理给药,能够以0.8~10mg/kg持续给药4~14日。
并且,由上述化学式1表示的化合物减少基质金属蛋白酶-3(matrix metalloproteinase-3,Mmp3)基因的表达。
并且,由上述化学式1表示的化合物降低锌依赖性肽链内切酶的水平。
并且,由上述化学式1表示的化合物可与泼尼松龙(prednisolone)或甲泼尼龙(methylprednisolone)等的药剂同时给药。
并且,本发明提供包含上述组合物的感音神经性听力损失的预防或改善用食品组合物。
发明的效果
本发明可提供有效于感音神经性听力损失的预防及/或治疗用药物组合物。
附图说明
图1为示出由化学式1表示的孟鲁斯特的药理机制的示意图。
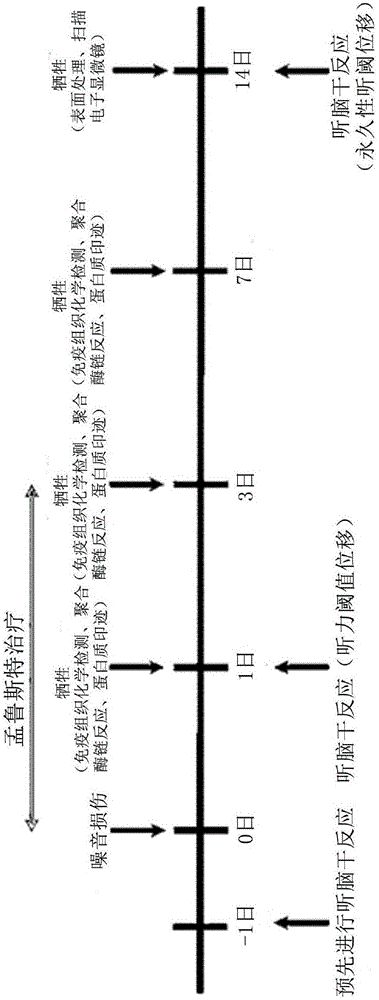
图2为示出本发明实施例的实验时间表的图表。
图3为观察基于噪声暴露的CysLT1受体单独增加效果的照片及曲线图。
图4为观察基于噪声暴露的CysLT1受体单独增加部位的照片。
图5为观察通过听性脑干反应检测的听力阈值位移的曲线图。
图6为确认利用荧光标记物的孟鲁斯特的细胞凋亡减少效果的照片(A部分)及曲线图(B部分)。
图7为确认利用扫描型电子显微镜的孟鲁斯特的细胞凋亡减少效果的照片。
图8为确认利用聚合酶链反应法(PCR)的孟鲁斯特的CysLT1受体表达的减少效果的曲线图。
图9为验证利用下一代碱基序列分析法的基于孟鲁斯特的目标识别的药物作用机理的曲线图。
图10为示出使孟鲁斯特诱导并减少Mmp3的基因及蛋白质表达量来起到保护内耳组织的效果的曲线图(A部分)及蛋白质印迹结果(B部分)。
图11为示出实现孟鲁斯特及银杏叶(银杏(ginkgo biloba))提取物的同时给药时的听力损失的治疗效果的图。
具体实施方式
以下,对本发明进行详细说明。
本发明基于作为由以下化学式1表示的化合物的孟鲁斯特的抗炎作用,提供如下的组合物,即,通过防止用于感知听力的内耳器官的损伤来隔绝听力损失的病理生理的进程,从而可预防或治疗感音神经性听力损失。
[化学式1]
并且,本发明提供如下的组合物,即,利用作为由上述化学式1表示的化合物的孟鲁斯特及银杏叶(银杏)提取物的同时给药,可预防或治疗感音神经性听力损失。
上述组合物为均包含药物组合物及食品组合物的概念。
可通过由上述化学式1表示的化合物提供治疗或预防效果的感音神经性听力损失包括噪声性听力损失或老年性听力损失。上述感音神经性听力损失的特征在于,来源于内耳的毛细胞及其周围组织的损伤。
由上述化学式1表示的化合物起到半胱氨酸白三烯受体的拮抗剂的作用。半胱氨酸白三烯受体在正常状态的内耳的柯替氏器官部分进行表达。
如表示作为本发明的化合物的孟鲁斯特的药理机制的图1所示,若向正常耳蜗提供噪音刺激,则使半胱氨酸白三烯受体在柯替氏器官、血管纹、螺旋韧带部位增加表达。于此相对应地,不仅增加受体的表达,还增加作为激动剂的半胱氨酸白三烯的表达。在此情况下,若以根据与受体相结合的半胱氨酸白三烯使作为G蛋白的亚单位中的一个的alphal-q与三磷酸鸟苷(GTP)相结合的方式使PLC活性化,则磷酯酰肌醇二磷酸(PIP2)变化为三磷酸肌醇(IP3),并且在细胞内的小器官促进钙的分泌,从而使细胞凋亡路径活性化,由此产生外毛细胞的凋亡。此时,若对孟鲁斯特进行处理,则抑制受体的G蛋白的活性化,因此减少细胞凋亡路径的活性化。
本发明的特征在于,上述半胱氨酸白三烯受体为1型受体(CysLT1)。即,由化学式1表示的化合物通过与半胱氨酸白三烯1型受体相结合来减少基质金属蛋白酶-3基因的表达。由上述Mmp3基因生成的锌依赖性肽链内切酶诱导具有与噪声性听力损失的关联性的细胞的基质的分解。上述化学式1的化合物不仅在基因水平(图10的A部分)方面减少表达,还在蛋白质水平(图10的B部分)方面减少表达。
并且,本发明的特征在于,药物组合物为口服给药用,以选自包括片剂、丸药、胶囊、粉末及颗粒在内的固体药物制剂或者包括药学上可接受的水溶液、悬浮液、乳剂、糖浆在内的使用时溶解的药物制剂或者酏剂口服用液体药物制剂中的剂型给药。
本发明的特征在于,上述药物组合物以0.8~10mg/kg连续给药4~14日。并且,由上述化学式1表示的化合物可以与泼尼松龙、甲泼尼龙或银杏提取物等的药剂同时给药。泼尼松龙和甲泼尼龙分别能够以5mg、4mg每天给药两次,并且根据处方医生的判断可增加用量。以不足1个月的期间进行给药的方法需要防止产生库欣综合征等的药物副作用,并且在糖尿病患者的情况下,需要注意急速的血糖变化。在银杏的情况下,能够以40mg、1日3次或者以80mg、1日2次的用量进行同时给药。
并且,将上述组合物作为食品组合物使用的情况下,相对于原料,本发明的上述组合物小于15重量百分比,优选地,以小于10重量百分比的量添加。但是,以健康及卫生为目的或者以调节健康为目的,在进行长时间摄取时,可添加小于上述范围的量,由于在安全性方面没有任何问题,因此有效成分还能够以大于上述范围的量使用。
对上述食品的种类不进行特别限制。例如,可添加本发明的上述组合物的食品包括肉类、香肠、面包、巧克力、糖果类、快餐类、饼干类、比萨、方便面、其他面类、口香糖类、包括冰淇淋类在内的乳制品、各种汤类、饮料、茶、口服液、酒精饮料、复合维生素等,包括普通意义中的所有健康食品。
当本发明的食品组合物制备成饮料时,如普通饮料,可添加多种香味剂或天然碳水化合物等的追加成分。上述作为天然碳水化合物可使用包括葡萄糖、果糖在内的单糖、包括麦芽糖、蔗糖在内的双糖、包括糊精、环糊精在内的天然甜味剂或包括糖精、阿司帕坦在内的合成甜味剂等。相对于本发明的食品组合物的总重量,上述天然碳水化合物为0.01~10重量百分比,优选地,以0.01~0.1重量百分比包含。
除此之外,本发明的食品组合物可包括多种营养剂、维生素、电解质、调味剂、着色剂、果胶酸及其盐、褐藻酸及其盐、有机酸、保护性胶体增稠剂、pH调节剂、稳定剂、防腐剂、甘油、醇、适用于碳酸饮料的碳酸化剂等。不仅如此,本发明的组合物可包括用于制备天然果汁、果汁饮料及蔬菜饮料的果肉。能够以独立或组合的方式使用这种成分。虽然未对上述的添加剂比率进行限制,但优选地,相对于本发明的食品组合物的总重量,以0.01~0.1重量百分比范围内的重量包含。
在现有研究中,为了治疗听力损失而尝试的抗炎症药剂诱导非特异性炎症反应的抑制,但本发明的特征在于4,利用半胱氨酸白三烯(LTC4、LTD4、LTE4)及第一型半胱氨酸白三烯受体(cysteinyl leukotriene receptor type 1,CysLT1receptor)在噪声暴露环境下特异性增加的优点,在听觉系统的毛细胞中无副作用地诱导抗炎症作用,从而抑制毛细胞的细胞凋亡(apoptosis)(图1)。并且,本发明提供用于抑制听力损失产生的后处理(posttreatment)方式的效用性,通过产生细胞外基质的分解来减少作为锌依赖性肽链内切酶(zinc-dependent endopeptidase)中的一种的基质金属蛋白酶-3的表达,从而可根据内耳组织保护效果,维持听觉系统的正常功能。
以下,对有关本发明所要提供的药物组合物作用于所要治疗或预防的听力相关疾病的方面进行详细说明。
“感音神经性听力损失”会在内耳(inner ear)的成分或伴随的神经成分受到影响的情况下产生,但大脑的听觉神经或听觉神经路径受到影响时,可包括神经或感觉成分。感觉性听力损失可以是遗传的或者声创伤(例如,爆炸声等的非常大的噪音)、病毒感染、药物诱导性或梅尼埃病为原因。神经性听力损失可因脑瘤、感染、各种大脑障碍及神经障碍产生,例如,因脑卒中产生。一些遗传性疾病,例如,雷夫叙姆病(支链脂肪酸的缺陷性积累)也可以产生影响听力损失的神经性疾病。听觉神经路径因脱髓鞘疾病而受到损伤,例如,因特发性炎性脱髓鞘疾病(包括多发性硬化症)、横贯性脊髓炎、德维克病、进行性多灶性白质脑病、格林-巴利综合征、慢性炎症性脱髓鞘性多发性神经病及抗髓鞘糖蛋白周围神经病而受到损伤。
“噪声性听力损失”因长时间暴漏在大噪音中而产生,例如,还可以因暴漏在大声音的音乐、重装备或机械装置、飞机、炮击或他人而产生的噪音中而产生听力损失。听力损失因内耳的毛细胞受体的破坏而产生。这种听力损失通常伴随着耳鸣。通常被诊断为永久性听力损失损伤。目前,虽然无噪声性听力损失的治疗法,但包括利用胰岛素样生长因子1(IGF-1)的治疗在内的多种治疗法正处于实验开发过程。可参照问下[[Lee et al.Otol.Neurotol.(2007)28:976-981]。
“老年性听力损失”作为年龄相关性听力损失,作为正常老化的一部分产生,在内耳的柯蒂螺旋器官以受体细胞的变性的方式产生。其它原因不仅包括耳蜗的基底膜的柔软性丧失,还包括前庭耳蜗神经的神经纤维素的减少。目前没有针对因老年性听力损失或过度的噪音而产生的永久性听力损伤的治疗法。
本发明涉及与耳朵的疾病相关的药物,以下,对耳朵的结构的术语进行说明。
“耳蜗”为与听力相关的内耳部分。耳蜗为以蜗牛形状纠缠的螺旋型的管类似结构物。耳蜗的内部分为3个区域,并根据前庭膜和基底膜的位置进行区分。前庭膜上的部分为前庭阶,从听小骨延伸至耳蜗的顶点,包含钾含量低且钠含量高的作为水性液体的外淋巴液。基底膜用于限制鼓阶区域,其从耳蜗的顶点延伸至圆窗,也包含外淋巴液。基底膜包含许多硬质纤维,但其长度从圆窗到耳蜗的顶点逐渐增加。若基底膜的纤维根据声音而活性化,则进行振动。耳蜗管位于前庭阶与鼓阶之间,其末端在耳蜗的顶点形成密封囊。耳蜗管包含内淋巴液,但其余脑脊液类似且钾含量高。
作为听觉系统的“柯蒂器官”位于基底膜上,并通过耳蜗管向上方延伸。柯蒂器官包含从自由面延伸的具有毛形状的突出部的毛细胞,并与称为盖膜的明胶表面相接触。毛细胞不具有轴突,但其被用于形成前庭耳蜗神经(脑神经VIII)的耳蜗支的感觉神经纤维包围。
作为本发明的具体实施例,对通过作为本发明的化合物的孟鲁斯特的后处理的听觉器官保护效果验证过程进行说明。
在本发明中,作为实施方法,使用了以确认的听力损失动物模型方法,由于包括人类在内的哺乳类的听觉系统具有相同的解剖组织学结构,因此上述听力损失动物模型方法具有非常便于适用于未来临床实验的优点。并且,具有听力损失诱导时间短(听觉系统损伤在经过2周后的永久性听力阈值变化)且可与使用于现有药理机制确认的invitro模型系统并用的优点。在本发明使用的孟鲁斯特浓度(10mg/kg)已被证明为无毒性的水平。
如图2所示,为了便于说明本实施例的实验,根据实验时间来进行说明。以0日为基准,施加噪音刺激,此后,进行3日的孟鲁斯特处理,以在1日、3日、7日、14日牺牲白鼠的方式观察其变化。利用在噪音刺激实验当日及1日、3日、7日获得的组织分别进行用于检测受体表达形式变化的免疫组织化学检测、聚合酶链反应(PCR)、蛋白质印迹(Western blot,WB),在14日,在牺牲白鼠之前,通过听性脑干反应检测确认永久性听力阈值位移,此后进行用于评价组织损伤的表面准备法及扫描型电子显微镜检测。
用于实施发明的实施方式
实施例1:白三烯受体存在与否验证实验
为了使药物起到特异性作用,需要验证在靶器官是否存在可使相应药物起作用的特异性受体。正常提取8周龄、雄性BALB/c白鼠的耳蜗,并利用聚合酶链反应(polymerase chain reaction,PCR)方法,来分别确认在核糖核酸(RNA)基因水平是否存在受体(图3的A部分)。
具体实验方法如下。在1日、3日、7日通过聚氨酯腹腔注射(1g/kg)对动物进行安乐死,并立即去除双侧颞骨。在TRIzol溶液投入所分离的2个耳蜗,并进行溶解,在通过投入氯仿来去除脂质后,通过异丙醇提取RNA基因。在定量所提取的RNA基因后,混合正向及反向两种引物(primer)和聚合酶,通过PCR设备按引物平均扩增35周期后,检测荧光显色程度,并按各基因比较分析表达量变化。其结果确认到,作为白三烯受体的基因,CysLT1(Cysltr1)、CysLT2(Cysltr2)及BLT1(Ltb4r1)的内源性信使核糖核酸(mRNA)在正常耳蜗进行表达(图3的A部分)。
实施例2:观察噪声暴露后的CysLT1受体及变化
为了确认在实施例1筛选的CysLT1受体是否根据噪音刺激而增加,利用噪音生成器,将8周龄、雄性BALB/c白鼠以112分贝的声压暴露3小时左右。然后,在白鼠中提取耳蜗组织,并按小时确认表达形式变化。利用PCR方法及作为蛋白质表达检测法的蛋白质印迹方法,在RNA和蛋白质水平分别确认受体存在与否。为了确认是否为非特异性增加,而其它种类的白三烯受体(CysLT2受体、BLT1受体、BLT2受体)及作为上位阶段酶的LOX也均利用聚合酶链反应法进行确认。利用酶免疫分析法(enzyme immunoassay)来确认根据所增加的LOX的CysLTs(LTC4、LTD4、LTE4)的耳蜗内表达量变化(图3)。
作为下一步骤,为了确认准确的药物的作用部位,而使用免疫组织化学染色法(immunohistochemistry,IHC)。利用针对CysLT1受体的一次抗体来确认在耳蜗相应受体进行表达的解剖学结构。并且,按小时比较分析噪声暴露时的受体表达形式的变化,从而作为用于决定适当的药物给药期间的基础材料使用(图4)。
具体的实验方法如下(PCR实验参照实施例1)。在1日、3日、7日通过聚氨酯腹腔注射(1g/kg)对动物进行安乐死,并立即去除双侧颞骨。在投入蛋白酶抑制剂的冷却的裂解缓冲液(ice-coldlysis buffer,100mM的三羟甲基氨基甲烷(Tris),pH为7.4,200mM的NaCl,1%的NP-40,10mM的MgCl2)内使在蛋白质印迹实验时所分离的2个耳蜗均质化。蛋白质印迹法根据现有方法实施。即,在摄氏4℃以13000rpm对均质液进行20分钟的离心分离,利用10%的聚丙烯酰胺凝胶电泳(SDS-PAGE)对上清液的蛋白质进行电泳,并通过硝酸纤维素膜进行转移。膜以针对半胱氨酸白三烯受体1(CysLT1;1:1000稀释(dilution);Caymen chemical,Ann Arbor,MI)的一次抗体恒温处理过夜,并通过化学发光法(Ab Frontier,Seoul,Korea)识别条带。利用图像处理软件(ImageJ software)(NIH,Bethesda,MD)使条带的表达强度定量化。
免疫组织化学染色法实验方法如下。对动物进行麻醉,通过心脏灌流包含0.5%的硝酸钠及肝素(10U/ml)的食盐水。而且,为了固定组织,以溶解有0.1M的磷酸缓冲液(pH为7.2)的4%的多聚甲醛(PFA)进行处理。为了获得耳蜗,从头盖骨的两侧解剖颞骨(temporal bone),在4%的PFA以摄氏4℃的温度固定过夜。通过磷酸缓冲盐溶液(PBS)对所固定的耳蜗进行10分钟且3次清洗,在溶液投入5%的乙二胺四乙酸(EDTA),并去除3日左右的石灰质。在完成脱钙化后,通过石蜡固定样品。利用滑动切片机(Leica,Wetzlar,Germany)获得4张连续的5μm厚度的切片。将连续的切片放在明胶涂敷的载玻片,以PBS漂洗3次后,以3%的H2O2处理5分钟,以包含0.2%的曲拉通X-100的PBS(PBST)进行漂洗。非特异性结合以溶解在PBST的1%的牛血清白蛋白(BSA)隔绝。切片与针对半胱氨酸白三烯受体1(CysLT1;1:100稀释;Caymen chemical,Ann Arbor,MI)的一次抗体一同在4℃恒温处理过夜。在以PBST完成漂洗后,切片与生物素化的二次抗体(Vector Laboratories,Burlingame,CA)一同恒温处理1小时左右,而且以亲和素/生物素系统(Vector Laboratories)恒温处理1小时左右,利用3,3'-二氨基联苯胺(D5637,DAB,Sigma Aldrich)溶液(在0.1M的磷酸盐缓冲液(PB)投入0.05%的二氨基联苯胺(DAB)和0.003%的过氧化氢(hydrogen peroxide))进行发色。细胞核利用苏木精QS(H-3404,Vector Laboratories)进行对比染色。使用PictureFrame Application 2.3 software获得光学显微镜(light field)图像。
实验结果,在施加噪音刺激后,在7日间按小时确认上述基因的表达形式变化(图3的B部分-E部分),在刺激后的3日,只有Cysltr1显著增加基因及蛋白质表达量(图3的B部分、G部分)。位于上位路径的5-脂氧合酶(Alox5)也显示类似的小时别增加形式(图3的F部分),作为CysLT1受体的激动剂的CysLTs的表达量也被增加(图3的H部分),在噪音刺激下,确认到CysLT1信号传递链被活性化。并且,根据免疫组织化学染色实验结果可知,与上述基因及蛋白质表达形式相同地,相对于正常对照组(图4的A部分-C部分),在噪音暴露后的3日,CysLT1受体的表达在螺旋韧带(图4的G部分、H部分)及柯替氏器官(图4的G部分、I部分)显著增加,由此,在以下实验中使用了半胱氨酸白三烯受体的拮抗剂。
实施例3:听力阈值位移检测
对孟鲁斯特是否防止耳蜗(cochlea)的噪音性损伤(noise-induced injury,由噪音诱导的损伤)进行了评价(参照图5的A部分、B部分)。为了对噪音暴露1日前的初始听力进行评价及记录,进行作为电气生理检测的听性脑干反应检测(auditory brainstem response,ABR)(pre-ABR)。ABR检测根据现有的方法进行,听力通过Biosig 32 ABR系统(Tucker-Davis Technologies,Gainesville,FL)进行评价。通过水合氯醛(SigmaAldrich-Fluka,St.Louis,MO)的腹腔注射对各白鼠进行麻醉。利用无菌电极探针以经皮的方式对脑干反应进行记录。将参比电极插入于待检测的耳朵下方,而在相反耳朵的下方和头部上方的皮肤下插入活性电极。通过直接放置的耳机向外部听力听觉通路施加刺激。选择听觉频率,将16或32kHz按5阶段从75dB自动缓解至10dB,直到ABR波动消失。在各频率收集1000刺激的平均值后,记录并存储各结果。听力阈值由可再生且可提取可在视觉上检测出的波动的最小强度决定。在噪声暴露前以及噪声暴露后的1日及14日对针对16及32kHz刺激的ABR进行记录。即,为了对急性听力损失进行评价,在完成噪声暴露的1日后,对听力阈值位移进行检测(compound threshold shift,CTS)。对噪声暴露组和噪声暴露及孟鲁斯特后处理组的阈值变化进行比较分析。为了对永久性听力损失进行评价,在完成噪声暴露的14日后,对听力阈值位移进行检测(permanent threshold shift,PTS)。对噪声暴露组和噪音暴露及孟鲁斯特后处理组的阈值变化进行比较分析(图5)。
首先,为了确认孟鲁斯特后处理的效能,在各动物的噪声暴露的前后,以ABR阈值之间的差异为基础计算听力阈值变化。基准线ABR阈值(-1日)在实验组之间无显著差异。在完后噪音暴露后,在噪声暴露后的1日对急性听力阈值变化(CTS)进行检测,在噪声暴露后的14日对永久性听力阈值变化(PTS)进行检测。如图5的A部分所述,在仅噪音暴露的组和孟鲁斯特后处理的组中,16及32kHz中的急性听力阈值变化(CTS)均显示类似的模式。相反地,若在给药4日的孟鲁斯特后,在噪声暴露的14日对PTS进行检测,则相对于仅噪音暴露的组,阈值位移显示出减少约50%,由此确认到具有根据孟鲁斯特的听力保护效果(图5的B部分)。
实施例4:确认孟鲁斯特的听觉毛细胞保护效果
在对照组、噪声暴露单纯组、噪声暴露后的孟鲁斯特后处理组中,从噪声暴露1周后的白鼠提取内耳组织,并通过表面处理法(surface preparation,SP)制备试样。
为了检测毛细胞的变化,而进行鬼笔环肽染色(phalloidin staining)。在0.1M的PB中以4%的PFA对所切割的耳蜗进行灌流,并在摄氏4℃中维持过夜。对耳蜗以PBS进行10分钟的3次清洗后,以5%的EDTA溶液进行3日左右的脱钙化。在完成脱钙化后,去除听软骨囊(otic capsule),在光学显微镜下去除外侧壁(lateral wall)、前庭膜(Reissner's membrane)和耳蜗(tectorial membrane)。以德克萨斯红(Texas Red)VR-X鬼笔环肽(T7471;在PBS以200U/mL的甲醇(methanol)稀释成(diluted)1:100;Invitrogen,Eugene,OR)对柯蒂器官(OC)进行1小时左右的染色。然后,以PBS对所有样品进行漂洗,并通过切割来进行表面处理法(microdissected into individual turns),使用包含4',6-二脒基-2-苯基吲哚(H-1200;1.5μg/ml;DAPI;Vector Laboratories)的封固溶液来将上述样品放置在玻璃载玻片。对载玻片进行最少15分钟左右的恒温处理。通过共聚焦显微镜(LSM510,Carl Zeiss,Jena,Germany)观察OC的毛细胞。检测区域为耳蜗钩(hook)区域上述的32kHz相应部位,在按实验组从4只获得的多个样品中,利用共聚焦显微镜(confocal microscopy)来对作为毛细胞组成成分标记物的德克萨斯红鬼笔环肽及针对细胞核的标记物进行观察,并对毛细胞凋亡的根据孟鲁斯特的减少程度进行比较分析(图6)。
通过这种表面处理法可知,相对于正常对照组,噪声暴露组中的毛细胞标记物明显减少,但相对于正常对照组,孟鲁斯特后处理组中的毛细胞标记物明显增加。
利用扫描型电子显微镜(confocal micscanning electron microscopy,SEM)追加验证了根据噪声暴露的细胞凋亡因孟鲁斯特而减少(图7)。为了对耳蜗的毛细胞的形态进行评价而使用扫描型电子显微镜。通过聚氨酯腹腔注射对白鼠进行安乐死后,为了获取耳蜗,而从头盖骨的两侧解剖颞骨,并小心地对颞骨进行切割。使用锋利的针,在所获得的耳蜗的圆窗上打孔。对圆窗放置具有改质的蝶形导管的巴斯德吸管,并在PBS中以2%的戊二醛对外侧淋巴空间进行灌流。将各试样放置于戊二醛溶液中过夜。以1%的四氧化锇对试样进行灌流,并在组织回转器放置15分钟左右。以PBS对样品进行3次漂洗。在光学显微镜下小心地去除耳蜗的骨部分,以切割的方式去除外侧壁,从而暴露柯替氏器官。以50%、70%、90%、95%及100%的丙酮对组织进行连续的脱水。以六甲基二硅氮烷(HMDS)对各试片进行处理,并以空气进行干燥,为了以白金进行涂敷,将试片放置于管端。通过JSM-6380(Jeol,Tokyo,Japan)拍摄上述组织的照片。在与32kHz相对应的底转区(basal turn areas)对毛细胞损伤进行分析。
相对于对照组,SEM影像仅在噪音暴露的组中的羟胆骨化醇(OHC)的静纤毛(stereocilia)显示相当部分的损伤,相对于仅噪音暴露的组,针对孟鲁斯特后处理组中的OHC的静纤毛的损伤被减少相当部分(图7)。这种结果与表面处理法的结果一致,因此,孟鲁斯特后处理在声音过大刺激后有效缓解毛细胞的凋亡。
利用聚合酶链反应方法来验证由孟鲁斯特减少根据噪声暴露的CysLT1受体增加(图8)。PCR实验方法可参照实施例1。
根据Cysltr1基因分析结果,孟鲁斯特后处理可显著减少在完成噪声暴露3日后的在噪声暴露组增加的CysLT1受体基因,从而确认到根据孟鲁斯特的保护效果依赖于CysLT1信号传递链的下调(down regulation)。
实施例5:利用下一代基因组分析法的药物目标识别
在完成噪声暴露72小时后,提取白鼠内耳组织,利用作为下一代基因组分析法的RNA-seq方法来识别孟鲁斯特起作用的目标,从而明确分析药物的听力损失产生抑制机制(图9)。
在完成噪声暴露3日后,利用在对照组、噪声暴露组、孟鲁斯特后处理组获得的耳蜗组织,并使用TruSeqTM RNA Sample Preparation Kit v2(Illumina Inc.SanDiego,CA,U.S.)来获得高品质的RNA基因样品(RQI>7),然后利用附着有Poly-Toligo的磁珠来获得包含poly-A的RNA。在高温下切割的RNA切片根据逆转录酶复制成互补DNA。利用包含在样品制备试剂盒(Sample Preparation Kit)(Illumina Inc.)的反应混合物(Master Mix)和引物抑制剂(Primer Cocktail),使互补DNA切片在如下的条件下进行聚合反应,即,在98℃进行30秒、按15周期在98℃进行10秒、在60℃进行30秒、在72℃进行30秒、在72℃进行5分钟。为了以将通过Ampure XP珠纯化的互补DNA文库(cDNA library)以12pM的浓度投入于流式细胞通道(flowcellchannel)的方式在Illumina 2000测序平台(Sequencing Platform)上实现2×100-bp双端测序(paired-end sequencing),而使用PCR产物。利用TopHat(v2.0.8)来检索未加工数据。RNA量利用Cuffdiff(Cufflinks v0.8.3)以每百万读段中来自于某基因外显子每千碱基长度的读段数(fragments per kilobase of exon per million reads,FPKM)数值进行比较分析。将FPKM数值转化为log2,并为了分析而实施了分位标准化(quantile normalized)。
下一代基因碱基序列分析结果,在完成噪声暴露3日后,对噪声暴露组和孟鲁斯特后处理组进行比较时,一共有13个基因发生显著变化,尤其,Adam28、Reg3g、Mmp3、Ighv1-73、Snora16a、Rpl17-ps5基因作为炎症相关基因,在噪声暴露组被增加,相反地,在孟鲁斯特后处理组中表示与正常对照组类似的表达形式,从而额外地确认到根据孟鲁斯特后处理的保护效果通过上述基因的下调实现(图9)。并且,孟鲁斯特后处理诱导所列举的基因中的与噪声性听力损失具有关联性且用于产生细胞外基质的分解的作为锌依赖性肽链内切酶的基质金属蛋白酶-3的基因及蛋白质表达量减少,从而可实现内耳组织保护效果(图10)。
实施例6:确认孟鲁斯特及银杏叶提取物的同时给药效果
确认根据孟鲁斯特及银杏叶提取物的处理的听力阈值位移效果。本实验以与实施例3相同的方式进行。但是,在孟鲁斯特的情况下使用10mg/kg,并与32.4mg/kg的EgB(银杏提取物(Glinko Biloba Extract)(Tanamin Tab))一同口服给药。其结果如图11所示。
如图11所示,相对于仅处理噪音的情况,在单独给药孟鲁斯特时产生听觉保护效果,相反地,在单独处理EgB时未产生保护效果。但是,当实现孟鲁斯特及银杏叶提取物的同时给药时,相对于单独处理孟鲁斯特的情况,产生更高的听觉保护效果。
- 还没有人留言评论。精彩留言会获得点赞!