用于治疗HPV阴性癌症的PDL‑1和PD‑1拮抗剂的制作方法
癌症一直是主要的全球健康负担。尽管在癌症的治疗方面有所进展,但一直存在对更有效且毒性更小的疗法的未满足的医疗需要,尤其对于患有对现有治疗剂有抗性的晚期疾病或癌症的那些患者。
免疫系统能够鉴定肿瘤相关抗原并且消除表达它们的癌性细胞。这个肿瘤免疫监视或肿瘤免疫编辑的过程在防止和抵抗肿瘤生长方面起重要作用,并且肿瘤浸润淋巴细胞(并且更确切地细胞毒性T细胞)的水平与许多癌症中的改进的预后相关。因此,增强免疫应答可以提供控制肿瘤的手段。
最近的研究表明,通常起到调节T细胞介导的免疫应答和控制自身免疫的免疫途径(被称为免疫检查点)的颠覆提供了一个使肿瘤能够逃避宿主免疫应答的共同机制。因此,大部分注意力都被引导到理解免疫检查点途径,希望将这一理解转化为下一代的免疫刺激药物。一个T细胞抑制性检查点途径通过程序性死亡-1(PD-1、CD279)及其配体程序性死亡配体-1(PDL-1、CD274、B7-H1)发信号。
据信PD-1/PDL-1途径主要的功能是通过在慢性炎症、感染和癌症期间抑制外围T细胞的活性来限制自身免疫。这个途径被认为是传递主要调节针对肿瘤细胞的T细胞效应阶段的抑制信号,并且已经与肿瘤生长和进展有牵连。
PD-1在活化的T细胞和调节性T细胞、NK-T细胞、B细胞、和活化的单核细胞中表达。在正常组织中,PDL-1在T细胞、B细胞、树突状细胞、巨噬细胞、间充质干细胞、骨髓源性肥大细胞以及不同非造血细胞上表达。PDL-1还通过肿瘤来表达并且在多个部位上起作用以帮助肿瘤避开由宿主免疫系统进行的检测和消除。PDL-1在宽范围的癌症中高频率地表达。在一些癌症中,PDL-1的表达与存活降低和不利预后相关联。
阻断PD-1和PDL-1之间的相互作用的抗体能够缓解PDL-1依赖性免疫抑制作用并增强抗肿瘤T细胞在体外的细胞毒性活性,并且一些这类抗体(例如,MEDI4736)正在作为癌症治疗被研究。
几种类型的癌症与人乳头状瘤病毒(HPV)相关联,并且已显示PD-1的表达在从与HPV相关癌症的患者中分离的肿瘤浸润淋巴细胞中上调。此外,已显示PDL-1的表达在HPV相关的癌症中被增加了。参见例如,派克(Pike)S.L.等人,癌症研究(Cancer Research),73:1733(20130;帕依(Pai)S.I.,肿瘤免疫学(OncoImmunology),2(5):e24065-1(2013)。
已显示几个抗体治疗的功效与抗原表达水平相关联。例如,赫赛汀(Herceptin)(曲妥单抗)与HER2蛋白结合,并且使用的药效试验数据显示有益的治疗效果在很大程度上仅限于具有最高HER2蛋白表达水平的患者。HER2过量表达的程度被认为是治疗效果的预测因子,并且被特别指定为用于过量表达HER2的癌症。
因此,鉴于对治疗癌症的高度未满足的需要,对PD-1拮抗剂(例如,阻断PD-1和PDL-1的相互作用的抗体)治疗HPV阳性和HPV阴性癌症的能力进行了研究以确定HPV阳性肿瘤状态是否是治疗功效的预测因子。
简要概述
本文提供了治疗HPV阴性癌症的方法。
在一些情况中,治疗癌症的方法包括向具有癌症的人类患者给予PDL-1拮抗剂,其中该癌症是HPV阴性的。在一些情况中,该PDL-1拮抗剂是抗PDL-1抗体或其抗原结合片段。在一些情况中,该PDL-1拮抗剂(例如,抗PDL-1抗体或其抗原结合片段)抑制PDL-1和PD-1的相互作用。在一些情况中,该PDL-1拮抗剂(例如,抗PDL-1抗体或其抗原结合片段)增加对HPV阴性癌症的免疫应答。
在一些情况中,治疗癌症的方法包括向具有癌症的人类患者给予PD-1拮抗剂,其中该癌症是HPV阴性的。在一些情况中,该PD-1拮抗剂是抗PD-1抗体或其抗原结合片段。在一些情况中,该PD-1拮抗剂(例如,抗PD-1抗体或其抗原结合片段)抑制PDL-1和PD-1的相互作用。在一些情况中,该PD-1拮抗剂(例如,抗PD-1抗体或其抗原结合片段)增加对HPV阴性癌症的免疫应答。
在一些情况中,治疗癌症的方法包括向具有癌症的人类患者给予PDL-1和PD-1的相互作用的拮抗剂,其中该癌症是HPV阴性的。
在一些情况中,该拮抗剂是MEDI4736或其抗原结合片段。
在一些情况中,该方法进一步包括确定该癌症是否是HPV阴性的。
在一些情况中,该给予减少了肿瘤生长。在一些情况中,该给予减小了肿瘤尺寸。在一些情况中,该给予使肿瘤尺寸减小至少25%。在一些情况中,该给予在拮抗剂第一次给予的大约12周内使肿瘤尺寸减小至少25%。
在一些情况中,该给予产生约100至约2,500d·μg/mL的AUC(τ)。在一些情况中,该给予产生约15至约350μg/mL的Cmax。
在一些情况中,该MEDI4736或其抗原结合片段的半衰期是约5至约25天。在一些情况中,该MEDI4736或其抗原结合片段的清除率是约1-10毫升/天/千克。
在一些情况中,给予了约0.1mg/kg、约0.3mg/kg、约1mg/kg、约3mg/kg、约10mg/kg或约15mg/kg MEDI4736或其抗原结合片段。在一些情况中,给予了约0.1mg/kg MEDI4736或其抗原结合片段。在一些情况中,给予了约0.3mg/kg MEDI4736或其抗原结合片段。在一些情况中,给予了约1mg/kg MEDI4736或其抗原结合片段。在一些情况中,给予了约3mg/kg MEDI4736或其抗原结合片段。在一些情况中,给予了约10mg/kg MEDI4736或其抗原结合片段。在一些情况中,给予了约15mg/kg MEDI4736或其抗原结合片段。
在一些情况中,约每14天至21天重复该给予。在一些情况中,约每14天重复该给予。
在一些情况中,该肿瘤尺寸减小或肿瘤生长减少,并且MEDI4736或其抗原结合片段随后作为维持疗法约每2个月给予一次。
在一些情况中,该给予产生部分应答。在一些情况中,该给予产生完全应答。
在一些情况中,该癌症是头颈部鳞状细胞癌(SCCHN)。在一些情况中,该癌症是口咽鳞状细胞癌。
在一些情况中,该肿瘤是至少一种化学治疗剂难治愈的。
附图/图简要说明
图1示出每两周(Q2W)用静脉内(IV)给予的MEDI4736治疗的时间线。在第6周、第12周和第16周之后并且然后每8周测量免疫相关应答标准(irRC)。
图2A示出对于研究的剂量-扩展和剂量-递增部分的研究流程图。使用两周给药时间表(Q2W)和三周给药时间表(Q3W)来进行研究的剂量扩展部分。在研究的递增部分中评估患有非小细胞肺癌(NSCLC)、黑色素瘤和其他肿瘤的患者;2B示出扩展中的肿瘤类型。
图3示出在研究的剂量-递增阶段过程中,在0.1mg/kg或0.3mg/kg下给予MEDI4736(Q2W)之后获得的药物代谢动力学数据的概述。“AUC”=曲线下面积;“Cmax”=最大观察浓度。
图4示出在研究的剂量-递增阶段过程中,在接受0.1mg/kg、0.3mg/kg、或1mg/kg MEDI4736(Q2W)的患者中观察到的随时间推移的MEDI4736的浓度。
图5示出在研究的剂量-递增阶段过程中,在接受0.1mg/kg、0.3mg/kg、或1mg/kg MEDI4736(Q2W)的患者中观察到的随时间推移的靶标结合。“LLOQ”=定量下限。
图6示出在接受0.1mg/kg、0.3mg/kg、或1mg/kg MEDI4736的患有非小细胞肺癌(NSCLC)、黑色素瘤或结肠直肠癌(CRC)的患者中观察到的MEDI4736的临床活性。最佳应答被表征为稳定疾病(SD)、进展性疾病(PD)、部分应答(PR)或不可评估(NE)。
图7示出在接受0.1mg/kg、0.3mg/kg、1mg/kg、10mg/kg或15mg/kg MEDI4736的患者中,MEDI4736对肿瘤尺寸的作用。
图8示出10mg/kg MEDI4736对NSCLC肿瘤的作用。
图9示出10mg/kg对HPV阳性(#)和HPV阴性头颈部鳞状细胞癌(SCCHN)肿瘤的作用。9A示出随时间推移相对于基线的变化,且9B示出在任何时间点在每个患者中观察到的从基线的最佳变化。
图10示出使用MEDI4736治疗的受试者在24个月的随访内的结果。应答率是基于HPV状态和/或PDL1状态呈现的。
详细说明
本文提供的是用于治疗HPV阴性癌症的方法。提供的方法包括给予有效量的一种或多种PD-1与PDL-1的相互作用的拮抗剂。
I.定义
应当指出的是,术语“一个/种(a或an)”实体是指一个/种或多个/种该实体;例如,“一种抗PDL-1抗体”应理解为代表一种或多种抗PDL-1抗体。因此,术语“一个”(或“一种”)、“一个或多个(一种或多种)”、以及“至少一个(至少一种)”在此可以互换地使用。
术语“抑制(inhibit)”、“阻断(block)”和“压制(suppress)”在此可互换地使用,并且是指任何统计学显著的生物活性的降低,包括活性的完全阻断。例如,“抑制(inhibition)”可以指至少10%、或至少20%、或至少30%、或至少40%、或至少50%、或至少60%、或至少70%、或至少80%、或至少90%、或约100%的生物活性的减少。因此,当术语“抑制(inhibition)”或“压制(suppression)”被用于描述例如对在T细胞上的PD-1和/或PDL-1的表达的作用和/或对T细胞介导的细胞溶解活性的作用时,该术语是指例如拮抗剂(如抗PD-1抗体和/或抗PDL1抗体)统计学上显著降低该拮抗剂结合的抗原的活性的能力。例如,术语抑制或阻断可以被用来指相对于在未处理的细胞群(对照)中的表达和/或T细胞介导的细胞溶解活性,抗PDL-1抗体和/或抗PD1抗体降低PDL-1或PD1的表达的能力,和/或该抗体在体外或体内增加T细胞介导的细胞溶解活性的能力。术语抑制或阻断在此也用于指拮抗剂(例如,抗PDL-1或抗PD1抗体或其抗原结合片段)降低PDL-1与PD-1相互作用(即,结合)能力的能力。
如在此使用的,术语效应细胞(如T细胞)的“抑制活化(inhibit activation)”或“压制活化(suppress activation)”是指相对于在拮抗剂抗体不存在下效应细胞的活化,在此披露的组合物(如抗PD1抗体和/或抗PDL-1抗体)在统计学上显著降低表达表面抗原(例如,T细胞)的效应细胞的活化的能力。在一个实施例中,当细胞与拮抗剂抗体相接触时,相对于在拮抗剂抗体不存在下测定的活化,T细胞或表达表面抗原的其他效应细胞的活化下降了至少10%、或至少20%、或至少30%、或至少40%、或至少50%、或至少60%、或至少70%、或至少80%、或至少90%、或约100%。
效应细胞活化可以使用本领域中已知的技术来测定,该本领域中已知的技术测量例如表面标志物表达、胞内信号传导、细胞分裂的速率、细胞溶解活性和/或细胞因子产生。
术语“抗体”意指通过位于免疫球蛋白分子的可变区内的至少一个抗原识别位点识别并特异性地结合一个靶标如蛋白质、多肽、肽、碳水化合物、多核苷酸、脂质或上述物质的组合的一个免疫球蛋白分子。如在此使用的,术语“抗体”包括完整多克隆抗体,完整单克隆抗体,抗体片段(诸如Fab、Fab′、F(ab′)2、以及Fv片段),单链式Fv(sc Fv)突变体,产生自至少两个完整抗体、嵌合抗体、人源化抗体、人抗体、包含抗体的抗原决定部分的融合蛋白以及包含抗原酶识别位点的任何其他修饰的免疫球蛋白分子的多特异性抗体(例如双特异性抗体),只要这些抗体展现希望的生物活性。抗体可以是以下五大类免疫球蛋白中的任一种:IgA、IgD、IgE、IgG、以及IgM、或其亚类(同种型)(例如IgG1、IgG2、IgG3、IgG4,IgA1和IgA2),基于它们的重链恒定域的特性分别被称为α、δ、ε、γ、以及μ。不同类的免疫球蛋白具有不同的且众所周知的亚基结构以及三维构型。抗体可以是裸的或轭合至其他分子如毒素、放射性同位素等等,以便形成抗体-药物轭合物(ADC)。
术语“抗体”或“免疫球蛋白”在此可互换使用,并包括完整抗体及其任何抗原结合片段或单链。典型抗体包含由二硫键互连的至少两个重(H)链和两个轻(L)链。每个重链由重链可变区(在此缩写成VH)和重链恒定区构成。重链恒定区由三个结构域CH1、CH2、和CH3构成。每个轻链由轻链可变区(在此缩写成VL)和轻链恒定区构成。轻链恒定区由一个结构域CL构成。VH和VL区可以进一步细分为高变区,名为互补决定区(CDR),它们散布在较为保守的名为构架区(FW)的区域内。每个VH和VL由三个CDR和四个FW形成,以如下顺序从氨基末端至羧基末端来安排:FW1、CDR1、FW2、CDR2、FW3、CDR3、FW4。重链和轻链的可变区含有与抗原相互作用的结合结构域。抗体的恒定区可以介导免疫球蛋白与宿主组织或宿主因素(包括免疫系统的不同细胞(例如,效应细胞)和经典补体系统的第一组分(C1q))的结合。本披露的示例性抗体包括典型抗体、scFv、及其组合,其中,例如,scFv是共价连接(例如,经由肽键或经由化学接头)至典型抗体的重链和/或轻链的N末端,或插入典型抗体的重链和/或轻链。本文另外的示例性“抗体”包括融合蛋白和任何其他修饰的免疫球蛋白分子,该融合蛋白包含抗体部分,该免疫球蛋白分子包含抗原识别位点。出于本披露的目的,术语抗体还包括含有免疫球蛋蛋白源性、天然存在的和/或合成的氨基酸序列(例如,肽体)的Fc融合蛋白,该Fc融合蛋白结合在待靶向的感兴趣的细胞中表达的(例如,细胞表面免疫检查点抗原如PD-1L)。
短语“抗原结合片段”是指完整抗体的一部分,和/或是指完整抗体的抗原决定可变区。已知的是,抗体的抗原结合功能可以由全长抗体的片段来执行。抗体片段的实例包括但不限于:Fab、Fab′、F(ab′)2、以及Fv片段、线性抗体、单链抗体、双抗体以及由抗体片段形成的多特异性抗体。
在具体的实施例中,根据本披露的方法使用的抗体具有降低的效应子功能。在一些实施例中,抗体包含在Fc区负责效应子功能的突变,例如,一个或多个描述于以下文献的突变:国际申请公开号WO 09/100309、WO 06/076594、WO 06/053301、WO 06/047350;以及WO 99/58572;美国专利号6,737,056和5,624,821,以及美国申请公开号US 2010/0166740和2006/0134709,其各自的内容通过引用以其全文在此结合。“降低的效应子功能”是指相比于对照(如具有野生型Fc区的多肽),减少特定的效应子功能(如ADCC或CDC)至少20%、至少30%或至少50%。
“阻断性”抗体或“拮抗性”抗体或药剂是抑制或降低其所结合的抗原的生物活性的一种抗体或药剂,例如,抑制或减少PDL-1与PD-1相互作用或结合PD-1的能力的一种抗体或药剂。在某个实施例中,阻断性抗体或拮抗性抗体基本上或完全抑制抗原的生物学活性。理想的是,该生物活性被降低至少10%、20%、30%、50%、70%、80%、90%、95%,或约100%。
如在此使用的,术语“特异性结合”是指其中如通过本领域中的技术测定的,以诊断或治疗相关的浓度例如通过竞争性ELISA或通过用BIACORE或KINEXA测定的KD的测量,特异性结合对的一个成员(如抗体)不显著地结合到除了它的一个或多个特异性结合伴侣之外的分子的情况(即,交叉反应性低于约25%、20%、15%、10%、或5%)。
如在此使用的,术语“MEDI4736”是指具有轻链可变区和重链可变区的抗体,该轻链可变区包含SEQ ID NO:1的氨基酸序列,该重链可变区包含SEQ ID NO:2的氨基酸序列。MEDI4736进一步被披露于国际申请公开号WO 2011/066389 A1和美国申请公共号2010/0028330,其各自的公开内容通过引用以其全文在此结合。MEDI4736的Fc结构域在IgG1重链的恒定结构域中含有三重突变,该三重突变使与负责介导抗体依赖性细胞介导的细胞毒性(ADCC)的补体组分C1q和Fcγ受体的结合减少。MEDI4736特异性结合PDL-1并阻断PDL-1与PD-1和CD80(B7.1)受体的结合。MEDI4736可以在体外解除PDL-1介导的对人T-细胞激活的抑制,并且通过T-细胞依赖性机制在异种移植物模型中抑制肿瘤生长。
用于在此提供的这些方法中的MEDI4736和其抗原结合片段包含重链和轻链或重链可变区和轻链可变区。在具体实施例中,用于在此提供的这些方法中的MEDI4736或其抗原结合片段包含轻链可变区和重链可变区,该轻链可变区包含SEQ ID NO:1的氨基酸序列,该重链可变区包含SEQ ID NO:2的氨基酸序列。在特定实施例中,用于在此提供的这些方法中的MEDI4736或其抗原结合片段包含重链可变区和轻链可变区,其中该重链可变区包含分别是SEQ ID NO:3、4、和5的CDR1、CDR2和CDR3序列,并且其中该轻链可变区包含分别是SEQ ID NO:6、7、和8的CDR1、CDR2和CDR3序列。本领域技术人员将能够容易地鉴定对于本领域技术人员而言已知的乔西亚(Chothia)定义、Abm定义或其他CDR定义。在具体实施例中,用于在此提供的这些方法中的MEDI4736或其抗原结合片段包含如国际申请公开号WO 2011/066389中所披露的2.14H9OPT抗体的可变重链和可变轻链CDR序列,该专利的内容通过引用以其全文在此结合。
术语“受试者”是指有待成为特定治疗的接受者的任何动物(例如,哺乳动物),包括但不限于人类、非人类灵长动物、啮齿类等。典型地,术语“受试者”和“患者”在提及人类受试者时可以互换地使用。
术语“药用组合物”是指一种呈关于允许活性成分的生物活性有效的这种形式的制剂,并且不包含对于该组合物将给予的受试者而言具有不可接受毒性的额外组分的制剂。这种组合物可以是无菌的。
术语例如“治疗(treating或treatment或to treat)”是指治愈、减慢已诊断的病理状况或病症,减轻已诊断的病理状况或病症的症状,和/或停止诊断的病理状况或病症的进展的预防性或防御性措施。因此,有治疗需要的那些患者包括已经诊断患有或怀疑患有所述病症的那些。预防性(prophylactic或preventative)措施是指预防和/或延缓靶向病理状况或病症的发展的措施。因此,需要预防性(prophylactic或preventative)措施的那些包括具有患病症的倾向的患者和病症有待预防的那些患者。
II.拮抗剂
已发现PDL-1和PD-1的相互作用为T和B细胞提供了至关重要的负共刺激信号。在此描述的方法提供了给予PDL-1/PD-1相互作用的拮抗剂来治疗HPV阴性癌症的方法。PDL-1和PD-1的相互作用的拮抗剂是特异性结合PDL-1和/或PD-1并抑制PDL-1与PD-1相互作用或结合的能力(即PD-1与PDL-1相互作用或结合的能力)的拮抗剂。
特异性结合PD-1或PDL-1并抑制其相互作用的拮抗剂是已知的和/或可以使用本领域中已知的技术容易地被鉴定和制备。在一些实施例中,PDL-1和/或PD-1的拮抗剂增加对HPV阴性癌症的免疫应答。在一些实施例中,PDL-1/PD-1相互作用的拮抗剂是特异性结合PD-1和/或PDL-1的抗体或其抗原结合片段。确认拮抗剂可以抑制PDL-1和PD-1相互作用的方法是已知的。例如,可以用来证明拮抗剂可以抑制PDL-1和PD-1的相互作用的某些测定法披露于WO 2012/145493,将其全文通过引用在此结合。
在此描述的方法还提供了给予PD-1拮抗剂来治疗HPV阴性癌症的方法。在一些实施例中,PD-1拮抗剂抑制PDL-1和PD-1的相互作用。在一些实施例中,PD-1拮抗剂是结合PD-1的抗体或其抗原结合片段。在另外的实施例中,PD-1拮抗剂是包含IgG Fc区的Fc融合蛋白,该IgG Fc区稠合到一个或多个多肽如PDL-1的一部分、scFv、或结合PD-1的合成肽。某些PD-1拮抗剂被披露例如于WO 2012/145493中。
在一些实施例中,PD-1拮抗剂与抗体竞争结合PD-1,该抗体包含具有SEQ ID NO:29中所述序列的VL和具有SEQ ID NO:30中所述序列的VH。在另外的实施例中,PD-1拮抗剂结合至与抗体相同的PD-1的表位,该抗体包含具有SEQ ID NO:29中所述序列的VL和具有SEQ ID NO:30中所述序列的VH。在另外的实施例中,PD-1拮抗剂包括具有在SEQ ID NO:29中所述序列的VL和具有在SEQ ID NO:30中所述序列的VH。
在一些实施例中,PD-1拮抗剂与抗体竞争结合PD-1,该抗体包含具有在SEQ ID NO:31中所述序列的VL和具有在SEQ ID NO:32中所述序列的VH。在另外的实施例中,PD-1拮抗剂结合至与抗体相同的PD-1的表位,该抗体包含具有在SEQ ID NO:31中所述序列的VL和具有在SEQ ID NO:32中所述序列的VH。在另外的实施例中,PD-1拮抗剂包括具有在SEQ ID NO:31中所述序列的VL和具有在SEQ ID NO:32中所述序列的VH。
在一些实施例中,PD-1拮抗剂与抗体竞争结合PD-1,该抗体包含具有在SEQ ID NO:33中所述序列的VL和具有在SEQ ID NO:34中所述序列的VH。在另外的实施例中,PD-1拮抗剂结合至与抗体相同的PD-1的表位,该抗体包含具有在SEQ ID NO:33中所述序列的VL和具有在SEQ ID NO:34中所述序列的VH。在另外的实施例中,PD-1拮抗剂包括具有在SEQ ID NO:33中所述序列的VL和具有在SEQ ID NO:34中所述序列的VH。
在一些实施例中,PD-1拮抗剂与抗体竞争结合PD-1,该抗体包含具有在SEQ ID NO:35-38中任一个所述序列的VL和具有在SEQ ID NO:39-44中任一个所述序列的VH。在另外的实施例中,PD-1拮抗剂结合至与抗体相同的PD-1的表位,该抗体包含具有在SEQ ID NO:35-38中任一个所述序列的VL和具有在SEQ ID NO:39-44中任一个所述序列的VH。在一些实施例中,PD-1拮抗剂包含具有在SEQ ID NO:35-38中任一个所述序列的VL和具有在SEQ ID NO:39-44中任一个所述序列的VH。
在一些实施例中,PD-1拮抗剂包含具有在SEQ ID NO:35中所述序列的VL和具有在SEQ ID NO:39-44中任一个所述序列的VH。在另外的实施例中,PD-1拮抗剂包括具有在SEQ ID NO:35中所述序列的VL和具有在SEQ ID NO:39中所述序列的VH。在另外的实施例中,PD-1拮抗剂包括具有在SEQ ID NO:35中所述序列的VL和具有在SEQ ID NO:40中所述序列的VH。在另外的实施例中,PD-1拮抗剂包括具有在SEQ ID NO:35中所述序列的VL和具有在SEQ ID NO:41中所述序列的VH。在另外的实施例中,PD-1拮抗剂包括具有在SEQ ID NO:35中所述序列的VL和具有在SEQ ID NO:42中所述序列的VH。在另外的实施例中,PD-1拮抗剂包括具有在SEQ ID NO:35中所述序列的VL和具有在SEQ ID NO:43中所述序列的VH。在另外的实施例中,PD-1拮抗剂包括具有在SEQ ID NO:35中所述序列的VL和具有在SEQ ID NO:44中所述序列的VH。
在一些实施例中,PD-1拮抗剂包含具有在SEQ ID NO:36中所述序列的VL和具有在SEQ ID NO:39-44中任一个所述序列的VH。在另外的实施例中,PD-1拮抗剂包括具有在SEQ ID NO:36中所述序列的VL和具有在SEQ ID NO:39中所述序列的VH。在另外的实施例中,PD-1拮抗剂包括具有在SEQ ID NO:36中所述序列的VL和具有在SEQ ID NO:40中所述序列的VH。在另外的实施例中,PD-1拮抗剂包括具有在SEQ ID NO:36中所述序列的VL和具有在SEQ ID NO:41中所述序列的VH。在另外的实施例中,PD-1拮抗剂包括具有在SEQ ID NO:36中所述序列的VL和具有在SEQ ID NO:42中所述序列的VH。在另外的实施例中,PD-1拮抗剂包括具有在SEQ ID NO:36中所述序列的VL和具有在SEQ ID NO:43中所述序列的VH。在另外的实施例中,PD-1拮抗剂包括具有在SEQ ID NO:36中所述序列的VL和具有在SEQ ID NO:44中所述序列的VH。
在一些实施例中,PD-1拮抗剂包含具有在SEQ ID NO:37中所述序列的VL和具有在SEQ ID NO:39-44中任一个所述序列的VH。在另外的实施例中,PD-1拮抗剂包括具有在SEQ ID NO:37中所述序列的VL和具有在SEQ ID NO:39中所述序列的VH。在另外的实施例中,PD-1拮抗剂包括具有在SEQ ID NO:37中所述序列的VL和具有在SEQ ID NO:40中所述序列的VH。在另外的实施例中,PD-1拮抗剂包括具有在SEQ ID NO:37中所述序列的VL和具有在SEQ ID NO:41中所述序列的VH。在另外的实施例中,PD-1拮抗剂包括具有在SEQ ID NO:37中所述序列的VL和具有在SEQ ID NO:42中所述序列的VH。在另外的实施例中,PD-1拮抗剂包括具有在SEQ ID NO:37中所述序列的VL和具有在SEQ ID NO:43中所述序列的VH。在另外的实施例中,PD-1拮抗剂包括具有在SEQ ID NO:37中所述序列的VL和具有在SEQ ID NO:44中所述序列的VH。
在一些实施例中,PD-1拮抗剂包含具有在SEQ ID NO:38中所述序列的VL和具有在SEQ ID NO:39-44中任一个所述序列的VH。在另外的实施例中,PD-1拮抗剂包括具有在SEQ ID NO:38中所述序列的VL和具有在SEQ ID NO:39中所述序列的VH。在另外的实施例中,PD-1拮抗剂包括具有在SEQ ID NO:38中所述序列的VL和具有在SEQ ID NO:40中所述序列的VH。在另外的实施例中,PD-1拮抗剂包括具有在SEQ ID NO:38中所述序列的VL和具有在SEQ ID NO:41中所述序列的VH。在另外的实施例中,PD-1拮抗剂包括具有在SEQ ID NO:38中所述序列的VL和具有在SEQ ID NO:42中所述序列的VH。在另外的实施例中,PD-1拮抗剂包括具有在SEQ ID NO:38中所述序列的VL和具有在SEQ ID NO:43中所述序列的VH。在另外的实施例中,PD-1拮抗剂包括具有在SEQ ID NO:38中所述序列的VL和具有在SEQ ID NO:44中所述序列的VH。
在一些实施例中,PD-1拮抗剂包含具有在SEQ ID NO:35-38中任一个所述序列的VL和具有在SEQ ID NO:39中所述序列的VH。在一些实施例中,PD-1拮抗剂包含具有在SEQ ID NO:35-38中任一个所述序列的VL和具有在SEQ ID NO:40中所述序列的VH。在一些实施例中,PD-1拮抗剂包含具有在SEQ ID NO:35-38中任一个所述序列的VL和具有在SEQ ID NO:41中所述序列的VH。在一些实施例中,PD-1拮抗剂包含具有在SEQ ID NO:35-38中任一个所述序列的VL和具有在SEQ ID NO:42中所述序列的VH。在一些实施例中,PD-1拮抗剂包含具有在SEQ ID NO:35-38中任一个所述序列的VL和具有在SEQ ID NO:43中所述序列的VH。在一些实施例中,PD-1拮抗剂包含具有在SEQ ID NO:35-38中任一个所述序列的VL和具有在SEQ ID NO:44中所述序列的VH。
在另外的实施例中,PD-1拮抗剂与尼鲁单抗(nivolumab)(例如,BMS-936558/MDX-1106/ONO-4538)竞争结合至PD-1。在其他实施例中,PD-1拮抗剂结合至与尼鲁单抗相同的PD-1的表位。在特定实施例中,根据披露的方法使用的PD-1拮抗剂是尼鲁单抗。参见,例如,布拉默(Brahmer)等人,临床肿瘤学杂志(J.Clin.Oncol.)28:3167-3175(2010);以及托帕利安(Topalian)等人,新英格兰医学杂志(N.Engl.J.Med.)28;366(26):2443-54(2012)。
在一些实施例中,PD-1拮抗剂与pidilizumab单抗(例如,CT-011;治疗技术公司(Curetech)/梯瓦制药公司(Teva))竞争结合至PD-1。在另外的实施例中,PD-1拮抗剂结合至与pidilizumab单抗相同的PD-1的表位。在特定实施例中,根据披露的方法使用的PD-1拮抗剂是pidilizumab单抗。参见,例如,伯杰(Berger)等人,临床癌症研究(Clin.Cancer Res.)14:3044-3051(2008)。
在一些实施例中,PD-1拮抗剂与lambrolizumab单抗(例如,MK-3475;默克公司(Merck))竞争结合至PD-1。在另外的实施例中,PD-1拮抗剂结合至与lambrolizumab单抗相同的PD-1的表位。在特定实施例中,根据披露的方法使用的PD-1拮抗剂是lambrolizumab单抗。参见,例如,哈米德(Hamid)等人,新英格兰医学杂志(N.Engl.J.Med.)11369(2):134-44(2013)。
在此描述的方法还提供了给予PDL-1拮抗剂来治疗HPV阴性癌症的方法。在一些实施例中,PDL-1拮抗剂抑制PDL-1和PD-1的相互作用。在一些实施例中,PDL-1拮抗剂是结合PDL-1的抗体或其抗原结合片段。在另外的实施例中,PDL-1拮抗剂是包含IgG Fc区的Fc融合蛋白,该IgG Fc区稠合到一个或多个多肽如PD-1的一部分、scFv、或结合PDL-1的合成肽。
在一些实施例中,PDL-1拮抗剂与MEDI4736(米迪缪尼有限公司(MedImmune)/阿斯利康有限公司(AstraZeneca))竞争结合至PDL-1。在另外的实施例中,PDL-1拮抗剂结合至与MEDI4736相同的PDL-1的表位。在特定实施例中,根据所披露的方法使用的PDL-1拮抗剂是MEDI4736。
例如,某些其他PDL-1拮抗剂被披露于WO 2012/145493中。
在一些实施例中,PDL-1拮抗剂与抗体竞争结合PDL-1,该抗体包含具有在SEQ ID NO:9中所述序列的VL和具有在SEQ ID NO:10中所述序列的VH。在另外的实施例中,PDL-1拮抗剂结合至与抗体相同的PDL-1的表位,该抗体包含具有在SEQ ID NO:9中所述序列的VL和具有在SEQ ID NO:10中所述序列的VH。在另外的实施例中,PDL-1拮抗剂包括具有在SEQ ID NO:9中所述序列的VL和具有在SEQ ID NO:10中所述序列的VH。
在一些实施例中,PDL-1拮抗剂与抗体竞争结合PDL-1,该抗体包含具有在SEQ ID NO:11中所述序列的VL和具有在SEQ ID NO:12中所述序列的VH。在另外的实施例中,PDL-1拮抗剂结合至与抗体相同的PDL-1的表位,该抗体包含具有在SEQ ID NO:11中所述序列的VL和具有在SEQ ID NO:12中所述序列的VH。在另外的实施例中,PDL-1拮抗剂包括具有在SEQ ID NO:11中所述序列的VL和具有在SEQ ID NO:12中所述序列的VH。
在一些实施例中,PDL-1拮抗剂与抗体竞争结合PDL-1,该抗体包含具有在SEQ ID NO:13中所述序列的VL和具有在SEQ ID NO:14中所述序列的VH。在另外的实施例中,PDL-1拮抗剂结合至与抗体相同的PDL-1的表位,该抗体包含具有在SEQ ID NO:13中所述序列的VL和具有在SEQ ID NO:14中所述序列的VH。在另外的实施例中,PDL-1拮抗剂包括具有在SEQ ID NO:13中所述序列的VL和具有在SEQ ID NO:14中所述序列的VH。
在一些实施例中,PDL-1拮抗剂与抗体竞争结合PDL-1,该抗体包含具有在SEQ ID NO:15中所述序列的VL和具有在SEQ ID NO:16中所述序列的VH。在另外的实施例中,PDL-1拮抗剂结合至与抗体相同的PDL-1的表位,该抗体包含具有在SEQ ID NO:15中所述序列的VL和具有在SEQ ID NO:16中所述序列的VH。在另外的实施例中,PDL-1拮抗剂包括具有在SEQ ID NO:15中所述序列的VL和具有在SEQ ID NO:16中所述序列的VH。
在一些实施例中,PDL-1拮抗剂与抗体竞争结合PDL-1,该抗体包含具有在SEQ ID NO:45中所述序列的VL和具有在SEQ ID NO:46中所述序列的VH。在另外的实施例中,PDL-1拮抗剂结合至与抗体相同的PDL-1的表位,该抗体包含具有在SEQ ID NO:45中所述序列的VL和具有在SEQ ID NO:46中所述序列的VH。在另外的实施例中,PDL-1拮抗剂包括具有在SEQ ID NO:45中所述序列的VL和具有在SEQ ID NO:46中所述序列的VH。
在一些实施例中,PDL-1拮抗剂与抗体竞争结合PDL-1,该抗体包含具有在SEQ ID NO:17-22中任一个所述序列的VL和具有在SEQ ID NO:23-28中任一个所述序列的VH。在另外的实施例中,PDL-1拮抗剂结合至与抗体相同的PDL-1的表位,该抗体包含具有在SEQ ID NO:17-22中任一个所述序列的VL和具有在SEQ ID NO:23-28中任一个所述序列的VH。在一些实施例中,PDL-1拮抗剂包含具有在SEQ ID NO:17-22中任一个所述序列的VL和具有在SEQ ID NO:23-28中任一个所述序列的VH。
在一些实施例中,PDL-1拮抗剂包含具有在SEQ ID NO:17中所述序列的VL和具有在SEQ ID NO:23-28中任一个所述序列的VH。在一些实施例中,PDL-1拮抗剂包括具有在SEQ ID NO:17中所述序列的VL和具有在SEQ ID NO:23中所述序列的VH。在一些实施例中,PDL-1拮抗剂包括具有在SEQ ID NO:17中所述序列的VL和具有在SEQ ID NO:24中所述序列的VH。在一些实施例中,PDL-1拮抗剂包括具有在SEQ ID NO:17中所述序列的VL和具有在SEQ ID NO:25中所述序列的VH。在一些实施例中,PDL-1拮抗剂包括具有在SEQ ID NO:17中所述序列的VL和具有在SEQ ID NO:26中所述序列的VH。在一些实施例中,PDL-1拮抗剂包括具有在SEQ ID NO:17中所述序列的VL和具有在SEQ ID NO:27中所述序列的VH。在一些实施例中,PDL-1拮抗剂包括具有在SEQ ID NO:17中所述序列的VL和具有在SEQ ID NO:28中所述序列的VH。
在一些实施例中,PDL-1拮抗剂包含具有在SEQ ID NO:18中所述序列的VL和具有在SEQ ID NO:23-28中任一个所述序列的VH。在一些实施例中,PDL-1拮抗剂包括具有在SEQ ID NO:18中所述序列的VL和具有在SEQ ID NO:23中所述序列的VH。在一些实施例中,PDL-1拮抗剂包括具有在SEQ ID NO:18中所述序列的VL和具有在SEQ ID NO:24中所述序列的VH。在一些实施例中,PDL-1拮抗剂包括具有在SEQ ID NO:18中所述序列的VL和具有在SEQ ID NO:25中所述序列的VH。在一些实施例中,PDL-1拮抗剂包括具有在SEQ ID NO:18中所述序列的VL和具有在SEQ ID NO:26中所述序列的VH。在一些实施例中,PDL-1拮抗剂包括具有在SEQ ID NO:18中所述序列的VL和具有在SEQ ID NO:27中所述序列的VH。在一些实施例中,PDL-1拮抗剂包括具有在SEQ ID NO:18中所述序列的VL和具有在SEQ ID NO:28中所述序列的VH。
在一些实施例中,PDL-1拮抗剂包含具有在SEQ ID NO:19中所述序列的VL和具有在SEQ ID NO:23-28中任一个所述序列的VH。在一些实施例中,PDL-1拮抗剂包括具有在SEQ ID NO:19中所述序列的VL和具有在SEQ ID NO:23中所述序列的VH。在一些实施例中,PDL-1拮抗剂包括具有在SEQ ID NO:19中所述序列的VL和具有在SEQ ID NO:24中所述序列的VH。在一些实施例中,PDL-1拮抗剂包括具有在SEQ ID NO:19中所述序列的VL和具有在SEQ ID NO:25中所述序列的VH。在一些实施例中,PDL-1拮抗剂包括具有在SEQ ID NO:19中所述序列的VL和具有在SEQ ID NO:26中所述序列的VH。在一些实施例中,PDL-1拮抗剂包括具有在SEQ ID NO:19中所述序列的VL和具有在SEQ ID NO:27中所述序列的VH。在一些实施例中,PDL-1拮抗剂包括具有在SEQ ID NO:19中所述序列的VL和具有在SEQ ID NO:28中所述序列的VH。
在一些实施例中,PDL-1拮抗剂包含具有在SEQ ID NO:20中所述序列的VL和具有在SEQ ID NO:23-28中任一个所述序列的VH。在一些实施例中,PDL-1拮抗剂包括具有在SEQ ID NO:20中所述序列的VL和具有在SEQ ID NO:23中所述序列的VH。在一些实施例中,PDL-1拮抗剂包括具有在SEQ ID NO:20中所述序列的VL和具有在SEQ ID NO:24中所述序列的VH。在一些实施例中,PDL-1拮抗剂包括具有在SEQ ID NO:20中所述序列的VL和具有在SEQ ID NO:25中所述序列的VH。在一些实施例中,PDL-1拮抗剂包括具有在SEQ ID NO:20中所述序列的VL和具有在SEQ ID NO:26中所述序列的VH。在一些实施例中,PDL-1拮抗剂包括具有在SEQ ID NO:20中所述序列的VL和具有在SEQ ID NO:27中所述序列的VH。在一些实施例中,PDL-1拮抗剂包括具有在SEQ ID NO:20中所述序列的VL和具有在SEQ ID NO:28中所述序列的VH。
在一些实施例中,PDL-1拮抗剂包含具有在SEQ ID NO:21中所述序列的VL和具有在SEQ ID NO:23-28中任一个所述序列的VH。在一些实施例中,PDL-1拮抗剂包括具有在SEQ ID NO:21中所述序列的VL和具有在SEQ ID NO:23中所述序列的VH。在一些实施例中,PDL-1拮抗剂包括具有在SEQ ID NO:21中所述序列的VL和具有在SEQ ID NO:24中所述序列的VH。在一些实施例中,PDL-1拮抗剂包括具有在SEQ ID NO:21中所述序列的VL和具有在SEQ ID NO:25中所述序列的VH。在一些实施例中,PDL-1拮抗剂包括具有在SEQ ID NO:21中所述序列的VL和具有在SEQ ID NO:26中所述序列的VH。在一些实施例中,PDL-1拮抗剂包括具有在SEQ ID NO:21中所述序列的VL和具有在SEQ ID NO:27中所述序列的VH。在一些实施例中,PDL-1拮抗剂包括具有在SEQ ID NO:21中所述序列的VL和具有在SEQ ID NO:28中所述序列的VH。
在一些实施例中,PDL-1拮抗剂包含具有在SEQ ID NO:22中所述序列的VL和具有在SEQ ID NO:23-28中任一个所述序列的VH。在一些实施例中,PDL-1拮抗剂包括具有在SEQ ID NO:22中所述序列的VL和具有在SEQ ID NO:23中所述序列的VH。在一些实施例中,PDL-1拮抗剂包括具有在SEQ ID NO:22中所述序列的VL和具有在SEQ ID NO:24中所述序列的VH。在一些实施例中,PDL-1拮抗剂包括具有在SEQ ID NO:22中所述序列的VL和具有在SEQ ID NO:25中所述序列的VH。在一些实施例中,PDL-1拮抗剂包括具有在SEQ ID NO:22中所述序列的VL和具有在SEQ ID NO:26中所述序列的VH。在一些实施例中,PDL-1拮抗剂包括具有在SEQ ID NO:22中所述序列的VL和具有在SEQ ID NO:27中所述序列的VH。在一些实施例中,PDL-1拮抗剂包括具有在SEQ ID NO:22中所述序列的VL和具有在SEQ ID NO:28中所述序列的VH。
在一些实施例中,PDL-1拮抗剂包含具有在SEQ ID NO:17-22中任一个所述序列的VL和具有在SEQ ID NO:23中所述序列的VH。在一些实施例中,PDL-1拮抗剂包含具有在SEQ ID NO:17-22中任一个所述序列的VL和具有在SEQ ID NO:24中所述序列的VH。在一些实施例中,PDL-1拮抗剂包含具有在SEQ ID NO:17-22中任一个所述序列的VL和具有在SEQ ID NO:25中所述序列的VH。在一些实施例中,PDL-1拮抗剂包含具有在SEQ ID NO:17-22中任一个所述序列的VL和具有在SEQ ID NO:26中所述序列的VH。在一些实施例中,PDL-1拮抗剂包含具有在SEQ ID NO:17-22中任一个所述序列的VL和具有在SEQ ID NO:27中所述序列的VH。在一些实施例中,PDL-1拮抗剂包含具有在SEQ ID NO:17-22中任一个所述序列的VL和具有在SEQ ID NO:28中所述序列的VH。
在另外的实施例中,PDL-1拮抗剂与BMS-936559(阿卡(aka)MDX-1105;百时美施贵宝公司(Bristol-Myers Squibb))竞争结合至PDL-1。在另外的实施例中,PDL-1拮抗剂结合至与BMS-936559相同的PDL-1的表位。在特定实施例中,根据所披露的方法使用的PDL-1拮抗剂是BMS-936559。参见,例如,布拉默(Brahmer)等人,新英格兰医学杂志(N.Engl.J.Med.)366:2455-2465(2012)。
在另外的实施例中,PDL-1拮抗剂与MPDL-3280A(阿卡(aka)Rg7446,基因泰克公司(Genentech)/罗氏制药公司(Roche))竞争结合至PDL-1。在另外的实施例中,PDL-1拮抗剂结合至与MPDL-3280A相同的PDL-1的表位。在特定实施例中,根据所披露的方法使用的PDL-1拮抗剂是MPDL-3280A。参见,例如,陈(Chen)D.,肿瘤学年鉴(Ann Oncol.)24(增刊1):i7(2013)。
III.使用PDL-1/PD-1相互作用的拮抗剂治疗的方法
如在此所证明和描述的,PDL-1/PD-1相互作用的拮抗剂(包括,例如,MEDI4736)是在治疗性治疗方法(包括HPV阴性癌症的治疗)中是有用的。在某些实施例中,拮抗剂可(例如,在体内方法中)用于抑制HPV阴性肿瘤的生长、诱导HPV阴性肿瘤细胞的分化、抑制HPV阴性肿瘤的转移、减少HPV阴性肿瘤体积、和/或降低HPV阴性肿瘤的致肿瘤性。
确定癌症是否是HPV阳性或HPV阴性的方法是已知的。
在一些实施例中,HPV阴性癌症是头颈部鳞状细胞癌(SCCHN)。
在某些方面中,呈现患有HPV阴性癌症的患者被给予PDL-1/PD-1相互作用的拮抗剂,例如,抗PDL-1抗体或其抗原结合片段(例如,MEDI4736或其抗原结合片段)或抗PD-1抗体或其抗原结合片段。PDL-1/PD-1相互作用的拮抗剂,例如,抗PDL-1抗体或其抗原结合片段(例如,MEDI4736或其抗原结合片段)或抗PD-1抗体或其抗原结合片段可仅给予一次或在仍然为患者提供益处时偶尔给予。在另外的方面中,该患者被给予另外的后继剂量。可以取决于该患者的年龄、体重、临床评价、肿瘤负荷和/或其他因素(包括主治医生的判断),在不同时间间隔下给予后续剂量。
剂量之间的间隔可以是每两周。剂量之间的间隔可以是每三周。剂量之间的间隔可以是每两个月(例如,在维持阶段过程中)。
给药间隔还可以是约每14天或约每21天。在一些实施例中,“约”每14天或“约”每21天指示14天+/-2天或21天+/-2天。在一些实施例中,PDL-1/PD-1相互作用的拮抗剂(例如,抗PDL-1抗体或其抗原结合片段(如MEDI4736或其抗原结合片段)或抗PD-1抗体或其抗原结合片段)的给予是大约每14天至21天。
在一些实施例中,向患者给予至少两个剂量的PDL-1/PD-1相互作用的拮抗剂,例如抗PDL-1抗体或其抗原结合片段(如MEDI4736或其抗原结合片段)或抗PD-1抗体或其抗原结合片段。在一些实施例中,可以向该患者给予至少三个剂量、至少四个剂量、至少五个剂量、至少六个剂量、至少七个剂量、至少八个剂量、至少九个剂量、至少十个剂量或至少十五个剂量或更多。在一些实施例中,在两周治疗周期内、在四周治疗周期内、在六周治疗周期内、在八周治疗周期内、在十二周治疗周期内、在二十四周治疗周期内或在一年或更长治疗周期内给予PDL-1/PD-1相互作用的拮抗剂,例如抗PDL-1抗体或其抗原结合片段(如MEDI4736或其抗原结合片段)或抗PD-1抗体或其抗原结合片段。在一些实施例中,在三周治疗周期内、在六周治疗周期内、在九周治疗周期内、在十二周治疗周期内、在二十四周治疗周期内、或在一年或更长治疗周期内给予PDL-1/PD-1相互作用的拮抗剂,例如抗PDL-1抗体或其抗原结合片段(如MEDI4736或其抗原结合片段)或抗PD-1抗体或其抗原结合片段。在一些实施例中,在两个月治疗周期内、在四个月治疗周期内、在六个月或更长治疗周期内(如在维持阶段期间内)给予PDL-1/PD-1相互作用的拮抗剂,例如抗PDL-1抗体或其抗原结合片段(如MEDI4736或其抗原结合片段)或抗PD-1抗体或其抗原结合片段。
向患者给予的PDL-1/PD-1相互作用的拮抗剂,例如抗PDL-1抗体或其抗原结合片段(如MEDI4736或其抗原结合片段)或抗PD-1抗体或其抗原结合片段的量将取决于各种参数,例如患者的年龄、体重、临床评估、肿瘤负荷和/或其他因素,包括主治医师的判断。
在某些方面中,该患者被给予一个或多个剂量的PDL-1/PD-1相互作用的拮抗剂,例如抗PDL-1抗体或其抗原结合片段(如MEDI4736或其抗原结合片段)或抗PD-1抗体或其抗原结合片段,其中该剂量为约0.1mg/kg。在某些方面中,该患者被给予一个或多个剂量的PDL-1/PD-1相互作用的拮抗剂,例如抗PDL-1抗体或其抗原结合片段(如MEDI4736或其抗原结合片段)或抗PD-1抗体或其抗原结合片段,其中该剂量为约0.3mg/kg。在某些方面中,该患者被给予一个或多个剂量的PDL-1/PD-1相互作用的拮抗剂,例如抗PDL-1抗体或其抗原结合片段(如MEDI4736或其抗原结合片段)或抗PD-1抗体或其抗原结合片段,其中该剂量为约1mg/kg。在某些方面中,该患者被给予一个或多个剂量的PDL-1/PD-1相互作用的拮抗剂,例如抗PDL-1抗体或其抗原结合片段(如MEDI4736或其抗原结合片段)或抗PD-1抗体或其抗原结合片段,其中该剂量为约3mg/kg。在某些方面中,该患者被给予一个或多个剂量的PDL-1/PD-1相互作用的拮抗剂,例如抗PDL-1抗体或其抗原结合片段(如MEDI4736或其抗原结合片段)或抗PD-1抗体或其抗原结合片段,其中该剂量为约10mg/kg。在某些方面中,该患者被给予一个或多个剂量的PDL-1/PD-1相互作用的拮抗剂,例如抗PDL-1抗体或其抗原结合片段(如MEDI4736或其抗原结合片段)或抗PD-1抗体或其抗原结合片段,其中该剂量为约15mg/kg。
在某些方面中,该患者被给予至少两个剂量的PDL-1/PD-1相互作用的拮抗剂,例如抗PDL-1抗体或其抗原结合片段(如MEDI4736或其抗原结合片段)或抗PD-1抗体或其抗原结合片段,其中该剂量为约0.1mg/kg。在某些方面中,该患者被给予至少两个剂量的PDL-1/PD-1相互作用的拮抗剂,例如抗PDL-1抗体或其抗原结合片段(如MEDI4736或其抗原结合片段)或抗PD-1抗体或其抗原结合片段,其中该剂量为约0.3mg/kg。在某些方面中,该患者被给予至少两个剂量的PDL-1/PD-1相互作用的拮抗剂,例如抗PDL-1抗体或其抗原结合片段(如MEDI4736或其抗原结合片段)或抗PD-1抗体或其抗原结合片段,其中该剂量为约1mg/kg。在某些方面中,该患者被给予至少两个剂量的PDL-1/PD-1相互作用的拮抗剂,例如抗PDL-1抗体或其抗原结合片段(如MEDI4736或其抗原结合片段)或抗PD-1抗体或其抗原结合片段,其中该剂量为约3mg/kg。在某些方面中,该患者被给予至少两个剂量的PDL-1/PD-1相互作用的拮抗剂,例如抗PDL-1抗体或其抗原结合片段(如MEDI4736或其抗原结合片段)或抗PD-1抗体或其抗原结合片段,其中该剂量为约10mg/kg。在某些方面中,该患者被给予至少两个剂量的PDL-1/PD-1相互作用的拮抗剂,例如抗PDL-1抗体或其抗原结合片段(如MEDI4736或其抗原结合片段)或抗PD-1抗体或其抗原结合片段,其中该剂量为约15mg/kg。在一些实施例中,相隔约两周给予该至少两个剂量。在一些实施例中,相隔约三周给予该至少两个剂量。
在某些方面中,该患者被给予至少三个剂量的PDL-1/PD-1相互作用的拮抗剂,例如抗PDL-1抗体或其抗原结合片段(如MEDI4736或其抗原结合片段)或抗PD-1抗体或其抗原结合片段,其中该剂量为约0.1mg/kg。在某些方面中,该患者被给予至少三个剂量的PDL-1/PD-1相互作用的拮抗剂,例如抗PDL-1抗体或其抗原结合片段(如MEDI4736或其抗原结合片段)或抗PD-1抗体或其抗原结合片段,其中该剂量为约0.3mg/kg。在某些方面中,该患者被给予至少三个剂量的PDL-1/PD-1相互作用的拮抗剂,例如抗PDL-1抗体或其抗原结合片段(如MEDI4736或其抗原结合片段)或抗PD-1抗体或其抗原结合片段,其中该剂量为约1mg/kg。在某些方面中,该患者被给予至少三个剂量的PDL-1/PD-1相互作用的拮抗剂,例如抗PDL-1抗体或其抗原结合片段(如MEDI4736或其抗原结合片段)或抗PD-1抗体或其抗原结合片段,其中该剂量为约3mg/kg。在某些方面中,该患者被给予至少三个剂量的PDL-1/PD-1相互作用的拮抗剂,例如抗PDL-1抗体或其抗原结合片段(如MEDI4736或其抗原结合片段)或抗PD-1抗体或其抗原结合片段,其中该剂量为约10mg/kg。在某些方面中,该患者被给予至少三个剂量的PDL-1/PD-1相互作用的拮抗剂,例如抗PDL-1抗体或其抗原结合片段(如MEDI4736或其抗原结合片段)或抗PD-1抗体或其抗原结合片段,其中该剂量为约15mg/kg。在一些实施例中,相隔约两周给予该至少三个剂量。在一些实施例中,相隔约三周给予该至少三个剂量。
在某些方面中,根据在此提供的方法,PDL-1/PD-1相互作用的拮抗剂(例如,抗PDL-1抗体或其抗原结合片段(如MEDI4736或其抗原结合片段)或抗PD-1抗体或其抗原结合片段)的给予是通过肠胃外给药。例如,PDL-1/PD-1相互作用的拮抗剂,例如,抗PDL-1抗体或其抗原结合片段(如MEDI4736或其抗原结合片段)或抗PD-1抗体或其抗原结合片段可通过静脉内输注或通过皮下注射来给予。在一些实施例中,该给予是通过静脉内输注。
在某些方面中,根据在此提供的方法,PDL-1/PD-1相互作用的拮抗剂(例如,抗PDL-1抗体或其抗原结合片段(如MEDI4736或其抗原结合片段)或抗PD-1抗体或其抗原结合片段)是与另外的癌症疗法组合或结合给予的。此类疗法包括,但不限于化学治疗剂如威罗菲尼、埃罗替尼、阿法替尼、西妥昔单抗、卡铂、贝伐单抗、埃罗替尼或培美曲塞或其他化学治疗剂,以及辐射或任何其他抗癌治疗。
在此提供的这些方法可以减小肿瘤尺寸、延迟肿瘤生长或维持稳定状态。在某些方面中,基于适当的统计分析,该肿瘤尺寸的减小可以是显著的。可以通过与基线处的患者肿瘤的尺寸、针对预期的肿瘤尺寸、针对基于大的患者群体的预期的肿瘤尺寸或针对对照群体的肿瘤尺寸进行比较来测量肿瘤尺寸的减小。在本文提供的某些方面,PDL-1/PD-1相互作用的拮抗剂(例如,抗PDL-1抗体或其抗原结合片段(如MEDI4736或其抗原结合片段)或抗PD-1抗体或其抗原结合片段)的给予可以使肿瘤尺寸减小至少25%。在本文提供的某些方面,PDL-1/PD-1相互作用的拮抗剂(例如,抗PDL-1抗体或其抗原结合片段(如MEDI4736或其抗原结合片段)或抗PD-1抗体或其抗原结合片段)的给予可以在第一次治疗的约6周内使肿瘤尺寸减小至少25%。在本文提供的某些方面,PDL-1/PD-1相互作用的拮抗剂(例如,抗PDL-1抗体或其抗原结合片段(如MEDI4736或其抗原结合片段)或抗PD-1抗体或其抗原结合片段)的给予可以在第一次治疗的约12周内使肿瘤尺寸减小至少25%。在本文提供的某些方面,PDL-1/PD-1相互作用的拮抗剂(例如,抗PDL-1抗体或其抗原结合片段(如MEDI4736或其抗原结合片段)或抗PD-1抗体或其抗原结合片段)的给予可以在第一次治疗的约18周内使肿瘤尺寸减小至少25%。
在某些方面中,使用在此提供的这些方法,即,给予PDL-1/PD-1相互作用的拮抗剂(例如,抗PDL-1抗体或其抗原结合片段(如MEDI4736或其抗原结合片段)或抗PD-1抗体或其抗原结合片段)可以在第一次治疗的6周内、7周内、8周内、9周内、10周内、12周内、16周内、20周内、24周内、28周内、32周内、36周内、40周内、44周内、48周内或52周内使肿瘤尺寸减小。
在此提供的这些方法可以减弱或延迟肿瘤生长。在一些方面中,该减小或延迟可以是统计学上显著的。可以通过与基线处的患者肿瘤的生长、针对预期的肿瘤生长、针对基于大的患者群体的预期的肿瘤生长或针对对照群体的肿瘤生长进行比较来测量肿瘤生长的减少。
在某些方面中,患者实现了疾病控制(DC)。疾病控制可以是完全应答(CR)、部分应答(PR)或稳定疾病(SD)。
“完全应答”(CR)是指所有病灶消失,无论可测量的或不可测量的,并且没有新的病灶。可以使用自第一次记载之日起不小于四周的重复连续评价来获得确认。新的不可测量的病灶排除CR。
“部分应答”(PR)是指相对于基线,肿瘤负荷减小≥50%。可以使用自第一次记载之日起至少4周的连续重复评价来获得确认。
“进展性疾病”(PD)是指相对于所记录的最小值(最低点),肿瘤负荷增加≥25%。可以通过自第一次记载之日起至少4周的连续重复评价来获得确认。新的不可测量的病灶没有定义PD。
“稳定疾病”(SD)是指不满足CR、PR或PD的标准。
在某些方面中,PDL-1/PD-1相互作用的拮抗剂(例如,抗PDL-1抗体或其抗原结合片段(如MEDI4736或其抗原结合片段)或抗PD-1抗体或其抗原结合片段)的给予可增加无进展存活期(PFS)。
在某些方面中,PDL-1/PD-1相互作用的拮抗剂(例如,抗PDL-1抗体或其抗原结合片段(如MEDI4736或其抗原结合片段)或抗PD-1抗体或其抗原结合片段)的给予可增加总体存活期(OS)。
在一些实施例中,该患者先前已经接受了用至少一种化学治疗剂进行的治疗。在一些实施例中,该患者先前已经接受了用至少两种化学治疗剂进行的治疗。该化学治疗剂可以是例如并且不限于威罗菲尼、埃罗替尼、阿法替尼、西妥昔单抗、卡铂、贝伐单抗、埃罗替尼和/或培美曲塞。
在一些实施例中,该肿瘤是至少一种化学治疗剂难治愈的或该肿瘤对至少一种化学治疗剂有抗性。在一些实施例中,该肿瘤是至少两种化学治疗剂难治愈的或该肿瘤对至少两种化学治疗剂有抗性。该肿瘤可能是以下各项中的一种或多种难治愈的或该肿瘤对以下各项中的一种或多种有抗性:例如并且不限于威罗菲尼、埃罗替尼、阿法替尼、西妥昔单抗、卡铂、贝伐单抗、埃罗替尼和/或培美曲塞。
在一些实施例中,在给予MEDI4736或其抗原结合片段之前,该患者具有0或1的东部肿瘤协作组(ECOG)(奥肯(Oken)MM等人,美国临床肿瘤学杂志,5:649-55(1982))行为状态。
在一些实施例中,在给予MEDI4736或其抗原结合片段之前,该患者具有0或1的东部肿瘤协作组(ECOG)(奥肯(Oken)MM等人,美国临床肿瘤学杂志,5:649-55(1982))行为状态。
如在此所讨论的,在一些实施例中,PDL-1/PD-1相互作用的拮抗剂是MEDI4736或其抗原结合片段。在一些实施例中,给予MEDI4736或其抗原结合片段可以产生希望的药物代谢动力学参数。可以使用“曲线下面积”(AUC)来评估总药物暴露。“AUC(τ)”是指直到给药周期结束的AUC,而“AUC(inf)”是指直到无穷时间的AUC。该给予可以产生约100至约2,500d·μg/mL的AUC(τ)。该给予可以产生约15μg/mL至约350μg/mL的观察到的最大浓度(Cmax)。MEDI4736或其抗原结合片段的半衰期可以是约5天至约25天。另外,MEDI4736或其抗原结合片段的清除率可以是约1-10毫升/天/千克。
如在此所讨论的,在一些实施例中,PDL-1/PD-1相互作用的拮抗剂是抗PDL-1抗体或其抗原结合片段(如MEDI4736或其抗原结合片段)。在一些实施例中,抗PDL-1抗体或其抗原结合片段(例如MEDI4736或其抗原结合片段)的给予可以使游离PDL-1水平降低。游离PDL-1是指没有结合的PDL-1(例如,通过MEDI4736)。在一些实施例中,PDL-1水平被降低至少80%。在一些实施例中,PDL-1水平被降低至少90%。在一些实施例中,PDL-1水平被降低至少95%。在一些实施例中,PDL-1水平被降低至少99%。在一些实施例中,在给予抗PDL-1抗体或其抗原结合片段(如MEDI4736或其抗原结合片段)后,PDL-1水平被消除。在一些实施例中,例如与给予抗PDL-1抗体或其抗原结合片段(如MEDI4736或其抗原结合片段)之前的PDL-1水平的增长率相比,给予抗PDL-1抗体或其抗原结合片段(如MEDI4736或其抗原结合片段)使PDL-1水平的增长率减小。
实例
实例1:患者与方法
(a)受试者
本研究中的受试者被要求是18周岁或更年长的,患有标准疗法难治愈或对此不存在标准疗法的晚期恶性黑色素瘤、肾细胞癌(RCC)、非小细胞肺癌(NSCLC)或结肠直肠癌(CRC)。在研究的剂量-扩展阶段中的受试者将是患有标准疗法难治愈或对此不存在标准疗法的晚期恶性黑色素瘤、NSCLC或CRC的成年人。在剂量-扩展阶段中的另外受试者患有NSCLC(鳞状细胞癌)、肝细胞癌(HCC)、三阴性乳癌(TNBC)、胰腺癌、GI癌、黑色素瘤、葡萄膜黑色素瘤或头颈部鳞状细胞癌(SCCHN)。这些癌症必须被组织学上或细胞学上确认。这些受试者被要求具有0或1的东部肿瘤协作组(ECOG)状态以及适当的器官和骨髓功能。适当的器官和骨髓功能被定义为:血红蛋白≥9g/dL;绝对嗜中性白细胞计数≥1,500/mm3;淋巴细胞计数≥800/mm3;血小板计数≥100,000/mm3;天冬氨酸转氨酶(AST)和丙氨酸转氨酶(ALT)≤2.5×惯例的正常值上限(ULN);胆红素≤1.5×ULN,除了在受试者患有记载的或猜想的吉耳伯氏病(Gilbert’s disease)的情况下(对于这些受试者,胆红素必须≤5×ULN);如通过Cockcroft-Gault方程或通过24小时尿收集用于确定肌酸酐清除率所确定,肌酸酐清除率≥50mL/min。
如果受试者具有活动性自身免疫疾病、先前抗PD-1或抗PDL-1疗法或先前严重或持续的免疫相关不良事件(irAE),他们不能参与。受试者不容许对于癌症治疗具有任何同时的化学疗法、免疫疗法、生物或激素疗法,但允许对于非癌症相关的病状同时使用激素(例如,对于糖尿病和激素替代疗法使用胰岛素)。
(b)研究设计
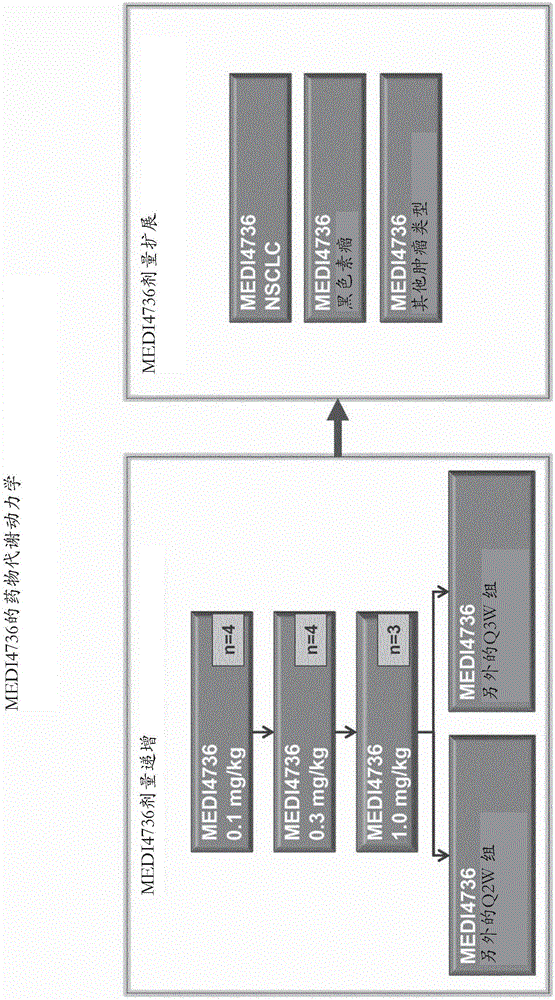
该研究是多中心、开放标记、1期、首次在人体内的剂量-递增和剂量-扩展研究,其中通过向癌症患者静脉内(IV)输注来给予多个剂量的MEDI4736。以0.1mg/kg、0.3mg/kg、1mg/kg、3mg/kg、10mg/kg和15mg/kg剂量给予MEDI4736。研究流程图被示于图1中。给药的第一天被认为是第1天,并且疾病评价发生在6周、12周和16周之后,并且然后每8周进行疾病评价。
使用0.1mg/kg、0.3mg/kg、1mg/kg、3mg/kg和10mg/kg剂量的给药,每2周(Q2W)(+/-2天)向不同组给予来进行剂量-递增。
通过在15mg/kg下每3周(Q3W)给予来进行单独的剂量-递增。然后使用在该剂量-递增中鉴定的最大耐受剂量(MTD)或最佳生物剂量(OBD)来进行扩展阶段。
剂量递增
在该剂量-递增阶段中,作为在4小时内给出的0.1mg/kg输注,向第一组中的所有受试者给予第一次剂量的MEDI4736。在60分钟内Q2W给出第一组的随后输注(第二次剂量和第三次剂量等)。随后组的剂量是作为60分钟IV输注Q2W给予的0.3mg/kg、1.0mg/kg、3.0mg/kg或10mg/kg。对于初始的剂量递增的剂量组的概述被提供于以下表1中。还在Q3W下给予15mg/kg的另外剂量。
表1:Q2W给药方案
随着Q2W剂量递增方案中的所有组完成,开始使用Q3W方案的单独剂量递增,并且基于可获得的安全性、PK/药物代谢动力学和临床数据进行高达15mg/kg Q3W的剂量给予。Q3W递增中的起始剂量是对于最佳生物剂量(OBD)(或如果没有鉴定OBD,则是所测试的最高剂量)的等效给药率(以平均毫克/千克/周计)。
该剂量-递增阶段中的受试者继续治疗直到确认的PD、替代癌症疗法开始、不可接受的毒性或其他中断治疗的原因出现。在实现确认的疾病控制(DC)的那些受试者中,治疗可以继续直到DC确认之日之后的6个月。DC将包括具有3个月或更多个月持续时间的稳定疾病(SD)、部分应答(PR)和完全应答(CR)。
剂量扩展
在Q2W和Q3W下完成剂量递增之后,选择用于该扩展阶段的剂量方案。登记在剂量扩展组中的受试者将接受最大耐受剂量(MTD)、最佳生物剂量(OBD)或如果没有确定MTD或OBD则在剂量递增过程中评估的最高剂量下的MEDI4736,该MEDI4736作为选择的剂量和频率下的IV输注给出。实现疾病控制(DC)的受试者将继续治疗并且然后进入维持周期。在维持周期过程中的任何时间下出现进展性疾病(PD)迹象时,将作为IV输注重新给予MEDI4736直到出现确认的PD或其他中断MEDI4736的原因。
维持周期
在该递增或扩展阶段过程中实现疾病控制(DC)的受试者进入维持周期,在该维持周期中治疗可以继续直到DC确认之日之后的六个月。
在维持周期过程中,每2个月作为IV输注给予MEDI4736持续6个月。在第2个月、第4个月和第6个月时将进行受试者的体格检查。在每2个月给药的6个月周期之后,中断MEDI4736。在出现进展性疾病(PD)迹象时,在Q2W或Q3W时间表下作为IV输注重新给予MEDI4736直到确认的PD、替代癌症疗法开始、不可接受的毒性、知情同意书撤回或其他中断治疗的原因出现,持续最长2年。
(c)药物代谢动力学、抗肿瘤和安全性评价
在Q2W剂量-递增阶段过程中使用验证的免疫测定来进行血清中的MEDI4736浓度的测量。在Q2W剂量-递增阶段过程中,根据以下时间表收集用于药物代谢动力学评价以及用于可溶性PDL-1(sPDL-1)浓度的血液样品:
·第一次剂量:第1天给药前、输注结束(EOI)和在EOI之后3小时、以及第2天、第3天、第5天和第10天(+/-1天)。在第一次研究受试者的初始4小时输注过程中取得在输注开始之后2小时处的另外样品。
·第二次剂量:给药前、EOI、EOI之后3小时、以及第8天。
·随后的仅偶数次剂量:给药前和EOI。
·在中断或最后一次剂量时,应该在最后一次剂量之后14天、30天、2个月和3个月时抽取药物代谢动力学(PK)样品。
对于Q3W给药,在与Q2W给药相同的时间表下进行药物代谢动力学评价,除了还在第一次剂量之后第15天时收集血液样品之外。在该剂量-扩展阶段过程中,每两个月进行药物代谢动力学评价(第1天给药前和EOI)。另外,在中断或最后一次剂量时,在最后一次剂量之后14天、30天、2个月和3个月时抽取药物代谢动力学(PK)样品。在维持阶段过程中,在第14天和第30天(+/-3天)并且在第2个月、第4个月和第6个月(+/-1周)时进行sPDL-1的药物代谢动力学评价和评估。
在第1天(输注前)并且在Q2W剂量-递增阶段过程中的剂量2之后的所有剂量下评价(并且将继续评价)抗药物抗体(ADA)的存在。将根据与Q3W剂量-递增和剂量-扩展阶段中相同的时间表评价ADA。在维持阶段过程中,将在第6个月(+/-1周)时评价ADA。
在Q2W剂量-递增阶段中,在筛选(第-28天至第-1天)过程中和在第7周时进行(并且将继续进行)肿瘤评价。用与Q3W剂量-递增阶段和剂量-扩展阶段中相同的时间安排进行肿瘤评价。肿瘤评价可以包括以下评估:体格检查(如果适用的话使用皮肤病灶的照片和测量值)、胸、腹和骨盆的CT或MRI扫描以及大脑的CT或MRI扫描。仅在筛选时或如果受试者是神经学症状的话,进行大脑的计算机断层摄影术或MRI扫描。在维持阶段过程中,在第2个月、第4个月和第6个月(+/-1周)时进行肿瘤评价。
在扩展阶段过程中,还在筛选(第-28天至第-1天)过程中和在第7周时进行肿瘤活组织检查。
抗肿瘤活性的评价是基于免疫相关客观应答率(ORR)、免疫相关疾病控制率(DCR)、免疫相关应答持续时间(DR)、免疫相关无进展存活期(PFS)以及总体存活期(OS)。免疫相关应答标准(吴克(Wolchok)等人,临床癌症研究(Clin Cancer Res.)15:7412-20(2009))被用来确定肿瘤应答。
该ORR被定义为具有确认的完全应答(CR)或确认的部分应答(PR)的受试者比例。确认的应答是在初始记载应答之后持续重复成像研究≥4周的那些。该DCR被定义为具有CR、PR或稳定疾病(SD)的受试者比例(实现SD的受试者如果他们维持SD≥3个月将被包括在该DCR中)。使用确切概率法来评估ORR和DCR的95%置信区间(CI)。该应答持续时间(DR)是从第一次记载客观应答到第一次记载疾病进展的持续时间。从用MEDI4736治疗开始直到记载由于任何原因引起的确认的免疫相关疾病进展或死亡(无论何者首先出现)来测量无进展存活期(PFS)。总体存活期(OS)是从用MEDI4736治疗开始直到死亡的时间。
在给予MEDI4736之后监测不良事件。其他评价包括体格检查、生命体征监测和实验室测量。
实例2:结果
(a)登记和基线特征
在Q2W剂量-递增阶段中给予0.1mg/kg、0.3mg/kg或1mg/kgMEDI4736的受试者的基线特征被提供于以下表2中。
表2:用于Q2W给药的人口统计
(b)药物代谢动力学
由在Q2W剂量-递增阶段中以0.1mg/kg和0.3mg/kg给予MEDI4736得到的药物代谢动力学数据被概述于图3中。MEDI4736在较低剂量下表现出非线性PK,但对于剂量≥1.0mg/kg Q2W是线性PK。参见图4。MEDI4736还显示剂量依赖性靶标结合增加,这与MEDI4736与PDL-1的结合一致。基于使用pK数据和可溶性PDL-1的测量值的计算,用剂量≥0.3mg/kg Q2W实现了显著的靶标占有,并且在剂量≥3mg/kg Q2W下预期接近完全饱和。参见图5。
(c)功效
在所有剂量水平下观察到肿瘤收缩,包括在经过多次预先治疗的患者中和在具有巨大肿瘤负荷的患者中。活性是明显快速(6周)并且是持久的。在接受少至0.1mg/kg Q2W的患者中观察到部分应答(PR)和稳定疾病(SD)。参见图6和下表3。
另外,在接受高达10mg/kg Q2W的患者中,肿瘤负荷减小多达83%。参见图6-8。例如,接受0.3mg/kg的一个NSCLC腺癌患者(1351901004)显示6周之后肿瘤负荷减小31%并且23周之后肿瘤负荷减小71%。在一个受试者中使用预防类固醇,并且看起来没有影响临床活性。
在剂量-扩展阶段中,最初在患有非小细胞肺癌、黑色素瘤和胰腺癌的受试者中观察到临床活性。在患有非小细胞肺癌(非鳞状)、胰腺癌、GI癌、黑色素瘤和头颈部鳞状细胞癌的受试者中观察到稳定疾病(在12周时)。
(d)安全性和抗药物抗体
MEDI4736通常是耐受良好的。没有观察到肺炎、结肠炎(任何等级的)或高血糖。另外,没有观察到治疗相关的等级≥3的事件,并且没有观察到剂量限制性毒性。
在0.1mg/kg至3mg/kg的剂量范围内观察到ADA发生率极低。具体来说,接受0.1mg/kg至1mg/kg剂量范围的给药的15个患者中仅有1个测试为ADA阳性,具有PK/PD含义。
(e)讨论
本研究证明了MEDI4736具有有利的pK特性并且通常是耐受良好的。另外,MEDI4736在治疗肿瘤(包括黑色素瘤和非小细胞肺癌)中是有效的,然而产生低发生率的ADA。
实例3:HPV状态和治疗功效的相关性
已显示几个抗体治疗的功效与抗原表达水平相关联。例如,赫赛汀(Herceptin)(曲妥单抗)与HER2蛋白结合,并且使用的药效试验数据显示有益的治疗效果在很大程度上仅限于具有最高HER2蛋白表达水平的患者。HER2过量表达的程度被认为是治疗效果的预测因子,并且被特别指定为用于过量表达HER2的癌症。
在HPV阳性肿瘤中已经观察到PD-1和PDL-1的水平增加。因此,对MEDI4736在治疗HPV阳性和HPV阴性肿瘤中的功效进行了检查,以确定HPV阳性肿瘤状态是否是治疗效果的预测因子。在这些实验中,确定了12例头颈部鳞状细胞癌(SCCHN)肿瘤的HPV状态。12例患者中的4例患有HPV阳性肿瘤,且12例患者中的8例患有HPV阴性肿瘤。也评估了PDL-1状态。12名受试者中的2名是PDL-1阳性,且8名受试者是PDL-1阴性(2名受试者的的PDL-1状态没有获得)。
在使用MEDI4736治疗前和在治疗后的6周、12周和18周测量了肿瘤尺寸。结果示于图9A和9B中。在给予10mg/kg Q2W的MEDI4736后,在12名受试者中的4名中观察到肿瘤缩小。在所有4例这些患者中,肿瘤缩小至少25%。那些患者中,2例是PDL-1阳性,1例是PDL-1阴性,且第四例的PDL-1状态是未知的。另外,在3/19(15.8%)的受试者中观察到完全应答(CR)和部分应答(PR),在PDL-1阳性的患者中的百分比甚至更高(2/3;66.7%)。图10总结了使用MEDI4736治疗的受试者的应答(包括24个月的随访)。因此,MEDI4736在治疗PDL-1阳性肿瘤中是有效的。然而,出乎意料地,响应于MEDI4736治疗而缩小的所有4例肿瘤均是HPV阴性。因此,MEDI4736在治疗HPV阴性肿瘤中是有效的,尽管HPV阴性肿瘤与MEDI4736抗原PDL-1的较低水平相关。
***
本领域技术人员仅仅使用常规实验即可识别出或能够确定在此描述的本披露内容的具体方面的许多等效物。此类等效物意图由以下权利要求书涵盖。
在此引用不同的公开,这些公开的披露内容通过引用以其全文结合。
尽管出于清晰理解的目的已经借助于说明和实例相当详细地描述了前述发明,但显而易见可以在所附权利要求书的范围内实践某些变化和修改。
序列表
SEO ID NO:1
>PCT/US 2010/058007_77来自PCT/US 2010/058007生物体:智人的序列77
EIVLTQSPGTLSLSPGERATLSCRASQRVSSSYLAWYQQKPGQAPRLLIYDASSRATGIPDRFSGSGSGTDFTLTISRLEPEDFAVYYCQQYGSLPWTFGQGTKVEIK
SEQ ID NO:2
>PCT/US 2010/058007_72来自PCT/US 2010/058007生物体:智人的序列72
EVQLVESGGGLVQPGGSLRLSCAASGFTFSRYWMSWVRQAPGKGLEWVANIKQDGSEKYYVDSVKGRFTISRDNAKNSLYLQMNSLRAEDTAVYYCAREGGWFGELAFDYWGQGTLVTVSS
SEO ID NO:3-VH CDR1
>PCT/US 2010/058007_73来自PCT/US 2010/058007生物体:智人的序列73
RYWMS
SEQ ID NO:4-VH CDR2
>PCT/US 2010/058007_74来自PCT/US 2010/058007生物体:智人的序列74
NIKQDGSEKYYVDSVKG
SEQ ID NO:5-VH CDR3
>PCT/US 2010/058007_75来自PCT/US 2010/058007生物体:智人的序列75
EGGWFGELAFDY
SEQ ID NO:6-VL CDR1
>PCT/US 2010/058007_78来自PCT/US 2010/058007生物体:智人的序列78
RASQRVSSSYLA
SEO ID NO:7-VL CDR2
>PCT/US 2010/058007_79来自PCT/US 2010/058007生物体:智人的序列79
DASSRAT
SEO ID NO:8-VL CDR3
>PCT/US 2010/058007_80来自PCT/US 2010/058007生物体:智人的序列80
QQYGSLPWT
SEQ ID NO:9
>WO 2012/145493_1来自WO 2012/145493生物体:小家鼠的序列1
DIVMTQSHKLMSTSVGDRVSITCKASQDVGTAVAWYQQKPGQSPKLLIYWASTRHTGVPDRFTGSGSGTDFTLTISNVQSEDLADYFCQQDSSYPLTFGAGTKVELK
SEQ ID NO:10
>WO 2012/145493_2来自WO 2012/145493生物体:小家鼠的序列2
EVKLQESGPSLVKPSQTLSLTCSVTGYSTTSDYWNWIRKFPGNKLEYVGYISYTGSTYYNPSLKSRISITRDTSKNQYYLQLNSVTSEDTATYYCARYGGWLSPFDYWGQGTTLTVSS
SEQ ID NO:11
>WO 2012/145493_3来自WO 2012/145493生物体:小家鼠的序列3
DIVTTQSHKLMSTSVGDRVSITCKASQDVGTAVAWYQQKPGQSPKLLIYWASTRHTGVPDRFTGSGSGTDFTLTISNVQSEDLADYFCQQDSSYPLTFGAGTKVELK
SEQ ID NO:12
>WO 2012/145493_4来自WO 2012/145493生物体:小家鼠的序列4
EVQLQESGPGLVAPSQSLSITCTVSGFSLTTYSINWIRQPPGKGLEWLGVMWAGGGTNSNSVLKSRLIISKDNSKSQVFLKMNSLQTDDTARYYCARYYGNSPYYAIDYWGQGTSVTVSS
SEQ ID NO:13
>WO 2012/145493_5来自WO 2012/145493生物体:小家鼠的序列5
DIVMTQSPSSLAVSVGEKVSMGCKSSQSLLYSSNQKNSLAWYQQKPGQSPKLLIDWASTRESGVPDRFTGSGSGTDFTLTISSVKAEDLAVYYCQQYYGYPLTFGAGTKLELK
SEQ ID NO:14
>WO 2012/145493_6来自WO 2012/145493生物体:小家鼠的序列6
EVKLQESGPSLVKPSQTLSLTCSVTGYSIISDYWNWIRKFPGNKLEYLGYISYTGSTYYNPSLKSRISITRDTSKNQYYLQLNSVTTEDTATYYCARRGGWLLPFDYWGQGTTLTVSS
SEQ ID NO:15
>WO 2012/145493_7来自WO 2012/145493生物体:小家鼠的序列7
DIVMTQSPAIMSASPGEKVTMTCSASSSIRYMHWYQQKPGTSPKRWISDTSKLTSGVPARFSGSGSGTSYALTISSMEAEDAATYYCHQRSSYPWTFGGGTKLEIK
SEQ ID NO:16
>WO 2012/145493_8来自WO 2012/145493生物体:小家鼠的序列8
EVKLQESGPSLVKPGASVKLSCKASGYTFTSYDINWVKQRPGQGLEWIGWIFPRDNNTKYNENFKGKATLTVDTSSTTAYMELHSLTSEDSAVYFCTKENWVGDFDYWGQGTTLTLSS
SEQ ID NO:17
>WO 2012/145493_81来自WO 2012/145493生物体:小家鼠的序列81
EIVLTQSPATLSLSPGERATLSCRASSSVSYIYWFQQKPGQAPRLLIYAAFNRATGIPARFSGSGSGTDYTLTISSLEPEDFAVYYCQQWSNNPLTFGQGTKVEIK
SEQ ID NO:18
>WO 2012/145493_82来自WO 2012/145493生物体:小家鼠的序列82
EIVLTQSPATLSLSPGERATLSCRASSSVSYIYWFQQKPGQSPRPLIYAAFNRATGIPARFSGSGSGTDYTLTISSLEPEDFAVYYCQQWSNNPLTFGQGTKVEIK
SEQ ID NO:19
>WO 2012/145493_83来自WO 2012/145493生物体:小家鼠的序列83
QIVLTQSPATLSLSPGERATLSCRASSSVSYIYWFQQKPGQSPRPLIYATFNLASGIPARFSGSGSGTSYTLTISRLEPEDFAVYYCQQWSNNPLTFGQGTKVEIK
SEQ ID NO:20
>WO 2012/145493_84来自WO 2012/145493生物体:小家鼠的序列84
DIQLTQSPSSLSASVGDRVTITCRASSGVSYIYWFQQKPGKAPKLLIYAAFNLASGVPSRFSGSGSGTEYTLTISSLQPEDFATYYCQQWSNNPLTFGQGTKVEIK
SEQ ID NO:21
>WO 2012/145493_85来自WO 2012/145493生物体:小家鼠的序列85
DIQLTQSPSSLSASVGDRVTITCRASSGVSYIYWFQQKPGKAPKPLIYAAFNLASGVPSRFSGSGSGTEYTLTISSLQPEDFATYYCQQWSNNPLTFGQGTKVEIK
SEQ ID NO:22
>WO 2012/14549386来自WO 2012/145493生物体:小家鼠的序列86
DIQLTQSPSILSASVGDRVTITCRASSSVSYIYWFQQKPGKAPKPLIYATFNLASGVPSRFSGSGSGTSYTLTISSLQPEDFATYYCQQWSNNPLTFGQGTKVEIK
SEQ ID NO:23
>WO 2012/145493_90来自WO 2012/145493生物体:小家鼠的序列90
QVQLVQSGAEVKKPGASVKVSCKASGYTFPDYYMNWVRQAPGQGLEWMGDIDPNYGGTNYAQKFQGRVTMTRDTSISTAYMELSRLRSDDTAVYYCARGALTDWGQGTMVTVSS
SEQ ID NO:24
>WO 2012/145493_91来自WO 2012/145493生物体:小家鼠的序列91
QVQLVQSGAEVKKPGASVKVSCKASGYTFPDYYMNWVRQAPGQSLEWMGDIDPNYGGTNYNQKFQGRVTMTRDTSISTAYMELSRLRSDDTAVYYCARGALTDWGQGTMVTVSS
SEQ ID NO:25
>WO 2012/145493_92来自WO 2012/145493生物体:小家鼠的序列92
EVQLVQSGAEVKKPGASVKVSCKASGYTFPDYYMNWVRQAPGQSLEWMGDIDPNYGGTNYNQKFQGRVTMTVDRSSSTAYMELSRLRSDDTAVYYCARGALTDWGQGTMVTVSS
SEQ ID NO:26
>WO 2012/145493_93来自WO 2012/145493生物体:小家鼠的序列93
EVQLVESGGGLVQPGRSLRLSCTASGYTFPDYYMNWVRQAPGKGLEWVGDIDPNYGGTTYAASVKGRFTISVDRSKSIAYLQMSSLKTEDTAVYYCTRGALTDWGQGTMVTVSS
SEQ ID NO:27
>WO 2012/145493_94来自WO 2012/145493生物体:小家鼠的序列94
EVQLVESGGGLVQPGRSLRLSCTASGYTFPDYYMNWVRQAPGKGLEWVGDIDPNYGGTTYNASVKGRFTISVDRSKSIAYLQMSSLKTEDTAVYYCARGALTDWGQGTMVTVSS
SEQ ID NO:28
>WO 2012/145493_95来自WO 2012/145493生物体:小家鼠的序列95
EVQLVESGGGLVQPGRSLRLSCTASGYTFPDYYMNWVRQAPGKGLEWVGDIDPNYGGTTYNQSVKGRFTISVDRSKSIAYLQMSSLKTEDTAVYYCARGALTDWGQGTMVTVSS
SEQ ID NO:29
>WO 2012/145493_11来自WO 2012/145493生物体:小家鼠的序列11
DIQMTQFPSSLCASQGGKVTVTCKASQDINNYMAWYQHKPGKGPRLLIHYTSTLLSGIPSRFSGSGSGRDYSFSISNLEPEDIATYYCLQYDNLWTFGGGTKLEIK
SEQ ID NO:30
>WO 2012/145493_12来自WO 2012/145493生物体:小家鼠的序列12
EVQLQQSGPVLVKPGASVKMSCKASGYTFTDYYMNWVKQSHGKSLEWIGNINPYNGGTTYNQKFKGKATLTVDKSSRTAYMEINSLTSEDSAVYYCARGRIYDGSLDYWGQGTALTVSS
SEQ ID NO:31
>WO 2012/145493_13来自WO 2012/145493生物体:小家鼠的序列13
DIVMTQSQKFMSTSVGDRVSVTCKASQSVDTNVAWYQQKPGQSPKALIFSASYRYSGVPDRFTGSGSGTDFTLTINSVQSEDLAEYFCQQYNSYPYTFGSGTKLEIK
SEQ ID NO:32
>WO 2012/145493_14来自WO 2012/145493生物体:小家鼠的序列14
QVQLQQSGAELAKPGASVRLSCKASGYTFTNYWMHWVKQRPGQGLEWIGHINPSSGFTTYNQNFKDKATLTADKSSNTAYMQLSSLTYEDSAVYFCAREDYDVDYWGQGTTLTVSS
SEQ ID NO:33
>WO 2012/145493_15来自WO 2012/145493生物体:小家鼠的序列15
QIVLTQSPALMSASPGEKVTMTCSASSSVSYMYWYQQKPRSSPKPWIYLTSNLASGVPARFSGSGSGTSYSLTISSMEAEDAATYYCQQWSSNPFTFGSGTKLEIK
SEQ ID NO:34
>WO 2012/145493_16来自WO 2012/145493生物体:小家鼠的序列16
EVQLVESGGGLVKPGGSLKLSCAASGFTFSDYGMHWVRQAPEKGLEWVAYISSGSYTIYYTDTVKGRFTISRDNAKNTLFLQMTSLRSEDTAMYYCARRGYGSFYEYYFDYWGQGTTLTVSS
SEQ ID NO:35
>WO 2012/145493_97来自WO 2012/145493生物体:小家鼠的序列97
EIVLTQSPATLSLSPGERATLSCRASSSVSYMYWYQQKPGQAPRLLIYLASNRATGIPARFSGSGSGTDYTLTISSLEPEDFAVYYCQQWSSNPFTFGQGTKLEIK
SEQ ID NO:36
>WO 2012/145493_98来自WO 2012/145493生物体:小家鼠的序列98
QIVLTQSPATLSLSPGERATLSCSASSSVSYMYWYQQKPGQAPRLLIYLTSNRATGIPARFSGSGSGTDYTLTISSLEPEDFAVYYCQQWSSNPFTFGQGTKLEIK
SEQ ID NO:37
>WO 2012/145493_99来自WO 2012/145493生物体:小家鼠的序列99
DIQLTQSPSSLSASVGDRVTITCRASSSVSYMYWYQQKPGKAPKLLIYLASNLASGVPSRFSGSGSGTEYTLTISSLEPEDFATYYCQQWSSNPFTFGQGTKLEIK
SEQ ID NO:38
>WO 2012/145493_100来自WO 2012/145493生物体:小家鼠的序列100
QIQLTQSPSSLSASVGDRVTITCSASSSVSYMYWYQQKPGKAPKLLIYLTSNLASGVPSRFSGSGSGTEYTLTISSLEPEDFATYYCQQWSSNPFTFGQGTKLEIK
SEQ ID NO:39
>WO 2012/145493_104来自WO 2012/145493生物体:小家鼠的序列104
EVQLVESGGGLVQPGGSLRLSCAASGFTFSDYGMHWVRQAPGKGLEWVSYISSGSSTIYYADSVKGRFTISRDNAKNTLYLQMSSLRAEDTAVYYCARRGYGSFYEYYFDYWGQGTTVTVSS
SEQ ID NO:40
>WO 2012/145493_105来自WO 2012/145493生物体:小家鼠的序列105
EVQLVESGGGLVQPGGSLRLSCAASGFTFSDYGMHWVRQAPGKGLEWVAYISSGSYTIYYADSVKGRFTISRDNAKNTLYLQMSSLRAEDTAVYYCARRGYGSFYEYYFDYWGQGTTVTVSS
SEQ ID NO:41
>WO 2012/145493_106来自WO 2012/145493生物体:小家鼠的序列106
EVQLVESGGGLVQPGGSLRLSCAASGFTFSDYGMHWVRQAPGKGLEWVAYISSGSYTIYSADSVKGRFTISRDNAKNTLYLQMSSLRAEDTAVYYCARRGYGSFYEYYFDYWGQGTTVTVSS
SEQ ID NO:42
>WO 2012/145493_107来自WO 2012/145493生物体:小家鼠的序列107
QVQLVQSGAEVKKPGASVKVSCKASGFTFSDYGMHWVRQAPGQRLEWMGYISSGSSTIYYSQKFQGRVTITRDNSASTLYMELSSLRSEDTAVYYCARRGYGSFYEYYFDYWGQGTTLTVSS
SEQ ID NO:43
>WO 2012/145493_108来自WO 2012/145493生物体:小家鼠的序列108
EVQLVQSGAEVKKPGASVKVSCAASGFTFSDYGMHWVRQAPGQRLEWMGYISSGSYTIYYSQKFQGRVTITRDNSASTLYMELSSLRSEDTAVYYCARRGYGSFYEYYFDYWGQGTTLTVSS
SEQ ID NO:44
>WO 2012/145493_109来自WO 2012/145493生物体:小家鼠的序列109
EVQLVQSGAEVKKPGASVKVSCAASGFTFSDYGMHWVRQAPGQRLEWVAYISSGSYTIYYSQKFQGRVTITRDNSASTLYMELSSLRSEDTAVYYCARRGYGSFYEYYFDYWGQGTTLTVSS
SEQ ID NO:45
>WO 2012/145493_9来自WO 2012/145493生物体:小家鼠的序列9
QIVLSQSPAI LSASPGEKVT MTCRASSSVS YIYWFQQKPG SSPKPWIYAT FNLASGVPAR FSGSGSGTSY SLTISRVETE DAATYYCQQW SNNPLTFGAG TKLELK
SEQ ID NO:46
>WO 2012/145493_10来自WO 2012/145493生物体:小家鼠的序列10
EVQLQQSGPD LVTPGASVRI SCQASGYTFP DYYMNWVKQS HGKSLEWIGD IDPNYGGTTY NQKFKGKAIL TVDRSSSTAY MELRSLTSED SAVYYCARGA LTDWGQGTSL TVSS
- 还没有人留言评论。精彩留言会获得点赞!