芍药苷在制备促进血管新生的药物中的用途的制作方法
本发明涉及一种芍药苷的制药用途,尤其是一种芍药苷在制备治疗缺血性疾病的药物中的用途。
背景技术:
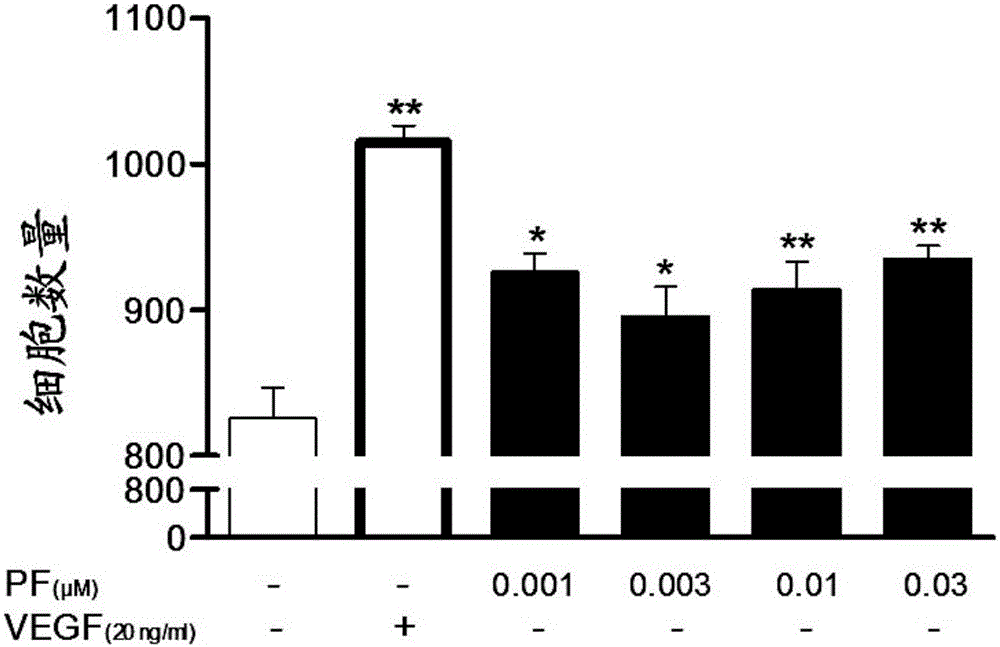
:近数十年来,随着人类生活水平提升,心脑血管病发病率逐渐升高。根据世界卫生组织对过去十年世界十大死亡原因调查的结果,心脑血管疾病是世界上导致人类死亡的重要原因。缺血性心脑血管病给社会、家庭和患者带来沉重的负担和巨大的痛苦。尽管近年来对于缺血性心脑血管病的预防和治疗方面已有很大的进步,但其治疗措施的发展仍不能满足患者的需要,缺血性心脑血管病的致死率仍居高不下。积极探索有效的防治药物,对进一步提高我国缺血性心脑血管病的预防及治疗水平具有重要意义。治疗性血管新生概念的提出,为缺血性心脏病提供了新的治疗途径,已有越来越多的基于促血管新生的临床试验取得了较好的疗效。血管新生是在既有的成熟血管系统的基础上通过扩张和重塑形成新的成熟血管网络的过程。在生理或病理条件下,血管新生对血管系统均发挥重要作用,它既是机体正常发育、生殖和组织修复的基础,也与某些疾病(如慢性炎症、肿瘤的生长和伤口愈合等)的病理过程息息相关。在成年人,生理情况下血管新生通常仅发生在伤口愈合、肌肉增长、女性生理周期、孕期等过程中。血管新生主要分为出芽式血管新生和套叠式血管新生两种形式。出芽式血管新生在卵黄囊及胚胎中均可发生;主要过程包括基膜溶解、细胞增殖、细胞迁移、细胞成管。套叠式血管新生是已存在的血管壁上相对的内皮细胞向管腔内生长,形成双层内皮细胞,随后双内皮细胞层及基底膜裂开,经过平滑肌细胞及周细胞包围,形成两个新的血管。影响血管新生的因素有很多,可分为促进和抑制两种因子。促血管新生因子包括血管内皮生长因子(VEGF)、成纤维细胞生长因子(FGF)、腺苷、表皮生长因子(EGF)、血小板源性生长因子(PDGF)、血管生成素、缺氧诱导因子1-α(HIF-1α)等。血管新生抑制因子主要包括:1)凝血酶敏感蛋白-1、血酶敏感蛋白-2;2)内皮抑素、血管抑素;3)Ⅰ型血小板结合蛋白基序的解聚蛋白样金属蛋白酶;4)色素上皮细胞衍生因子;5)金属蛋白酶组织抑制因子;6)血小板第四因子、血管抑制蛋白、分泌性细胞因子白介素、肌钙蛋白。在上述这些因子中,绝大部分是内源性的物质,生产成本高,价格昂贵。因此,目前迫切需要一种廉价的外源性促进血管新生的物质。传统中药是祖先留给我们的宝藏。我们期待从其中可以寻找廉价的促进血管新生的物质。在传统中药中,赤芍作为活血化瘀的代表中药,常见于血府逐瘀汤、补阳还五汤等活血化瘀方剂中。李东垣称其能:“破瘀血而疗腹痛……,仲景方中多用之者”。《本草从新》:“白芍药……白益脾,能于土中泻木,赤散邪,能血中之滞。赤白各随花色,单瓣者入药”。赤芍中含有多个有效成分,如赤芍801、赤芍精、芍药苷等,它们均具有很好的药理作用。芍药苷是赤芍中的主要活性成分。芍药苷是一种单萜类化合物。白芍总苷(TGP)是芍药的水/酒精提取物,现在主要在临床上用于关节炎的治疗,芍药苷是其主要活性成分。在关节炎模型上白芍总苷可以缓解疼痛、关节水肿、滑液囊肥大并减轻骨损害及软骨退化。有文献报道,白芍总苷可以通过减少前列腺素E2、白介素B4、一氧化氮、活性氧、促炎细胞因子及趋化因子的产生从而抑制炎症。有文献报道,白芍总苷、芍药苷可以抑制淋巴细胞及成纤维细胞样滑膜细胞的增殖、抑制血管新生、减少基质金属蛋白酶生成。还有文献报道,白芍总苷可以显著抑制VEGF诱导的血管新生。CN104147034A公开了一种抑制血管平滑肌细胞增殖的中药组合物,所述组合物由黄芪甲苷、苦杏仁苷和芍药苷组成。上述文献也是利用了芍药苷对于血管平滑肌细胞增殖的抑制作用。CN103830255A公开了芍药苷在制备治疗脑血管疾病的药物中的应用,其单位剂量为50~200mg。在上述剂量范围内,芍药苷依然表现出抑制血管新生的作用。综上,传统的观点认为,芍药苷主要用于抑制血管新生。技术实现要素:本申请的发明人克服了现有技术的偏见,意外地发现芍药苷在较低剂量时可以促进血管新生,从而完成本发明。本发明提供一种芍药苷或其药学上可接受的盐在制备促进血管新生的药物中的用途。根据本发明所述的用途,优选地,单位剂量的所述药物中含有5~40mg芍药苷或其药学上可接受的盐。根据本发明所述的用途,优选地,单位剂量的所述药物中含有10~35mg芍药苷或其药学上可接受的盐。本发明还提供一种芍药苷或其药学上可接受的盐作为唯一活性成分在制备促进血管新生的药物中的用途。根据本发明所述的用途,优选地,单位剂量的所述药物中含有5~40mg芍药苷或其药学上可接受的盐。根据本发明所述的用途,优选地,单位剂量的所述药物中含有10~35mg芍药苷或其药学上可接受的盐。根据本发明所述的用途,优选地,所述的药物为治疗缺血性疾病的药物。根据本发明所述的用途,优选地,所述的缺血性疾病包括缺血性心脏病或缺血性脑病。根据本发明所述的用途,优选地,所述的缺血性疾病包括冠心病、血栓形成性脑梗死、脑栓塞、腔隙性脑梗死或下肢缺血性疾病。本发明也提供一种促进血管新生的药物制剂,其特征在于,单位剂量的所述药物制剂中含有如下组分:(1)5~40mg芍药苷或其药学上可接受的盐;和(2)药学上可接受的载体。鉴于临床上用大剂量白芍总苷、芍药苷治疗关节炎,其中一部分的作用效果有赖于芍药苷抑制血管新生的活性。本发明则发现,低剂量的芍药苷可促进血管新生。腺苷作为缺血性疾病发生时重要的保护因素,具有较强的促进血管新生作用,但由于其半衰期短、血清清除率高、不能透过血脑屏障、有心脏副作用等缺陷使其在临床应用中受到了很大限制。以往的研究表明,芍药苷在很多方面具有优于腺苷的优势,具有更稳定的血药浓度,可以透过血脑屏障,在实验动物用药过程中并没有发现致心律失常等副作用。因此,本发明的芍药苷可以用于制备促进血管新生的药物,该药物将对缺血性心脑血管疾病具有很好的治疗效果。附图说明图1为MTT试验法测定的芍药苷促进HUVECs增殖的统计图。图中,+表示含有,-表示不含有;PF表示芍药苷;VEGF表示血管内皮生长因子。图2为Hoechst染色法测定的芍药苷促进HUVECs增殖的统计图。图中,+表示含有,-表示不含有;PF表示芍药苷;VEGF表示血管内皮生长因子。图3为划痕试验测定的芍药苷促进HUVECs迁移的统计图。图中,ctrl表示空白对照组,VEGF表示血管内皮生长因子。图4为实时细胞功能分析仪测定的芍药苷促进HUVECs迁移的统计图。图中,+表示含有,-表示不含有;PF表示芍药苷;VEGF表示血管内皮生长因子。图5为芍药苷促进HUVECs成管的统计图。图中,ctrl表示空白对照组,VEGF表示血管内皮生长因子。分支点的数量均是基于空白对照组为100%计算得到的。图6为芍药苷促进脑梗塞面积减少的统计图。图中,S表示假手术组,M表示模型组,PF表示芍药苷组。图7为芍药苷促进VEGF受体信号通路蛋白磷酸化的图。图中,S表示假手术组,M表示模型组,PF表示芍药苷组;R表示右侧,L表示左侧。具体实施方式下面结合具体实施例对本发明作进一步的说明,但本发明的保护范围并不限于此。本发明所述的“疾病”特指包括动物或人的任何不健康状况,并且包括可以由应用于该动物或人的医学或者兽医疗法导致的或易发生于该疗法的不健康状况。本发明的“药学上可接受的”意指其可用于制备药物或制剂,其通常是安全、无毒的并且既不在生物学上也不在其它方面不合乎需要,并且包括其对于兽医使用以及人类药物使用是可接受的。“药学上可接受的盐”意指如上所定义的药学上可接受的,并且具有所期望的药理学活性的盐。本发明的芍药苷的药学上可接受的盐可以是与酸形成的盐或与碱形成的盐。所述酸包括但不限于盐酸、氢溴酸、硫酸、硝酸、磷酸等无机酸;乙酸、三氟乙酸、丙酸、己酸、庚酸、环戊烷丙酸、乙醇酸、丙酮酸、乳酸、丙二酸、琥珀酸、苹果酸、马来酸、富马酸、酒石酸、柠檬酸、苯甲酸、o-(4-羟基苯甲酰基)苯甲酸、肉桂酸、扁桃酸、甲磺酸、乙磺酸、1,2-乙二磺酸、2-羟基乙磺酸、苯磺酸、对氯苯磺酸、2-萘磺酸、对甲苯磺酸、樟脑磺酸、4-甲基二环[2.2.2]辛-2-烯-1-羧酸、葡庚糖酸、4,4′-亚甲基双(3-羟-2-烯-1-羧酸)、3-苯基丙酸、三甲基乙酸、叔丁基乙酸、十二烷基硫酸、葡糖酸、谷氨酸、羟基萘甲酸、水杨酸、硬脂酸、粘康酸等有机酸。所述的碱包括但不限于氢氧化钠、碳酸钠、氢氧化钾、氢氧化铝和氢氧化钙等无机碱;乙醇胺、二乙醇胺、三乙醇胺、氨丁三醇、N-甲基葡萄糖胺等有机碱。本发明的“治疗上有效量”意指化合物被给予动物或人用于治疗疾病时,足以实现对该疾病的该治疗的量。本发明的“治疗”意指治疗上有效量的化合物的任何施用并且包括:(1)预防可易患所述疾病但仍还没有经历或显示出该疾病的病理学或症状学的动物中发生该疾病,(2)抑制正经历或显示出所述疾病的病理学或症状学的动物或人中的该疾病(即,阻制所述病理学和/或症状学的进一步发展),或(3)改善正经历或显示出所述疾病的病理学或症状学的动物或人中的该疾病(即,逆转所述病理学和/或症状学)。通常认为芍药苷可以抑制血管新生,本申请则发现,芍药苷可以促进血管新生。在芍药苷的给药浓度较低的情况下,上述现象尤为明显。有鉴于此,根据本发明的一个实施方式,本发明提供一种芍药苷或其药学上可接受的盐(以下统称芍药苷,除非特别声明)在制备促进血管新生的药物中的用途。根据本发明的另一个实施方式,本发明还提供一种芍药苷或其药学上可接受的盐作为唯一活性成分在制备促进血管新生的药物中的用途。本发明的芍药苷(CAS号为23180-57-6)的化学结构如下所示:本发明的芍药苷的来源并没有限制,可以是天然产物的提取物或者是化学合成物。本发明的芍药苷可以来源于毛茛科植物芍药PaeoniaalbifloraPall的根、牡丹P.suffrsticosaAndr的根、紫牡丹P.delarayiFranch的根。在本发明中,芍药可以为“赤芍”或“白芍”。赤芍来自毛茛科植物芍药PaeonialactifloraPall或川赤芍PaeoniaveitchiiLynch的干燥根;白芍来自毛茛科植物芍药PaeonialactifloraPall的干燥根。在本发明中,在单位剂量的所述药物中,芍药苷或其药学上可接受的盐的含量可以为5~40mg;优选为10~35mg;更优选为15~30mg。例如,在单位剂量的所述药物中,芍药苷或其药学上可接受的盐的含量为15.4mg、28.9mg、30mg、35mg或38.5mg。在上述含量范围内,芍药苷表现出很好的促进血管新生作用;如果超过上述范围,芍药苷将抑制血管新生。本发明的单位剂量表示含有治疗上有效量的活性物质的独立制剂单元,例如,片剂中的一片药品、胶囊剂中一粒胶囊。药学上可接受的盐如前所述,这里不再赘述。在本发明中,所述的药物可以为治疗缺血性疾病的药物。本发明的缺血性疾病包括缺血性心脏病或缺血性脑病。本发明的缺血性疾病的实例包括但不限于冠心病、血栓形成性脑梗死、脑栓塞、腔隙性脑梗死或下肢缺血性疾病。本申请发现,芍药苷在合适的给药浓度下具有促进血管新生的作用。上述缺血性疾病可以通过促进血管新生而得到改善。根据本发明的一个具体实施方式,本发明提供一种促进血管新生的药物制剂,在单位剂量的所述药物制剂中,包括5~40mg、优选为10~35mg、更优选为15~30mg的芍药苷或其药学上可接受的盐。药学上可接受的盐如前所述,这里不再赘述。本发明的药物制剂还可以包括药学上可接受的载体。在本发明中,药学上可接受的载体并没有特别限定,具体的实例包括但不限于淀粉、糖粉、糊精、乳糖、微晶纤维素、甘露醇;优选为甘露醇。本发明的药物制剂形式并没有特别限制,具体的实例可以为粉针剂、注射液、片剂、胶囊、滴丸或口服液。本发明所提供的各种药物剂型均可以以药学常规方法制备而成。本发明的药物制剂可以含有粘性剂、保湿剂等。本发明的粘性剂可以选自聚丙烯酸盐、甲基纤维素钠、羧甲基纤维素钠中的任意一种或多种。本发明的保湿剂可以选自甘油、聚乙二醇、山梨醇、丙二醇中的任意一种或多种。本发明的药物制剂为口服片剂时,还可以含有抗粘剂、增塑剂等。所述的抗粘剂并没有特别限定,可以为本领域常用抗粘剂;例如滑石粉、单硬脂酸甘油酯。所述的增塑剂并没有特别限定,可以为本领域常用的增塑剂;例如丙二醇、聚乙二醇、癸二酸二丁酯、柠檬酸三乙酯等。本发明的药物制剂可以通过口服、舌下、经皮、经肌肉或皮下、皮肤粘膜、静脉途径给药。为了验证芍药苷的促进血管新生作用,需要选择合适的细胞模型进行检测。内皮细胞是血管新生的主要参与细胞,内皮细胞要经过迁移、增殖、成管等步骤来完成血管新生的过程。对单独内皮细胞培养而言,在研究血管新生机理或药物疗效评价时常分别对内皮细胞的增殖、迁移、成管这三个步骤进行验证。评价细胞增殖的试验方法有MTT试验、Hoechst染色等,评价细胞增殖的方法有划痕试验、xCELLigenceRTCADP实时监测等,评价成管的方法主要为小管形成试验。本发明采用人脐静脉内皮细胞HUVECs(购自美国菌种保藏中心ATCC)作为细胞模型进行验证。<实验原料和仪器><人脐静脉内皮细胞培养>培养方法:采用F-12K培养基,其内加入10wt%胎牛血清,2mML-谷氨酰胺,100U/ml青霉素-链霉素,100μg/ml肝素,30μg/ml内皮细胞生长支持物。培养瓶内预先铺胶原。将培养瓶置于CO2培养箱(37℃、95%的CO2、5%的O2)中。每2日更换一次培养基。传代方法:在显微镜(转盘式共聚焦显微镜系统)下观察HUVECs,细胞呈鹅卵石样平铺在培养瓶底,待细胞铺满瓶底的80%面积时可传代。于37℃水浴锅中预温培养基、胰蛋白酶、PBS缓冲液。将培养瓶从培养箱中取出,置于超净台中。轻轻摇晃倒出培养液,加入6ml预温的PBS缓冲液,轻轻摇晃后倒出,重复上述步骤。加入0.5ml预温的胰蛋白酶,转动培养瓶,使胰蛋白酶均匀覆盖细胞,将培养瓶置于37℃培养箱中静置1min,在显微镜下观察细胞变圆、收缩,轻拍培养瓶侧壁,使细胞从瓶壁上脱离。立即向培养瓶中加入4ml完全培养基(F-12k培养基,10wt%胎牛血清,2mML-谷氨酰胺,100U/ml青霉素-链霉素,100μg/ml肝素,30μg/ml内皮细胞生长支持物)终止消化,反复吹打细胞,使细胞密度均匀。按照1:2或1:3的传代比例,向培养瓶中加入4~8ml完全培养基(F-12k培养基,10wt%胎牛血清,2mML-谷氨酰胺,100U/ml青霉素-链霉素,100μg/ml肝素,30μg/ml内皮细胞生长支持物),吹打均匀,后将细胞平均分配于2-3个培养瓶中。将培养瓶置于37℃培养箱,适度晃动瓶身,使细胞在瓶中分布均匀,待细胞贴壁后视情况给予换液。试验均使用2~8代细胞。细胞计数:将细胞悬液吹打均匀,取10μl加到细胞计数板内。在显微镜下计数四个大方格的细胞总数。按照如下公式计算细胞浓度:细胞浓度(个/ml)=4个大方格内的细胞数/4×104细胞冻存:选用对数生长期的HUVECs,在冻存前一天换液一次。将细胞消化、计数,用细胞冻存液将细胞按2×106/ml的浓度重悬。将细胞悬液分装于冻存管中,拧紧瓶盖,做好标记,置于梯度冻存盒中,于-80℃冰箱中过夜。次日转移至液氮罐中。细胞复苏:取5ml完全培养基(F-12k培养基,10wt%胎牛血清,2mML-谷氨酰胺,100U/ml青霉素-链霉素,100μg/ml肝素,30μg/ml内皮细胞生长支持物)于37℃水浴锅中预热后加入预铺胶的培养瓶中。将冻存管从液氮中取出后迅速置于3℃水浴锅中,水面不要浸到冻存管的瓶盖。轻轻晃动冻存管,待最后一片冰溶化后,迅速将其消毒,置于超净台中。用吸管吸出细胞悬液,转移至预先加入培养基的培养瓶中。用吸管吹打细胞,使其混合均匀。将培养瓶置于培养箱中,待细胞贴壁后,及时更换培养基。<人脐静脉内皮细胞试验模型>(1)细胞增殖为明确芍药苷对血管新生的影响,通过MTT试验及Hoechst染色法检测芍药苷对HUVECs增殖的干预作用。MTT试验将HUVECs以104/ml的密度种植于96孔板,培养24h后换用0.5%的低血清培养基饥饿12h。后给予不同浓度(0.001、0.003、0.01、0.03μM)芍药苷处理,空白对照组给与0.1%DMSO,阳性对照组给予20ng/mlVEGF。30h后每孔加入适量MTT,4h后小心吸走培养基,每孔加入100μlDMSO。将板放于摇床上轻摇5min,使甲瓒结晶均匀溶解于DMSO中。用多功能酶标仪工作站在570nm处检测吸光值,根据测得的光密度OD值来判断细胞活性及数量。OD值越大,细胞活性越强,数量越多。分组安排详见下表。数据以表示,试验重复3次以上。试验结果参见图1。由图可知,芍药苷PF(0.001μM、0.003μM、0.01μM、0.03μM)显著增加了HUVECs增殖(P<0.01)。尤其是0.001μM、0.003μM的芍药苷,促进HUVECs增殖效果更加显著。Hoechst染色按上述实验方法(MTT试验)将HUVECs种于96孔板,培养24h后饥饿过夜。后给予芍药苷处理,实验分组同MTT试验。30h后每孔加入10μg/ml的Hoechst33258,置于培养箱中染色15min。使用高内涵细胞成像分析系统InCellAnalyzer2000采集图像并分析计算每孔细胞数。以3孔平均细胞数平均值作为每孔细胞数。试验结果参见图2。由图可知,芍药苷PF(0.001μM、0.003μM、0.01μM、0.03μM)可显著促进HUVECs增殖(P<0.05)。(2)细胞迁移为明确芍药苷的促血管新生活性,通过划痕试验及实时细胞功能分析仪(xCELLigenceRTCADP系统)检测芍药苷对HUVECs迁移的影响。划痕试验将HUVECs种植于48孔板,每孔2×104个,12h后在每个孔中央过圆心做一划痕,加入预温的PBS缓冲液,轻轻摇晃后吸出,以去除漂浮的HUVECs,以防刮下的HUVECs落在划痕处再生长,重复以上步骤。在高内涵细胞成像分析系统(InCellAnalyzer2000)下拍照,记录并测量划痕宽度作为基线值。分别给予不同浓度(0.3、1、10μM)芍药苷处理,以0.1%DMSO及20ng/mlVEGF分别作为空白及阳性对照,10h后再次拍照观察划痕区无细胞覆盖区域的宽度,两次数值相减即为HUVECs迁移距离。数据以表示,试验重复3次以上。试验结果参见图3。由图可知,芍药苷PF(0.3μM、1μM、10μM)及VEGF(20ng/ml)均可增强HUVECs迁移能力(P<0.01),芍药苷PF的促HUVECs迁移能力高于正常对照组,但低于VEGF。实时细胞功能分析仪实时监测在CIM-Plate16(艾森生物生产)上预先铺胶原,将含不同浓度(0.1、1、10μM)芍药苷的低血清培养基加入CIM胚的下层,以0.1%DMSO及20ng/mlVEGF分别作为空白及阳性对照。静置平衡一段时间后,将CIM胚安装于实时细胞功能分析仪上,测量基线。准备好HUVECs悬液,在CIM胚的上层每孔加入100μl细胞悬浮液(约30,000个细胞)。将加入细胞悬液的CIM胚于室温下静置一段时间,待细胞沉降后,安装于实时细胞功能分析仪上,每间隔15min记录细胞迁移情况,共检测10h。以细胞指数做为评价细胞迁移功能的参考指标。数据以表示,试验重复3次以上。试验结果参见图4。由图可知,芍药苷PF(0.1μM、1μM、10μM)及VEGF均促进了HUVECs迁移(P<0.01)。芍药苷PF的最大促进作用出现在6.5h,而VEGF的最大作用出现在8h。此外,选用4h~7h的数据分析显示,芍药苷PF的促HUVECs迁移作用呈剂量依赖性。(3)成管利用成管试验检测芍药苷对HUVECs形成管状结构的影响。Matrigel基质胶4℃过夜溶解,枪头盒、EP管(离心管)、24孔板均℃过夜预冷。次日在冰盒上进行铺胶,先用无血清及生长因子补充物的培养基1:1稀释Matrigel基质胶,混匀后,按照200ul/孔的用量加入24孔板,37℃孵箱放置30min。将HUVECs按105/500μl的浓度种于预先铺过基质胶的24孔板上,所用低血清培养基含不同浓度(0.3、1、10μM)芍药苷,以0.1%DMSO及20ng/mlVEGF分别作为空白及阳性对照。后于倒置显微镜下观察管状结构形成情况。以每个孔三个随机视野的分支点数作为评价管状结构形成能力的参考。数据以表示,试验重复3次以上。试验结果参见图5。由图可知,芍药苷PF(0.3μM)及VEGF(20ng/ml)均促进了HUVECs管状结构的生成(P<0.05)。高剂量范围(例如,10μM)则表现出抑制作用。<小鼠试验>小鼠饲养:试验使用25~30g的C57/BL6J雄性小鼠。试验前小鼠均适应性饲养一周。小鼠饲养在室温、光控环境中,食物、饮水充足。所有试验均通过伦理委员会审批。小鼠大脑中动脉阻塞脑卒中模型(MCAO)的建立:将小鼠麻醉后仰卧位固定,自颈前正中做一纵向切口。将下颌下腺分离至两侧,沿气管右侧向深处分离,暴露右侧颈总动脉(CCA)、颈外动脉(ECA)、颈内动脉(ICA)。分离CCA并于其上挂第一线,随后向头侧分离ECA血管及其分支,将ECA分支灼烧掉,随后在ECA距离根部稍远的位置烧断,尽量使保留的ECA近心端长一些。随后在残留的ECA上挂第二线。分离ICA,并在其上挂第三线。随后将第一线系紧、切断CCA血流,拉紧第三线使ICA内血液不能倒流。然后,在残留ECA的远端剪口,将线栓(MCAO)插入ECA,将第二线系紧,随后将线栓继续深入,插入ICA,直至线栓上标记的黑色标记位置到达CCA分叉部。线栓顶端到达位置约为大脑中动脉开口处。松开第一线、第三线,待1.5h后将线栓拔出,系紧第二线。试验中保持小鼠体温为37±0.5℃。缝合伤口,将小鼠放于保温垫上直至醒来。假手术组与模型组区别在于省略插线栓这一步,其余步骤相同。给药方案:小鼠经MCAO造模,于术后24h开始给予芍药苷皮下注射,剂量为5mg/kg·d-1,共给药21天。模型组、空白对照组、假手术组给予含0.1%DMSO的生理盐水皮下注射。分组及给药方案如下:编号组别只数干预方法1空白对照组80.1%DMSO2假手术组S80.1%DMSO3模型组M80.1%DMSO4芍药苷PF85mg/kg·d-1脑梗塞面积测试:将小鼠麻醉后,取出大脑,去除嗅球小脑和低位脑干,置于冰盐水中15min,冠状切成5片2mm厚脑片,将脑片置于2wt%的TTC磷酸缓冲溶液中,温孵染色15min,孵育完毕后用中性甲醛固定,充分固定后扫描双侧脑片,计算脑片梗塞面积。采用如下公式计算每鼠5片脑片总梗塞面积占脑片总面积的比例S:S=(A1+A2)/(T1+T2)式中,A表示每片脑片的脑梗塞面积,T表示脑片的总面积,1表示右侧,2表示左侧。试验结果参见图6。由图可知,脑梗后大鼠脑梗塞面积显著增加;低剂量的芍药苷可明显减轻大鼠脑梗塞的严重程度(P<0.01)。VEGF受体信号通路蛋白表达:取梗死区周围组织,裂解并提取蛋白,采用westernblot法检测VEGF等信号通路蛋白的表达,验证芍药苷对脑梗死周围区域血管新生相关信号通路蛋白的活化及表达的干预情况。试验结果参见图7。由图可知,脑梗塞后,大鼠缺血区及周边组织VEGFR2和FAK蛋白磷酸化水平明显降低(P<0.05);低剂量的芍药苷可明显增强VEGFR2和FAK蛋白磷酸化(P<0.05)。实施例1芍药苷冻干粉针的制备:称取芍药苷原料15g及药用甘露醇40.0g,溶于1000ml注射用水中,充分搅拌使溶解,补加注射用水至2000ml,加入针用活性碳2.0g,加热至60℃搅拌30分钟,碳棒过滤,滤液经0.25μm微孔滤膜过滤除菌,分装于1000支西林瓶中,装量2.0ml/支,冷冻干燥,即得。每支含芍药苷15mg。实施例2芍药苷注射液的制备:精密称取芍药苷原料28.9g,溶于1000ml注射用水中,充分搅拌使溶解,补加注射用水至2000ml,加入针用活性碳2.0g,加热至60℃搅拌30分钟,碳棒过滤,滤液经0.25μm微孔滤膜过滤除菌,分装于1000支西林瓶中,装量2.0ml/支,封口,灭菌,即得。每支含芍药苷28.9mg。本发明并不限于上述实施方式,在不背离本发明的实质内容的情况下,本领域技术人员可以想到的任何变形、改进、替换均落入本发明的范围。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1