亚丁基苯酞的用途的制作方法
本发明是关于亚丁基苯酞(butylidenephthalide,BP)的应用,包括预防、减缓及/或抑制癌症干细胞(cancer stem cells,CSCs),尤其是口腔癌干细胞、鼻咽癌干细胞、食道癌干细胞、骨髓瘤干细胞、皮肤癌干细胞、黑色素瘤干细胞、甲状腺癌干细胞、淋巴瘤干细胞、血癌干细胞、乳癌干细胞、膀胱癌干细胞、卵巢癌干细胞、子宫颈癌干细胞、前列腺癌干细胞、胃癌干细胞、肝癌干细胞、肺癌干细胞、大肠癌干细胞、直肠癌干细胞、胰脏癌干细胞、胆囊癌干细胞、肾脏癌干细胞、神经胶母细胞瘤干细胞、胸腺恶性肿瘤干细胞、横纹肌肉瘤干细胞、脑瘤干细胞、及髓母细胞瘤干细胞,特别是口腔癌干细胞、胰脏癌干细胞、及脑瘤干细胞(brain tumor stem cell)的生长、迁移(migration)、侵袭(invasion)及/或转移(metastasis)。
背景技术:
肿瘤(tumor)在医学上是指细胞的异常病变,此种病变是在各种致瘤因素(carcinogenic factor)作用下,使身体局部组织的细胞在基因层次上失去对其生长的正常调控,导致细胞异常增生且集结成为肿块,因而称为“肿瘤”。其中,“癌症”即为最常见的肿瘤形态,异常增生的“癌细胞”除了会集结成为肿块,更会扩散、转移至身体其他组织或器官,故又称作恶性肿瘤(malignant tumor)。癌细胞的增生以及转移会导致严重的生理功能异常且难以治愈,故近年来癌症已成为全球人类死因之首。
传统的癌症治疗方式包括外科手术治疗、化学疗法以及放射线疗法等,然而,手术切除肿块的方式通常无法有效根治癌症,大概因未完全切除的癌细胞仍可持续地生长,使患者的病情又趋于恶化。因此,一般几乎不会仅以手术切除的方式来治疗癌症,而会搭配其他治疗方式,例如化学疗法及╱或放射线疗法。其中,化学疗法为使用化学药物(例如:烷基化剂(alkylating agent))对生长快速的癌细胞进行毒杀作用。然而,多数化学疗法所使用的药物也会作用于正常细胞,对癌症患者造成严重的副作用,包括呕吐、秃发、倦态、出血以及贫血等。至于放射线疗法(例如:伽玛刀疗法),其为利用快速分裂的癌细胞对于放射线较正常细胞敏感的原理,造成癌细胞DNA断裂,进而杀死癌细胞。然而,以高能量的放射线摧毁癌细胞的同时也会照射到正常细胞,此会导致例如白血球减少、疲倦、失眠、疼痛、食欲不佳等副作用。此外,化学疗法及放射线疗法对于部分晚期患者的治疗效果并不佳。
研究指出,多数的癌细胞并不具有引起肿瘤发生的能力,只有极少部分癌细胞具有致瘤性(tumorigenicity),这些癌细胞具有干细胞性质,也就是自我更新(self-renewal)及分化(differentiation)的能力,会不断生长及分化成不同种类、型态的肿瘤细胞,而被称为癌症干细胞(cancer stem cells,CSCs),或称为肿瘤干细胞。研究另外证实,癌症干细胞具有形成肿瘤、发展成癌症的潜力,特别是当转移至身体其他组织或器官时,会发展成其他种类的癌症。此外,相较于其他癌症细胞,在例如血癌、乳癌、脑癌、卵巢癌、前列腺癌、大肠癌、直肠癌、口腔癌等不同的癌症组织中,癌症干细胞对化学疗法或放射线疗法更具抵抗性,此与肿瘤的复发、侵袭、转移、及病患的存活率有极密切的关联。因此,若能有效的预防、减缓、或抑制癌症干细胞的生长、迁移、侵袭、或转移,即可提高肿瘤及癌症治疗的成功率以及提升病患的存活率。
然而,目前临床医学上的治疗方式(包括外科手术治疗、化学疗法以及放射线疗法等)对于预防、减缓、或抑制癌症干细胞的生长、迁移、侵袭、或转移的成效皆相当有限。因此,持续开发可有效预防、减缓、或抑制癌症干细胞的生长、迁移、侵袭、或转移的方法或药物,以降低发病率、复发率及死亡率、提升治愈率、及减少副作用,有相当的必需性及迫切性。
本案发明人研究发现,亚丁基苯酞(butylidenephthalide,BP)可有效抑制癌症干细胞的生长因子、干细胞性(stemness)因子、上皮细胞间质转化(epithelial-mesenchymal transition,EMT)因子、及明胶酶(gelatinase)的表现,尤其可有效抑制Sox-2、Oct4、及EZH2的表现,故可抑制癌症干细胞的生长、迁移、侵袭、及转移,从而可用于提供预防、减缓及/或抑制癌症干细胞的生长、迁移、侵袭及/或转移的药剂、食品、或食品添加剂。
技术实现要素:
本发明的一目的,在于提供一种预防、减缓及/或抑制癌症干细胞(cancer stem cells,CSCs)的生长、迁移(migration)、侵袭(invasion)及/或转移(metastasis)的方法,其包括于有需要的个体中投予有效量的亚丁基苯酞(butylidenephthalide,BP)。
具体的,本发明的目的,在于提供一种使用亚丁基苯酞(BP)于制造一制剂的用途,该制剂是用以预防、减缓及/或抑制癌症干细胞的生长、迁移、侵袭及/或转移。
其中,该制剂是用于抑制Sox-2、Oct4、及EZH2的表现以预防、减缓及/或抑制癌症干细胞的生长、迁移、侵袭及/或转移。
其中,该癌症干细胞为以下的至少一种:口腔癌干细胞、鼻咽癌干细胞、食道癌干细胞、骨髓瘤干细胞、皮肤癌干细胞、黑色素瘤干细胞、甲状腺癌干细胞、淋巴瘤干细胞、血癌干细胞、乳癌干细胞、膀胱癌干细胞、卵巢癌干细胞、子宫颈癌干细胞、前列腺癌干细胞、胃癌干细胞、肝癌干细胞、肺癌干细胞、大肠癌干细胞、直肠癌干细胞、胰脏癌干细胞、胆囊癌干细胞、肾脏癌干细胞、神经胶母细胞瘤干细胞、胸腺恶性肿瘤干细胞、横纹肌肉瘤干细胞、脑瘤干细胞、及髓母细胞瘤干细胞。
其中,该癌症干细胞为口腔癌干细胞、胰脏癌干细胞、及/或脑瘤干细胞。
其中,该癌症干细胞为口腔癌干细胞。
其中,该癌症干细胞为胰脏癌干细胞。
其中,该癌症干细胞为脑瘤干细胞。
其中,该制剂为一药剂、一食品、或一食品添加剂。
其中,该制剂为一药剂且该药剂的用量,以亚丁基苯酞(BP)计,为每天约30毫克/公斤体重至约500毫克/公斤体重。
其中,该药剂的用量,以亚丁基苯酞(BP)计,为每天约40毫克/公斤体重至约120毫克/公斤体重。
本发明的详细技术内容及部分具体实施例例,将描述于以下内容中,以供本领域技术人员据以明了本发明的特征。
附图说明
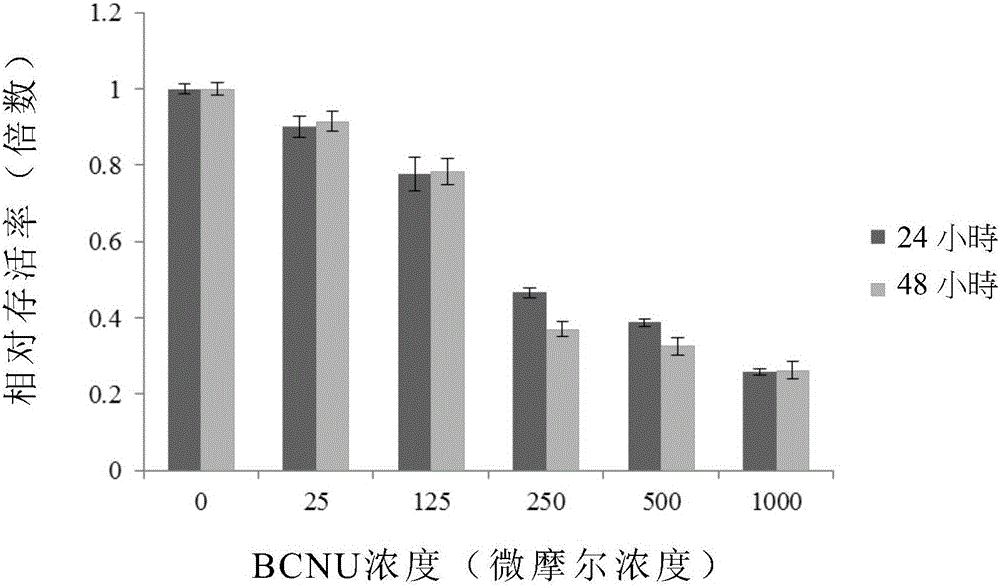
图1是显示经不同处理后的脑瘤干细胞CSCsCD133+细胞株的相对存活率的直方图,其中图1A显示经不同浓度的亚丁基苯酞(BP)处理后的结果,图1B显示经不同浓度的双氯乙基亚硝脲(BCNU)处理后的结果;
图2是显示经不同浓度的亚丁基苯酞(BP)处理的正常人类口腔角质细胞(Normal Human Oral Keratinocyte,NHOK,即◆)或类头颈癌起始细胞的口腔癌干细胞ALDH1+CD44+-1细胞株(即,■)及ALDH1+CD44+-2细胞株(即,▲)的存活率的曲线图;
图3至图5显示以西方墨点法分析经不同浓度的亚丁基苯酞(BP)处理的脑瘤干细胞CSCsCD133+细胞株的干细胞性(stemness)维持标志蛋白的表现的结果,其中图3是显示EZH2蛋白及肌动蛋白的表现的照片图,图4是显示CD133蛋白及肌动蛋白的表现的照片图,图5是显示Sox-2蛋白、Oct4蛋白、及β-肌动蛋白的表现的照片图;
图6是显示以西方墨点法分析经不同浓度的亚丁基苯酞(BP)处理的胰脏癌细胞MiaPaCa-2细胞株的Sox-2蛋白、CD133蛋白、CD44蛋白、及β-肌动蛋白的表现的照片图;
图7是显示以西方墨点法分析经不同浓度的亚丁基苯酞(BP)处理的类头颈癌起始细胞的口腔癌干细胞ALDH1+CD44+-1细胞株及ALDH1+CD44+-2细胞株的Oct4蛋白、Sox-2蛋白、及GAPDH蛋白的表现的照片图;
图8显示以流式细胞仪分析经不同浓度的亚丁基苯酞(BP)处理的类头颈癌起始细胞的口腔癌干细胞ALDH1+CD44+-1细胞株及ALDH1+CD44+-2细胞株于存在或不存在DEAB的情况下的ALDH活性所得的结果;
图9A是显示以西方墨点法分析经不同浓度的亚丁基苯酞(BP)处理的脑瘤干细胞CSCsCD133+细胞株的Axl蛋白、Gas6蛋白、及肌动蛋白表现的照片图;
图9B是显示以反转录-聚合酶连锁反应分析经不同浓度的亚丁基苯酞(BP)处理的脑瘤干细胞CSCsCD133+细胞株的Axl基因及GAPDH基因表现的照片图;
图10是显示以西方墨点法分析经不同浓度的亚丁基苯酞(BP)处理的脑瘤干细胞CSCsCD133+细胞株的MMP-2蛋白及肌动蛋白表现的照片图;
图11显示以侵袭试验系统分析经不同浓度的亚丁基苯酞(BP)处理的口腔癌干细胞ALDH1+CD44+-1细胞株及ALDH1+CD44+-2细胞株的的侵袭能力所得的结果,其中图11A是显示位于侵袭试验系统下室中的聚碳酸酯滤膜的染色结果的照片图,图11B是显示量化后的相对侵袭能力的直方图;
图12是显示以西方墨点法分析经不同浓度的亚丁基苯酞(BP)处理的脑瘤干细胞CSCsCD133+细胞株的E-cadherin蛋白、TGFβ-1蛋白、Slug蛋白、及β-肌动蛋白表现的照片图;
图13是显示以伤口愈合试验测试脑瘤干细胞CSCsCD133+细胞株,经不同处理后的迁移能力所得的结果,其中上两排显示经不同浓度的亚丁基苯酞(BP)处理后的结果的照片图,而下两排显示经不同浓度的双氯乙基亚硝脲(BCNU)处理后的结果的照片图;
图14A是显示于显微镜下观察带有pcDNA3.0-Axl或pcDNA3.0-neo质体的脑瘤干细胞CSCsCD133+细胞株的照片图;
图14B是显示以西方墨点法分析带有pcDNA3.0-Axl或pcDNA3.0-neo质体的脑瘤干细胞CSCsCD133+细胞株的Axl-1蛋白及β-肌动蛋白表现的照片图;
图14C显示以伤口愈合试验测试经不同浓度的亚丁基苯酞(BP)处理后的带有pcDNA3.0-Axl或pcDNA3.0-neo质体的脑瘤干细胞CSCsCD133+细胞株的迁移能力所得的结果;
图15以软洋菜胶细胞群落形成方法探讨经不同浓度的亚丁基苯酞(BP)处理后的口腔癌干细胞的肿瘤起始活性所得的结果,其中图15A是显示ALDH1+CD44+-1细胞株及ALDH1+CD44+-2细胞株的细胞群落形成的照片图,图15B是显示ALDH1+CD44+-1细胞株及ALDH1+CD44+-2细胞株的相对细胞群落形成能力的直方图;以及
图16显示以动物实验分析亚丁基苯酞(BP)于抑制癌症干细胞的肿瘤起始活性所得的结果,包括未经亚丁基苯酞(BP)处理的控制组小鼠(以「」显示)、每天注射100毫克/公斤体重的亚丁基苯酞(BP)的实验组小鼠(以「」显示)、及每天注射200毫克/公斤体重的亚丁基苯酞(BP)的实验组小鼠(以「」显示)的结果,其中图16A显示各组小鼠在不同时间点的平均体重(克),图16B显示各组小鼠在不同时间点的平均肿瘤体积,图16C是显示各组小鼠的GFP信号强度的照片图,图16D是显示将各组小鼠的GFP信号强度量化后的结果的直方图。
具体实施方式
以下将描述根据本发明的部分具体实施例;但,在不背离本发明精神下,本发明还可以多种不同形式的态样来实践,不应将本发明权利要求书为限于说明书所陈述的。此外,除非文中有另外说明,于本说明书中(尤其是在权利要求书中)所使用的“一”、“该”及类似用语应理解为包括单数及复数形式;所谓“有效量”或“治疗有效量”,是指投予至个体时,可有效至少部分改善怀疑个体的病情的化合物数量;所谓“个体”是指哺乳动物,哺乳动物可为人类或非人动物。
本案发明人发现,对于一癌症干细胞,亚丁基苯酞(BP)具有以下至少一种效果:抑制癌症干细胞的存活率、抑制癌症干细胞生长因子(例如:EZH2蛋白)表现、抑制癌症干细胞的干细胞性维持的标志(例如:CD133蛋白、Sox-2蛋白、Oct4蛋白)的表现、抑制与癌症干细胞的增生、抗细胞凋亡、迁移、及侵袭相关的基因(例如:Axl基因)或蛋白(例如:Axl蛋白、Gas6蛋白、MMP-2蛋白)的表现、抑制与癌症干细胞的转移相关的蛋白(例如:E-cadherin蛋白、TGFβ-1蛋白、及Slug蛋白)的表现、以及抑制癌症干细胞迁移至伤口的能力。于本发明部分具体实施例中,亚丁基苯酞(BP)通过抑制Sox-2、Oct4、及EZH2的表现,以预防、减缓及/或抑制癌症干细胞的生长、迁移、侵袭及/或转移。
因此,本发明关于使用亚丁基苯酞(BP)于制造一制剂的用途。其中,该制剂用以预防、减缓及/或抑制癌症干细胞的生长、迁移、侵袭及/或转移。
本发明制剂可适用于任何适宜的癌症干细胞,包括例如:口腔癌干细胞、鼻咽癌干细胞、食道癌干细胞、骨髓瘤干细胞、皮肤癌干细胞、黑色素瘤干细胞、甲状腺癌干细胞、淋巴瘤干细胞、血癌干细胞、乳癌干细胞、膀胱癌干细胞、卵巢癌干细胞、子宫颈癌干细胞、前列腺癌干细胞、胃癌干细胞、肝癌干细胞、肺癌干细胞、大肠癌干细胞、直肠癌干细胞、胰脏癌干细胞、胆囊癌干细胞、肾脏癌干细胞、神经胶母细胞瘤干细胞、胸腺恶性肿瘤干细胞、横纹肌肉瘤干细胞、脑瘤干细胞、及髓母细胞瘤干细胞。于本发明部分具体实施例中,该制剂用于预防、减缓及/或抑制口腔癌干细胞、胰脏癌干细胞及/或脑瘤干细胞的生长、迁移、侵袭及/或转移。
根据本发明所提供的制剂可以呈任何适宜的形式,并无特殊的限制。举例言之,但不以此为限,该制剂可以药剂的形式提供,也可以呈固体或流体的食品或食品添加剂的形式提供。
当以药剂的形式提供本发明制剂时,该药剂可视所欲的投药形式而呈对应的适宜剂型。举例言之,但不以此为限,该药物可以口服或非经口服(例如皮下、静脉内、肌肉、腹腔、或鼻腔)的投药方式施用至有需要的个体上。视使用形式及用途而定,可选用适宜的载剂以提供该药剂。
以适于口服投药的剂型为例,本发明所提供的药剂可含有任何不会对亚丁基苯酞(BP)的所欲实现的效果有不利影响的医药上可接受的载剂,例如:溶剂(水、食盐水、葡萄糖(dextrose)、甘油、乙醇或其类似物、及前述的组合)、油性溶剂、稀释剂、安定剂、吸收延迟剂、崩散剂、乳化剂、抗氧化剂、黏合剂、结合剂、增黏剂、分散剂、悬浮化剂、润滑剂、吸湿剂、固体载剂(例如淀粉、皂土(bentonite))等。可利用任何适宜的方法,以适于口服投药的剂型提供该药剂,例如:锭剂(例如糖衣锭)、丸剂、胶囊剂、颗粒剂、散剂、流浸膏剂、溶液剂、糖浆剂、悬液剂、乳剂、及酊剂等。
至于适于皮下、静脉内、肌肉、或腹腔注射的注射剂型或点滴剂型,则可于本发明所提供的药剂中含有一或多种例如溶液、盐类缓冲液(如磷酸盐缓冲液或柠檬酸盐缓冲液)、增溶剂、乳化剂、5%糖溶液、以及其他载剂等成分,以静脉输注液、乳剂静脉输注液、干粉注射剂、悬液注射剂、或干粉悬液注射剂等剂型提供该药剂。或者,将该药剂制备成一注射前固体,以可溶于其他溶液或悬浮液中的剂型、或可乳化的剂型提供该注射前固体,并于投予至该有需要的个体之前,将该注射前固体溶于其他溶液或悬浮液中或将其乳化,提供所欲的注射剂。此外,适于经鼻腔或经皮肤投予的外用剂型,则例如乳液、乳霜、凝胶(例如水凝胶)、膏状物(例如分散膏、软膏)、喷雾剂、或溶液(例如洗液、悬浮液)。
视需要地,可于本发明所提供的药剂中另外含有适宜用量的添加剂,例如可提高该药剂于服用时的口适感及视觉感受的调味剂、调色剂、着色剂等,以及可改善该药剂的稳定性及储存性的缓冲剂、保存剂、防腐剂、抗菌剂、抗真菌剂等。此外,该药剂可视需要另外含有一种或多种其他活性成分,或者与含有该一种或多种其他活性成分的药物并用,以进一步加强该药剂的功效或增加制剂配方的运用灵活性与调配度,只要该其他活性成分对亚丁基苯酞(BP)的所欲实现的效果没有不利的影响即可。
可以一日一次、一日多次、或数日一次等不同频率施用本发明所提供的药剂,视投予个体的年龄、体重、及健康况状(例如:所欲处理的病症以及该病症的严重程度)而异。举例言之,当以口服方式施用至一个体以预防、减缓及/或抑制癌症干细胞的生长、迁移、侵袭及/或转移时,以亚丁基苯酞(BP)计,其用量为每天约30毫克/公斤体重至约500毫克/公斤体重,较佳为每天约40毫克/公斤体重至约120毫克/公斤体重,更佳为每天约50毫克/公斤体重至约90毫克/公斤体重,其中,该单位“毫克/公斤体重”是指每公斤体重个体所须的投药量。但,对于急性患者而言,其用量可视实际需要而酌增,例如增加至数倍或数十倍。
视需要地,可将本发明药剂与以下之一者并用,以预防、减缓及/或抑制癌症干细胞的生长、迁移、侵袭及/或转移:外科手术治疗、化学疗法、放射线疗法、抗体疗法、免疫疗法、抗血管生成疗法、表现型的改变疗法、及分化疗法。
当根据本发明所提供的制剂以食品添加物的形式提供时,其可呈例如粉末、液体、悬浮液、颗粒等不同型态,以方便于食品制造过程中添加;而当该制剂以食品的形式提供时,则可为例如乳制品、肉类加工品、面包类、面食品、饼干、口含锭、果汁类、茶类、运动饮料、营养饮料等,且可以是健康食品(例如:术后营养补充品),但不以此为限。
可以一日一次、一日多次、或数日一次等不同频率食用本发明所提供的健康食品,视投予个体的年龄、体重、及健康况状而异。也可针对特定族群调整本发明所提供的健康食品中亚丁基苯酞(BP)的含量,较佳为调整至每日应服用的量。举例言之,若一个体的建议摄取量为每日约50毫克亚丁基苯酞(BP),又该健康食品每份含25毫克的亚丁基苯酞(BP),则该个体每日可食用大约二份该健康食品。
可于本发明健康食品的外包装标示建议使用量、特定族群(例如孕妇、糖尿病患者)的使用标准及条件、或与其他食品或医药共同服用的建议事项,以利用户在无医师、药师或相关执事人员指导下可在家自行服用而无安全疑虑。
本发明另外提供一种预防、减缓及/或抑制癌症干细胞的生长、迁移、侵袭及/或转移的方法,其包括于有需要的个体中投予有效量的亚丁基苯酞(BP)。其中,有关亚丁基苯酞(BP)的施用型态与适用剂量,以及适用的癌症干细胞的态样等,均如上述的说明。
现以下列实施例进一步例示说明本发明。其中,这些实施例仅提供作为说明,而非用以限制本发明的保护范围。本发明保护范围以权利要求书中的为准。
实施例
实施例1:亚丁基苯酞(BP)于抑制癌症干细胞生长的效果
(1-1)
为研究亚丁基苯酞(BP)于抑制癌症干细胞生长的效果,分别以不同浓度(0、25、50、62.5、75、100微克/毫升)的亚丁基苯酞(BP)、不同浓度(0、25、125、250、500、1000微摩尔浓度)的双氯乙基亚硝脲(bis-chloroethylnitrosourea,BCNU;为目前临床上用于治疗恶性脑胶质瘤的化学疗法药物之一)、或不同浓度(0、100、200、400、800、1600微摩尔浓度的替莫唑胺(temozolomide,TMZ;为目前临床上用于治疗恶性脑胶质瘤的化学疗法药物之一),对脑瘤干细胞CSCsCD133+细胞株或恶性脑胶质瘤DBTRG细胞株进行处理,历时24或48小时,其后,利用细胞存活率试验(MTT assay)分析脑瘤干细胞CSCsCD133+细胞株及恶性脑胶质瘤DBTRG细胞株的存活率。以处理浓度为0的组别的结果为基准,计算各实验组的细胞相对存活率,结果示于图1A、1B、及表1。
表1
由图1A、1B可知,不论处理24或48小时,脑瘤干细胞CSCsCD133+细胞株的相对存活率皆明显随着亚丁基苯酞(BP)或双氯乙基亚硝脲(BCNU)的浓度提高而下降。另一方面,由表1可知,以亚丁基苯酞(BP)、双氯乙基亚硝脲(BCNU)、或替莫唑胺(TMZ)处理脑瘤干细胞CSCsCD133+细胞株24小时的半抑制浓度(The halfmaximal inhibitory concentration,IC50)分别为406微摩尔浓度(即,76.5微克/毫升)、377.6微摩尔浓度(即,80.8微克/毫升)、及大于1600微摩尔浓度(即,大于310.6微克/毫升)。前述结果显示,亚丁基苯酞(BP)对于癌症干细胞的生长具有抑制效果,且优于目前临床上的化学疗法药物。
(1-2)
分别以不同浓度(0、25、50、100微克/毫升)的亚丁基苯酞(BP),对正常人类口腔角质细胞(Normal Human OralKeratinocyte,NHOK)或类头颈癌起始细胞(head and neckcancer-derived tumor initiating cell-like,HNC-TIC-like)的口腔癌干细胞ALDH1+CD44+-1细胞株及ALDH1+CD44+-2细胞株进行处理,历时24小时,其后,利用细胞存活率试验(MTT assay)分析正常人类口腔角质细胞、类头颈癌起始细胞的口腔癌干细胞ALDH1+CD44+-1及ALDH1+CD44+-2细胞株的存活率,结果示于图2。
由图2可知,正常人类口腔角质细胞的存活率并未随着亚丁基苯酞(BP)的浓度提高而下降,而类头颈癌起始细胞的口腔癌干细胞ALDH1+CD44+-1及ALDH1+CD44+-2细胞株的存活率皆明显随着亚丁基苯酞(BP)的浓度提高而下降。前述结果再次证明,亚丁基苯酞(BP)对于癌症干细胞的生长具有抑制效果,且对正常的细胞不具细胞毒性,不会引发因细胞毒性所导致的副作用,故可用于提供一优良的抑制癌症干细胞生长的药物。
实施例2:亚丁基苯酞(BP)于抑制癌症干细胞生长因子表现的效果
已知基因增强子同源物2(enhancer of zeste homolog 2,EZH2)基因为癌症干细胞的一关键生长因子,其影响癌症干细胞的生长。因此,分别以不同浓度(0、12.5、25、50、62.5、75微克/毫升)的亚丁基苯酞(BP),对脑瘤干细胞CSCsCD133+细胞株进行处理,其后,萃取细胞的蛋白质,并以西方墨点法(Western Blotting)确认经亚丁基苯酞(BP)处理的脑瘤干细胞CSCsCD133+细胞株的EZH2蛋白的表现,结果示于图3。
由图3可知,脑瘤干细胞CSCsCD133+细胞株的EZH2蛋白的表现明显随着亚丁基苯酞(BP)的浓度提高而下降。前述结果再次证明,亚丁基苯酞(BP)对于癌症干细胞的生长具有抑制效果。
实施例3:亚丁基苯酞(BP)于抑制癌症细胞及癌症干细胞的干细胞性(stemness)的效果
(3-1)
已知CD44蛋白、CD133蛋白、Sox-2(sex-determining region Yprotein(SRY)-related high-mobility group box 2)蛋白、及Oct4(octamerbinding transcription factor 4)蛋白皆为癌症干细胞维持其干细胞性(stemness)的重要标志(marker),参与调节癌症干细胞的自我更新及分化。因此,分别以不同浓度(0、12.5、25、50、62.5、75微克/毫升)的亚丁基苯酞(BP),对脑瘤干细胞CSCsCD133+细胞株进行处理,历时24小时,其后,萃取细胞的蛋白质,并以西方墨点法确认经亚丁基苯酞(BP)处理的脑瘤干细胞CSCsCD133+细胞株的CD133蛋白、Sox-2蛋白、及Oct4蛋白的表现,结果示于图4及图5。另外,分别以不同浓度(0、12.5、25、50微克/毫升)的亚丁基苯酞(BP),对胰脏癌细胞MiaPaCa-2细胞株进行处理,历时24小时,其后,萃取细胞的蛋白质,并以西方墨点法确认经亚丁基苯酞(BP)处理的胰脏癌细胞MiaPaCa-2细胞株的Sox-2蛋白、CD133蛋白、及CD44蛋白的表现,结果示于图6。又,分别以不同浓度(0、25、50微克/毫升)的亚丁基苯酞(BP),对类头颈癌起始细胞的口腔癌干细胞ALDH1+CD44+-1或ALDH1+CD44+-2细胞株进行处理,历时24小时,其后,萃取细胞的蛋白质,并以西方墨点法确认经亚丁基苯酞(BP)处理的类头颈癌起始细胞的口腔癌干细胞ALDH1+CD44+-1及ALDH1+CD44+-2细胞株的Sox-2蛋白及Oct4蛋白的表现,结果示于图7。
由图4及图5可知,脑瘤干细胞CSCsCD133+细胞株的CD133蛋白、Sox-2蛋白、及Oct4蛋白的表现明显随着亚丁基苯酞(BP)的浓度提高而下降。另外,由图6可知,胰脏癌细胞MiaPaCa-2细胞株的Sox-2蛋白、CD133蛋白、及CD44蛋白的表现也随着亚丁基苯酞(BP)的浓度提高而下降。又,由图7可知,类头颈癌起始细胞的口腔癌干细胞ALDH1+CD44+-1及ALDH1+CD44+-2细胞株的Sox-2蛋白及Oct4蛋白的表现皆随着亚丁基苯酞(BP)的浓度提高而下降。前述结果显示,亚丁基苯酞(BP)具有抑制癌症细胞及癌症干细胞的干细胞性的效果。
(3-2)
ALDH蛋白也为癌症干细胞维持其干细胞性(stemness)的重要标志(marker),参与调节癌症干细胞的自我更新及分化。因此,分别以不同浓度(0、25、50微克/毫升)的亚丁基苯酞(BP),对类头颈癌起始细胞的口腔癌干细胞ALDH1+CD44+-1及ALDH1+CD44+-2细胞株进行处理,历时24小时。其后,由各组取1×105个细胞悬浮于50微升干细胞鉴定组(ALDEFLUOR array kit,购自加拿大温哥华STEMCELL Technologies公司)的缓冲溶液中,并于该细胞悬浮液中加入ALDEFLUOR至最终浓度为1微摩尔浓度。接着,以7-ADD进行染色,再以流式细胞仪分析经亚丁基苯酞(BP)处理的类头颈癌起始细胞的口腔癌干细胞ALDH1+CD44+-1及ALDH1+CD44+-2细胞株的ALDH蛋白的活性(称为实验组),结果示于图8。
重复前述实验,但于细胞悬浮液中一并加入N,N-二乙基-4-氨基苯甲醛(N,N-diethylaminobenzaldehyde,DEAB;为ALDH抑制剂)至最终浓度为150微摩尔浓度,此为控制组,结果也示于图8。
由图8可知,于加入DEAB的控制组中,不论是否经亚丁基苯酞(BP)处理,具有ALDH蛋白活性的活细胞仅占所有活细胞的0.1%。另一方面,于未加入DEAB的实验组中,具有ALDH蛋白活性的活细胞数量随着亚丁基苯酞(BP)的浓度提高而减少。前述结果显示亚丁基苯酞(BP)具有抑制癌症干细胞的ALDH蛋白活性的效果,再次证明亚丁基苯酞(BP)具有抑制癌症干细胞的干细胞性的效果。
实施例4:亚丁基苯酞(BP)于抑制癌症干细胞的增生、抗细胞凋亡、迁移、侵袭的效果
(4-1)
已知Axl(即,一酪胺酸激酶受体(receptor tyrosine kinase))的表现与癌症干细胞的增生、抗细胞凋亡、迁移、侵袭的能力有关。因此,以不同浓度(0、12.5、25、50、62.5、75微克/毫升)的亚丁基苯酞(BP),对脑瘤干细胞CSCsCD133+细胞株进行处理,历时24小时,其后,萃取细胞的蛋白质及总RNA(total RNA),并进行西方墨点法和反转录-聚合酶连锁反应(reversetranscriptase-polymerase chain reaction,RT-PCR),以确认经亚丁基苯酞(BP)处理的脑瘤干细胞CSCsCD133+细胞株的Axl蛋白、Gas6蛋白(即,Axl的配体蛋白)、及Axl基因的表现,结果示于图9A、9B。
由图9A、9B可知,Axl蛋白、Gas6蛋白、及Axl基因的表现皆明显随着亚丁基苯酞(BP)的浓度提高而下降。前述结果显示,亚丁基苯酞(BP)具有抑制癌症干细胞的增生、抗细胞凋亡、迁移、侵袭的效果。
(4-2)
已知癌症干细胞进行侵袭时,需先通过基质金属蛋白酶(Matrix metalloproteinase,MMP)将细胞外基质(extracellularmatrix,ECM)分解。其中,明胶酶(gelatinases)的表达和肿瘤扩散的组织病理学有着高度相关性,包括Gelatinase-A(即,MMP-2)与Gelatinase-B(即,MMP-9)。因此,以不同浓度(0、12.5、25、50、62.5、75微克/毫升)的亚丁基苯酞(BP),对脑瘤干细胞CSCsCD133+细胞株进行处理,历时24小时,其后,萃取细胞的蛋白质,并进行西方墨点法确认经亚丁基苯酞(BP)处理的脑瘤干细胞CSCsCD133+细胞株的MMP-2蛋白的表现,结果示于图10。
由图10可知,MMP-2蛋白的表现明显随着亚丁基苯酞(BP)的浓度提高而下降。前述结果再次证明,亚丁基苯酞(BP)具有抑制癌症干细胞的迁移及侵袭的效果。
(4-3)
本研究进一步以穿透式侵袭试验系统(system,购自英国Corning公司)搭配孔径大小为8微米的聚碳酸酯滤膜(购自英国Corning公司)探讨亚丁基苯酞(BP)于抑制癌症干细胞的迁移及侵袭的效果。首先,将基底凝胶(MatrigelTM,购自美国BDPharmingen公司)涂覆于该聚碳酸酯滤膜上,再将经涂覆的聚碳酸酯滤膜置于该穿透式侵袭试验系统的下室(lower chamber)中,并于下室加入含有10%血清的培养液。另一方面,以不同浓度(0、25、50微克/毫升)的亚丁基苯酞(BP),对类头颈癌起始细胞的口腔癌干细胞ALDH1+CD44+-1及ALDH1+CD44+-2细胞株进行处理,历时24小时。其后,以1×105个细胞/100微升的细胞密度,将前述经处理的口腔癌干细胞以不含血清的培养液继续培养于该穿透式侵袭试验系统的上室(upper chamber)中,历时24小时。最后,去除下室中的培养液,取出下室中的聚碳酸酯滤膜并以4%的甲醛水溶液进行固定,经结晶紫(crystal violet)染色后,于显微镜下以100倍的放大倍率计数五个不同视野下的细胞数目,并拍照纪录,结果示于图11A。以处理浓度为0微克/毫升的组别的结果为基准,计算各实验组细胞的相对侵袭能力,结果示于图11B。
由图11A可知,该聚碳酸酯滤膜上的细胞数目明显随着亚丁基苯酞(BP)的浓度提高而减少,且由图11B可知,该癌症干细胞的相对侵袭能力也随着亚丁基苯酞(BP)的浓度提高而降低。前述结果再次证明,亚丁基苯酞(BP)具有抑制癌症干细胞的迁移及侵袭的效果。
实施例5:亚丁基苯酞(BP)于抑制癌症干细胞转移的效果
(5-1)
已知癌症干细胞发生上皮细胞间质转化(epithelial-mesenchymal transition,EMT)时,癌症干细胞的E-黏附蛋白(E-cadherin)的表现会下降,使得癌症干细胞间的聚集力降低、产生高度侵袭性与移动力、且脱离原发肿瘤,而发生转移。因此,以不同浓度(0、12.5、25、50、62.5、75微克/毫升)的亚丁基苯酞(BP),对脑瘤干细胞CSCsCD133+细胞株进行处理,历时24小时,其后,萃取细胞的蛋白质,并以西方墨点法确认经亚丁基苯酞(BP)处理的脑瘤干细胞CSCsCD133+细胞株的E-cadherin蛋白、TGFβ-1蛋白(具有诱发上皮细胞间质转化的能力)、及Slug蛋白(Snail转录抑制蛋白家族的成员之一,具有促进癌细胞转移的特性)的表现,结果示于图12。
由图12可知,TGFβ-1蛋白及Slug蛋白的表现皆明显随着亚丁基苯酞(BP)的浓度提高而下降,而E-cadherin蛋白的表现则随着亚丁基苯酞(BP)的浓度提高而增加。前述结果显示,亚丁基苯酞(BP)通过抑制TGFβ-1蛋白及Slug蛋白的表现,而调控E-cadherin蛋白的表现增加,故可用于抑制癌症干细胞发生上皮细胞间质转化、抑制癌症干细胞转移。
(5-2)
本研究进一步以伤口愈合试验(wound healing assay)探讨亚丁基苯酞(BP)于抑制癌症干细胞转移的效果。首先,以不同浓度(0、12.5、25、50、62.5、75微克/毫升)的亚丁基苯酞(BP)或不同浓度(0、25、50、100、200、400微摩尔浓度)的双氯乙基亚硝脲(BCNU),对脑瘤干细胞CSCsCD133+细胞株进行处理,历时24小时。同时,于进行该处理的第0及24小时,观察脑瘤干细胞CSCsCD133+细胞株迁移至伤口的情形,并拍照纪录,结果示于图13。
由图13可知,相较于以双氯乙基亚硝脲(BCNU)处理的脑瘤干细胞CSCsCD133+细胞株,其迁移至伤口的细胞数目并未随着双氯乙基亚硝脲(BCNU)的浓度提高而减少,以亚丁基苯酞(BP)处理的脑瘤干细胞CSCsCD133+细胞株迁移至伤口的细胞数目明显随着亚丁基苯酞(BP)的浓度提高而减少。前述结果显示,亚丁基苯酞(BP)具有抑制癌症干细胞转移的能力。
(5-3)
为进一步探讨亚丁基苯酞(BP)抑制癌症干细胞的转移能力是否与Axl有相关。本研究使用Lipofectmine 2000转染试剂,将pcDNA3.0-Axl以及pcDNA3.0-neo质体分别转染至脑瘤干细胞CSCsCD133+细胞株,并以200至600微克/毫升的G418进行筛选,同时也将G418添加至未转染的脑瘤干细胞CSCsCD133+细胞株进行筛选,以获得带有pcDNA3.0-Axl或pcDNA3.0-neo质体的脑瘤干细胞CSCsCD133+细胞株,其后以显微镜观察此二细胞株,并拍照,结果示于图14A。接着,萃取此两种细胞株的蛋白质,并以西方墨点法确认此两种细胞株的Axl蛋白及β-肌动蛋白的表现,结果示于图14B。另外,以不同浓度(0、12.5、25、50、62.5、75微克/毫升)的亚丁基苯酞(BP),分别对带有pcDNA3.0-Axl或pcDNA3.0-neo质体的脑瘤干细胞CSCsCD133+细胞株进行处理,历时24小时。同时,于进行该处理的第0及24小时,观察带有pcDNA3.0-Axl及pcDNA3.0-neo质体的脑瘤干细胞CSCsCD133+细胞株迁移至伤口的情形,并拍照纪录,结果示于图14C。
由图14C可知,相较于带有pcDNA3.0-neo质体的脑瘤干细胞CSCsCD133+细胞株(即,未过度表现Axl蛋白的脑瘤干细胞CSCsCD133+细胞株),其迁移至伤口的细胞数目明显随着亚丁基苯酞(BP)的浓度提高而减少,带有pcDNA3.0-Axl质体的脑瘤干细胞CSCsCD133+细胞株(即,过度表现Axl蛋白的脑瘤干细胞CSCsCD133+细胞株)迁移至伤口的细胞数目受到亚丁基苯酞(BP)抑制的现象则不明显。综合前述结果与实施例4的结果可知,亚丁基苯酞(BP)可通过抑制Axl表现而抑制癌症干细胞的转移。
实施例6:亚丁基苯酞(BP)于抑制癌症干细胞的肿瘤起始活性(tumor initiating activity)的效果
(6-1)
本研究以软洋菜胶细胞群落形成方法(soft agar colonyformation assay)探讨亚丁基苯酞(BP)于抑制癌症干细胞的肿瘤起始活性(tumor initiating activity)的效果。首先,以不同浓度(0、25、50微克/毫升)的亚丁基苯酞(BP),对类头颈癌起始细胞的口腔癌干细胞ALDH1+CD44+-1及ALDH1+CD44+-2细胞株进行处理,历时24小时,其后,将前述经处理的细胞分别以2×104的起始细胞数接种于上层洋菜胶[含有DMEM培养液(Dulbecco's ModifledEagle's Medium)、10%(v/v)胎牛血清(Fetal Calf Serum,FCS)、以及0.3%(w/v)洋菜胶](购自Sigma-Aldrich)中。另一方面,于6孔培养盘的各孔中加入2毫升的下层洋菜胶[含有DMEM培养液、10%(v/v)FCS、以及0.6%(w/v)洋菜胶](购自Sigma-Aldrich),待洋菜胶凝固后,分别于不同孔中加入2毫升的前述各组上层洋菜胶(含有口腔癌干细胞)。其后,将培养盘置于37℃培养箱中进行培养,历时4周。最后,该下层洋菜胶以0.005%的结晶紫(crystalviolet)进行染色后,置于显微镜下计数五个不同视野(直径大于或等于100微米)下的细胞群落数目,并拍照纪录,结果示于图15A。以处理浓度为0微克/毫升的组别的结果为基准,计算各实验组细胞的相对细胞群落形成能力,结果示于图15B。
由图15A可知,下层洋菜胶中的细胞群落数目明显随着亚丁基苯酞(BP)的浓度提高而减少;由图15B可知,该癌症干细胞细胞的相对细胞群落形成能力也随着亚丁基苯酞(BP)的浓度提高而减少。前述结果显示,亚丁基苯酞(BP)可有效抑制癌症干细胞的肿瘤起始活性。
(6-2)
本研究进一步以动物实验探讨亚丁基苯酞(BP)于抑制癌症干细胞的肿瘤起始活性的效果。首先,以相同条件饲养年龄介于5至6周的BALB/c-nu/nu品种的裸小鼠(每只的重量约18至22克,共9只),历时4周。然后,将转染有GFP的稳定构筑的类头颈癌起始细胞的口腔癌干细胞细胞株(1×104个/0.1毫升/每只小鼠)皮下注射到小鼠的腋下。待肿瘤生长至体积达到100立方毫米后,将小鼠分成一控制组与两个实验组(共三组,每组3只),并对该两个实验组小鼠分别注射100毫克/公斤体重/每天及200毫克/公斤体重/每天的亚丁基苯酞(BP),对控制组则仅注射vehicle[不含亚丁基苯酞(BP)],历时6天。接着,于注射亚丁基苯酞(BP)或vehicle后的第10天,每隔2天测量各组小鼠的平均体重,并测量肿瘤的平均长度与平均宽度后以下式1计算肿瘤的平均体积,结果分别示于图16A、16B(共测量22天)。同时,以IVIS影像系统针测各组小鼠的GFP信号(即,绿色荧光),并拍照纪录,结果示于图16C。并且以Image-Pro Plus软件分析各组小鼠的GFP信号强度,结果示于图16D。
式1:[长度×宽度2]/2(单位:立方毫米)
由图16A至16D可知,在小鼠的体重方面没有明显改变的情况下,相较于未注射亚丁基苯酞(BP)的控制组,实验组小鼠的GFP信号强度明显减少,且肿瘤体积于注射亚丁基苯酞(BP)后,随时间经过而减少。前述结果再次显示,亚丁基苯酞(BP)可有效抑制癌症干细胞的肿瘤起始活性。
由以上实验结果可知,亚丁基苯酞(BP)可有效于抑制癌症干细胞的存活率、抑制癌症干细胞生长因子表现、抑制癌症干细胞的干细胞性维持的标志的表现、抑制与癌症干细胞的增生、抗细胞凋亡、迁移、及侵袭相关的基因或蛋白的表现、抑制与癌症干细胞的转移相关的基因或蛋白的表现、抑制与癌症干细胞迁移至伤口的能力,尤其可有效抑制Sox-2、Oct4、及EZH2的表现,故可用以预防、减缓及/或抑制癌症干细胞的生长、迁移、侵袭及/或转移。
- 还没有人留言评论。精彩留言会获得点赞!