自组装纳米结构及其制备方法与流程
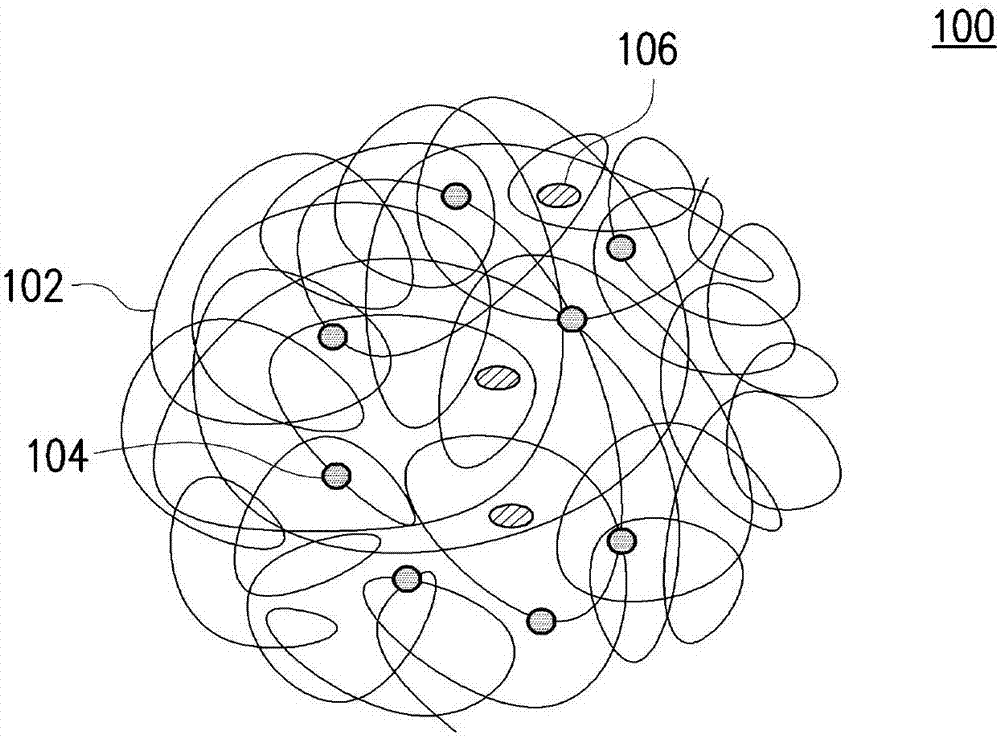
本发明是有关于一种自组装纳米结构及其制备方法,且特别是有关于一种具有显影功能的自组装纳米结构及其制备方法。
背景技术:
:磁共振成像(magneticresonanceimaging,mri)为诊断疾病且将其分阶段的重要工具,这是由于其为非侵袭性以及非辐射性的。磁共振成像中,经常利用显影剂(contrastagent)改良组织影像的解析度。在现有技术中,常使用超顺磁性氧化铁或其衍生物等含有金属的化合物作为显影剂。但氧化铁的半衰期较长,易累积在生物体组织中,长久下来有造成慢毒性的疑虑。技术实现要素:有鉴于此,本发明提供一种自组装纳米结构及其制备方法,所制备出的自组装纳米结构具有极佳的显影效果且不具生物毒性。一种自组装纳米结构(self-assemblednanostructure),包括双性几丁聚醣以及显影剂化合物。显影剂化合物嫁接于双性几丁聚醣上。在本发明的一实施例中,上述的双性几丁聚醣包括羧甲基己酰几丁聚醣(carboxymethylhexanoylchitosan,chc)、脱氧胆酸修饰羧甲基几丁聚醣(deoxycholicacidmodifiedcarboxymethylatedchitosan,dcmc)、月桂酰基硫酸几丁聚醣(lauroylsulfatedchitosan,lsc)或甲基吡咯烷酮几丁聚醣(methylpyrrolidonechitosan,mpc)。在本发明的一实施例中,上述的显影剂化合物包括核磁共振(mri)显影剂化合物。在本发明的一实施例中,上述的核磁共振显影剂化合物包括钆双胺(gadodiamide)、钆喷酸二甲葡胺(gadopentetatedimeglumine)、钆特酸葡甲胺(gadoteratemeglumine)或其组合。在本发明的一实施例中,上述的双性几丁聚醣的重均分子量为约1,000至60,000。在本发明的一实施例中,上述的自组装纳米结构缠绕成球状纳米粒子,球状纳米粒子的粒径为约5纳米至500纳米。在本发明的一实施例中,上述的自组装纳米结构为100重量份计,显影剂化合物为约1重量份至30重量份。在本发明的一实施例中,上述的自组装纳米结构包覆荧光显影剂化合物。在本发明的一实施例中,上述的荧光显影剂化合物包括荧光异硫氰酸盐(fluoresceinisothiocyanate,fitc)、c83h95n13o23s2zn2或c57h58n14o18szn2。在本发明的一实施例中,上述的自组装纳米结构包覆药物分子。在本发明的一实施例中,上述的药物分子包括顺-二氯二氨铂(ii)(cis-diamminedichloridoplatinum(ii))或其衍生物、吉西他滨(gemcitabine)或其衍生物、或去氧甲基姜黄素(demethoxycurcumin)或其衍生物。本发明提供一种自组装纳米结构的制备方法,包括:配制含有双性几丁聚醣的溶液;在所述溶液中加入显影剂化合物;在所述溶液中加入交联剂;使所述双性几丁聚醣与所述显影剂化合物进行交联反应;纯化所述溶液;以及干燥所述溶液。在本发明的一实施例中,上述的交联剂包括1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(n-(3-dimethylaminopropyl)-n′-ethylcarbodiimidehydrochloride,edc·hcl)、n-羟基丁二酰亚胺(n-hydroxysuccinimide,nhs)或其组合。在本发明的一实施例中,上述的交联反应的反应温度为约4℃至60℃。在本发明的一实施例中,上述的交联反应的反应时间为约4小时至24小时。在本发明的一实施例中,还包括在自组装纳米结构的表面上修饰具有专一辨识性的蛋白质分子。在本发明的一实施例中,上述的蛋白质分子包括表皮生长因数受体(epidermalgrowthfactorreceptor,egfr)或cd133蛋白。在本发明的一实施例中,在配制含有双性几丁聚醣的溶液时,以溶液为100重量份计,双性几丁聚醣的含量为约0.05重量份至1重量份。在本发明的一实施例中,上述的显影剂化合物包括核磁共振(mri)显影剂化合物。在本发明的一实施例中,上述的核磁共振(mri)显影剂化合物包括钆双胺(gadodiamide)、钆喷酸二甲葡胺(gadopentetatedimeglumine)、钆特酸葡甲胺(gadoteratemeglumine)或其组合。基于上述,在本发明的自组装纳米结构中,将显影剂化合物嫁接于双性几丁聚醣上,由于两者之间有化学键结,故显影剂化合物不会释放于生物体组织中而危害生物体。此外,双性几丁聚醣与显影剂化合物的键结具有加乘作用,可进一步提高显影剂化合物的显影效果。另外,可将具有专一辨识性的蛋白质分子修饰于本发明的自组装纳米结构上,使本发明的自组装纳米结构具有专一的辨识功能,可提高给药的效率。为让本发明的上述特征和优点能更明显易懂,下文特举实施例,并配合附图作详细说明如下。附图说明图1是根据本发明一实施例所绘示的自组装纳米结构的示意图;图2是根据本发明一实施例所绘示的以自组装纳米结构包覆药物分子的示意图;图3是根据本发明另一实施例所绘示的以自组装纳米结构包覆药物分子与荧光显影剂化合物的结构示意图;图4是根据本发明一实施例所绘示的自组装纳米结构的制备方法的流程图;图5是根据本发明一实施例的钆双胺、羧甲基己酰几丁聚醣及嫁接有钆双胺的羧甲基己酰几丁聚醣的红外线光谱图;图6是根据本发明一实施例的自组装纳米结构对不同药物分子的包覆率的比较图;图7是根据本发明一实施例的修饰有表皮生长因数受体的自组装纳米结构与未修饰表皮生长因数受体的自组装纳米结构的细胞包吞量比较图。附图标记说明:100:自组装纳米结构;102:双性几丁聚醣;104:显影剂化合物;106:药物分子;108:荧光显影剂化合物;s100、s102、s104、s106、s108、s110:步骤。具体实施方式图1是根据本发明一实施例所绘示的自组装纳米结构的示意图。请参照图1,本发明的自组装纳米结构100包括双性几丁聚醣102以及显影剂化合物104,其中显影剂化合物104嫁接于双性几丁聚醣102上。换言之,双性几丁聚醣102以及显影剂化合物104之间具有化学键结,而非物理性吸附。如图1所示,在一实施例中,在适当环境(例如水性溶液)下,嫁接有显影剂化合物104的双性几丁聚醣102会缠绕并自组装成球状纳米粒子。更具体地说,本发明的双性几丁聚醣102同时具有亲水性及疏水性的官能团,在水溶液中具有自组装的性质,而能在嫁接显影剂化合物104后,形成本发明的自组装纳米结构100。在一实施例中,本发明的双性几丁聚醣例如是羧甲基己酰几丁聚醣、脱氧胆酸修饰羧甲基几丁聚醣、月桂酰基硫酸几丁聚醣或甲基吡咯烷酮几丁聚醣。本发明的双性几丁聚醣102在嫁接显影剂化合物104后,其临界微胞浓度(criticalmicelleconcentration)为约0.010mg/ml至0.030mg/ml之间,例如约0.026至0.028之间。也就是说,本发明的双性几丁聚醣102在嫁接显影剂化合物104后,在极低的浓度下即可进行自组装,形成本发明的自组装纳米结构100。显影剂化合物包括核磁共振(mri)显影剂化合物。在一实施例中,核磁共振显影剂化合物例如是钆错合物、锰错合物、铬错合物或铁错合物。钆错合物例如是钆双胺、钆喷酸二甲葡胺、钆特酸葡甲胺或其组合。在一实施例中,如图1所示,本发明的显影剂化合物104位于自组装纳米结构100的内侧,故显影剂化合物104与生物体接触的机率可被降低。因此,本发明的自组装纳米结构100具有极低的毒性。在图1中,显影剂化合物104全部位于自组装纳米结构100的内侧,但本发明不以此为限。在其他实施例中(未绘示),部分的显影剂化合物104亦可位于自组装纳米结构100的外侧。在一实施例中,双性几丁聚醣102的重均分子量为约1,000至60,000,例如约5,000至60,000、约10,000至50,000或约20,000至40,000。双性几丁聚醣102的重均分子量影响自组装纳米结构100的粒径。在一实施例中,本发明的自组装纳米结构100的粒径为约5纳米至500纳米,例如约10纳米至500纳米、约50纳米至400纳米或约100纳米至300纳米。若自组装纳米结构100的粒径小于约5纳米,则自组装纳米结构100容易被血液带走。若自组装纳米结构100的粒径大于约500纳米,则自组装纳米结构100不易进入生物体内的肿瘤细胞中。在一实施例中,以自组装纳米结构100为100重量份计,显影剂化合物104为约1重量份至30重量份,例如约1重量份至20重量份、约5重量份至20重量份或约10重量份至15重量份。若显影剂化合物104小于约1重量份,则自组装纳米结构100的显影效果不足。若显影剂化合物104大于约30重量份,则自组装纳米结构100在水溶液中不易自组装成球体状。本发明的自组装纳米结构100可用来包覆药物分子,使药物分子在生物体中被运送时可以被自组装纳米结构100所保护。此外,可通过本发明的自组装纳米结构100的显影功能,可轻易观察到被自组装纳米结构100所包覆的药物分子在生物体中的位置。图2是根据本发明一实施例所绘示的以自组装纳米结构包覆药物分子的示意图。图3是根据本发明另一实施例所绘示的以自组装纳米结构包覆药物分子与荧光显影剂化合物的结构示意图。请参见图2及图3,自组装纳米结构100包覆药物分子106。更具体地说,自组装纳米结构100的缠绕网状结构捕获药物分子106于其中。在一实施例中,药物分子例如是顺-二氯二氨铂(ii)或其衍生物、吉西他滨或其衍生物或去氧甲基姜黄素或其衍生物。特别要注意的是,药物分子106是以物理性的方式被包覆于自组装纳米结构100中。也就是说,药物分子106和自组装纳米结构100之间不具有化学键结。因此,药物分子可较容易地从自组装纳米结构100中被释放,进而被生物体吸收。在一实施例中,自组装纳米结构100还可包覆荧光显影剂化合物108,以进一步加强显影效果,如图3所示。更具体地说,自组装纳米结构100的缠绕网状结构捕获荧光显影剂化合物108于其中。在一实施例中,荧光显影剂化合物108例如是荧光异硫氰酸盐、c83h95n13o23s2zn2(如psvuetm794)或c57h58n14o18szn2(如psvuetm480)。特别要注意的是,荧光显影剂化合物108亦是以物理性的方式被包覆于自组装纳米结构100中。也就是说,荧光显影剂化合物108和自组装纳米结构100之间不具有化学键结。在一实施例中,本发明的显影剂化合物例如是通过fda认证的金属错合物,故人体对本发明的自组装纳米结构发生严重过敏的机率极低。图4是根据本发明一实施例所绘示的自组装纳米结构的制备方法的流程图。请参照图4,在步骤s100中,先配制含有双性几丁聚醣的溶液。在一实施例中,双性几丁聚醣例如是羧甲基己酰几丁聚醣、脱氧胆酸修饰羧甲基几丁聚醣、月桂酰基硫酸几丁聚醣或甲基吡咯烷酮几丁聚醣。在一实施例中,在配制含有双性几丁聚醣的溶液时,以溶液为100重量份计,双性几丁聚醣的含量为约0.05重量份至1重量份,例如约0.1重量份至1重量份、约0.15重量份至0.85重量份或约0.2重量份至0.7重量份。接着,在步骤s102中,在溶液中加入显影剂化合物。在一实施例中,显影剂化合物包括核磁共振(mri)显影剂化合物。核磁共振显影剂化合物例如是钆错合物、锰错合物、铬错合物或铁错合物。钆错合物例如是钆双胺、钆喷酸二甲葡胺或钆特酸葡甲胺。然后,在步骤s104中,在溶液中加入交联剂。在一实施例中,交联剂例如是1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐、n-羟基丁二酰亚胺或其组合。之后,在步骤s106中,使双性几丁聚醣与显影剂化合物进行交联反应。在一实施例中,交联反应的反应温度例如是约4℃至60℃,例如约10℃至60℃、约20℃至60℃或约40℃至60℃。交联反应的反应时间例如是约4小时至24小时,例如约8小时至24小时、约12小时至24小时或约18小时至24小时。本发明可通过控制例如各交联剂的用量、交联反应的反应温度、反应时间等参数,以制备具有不同显影剂含量的自组装纳米结构。继之,在步骤s108中,对溶液进行纯化。在一实施例中,纯化方法例如是以透析进行纯化。透析用的溶液例如是水或乙醇。接着,在步骤s110中,对溶液进行干燥,得到黄色粉末。在一实施例中,干燥方法例如是烘干或冻干。然后,可将此黄色粉末溶于水性溶液中,即可得到本发明的自组装纳米结构100。在一实施例中,可进一步地在自组装纳米结构100的表面上修饰具有专一辨识性的蛋白质分子。蛋白质分子例如是表皮生长因数受体或cd133蛋白。本发明的自组装纳米结构100的表面被修饰上具有专一辨识性的蛋白质分子后,可对不同的目标具有专一辨识性。例如,具有专一辨识性的蛋白质分子为抗体,被修饰在本发明的自组装纳米结构100的表面上。在此情形下,本发明的自组装纳米结构100可对相对应的抗原具有专一辨识性。本发明的自组装纳米结构的制备过程简易,可降低量产的难度。本发明的自组装纳米结构的制备过程中使用的溶剂多为毒性较低的水、甲醇或异丙醇等溶剂,可增加自组装纳米结构的安全性。实施例本发明的自组装纳米结构例如是以下述方式制备。取0.5g的羧甲基己酰几丁聚醣、0.2g的钆双胺和0.65g的1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐,溶于100ml的磷酸盐缓冲溶液(phosphatebuffer)中。磷酸盐缓冲溶液的ph为7.4。在低温(4℃)下搅拌30分钟后,加入0.39g的n-羟基丁二酰亚胺,并于低温(4℃)下搅拌24小时。待反应结束后,以纯水透析此溶液48小时,再以乙醇透析此溶液24小时。接着,将溶液烘干、搅碎,得到黄色粉末。将此黄色粉末溶于水溶液中即可得到本发明的自组装纳米结构。在一实施例中,如下表1所示,可通过调整交联反应的反应时间,得到具有不同显影剂含量的自组装纳米结构。表1在一实施例中,如下表2所示,可通过调整交联反应的反应温度,得到具有不同显影剂含量的自组装纳米结构。表2在一实施例中,如下表3所示,可通过调整交联剂的比例,得到具有不同显影剂含量的自组装纳米结构。表3图5是根据本发明一实施例的钆双胺、羧甲基己酰几丁聚醣及嫁接有钆双胺的羧甲基己酰几丁聚醣的红外线光谱图。请参照图5,羧甲基己酰几丁聚醣的c=o的信号为1668.93cm-1,嫁接钆双胺的羧甲基己酰几丁聚醣的c=o的信号为1641.23cm-1。更具体地来说,羧甲基己酰几丁聚醣的c=o的信号在嫁接钆双胺后产生位移的现象。嫁接钆双胺的羧甲基己酰几丁聚醣具有三级胺,未嫁接钆双胺的羧甲基己酰几丁聚醣则只具有二级胺。三级胺上的烷基的推电子行为使c=o的键能减弱,故嫁接有钆双胺的羧甲基己酰几丁聚醣的c=o的信号具有较低的波数。由此可知,在本发明的自组装纳米结构中,羧甲基己酰几丁聚醣与钆双胺之间具有化学键结。本发明的自组装纳米结构、钆双胺与物理性包覆钆双胺的羧甲基己酰几丁聚醣的弛豫率(relaxivity)如表4所示。以下,符号“chc+gd”代表钆双胺与羧甲基己酰几丁聚醣之间仅有物理性混合,而符号“chc-gd”代表钆双胺与羧甲基己酰几丁聚醣之间存在化学键结(亦即本发明的自组装纳米结构)。表4弛豫率(mm-1s-1)chc-gd(本发明的自组装纳米结构)4.2729chc+gd1.2277钆双胺1.8158请参见表4,可知本发明的自组装纳米结构的弛豫率比单一钆双胺和chc+gd的弛豫率还要高。当显影剂中的顺磁金属所嫁接的分子越大,顺磁金属和溶剂分子间的旋转时间会变长,可使显影剂的弛豫率被提升。显影剂的弛豫率越高,则其对比效果越佳,具有越优异的显影效果。本发明的自组装纳米结构中的顺磁金属钆上嫁接着双性几丁聚醣(高分子),故其弛豫率比单一钆双胺和chc+gd高,故本发明的自组装纳米结构的对比效果比单一钆双胺和chc+gd还要优异。换言之,本发明的显影剂化合物嫁接双性几丁聚醣后,可对显影剂化合物的显影效果产生加乘作用,且此加乘作用仅在钆双胺与羧甲基己酰几丁聚醣之间存在化学键结(亦即本发明的自组装纳米结构)时才发生,当两者之间仅具有物理性混合时并不会有此加乘作用。图6是根据本发明一实施例的自组装纳米结构对不同药物分子的包覆率的比较图。本发明的自组装纳米结构在水溶液中对药物分子进行12小时的包覆后,对药物分子可具有优异的包覆率。如图6所示,本发明的自组装纳米结构在水溶液中对去氧甲基姜黄素、顺-二氯二氨铂(ii)、吉西他滨等药物分子进行12小时的包覆后,对上述药物分子具有优异的包覆率。因此,本发明的自组装纳米结构在生医领域具有良好的应用价值。图7是本发明一实施例的修饰有表皮生长因数受体的自组装纳米结构与未修饰表皮生长因数受体的自组装纳米结构的细胞包吞量比较图。在本发明一实施例中,修饰有表皮生长因数受体的自组装纳米结构与未修饰表皮生长因数受体的自组装纳米结构分别包覆荧光显影剂化合物(例如是psvuetm794或psvuetm480),再分别置于肺癌细胞株(a549)中进行4小时的细胞培养。在本发明中,例如是以下述方式,得到包覆荧光显影剂化合物的自组装纳米结构。将嫁接有钆双胺的羧甲基己酰几丁聚醣溶于水中。嫁接有钆双胺的羧甲基己酰几丁聚醣的重量百分浓度为0.05wt%。于溶液中加入500g/ml荧光显影剂化合物(例如是psvuetm794或psvuetm480),搅拌12小时。最后,对溶液进行纯水透析,得到包覆荧光显影剂化合物的自组装纳米结构。比较肺癌细胞株(a549)的相对荧光强度,可得到肺癌细胞株(a549)对修饰有表皮生长因数受体的自组装纳米结构与未修饰表皮生长因数受体的自组装纳米结构的细胞包吞量。如图7所示,肺癌细胞株(a549)对修饰表皮生长因数受体的自组装纳米结构具有优异的细胞包吞量。因此,本发明的自组装纳米结构在生医领域具有良好的应用价值。综上所述,在本发明的自组装纳米结构中,将显影剂化合物嫁接于双性几丁聚醣上,由于两者之间有化学键结,故显影剂化合物不会释放于生物体组织中而危害生物体。此外,双性几丁聚醣与显影剂化合物的键结具有加乘作用,可进一步提高显影剂化合物的显影效果。另外,可将具有专一辨识性的蛋白质分子修饰于本发明的自组装纳米结构上,使本发明的自组装纳米结构具有专一的辨识功能,可提高给药的效率。最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 一种基于纳米材料自组装的土霉素sers检测方法
- 暴露高能晶面纳米片自组装的三维网络结构α?Fe<sub>2</sub>O<sub>3</sub>的制备方法
- 一种三氧化钨纳米带自组装成微纳米星的制备方法
- 一种葡萄糖和温度敏感性的自组装纳米粒子及其制备方法和应用
- 允许通过嵌段共聚物的自组装产生纳米结构体的方法
- 一种自组装纳米止血剂、其制备方法及应用
- 一种纳米片自组装棱台状(NH<sub>4</sub>)<sub>2</sub>V<sub>3</sub>O<sub>8</sub>的制备方法
- 一种干燥介导金纳米颗粒自组装制备金基底的方法及其应用
- 一种以杆菌肽为模板自组装合成球状金纳米粒子的方法
- 一种果胶-多臂聚乙二醇自组装制备纳米药物的方法
- 一种具有葡萄糖敏感性和温度敏感性的自组装纳米粒子及其制备方法
- 一种基于纳米材料自组装的土霉素sers检测方法
- 暴露高能晶面纳米片自组装的三维网络结构α?Fe<sub>2</sub>O<sub>3</sub>的制备方法
- 一种三氧化钨纳米带自组装成微纳米星的制备方法
- 一种葡萄糖和温度敏感性的自组装纳米粒子及其制备方法和应用
- 允许通过嵌段共聚物的自组装产生纳米结构体的方法
- 一种自组装纳米止血剂、其制备方法及应用
- 一种纳米片自组装棱台状(NH<sub>4</sub>)<sub>2</sub>V<sub>3</sub>O<sub>8</sub>的制备方法
- 一种干燥介导金纳米颗粒自组装制备金基底的方法及其应用
- 一种以杆菌肽为模板自组装合成球状金纳米粒子的方法