复合佐剂及含复合佐剂的狂犬疫苗及其制备方法和应用与流程
本发明涉及免疫学领域,具体涉及复合佐剂及含复合佐剂的狂犬疫苗及其制备方法和应用。
背景技术:
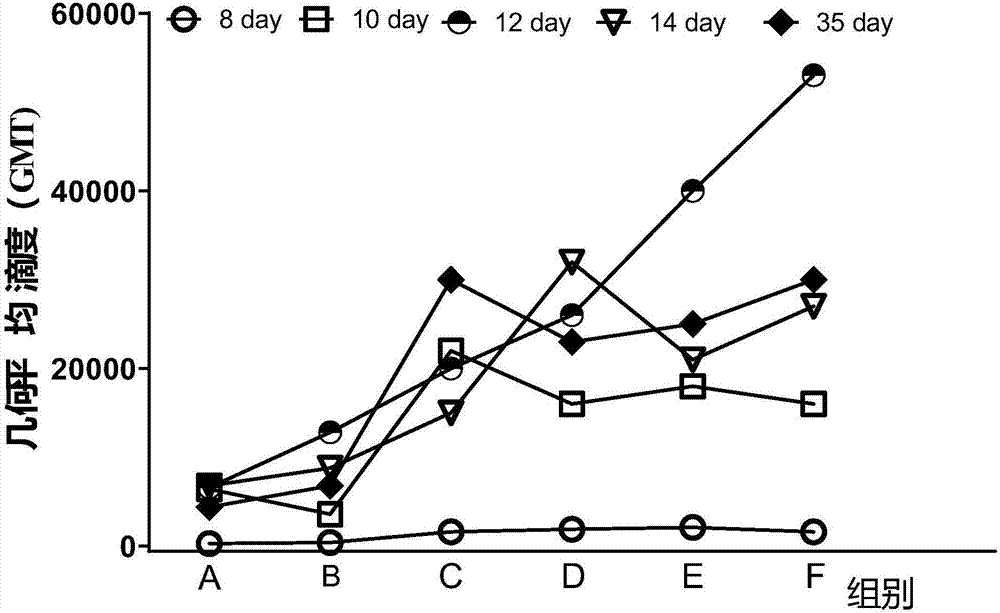
:狂犬病(rabies)是由狂犬病毒引起的一种人畜共患的中枢神经系统急性传染病,是仅能依靠疫苗和高兔血清预防的急性传染病,流行性广,病死率100%。全球98%的狂犬病病例集中在亚洲,我国是狂犬病的高发地区,80年代平均年发病人数为5530例,最高年发病人数为7043例。控制人狂犬病发病死亡的主要措施为伤口处理、接种狂犬病疫苗和注射抗狂犬病免疫血清或免疫球蛋白。狂犬疫苗(rabiesvaccine(verocell)forhumanuse,free-dried.)最早是由法国微生物学家、化学家路易斯·巴斯德制备得到的,随着技术的发展,疫苗种类越来越多。狂犬疫苗主要是在疯动物咬伤人后实施接种免疫,即病毒感染在先,注射疫苗在后,其作用是抢救伤者生命,将病毒扼杀在潜伏期内,阻断病人进入临床发病期。目前我国现在使用的有精制vero细胞狂犬病疫苗和精制地鼠肾细胞狂犬病疫苗。皂甙(saponin)又称皂素,是一种佐剂,是免疫刺激复合物中的一种组分之一,是广泛存在于植物界的一类特殊的甙类,可从植物的外皮、叶、茎、根甚至花中提取得到。它的水溶液振摇后可产生持久的肥皂样的泡沫,具有双向调节免疫作用。kensil从皂甙中分离了10多种皂甙单体,其中四种为皂甙的主要单体,分别为:qs-7,qs-17,qs-18,qs-21。其中的数字7,17,18,21代表利用c4柱的反相高效液相色谱法(rp-hplc)的洗脱时间。非甲基化的cpg基序普遍存在于细菌dna中,并且有强烈的免疫刺激作用,cpgodn是指含有胞嘧啶-磷酸-鸟嘌呤基序的寡脱氧核苷酸,人工合成的含cpg基序的寡核苷酸(cpgodn)能够模拟细菌dna中cpg基序的免疫刺激特性,并且能诱导th1型为主的免疫应答,cpgodn与蛋白类抗原联合应用可以有效地诱导机体产生免疫应答,具有潜在的免疫佐剂效应。saponin或者人工合成的含cpg的寡核苷酸作为佐剂与抗原同时注射或预先注射,能非特异性地增强或改变机体对抗原的免疫反应,但目前还没有关于saponin和cpgodn2006(序列为:tcgtcgttttgtcgttttgtcg)作为复合佐剂与狂犬疫苗同时注射到小鼠中以诱导较强的体液免疫反应和细胞免疫反应的报道。技术实现要素:为此,本发明提供了一种狂犬疫苗用复合佐剂以及含有该复合佐剂的狂犬疫苗,本发明的狂犬疫苗进行免疫时,能够诱导较强的体液免疫反应及细胞免疫反应。本发明提供了一种狂犬疫苗用复合佐剂,其包含saponin和cpgodn2006,所述saponin与cpgodn2006的质量比为8:1-1:10。本发明提供了一种狂犬疫苗用复合佐剂的制备方法,其是将含有saponin和cpgodn2006的原料进行混合。本发明提供了一种狂犬疫苗组合物,其包含复合佐剂和狂犬疫苗,其中,相对于狂犬疫苗1/100-1/10份,所述saponin为5μg-40μg,所述cpgodn2006的剂量为5μg-50μg。本发明提供了一种狂犬疫苗组合物的制备方法,其是将含有saponin、cpgodn2006和狂犬疫苗的原料进行混合。具体来说,本发明提出了如下技术方案。一种狂犬疫苗用复合佐剂,其包含saponin和cpgodn2006,所述saponin与cpgodn2006的质量比为8:1-1:10。优选的,对于所述的狂犬疫苗用复合佐剂,所述saponin与cpgodn2006的质量比为4:1-1:2,优选为1:1。一种制备狂犬疫苗用复合佐剂的制备方法,其是将含有saponin和cpgodn2006的原料进行混合。优选的,对于所述的制备方法,所述saponin与cpgodn2006的质量比为8:1-1:10。优选的,对于所述的制备方法,所述saponin与cpgodn2006的质量比为4:1-1:2,优选为1:1。一种狂犬疫苗组合物,其包含复合佐剂和狂犬疫苗。优选的,对于所述的狂犬疫苗组合物,相对于狂犬疫苗1/100-1/10份,所述saponin为5μg-40μg,所述cpgodn2006为5μg-50μg,其中,所述狂犬疫苗、saponin和cpgodn2006的用量是每只小鼠的用量。优选的,对于所述的狂犬疫苗组合物,相对于狂犬疫苗1/50-1/25份,所述saponin为10μg-40μg,所述cpgodn2006为10μg-20μg,其中,所述狂犬疫苗、saponin和cpgodn2006的用量是每只小鼠较优选的用量。更优选的,所述saponin的剂量为10μg-20μg。一种狂犬疫苗组合物的制备方法,其是将含有saponin、cpgodn2006和狂犬疫苗的原料进行混合。一种狂犬疫苗注射液,包含上述的狂犬疫苗组合物和稀释液,所述稀释液为pbs,所述pbs的用量为6.8-7.8ml。优选的,对于所述的狂犬疫苗注射液,所述狂犬疫苗注射液为腹腔注射针剂。一种狂犬疫苗组合物,其在哺乳动物免疫应答中的应用,优选在人或在动物免疫应答中的应用。本发明所取得的有益效果是:本发明使用含有复合佐剂的狂犬疫苗进行免疫,结果表明复合佐剂能够促进狂犬疫苗尽早产生抗体和提高抗狂犬疫苗的抗体滴度并能维持较长时间,此外,本发明的狂犬疫苗组合物能够诱导细胞免疫反应,可以减少狂犬疫苗免疫次数。附图说明图1是实施七中低剂量复合佐剂、高剂量复合佐剂及对照组pbs的血清抗狂犬疫苗的抗体水平检测的od450nm随时间变化的曲线图;图2是实施例七中所有实验分组的小鼠血清抗狂犬疫苗抗体滴度随时间变化示意图;图3是实施例七中所有剂量组的ifn-γ随时间变化的示意图。具体实施方式图1是实施七中低剂量复合佐剂、高剂量复合佐剂及对照组pbs的血清抗狂犬疫苗的抗体水平检测的od450nm随时间变化的曲线图,其中低剂量复合佐剂为10μgsaponin+10μgcpgodn2006;高剂量复合佐剂为20μgsaponin+20μgcpgodn2006,从图中可以看出,单纯佐剂免疫小鼠不诱导狂犬疫苗抗原特异的抗体产生,因相同时间点,佐剂免疫小鼠血清igg抗体水平与pbs免疫组无统计学差异。图2是实施例七中所有实验分组的小鼠血清抗狂犬疫苗抗体滴度随时间变化示意图,其中,a:1/50人份狂犬疫苗;b:1/25人份狂犬疫苗;c:1/50人份狂犬疫苗+低剂量复合佐剂;d:1/50人份狂犬疫苗+高剂量复合佐剂;e:1/25人份狂犬疫苗+低剂量复合佐剂;f:1/25人份狂犬疫苗+高剂量复合佐剂。从图2中可以看出,a组初免14d抗体滴度达到最高,b组初免12d抗体滴度达到最高,c-f组初免10d抗体滴度均达到较高水平:其中c组初免35d抗体滴度达到最高,d组初免14d抗体滴度达到最高,e-f组初免12d抗体滴度到达最高。图3是实施例七中所有剂量组的ifn-γ随时间变化的示意图,其中,a:pbs对照;b:1/50人份狂犬疫苗;c:1/25人份狂犬疫苗;d:低剂量复合佐剂(10μgsaponin+10μgcpgodn2006);e:高剂量复合佐剂(20μgsaponin+20μgcpgodn2006);f:1/50人份狂犬疫苗+低剂量复合佐剂;g:1/50人份狂犬疫苗+高剂量复合佐剂;h:1/25人份狂犬疫苗+低剂量复合佐剂;i:1/25人份狂犬疫苗+高剂量复合佐剂。从图中可以看出同一免疫不同时间检测的分泌ifn-γ斑点形成细胞数(ifn-γ-sfc)的变化,a-d组、g-h组在初免后8天内形成的fn-γ-sfc较多,e组在初免后4天内形成的ifn-γ-sfc较多,f组在初免后14天内形成的ifn-γ-sfc较多,i组在初免后14天内形成的ifn-γ-sfc较多,f-i组在初免后35天内形成的ifn-γ-sfc维持较高水平。术语“1人份”是指一个人一次所用的剂量。如上所述,本发明提供了一种狂犬疫苗用复合佐剂,所述狂犬疫苗用复合佐剂包含saponin和cpgodn2006,所述saponin与cpgodn2006的质量比为8:1-1:10。在另一种具体实施方式中,本发明提供了一种狂犬疫苗用复合佐剂,所述狂犬疫苗用复合佐剂包含saponin和cpgodn2006,所述saponin与cpgodn2006的质量比为4:1-1:2,优选为1:1。本发明提供了一种狂犬疫苗用复合佐剂的制备方法,其是将含有saponin和cpgodn2006的原料进行混合。本发明还提供了一种狂犬疫苗组合物,其包含复合佐剂和狂犬疫苗,并且相对于狂犬疫苗为1/100-1/10份,所述saponin为5μg-40μg,所述cpgodn2006为5μg-50μg。优选的,相对于狂犬疫苗为1/50-1/25份,所述saponin为10μg-40μg,所述cpgodn2006为10μg-20μg,更有选的,相对于狂犬疫苗为1/50份或1/25份,所述saponin为10μg或20μg,所述cpgodn2006为10μg或20μg。本发明提供了一种狂犬疫苗组合物的制备方法,其是将含有saponin、cpgodn2006和狂犬疫苗的原料混合得到溶液。本发明是将saponin、cpgodn2006和抗原配成溶液,然后进行稀释,先加入稀释液,然后依次加入saponin、cpgodn2006和抗原,得到稀释的溶液。wo0009159公开了cpg和saponin的组合物及其制备方法,说明书中公开使用cpgodn1826作为佐剂、saponin中的单体qs-21佐剂与ova疫苗进行免疫,但是cpgodn1826的序列为tccatgacgttcctgacgtt,所述cpgodn1826的作用是诱导抗原呈递细胞的活化和i型ifn抗病毒活性的活化[ankmb.etal.,2008.animportantrolefortypeiiiinterferon(ifn-lambda/il-28)intlr-inducedantiviralactivity.jimmunol180:2474-85.],表明th1的免疫反应;cpgodn2006的序列为tcgtcgttttgtcgttttgtcg,cpgodn2006能显著增强抗原特异性抗体反应和干扰素介导的细胞免疫[zhangy.etal.,2003.cpgodn2006andil-12arecomparableforprimingth1lymphocyteandiggresponsesincattleimmunizedwitharickettsialoutermembraneproteininalum.vaccine21:3307-18.],因此,cpgodn1826与本发明的cpgodn2006的序列不同,所起的作用也不同。下面对本实施例所用的原料及设备的生产厂家,以及产品分析使用的设备和分析方法进行说明如下,其中所述的化学物质没有标明的均为常规试剂的化学纯级别。其中,实施例所用到的原料的信息及实验设备的信息如表1和表2所示。表1本发明所用到的原料的信息表2本发明所用的实验设备的信息设备型号厂家离心机tg16-ws台式高速离心机长沙平凡仪器仪表有限公司离心机l-530湘仪离心机酶标仪infinitem200瑞士tecan酶联免疫斑点读板仪s5-verse美国ctl公司实施例一1.一种狂犬疫苗用复合佐剂,包含saponin和cpgodn2006,是将saponin与cpgodn2006的质量比为1:10进行混合而得到。2.一种狂犬疫苗组合物,其包含saponin、cpgodn2006和狂犬疫苗,以每只小鼠计,将5μg的saponin、50μg的cpgodn2006及1/10人份的狂犬疫苗进行混合而得到。实施例二1.一种狂犬疫苗用复合佐剂,包含saponin和cpgodn2006,是将saponin与cpgodn2006的质量比为8:1进行混合而得到。2.一种狂犬疫苗组合物,其包含saponin、cpgodn2006和狂犬疫苗,以每只小鼠计,将40μg的saponin、5μg的cpgodn2006及1/100人份的狂犬疫苗进行混合而得到。实施例三1.一种狂犬疫苗用复合佐剂,包含saponin和cpgodn2006,是将saponin与cpgodn2006的质量比为1:1进行混合而得到。2.一种狂犬疫苗组合物,其包含saponin、cpgodn2006和狂犬疫苗,以每只小鼠计,将10μg的saponin、10μg的cpgodn2006及1/25人份的狂犬疫苗进行混合而得到。实施例四1.一种狂犬疫苗用复合佐剂,包含saponin和cpgodn2006,是将saponin与cpgodn2006的质量比为1:1进行混合而得到。2.一种狂犬疫苗组合物,其包含saponin、cpgodn2006和狂犬疫苗,以每只小鼠计,将20μg的saponin、20μg的cpgodn2006及1/50人份的狂犬疫苗进行混合而得到。实施例五1.一种狂犬疫苗用复合佐剂,包含saponin和cpgodn2006,是将saponin与cpgodn2006的质量比为1:1进行混合而得到。2.一种狂犬疫苗组合物,其包含saponin、cpgodn2006和狂犬疫苗,以每只小鼠计,将20μg的saponin、20μgcpgodn2006及1/25人份的狂犬疫苗进行混合而得到。实施例六1.一种狂犬疫苗用复合佐剂,包含saponin和cpgodn2006,是将saponin与cpgodn2006的质量比为1:1进行混合而得到。2.一种狂犬疫苗组合物,其包含saponin、cpgodn2006和狂犬疫苗,以每只小鼠计,将10μg的saponin、10μg的cpgodn2006及1/50人份的狂犬疫苗进行混合而得到。实施七效果验证1.佐剂狂犬疫苗诱导的体液免疫反应(1)试验动物及分组balb/c小鼠,雌性,每只小鼠18-20g。分为12组,每组30只小鼠。(2)抗原和佐剂抗原:冻干人用狂犬病疫苗(vero细胞)佐剂:saponin,cpgodn2006(3)分组狂犬疫苗按说明书溶解狂犬疫苗,0.5ml注射用水溶解1人份狂犬疫苗,cpgodn2006的浓度为2mg/ml,saponin的浓度为10mg/ml。此为三种溶液的浓溶液,然后将其进行稀释,即加入稀释液pbs,然后依次加入saponin、cpgodn2006和抗原,得到稀释的溶液。低剂量抗原组:0.4ml狂犬疫苗+7.6mlpbs;(1/50人份狂犬疫苗/小鼠)高剂量抗原组:0.8ml狂犬疫苗+7.2mlpbs;(1/25人份狂犬疫苗/小鼠)低剂量复合佐剂组:0.2mlcpgodn2006+0.04mlsaponin+7.8mlpbs;高剂量复合佐剂组:0.4mlcpgodn2006+0.08mlsaponin+7.6mlpbs;低剂量抗原+低剂量复合佐剂组:0.4ml狂犬疫苗+0.2mlcpgodn2006+0.04mlsaponin+7.4mlpbs;低剂量抗原+高剂量复合佐剂组:0.4ml狂犬疫苗+0.4mlcpgodn2006+0.08mlsaponin+7.2mlpbs;高剂量抗原+低剂量复合佐剂组:0.8ml狂犬疫苗+0.2mlcpgodn2006+0.04mlsaponin+7.0mlpbs;高剂量抗原+高剂量复合佐剂组:0.8ml狂犬疫苗+0.4mlcpgodn2006+0.08mlsaponin+6.8mlpbs;pbs对照组:8mlpbs。(4)分别免疫相应的抗原及抗原与佐剂的混合物,于0天、7天腹腔注射免疫2次。(5)小鼠解剖及血清获取初免后4天、8天、10天、12天、14天、35天,每组分别解剖5只小鼠,摘眼球取血,室温放置3小时,3000转/分离心10min,取上清,上清12000转/分离心10min,取上清-30℃保存。(6)间接elisa法(酶联免疫吸附测定法)测定血清中igg抗体每组每次解剖选1只小鼠稀释不同的稀释度进行检测,确定不同解剖时间不同免疫原免疫小鼠的抗体滴度范围,每组每个时间点稀释2-3个浓度侧血清od值,其步骤如下:a.抗原包被:每只冻干的狂犬疫苗采用0.5ml注射用水溶解,包被液1:300倍稀释狂犬疫苗,每孔加100μl,4℃包被过夜;b.洗板:3min/次,共洗三次,洗液为pbst,即为含0.05%tween20的pbs(采用手洗);c.封闭:每孔加入200μl封闭液(含1%牛血清蛋白(bsa)的pbst),37℃封闭1h;d.洗板:采用与步骤(b)相同的方法进行洗板;e.待检血清用封闭液稀释,稀释比例为:pbs组、低剂量佐剂组和高剂量佐剂组,每个时间点解剖小鼠收集的血清均为1:100稀释;初免后4天的各组小鼠血清也1:100稀释;初免后8天:低、高剂量抗原免疫小鼠血清1:100、1:500和1:1000稀释,抗原佐剂免疫小鼠1:100、1:100和1:2000稀释;初免后10天收集血清:低、高剂量抗原免疫小鼠血清1:100、1:4000和1:8000稀释,抗原佐剂免疫小鼠血清1:8000、1:16000和1:20000稀释;初免后12天、14天、35天:低、高剂量抗原免疫小鼠血清1:8000和1:10000稀释,抗原佐剂免疫小鼠血清1:20000和1:30000稀释;每孔加入100μl血清稀释液,每样品每稀释度设两个复孔,37℃孵育2h;f.洗板:采用与步骤(b)相同的方法进行洗板;g.封闭液稀释hrp标记的兔抗原鼠igg二抗(1:30000),每孔加入100μl,37℃孵育1h;h.洗板:采用与步骤(b)相同的方法进行洗板;i.每孔加入显色液100μltmb显色液,避光室温放置20-30min,加入50μl终止液(2nh2so4)终止显色,测od450nm吸光值。(7)结果a.测定血清的水平测定结果见表3,其中,表中的数据代表是每组5只小鼠血清抗体检测od450nm的平均值±误差值,低剂量佐剂和高剂量佐剂的数据如图1所示。表3显示的是初免4天和8天抗体血清的水平(血清1:100稀释)组别4d8d4d与8d比较pbs对照组0.094±0.0140.099±0.043t=-0.29,p=0.78低剂量抗原组0.096±0.0070.360±0.199t=-2.96,p=0.042高剂量抗原组0.116±0.0130.665±0.148t=-8.28,p=0.004低剂量抗原+低剂量佐剂组0.132±0.0151.076±0.369t=-5.71,p=0.005低剂量抗原+高剂量佐剂组0.146±0.0451.058±0.431t=-4.71,p=0.009高剂量抗原+低剂量佐剂组0.161±0.0191.476±0.523t=-5.60,p=0.005高剂量抗原+高剂量佐剂组0.146±0.0471.039±0.799t=-3.35,p=0.044与对照组pbs相比:在初免后4天,低剂量抗原+高剂量佐剂组、高剂量抗原+低剂量佐剂组和高剂量抗原+高剂量佐剂组的p值均<0.01,表现出极显著的差异,低剂量抗原+低剂量佐剂组的p值<0.05,表现出显著的差异;在初免后8天,低剂量抗原+低剂量佐剂组、低剂量抗原组+高剂量佐剂组、高剂量抗原+低剂量佐剂组和高剂量抗原+高剂量佐剂组的p值均<0.01,表现出极显著的差异。与低剂量抗原组相比较:在初免后4天,低剂量抗原+高剂量佐剂组、高剂量抗原+低剂量佐剂组和高剂量抗原+高剂量佐剂组的p值均<0.01,表现出极显著的差异;在初免后8天,高剂量抗原+低剂量佐剂组的p<0.01,表现出极显著的差异,低剂量抗原+低剂量佐剂组、低剂量抗原+高剂量佐剂和高剂量抗原+高剂量佐剂的p值均<0.05,表现出显著的差异。与高剂量抗原组相比较:在初免后4天,高剂量抗原+低剂量佐剂组的p<0.05,表现出显著的差异;在初免后8天,高剂量抗原+低剂量佐剂组的p<0.01,表现出极显著的差异。表3显示狂犬疫苗免疫小鼠4d抗体水平与对照组在统计学上无显著性差异,而佐剂狂犬疫苗免疫小鼠4d的血清抗体水平均显著高于pbs对照组,但总体水平偏低;佐剂狂犬疫苗免疫小鼠,8d血清抗体水平显著高于pbs对照组,同时狂犬疫苗和佐剂狂犬疫苗免疫小鼠血清抗体水平显著高于初免4d的小鼠血清水平。因此,佐剂促进狂犬疫苗尽早产生抗体,且增强抗体水平。从图1中可以看出,单纯佐剂免疫小鼠不诱导狂犬疫苗抗原特异的抗体产生,因相同时间点,佐剂免疫小鼠血清igg抗体水平与pbs免疫组无统计学差异。b.佐剂提高狂犬疫苗抗体滴度且维持较长时间检测分两次,初免4天、8天、10天收集血清检测1次,初免12天、14天、35天收集血清检测1次;以每次检测的pbs组(共15只小鼠数据)免疫小鼠血清1:100稀释所测od平均值±2sd值为标准,确定血清igg抗体效价。其中,a为1/50人份狂犬疫苗(低剂量抗原组),b为1/25人份狂犬疫苗(高剂量抗原组),c为1/50人份狂犬疫苗+10μgsaponin/10μgcpgodn2006(低剂量抗原+低剂量复合佐剂组),d为1/50人份狂犬疫苗+20μgsaponin/20μgcpgodn2006(低剂量抗原+高剂量复合佐剂组),e为1/25人份狂犬疫苗+10μgsaponin/10μgcpgodn2006(高剂量抗原+低剂量复合佐剂组),f为1/25人份狂犬疫苗+20μgsaponin/20μgcpgodn2006(高剂量抗原+高剂量复合佐剂组)。从图2可以看出:a组初免14d抗体滴度达到最高,b组初免12d抗体滴度达到最高,c-f组初免10d抗体滴度均达到较高水平:其中c组初免35d抗体滴度达到最高,d组初免14d抗体滴度达到最高,e-f组初免12d抗体滴度到达最高。初免8d各组之间抗体滴度比较:c-f组小鼠血清抗体滴度均显著高于a和b组(p<0.01),a组与b组小鼠血清抗体滴度及c-f组小鼠血清抗体滴度两两相比较,差异均无统计学意义(p>0.05)。初免10d各组之间抗体滴度比较:c-f组小鼠血清抗体滴度均显著高于a组、b组(p<0.01)。初免12d各组之间抗体滴度比较:d-f组小鼠血清抗体滴度均显著高于a组(p<0.05或p<0.01),e-f组小鼠血清抗体滴度显著高于b组和c组(p<0.05或p<0.01),d组小鼠血清抗体滴度显著低于f组(p=0.004)。初免14d各组之间抗体滴度比较:d-f组小鼠血清抗体滴度均显著高于a组和b组(p<0.05或p<0.01),c组小鼠血清抗体滴度均显著低于d组(p=0.004)和f组(p=0.039)。初免35d各组之间抗体滴度比较:c-f组小鼠血清抗体滴度均显著高于a组和b组(p<0.01)。2.佐剂狂犬疫苗诱导的细胞免疫反应(1)试验动物及分组balb/c小鼠,雌性,每只小鼠18-20g。分为12组,每组20只小鼠。(2)抗原和佐剂抗原:冻干人用狂犬病疫苗(vero细胞)佐剂:saponin,cpgodn2006(3)分组狂犬疫苗按说明书溶解狂犬疫苗,0.5ml注射用水溶解1人份狂犬疫苗,cpgodn2006的浓度为2mg/ml,saponin的浓度为10mg/ml。高剂量抗原组:0.8ml狂犬疫苗+7.2mlpbs;低剂量抗原组:0.4ml狂犬疫苗+7.6mlpbs;低剂量佐剂组:0.2mlcpgodn2006+0.04mlsaponin+7.8mlpbs;高剂量佐剂组:0.4mlcpgodn2006+0.08mlsaponin+7.6mlpbs;低剂量抗原+低剂量佐剂组:0.4ml狂犬疫苗+0.2mlcpgodn2006+0.04mlsaponin+7.4mlpbs;低剂量抗原+高剂量佐剂组:0.4ml狂犬疫苗+0.4mlcpgodn2006+0.08mlsaponin+7.2mlpbs;高剂量抗原+低剂量佐剂组:0.8ml狂犬疫苗+0.2mlcpgodn2006+0.04mlsaponin+7.0mlpbs;高剂量抗原+高剂量佐剂组:0.8ml狂犬疫苗+0.4mlcpgodn2006+0.08mlsaponin+6.8mlpbs;pbs对照组:8mlpbs。(4)分别免疫相应的抗原及抗原与佐剂的混合物,于0天、7天腹腔免疫2次。(5)小鼠解剖初免后4天、8天、14天、35天,每组分别解剖5只小鼠,摘眼球取血,并断颈处死小鼠,浸泡于75%的乙醇中2-3min,在超净台中无菌摘除脾脏。(6)酶联免疫斑点检测1)制备脾淋巴细胞:在35mm培养皿中加入4-5ml小鼠淋巴细胞分离液(小鼠淋巴分离液,达科为生物工程有限公司,使用前恢复至室温并摇匀),将200目尼龙网放置一次性培养皿,脾脏置于尼龙网上,剪刀剪碎,用5ml注射器活塞研磨脾脏,尼龙网过滤后的细胞悬液立即转移到15ml离心管中,覆盖500μl-1ml的rpmi-1640培养基;室温,800g(l350离心机,湖南湘仪仪器有限公司,约为2140转)离心30min(降速为2档),吸出淋巴细胞层,再加入10-12mlrpmi-1640培养基,颠倒混匀。室温250g(1200转)离心10min,倾倒上清液,用无血清培养基(达科为生物工程有限公司)0.5ml悬浮细胞,稀释细胞、计数,调整细胞浓度至2.5×106/ml。2)酶联免疫斑点(elispot)检测:根据预包被的mouseifn-γelispotpluskit(alp)试剂盒(mabtech,sweden)说明书检测脾淋巴细胞分泌ifn-γ的斑sfc,具体操作:(1)0.2μm滤膜过滤的pbs洗板5次,每孔加入200μl含10%胎牛血清的rpmi-1640培养基,室温孵育30min或pbs洗涤后的板直接加细胞培养。(2)弃去培养基,加入100μl淋巴细胞悬液和50μl1/50人用剂量的狂犬疫苗或coa(终浓度为5μg/ml),阴性对照加50μl无血清培养基。5%co2、37℃孵育48h。(3)显色:取出微孔板,弃液体,每孔加200μlpbs(0.22μm过滤)洗板5次,每孔依次加入100μl检测抗体,室温孵育2h。弃去孔内溶液,同上洗板5次,每孔依次加入100μlstreptavidin-alp,室温孵育1h。弃去孔内溶液,同上洗板5次,加入100μlbcip/nbt底物溶液(0.45μm过滤),室温放置10-30min,待出现斑点后,用蒸馏水洗涤各孔,将微孔板置通风处避光干燥。(4)检测sfc:酶联免疫斑点读板仪(ctl,美国)读板,自动分析ifn-γ的sfc。测定结果见表4。表4分泌ifn-γ的sfc从上表可以看出,在免疫后8天、14天和35天,与对照组pbs相比,低剂量抗原+高剂量佐剂、高剂量抗原+低剂量佐剂和高剂量抗原+高剂量佐剂的p值均<0.01,表现出极显著的差异;在免疫后8天内,低剂量抗原组、高剂量高原组和低剂量抗原+低剂量佐剂的p值均<0.01,表现出极显著的差异,在免疫后35天内,低剂量抗原+低剂量佐剂的p值<0.05,表现出显著的差异。与低剂量抗原组相比,在免疫后14天、35天内,高剂量抗原+高剂量佐剂的p值均<0.01,表现出极显著的差异,在免疫后14天内,低剂量抗原+低剂量佐剂、高剂量抗原+低剂量佐剂的p值均<0.01,表现出极显著的差异,在免疫后35天内,低剂量抗原+高剂量佐剂、高剂量抗原+低剂量佐剂的p值均<0.05,表现出显著的差异。与高剂量抗原相比,在免疫后14天、35天内,高剂量抗原+低剂量佐剂、高剂量抗原+高剂量佐剂的p值均<0.01,表现出极显著的差异,在免疫后14天内,低剂量抗原+低剂量佐剂的p值<0.01,表现出极显著的差异,在免疫后35天内,低剂量抗原+高剂量佐剂的p值<0.01,表现出极显著的差异。与低剂量佐剂相比,在免疫后8天、14天、35天内,低剂量抗原+高剂量佐剂、高剂量抗原+低剂量佐剂的p值均<0.01,表现出极显著的差异,在免疫后8天内,低剂量抗原组、高剂量抗原组、低剂量抗原+低剂量佐剂的p值均<0.01,表现出极显著的差异,高剂量抗原+高剂量佐剂的p值<0.05,表现出显著的差异,在免疫后14天内,低剂量抗原+低剂量佐剂、高剂量抗原+高剂量佐剂的p值均<0.01,表现出极显著的差异,在免疫后35天内,低剂量抗原+低剂量佐剂的p值<0.05,表现出显著的差异,高剂量抗原+高剂量佐剂的p值<0.01,表现出极显著的差异。与高剂量佐剂相比,在免疫后8天、14天、35天内,低剂量抗原+高剂量佐剂、高剂量抗原+低剂量佐剂、高剂量抗原+高剂量佐剂的p值均<0.01,表现出极显著的差异,在初免后8天、14天内,低剂量抗原+低剂量佐剂的p值均<0.01,表现出极显著的差异,在初免后8天内,低剂量抗原、高剂量抗原的p值均<0.01,表现出极显著的差异,在初免后35天内,低剂量抗原+低剂量佐剂的p值<0.05,表现出显著的差异。说明含有复合佐剂组合物的狂犬疫苗能够促使小鼠脾细胞分泌ifn-γ的斑点形成细胞数,即本发明的含有复合佐剂组合物的狂犬疫苗能够较强的细胞免疫反应。以上所述,仅是本发明实施的较佳实施例,并非对本发明做任何形式上的限制,凡在本发明的精神和原则之内所做的修改、等同替换和改进等,均需要包含在本发明的保护范围之内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1