一种靶向作用于胃癌组织的多西紫杉醇壳聚糖纳米胶束及制备方法和应用与流程
本发明属于海洋生物医用材料领域,具体涉及一种靶向于胃癌组织的多西紫杉醇壳聚糖纳米胶束及制备方法和应用。
背景技术:
多西紫杉醇是欧洲浆果紫杉的针叶中提取的化合物半合成的紫杉醇衍生物,目前临床上用于治疗乳腺癌、胃癌以及非小细胞癌等多种癌症,疗效显著。
药剂学中以高分子载体材料形成的胶束为载体制成的药物胶束制剂正受到越来越多的关注,而粒径为纳米尺寸的纳米胶束作为药物的载体具有很多独特的优势,如具有缓控释及靶向特性、与细胞和组织的生物相容性好等优点,在新型载药系统领域显示了良好的应用前景。纳米胶束负载难溶性药物的尝试已取得良好效果,这些药物如紫杉醇、喜树碱和依托泊苷等。纳米胶束载体既能提高药物的水溶性又能提高药物在肿瘤部位的浓度和滞留时间,从而提高疗效,降低副作用。
在众多构建纳米胶束的材料中,壳聚糖是目前研究的热点。壳聚糖是自然界中唯一的碱性多糖,其分子链上的游离氨基可以在较温和的条件下发生化学反应,可以通过化学改性赋予壳聚糖衍生物新的生物活性和理化性质。壳聚糖及其衍生物作为一种极具潜力的新型辅料被广泛应用到生物工程和生物医药等领域中。壳聚糖纳米药物载体具有相对于游离药物和其他载体所不具备的优势,如较高的疏水药物溶解性和包载效率,较好的药物靶向性,较好的生物相容性、较低的细胞毒性、较高的生物利用度等,这些独特的优势使其吸引了全世界研究人员的广泛关注。
GX1是利用噬菌体随机肽库技术筛选的一种环状9肽,分子量约为1000Da。胃腺癌组织中的GX1受体表达率显著高于正常胃组织,且随着分化程度越低表达率逐渐增加,在低分化胃癌组织中的表达明显高于高分化和中分化胃癌组织。研究发现,GX1可以特异性的与胃癌血管内皮细胞结合,逐渐富集于肿瘤组织,验证了其具有良好的体内肿瘤血管靶向性(Journal of Controlled Release,2008,131,86-93)。
多西紫杉醇难溶于水,且脂溶性也不好,严重影响了其临床应用。目前上市品种仅为多西紫杉醇注射液,是用吐温-80及无水乙醇作溶剂配制而成,易引起较多不良反应,如刺激、溶血、过敏反应、神经毒性、心血管毒性等等。因此,对现有的多西紫杉醇制剂进行剂型改造是十分必要的。
技术实现要素:
本发明的目的是提供一种靶向于胃癌组织的多西紫杉醇壳聚糖纳米胶束及制备方法和应用。
为实现上述目的,本发明采用技术方案为:
一种靶向作用于胃癌组织的多西紫杉醇壳聚糖纳米胶束,多西紫杉醇壳聚糖纳米胶束(GDD壳聚糖纳米胶束)按重量百分比计,20-30%介导分子,30-60%载体和20-40%多西紫杉醇;
其中介导分子为GX1-PEG5000-去氧胆酸,载体为N-去氧胆酸羟乙基壳聚糖。
所述GDD壳聚糖纳米胶束粒径为350-500nm,多分散指数(PDI)为0.05-0.30,Zeta电位为-30--20mV。
所述介导分子GX1-PEG5000-去氧胆酸:
1)将NHS-PEG5000-NH-Boc和GX1溶于二甲基甲酰胺(DMF)中,室温密闭反应24-36h;
2)向上述所得反应液中加入三氟乙酸(TFA),冰水浴下反应3-4h,而后加入过量丙酮沉淀,离心,收集沉淀,沉淀加水溶解,冻干;
3)将上述所得产物加入到DMF中搅拌,而后再加入去氧胆酸、1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(EDC·HCl)和N-羟基琥珀酰亚胺(NHS),室温下搅拌反应24-36h;反应后加入过量丙酮沉淀,沉淀再经水溶解,冻干,得到GX1-PEG5000-去氧胆酸。
所述载体N-去氧胆酸羟乙基壳聚糖:
1)将壳聚糖加入至过量40%NaOH中,在-20--10℃下碱化反应,而后向碱化壳聚糖溶液中滴入氯乙醇,再于70-80℃下反应24-36h,反应后调节pH至中性,调节后经无水乙醇沉淀,过滤,收集沉淀,透析,冻干;
2)将上述获得产物加入到DMF中搅拌,加入去氧胆酸,EDC·HCl和NHS,室温下搅拌反应24-36h,透析,冻干,得到N-去氧胆酸羟乙基壳聚糖。
一种靶向作用于胃癌组织的多西紫杉醇壳聚糖纳米胶束的制备方法:
1)取壳聚糖置于过量的40%NaOH中-20-10℃下碱化反应;碱化后滴入50-100mL氯乙醇,再于70-80℃下反应24-36h,反应后调反应液至中性,调节后醇沉,收集沉淀,沉淀加入至DMF中搅拌,而后再加入去氧胆酸、EDC·HCl和NHS,室温下搅拌反应,得到N-去氧胆酸羟乙基壳聚糖;其中,去氧胆酸的加入量为壳聚糖质量的0.05-0.1倍;去氧胆酸、EDC·HCl和NHS摩尔比为1-1.5:1.5:1.5;
2)将NHS-PEG5000-NH-Boc和GX1溶于DMF中,室温密闭反应24-36h,反应后加入TFA,冰水浴下反应3-4h,反应后加入过量丙酮进行沉淀,收集沉淀于水中溶解,而后再于DMF中溶解,溶解后加入去氧胆酸、EDC·HCl和NHS,搅拌反应12-24h,即得到GX1-PEG5000-去氧胆酸,其中,去氧胆酸、EDC·HCl和NHS摩尔比为1-1.5:1.5:1.5,NHS-PEG5000-NH-Boc和GX1的摩尔比2:1-3:1;
3)将经甲醇溶解的多西紫杉醇滴加至N-去氧胆酸羟乙基壳聚糖水溶液中,再加入GX1-PEG5000-去氧胆酸,而后放入超声波细胞粉碎机中,冰水浴下超声,透析,冻干,即获得GDD纳米胶束;其中,N-去氧胆酸羟乙基壳聚糖的添加量为多西紫杉醇质量的2-4倍,GX1-PEG5000-去氧胆酸添加量为N-去氧胆酸羟乙基壳聚糖质量的0.1-0.3倍。
所述甲醇溶解的多西紫杉醇为2-8mg多西紫杉醇溶于1-2ml甲醇中。
N-去氧胆酸羟乙基壳聚糖水溶液为20-30mgN-去氧胆酸羟乙基壳聚糖溶于5-10ml水中。
所述超声条件设定为:750W,20kHz,工作2s,暂停10s,共10min。
一种靶向作用于胃癌组织的多西紫杉醇壳聚糖纳米胶束的应用,所述多西紫杉醇壳聚糖纳米胶束在制备胃癌药物中的应用。
本发明所具有的优点:
本发明GX1介导靶向胃癌组织的包裹多西紫杉醇的壳聚糖纳米胶束,改善现有多西紫杉醇制剂的剂型缺陷,赋予其缓释效果,并提高靶向性,使其有选择地集中于肿瘤组织,从而提高抗肿瘤疗效;具体为:
1)本发明中,采用壳聚糖作为载体材料,安全、无毒、具有良好的生物相容性,充分利用其2位和6位易于结构修饰的特点,制备了一种两亲性壳聚糖衍生物,利用自组装法即可制备纳米胶束,该方法制备条件温和,周期短,简单易行。
2)本发明利用GX1对胃癌组织的高度靶向性,引导纳米胶束主动在胃癌组织中聚集,降低药物对人体正常器官和组织的毒副作用。
3)本发明制备的纳米胶束粒径适中,尺寸均一,具有较高的包封率和载药量,并且赋予多西紫杉醇缓释效果。
4)GDD壳聚糖纳米胶束包裹的多西紫杉醇在6天内可缓慢释放至80%左右。
附图说明
图1为本发明实例N-去氧胆酸羟乙基壳聚糖的红外光谱图,其中1102.29cm-1是醚键伸缩振动的特征峰,说明壳聚糖的6位上连接了羟乙基基团;1653.71cm-1,1567.55cm-1显示较强的酰胺I带和II带的吸收峰,说明去氧胆酸成功和壳聚糖的氨基相连接。
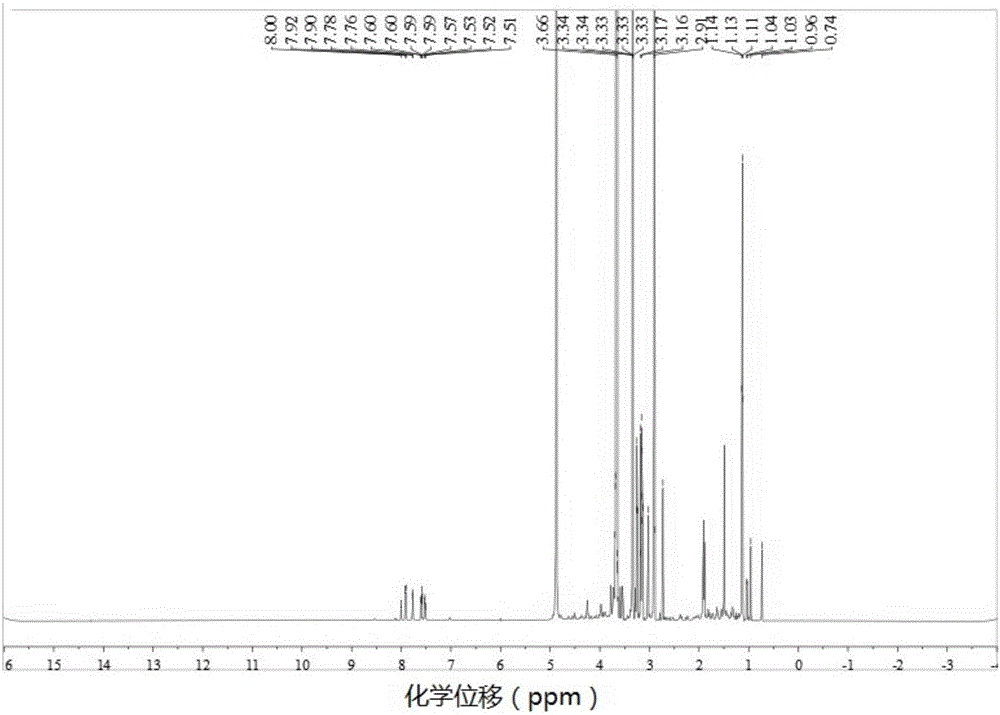
图2为本发明实例GX1-PEG5000-去氧胆酸的1H-NMR图,试剂为D2O。其中,δ7.51-8.00之间的信号显示GX1的存在,δ2.91-3.66之间的信号为PEG的特征信号,δ0.74-1.14之间的信号为去氧胆酸的甲基和亚甲基的信号。
图3为本发明实例纳米胶束粒径分布图,其中Z-Average是392.4nm,PDI是0.175。
图4为本发明实例纳米胶束缓释释放曲线,在约6天的时间内,多西紫杉醇可缓慢释放至80%左右。
图5为本发明实例纳米胶束扫描电镜图,图中显示纳米胶束的粒径为200nm左右,该结果和粒径分布结果有差异,可能是因为扫描电镜样品制备过程易对纳米胶束结构造成破坏。
具体实施例
下面结合说明书附图对本发明作进一步说明,并且本发明的保护范围不仅局限于以下实施例。
实施例1
1)称取3g壳聚糖,加入100mL 40%NaOH,在-20℃冰箱中冻存7天。取80mL氯乙醇缓慢滴入上述碱化壳聚糖溶液中,80℃下反应24h,用HCl调pH为中性,调节后加入过量无水乙醇沉淀,过滤,收集沉淀,透析,冻干;冻干产物加入到125mL DMF中搅拌,再加入150mg去氧胆酸,120mg EDC·HCl,72mg NHS,室温下搅拌反应24h,透析,冻干,得到N-去氧胆酸羟乙基壳聚糖(参见图1);
2)将NHS-PEG5000-NH-Boc和GX1(摩尔比3:1)加入至5mL DMF中,将室温密闭反应24h;向上述所得反应液中加入1mL TFA,冰水浴下反应4h,反应后加入过量丙酮沉淀,离心,收集沉淀,沉淀加水溶解,冻干;将冻干产物加入到DMF中搅拌,而后加入30mg去氧胆酸,30mg EDC·HCl和18mg NHS,室温下搅拌反应24h。反应完成后,加入过量丙酮沉淀,收集沉淀加水溶解,冻干,得到GX1-PEG5000-去氧胆酸(参见图2);
3)取30mg N-去氧胆酸羟乙基壳聚糖,溶于10mL水中得N-去氧胆酸羟乙基壳聚糖水溶液。取10mg多西紫杉醇溶于2mL甲醇中,缓慢滴加至所述N-去氧胆酸羟乙基壳聚糖水溶液中,混合,再加入6mg GX1-PEG5000-去氧胆酸,而后放入超声波细胞粉碎机中,冰水浴下超声,仪器条件为:750W,20kHz,工作2s,暂停10s,共10min。所制备胶束溶液透析,冻干,得GDD纳米胶束。
所得的壳聚糖纳米胶束,包封率为47.1%,载药量为30.3%;平均粒径为392.4nm,PDI为0.175;Zeta电位为-21.2mV(参见图3和5)。
将3mg壳聚糖纳米胶束溶解于1mL pH 7.4磷酸盐缓冲液(0.5%吐温-80,v/v),放入透析袋,将透析袋放在装有30mL pH 7.4或5.8的PBS(0.5%吐温-80,v/v)的烧杯中,37℃水浴震荡,在特定时间取1mL上述磷酸盐溶液,并补充1mL 37℃磷酸盐溶液,用高效液相色谱仪测定多西紫杉醇含量(色谱条件:波长是230nm,流动相是水:乙腈(50:50),流速是1.0mL/min,柱温是25℃),计算其累计释放的百分数。所得的纳米胶束具有良好的缓释效果,在6天内可缓慢释放至79.42%(参见表1,图4)。
表1多西紫杉醇累计释放度
实施例2
1)称取3g壳聚糖,加入100mL 40%NaOH,在-20℃冰箱中冻存7天。取80mL氯乙醇缓慢滴入上述碱化壳聚糖溶液中,80℃下反应24h,用HCl调pH为中性,调节后加入过量无水乙醇沉淀,过滤,收集沉淀,透析,冻干;冻干产物加入到125mL DMF中搅拌,再加入150mg去氧胆酸,120mg EDC·HCl,72mg NHS,室温下搅拌反应24h,透析,冻干,得到N-去氧胆酸羟乙基壳聚糖;
2)将NHS-PEG5000-NH-Boc和GX1(摩尔比3:1)加入至5mL DMF中,将室温密闭反应24h;向上述所得反应液中加入1mL TFA,冰水浴下反应4h,反应后加入过量丙酮沉淀,离心,收集沉淀,沉淀加水溶解,冻干;将冻干产物加入到DMF中搅拌,而后加入30mg去氧胆酸,30mg EDC·HCl和18mg NHS,室温下搅拌反应24h。反应完成后,加入过量丙酮沉淀,收集沉淀加水溶解,冻干,得到GX1-PEG5000-去氧胆酸;
3)取20mg N-去氧胆酸羟乙基壳聚糖,溶于10mL水中得N-去氧胆酸羟乙基壳聚糖水溶液。取5mg多西紫杉醇溶于2mL甲醇中,缓慢滴加至所述N-去氧胆酸羟乙基壳聚糖水溶液中,混合,再加入6mg GX1-PEG5000-去氧胆酸,而后放入超声波细胞粉碎机中,冰水浴下超声,仪器条件为:750W,20kHz,工作2s,暂停10s,共10min。所制备胶束溶液透析,冻干,得GDD纳米胶束。
所得的壳聚糖纳米胶束,包封率为43.9%,载药量为29.5%;平均粒径为364.6nm,PDI为0.235;Zeta电位为-21.6mV。
实施例3
1)称取3g壳聚糖,加入100mL 40%NaOH,在-20℃冰箱中冻存7天。取80mL氯乙醇缓慢滴入上述碱化壳聚糖溶液中,80℃下反应24h,用HCl调pH为中性,调节后加入过量无水乙醇沉淀,过滤,收集沉淀,透析,冻干;冻干产物加入到125mL DMF中搅拌,再加入150mg去氧胆酸,120mg EDC·HCl,72mg NHS,室温下搅拌反应24h,透析,冻干,得到N-去氧胆酸羟乙基壳聚糖;
2)将NHS-PEG5000-NH-Boc和GX1(摩尔比3:1)加入至5mL DMF中,将室温密闭反应24h;向上述所得反应液中加入1mL TFA,冰水浴下反应4h,反应后加入过量丙酮沉淀,离心,收集沉淀,沉淀加水溶解,冻干;将冻干产物加入到DMF中搅拌,而后加入30mg去氧胆酸,30mg EDC·HCl和18mg NHS,室温下搅拌反应24h。反应完成后,加入过量丙酮沉淀,收集沉淀加水溶解,冻干,得到GX1-PEG5000-去氧胆酸;
3)取10mg N-去氧胆酸羟乙基壳聚糖,溶于10mL水中得N-去氧胆酸羟乙基壳聚糖水溶液。取3mg多西紫杉醇溶于2mL甲醇中,缓慢滴加至所述N-去氧胆酸羟乙基壳聚糖水溶液中,混合,再加入6mg GX1-PEG5000-去氧胆酸,而后放入超声波细胞粉碎机中,冰水浴下超声,仪器条件为:750W,20kHz,工作2s,暂停10s,共10min。所制备胶束溶液透析,冻干,得GDD纳米胶束。
所得的壳聚糖纳米胶束,包封率为36.8%,载药量为27.4%;平均粒径为378.2nm,PDI为0.188;Zeta电位为-25.5mV。
- 还没有人留言评论。精彩留言会获得点赞!