用于治疗异常肾上腺皮质细胞疾病的化合物和方法与流程
对相关申请的交叉引用
本申请要求于2012年3月22日提交的美国临时申请第61/614,269号依据35U.S.C.§119(e)的益处,所述申请通过引用以其整体结合于此。
背景
技术领域
提供的方法和组合物用于治疗与异常肾上腺皮质细胞行为(aberrant adrenal cortex cell behavior)相关的疾病。
相关技术描述
肾上腺由两部分组成:其中产生某些激素的外皮质,以及作为神经系统的一部分的内髓质,其中产生神经系统激素。皮质致力于合成皮质类固醇和雄激素激素。特定的皮质细胞产生特定的激素,包括醛固酮、皮质醇和雄激素如雄甾烯二酮。肾上腺皮质瘤(adrenocortical tumor)起源于皮质中。
有两个主要类型的肾上腺皮质肿瘤:良性的腺瘤和恶性的肾上腺皮质癌。很多人中的腺瘤不产生症状,但是在一些情况中,肿瘤导致过量激素产生。肾上腺皮质癌可以产生激素皮质醇、醛固酮、雌激素或睾酮,以及其他激素。肾上腺皮质癌(肾上腺皮质癌症)(ACC)是罕有的、高度恶性的肿瘤。在女性中,肿瘤通常释放这些激素,这些激素可以导致男性特征。过量的激素可能导致症状也可能不导致症状。通常,腺瘤通过除去肾上腺或利用治疗性干预来治疗。同样地,肾上腺皮质癌可能导致激素产生,该激素产生可能导致显著的身体变化如体重增加、体液增加(fluid build-up)、儿童的青春期提早或女性中的过多面毛或体毛。虽然病因是未知的,但是肾上腺皮质癌在小于5岁的儿童以及30几岁和40几岁的成年人中是最常见的。肾上腺皮质癌可能与通过家庭一代传一代的癌症综合征(遗传的)有联系。男性和女性都可能发展出此肿瘤。
肾上腺皮质癌的不同阶段定义如下。阶段I是这样的肾上腺癌症,其小于5厘米(小于2英寸)并且仅发现于肾上腺中。阶段II是这样的肾上腺癌症,其大于5厘米(约2英寸)并且仅发现于肾上腺中。阶段III是这样的肾上腺癌症,其已扩展至肾上腺附近的脂肪和淋巴结中。阶段IV是这样的肾上腺癌症,其已扩展至肾上腺附近的脂肪或器官中以及扩展至淋巴结或扩展至身体的其他部分,如肺、肝、骨和腹部。
虽然随着现代分子技术的出现对该疾病的了解已经有所进步,但是代表诊断中的约一半的患有晚期疾病的患者的预后仍然是不令人乐观的。靶向疗法处于临床开发中,但是其是否将在该疾病的处理中产生突破还是未知的(Hammer,G.D.和T.Else编辑,Adrenocortical Carcinoma,Basic Science and Clinical Concepts(肾上腺皮质癌,基础科学和临床概念),2011,New York:Springer)。
唯一FDA批准的用于ACC的治疗剂是米托坦(mitotane)(o.p′-DDD),其是杀虫剂DDT的衍生物,发现于20世纪50年代,那时发现其破坏狗的肾上腺皮质。虽然使用了半个世纪,但其分子机制仍然是不清楚的。该药物需要化学转化为有活性的、自由基形式,其然后诱发脂质过氧化和细胞死亡。米托坦还抑制类固醇产生并且抑制其他细胞色素P450类酶(同上(Id.))。
虽然米托坦被广泛用于治疗ACC,但其具有仅在四分之一至三分之一的患者中增加的无进展存活期。对于取得治疗益处的患者,效果是短暂的,平均延迟疾病进展五个月(同上)。作为治疗剂,米托坦具有很多问题,这使得其难以使用,并且需要紧密监测患者。这些问题包括:
●严重的副作用:实践中,所有患者都经历胃肠功能障碍和CNS症状。米托坦导致升高的胆固醇和甘油三酯,降低的甲状腺激素功能,升高的肝酶,和白细胞减少症(leukopenia)(同上);
●窄的治疗窗:需要14mg/l来获得治疗益处,20mg/l是有毒的(Hermsen,I.G.等,J.Clin.Endocrinol.Metab.,96(6):1844-51,2011);和
●不良的ADME性质:必须频繁地调整米托坦的剂量以在不产生副作用的情况下实现足够的加载速率。即使患者摄取大量的药物,也需要数月来达到目标治疗血液水平。该药物积累在脂肪组织中,具有数月的消除半衰期。米托坦干扰其他药物的代谢,使得ACC患者的很多使人虚弱无力的症状的医学处理和额外的化疗受挑战(Kroiss,M.等,Clin.Endocrinol.(Oxf)75(5):585-91,2011;van Erp,N.P,Eur.J.Endocrinol.164(4):621-6,2011)。
由于米托坦作为用于ACC的疗法的多种限制,所以对于此致命疾病管理来说,非常需要具有更好的效力和安全性特征的替代。
概要
简言之,公开了用于治疗多种疾病或病症的方法,所述方法通过向患者施用治疗有效量的N-(2,6-二(1-甲基乙基)苯基)-N′-((1-(4-(二甲基氨基)苯基)环戊基)-甲基)脲盐酸盐(ATR-101),其中这样的方法包括治疗肾上腺皮质癌(ACC)、良性腺瘤、增加的激素产生(increased hormone production)、转移性肾上腺皮质癌(metastatic adrenocortical carcinoma)、先天性肾上腺增生(congenital adrenal hyperplasia)、库欣综合征(Cushing’s syndrome)、过量皮质醇产生(excess cortisol production)、与过量皮质醇产生相关的症状、醛固酮过多症(hyperaldosteronism)或21-羟化酶缺乏症(21-hydroxylase deficiency)以及减小肾上腺皮质瘤尺寸。
在一个实施方案中,公开了一种用于治疗患者的ACC的方法,所述方法包括向患者施用治疗有效量的ATR-101。
在另一个实施方案中,公开了一种用于治疗患者的库欣综合征的方法,所述方法包括向患者施用治疗有效量的ATR-101。
在另一个实施方案中,以上方法还包括施用第二治疗剂。在进一步的实施方案中,第二治疗剂是化疗剂(chemotherapeutic agent),米托坦,米非司酮(mifepristone),二甲双胍(甲福明,metformin),依维莫司(everolimus),靶向剂(targeting agent),抑肾上腺素剂(抗肾上腺素剂,adrenolysis agent),或IGFR拮抗剂。
在另一个实施方案中,公开了一种用于抑制患者的异常肾上腺激素产生(aberrant adrenal hormone production)的方法,所述方法包括向患者施用有效量的ATR-101以抑制激素产生。在进一步的实施方案中,所述方法还包括施用第二治疗剂。在进一步的实施方案中,所述激素是盐皮质激素(包括醛固酮),糖皮质激素(包括皮质醇),或雄激素(包括雄甾烯二酮、脱氢表雄酮和肾上腺雄甾酮)。
在进一步的实施方案中,以上方法包括口服施用ATR-101。
在进一步的实施方案中,通过以上方法治疗的患者每天施用一次、两次、三次或四次ATR-101。
在进一步的实施方案中,通过以上方法治疗的患者患有选自由以下各项组成的组中的病症:库欣综合征;过量皮质醇产生;导致肾上腺皮质醇过量的ACTH过量;垂体ACTH过量(库欣病(Cushing’s disease));异位性ACTH综合征(ectopic ACTH syndrome);原发性肾上腺皮质醇过量;或不依赖ACTH大结节样增生(ACTH independent macronodular hyperplasia)(总是双侧的);或先天性肾上腺增生(包括11羟化酶缺乏症(11hydroxylase deficiency),21-羟化酶缺乏症,醛固酮过多症(康恩综合征(Conn syndrome)),或双侧肾上腺增生(bilateral adrenal hyperplasia))。
在另一个实施方案中,公开了一种组合物,所述组合物在单位剂量中包含ATR-101和第二治疗剂。在进一步的实施方案中,第二治疗剂是化疗剂。在进一步的实施方案中,第二治疗剂选自由以下各项组成的组:米非司酮;化疗剂;二甲双胍;依维莫司;靶向剂;抑肾上腺素剂;和IGFR拮抗剂。
附图简述
图1描绘了在SCID小鼠中ATR-101治疗对H295R细胞系异种移植物的尺寸的作用。具有被填充的符号的实线表示施用300mg/kg/天ATR-101的小鼠。虚线和空心的符号表示施用赋形剂的小鼠。在给药的前8天期间,施用的ATR-101在10%DMSO,0.9%NaCl,0.5%CMC pH 3.9,0.2%Tween-20(吐温-20)(制剂I)中。随后,施用的ATR-101在0.5%CMC pH 1.9,0.2%Tween-20(制剂II)中。
图2描绘了在SCID小鼠中ATR-101治疗对H295R细胞系异种移植物的尺寸的作用。具有被填充的符号的实线表示施用300mg/kg/天ATR-101的小鼠。虚线和空心的符号表示施用赋形剂的小鼠。在第1-6天和在剩下的实验中施用来自在10%DMSO,0.9%NaCl,0.5%CMC pH 3.9,0.2%Tween-20中的分开制备的两个批次的ATR-101。
图3描绘了来自治疗和对照组的小鼠的肿瘤和器官的事后分析的结果,并且显示治疗组中的存活小鼠的肿瘤显著小于对照组中的小鼠的肿瘤。
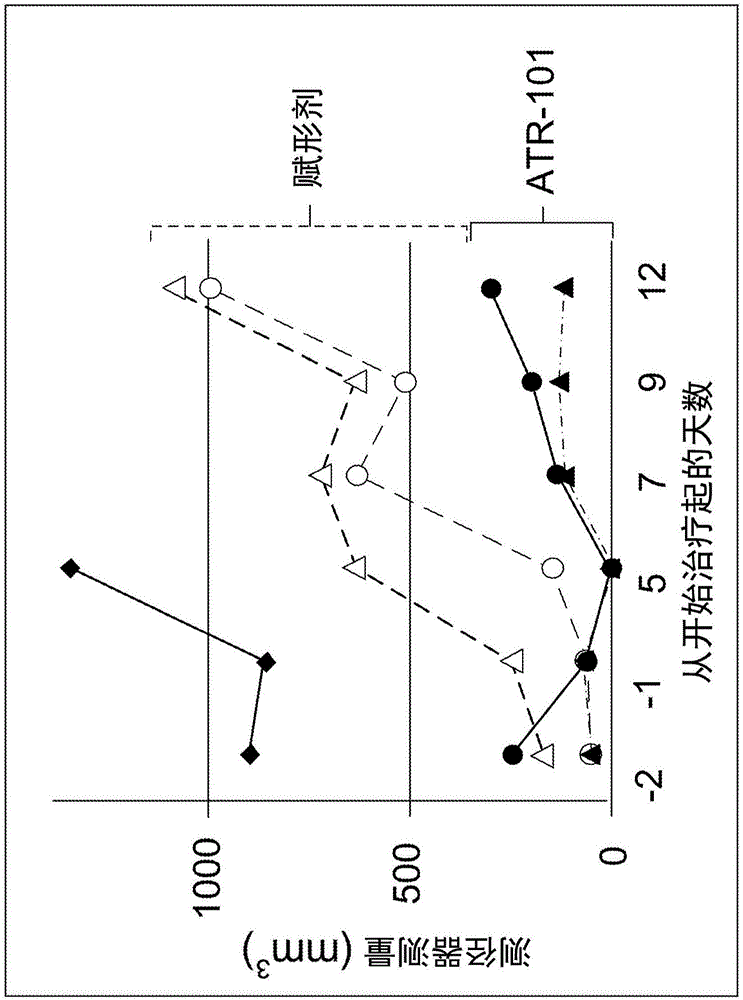
图4描绘了相比于用赋形剂治疗的对照小鼠(圆圈),作为在开始口服施用ATR-101(三角形)后的时间的函数的异种移植物尺寸。
图5描绘了相比于用赋形剂治疗的对照小鼠(圆圈),作为在开始口服施用ATR-101联合二甲双胍(球体)后的时间的函数的异种移植物尺寸。
图6描绘了相比于用赋形剂治疗的对照小鼠(圆圈),作为在开始口服施用ATR-101联合依维莫司(正方形)后的时间的函数的异种移植物尺寸。
图7描绘了ATR-101施用对ACC异种移植物建立的作用。给注射以H295R细胞的10只小鼠的随机组施用700mg/kg/天ATR-101达4天,之后在细胞注射后14天开始通过填喂法施用300mg/kg/天ATR-101或赋形剂。异种移植物的尺寸每周测量三次。数据显示在注射后的不同时间异种移植物体积(椭球模型)的平均值和标准偏差。
图8描绘了用赋形剂或ATR-101治疗的具有H295R异种移植物的小鼠中的尿皮质醇水平。给注射以H295R细胞的10只小鼠的随机组施用700mg/kg/天ATR-101达4天,之后在细胞注射后14天开始通过填喂法施用300mg/kg/天ATR-101或赋形剂。在细胞注射后22天(开始ATR-101或赋形剂施用后8天)开始指示的天数上收集尿液,并且使用皮质醇测定试剂盒(Arbor Assays)确定皮质醇水平。
图9描绘了在SCID小鼠中高剂量的ATR-101对H295R细胞系异种移植物的尺寸的作用。异种移植物尺寸被显示为相对于用赋形剂治疗的对照小鼠(菱形),在开始口服施用1,000mg/kg/天ATR-101(正方形)后的时间的函数。
图10描绘了与赋形剂治疗的小鼠相比,用1,000mg/kg/天ATR-101治疗的小鼠中的异种移植物重量。
图11描绘了ATR-101对H295R细胞(A)ATP水平和(B)刃天青(resazurin)减少的作用。将指定浓度的ATR-101加入到H295R细胞(20,000个细胞/孔用于ATP测定和40,000个细胞/孔用于刃天青测定,在于无血清培养基中之前的那天铺板)。条状图显示用在图表的右侧指示的ATR-101的浓度处理达该条状图下方指示的时间的细胞的平均发光和荧光强度。
图12A-F描绘了在H295R细胞中胆固醇缺失对由ATR-101引起的ATP水平的变化的作用。将指定浓度的ATR-101添加到H295R细胞,该H295R细胞在无血清培养基中培养了4天,继之以:(A)4小时,利用ATR-101;(B)4小时,利用ATR-101和MβCD(2mM);或(C)4小时,利用与胆固醇复合的ATR-101和MβCD(2mM)。条状图显示在用ATR-101温育4小时后制备的溶解产物的平均发光信号。将指定浓度的ATR-101添加到H295R细胞:(D)描绘了在H295R细胞中ATR-101对刃天青减少的作用;(E)描绘了在H295R细胞中ATR-101和MβCD(2mM)对刃天青减少的作用;并且(F)描绘了在H295R细胞中与胆固醇复合的ATR-101和MβCD(2mM)对刃天青减少的作用。
图13描绘了在治疗期间以及在恢复期期间的1、7、14和28天测量的在施用了0、0.3、3或30mg/kg/天的ATR-101的公狗(雄性狗)中的基础和ACTH刺激的皮质醇水平。
图14描绘了在治疗期间以及在恢复期期间的1、7、14和28天测量的在施用了0、0.3、3或30mg/kg/天的ATR-101的母狗(雌性狗)中的基础和ACTH刺激的皮质醇水平。
图15A-E描绘了相比于对照动物,施用了高剂量的ATR-101的狗的肾上腺的组织病理学。
图16A-C描绘了在施用0、0.3、3或30mg/kg/天的ATR-101达28天后公狗中的肾上腺重量。图16A描绘了以绝对肾上腺重量的剂量相关的变化。图16B描绘了以肾上腺与体重之比(肾上腺:体重(%))的剂量相关的变化。图16C描绘了以肾上腺与脑重量之比(肾上腺:脑重量(BrW))的剂量相关的变化。
图17A-C描绘了在施用0、0.3、3或30mg/kg/天的ATR-101达28天后母狗中的肾上腺重量。图17A描绘了以绝对肾上腺重量的剂量相关的变化。图17B描绘了以肾上腺与体重之比(肾上腺:体重(%))的剂量相关的变化。图17C描绘了肾上腺与脑重量之比(肾上腺:脑重量(BrW))的剂量相关的变化。
图18描绘了在被给予100mg/kg/天达7天的雌性大鼠中ATR-101的组织分布。显示的数值为平均值+标准偏差,N=3。
图19描绘了在被给予3mg/kg/天达7天的母狗中ATR-101的组织分布。显示的数值为平均值+标准偏差,N=3。
图20描绘了作为血浆浓度的百分比的ATR-101在大鼠和狗中的组织分布。显示的数值为平均值+标准偏差,N=3。
详述
定义
当在本文中使用时,“治疗”包括用于减缓或阻止与异常的肾上腺皮质细胞活性相关的疾病的进展的治疗性应用,用于防止与异常的肾上腺皮质细胞活性相关的疾病的发展的预防性应用,以及与异常的肾上腺皮质细胞活性相关的疾病的逆转。疾病的逆转与减缓或阻止疾病的治疗性应用的不同之处在于:利用逆转的方法,不仅疾病的进展被完全阻止,细胞行为在某种程度上被移向在缺乏异常的肾上腺皮质细胞活性下将会观察到的正常状态。
当在本文中使用时,“异常的肾上腺皮质细胞行为”包括增加的激素产生,良性腺瘤,肾上腺皮质癌,转移性肾上腺皮质癌,先天性肾上腺增生,醛固酮过多症(包括康恩综合征),单侧醛固酮产生腺瘤,双侧肾上腺增生(或特发性醛固酮过多症(IHA)),肾素响应性腺瘤(renin-responsive adenoma),原发性肾上腺增生和糖皮质激素可抑制醛固酮增多症(glucocorticoid-remediable aldosteronism)(GRA)和21-羟化酶缺乏症。因此,在本文中使用“与异常的肾上腺皮质细胞活性相关的疾病”是指直接或间接地起因于异常的肾上腺皮质细胞行为的症状和/或病症。如在本文中将变得明显的,这些直接或间接地起因于异常的肾上腺皮质细胞行为的症状和/或病症有很多。当在本文中使用时,“肾上腺皮质的(adrenocortical)”和“肾上腺皮质(adrenal cortex)”意在表示相同含义。
当在本文中使用时,“库欣综合征”是指由身体组织对高水平皮质醇的长期暴露引起的激素紊乱。库欣综合征有时被称为“皮质醇增多症(hypercortisolism)”(过量皮质醇产生)。库欣综合征包括多种疾病亚型,包括库欣病(Cushing’s disease)、肾上腺库欣综合征(adrenal Cushing’s syndrome)和异位性ACTH综合征(ectopic ACTH syndrome),其是通过皮质醇增多症的病因分类的。库欣病,也被称为垂体库欣病(pituitary Cushing’s),是由分泌过量ACTH(其又刺激肾上腺产生更多的皮质醇)的垂体瘤引起的。异位性ACTH综合征是由在可以产生ACTH的垂体外出现的、刺激皮质醇产生的肿瘤引起的。肾上腺库欣综合征是由导致过量皮质醇分泌的肾上腺异常(通常是肾上腺肿瘤)引起的。
当在本文中使用时,短语“转移性癌症”被定义为具有扩展至身体的其他区域的潜力或已经开始扩展至身体的其他区域的癌症。
当在本文中使用时,术语“治疗有效量”是指治疗、改善或预防疾病或病症,或展现可检测的治疗或预防效果的治疗剂的量。效果通过例如肿瘤尺寸的减小来检测。效果也通过例如化学标记物或抗原水平来检测。疗效也包括物理症状的减少,如体温下降。受试者的精确的有效量将取决于受试者的尺寸和健康,病症的性质和程度,所选择用于施用的治疗剂或治疗剂的组合,以及本领域技术人员已知的其他变量。特定情况的有效量由常规实验确定并且属于临床医生的判断。
“前药”是这样的化合物,其典型地本身几乎不具有或不具有药理活性,但是在施用于受试者后能够例如通过水解或代谢分解键接如酯部分来释放活性药物。
方法
本文提供了用于治疗与异常的肾上腺皮质细胞活性相关的疾病的方法。在不同的方面中,还提供了用于减缓或阻止与异常的肾上腺皮质细胞活性相关的疾病的进展的方法。在不同的方面中,还提供了用于预防与异常的肾上腺皮质细胞活性相关的疾病的方法。在不同的方面中,还提供了用于逆转与异常的肾上腺皮质细胞活性相关的疾病的方法。
根据本发明的方法还包括减缓或阻止进展、预防或逆转与异常的肾上腺皮质细胞行为相关的症状。
治疗
在不同的方面中,提供一种用于治疗患者的增加的激素产生的方法,所述方法包括向患者施用治疗有效量的ATR-101。
在不同的方面中,提供一种用于治疗患者的良性腺瘤的方法,所述方法包括向患者施用治疗有效量的ATR-101。
在不同的方面中,提供一种用于治疗患者的肾上腺皮质癌的方法,所述方法包括向患者施用治疗有效量的ATR-101。
在不同的方面中,提供一种用于治疗患者的转移性肾上腺皮质癌的方法,所述方法包括向患者施用治疗有效量的ATR-101。
在不同的方面中,提供一种用于治疗患者的先天性肾上腺增生的方法,所述方法包括向患者施用治疗有效量的ATR-101。
在不同的方面中,提供一种用于治疗患者的库欣综合征的方法,所述方法包括向患者施用治疗有效量的ATR-101。
在不同的方面中,提供一种用于治疗患者的过量皮质醇产生的方法,所述方法包括向患者施用治疗有效量的ATR-101。
在不同的方面中,提供一种用于治疗患者的与过量皮质醇产生相关的症状的方法,所述方法包括向患者施用治疗有效量的ATR-101。
在不同的方面中,提供一种用于治疗患者的醛固酮过多症的方法,所述方法包括向患者施用治疗有效量的ATR-101。
在不同的方面中,提供一种用于治疗患者的康恩综合征的方法,所述方法包括向患者施用治疗有效量的ATR-101。
在不同的方面中,提供一种用于治疗患者的单侧产生醛固酮的腺瘤(unilateral aldosterone-producing adenoma)的方法,所述方法包括向患者施用治疗有效量的ATR-101。
在不同的方面中,提供一种用于治疗患者的双侧肾上腺增生(或特发性醛固酮过多症(IHA))的方法,所述方法包括向患者施用治疗有效量的ATR-101。
在不同的方面中,提供一种用于治疗患者的肾素响应性腺瘤的方法,所述方法包括向患者施用治疗有效量的ATR-101。
在不同的方面中,提供一种用于治疗患者的原发性肾上腺增生的方法,所述方法包括向患者施用治疗有效量的ATR-101。
在不同的方面中,提供一种用于治疗患者的糖皮质激素可抑制醛固酮增多症(GRA)的方法,所述方法包括向患者施用治疗有效量的ATR-101。
在不同的方面中,提供一种用于治疗患者的21-羟化酶缺乏症的方法,所述方法包括向患者施用治疗有效量的ATR-101。
在不同的方面中,提供一种用于减小患者的肾上腺皮质瘤尺寸的方法,所述方法包括向患者施用有效量的ATR-101。
在不同的方面中,提供一种抑制患者的异常肾上腺激素产生的方法,所述方法包括向患者施用有效量的ATR-101以抑制激素产生。
减缓或阻止进展
在不同的方面中,提供一种用于减缓或阻止患者的增加的激素产生的进展的方法,所述方法包括向患者施用治疗有效量的ATR-101。
在不同的方面中,提供一种用于减缓或阻止患者的良性腺瘤的进展的方法,所述方法包括向患者施用治疗有效量的ATR-101。
在不同的方面中,提供一种用于减缓或阻止患者的肾上腺皮质癌的进展的方法,所述方法包括向患者施用治疗有效量的ATR-101。
在不同的方面中,提供一种用于减缓或阻止患者的转移性肾上腺皮质癌的进展的方法,所述方法包括向患者施用治疗有效量的ATR-101。
在不同的方面中,提供一种用于减缓或阻止患者的库欣综合征的进展的方法,所述方法包括向患者施用治疗有效量的ATR-101。
在不同的方面中,提供一种用于减缓或阻止患者的过量皮质醇产生的进展的方法,所述方法包括向患者施用治疗有效量的ATR-101。
在不同的方面中,提供一种用于减缓或阻止患者的与过量皮质醇产生相关的症状的进展的方法,所述方法包括向患者施用治疗有效量的ATR-101。
在不同的方面中,提供一种用于减缓或阻止患者的先天性肾上腺增生的进展的方法,所述方法包括向患者施用治疗有效量的ATR-101。
在不同的方面中,提供一种用于减缓或阻止患者的醛固酮过多症的进展的方法,所述方法包括向患者施用治疗有效量的ATR-101。
在不同的方面中,提供一种用于减缓或阻止患者的康恩综合征的进展的方法,所述方法包括向患者施用治疗有效量的ATR-101。
在不同的方面中,提供一种用于减缓或阻止患者的单侧产生醛固酮的腺瘤的进展的方法,所述方法包括向患者施用治疗有效量的ATR-101。
在不同的方面中,提供一种用于减缓或阻止患者的双侧肾上腺增生(或特发性醛固酮过多症(IHA))的进展的方法,所述方法包括向患者施用治疗有效量的ATR-101。
在不同的方面中,提供一种用于减缓或阻止患者的肾素响应性腺瘤的进展的方法,所述方法包括向患者施用治疗有效量的ATR-101。
在不同的方面中,提供一种用于减缓或阻止患者的原发性肾上腺增生的进展的方法,所述方法包括向患者施用治疗有效量的ATR-101。
在不同的方面中,提供一种用于减缓或阻止患者的糖皮质激素可抑制醛固酮增多症(GRA)的进展的方法,所述方法包括向患者施用治疗有效量的ATR-101。
在不同的方面中,提供一种用于减缓或阻止患者的21-羟化酶缺乏症的进展的方法,所述方法包括向患者施用治疗有效量的ATR-101。
预防
在不同的方面中,提供一种用于预防患者的增加的激素产生的方法,所述方法包括向患者施用治疗有效量的ATR-101。
在不同的方面中,提供一种用于预防患者的良性腺瘤的方法,所述方法包括向患者施用治疗有效量的ATR-101。
在不同的方面中,提供一种用于预防患者的肾上腺皮质癌的方法,所述方法包括向患者施用治疗有效量的ATR-101。
在不同的方面中,提供一种用于预防患者的转移性肾上腺皮质癌的方法,所述方法包括向患者施用治疗有效量的ATR-101。
在不同的方面中,提供一种用于预防患者的库欣综合征的方法,所述方法包括向患者施用治疗有效量的ATR-101。
在不同的方面中,提供一种用于预防患者的过量皮质醇产生的方法,所述方法包括向患者施用治疗有效量的ATR-101。
在不同的方面中,提供一种用于预防患者的与过量皮质醇产生相关的症状的进展的方法,所述方法包括向患者施用治疗有效量的ATR-101。
在不同的方面中,提供一种用于预防患者的先天性肾上腺增生的方法,所述方法包括向患者施用治疗有效量的ATR-101。
在不同的方面中,提供一种用于预防患者的醛固酮过多症的方法,所述方法包括向患者施用治疗有效量的ATR-101。
在不同的方面中,提供一种用于预防患者的康恩综合征的方法,所述方法包括向患者施用治疗有效量的ATR-101。
在不同的方面中,提供一种用于预防患者的单侧产生醛固酮的腺瘤的方法,所述方法包括向患者施用治疗有效量的ATR-101。
在不同的方面中,提供一种用于预防患者的双侧肾上腺增生(或特发性醛固酮过多症(IHA))的方法,所述方法包括向患者施用治疗有效量的ATR-101。
在不同的方面中,提供一种用于预防患者的肾素响应性腺瘤的方法,所述方法包括向患者施用治疗有效量的ATR-101。
在不同的方面中,提供一种用于预防患者的原发性肾上腺增生的方法,所述方法包括向患者施用治疗有效量的ATR-101。
在不同的方面中,提供一种用于预防患者的糖皮质激素可抑制醛固酮增多症(GRA)的方法,所述方法包括向患者施用治疗有效量的ATR-101。
在不同的方面中,提供一种用于预防患者的21-羟化酶缺乏症的方法,所述方法包括向患者施用治疗有效量的ATR-101。
逆转(reversing)
在不同的方面中,提供一种用于逆转患者的激素产生的方法,所述方法包括向患者施用治疗有效量的ATR-101。
在不同的方面中,提供一种用于逆转患者的良性腺瘤的方法,所述方法包括向患者施用治疗有效量的ATR-101。
在不同的方面中,提供一种用于逆转患者的肾上腺皮质癌的方法,所述方法包括向患者施用治疗有效量的ATR-101。
在不同的方面中,提供一种用于逆转患者的转移性肾上腺皮质癌的方法,所述方法包括向患者施用治疗有效量的ATR-101。
在不同的方面中,提供一种用于逆转患者的库欣综合征的方法,所述方法包括向患者施用治疗有效量的ATR-101。
在不同的方面中,提供一种用于逆转患者的过量皮质醇产生的方法,所述方法包括向患者施用治疗有效量的ATR-101。
在不同的方面中,提供一种用于逆转患者的先天性肾上腺增生的方法,所述方法包括向患者施用治疗有效量的ATR-101。
在不同的方面中,提供一种用于逆转患者的醛固酮过多症的方法,所述方法包括向患者施用治疗有效量的ATR-101。
在不同的方面中,提供一种用于逆转患者的康恩综合征的方法,所述方法包括向患者施用治疗有效量的ATR-101。
在不同的方面中,提供一种用于逆转患者的单侧产生醛固酮的腺瘤的方法,所述方法包括向患者施用治疗有效量的ATR-101。
在不同的方面中,提供一种用于逆转患者的双侧肾上腺增生(或特发性醛固酮过多症(IHA))的方法,所述方法包括向患者施用治疗有效量的ATR-101。
在不同的方面中,提供一种用于逆转患者的肾素响应性腺瘤的方法,所述方法包括向患者施用治疗有效量的ATR-101。
在不同的方面中,提供一种用于逆转患者的原发性肾上腺增生的方法,所述方法包括向患者施用治疗有效量的ATR-101。
在不同的方面中,提供一种用于逆转患者的糖皮质激素可抑制醛固酮增多症(GRA)的方法,所述方法包括向患者施用治疗有效量的ATR-101。
在不同的方面中,提供一种用于逆转患者的21-羟化酶缺乏症的方法,所述方法包括向患者施用治疗有效量的ATR-101。
化合物
可用于本发明的方法的化合物包括,在不同的方面中,诱发肾上腺皮质细胞中的静止状态的那些化合物。在不同的方面中,化合物和方法不杀死肾上腺干细胞。在不同的方面中,本发明的化合物和方法选择性地消融肾上腺皮质细胞。在不同的方面中,本发明的化合物选择性地抑制肾上腺皮质细胞中的细胞色素C氧化酶(复合体IV)的酶活性,和/或选择性地抑制靶肾上腺皮质细胞中的呼吸作用。在不同的方面中,本发明的化合物和方法调节肾上腺皮质细胞中(和来自肾上腺皮质细胞)的激素产生。
在一个实施方案中,本发明的方法利用酰基辅酶A的抑制剂:胆固醇O-酰基转移酶(ACAT;EC 2.3.1.26),其被指定为PD132301或PD132301-2(N-(2,6-二(1-甲基乙基)苯基)-N′-((1-(4-(二甲基氨基)苯基)环戊基)-甲基)脲盐酸盐;PD-132301-2;PD 132301-2;N-(2,6-二(1-甲基乙基)-苯基)-N′-((1-(4-(二甲基氨基)苯基)-环戊基)甲基)-脲单盐酸盐)。PD132301的前药及其盐也被考虑。如由以下结构描绘的游离碱的单盐酸盐在本文中被称为“ATR-101”。
ATR-101可以通过本领域中已知的技术制备,包括(例如)通过由Trivedi,B.K.等,J.Med.Chem.,37(11):1652-1659,1994和/或美国专利号5,015,644公开的方法。除了单盐酸盐以外,其他考虑的盐形式包括这样的盐,其保留生物有效性并且其不是在生物学上或在其他方面不合需要的,并且其与无机酸或有机酸形成,所述无机酸如但不限于,盐酸,氢溴酸,硫酸,硝酸,磷酸等,所述有机酸如但不限于,乙酸,2,2-二氯乙酸,己二酸,藻酸,抗坏血酸,天冬氨酸,苯磺酸,苯甲酸,4-乙酰胺基苯甲酸,樟脑酸,樟脑-10-磺酸,癸酸,己酸,辛酸,碳酸,肉桂酸,柠檬酸,环己烷氨基磺酸(cyclamic acid),十二烷基硫酸,乙烷-1,2-二磺酸,乙磺酸,2-羟基乙磺酸,甲酸,富马酸,粘酸(galactaric acid),龙胆酸(gentisic acid),葡庚糖酸,葡糖酸,葡糖醛酸,谷氨酸,戊二酸,2-氧代-戊二酸,甘油磷酸,羟基乙酸,马尿酸(hippuric acid),异丁酸,乳酸,乳糖酸,月桂酸,马来酸,苹果酸,丙二酸,扁桃酸,甲磺酸,粘液酸,萘-1,5-二磺酸,萘-2-磺酸,1-羟基-2-萘酸,烟酸,油酸,乳清酸(orotic acid),草酸,棕榈酸,扑酸,丙酸,焦谷氨酸,丙酮酸,水杨酸,4-氨基水杨酸,癸二酸,硬脂酸,琥珀酸,酒石酸,硫氰酸,对甲苯磺酸,三氟乙酸,十一碳烯酸等。
测试
本领域中理解的是,用本发明的方法或化合物的靶向的患者群体通过常规测试鉴定。在一个实施方案中,目标患者被鉴定为这样的患者,其中促肾上腺皮质激素(ACTH水平)低或被抑制,脱氢表雄酮(DHEA)水平低或被抑制,醛固酮水平高,皮质醇水平高,和/或钾水平低。
关于高水平的皮质醇,本领域中已知的是,皮质醇可以抑制DHEA和孕酮。其也可以抑制甲状腺活性。皮质醇可以使钙自骨移动,并且使其循环回到我们的血流中。在不同的方面中,过量的皮质醇可以导致骨损失并且因此导致骨质疏松症(osteoporosis)。过量的皮质醇可以抑制免疫系统并且导致疾病,包括寄生虫和病毒疾病。例如,假丝酵母(Candida)和寄生病症可以由高皮质醇导致,因为过量的皮质醇破坏友好的细菌,就像抗生素那样。高皮质醇还升高血糖,这可以引发或恶化糖尿病。因此,由应激引发的高皮质醇所致的腹部周围的增重是常见的。
升高的皮质醇可以表现为容易擦伤,肌肉紧张性差或肌肉消瘦,不良的伤口愈合,薄的皮肤,肥胖纹(stretch marks),过多的疤痕组织,脂肪垫的发展,慢性酵母感染,加速的皮肤老化,肿胀的皮肤松弛,水分保持,满月脸,记忆丧失和一般认知(学习)能力损失,和/或情绪波动。表明增加的皮质醇或其他肾上腺激素产生的症状包括刚好在颈部下方在后背上突起的圆形的脂肪瘤(水牛背(buffalo hump)),肥胖,身高生长萎缩(身材矮小),男性化,包括出现男性特征,包括增加的体毛(尤其在面部),阴毛,痤疮和声音变深。
协同治疗(co-therapy)
提供的方法考虑了通过施用第二治疗剂的协同治疗,所述第二治疗剂包括已知的化疗剂,靶向剂,抑肾上腺素剂,二甲双胍,依维莫司,和/或IGF1R拮抗剂。涉及协同治疗的方法还包括使用放射疗法。
临床试验方案
考虑的方法包括在临床试验中联合目前涉及的、之前涉及的或预期将要涉及的其他治疗方法使用化合物。
例如,提供这样的方法,其包括通过口腔施用化合物与米托坦,每天四次,持续3周。该方案包括在第1周中的在2天的6小时的顺铂注入和在3天的1小时的依托泊苷(etoposide)注入和在2天的1小时的多柔比星(doxorubicin)注入。在第1周中开始每天施用一次G-CSF并且继续直至血细胞计数回到正常或在第1周中注射一次培非司亭(pegfilgrastim)。
提供这样的方法,所述方法包括在已经进行了或将要进行根治性切除术的患者中一起使用化合物和米托坦。
考虑这样的方法,所述方法包括本发明的化合物以及口服索拉非尼(sorafenib)400mg,口服一日两次(p.o.bid),加上静脉内紫杉醇(paclitaxel)60mg/mq/每周一次静脉注射。
提供这样的方法,所述方法包括将化合物与抗癌肽(antineoplaston)一起施用。在一些方面中,考虑了用于治疗阶段IV肾上腺癌的方法。
还考虑这样的方法,所述方法用于在具有攻击性或其他方面不可治疗的肾上腺皮质癌的个体中将化合物与阿西替尼(axitinib)一起施用。
考虑这样的方法,所述方法将本发明的化合物与舒尼替尼(sunitinib)或特姆莫司(temsirolimus)一起使用。还考虑包括施用化合物和舒尼替尼羟氯喹(sunitinib hydroxychloroquine)施用的方法。
还考虑这样的方法,其使用本发明的化合物和多韦替尼(dovitinib)(TKI-258),以以5天开/2天关时间安排施用500mg/天的平整模式(flat scale)用药。
还考虑这样的方法,其使用本发明的化合物以及抗体8H9,其被注射到存在肿瘤的腹部或腹膜的内衬中。还考虑这样的方法,其中放射性的碘可以结合至此抗体以将辐射递送至肿瘤。
化疗剂/放疗剂
合适的化疗剂和放疗剂的实例包括,但不限于:抗代谢物;DNA破坏剂;可用作化疗剂的细胞因子;共价DNA结合药物;拓扑异构酶抑制剂;抗有丝分裂剂;抗肿瘤抗生素;分化剂;烷基化剂;甲基化剂;激素或激素拮抗剂;氮芥;放射敏化剂;光敏剂;放射源,任选地与放射敏化剂或光敏剂一起;或其他常用的治疗剂。
考虑使用的化疗剂包括(不限于),烷基化剂,其包括:氮芥,如二氯甲基二乙胺(mechlor-ethamine),环磷酰胺(cyclophosphamide),异环磷酰胺(ifosfamide),美法仑(melphalan)和苯丁酸氮芥(chlorambucil);亚硝基脲类,如卡莫司汀(carmustine)(BCNU),洛莫司汀(lomustine)(CCNU),和司莫司汀(semustine)(甲基-CCNU);乙烯亚胺/甲基三聚氰胺如三乙烯蜜胺(TEM),三乙烯,三亚乙基硫代磷酰胺(塞替派(thiotepa)),六甲基三聚氰胺(HMM,六甲蜜胺(altretamine));烷基磺酸盐如白消安(busulfan);三嗪如达卡巴嗪(dacarbazine)(DTIC);抗代谢物,包括叶酸类似物如甲氨蝶呤(methotrexate)和三甲曲沙(trimetrexate),嘧啶类似物如5-氟尿嘧啶,氟脱氧尿苷(fluorodeoxyuridine),吉西他滨(gemcitabine),胞嘧啶阿糖核苷(cytosine arabinoside)(AraC,阿糖胞苷(cytarabine)),5-氮杂胞苷(5-azacytidine),2,2′-二氟脱氧胞苷,嘌呤类似物如6-巯基嘌呤,6-硫代鸟嘌呤,硫唑嘌呤(azathioprine),2′-脱氧柯福霉素(2′-deoxycoformycin)(喷司他丁(pentostatin)),赤羟基壬基腺嘌呤(erythrohydroxynonyladenine)(EHNA),磷酸氟达拉滨(fludarabine phosphate),和2-氯脱氧腺苷(克拉屈滨(cladribine),2-CdA);天然产物,包括抗有丝分裂药如紫杉醇,长春花生物碱,包括长春碱(vinblastine)(VLB),长春新碱(vincristine),和长春瑞滨(vinorelbine),泰索帝(taxotere),雌莫司汀(estramustine),和磷酸雌莫司汀;表鬼臼毒素(epipodophylotoxin)如依托泊苷和替尼泊苷(teniposide);抗生素如放线菌素D,道诺霉素(daunomycin)(红比霉素(rubidomycin)),多柔比星,米托蒽醌(mitoxantrone),伊达比星(idarubicin),博莱霉素(bleomycin),普卡霉素(plicamycin)(光辉霉素(mithramycin)),丝裂霉素C,和放线菌素(actinomycin);酶如L-天冬酰胺酶;生物学反应修饰剂如干扰素-α,IL-2,G-CSF和GM-CSF;混杂试剂,包括铂配位复合物如顺铂(cisplatin),Pt(IV)和卡铂(carboplatin),蒽二酮如米托蒽醌,取代的脲如羟基脲,甲肼衍生物,包括N-甲肼(MIH)和丙卡巴肼(procarbazine),肾上腺皮质抑制剂如米托坦(o,p′-DDD)和氨鲁米特(aminoglutethimide);激素和拮抗剂,包括肾上腺皮质类固醇拮抗剂如泼尼松(prednisone)和等效物,地塞米松(dexamethasone)和氨鲁米特;孕酮如己酸羟基孕酮,醋酸甲羟孕酮(medroxyprogesterone acetate)和醋酸甲地孕酮(megestrol acetate);雌激素如己烯雌酚(diethylstilbestrol)和乙炔基雌二醇等效物;抗雌激素如他莫昔芬(tamoxifen);雄激素,包括丙酸睾酮和氟甲睾酮(fluoxymesterone)/等效物;抗雄激素如氟他胺(flutamide),释放促性腺激素的激素类似物和亮丙瑞林(leuprolide);和非甾体抗雄激素如氟他胺.
在一些实施方案中,化疗剂被共同施用或共同配制,其中化疗剂选自由以下各项组成的组:5-氟尿嘧啶(5-FU),阿霉素(Adriamycin),D放线菌素,博来霉素(Bleomycin),长春碱,顺铂,阿西维辛(acivicin);阿柔比星(aclarubicin);盐酸阿考达唑(acodazole hydrochloride);阿克罗宁(acronine);阿多来新(adozelesin);阿地白介素(aldesleukin);六甲蜜胺(altretamine);安波霉素(ambomycin);醋酸阿美蒽醌(ametantrone acetate);氨鲁米特;安吖啶(amsacrine);阿那曲唑(anastrozole);安曲霉素(anthramycin);天冬酰胺酶;曲林菌素(asperlin);阿扎胞苷(azacitidine);阿扎替派(azetepa);阿佐霉素(azotomycin);巴马司他(batimastat);苯佐替派(benzodepa);比卡鲁胺(bicalutamide);盐酸比生群(bisantrene hydrochloride);二甲磺酸双奈法德(bisnafide dimesylate);比折来新(bizelesin);硫酸博来霉素;布喹那钠(brequinar sodium);溴匹立明(bropirimine);白消安;放线菌素C;卡普睾酮(calusterone);卡醋胺(caracemide);卡贝替姆(carbetimer);卡铂;卡莫司汀;盐酸卡柔比星(carubicin hydrochloride);卡折来新(carzelesin);西地芬戈(cedefingol);苯丁酸氮芥;西罗霉素(cirolemycin);克拉屈滨;甲磺酸克立那托(crisnatol mesylate);环磷酰胺;阿糖胞苷(cytarabine);达卡巴嗪;盐酸柔红霉素(daunorubicin hydrochloride);地西他滨(decitabine);右奥马铂(dexormaplatin);地扎胍宁(dezaguanine);甲磺酸地扎胍宁;地吖醌(diaziquone);多柔比星;盐酸多柔比星;屈洛昔芬(droloxifene);柠檬酸屈洛昔芬;丙酸甲雄烷酮(dromostanolone propionate);达佐霉素(duazomycin);依达曲沙(edatrexate);盐酸依鸟氨酸(eflomithine hydrochloride);依沙芦星(elsamitrucin);恩洛铂(enloplatin);恩普氨酯(enpromate);依匹哌啶(epipropidine);盐酸表柔比星(epirubicin hydrochloride);厄布洛唑(erbulozole);盐酸依索比星(esorubicin hydrochloride);雌莫司汀;雌莫司汀磷酸钠;依他硝唑(etanidazole);依托泊苷;磷酸依托泊苷;氯苯乙嘧胺(etoprine);盐酸法罗唑啉(fadrozole hydrochloride);法扎拉滨(fazarabine);芬维A铵(fenretinide);氟尿苷(floxuridine);磷酸氟达拉滨;氟尿嘧啶;氟西他滨(fluorocitabine);磷喹酮(fosquidone);福司曲星钠(fostriecin sodium);吉西他滨;盐酸吉西他滨;羟基脲;盐酸伊达比星;异环磷酰胺;伊莫福新(ilmofosine);白介素II(包括重组白介素II,或rIL2),干扰素β-2a;干扰素β-2b;干扰素β-n1;干扰素β-n3;干扰素β-I a;干扰素β-I b;异丙铂(iproplatin);盐酸伊立替康(irinotecan hydrochloride);醋酸兰瑞肽(lanreotide acetate);来曲唑(letrozole);醋酸亮丙瑞林;盐酸利阿唑(liarozole hydrochloride);洛美曲索钠(lometrexol sodium);洛莫司汀;盐酸洛索蒽醌(losoxantrone hydrochloride);马索罗酚(masoprocol);美坦辛(maytansine);盐酸氮芥(mechlorethamine hydrochloride);醋酸甲地孕酮;醋酸美仑孕酮(melengestrol acetate);美法仑;美诺立尔(menogaril);巯基嘌呤;甲氨蝶呤;甲氨蝶呤钠;氯苯氨啶(metoprine);美妥替哌(meturedepa);米丁度胺(mitindomide);米托卡星(mitocarcin);丝裂红素(mitocromin);米托洁林(mitogillin);米托马星(mitomalcin);丝裂霉素;米托司培(mitosper);米托坦;盐酸米托蒽醌;霉酚酸(mycophenolic acid);诺考达唑(nocodazole);诺拉霉素(nogalamycin);奥马铂(ormaplatin);奥昔舒仑(oxisuran);培加帕酶(pegaspargase);培利霉素(peliomycin);戊氮芥(pentamustine);硫酸培洛霉素(peplomycin sulfate);培磷酰胺(perfosfamide);哌泊溴烷(pipobroman);哌泊舒凡(piposulfan);盐酸吡罗蒽醌(piroxantrone hydrochloride);普卡霉素;普洛美坦(plomestane);卟吩姆钠(porfimer sodium);泊非霉素(porfiromycin);泼尼莫司汀(prednimustine);盐酸丙卡巴肼;嘌呤霉素(puromycin);盐酸嘌呤霉素;吡唑呋喃菌素(pyrazofurin);利波腺苷(riboprine);罗谷亚胺(rogletimide);沙芬戈(safingol);盐酸沙芬戈;司莫司汀;辛曲秦(simtrazene);磷乙酰天冬氨酸钠(sparfosate sodium);司帕霉素(sparsomycin);盐酸螺旋锗(spirogermanium hydrochloride);螺莫司汀(spiromustine);螺铂(spiroplatin);链黑霉素(streptonigrin);链佐星(streptozocin);磺氯苯脲(sulofenur);他利霉素(talisomycin);替可加兰钠(tecogalan sodium);替加氟(tegafur);盐酸替洛蒽醌(teloxantrone hydrochloride);替莫泊芬(temoporfin);替尼泊苷;替罗昔隆(teroxirone);睾内酯(testolactone);硫咪嘌呤(thiamiprine);硫鸟嘌呤;塞替派;噻唑羧胺核苷(tiazofurin);替拉扎明(tirapazamine);柠檬酸托瑞米芬(toremifene citrate);醋酸曲托龙(trestolone acetate);磷酸曲西立滨(triciribine phosphate);三甲曲沙;葡糖醛酸三甲曲沙;曲普瑞林(triptorelin);盐酸妥布氯唑(tubulozole hydrochloride);尿嘧啶氮芥(uracil mustard);乌瑞替派(uredepa);伐普肽(vapreotide);维替泊芬(verteporfin);硫酸长春碱;硫酸长春新碱;长春地辛(vindesine);硫酸长春地辛;硫酸长春匹定(vinepidine sulfate);硫酸长春甘酯(vinglycinate sulfate);硫酸环氧长春碱(vinleurosine sulfate);酒石酸长春瑞滨;硫酸异长春碱(vinrosidine sulfate);硫酸长春利定(vinzolidine sulfate);伏氯唑(vorozole);折尼铂(zeniplatin);净司他丁(zinostatin);和盐酸佐柔比星(zorubicin hydrochloride)。
其他化疗剂包括,但不限于,20-表-1,25二羟基维生素D3;5-乙炔尿嘧啶;阿比特龙(abiraterone);阿克拉霉素(aclarubicin);酰基富烯(acylfulvene);adecypenol;阿多来新(adozelesin);阿地白介素;ALL-TK拮抗剂;六甲蜜胺;氨莫司汀(ambamustine);amidox;氨磷汀(amifostine);氨基乙酰丙酸(aminolevulinic acid);氨柔比星(amrubicin);阿那格雷(anagrelide);穿心莲内酯(andrographolide);血管发生抑制剂;拮抗剂D;拮抗剂G;安雷利克斯(antarelix);反背侧化形态发生蛋白-1(anti-dorsalizing morphogenetic protein-1);抗雄激素,前列腺癌;抗雌激素;抗瘤酮;反义寡核苷酸;甘氨酸阿非科林(aphidicolin glycinate);凋亡基因调节剂;凋亡调节剂;脱嘌呤核酸;ara-CDP-DL-PTBA;精氨酸脱氨酶;asulacrine;阿他美坦(atamestane);阿莫司汀(atrimustine);axinastatin 1;axinastatin 2;axinastatin 3;阿扎司琼(azasetron);阿扎毒素(azatoxin);重氮酪氨酸(azatyrosine);浆果赤霉素III衍生物;balanol;巴马司他;BCR/ABL拮抗剂;苯并二氢卟酚(benzochlorin);苯甲酰星状孢子素(benzoylstaurosporine);β内酰胺衍生物;β-alethine;βclamycin B;桦木酸(betulinic acid);bFGF抑制剂;比卡鲁胺;比生群;双氮丙啶精胺(bisaziridinylspermine);双奈法德(bisnafide);bistratene A;比折来新;breflate;溴匹立明;布度钛(budotitane);丁硫氨酸亚砜胺(buthionine sulfoximine);卡泊三醇(calcipotriol);calphostin C;喜树碱衍生物;金丝雀痘IL-2(canarypox IL-2);卡培他滨(capecitabine);甲酰胺-氨基-三唑;羧基胺基三唑;CaRest M3;CARN 700;软骨来源抑制剂;卡折来新;酪蛋白激酶抑制剂(ICOS);栗精胺(castanospermine);杀菌肽B(cecropin B);西曲瑞克(cetrorelix);chlorlns;氯喹喔啉磺酰胺(chloroquinoxaline sulfonamide);西卡前列素(cicaprost);独联体卟啉(cis-porphyrin);克拉屈滨;氯底酚胺(clomifene)类似物;克霉唑(clotrimazole);科里霉素A(collismycin A);科里霉素B(collismycin B);考布他汀A4(combretastatin A4);考布他汀(combretastatin)类似物;conagenin;crambescidin 816;克立那托(crisnatol);cryptophycin 8;cryptophycin A衍生物;curacin A;环戊蒽醌(cyclopentanthraquinones);cycloplatam;cypemycin;阿糖胞苷ocfosfate(cytarabine ocfosfate);细胞溶解因子;cytostatin;达昔单抗(dacliximab);地西他滨;dehydrodidemnin B;地洛瑞林(deslorelin);地塞米松;右异环磷酰胺;右雷佐生(dexrazoxane);右维拉帕米(dexverapamil);地吖醌;didemnin B;didox;diethylnorspermine;二氢-5-氮杂胞苷;9-二氢紫杉醇(9-dioxamycin);二苯基螺莫司汀;二十二烷醇(docosanol);多拉司琼(dolasetron);去氧氟尿苷(doxifluridine);屈洛昔芬;屈大麻酚(dronabinol);多米卡星SA(duocarmycin SA);依布硒啉(ebselen);依考莫司汀(ecomustine);依地福新(edelfosine);依决洛单抗(edrecolomab);依氟鸟氨酸(eflomithine);榄香烯(elemene);乙嘧替氟(emitefur);表柔比星;爱普列特(epristeride);雌莫司汀类似物;雌激素激动剂;雌激素拮抗剂;依他硝唑;磷酸依托泊苷;依西美坦(exemestane);法倔唑(fadrozole);法扎拉滨;芬维A铵;非格司亭(filgrastim);非那雄胺(finasteride);夫拉平度(flavopiridol);氟卓斯汀(flezelastine);fluasterone;氟达拉宾(fludarabine);盐酸fluorodaunorunicin;福酚美克(forfenimex);福美司坦(formestane);福司曲星(fostriecin);福莫司汀(fotemustine);钆德克萨卟啉(gadolinium texaphyrin);硝酸镓;加洛他滨(galocitabine);加尼瑞克(ganirelix);明胶酶抑制剂;吉西他滨;谷胱甘肽抑制剂;hepsulfam;heregulin;六亚甲基双乙酰胺;金丝桃素(hypericin);伊班膦酸(ibandronic acid);伊达比星;艾多昔芬(idoxifene);伊决孟酮(idramantone);伊莫福新;伊洛马司他(ilomastat);咪唑并吖啶酮;咪喹莫特(imiquimod);免疫刺激性肽;胰岛素样生长因子-1受体抑制剂;干扰素激动剂;干扰素;白介素;碘苄胍(iobenguane);碘阿霉素(iododoxorubicin);4-依波米醇(ipomeanol,4-);伊罗普拉(iroplact);伊索拉定(irsogladine);isobengazole;isohomohalicondrin B;伊他司琼(itasetron);jasplakinolide;kahalalide F;三乙酸lamellarin-N;兰瑞肽(lanreotide);雷纳霉素(leinamycin);来格司亭(lenograstim);硫酸香菇多糖(lentinan sulfate);leptolstatin;来曲唑;白血病抑制因子;白细胞α干扰素;亮丙瑞林+雌激素+孕酮;亮丙瑞林(leuprorelin);左旋咪唑(levamisole);利阿唑(liarozole);线型聚胺类似物;亲油性二糖肽;亲油性铂化合物;lissoclinamide 7;洛铂(lobaplatin);蚯蚓磷脂(lombricine);洛美曲索(lometrexol);氯尼达明(lonidamine);洛索蒽醌(losoxantrone);洛伐他汀(lovastatin);洛索立宾(loxoribine);勒托替康(lurtotecan);镥德克萨卟啉(lutetium texaphyrin);lysofylline;溶解性肽;美坦新(maitansine);制甘糖酶素A(mannostatin A);马立马司他(marimastat);马索罗酚;maspin;基质溶素(matrilysin)抑制剂;基质型金属蛋白酶抑制剂;美诺立尔;麦尔巴隆(merbarone);美替瑞林(meterelin);蛋氨酸酶(methioninase);胃复安(metoclopramide);MIF抑制剂;米非司酮;米替福新(miltefosine);米立司亭(mirimostim);错配的双链RNA;米托胍腙(mitoguazone);二溴卫矛醇(mitolactol);丝裂霉素类似物;米托萘胺(mitonafide);米托毒素(mitotoxin)成纤维细胞生长因子-皂草素(saporin);米托蒽醌;莫法罗汀(mofarotene);莫拉司亭(molgramostim);单克隆抗体,人绒毛膜促性腺素;单磷酰基脂质A+肌细菌(myobacterium)细胞壁sk;莫哌达醇(mopidamol);多药耐药性基因抑制剂;基于多肿瘤抑制基因1的疗法;芥子抗癌症药;印度洋海绵B(mycaperoxide B);分枝杆菌细胞壁提取物;myriaporone;N-乙酰基地那林(N-acetyldinaline);N-取代的苯甲酰胺(N-substituted benzamides);那法瑞林(nafarelin);那瑞替喷(nagrestip);纳洛酮(naloxone)+喷他佐辛(pentazocine);napavin;naphterpin;那托司亭(nartograstim);奈达铂(nedaplatin);奈莫柔比星(nemorubicin);奈立膦酸(neridronic acid);中性肽链内切酶;尼鲁米特(nilutamide);nisamycin;一氧化氮调节剂;硝基氧抗氧化剂;nitrullyn;06-苄基鸟嘌呤;奥曲肽(octreotide);okicenone;寡核苷酸;奥那司酮(onapristone);昂丹司琼(ondansetron);oracin;口服细胞因子诱导剂;奥马铂;奥沙特隆(osaterone);奥沙利铂(oxaliplatin);oxaunomycin;palauamine;棕榈酰根霉素(palmitoylrhizoxin);帕米磷酸(pamidronic acid);人参炔三醇(panaxytriol);帕诺米芬(panomifene);副球菌素(parabactin);帕折普汀(pazelliptine);培加帕酶;培得星(peldesine);戊聚糖多硫酸钠;喷司他丁;戊曲唑(pentrozole);全氟溴烷(perflubron);培磷酰胺;紫苏子醇(perillyl alcohol);苯连氮霉素(phenazinomycin);乙酸苯酯;磷酸酶抑制剂;溶血性链球菌制剂(picibanil);盐酸匹鲁卡品(pilocarpine hydrochloride);吡柔比星(pirarubicin);吡曲克辛(piritrexim);placetin A;placetin B;血纤维蛋白溶酶原激活剂抑制剂;铂络合物;铂化合物;铂-三胺络合物;卟吩姆钠;泊非霉素;泼尼松;丙基双吖啶酮(propyl bis-acridone);前列腺素J2;蛋白酶体抑制剂;基于蛋白A的免疫调节剂;蛋白激酶C抑制剂;蛋白质激酶C抑制剂,微藻(microalgal);蛋白酪氨酸磷酸酶抑制剂;嘌呤核苷磷酸化酶抑制剂;红紫素(purpurins);吡唑并吖啶;吡啶氧化的血红蛋白聚氧化乙烯轭合物(pyridoxylated hemoglobin polyoxyethylene conjugate);raf拮抗剂;雷替曲塞(raltitrexed);雷莫司琼(ramosetron);ras法尼基蛋白转移酶抑制剂;ras抑制剂;ras-GAP抑制剂;脱甲基化瑞替普酶(retelliptine demethylated);羟乙磷酸铼Re 186(rhenium Re 186etidronate);根霉素(rhizoxin);核酶;RII retinamide;罗谷亚胺(rogletimide);rohitukine;罗莫肽(romurtide);罗喹美克(roquinimex);rubiginone B1;ruboxyl;沙芬戈;saintopin;SarCNU;sarcophytol A;沙格司亭(sargramostim);Sdi 1模拟物(Sdi 1mimetics);司莫司汀;衰老来源的抑制剂1;正义寡核苷酸;信号转导抑制剂;信号转导调节剂;单链抗原结合蛋白;西佐喃(sizofuran);索布佐生(sobuzoxane);硼卡钠(sodium borocaptate);乙酸苯酯钠;solverol;促生长因子结合蛋白(somatomedin binding protein);索纳明(sonermin);膦门冬酸(sparfosic acid);穗霉素D(spicamycin D);螺莫司汀;splenopentin;spongistatin 1;鱼鲨胺(squalamine);干细胞抑制剂;干细胞分化抑制剂;stipiamide;溶基质素(stromelysin)抑制剂;sulfinosine;超活性血管活性肠肽拮抗剂;suradista;苏拉明(suramin);八氢吲嗪三醇(swainsonine);合成粘多糖;他莫司汀(tallimustine);他莫昔芬甲碘化物;牛磺莫司汀(tauromustine);他扎罗汀(tazarotene);替可加兰钠;替加氟;tellurapyrylium;端粒酶抑制剂(telomerase inhibitor);替莫泊芬;替莫唑胺(temozolomide);替尼泊苷;十氧化四氯(tetrachlorodecaoxide);四唑明(tetrazomine);thaliblastine;噻可拉林(thiocoraline);血小板生成素(thrombopoietin);血小板生成素模拟物(thrombopoietin mimetic);胸腺法新(thymalfasin);胸腺生成素受体激动剂;胸腺曲南(thymotrinan);甲状腺刺激激素;锡本紫红素乙酯(tin ethyl etiopurpurin);替拉扎明;二氯环戊二烯钛(titanocene bichloride);topsentin;托瑞米芬(toremifene);全能干细胞因子;翻译抑制剂;维甲酸(tretinoin);三乙酰尿苷(triacetyluridine);曲西立滨(triciribine);三甲曲沙;曲普瑞林;托烷司琼(tropisetron);妥罗雄脲(turosteride);酪氨酸激酶抑制剂;酪氨酸磷酸化抑制剂(tyrphostin);UBC抑制剂;乌苯美司(ubenimex);泌尿生殖器静脉窦来源的生长抑制因子;尿激酶受体拮抗剂;伐普肽;variolin B;载体系统,红血球基因疗法;维拉雷琐(velaresol);藜芦明(veramine);verdins;维替泊芬;长春瑞滨;vinxaltine;vitaxin;扎诺特隆(zanoterone);亚苄维C(zilascorb);和净司他丁斯酯(zinostatin stimalamer)。
细胞因子
可以有效抑制恶性肿瘤生长和转移的细胞因子也被考虑用于组合疗法中。这样的细胞因子、淋巴激活素或其他成血因子包括,但不限于,M-CSF,GM-CSF,TNF,IL-1,IL-2,IL-3,IL-4,IL-5,IL-6,IL-7,IL-8,IL-9,IL-10,IL-11,IL-12,IL-13,IL-14,IL-15,IL-16,IL-17,IL-18,IFN-α或IFN-γ,TNFα,TNF1,TNF2,G-CSF,Meg-CSF,GM-CSF,SCF,MIP-1,LIF,c-kit配体,血小板生成素,干细胞因子,和促红细胞生成素。
共刺激化合物
同样考虑涉及利用其他刺激性分子的协同治疗。刺激性分子包括CD40,B7-1,B7-2,CD54,ICAM家族的成员(包括ICAM-1、-2或-3),CD58,SLAM配体,结合热稳定抗原的多肽,结合TNF受体家族的成员(包括但不限于4-1BBL,TRAF-1,TRAF-2,TRAF-3,OX40L,TRAF-5,CD70)的多肽,CD 154,趋化因子,包括但不限于CCL3,CCL5CXCL10和CCL7。
施用(给药,administration)
护理的标准
在一些实施方案中,本文所述的方法还包括向受试者施用护理癌症治疗的标准。在本发明方法的语境中,“护理的标准”是指这样的治疗,其通常被临床医生所接受以用于特定类型的诊断患有某一类型疾病的患者。
施用的途径
所述化合物通过任何合适的方式施用,全身地或局部地,包括经由肠胃外,皮下,肺内,肌肉内,口服和鼻内。肠胃外途径包括静脉内,动脉内,硬脑膜上和鞘内施用。在不同的方面中,所述化合物通过脉冲注入施用。考虑其他施用方法,包括局部施用,尤其是透皮施用,透粘膜施用,直肠施用,口服施用或局部施用。
药物组合物/制剂
本发明的另一个方面提供用于治疗病症的药物组合物。在本发明的另一个方面中,提供在单位剂量中包含ATR-101和第二治疗剂的组合物。
描述于Remington’s Pharmaceutical Sciences 16th edition(雷明顿药物科学,第16版),Osol,A.Ed.(1980)中的一种或多种其他药用组分被包含在所述制剂中,前提是它们不会不利地影响所需制剂的特性。用于药物组合物的制剂的实例包括,但不限于,溶液,混悬剂,粉剂,粒剂,片剂,胶囊,丸剂,锭剂,咀嚼剂,霜剂,软膏剂,凝胶,脂质体制剂,纳米颗粒制剂,可注射制剂,灌肠剂,栓剂,可吸入粉剂,可喷雾液体,气溶胶,贴剂,贮存药剂(depots)和植入物。在不同的方面中,药物组合物制剂为片剂或胶囊的形式。在不同的方面中,片剂是无包衣的或包含被包被的核,例如用非功能性薄膜或释放改性或肠溶包衣。在不同的方面中,胶囊具有硬或软的壳,包括例如明胶和/或HPMC,任选地与一种或多种增塑剂一起。冻干的制剂或水溶液被考虑。还提供持续释放制剂。
提供的药物组合物的不同组分取决于所选的施用途径和所需的递送方法。
载体
合适的载体包括任何这样的材料,所述材料当与所述化合物组合时保持活性并且与受试者的免疫系统是非反应性的。实例包括,但不限于,大量标准药物载体中的任一种。考虑各种各样的含水载体并且其包括但不限于,水,缓冲的水,生理盐水,0.4%盐水和0.3%甘氨酸。
稳定剂
在不同的方面中,药物组合物制剂包括用于增强的稳定性的蛋白质,诸如且不限于,清蛋白,脂蛋白和球蛋白。
稀释剂
在不同的方面中,药物组合物制剂包括稀释剂,单独地或组合地,如,且不限于,乳糖,包括无水乳糖和乳糖一水合物;乳糖醇;麦芽糖醇;甘露糖醇;山梨糖醇;木糖醇;右旋糖和右旋糖一水合物;果糖;蔗糖和基于蔗糖的稀释剂如可压缩的糖,糖粉(confectioner’s sugar)和糖球;麦芽糖;肌醇;水解的谷物固体;淀粉(例如,玉米淀粉,小麦淀粉,稻淀粉,马铃薯淀粉,木薯淀粉等),淀粉组分如直链淀粉和dextrate,以及改性的或加工的淀粉如预胶化淀粉;糊精;纤维素,包括粉末状的纤维素,微晶纤维素,硅化微晶纤维素,α-和无定形纤维素和粉末状纤维素的食品级来源,和乙酸纤维素;钙盐,包括碳酸钙,磷酸三钙,磷酸氢钙二水合物,硫酸钙一水合物,硫酸钙和粒状乳酸钙三水合物;碳酸镁;氧化镁;膨润土;高岭土;氯化钠;等。
稀释剂,如果存在,典型地总计构成组合物重量的约5%至约99%,约10%至约85%,或约20%至约80%。所选的一种或多种稀释剂显示合适的流动性质并且,当需要片剂时,显示合适的可压缩性。
粘合剂
在不同的方面中,药物组合物制剂包括粘合剂或粘结剂,其是有用的赋形剂,尤其是在组合物是片剂形式的情况下。这样的粘合剂和粘结剂应当对被配制在片剂中的混合物赋予足够的内聚性以允许正常加工操作如确定尺寸(尺寸化,sizing),润滑,压缩和包装,但是仍然允许片剂可以崩解并且化合物可以在摄入后被吸收。合适的粘合剂和粘结剂包括,单独地或组合地,阿拉伯树胶;黄蓍胶;葡萄糖;聚右旋糖;淀粉,包括预胶化淀粉;明胶;改性纤维素,包括甲基纤维素,羧甲纤维素钠,羟丙甲基纤维素(HPMC或羟丙甲纤维素),羟丙基纤维素,羟乙基纤维素和乙基纤维素;糊精,包括麦芽糊精;玉米蛋白;藻酸和藻酸的盐,例如藻酸钠;硅酸铝镁;膨润土;聚乙二醇(PEG);聚氧化乙烯;瓜尔胶;多糖酸;聚乙烯吡咯烷酮(聚维酮),例如聚维酮K-15、K-30和K-29/32;聚丙烯酸(卡波姆(carbomer));聚甲基丙烯酸酯;等。在不同的方面中,一种更多种粘合剂和/或粘结剂(如果存在)总计构成组合物的重量的约0.5%至约25%,例如约0.75%至约15%,或约1%至约10%。
缓冲剂
在不同的方面中,所述化合物的含水药物组合物制剂包含缓冲剂。缓冲剂的实例包括乙酸盐(例如,乙酸钠),琥珀酸盐(如琥珀酸钠),葡萄酸盐,组氨酸,柠檬酸盐和其他有机酸缓冲剂。缓冲液浓度可以为约1mM至约200mM,或约10mM至约60mM,这取决于例如缓冲剂和所需的制剂的等渗压性。在不同的方面中,所述化合物的含水药物组合物制剂被制备在pH缓冲溶液中,例如,在约4.5至约8.0,或约4.8至约6.5,或约4.8至约5.5,或备选地约5.0的pH。
崩解剂
在不同的方面中,药物组合物制剂包含崩解剂。
合适的崩解剂包括,单独地或组合地,淀粉,包括预胶化淀粉和羟基乙酸淀粉钠;粘土;硅酸铝镁;基于纤维素的崩解剂如粉状的纤维素,微晶纤维素,甲基纤维素,低取代羟丙基纤维素,羧甲纤维素,羧甲纤维素钙,羧甲纤维素钠和交联羧甲纤维素钠;藻酸盐;聚维酮;交聚维酮;波拉克林(polacrilin)钾;树胶如琼脂,瓜尔胶,槐豆树胶,刺梧桐树胶,果胶和黄蓍胶;胶体二氧化硅;等。一种或多种崩解剂,如果存在,典型地总计构成组合物重量的约0.2%至约30%,例如约0.2%至约10%,或约0.2%至约5%。
湿润剂
在不同的方面中,药物组合物制剂包括湿润剂。湿润剂(如果存在)通常被选择用来保持化合物与水紧密缔合,这是一种被认为可以提高组合物的生物利用度的状态。可以用作湿润剂的表面活性剂的非限制性实例包括,单独地或组合地,季铵化合物,例如苯扎氯铵,苄索氯铵和氯化十六烷吡啶;磺基琥珀酸二辛酯钠;聚氧乙烯烷基苯基醚,例如壬苯聚醇9,壬苯聚醇10和辛苯昔醇9;泊洛沙姆(聚氧乙烯和聚氧丙烯嵌段共聚物);聚氧乙烯脂肪酸甘油酯和油,例如聚氧乙烯(8)辛酸/癸酸甘油单酯和甘油二酯,聚氧乙烯(35)蓖麻油和聚氧乙烯(40)氢化蓖麻油;聚氧乙烯烷基醚,例如ceteth-10,laureth-4,laureth-23,oleth-2,oleth-10,oleth-20,steareth-2,steareth-10,steareth-20,steareth-100和聚氧乙烯(20)十六十八醇醚;聚氧乙烯脂肪酸酯,例如聚氧乙烯(20)硬脂酸酯,聚氧乙烯(40)硬脂酸酯和聚氧乙烯(100)硬脂酸酯;脱水山梨醇酯;聚氧乙烯脱水山梨醇酯,例如聚山梨醇酯20和聚山梨醇酯80;丙二醇脂肪酸酯,例如丙二醇月桂酸酯;十二烷基硫酸钠;脂肪酸及其盐,例如油酸,油酸钠和油酸三乙醇胺;甘油脂肪酸酯,例如甘油单油酸酯,甘油单硬脂酸酯和甘油棕榈酰硬脂酸酯;脱水山梨醇酯,例如脱水山梨醇单月桂酸酯,脱水山梨醇单油酸酯,脱水山梨醇单棕榈酸酯和脱水山梨醇单硬脂酸酯;泰洛沙泊;等。一种或多种湿润剂,如果存在,典型地总计构成组合物重量的约0.25%至约15%,优选地约0.4%至约10%,并且更优选地约0.5%至约5%。
润滑剂
在不同的方面中,药物组合物制剂包含润滑剂。润滑剂在片剂制剂的压缩过程中减小压片混合物和压片设备之间的摩擦。合适的润滑剂包括,单独地或组合地,山嵛酸甘油酯;硬脂酸及其盐,包括硬脂酸镁,硬脂酸钙和硬脂酸钠;氢化植物油;棕榈酰硬脂酸甘油酯;滑石;蜡;苯甲酸钠;乙酸钠;富马酸钠;硬脂酰富马酸钠;PEG(例如,PEG 4000和PEG 6000);泊洛沙姆;聚乙烯醇;油酸钠;十二烷基硫酸钠;十二烷基硫酸镁;等。一种或多种润滑剂,如果存在,典型地总计构成组合物重量的约0.05%至约10%,例如约0.1%至约8%,或约0.2%至约5%。硬脂酸镁是尤其有用的润滑剂。
防粘剂(anti-adherent)
在不同的方面中,药物组合物制剂包含防粘剂。防粘剂减少片剂制剂与设备表面的粘附。合适的防粘剂包括,单独地或组合地,滑石,胶体二氧化硅,淀粉,DL-亮氨酸,十二烷基硫酸钠和金属硬脂酸盐。一种或多种防粘剂,如果存在,典型地总计构成组合物重量的约0.1%至约10%,例如约0.1%至约5%,或约0.1%至约2%。
助流剂
在不同的方面中,药物组合物制剂包含助流剂。助流剂改善流动性质并且减小压片混合物中的静态。合适的助流剂包括,单独地或组合地,胶体二氧化硅,淀粉,粉末状的纤维素,十二烷基硫酸钠,三硅酸镁和金属硬脂酸盐。一种或多种助流剂,如果存在,典型地总计构成组合物重量的约0.1%至约10%,例如约0.1%至约5%,或约0.1%至约2%。
张度剂(tonicity agent)
在不同的方面中,药物组合物制剂包含张度剂。张度剂可以被包含在制剂中用于稳定化。示例的张度剂包括多元醇,如甘露醇,蔗糖或海藻糖。优选地,含水制剂是等张的,虽然也考虑高张或低张溶液。多元醇在制剂中的示例浓度范围可以为约1%至约15%w/v。
表面活性剂
在不同的方面中,药物组合物制剂包含表面活性剂。表面活性剂也可以被添加以减少化合物的聚集和/或最小化制剂中颗粒的形成和/或减少吸附。示例的表面活性剂包括非离子表面活性剂如聚山梨醇酯(例如,聚山梨醇酯20或聚山梨醇酯80)或泊洛沙姆(例如,泊洛沙姆188)。表面活性剂的示例浓度范围可以为约0.001%至约0.5%,或约0.005%至约0.2%,或备选地约0.004%至约0.01%w/v。
防腐剂
在不同的方面中,药物组合物制剂基本上不含一种或多种防腐剂,如苄醇,苯酚,间甲酚,氯代丁醇和苄乙氧胺(benzethonium)。在其他方面中,防腐剂包含在制剂中,例如,以范围为约0.1%至约2%、或备选地约0.5%至约1%的浓度。
持续释放制剂
还提供持续释放药物组合物制剂。持续释放制剂的合适的实例包括含有抗体的固体疏水聚合物的半透性基质,所述基质是以成型制品的形式,包括但不限于薄膜或微胶囊。持续释放基质的实例包括聚酯,水凝胶(例如,聚(2-羟基乙基-甲基丙烯酸酯),或聚(乙烯醇)),聚交酯(美国专利号3,773,919),L-谷氨酸和乙基-L-谷氨酸酯的共聚物,不可降解的乙烯-醋酸乙烯酯,可降解的乳酸-乙醇酸共聚物如Lupron DepotTM(可注射微球,由乳酸-乙醇酸共聚物和乙酸亮丙瑞林组成),和聚-D-(-)-3-羟基丁酸。尽管聚合物如乙烯-醋酸乙烯酯和乳酸-乙醇酸能够使得分子的释放持续超过100天,但某些水凝胶释放蛋白质的时间较短。
活性成分也可以被捕获在制备的微胶囊中,例如,通过凝聚技术或通过界面聚合,例如,羟甲基纤维素或明胶-微胶囊和聚-(甲基丙烯酸甲酯)微胶囊,分别地,在胶状药物递送系统(例如,脂质体,清蛋白微球,微乳液,纳米颗粒和纳米胶囊)中或在粗乳状液(macroemulsion)中。这样的技术公开在雷明顿药物科学,第16版,Osol,A.Ed.(1980)中。
冻干制剂
还提供在冻干制剂中的药物组合物。所得的“冻干饼(lyophilized cake)”在使用前被重构。冻干饼的重构增加水溶液的体积,典型地相当于在冻干期间去除的体积。
剂量
要施用的化合物的量以及其他施用参数如治疗的频率和持续时间,取决于打算使用的化合物或前药,以及其他因素如施用途径,剂量间隔时间,排泄速率,化合物的制剂,受体,受体的被治疗的受试者的年龄、体重、性别、饮食、医疗史和总体状态(例如,健康),疾病的严重程度,和/或要治疗的肿瘤的尺寸,恶性和侵入性。因此,以足以实现所需治疗或预防效果的剂量施用化合物,并且逐例地确定。
在一些实施方案中,化合物以以下剂量施用:约1.0μg/kg至约100mg/kg,约0.01mg/kg至约100mg/kg,约0.01mg/kg至约50mg/kg,约0.01mg/kg至约30mg/kg,约0.01mg/kg至约10mg/kg,约0.01mg/kg至约5mg/kg,约0.05mg/kg至约10mg/kg,约0.1mg/kg至约200mg/kg,约0.1mg/kg至约50mg/kg,约0.1mg/kg至约10mg/kg,约0.5mg/kg至约25mg/kg,约1mg/kg至约10mg/kg,或约2mg/kg至约10mg/kg。
在方案中考虑这样的施用,所述施用是每天一次的;每天两次、三次或四次的;隔天的;每三天一次的;或每周2次、3次、4次、5次或6次的;每周一次的;每月两次的;每月一次的或或多或少不同频率的(如果需要),这取决于治疗的反应或状态和受体耐受性。考虑在较长的时间如4周、5周、6周、7周、8周、10周或12周或更长时间保持剂量,并且如果需要可以调整剂量。治疗的进展通过常规技术和测定监测,并且属于现有技术。
提供以下实施例仅为了举例说明本发明而绝不是为了限制其范围。
实施例
实施例1
为了研究ATR-101在肾上腺皮质癌(ACC)的小鼠模型中的潜在疗效,建立在SCID小鼠(6-7周雄性)中的来源于人ACC的细胞系H295R的异种移植物。在异种移植物生长至可测量尺寸后,将小鼠随机分成两组。给治疗组通过灌胃施用300mg/kg/天ATR-101。给对照组施用不含ATR-101的赋形剂。在开始施用ATR-101前以及在开始施用ATR-101后指定的天数使用测径器测量肿瘤尺寸。
治疗组中的四只小鼠和对照组中的两只小鼠在将小鼠转移至生物危害性试剂封隔设施并且启动施用的2天内死亡。这些死亡的原因是未知的,但是与ATR-101治疗无关。这些小鼠被从分析中排除。
治疗组中的一只小鼠和对照组中的两只小鼠在开始治疗后六天死亡。在开始ATR-101施用后8天,治疗组中存活的小鼠的肿瘤尺寸减小50%(n=3,相对标准差32%)(图1,实线)。同时,在同一时间期对照组中小鼠的肿瘤的尺寸增加400%(n=4,相对标准差160%)(图1,虚线)。肿瘤测量的可重现性通过在开始施用前2天和1天并且再次在开始施用后6天和8天的相继测量所确证。治疗组中小鼠的体况评分(BCS)(3.0)也高于对照组中小鼠的体况评分(2.0)。
在首周的ATR-101施用(图1)后,与开始施用赋形剂以及与开始施用ATR-101同时发生的小鼠的大比例死亡,使得我们将ATR-101的制剂由在10%DMSO,0.9%NaCl,0.5%CMC pH3.9,0.2%Tween-20中(制剂I)改变为在0.5%CMC pH 1.9,0.2%Tween-20中(制剂II)。治疗组中小鼠的肿瘤在制剂变化的两天内继续生长,但是在开始ATR-101施用后15天,该组中的肿瘤的尺寸显著小于对照组中小鼠的肿瘤(p<0.05)。
将ATR-101施用于具有来源于ACC的细胞系异种移植物的小鼠快速地并且可重现地导致在具有小于300mm3的肿瘤的所有小鼠中异种移植物退化至小于在开始ATR-101施用前其尺寸的一半。在具有300mm3和900mm3的肿瘤的两只小鼠中,ATR-101施用不阻止肿瘤生长并且小鼠很快变得濒死。H295R细胞异种移植物的退化在之前的使用其他试剂(包括米托坦以及目前在临床试验中的药物)的研究中未被报道(Barlaskar,F.M.,等,J.Clin.Endocrinol.Metab.,94(1):204-12,2009;Luconi,M.,等,Endocr.Relat.Cancer,17(1):169-77,2010)。这些结果支持推进ATR-101至临床试验受试者以确定剂量-响应关系并且扩展毒理学研究以建立ATR-101的治疗窗。
在两种实验中,ATR-101的疗效都在开始ATR-101施用后6-8天最大。在两种实验中,肿瘤在开始ATR-101施用后7-9天继续生长并且在开始ATR-101施用后8-15天超过治疗前尺寸。在开始ATR-101施用后15天,被治疗的小鼠中的一些肿瘤达到与对照小鼠中的肿瘤相当的尺寸。小鼠的肿瘤生长继续和复发的原因是未知的。因为复发时程的重现性和快速扩大至治疗前的尺寸,所以复发不可能是由于肿瘤细胞中的遗传变化所致。
H295R细胞系是一种来源于ACC的细胞系,其通常被公认为保留了ACC肿瘤细胞的许多特性。在文献中已经报道了分离自患者的ACC肿瘤细胞的单个原发性异种移植物(Yamazaki,H.等,APMIS,106(7-12):1056-1060,1998)。该原发性异种移植物在植入的8天内显示生长。其中可获得原发性ACC肿瘤的病例的小数量使得使用原发性肿瘤细胞的研究是困难的。
实施例2
为了确定ATR-101对来源于ACC的细胞系异种移植物的作用是否具有可重现性,重复在SCID小鼠(10-11周雄性)中的使用相同H295R细胞系的异种移植物的实验。
治疗组中的一只小鼠具有由4周前植入的H295R细胞产生的大肿瘤。该小鼠在ATR-101施用后6天死亡并且不被包括在分析中。治疗组中剩余的小鼠(n=2)的肿瘤在开始ATR-101施用后六天减小至不可检测的尺寸(图2)。同时,对照组中小鼠(n=2)的肿瘤的尺寸不止增倍。治疗组中小鼠的肿瘤在开始ATR-101施用后八天内继续生长。在开始ATR-101施用后13天,被治疗的小鼠的肿瘤是对照小鼠中的肿瘤的尺寸的八分之一至三分之一。肿瘤生长的继续与转换到新批次的ATR-101同时发生。该批次使用相同的方案使用来自相同合成法的ATR-101制备,不同之处在于在开始ATR-101施用后六天,在施用第一剂量之前不对制剂进行温育过夜。
利用治疗组和对照组中小量的小鼠进行两个实验。对于在这些实验中使用小组的小鼠有若干原因。除了有限的资源/人力以外,仅部分的小鼠(23/25)经受住运输。而且,小鼠的一个亚群(16/23)发展出肿瘤,并且很多小鼠在转移至用于ATR-101施用的封隔设施后的头两天期间死亡,在开始治疗后给测量留下小的数量(10/16和5/7)。
对来自第一个实验的治疗和对照组的小鼠的肿瘤和器官的事后分析确认,治疗组中存活小鼠的肿瘤(平均0.71g,平均0.13g的标准差)显著(p<0.05)小于对照组中的小鼠的肿瘤(平均1.23g,平均0.28g的标准差)(图3)。治疗和对照组之间的肿瘤形态学没有可检测的差异。治疗组中小鼠的总体重(平均24g,平均1g的标准差)显著高于对照组中小鼠的总体重(平均19g,平均3g的标准差)。体重的该差异可以反映对照组中小鼠的更大肿瘤负荷。
实施例3
使用测径器测量作为在开始口服300mg/kg/天ATR-101(三角形)(相比于用赋形剂治疗的对照小鼠(圆圈))后的时间的函数的异种移植物尺寸(图4)。数据显示各组中的9只和10只小鼠的平均值和标准差。包括在治疗组中的一只小鼠被除去,因为异种移植物的腹部位置阻止对其尺寸的准确测量。在研究的治疗和对照臂之间随机化20只小鼠。在每只小鼠中通过皮下注射100,000,000个H295R细胞产生异种移植物。
实施例4
使用测径器测量作为开始口服300mg/kg/天ATR-101+300mg/kg/天二甲双胍(球体)(相比于用赋形剂治疗的对照小鼠(圆圈))后的时间的函数的异种移植物尺寸(图5)。数据显示各组中3只和10只小鼠的平均值和标准差。两组小鼠被一起注射和饲养,但是不被随机化为相同组的小鼠的一部分。在每只小鼠中通过皮下注射100,000,000个H295R细胞产生异种移植物。
实施例5
使用测径器测量作为开始口服300mg/kg/天PD132301-02+4mg/kg/天依维莫司(方块)(相比于用赋形剂治疗的对照小鼠(圆环))后的时间的函数的异种移植物尺寸(图6)。数据显示各组中3只和10只小鼠的平均值和标准差。两组小鼠被一起注射和饲养,但是不被随机化为相同组的小鼠的一部分。在每只小鼠中通过皮下注射100,000,000个H295R细胞产生异种移植物。
实施例6
为了研究ATR-101在ACC的小鼠模型中建立ACC异种移植物中的潜在治疗益处,将来源于ACC的细胞系H295R注射到SCID小鼠(6-7周雄性)中。在SCID小鼠的右背部侧面区域中在皮下注射在0.2ml DMEM中的1x 108个细胞。注射后两周,将小鼠随机化为10只的组。将ATR-101以700mg/kg/天施用4天,之后是通过灌胃的300mg/kg/天,在10%DMSO,0.5%CMC,0.9%NaCl,0.2%Tween,pH 3中。给对照小鼠施用赋形剂。使用测径器测量肿瘤尺寸,每周三次。在开始ATR-101或赋形剂施用后的不同时间点测量尿皮质醇。
在用赋形剂处理的10只小鼠中,7只在注射后的50天内发展出了明显的异种移植物。到注射后的100天,对小鼠中的五只进行安乐死,因为濒死并且具有大于2,000mm3的异种移植物。在用ATR-101治疗的10只小鼠中,2只发展出了明显的异种移植物并且直至异种移植物形成的中值时间比赋形剂治疗组的两倍更长。在注射后100天,所有小鼠都存活,并且2个异种移植物未生长至500mm3(图7)。与ATR-101相比,用赋形剂治疗的小鼠的体重没有明显差别。因此,ATR-101治疗抑制异种移植物建立,减小异种移植物生长速率,并且延长被注射有来源于ACC的细胞的SCID小鼠的存活。
所有肾上腺皮质癌中的约60%都显示激素过量的病征,最常见的是皮质醇(Peppa等,Cases J.2:8951,2009)。在一些情况下,库欣综合征可以由产生过量皮质醇的ACC导致。最初的H295细胞系分离自产生过量皮质醇的ACC(Gazdar等,Cancer Res.50:5488-5496,1990)。H295R细胞系继续表现出皮质醇产生(Samandari等,J.Endocrinol.195:459-472,2007)。在细胞注射后22天(开始ATR-101或赋形剂施用后8天)开始测量尿皮质醇水平若干次(图8)。用赋形剂治疗的小鼠中的尿皮质醇水平关于其异种移植物的尺寸而变化。用ATR-101治疗的小鼠的平均尿皮质醇水平低于被施用有赋形剂的小鼠的平均尿皮质醇水平。因此,ATR-101治疗降低由异种移植到SCID小鼠中的H295R细胞产生的皮质醇的水平。
实施例7
还研究了在SCID小鼠中高剂量的ATR-101对来源于ACC的异种移植物的作用。如之前所述制备异种移植物,其中在ATR-101治疗组中有3只小鼠,并且在对照组中有3只小鼠。如图9中所示,使用测径器测量作为开始口服1,000mg/kg/天ATR-101(正方形)(相比于用赋形剂治疗的对照小鼠(菱形))后的时间的函数的异种移植物尺寸。与赋形剂治疗的对照相比,高剂量(1,000mg/kg/天)的ATR-101施用显著减小肿瘤生长。如图10中所示,在1,000mg/kg/天ATR-101治疗小鼠(相比于赋形剂治疗的对照小鼠)中测量异种移植物重量。
实施例8
ATR-101细胞毒性的机制通过测量其对在正常和胆固醇缺失条件下生长的来源于ACC的H295R细胞的ATP水平和还原活性的作用来研究。
为了测量H295R细胞的ATP水平和还原潜能,将这些细胞培养在96孔平底细胞培养板(BD Biosciences)中,以在100μl中50,000个细胞铺板。将细胞铺板在没有葡萄糖的DMEM培养基(GIBCO 11966)+10mM半乳糖+5mM钠-HEPES+2mM谷氨酰胺(添加)+1mM丙酮酸钠+100U/ml青霉素/链霉素+0%或5%胎牛血清中。在过夜(16-20h)温育后,将20μl的含有5%胎牛血清的培养基以及产生终浓度所需的ATR-101的等分试样添加到细胞。为了测量ATP水平,在指定的时间添加100μl的(Promega Corp.,Madison,WI)试剂以溶解细胞,并且测量荧光素发光以确定溶胞产物中ATP的量。为了测量还原活性,在ATR-101后立即向细胞加入细胞存活力试剂(Life Technologies Corp.)。在37℃,在CO2下温育细胞,并且在指定的时间测量试卤灵荧光。
向H295R细胞中添加ATR-101以依赖时间和浓度的方式减小依赖ATP的荧光素酶测定的发光信号(图11A)。16μM ATR-101在4小时中具有半最大作用。在相同的时间,64μM ATR-101使发光信号减小约90%。这些结果表明ATR-101导致H295R细胞中的ATP的快速耗尽。
细胞还原活性通过使用细胞存活力试剂(Invitrogen)测量刃天青减少来确定。添加多至8μM的ATR-101到H295R细胞中以依赖时间和浓度的方式增加荧光信号,而更高的ATR-101浓度减少荧光(图11B)。不同浓度的ATR-101对刃天青还原活性的不同效果表明ATR-101对细胞具有多重作用。低至中等浓度的ATR-101增加还原活性,但是对ATP水平几乎没有效果。高浓度的ATR-101降低还原活性和ATP水平两者,推测是由于细胞活力的减弱。
为了研究ATR-101杀死培养物中的细胞的机制,研究胆固醇缺失对在ATR-101存在下培养的H295R细胞的ATP水平的作用。将细胞在甲基-β-环糊精(MβCD)存在下培养,甲基-β-环糊精可以螯合胆固醇并且由此使细胞中的游离胆固醇缺失。在2mM MβCD存在下的培养不显著改变H295R细胞中的ATP水平(图12B)。显著地,在MβCD存在下培养的细胞的ATP水平不受多至32μM的ATR-101的影响。MβCD使ATP水平的半最大缺失所需的ATR-101的浓度增加超过4倍。
为了确定MβCD对ATR-101细胞毒性的作用是否是由于胆固醇缺失所致,在与胆固醇复合的相等量的MβCD存在下培养H295R细胞(图12C)。对这些细胞的平行分析证明,与胆固醇复合的MβCD单独减小H295R细胞的ATP水平。利用ATR-101处理细胞导致细胞中ATP水平的进一步下降。因此,通过在MβCD存在下培养使H295R细胞免受ATR-101的细胞毒性是由于这些细胞中的胆固醇缺失所致。
为了确定在MβCD存在下培养H295R细胞是否改变ATR-101进入细胞中,检查MβCD对ATR-101诱发的还原活性的变化的作用(图12D-F)。在单独的MβCD存在下培养对细胞的还原活性几乎没有作用(图12E)。MβCD不抑制由ATR-101导致的刃天青还原活性的增加。相反地,在MβCD存在下培养的细胞表现出响应于ATR-101的还原活性的更大增加,可能地是由MβCD抑制ATR-101细胞毒性所致。在与胆固醇复合的MβCD存在下培养的细胞在不存在和存在ATR-101的情况下都表现出较低的还原活性。还原活性的下降可能与由与胆固醇复合的MβCD导致的ATP水平的下降相关。
这些结果表明,ATP水平的下降与细胞的还原活性的改变不直接相关,并且ATR-101细胞毒性的机制不仅仅由呼吸的抑制决定,即使已知在分离的线粒体中ATR-101抑制电子传递链的复合体II。结合起来,这些结果证明MβCD不阻止ATR-101进入到H295R细胞中,并且MβCD对ATR-101细胞毒性的防护可能是由于细胞中游离胆固醇的螯合所致。
实施例9
在试验前以及在以不同剂量(0mg/kg/天,0.3mg/kg/天,3mg/kg/天,和30mg/kg/天)的ATR-101治疗期间的1、7、14和28天,在狗中测量基础和促肾上腺皮质激素(ACTH)刺激的皮质醇水平。研究6只狗/性别/剂量组。在28天的治疗后,对4只狗/性别/组进行安乐死,同时2只狗/性别/组/具有4周的无药物恢复期然后进行安乐死。在ACTH刺激前以及在ACTH刺激后0.5和1小时测定公狗和母狗中的血浆皮质醇浓度(ng/ml)。从治疗的第7天开始,显著的与药物相关的ACTH响应的下降在以3mg/kg/天和30mg/kg/天的ATR-101治疗的公狗和母狗中发生,继续至治疗的第14天和第28天(图13和14)。在恢复期期间的第42天和第56天,观察到皮质醇抑制作用的逆转(图13和14)。
实施例10
来自用高剂量300mg/kg/天的ATR-101治疗达28天的狗和对照动物的左和右肾上腺在尸体解剖时收集并且固定在10%中性缓冲的福尔马林中,通过常规石蜡技术处理,纵向切片并且利用用于常规光学显微术的苏木精和曙红染色(图15A-E)。在第28天在用ATR-101治疗的狗的肾上腺中观察到显著的作用,包括纤维化(松弛沉积(deposition)从而压缩皮髓交界处内的维管组织),空泡形成(在皮质的束状带和网状带内的胞质内的小至中等尺寸的清晰的空泡),和皮质萎缩(由于包括束状带和网状带的细胞的细胞尺寸和数量减小所致的肾上腺皮质厚度的减小)(图15D,15E)。
实施例11
来自用不同剂量的ATR-101(0mg/kg/天,0.3mg/kg/天,3mg/kg/天,或30mg/kg/天)治疗达28天的公狗和母狗的左和右肾上腺在尸体解剖时收集并且称重。在两种性别中都发生了剂量相关的肾上腺重量的变化(图16A和17A)。在两个性别中,以>3mg/kg/天,绝对和相对(肾上腺相对于身体(肾上腺:体重(%))和肾上腺相对于脑(肾上腺:脑重量)重量比)肾上腺重量下降14%至55%(图16A-C和17A-C)。在4周恢复期后,肾上腺重量仍然下降6%至11%(在雄性中,以3mg/kg/天)并且减少10%至32%(在两种性别中,以30mg/kg/天)。在两种性别中,以>3mg/kg/天,肾上腺重量变化与包括肾上腺皮质萎缩、纤维化和空泡形成在内的组织学变化相关联,如实施例10中所述的(图15A-E)。肾上腺的组织学变化在恢复期后持续。
实施例12
检查ATR-101在3只大鼠和3只狗中的组织分布。测量在血浆、红血球、肾上腺、肝、肾、骨骼肌、卵巢、皮下脂肪和脑脊液中的ATR-101浓度。图18显示ATR-101在施用100mg/kg/天达7天的雌性大鼠中的组织分布(ng/mL或ng/g)。大鼠中的ATR-101浓度在肾上腺(~2X)和卵巢中(~1.4X)比在血浆中更高。图19显示ATR-101在施用3mg/kg/天达7天的母狗中的组织分布(ng/mL或ng/g)。狗中的ATR-101浓度在肾上腺和在血浆中类似。大鼠和狗的肾上腺中的ATR-101浓度与这些物种对肾上腺毒性的相对敏感度不对应,表明单独的组织积累不能解释作用的抗肾上腺素机制。图20显示在大鼠和狗中的作为血浆浓度的百分比的ATR-101的组织分布。在任一物种中ATR-101看起来都不穿过血脑屏障。在大鼠的脑脊液(CSF)中观察到的低水平的ATR-101可能是由于血液污染CSF所致。
本文引用的所有文献(包括出版物,专利申请和专利)通过引用结合于此,其程度与各个文献被单独地且明确地指示为通过引用结合并且被完整地陈述于本文中一样。
在描述本发明的语境中(尤其是在所附权利要求的语境中),使用术语“一个”和“一种”和“该”以及类似的指称对象是被视为覆盖单数和复数两者,除非在本文中另外地指出或与语境明显矛盾。除非另外指出,术语“包含”、“具有”、“包括”和“含有”被视为是开放性术语(即,表示“包括,但不限于”)。
除非本文中另外指出,本文中列举数值范围仅是意在用作单独地提及落在所述范围内的各个单独的值和每个端点的速记法,并且每个单独的值和端点与其被单独地在结合到说明书中,如同其在本文中被个别地体积一样。
除非本文中另外指出或与语境明显矛盾,本文所描述的所有方法可以任何合适的次序进行。使用本文提供的任何和所有实例或示例性语言(例如,“如”)仅意在更好地举例说明本发明,并且除非另外要求,不对本发明的范围加以限制。说明书中的任何语言都不应当被视为指示任何未要求的要素作为对实施本发明是必要的。
感谢Veronica Burns和Yunhui Cheng因其在Tom Kerppola的直接监管下的在H295R细胞和异种移植物方面的实验工作。
本文描述了本发明的所有实施方案,包括发明人已知的用于实施本发明的最佳方式。在阅读前述描述后,那些优选的实施方案的变形对本领域技术人员可以变得明显。本发明的发明人预期当适当时技术人员采用这样的变形,并且本发明的发明人预计本发明与如在本文中具体描述的不同其他方式实施。因此,在适用的法律允许时,本发明包括所附权利要求中列出的主题的所有改变和等同替换物。此外,除非本文中另外指出或与语境明显矛盾,本发明涵盖在其所有可能的变形中的上述要素的任何组合。
- 还没有人留言评论。精彩留言会获得点赞!