脐带间充质干细胞联合黄芪多糖在制备治疗高血糖和糖尿病肾病药物中的应用的制作方法
本发明涉及高血糖和糖尿病肾病药物领域,具体而言,涉及脐带间充质干细胞联合黄芪多糖在制备治疗高血糖和糖尿病肾病药物中的应用。
背景技术:
根据世界卫生组织(WHO)预计,到2030年,糖尿病患者将从2010年的两亿八千五百万人增至四亿三千九百万。糖尿病也是对我国人群健康危害最为严重的疾病之一,糖尿病的各种急慢性并发症是导致糖尿病患者死亡的主要原因。糖尿病肾病是糖尿病患者最主要的微血管病变并发症之一,也是引起终末期肾功能衰竭的主要原因,如何有效防止和治疗糖尿病肾病仍然是糖尿病研究所面临的重要课题之一。
糖尿病肾病的病理生理学特征:微量蛋白尿是糖尿病肾病肾脏损伤的最早的临床表现,其形成主要与肾脏在组织学改变,如细胞外基质沉积、肾小球基底膜增厚以及肾小球系膜扩张有关。糖尿病肾病病程后期将出现大量蛋白尿,肾小球滤过率将进行性降低,肾脏组织学改变包括肾小球硬化、肾小管间隙纤维化以及动脉透明样变性。
目前糖尿病肾病的治疗方法有很多,包括控制血糖、血压和减少蛋白尿等。终末期患者可行肾脏替代治疗,包括血液透析和肾脏移植,而肾脏移植只有在同时进行胰岛B细胞移植的情况下才有效,否则肾衰竭将再次出现。血液透析对患者的生活质量有较大的影响,肾脏移植是现今治疗终末期肾脏疾病最有效的手段。然而肾源的短缺大大限制了肾移植的推广。肾脏是一种终末分化的器官,其再生潜能远远低于人体其他器官。肾脏功能并非由单个细胞执行,而是由不同功能的细胞组成一个单位来行使功能,这也使得肾脏的再生十分困难。
间充质干细胞(Mesenchymal stem cells,MSCs)也称为多潜能间充质基质细胞,它为一种非造血成体干细胞,组织分布广,具有自我更新和分化能力。MSCs首先从骨髓中分离得到,随后从其他组织和器官也能获得,这些组织和器官包括毛囊、牙齿根、脑骨膜、软骨膜、真皮、脐血、脐带、胎盘、脂肪肌肉、肺、肝和脾脏。多项研究已经表明,体外培养的MSCs特异性表达造血细胞不表达的113种转录产物和17种蛋白。根据国际细胞治疗协会(ISCT)下属间充质和组织干细胞委员会所提出的定义人MSCs最低标准:a)在标准培养条件下,MSCs必须具有对塑料底物的黏附性;b)CD105、CD73、CD90呈阳性,CD45、CD34、CD14或CD11b、CD79a或CD19和HLA-DR呈阴性;c)在体外标准分化条件下,MSCs能分化为成骨细胞、脂肪细胞和软骨细胞。
间充质干细胞在各学科有很多探索性研究,近期也有基础研究证实肾脏细胞有再生潜能,干细胞治疗肾损伤,包括糖尿病肾病均有一些探索性研究。近来,脐带间充质干细胞(umbilical cord-derived mesenchymal stem cells,UCMSCs)越来越受到研究者的重视。脐带间充质干细胞具有自我更新和分化成不同细胞的能力。脐带间充质干细胞来源于脐带。脐带是胎儿分娩后的废弃物,来源广泛,不存在伦理学问题。另外,由于胎血屏障的存在,脐带受病毒污染的几率明显降低且取材过程无痛苦。更重要的是,脐带间充质干细胞连续多次传代仍可保持干细胞特性,易于长期培养并可冻存,增殖能力高,且安全有效。人脐带间充质干细胞可以在小鼠体内存在相当长的一段时间,单次注射不引起宿主的免疫反应。利用脐带间充质干细胞分化成特定功能性细胞的特性进行移植,可以替代体内不可逆丧失功能细胞,从而在一些目前尚无有效治疗手段的疾病如肿瘤、糖尿病、血液病、心肌坏死、帕金森氏病、脊髓损伤等的治疗方面,具有广阔的临床应用前景。应用干细胞技术治疗实验性糖尿病肾病已经在实验动物取得了较大的进展,并有可能成为未来治疗糖尿病的有效方法之一。
黄芪作为传统中药材,具有扶正补气之功效。现代药学研究表明,黄芪含有多种活性成分,包括黄芪多糖,黄芪皂苷,黄芪黄酮类成分等。黄芪药用历史悠久,古有“补药之长”之称,为历代中医最常用的中药之一。黄芪多糖(APS)是中药黄芪中主要生物大分子成分,其结构与活性研究较为广泛。具有降低血糖、增加对胰岛素的敏感性、改善胰岛素抵抗、抑制胰岛细胞凋亡作用,此外还具有提高免疫、抗氧化、抗肿瘤活性、抗衰老等生物活性。有研究表明黄芪多糖可降低糖尿病大鼠血糖及胰岛素水平,也可降低血清IL-1β、IL-6,从而改善胰岛素抵抗。近年来研究认为APS可能通过改善大鼠血糖、血脂代谢,降低TGF-1mRNA的表达,进而阻滞DN的发生和发展。张建军等就黄芪注射液对糖尿病肾病患者肾脏状态及纤维化指标的影响进行观察.发现其较未采用黄芪注射液治疗的患者表现出更佳地改善肾脏功能指标和血清纤维化指标的效果,从而较为全面地肯定了其在肾脏病变改善中的效果。而这些均与黄芪注射液有效改善了肾脏功能状态有关。另外其有效抑制肾脏的纤维化也有极为突出的功效,而这些均对糖尿病肾病具有针对性且全面的改善作用。
有鉴于此,特提出本发明。
技术实现要素:
本发明的第一目的在于提供一种脐带间充质干细胞联合黄芪多糖在制备治疗高血糖和糖尿病肾病药物中的应用。本发明中,通过将具有分化能力、且具有治疗糖尿病潜力的脐带间充质干细胞与具有降糖和改善肾脏状态并由于糖尿病引起的肾脏疾病有着抑制效果的黄芪多糖联用以制备用于治疗高血糖和糖尿病肾病的药物,从而可以有效控制血糖水平,并改善肾脏功能。
为了实现本发明的上述目的,特采用以下技术方案:
脐带间充质干细胞联合黄芪多糖在制备治疗高血糖和糖尿病肾病药物中的应用。
本发明中,通过将间充质干细胞与黄芪多糖联用,从而可以利用间充质干细胞的分化能力从而对损伤细胞进行补充;同时本发明中,通过使用黄芪多糖也能够进一步有效控制血糖水平,同时还能够对肾脏起到一定的保护作用,有效改善肾脏功能。
本发明中,所述脐带间充质干细胞为人脐带间充质干细胞。
可选的,本发明中,所述应用还进一步包括培养脐带间充质干细胞,然后再将培养得到的脐带间充质干细胞与黄芪多糖联合应用的步骤。
可选的,本发明中,所述培养为将脐带间充质干细胞原代,或者冻存脐带间充质干细胞复苏后,在培养基中进行培养,然后再进行传代培养。
可选的,本发明中,所述培养基为含有FBS、青霉素以及链霉素的DMEM/F12培养基。
可选的,本发明中,所述FBS的含量为10%,青霉素和链霉素的浓度为100U/ml。
可选的,本发明中,所述传代培养是在5%CO2的培养箱中进行的。
可选的,本发明中,所述传代培养的温度为35~38℃;优选的,本发明中,所述传代培养的温度为36~37℃。
可选的,本发明中,所述应用还进一步包括将传代培养得到的脐带间充质干细胞消化后,得到稳定增殖细胞,并检测,然后再与黄芪多糖联合应用的步骤。
可选的,本发明中,所述消化为采用胰蛋白酶进行消化。
可选的,本发明中,所述胰蛋白酶的浓度为0.20%~0.25%;优选的,本发明中,所述胰蛋白酶的浓度为0.24%~0.25%。
与现有技术相比,本发明的有益效果为:
本发明中,通过将具有分化能力、且具有治疗糖尿病潜力的脐带间充质干细胞与具有降糖和改善肾脏状态并由于糖尿病引起的肾脏疾病有着抑制效果的黄芪多糖联用以制备用于治疗高血糖和糖尿病肾病的药物,从而可以有效控制血糖水平,并改善肾脏功能。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,以下将对实施例或现有技术描述中所需要使用的附图作简单地介绍。
图1为不同阶段的人间充质干细胞在显微镜下的细胞形态以及染色情况,其中A为未经诱导分化处理的人间充质干细胞在10×显微镜下观察到的细胞形态;B为经成脂诱导试剂诱导分化处理后人间充质干细胞在10×显微镜下观察到的细胞染色情况;C为经成骨诱导试剂诱导分化处理后人间充质干细胞在10×显微镜下观察到的细胞染色情况。
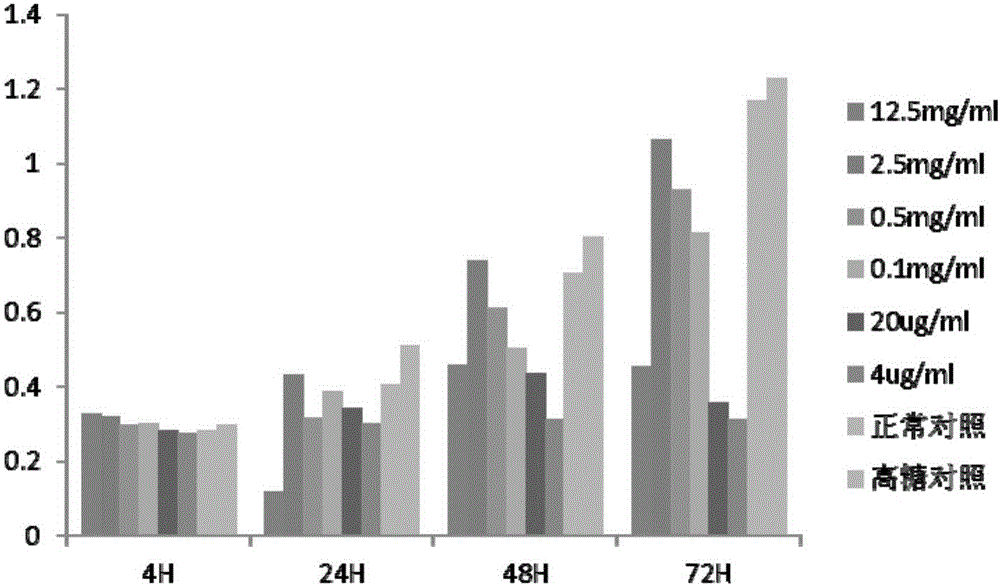
图2为人脐带间充质干细胞在不同浓度黄芪多糖条件下的增殖图。
图3为HMC不同浓度黄芪多糖条件下的增殖图。
图4为ELISA检测上清液FN、Ⅳ型胶原含量图。
图5不同实验组HE染色图;其中,A为正常对照组HE染色图;B为模型组HE染色图;C为APS治疗组HE染色图;D为MSC治疗组HE染色图;E为A+M治疗组HE染色图。
图6为不同实验组FN以及colIV检测图;其中,A为正常组FN检测图,B为正常组colIV检测图;C为模型组FN检测图,D为模型组colIV检测图;E为APS治疗组FN检测图,F为APS治疗组colIV检测图;G为MSC治疗组FN检测图,H为MSC治疗组colIV检测图;I为A+M治疗组FN检测图,J为A+M治疗组colIV检测图。
图7为不同实验组PAS染色图;其中,A为正常对照组PAS染色图;B为模型组PAS染色图;C为APS治疗组PAS染色图;D为MSC治疗组PAS染色图;E为A+M治疗组PAS染色图。
具体实施方式
下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限制本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
实施例1
将huMSCs(即人脐带间充质干细胞)经原代培养后置于含10%FBS、100U/ml青霉素和链霉素的DMEM/F12培养基中;然后,在37℃、5%CO2的培养箱中常规培养传代;将传代培养得到的细胞用0.25%胰蛋白酶消化,并收集稳定增殖细胞。
将106个收集得到的人脐带间充质干细胞悬浮在100ml含1%牛血清白蛋白的PBS缓冲溶液中,并用流式细胞术检测阳性抗体(CD90,CD105,CD73)和阴性抗体(CD45,CD34,CD11b,CD19和HLA-DR)表达情况。结果显示,实施例1培养得到的人脐带间充质干细胞符合干细胞标准。
实验例1
成脂及成骨分化的实验研究
干细胞具有自我复制及多项分化的潜能。到目前为止人们已经陆续从脐带,胎盘,骨髓,脂肪,皮肤,毛囊等组织提取分离出间充质干细胞。分离方法主要有种植法和酶消化法两种。不同的方法和实验程序对提取的干细胞的质量和纯度有很大差异。所以干细胞的分化实验是世界上普遍认可的干细胞鉴定标准。
具体检测方法如下:
a、取实施例1传代培养得到的人脐带间充质干细胞,常规培养,并每3d换一次培养液;取对数生长期的人脐带间充质干细胞,在约80%融合时加入成骨诱导液,并每3d全量换液一次,21d后进行茜素红染色鉴定骨节形成,显微镜下观察并拍照,见图1B;
b、取实施例1传代培养得到的人脐带间充质干细胞,常规培养,并每3d换一次培养液;取对数生长期的人脐带间充质干细胞,在约80%融合时加入脂肪诱导培养基,2周后油红O染色鉴定,显微镜下观察并拍照,见图1C;
图1A为阴性对照组,经对照检测可知,本发明人脐带间充质干细胞具有良好的成骨、成脂能力。
实验例2
黄芪多糖浓度的筛选
选取生长状态良好的huMSCs(人脐带间充质干细胞)和HMC分别以3×103个/孔接种于96孔板中,待细胞贴壁后,加入100μL终质量浓度为12.5,2.5,0.5,0.1,0.02,0.004mg/mL的APS(黄芪多糖),对照组不加APS(黄芪多糖),调零孔不含细胞,只加100μL培养液,每组平行做5个复孔,各组培养达4h,24h,48h,72h后各加10μLCCK8溶液,37℃孵育4h后,选择490nm波长测定各孔吸光度(OD)值。根据cck-8结果测出的有效浓度选取低、中、高3个最适浓度。测试结果如图2、图3所示。同时,由检测结果可知黄芪多糖能够有效促进huMSCs增殖,并不会对huMSCs产生抑制或者毒性作用。
经对照检测发现,APS浓度为2.5,0.5和0.1mg/mL为最适浓度。
实验例3
huMSCs与HMC(肾小球细胞)共培养体系的建立及ELISA检测上清液FN、Ⅳ型胶原含量
将HMC制成1xl06ml的细胞悬液接种于6孔培养板内,每孔2ml,待细胞贴附在6孔板并更换培养基后,用无菌镊子在6孔板中放入上层小室。
将实施例1中传代培养的人脐带间充质干细胞用0.25%胰蛋酶消化,制成人脐带间充质干细胞悬液,调整细胞浓度为1x106个/ml,接种到已预先在培养液中浸湿的套皿中,并置37℃、5%CO2培养箱中共培养,用无血清培养基饥饿细胞24h使其同步化,将培养后的人脐带间充质干细胞分为5组:空白对照组,人脐带间充质干细胞组,人脐带间充质干细胞联合低、中、高浓度黄芪多糖处理组。经以上处理48h后,收集各组细胞,同时收取细胞培养上清液于-20℃保存。
ELISA检测上清液FN、Ⅳ型胶原含量:提取各组上清液,在微孔反应板相应孔中分别加入待测样本、,再加生物素化抗体工作液50txl。振荡混匀,置20-25℃环境中温育120min。将孔内液体吸干,用洗涤液充分洗涤5次,干燥。除空白孔外,加入酶结合物工作液l00ul。振荡混匀,置20-25℃环境中温育30inin。将孔内液体吸干,洗涤液充分洗涤5次,干燥。每孔加入显色剂A、B各50ul,轻轻振荡混匀,37℃环境中避光显色l0min。加入终止液50ul后,轻轻振荡混匀。用酶标仪(450nm波长)测定各孔吸光度值,测试结果见图4。
由测试结果可知,在细胞水平上huMSCs能够对肾脏病变有改进作用。
实验例4
人脐带间充质干细胞联合黄芪多糖治疗实验
1)动物饲养
清洁级雄性Wistar大鼠60只,体重200~220g,由吉林大学实验动物中心提供。
所有大鼠同室分笼饲养,自然光照,自由进食进水,饲养温度18~25℃,相对湿度40~50%,避免高分贝噪声;确保通风良好,1h/次,3次/d;勤换垫料,2-3次/周。饲养一周适应试验环境后开始做实验。造模前禁食12h,不禁水。
2)糖尿病模型制备
大鼠适应性饲养7d后,禁食不禁水12h,单次腹腔注射STZ(50mg·kg-1)诱发糖尿病,对照组动物腹腔注射等体积0.1mol/L枸橼酸盐缓冲液。注射STZ 3d后用血糖测定仪检测血糖,用尿糖试纸检测尿糖。血糖≥16.7mmol·L-1,尿糖≥+++列入糖尿病动物。
3)动物随机分组并给药干预治疗观察
实验动物随机分五组,分别为对照组、模型组、APS治疗组、MSC治疗组、APS+MSC联合治疗组,每组各10只。
其中,对照组为正常大鼠;模型组的实验对象为实验步骤2)中糖尿病模型大鼠,并不予治疗;APS治疗组的实验对象为实验步骤2)中糖尿病模型大鼠,并予以APS治疗;MSC治疗组的实验对象为实验步骤2)中糖尿病模型大鼠,并予以人脐带间充质干细胞治疗;APS+MSC联合治疗组的实验对象为实验步骤2)中糖尿病模型大鼠,并予以人脐带间充质干细胞和黄芪多糖联合治疗;
每天分别给各组大鼠灌胃给药,给药剂量为APS:12.5g/kg、MSC:2×106个/只;每周一上午九点测各组大鼠血糖值;监测大鼠一般状况并收集标本固定、冻存。
4)葡萄糖耐量试验
于实验第6周末,将大鼠禁食6小时后,灌胃给予20%葡萄糖1ml·100g-1体重(相当2g·kg-1体重),用北京怡成科技公司提供的JPS-3+型血糖仪分别测定空腹(0min)及服糖后30、60及120min的血糖含量,结果如下表1所示:
表1各组动物不同时间点的血糖值(mmol·L-1)(x±s)
与正常组比较*P<0.05,**P<0.01;与模型组比较ΔP<0.05,ΔΔP<0.01
同时,按如下公式计算葡萄糖曲线下面积(AUC):AUC=(BG0+BG30)×0.5÷2+(BG30+BG60)×0.5÷2+(BG60+BG120)×1÷2。
由表1中结果可知,空白对照组大鼠具有正常糖调节能力。糖尿病组大鼠于给予葡萄糖后30~60min血糖一直处于高水平,到120min时血糖水平稍有下降,表明糖尿病大鼠的糖耐量明显降低,糖调节机能受损。在给药组,60和120min血糖浓度明显低于相应时间点的糖尿病组,特别是120min时,比糖尿病组血糖值显著降低,说明给药组糖调节机能受损减缓。
5)处死动物
将实验步骤4)中的大鼠处死,在处死前禁食12h,并收集24h尿液,测尿量,并冻存作后续检测;分别称量各组大鼠的体重,测血糖,并记录数据;摘眼球取血收集血清冻存用作后续指标监测。处死后收集双侧肾脏,称重,并固定、冻存。
6)比较各组大鼠血糖、血脂
各组大鼠血糖、血脂测量结果如下表2所示:
表2各组大鼠血糖血脂比较(x±s)
与正常组比较*P<0.05,**P<0.01 与模型组比较ΔP<0.05,ΔΔP<0.01
由表2的测试结果可知:模型组大鼠的各项显著高于正常组,HDL-C无明显变化。与模型组比较:APS组大鼠的TCHO、TG、LDL-C、GLU明显降低,HDL-C无明显变化;MSC组TCHO、LDL-C、GLU显著降低;APS+MSC组TCHO、TG、LDL-C、GLU均极显著降低,HDL-C无明显变化。
7)各组大鼠BUN、CRE比较
各组大鼠BUN、CRE测量结果如下表3所示:
表3各组大鼠BUN、CRE比较(x±s)
与正常组比较*P<0.05,**P<0.01 与模型组比较ΔP<0.05,ΔΔP<0.01
模型组大鼠的血尿BUN和尿CRE显著高于正常组,血CRE无明显变化。与模型组比较:APS组大鼠的尿CRE和血BUN明显降低,尿BUN和血CRE无明显变化;MSC组CRE、尿BUN显著降低,血BUN无明显变化;APS+MSC组的各项数据均显著降低。
8)各组大鼠24h尿量、MTP、MAZ比较
各组大鼠24h尿量、MTP、MAZ的测试结果如下表4所示:
表4各组动物24h尿量、MTP、MAZ比较(x±s)
与正常组比较*P<0.05,**P<0.01 与模型组比较ΔP<0.05,ΔΔP<0.01
由表4的检测结果可知,模型组大鼠的各项数据均显著高于正常组。与模型组比较:APS组、MSC组大鼠的24h尿量、MAZ显著降低,MTP无明显变化。APS+MSC组各项数据均显著降低。
9)肾组织及血清氧化应激结果比较
各组大鼠肾组织氧化应激结果以及血清氧化应激结果如下表5、表6所示:
表5肾组织氧化应激结果比较(x±s)
与正常组比较*P<0.05,**P<0.01 与模型组比较#P<0.05,##P<0.01
表6血清氧化应激结果比较(x±s)
与正常组比较*P<0.05,**P<0.01 与模型组比较#P<0.05,##P<0.01
由表5、表6的对照结果可知,与正常组大鼠相比,模型组大鼠肾组织匀浆以及血清中GSH-PX、T-AOC、CAT、T-SOD的活性显著降低,MDA的含量显著升高(P<0.01);说明糖尿病大鼠抗氧化防御机能处于低下状态。与模型组大鼠相比,治疗组大鼠肾组织匀浆以及血清中GSH-PX、T-AOC、CAT、T-SOD的活性呈现不同程度的升高,MDA含量也有所下降,其中,A+M组大鼠改善作用最为明显;说明APS联合HUCMSC可以通过提高糖尿病大鼠肾脏的抗氧化酶活性,抑制脂质过氧化反应,从而改善糖尿病大鼠肾脏病变。
10)HE染色
按照如下步骤:石蜡切片脱蜡至水→蒸馏水洗→用哈瑞苏木精或迈耶苏木精染核→盐酸酒精分化1s→流水冲洗→伊红染色液染色→流水冲洗→常规脱水、透明→封固→光镜观察,分别对各组小鼠进行肾脏检测,检测结果如下:
正常对照组:肾小球囊无渗出及粘连,系膜细胞无增生,见图5A。
模型组:可见系膜细胞增生,系膜基质增多,肾小球体积增大,炎细胞浸润,见图5B。
治疗组:肾小球系膜细胞无明显增生,糖尿病肾病大鼠肾脏的病理改变得到明显改善,其中A+M组改善最明显。APS、MSC以及A+M治疗组检测结果分别依次见图5C、图5D以及图5E。
11)免疫组化
按照如下步骤:载玻片防脱片处理→石蜡切片脱蜡至水→蒸馏水洗→热修复抗原10min/次2次→3%过氧化氢10min→PBS冲洗2min/次3次→加一抗过夜→PBS冲洗2min/次3次→加二抗20min→PBS冲洗2min/次3次→DAB显色3min→自来水冲洗→苏木精染核1min→盐酸酒精分化1s→流水冲洗至中性→常规脱水、透明→封固→光镜观察。分别对各组大鼠进行免疫组化检测。
其中,一抗为FN纤维连接蛋白(PBS 1:100稀释);二抗为:colⅣ Ⅳ型胶原(PBS 1:100稀释),检测结果如下:
正常对照组:肾小球系膜外基质中FN表达较少,肾小管基底膜以及肾小球系膜区、基底膜、毛细血管壁免疫染色均较弱,colⅣ表达较少,FN和colIV检测结果分别依次见图6A、6B。
模型组:肾小球系膜外基质中FN表达增多,肾小管基底膜以及肾小球系膜区、基底膜、毛细血管壁可见阳性染色,呈棕褐色,染色从强度到面积均明显增加,且染色浓重部位位于细胞外基质中即colⅣ表达增多,FN和colIV检测结果分别依次见见图6C、6D。
治疗组:肾小球系膜外基质中FN表达减少,肾小管基底膜以及肾小球系膜区、基底膜、毛细血管壁colⅣ表达均减少,纠正细胞外基质积聚,其中A+M组改善最明显见。APS治疗组FN和colIV检测结果分别依次见图6E、6F;MSC治疗组FN和colIV检测结果分别依次见图6G、6H;A+M治疗组FN和colIV检测结果分别依次见图6I、6J。
12)PAS染色进行肾脏形态病理学检查
按照如下步骤:石蜡切片脱蜡至水→蒸馏水洗→过碘酸酒清夜10min→自来水冲洗10min→Schiff氏液10min→流水冲洗5min→用哈瑞苏木精或迈耶苏木精染核3min→盐酸酒精分化1s→流水冲洗5min→常规脱水、透明→封固→光镜观察,分别对各组大鼠进行肾脏形态病理学检测,检测结果如下:
正常对照组:肾小球囊无渗出及粘连,系膜区PAS阳性物质无增多,系膜细胞无增生,见图7A。
模型组:可见系膜细胞增生,系膜区PAS阳性物质增多,呈不均匀红染,部分毛细血管受压塌陷,见图7B。
治疗组:肾小球系膜细胞无明显增生,PAS阳性物质较模型组明显减轻,大部分毛细血管开放,其中A+M组改善最明显;APS、MSC以及A+M治疗组检测结果分别依次见图7C、图7D、图7E。
结合以上4)-12)的测试结果可知,本发明中,APS、MSC以及A+M治疗组中,大鼠的血糖、血脂、肾功能、抗氧化应激能力及肾脏结构都有一定的改善,与APS和MSC组比较,APS+MSC联合用药组降血糖、改善肾功能、降血脂及抗氧化应激能力方面明显更优。
尽管已用具体实施例来说明和描述了本发明,然而应意识到,在不背离本发明的精神和范围的情况下可以作出许多其它的更改和修改。因此,这意味着在所附权利要求中包括属于本发明范围内的所有这些变化和修改。
- 还没有人留言评论。精彩留言会获得点赞!
- 从人胎盘羊膜制备羊膜间充质干细胞的方法及其应用与流程
- 一种脐疗贴的制备方法及应用与流程
- 一种干细胞制剂及其在制备治疗慢性肾炎的药物中的应用的制作方法与工艺
- 脐带间充质干细胞在制备治疗角膜损伤的干细胞制剂中的应用的制作方法与工艺
- 脐带间充质干细胞联合黄芪多糖在制备治疗高血糖和糖尿病肾病药物中的应用的制作方法与工艺
- 由脐带间充质干细胞制备CD34阳性细胞的方法与流程
- 基因重组干细胞制剂的制备方法及其在皮肤损伤修复、瘢痕抑制中的应用与流程
- 一种大规模制备人脐带间充质干细胞因子用诱导分泌培养基的制作方法与工艺
- 一种人母乳干细胞的制备方法及其应用与流程
- 间充质干细胞联合维生素E在制备肾脏组织细胞修复药物中的应用的制作方法与工艺