营养组合物及在制备基因损伤恢复药物中的应用的制作方法
本发明涉及一种营养组合物及用途,尤其是一种具有促进造血干细胞增殖等作用且可恢复多种损伤基因的营养组合物及在制备基因损伤恢复药物中的应用。
背景技术:
已有研究证明DNA修复通路由一个内源性的网络修复系统组成,已经发现了130种以上的基因专司维护DNA的忠实性,正常情况下,虽然人体细胞DNA单链断裂可达2300次/h,但由于DNA修复能力为20万次/h,因此不会对机体造成损害。然而,当DNA修复基因受损,就不能及时进行DNA修复,从而导致各种疾病。因此目前在遗传学方面已有如下权威结论:“不论是器质性疾病还是功能性疾病,都有必要在基因水平上去探究其病因”,“人类正常的衰老和死亡也受到基因的调控”,“不论是防治疾病还是延缓衰老,都可以从基因这个层次上来研究解决问题”为此,基因治疗已经成为现代科学研究的热点。
基因治疗是纠正与疾病相关的缺陷基因的一种技术,现有方法大多是以正常基因替换异常的致病基因。如将载有治疗基因的病毒载体感染靶细胞;脂质体携带治疗基因穿过靶细胞膜进入细胞;通过化学方法将治疗基因与特异细胞受体结合,开展靶向治疗。此外,也有少数用RNA干扰的方法。虽然1990年开始进行第一例基因治疗已获得成功,但仍面临如下问题有待解决:①外源基因在受体表达不稳定、时间短,限制了基因治疗的疗效;②外源基因移植引起免疫系统对已识别过的外来物产生免疫增强,使病人的治疗难以重复;③病毒载体对病人可能有各种潜在的危险;④许多疾病是由多基因缺陷引起的,无法用单基因纠正解决问题。
专利号为200710012788.8的中国发明专利公开了一种“促进造血干细胞增殖与血红蛋白合成的营养组合物”。该营养组合物的原料及重量比如下:核苷酸90~110、精氨酸20~30、赖氨酸20~30、半胱氨酸10~20、甘氨酸25~35、组氨酸20~30、卵磷脂110~130、脑磷脂50~70、维生素E 0.4~0.6、维生素C 5~7、叶酸0.02~0.04、维生素B2 0.05~0.07、维生素B6 0.07~0.08、维生素B12 0.0001~0.0002、铁0.5~1.5、锌0.5~0.7、锰0.4~0.6、枸杞多糖14~16、葡萄籽提取物14~16。可明显提高血中血红蛋白(Hb)、红细胞(RBC)、白细胞(WBC)及血小板(Plt)数量;可刺激骨髓造血干细胞的增殖,使造血干细胞明显增多;明显提高细胞内线粒体数目;对肝、脾的损伤具有明显的恢复作用。该营养组合物适用于营养不良性贫血(缺铁性贫血及叶酸与维生素B12营养不良性贫血)、红细胞生成减少所致贫血以及红细胞破坏过多或丢失所致贫血。专利号为201010129033.8的中国发明专利公开了该营养组合物作为药物可为错配修复基因损伤的恢复提供基本营养条件,从而达到恢复错配修复基因损伤的目的。然而该营养物仅局限于错配修复基因损伤的恢复,并不能满足其他基因治疗的需要。
技术实现要素:
本发明是为了解决现有技术所存在的上述技术问题,提供一种具有促进造血干细胞增殖等作用且可恢复多种损伤基因的营养组合物及在制备基因损伤恢复药物中的应用。
本发明的技术解决方案是:一种营养组合物,其特征在于各组分质量比如下:赖氨酸200~1200、甲硫氨酸100~1600、苯丙氨酸150~1400、苏氨酸50~600、色氨酸50~400、精氨酸200~1500、组氨酸100~1000、甘氨酸100~600、天冬氨酸100~600、亮氨酸100~600、异亮氨酸100~600、缬氨酸100~800、丝氨酸100~400、谷氨酰胺200~600、牛磺酸100~500、乳清酸100~300、核苷酸200~1200、维生素A 0.2~0.6、维生素D 0.002~0.006、维生素B2 1~4、维生素B6 1~4、维生素B12 0.001~0.006、烟酸 5~20、叶酸0.01~1.2、维生素C 50~150、铁2~10、锌2~10、锰2~10、铜 0.5~2、硒0.01~0.1、铬0.01~0.02、钾10~300、钙100~300、镁100~200、肌醇50~60、大豆磷脂100~2500。
各组分最佳质量比如下:赖氨酸600、甲硫氨酸800、苯丙氨酸700、苏氨酸300、色氨酸200、精氨酸760、组氨酸500、甘氨酸300、天冬氨酸300、亮氨酸300、异亮氨酸300、缬氨酸400、丝氨酸200、谷氨酰胺300、牛磺酸500、乳清酸300、核苷酸400、维生素A 0.6、维生素D0.006、维生素B22、维生素B62、维生素B12 0.004、烟酸12、叶酸0.9、维生素C100、铁10、锌10、锰 8、铜2、硒0.1、铬 0.02、钾 300、钙300、镁 200、肌醇60、大豆磷脂1200。
上所述营养组合物在制备基因损伤恢复药物中的应用。
上所述营养组合物在制备DNA切除修复基因损伤恢复药物中的应用。
上所述营养组合物在制备DNA错配修复基因损伤恢复药物中的应用。
上所述营养组合物在制备DNA同源重组修复基因损伤恢复药物中的应用。
上所述营养组合物在制备DNA 错误倾向修复基因损伤恢复药物中的应用。
本发明的营养组合物具有促进造血干细胞增殖等作用且可对DNA切除修复基因损伤、DNA错配修复基因损伤、DNA同源重组修复基因损伤及DNA 错误倾向修复基因损伤等均有恢复作用,可满足基因治疗的需要,解决向机体植入外源基因所存在的种种问题,具有有效、安全、简便、经济、不产生免疫排斥等优点。
附图说明
图1是本发明实施例对再障大鼠体重的影响示意图。
图2 是本发明实施例对再障大鼠肝、骨髓、脑核苷酸切除修复基因的影响示意图。
图3是本发明实施例对再障大鼠肝、骨髓、脑碱基切除修复基因的影响示意图。
图4是本发明实施例对再障大鼠肝脏、骨髓以及脑组织中错配修复基因的影响示意图。
图5是本发明实施例对再障大鼠肝、骨髓、脑同源重组修复基因的影响示意图。
图6是本发明实施例对再障大鼠肝、骨髓、脑SOS修复基因的影响示意图。
具体实施方式
实施例1:本发明的营养组合物各组分质量(mg)比如下:赖氨酸200~1200、甲硫氨酸100~1600、苯丙氨酸150~1400、苏氨酸50~600、色氨酸50~400、精氨酸200~1500、组氨酸100~1000、甘氨酸100~600、天冬氨酸100~600、亮氨酸100~600、异亮氨酸100~600、缬氨酸100~800、丝氨酸100~400、谷氨酰胺200~600、牛磺酸100~500、乳清酸100~300、核苷酸200~1200、维生素A 0.2~0.6、维生素D 0.002~0.006、维生素B2 1~4、维生素B6 1~4、维生素B12 0.001~0.006、烟酸 5~20、叶酸0.01~1.2、维生素C 50~150、铁2~10、锌2~10、锰2~10、铜 0.5~2、硒0.01~0.1、铬0.01~0.02、钾10~300、钙100~300、镁100~200、肌醇50~60、大豆磷脂100~2500。
实施例2:各组分质量(mg)比如下:赖氨酸600、甲硫氨酸800、苯丙氨酸700、苏氨酸300、色氨酸200、精氨酸760、组氨酸500、甘氨酸300、天冬氨酸300、亮氨酸300、异亮氨酸300、缬氨酸400、丝氨酸200、谷氨酰胺300、牛磺酸500、乳清酸300、核苷酸400、维生素A 0.6、维生素D0.006、维生素B22、维生素B62、维生素B12 0.004、烟酸12、叶酸0.9、维生素C100、铁10、锌10、锰 8、铜2、硒0.1、铬 0.02、钾 300、钙300、镁 200、肌醇60、大豆磷脂1200。
所述营养组合物对DNA切除修复基因损伤、DNA错配修复基因损伤、DNA同源重组修复基因损伤及DNA 错误倾向修复基因损伤等均有恢复作用,可在制备基因损伤恢复药物中应用。
实施例1、2原料来源如下表:
实验:
一.再生障碍性贫血大鼠模型的建立
本实验采用SD大鼠。实验步骤:第一天X射线2.5Gy照射后,于第4、6、8天分别给予环磷酰胺35mg/kg,氯霉素45 mg/kg腹腔注射。第15天重复以上步骤。以单纯等量生理盐水相应部位注射为正常对照组。
实验分组:根据动物药理学的药品剂量和综合试验的设计分析,分为:①正常对照组;②再障模型组;③实施例2营养组合物高剂量组,以2266.95mg/kg.d对大鼠灌胃;④实施例2营养组合物中剂量组,以1511.3mg/kg.d对大鼠灌胃;⑤实施例2营养组合物低剂量组,以1057.91mg/kg.d对大鼠灌胃。
试验流程:首先,按前述再障大鼠模型的建立方法建立模型,从第5天开始,营养组合物高、中、低剂量组分别以相应剂量对大鼠进行灌胃,每天一次,直至第60天,拉颈处死大鼠,采样进行检测。同时每日进行整体观察,测量体重。
二.实验方法
1. 外周血检测
各实验组第60天, 称重动物,经眼眶取血,采用全自动血细胞分析仪测定外周血血红蛋白含量、红细胞、白细胞及血小板数;显微镜下观察外周血涂片。
2.促红细胞生成素(Epo)检测
酶标板每孔加入标准液,对照液及预先用样品稀释液稀释的待测样品100ul,封板,37°C孵育90分钟。反应后甩干孔内液体后,将准备好的生物素抗小鼠EPO抗体工作液按每孔100ul依次加入(TMB空白显色孔除外),封板后37°C反应60分钟,0.01M PBS洗涤3次,每次浸泡1分钟左右。加入准备好的亲和素-过氧化物酶复合物工作液按每孔100ul依次加入(TMB空白显色孔除外),37°C反应30分钟。按每孔90µl依次加入已在37℃中平衡30分钟TMB显色液,37°C避光反应,每孔100µl依次加入TMB终止液。用酶标仪于450nm波长处读取吸光度(OD值), 根据标准曲线测得样本Epo浓度(pg/ml)。
3. 骨髓检测
颈椎脱臼处死大鼠, 分离双侧股骨打开骨髓腔进行骨髓涂片、骨髓单个核细胞计数、骨髓病理检查、骨髓间充质干细胞增殖及分化趋势的分析。
4. 骨髓间充质干细胞(BMSCs)的分离提取
SD大鼠腹腔注射麻醉药后脱颈处死,75% 乙醇浸泡大鼠20 min;无菌取双后肢,放入75% 的乙醇中浸泡5 min;清除下肢肌肉,从膝关节断离股骨,剪开股骨两端;用10 mL注射器吸取10% 胎牛血清的F-12K培养液冲洗骨髓腔,收集骨髓冲洗液,制成单细胞悬液,200目筛网滤过后以1×108接种于培养瓶中。置于37°C、5% CO2培养箱中培养。72 小时首次更换培养液,去除未贴壁细胞,以后每隔2天换液1次。当细胞铺满整个培养瓶底面积的80%~90%时,传代培养。
5.间充质干细胞(BMSCs)的成脂诱导分化
成脂诱导法:将分离纯化的骨髓间充质干细胞常规培养,消化传代,以1×105/孔的密度,400ul/孔接种于预先放置有盖玻片的6孔培养板中,制备细胞爬片,当细胞生长达80% 融合时,加入10%的胎牛血清、1μmol/L地塞米松、0.5 mmol/L IBMX、10 mg/L牛胰岛素的H-DMEM诱导3天,再用10% 的胎牛血清、10 mg/L牛胰岛素的H-DMEM处理1天,如此循环3次后,用10%的胎牛血清、10 mg/L牛胰岛素的H-DMEM处理7天,每隔三四天换液1次。对照组始终加入含体积分数为10% 的胎牛血清、10 mg/L牛胰岛素的H-DMEM,每隔三四天换液1次。诱导后细胞用PBS洗涤2~3次,10% 甲醛室温固定40min。PBS洗2~3次,饱和油红O染液用一蒸水以3:2稀释,室温染色30min,PBS洗数次直至无肉眼观察到沉渣,光镜观察。
6. 间充质干细胞(BMSCs)成骨细胞培养及鉴定
取P2代骨髓间充质干细胞,按2×105个/孔接种于12孔板,当细胞贴壁生长达80% 融合时,吸除孔中培养液,换为成骨细胞诱导液 (含高糖DMEM、体积分数为10% 胎牛血清、10-8mol/L地塞米松、10-2 mol/L β-甘油磷酸钠、50 mg/L抗坏血酸),每3天更换诱导液1次。培养14天后,吸除培养液,PBS洗2次,10%甲醛室温固定40 min,PBS洗3次,加入0.1% 茜红素(3:2稀释),室温染色10min,去除染液,PBS洗3次后,显微镜下观察。
7. RNA提取和RT-PCR分析
常规应用Trizol 法提取各标本的总RNA,紫外分光光度计测定A260和A280,以检测RNA含量和纯度,并置放于-70°C保存。
反转录体系20μl,包含样品RNA 1μl,按照TaKaRa 的反转录试剂盒提供的说明书进行操作。反转录反应条件为:65°C 1min,30°C 5min,65°C 15min,98°C 5min,5°C 5min。
PCR反应体系50 μl,包含反转录液10 μl。PCR反应条件: 94°C预变性1min;97°C 变性 20s,64°C退火20s,72°C 20s延伸,循环30次;72°C 延伸5min,4°C恒定。取5μl PCR扩增产物经1%琼脂糖凝胶电泳, 紫外灯下凝胶成像。
8. 透射电镜观察
将大鼠部分肝、脾、脑、肾组织标本上取不同部位的3张切片进行透射电镜(JEM-100CXE 型) 超微结构的观察,每张切片分别随机观察5-6个部位,并按相同放大倍数摄片,每组随机抽取l0张照片,采用Epson微机和Summa Sketch PIus 数字化仪,并使用Sigmascan软件,对各组照片作电镜图像的形态进行分析,同时计数线粒体的平均数目。
9. 线粒体膜电位测定
细胞(5×105个)接种于25cm2培养瓶中, 37℃培养24 h后,加入不同浓度的姜黄素分别作用1 h和 6 h 后,收获细胞,PBS洗两遍,重悬于2ml 含1.0 µM 罗丹明123的新鲜培养液中,37°C 水浴振摇孵育10 min,离心去掉细胞,荧光比色计测定培养液中罗丹明123的强度,激发波长490 nm,发射波长520 nm,结果以细胞吸收的罗丹明123的荧光强度表示。
10. 线粒体DNA含量测定
将骨髓单个核细胞(5×107)、新鲜组织肝脏、脾、脑、肾匀浆、裂解、离心,获取线粒体。按照DNA提取试剂盒说明提取线粒体中的DNA,采用紫外分光光度计测量其含量。计算公式如下:
DNA浓度(μg/μl)= A260 × 50μg/ml × 稀释倍数 × 10-3
11. 病理学观察
将大鼠部分肝、脾、脑、肾、肠、肌肉置于4 %多聚甲醛中固定,依次经过常规脱水、石蜡浸泡包埋、切片、HE 染色, 显微镜观察各组织细胞的形态结构。
12. 免疫组化染色
石蜡切片脱蜡、水化;PBS洗2-3次各5分钟;3% H2O2(80%甲醇)滴加在玻片上,室温静置10分钟;PBS洗2-3次各5分钟;抗原修复;PBS洗2-3次各5分钟;滴加正常山羊血清封闭液,室温20分钟。甩去多余液体,滴加一抗50μl,4°C过夜。过夜后需在37°C复温45分钟。PBS洗3次各5分钟;滴加二抗40-50μl,室温静置,或37°C 1小时;PBS洗3次各5分钟;DAB显色5-10分钟,在显微镜下掌握染色程度;PBS或自来水冲洗10分钟;苏木精复染2分钟,盐酸酒精分化;自来水冲洗10-15分钟;脱水、透明、封片、镜检。
13. 流式细胞仪分析
取大鼠左胫骨,去除表面肌肉组织,修剪骨垢,用18 号针插入胫骨踝端,用PBS 5mL 冲洗入试管内,以200目筛网过滤。1000 r/min 离心 5min,弃上清液。将细胞加入5mL Percoll分离液(相对比重1.073g/L),2000r/min,离心25min,取中间单个核细胞层。PBS洗涤后调整单个核细胞数为l×106/管,每样本3管,测定管加入FITC标记的CD34或CD45抗体,37°C孵育2小时。然后PBS洗涤一次。用流式细胞仪检测表达CD34/45阳性细胞数量变化,以标记抗体呈阳性的细胞百分率作为表达CD34/45 蛋白(骨髓造血干细胞标志物)的计量标准。同时以只加标记荧光素的羊抗兔IgG和不加抗体的细胞作阴性对照。
14. 蛋白芯片分析
将大鼠部分骨髓单个核细胞、骨髓间充质干细胞、肝脏组织进行蛋白芯片分析,此部分工作由上海康城公司完成。
15. 统计学分析
所有数据均用SPSS 17.0软件进行统计分析。每一项分析至少有三次结果。数值用均数±SD表示,采用t检验。P<0.05认为有显著性差异,并在统计学上有意义。
三、实验结果
(一)营养组合物对再障大鼠全身情况的影响
与正常对照组相比,再障模型组大鼠自6天起陆续出现皮毛松弛蓬乱,光泽度降低,部分大鼠有脱毛及皮损。同时大鼠消瘦、精神渐显不佳,唇色眼睑苍白、活动减少、少食、体重下降。其中再障模型组大鼠体重(218.23±33.52 g)与正常对照组(366.54±49.68 g,*p<0.05)相比下降明显。
不同剂量的营养组合物组与再障模型组比较,大鼠精神状态渐佳,进食量增大,体重增加(见图1)。表明营养组合物对再生障碍性贫血小鼠全身有显著恢复作用。
(二)营养组合物对再障大鼠外周血的影响
与正常对照组相比,再障模型组外周血中红细胞 (RBC)、白细胞 (WBC)、血小板 (PLT) 及血红蛋白 (Hb) 均显著下降 (表 1,#p<0.05);不同剂量营养组合物组与再障模型组比较,其外周血中各项指标均显著升高 (表 1,*p<0.05),并呈量效依赖性。
与正常对照组相比,再障模型组大鼠促红细胞生成素(EPO)含量明显升高,且EPO与 RBC、 Hb的降低呈负相关,r=-0.91及r=-0.93(*p<0.05),表明EPO水平与再障骨髓红系生成能力降低,EPO反应性能力减弱,EPO呈代偿性升高有关。(表1,*p<0.01)。EPO是一种重要的造血调控因子,具有促进红系祖细胞增殖、分化和成熟,维持外周血中红细胞,血红蛋白恒定的作用,血液中EPO水平能反映机体中的红细胞生成能力。而不同剂量的营养组合物组与再障模型组比较,促红细胞生成素(Epo)由于代偿作用含量降低 (*p<0.01);并呈剂量-效应关系。
以上结果提示,营养组合物对再障大鼠外周血各种血细胞有促进升高作用。
表1营养组合物对再障大鼠外周血的影响
# P<0.05 再障组与正常组;*P<0.05 营养组合物组与再障组
(三)本发明实施例营养组合物对再障大鼠基因损伤恢复的影响
1. 切除修复基因
1.1 核苷酸切除修复基因
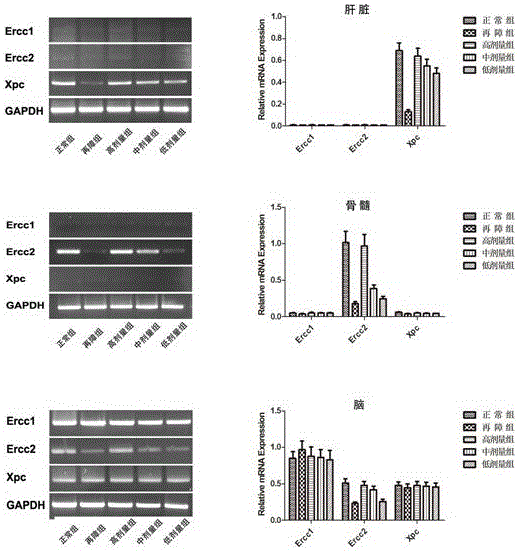
核苷酸切除修复 (NER) 通路被认为是机体内最主要及最重要的损伤修复通路,主要修复外源性物质导致的DNA损伤,例如嘧啶二聚体、光化合物及其它大的化合物及交联所导致的损伤。本实验选取了3 个 NER 基因 (Ercc1, Ercc2, Xpc),从转录水平检测了其在营养组合物组中肝脏、骨髓以及脑中的表达变化(见图2)。
在肝脏组织中,与正常对照组相比,再障模型组大鼠肝脏组织中核苷酸切除修复基因Xpc 表达量下调;营养组合物处理再障大鼠后,大鼠肝脏组织中Xpc 的表达量随营养组合物剂量增加而增加。核苷酸切除修复基因Ercc1、Ercc2 无明显变化。
在骨髓中,与正常对照组相比,再障模型组大鼠骨髓造血细胞核苷酸切除修复基因Ercc2 表达量下调;营养组合物处理再障大鼠后,大鼠骨髓造血细胞Ercc2 的表达量随营养组合物剂量增加而增加。核苷酸切除修复基因Ercc1、Xpc 无明显变化。
在脑组织中,与正常对照组相比,再障模型组大鼠脑组织中核苷酸切除修复基因Ercc2 表达量下调;营养组合物处理再障大鼠后,大鼠脑组织中Ercc1 的表达量随营养组合物剂量增加而增加。核苷酸切除修复基因Ercc1、Xpc无明显变化。
结果表明本发明实施例营养组合物对再障大鼠核苷酸切除修复基因损伤具有一定的恢复作用。
1.2 碱基切除修复基因
碱基切除修复 (base excision repair, BER) 基因主要参与修复内源性烷化剂和外源性致癌剂如亚硝氨引起的 DNA 碱基的烷化以及细胞内自发的和由于电离辐射及紫外线辐射引起的 DNA 碱基的氧化。本实验选取了4 个 BER 基因 (Apex1, Ogg1, Polb, MTH1),从转录水平检测了其在营养组合物组中的表达变化(见图3)。
在肝脏组织中,各组碱基切除修复基因无明显变化。
在骨髓中,与正常对照组相比,再障模型组大鼠骨髓造血细胞碱基切除修复基因Ogg1、MTH1表达量下调;营养组合物处理再障大鼠后,大鼠骨髓造血细胞碱基切除修复基因Ogg1、MTH1的表达量随营养组合物剂量增加而增加。碱基切除修复基因Apex1、Polb 无明显变化。
在脑组织中,与正常对照组相比,再障模型组大鼠骨髓造血细胞碱基切除修复基因Ogg1、MTH1表达量下调;营养组合物处理再障大鼠后,大鼠骨髓造血细胞中碱基切除修复基因Ogg1、MTH1的表达量随营养组合物剂量增加而增加。碱基切除修复基因Apex1、Polb 无明显变化。
结果表明本发明实施例营养组合物对再障大鼠碱基切除修复基因损伤具有一定的恢复作用。
2. 错配修复基因
DNA错配修复系统 (MMR) 是人体细胞的一种能修复DNA碱基错配的安全保障体系,由一系列特异性修复DNA碱基错配的酶分子 (错配修复基因产物) 组成。该系统能消除DNA合成错误,保持遗传物质的完整性和稳定性,避免遗传物质发生突变,保证DNA复制的忠实性。本实验选用最常用的4个错配修复基因MSH2、MSH3、MLH1、PMS2。
在肝脏,骨髓以及脑组织中,与正常对照组相比,再障模型组大鼠中4个错配修复基因的蛋白表达量均下调;营养组合物处理再障大鼠后,大鼠肝脏,骨髓以及脑组织中错配修复基因的表达量随营养组合物剂量增加而增加(见图4)。
结果表明本发明营养组合物对再障大鼠错配修复基因的损伤具有恢复作用。
3. 同源重组修复基因(双链断裂修复)
当细胞暴露在电离辐射、 DNA交联剂及缺氧等各种致 DNA 损伤的条件下时,常出现染色体DNA双链断裂。在真核生物细胞中,已知存在两种修复染色体 DNA双链断裂的主要途径,即同源重组和非同源 DNA末端连接。准确的DNA修复是维持染色体完整性的前提,同源重组则在 DNA修复过程中发挥关键作用。本实验选用最常用的4个同源重组修复基因 Rad51、Rad52、Xrcc1、Xrcc2。
在肝脏,骨髓以及脑组织中,与正常对照组相比,再障模型组大鼠同源重组修复基因Rad51、Rad52、Xrcc1表达量均下调;营养组合物处理再障大鼠后,大鼠重组修复基因Rad51、Rad52、Xrcc1的表达量随营养组合物剂量增加而增加,而Xrcc2无明显变化(见图5)。
结果表明本发明实施例营养组合物对再障大鼠同源重组修复基因的损伤具有恢复作用。
4. 错误倾向修复(SOS修复)基因
当DNA两条链都有损伤并且损伤位点邻近时,损伤不能被切除修复或重组修复,这时在Restriction Endoneuclease和Exoneuclease的作用下造成损伤处的DNA链空缺,再由损伤诱导产生的一整套的特殊DNA聚合酶─SOS修复酶类,催化空缺部位DNA的合成,这时补上去的核苷酸几乎是随机的,仍然终于保持了DNA双链的完整性,使细胞得以生存。本实验选用最常用的两个SOS修复基因RecA、LexA。
在肝脏,骨髓组织中,与正常对照组相比,再障模型组大鼠SOS修复基因RecA 表达量均下调;营养组合物处理再障大鼠后,大鼠SOS修复基因RecA的表达量随营养组合物剂量增加而增加。SOS修复基因LexA 无明显变化(见图6)。
在脑组织中,各组之间SOS修复基因无明显变化。
结果表明本发明实施例营养组合物对再障大鼠SOS修复基因的损伤具有恢复作用。
- 还没有人留言评论。精彩留言会获得点赞!
- 化药/基因共转运功能化碳纳米管的制备方法及应用与流程
- 抗体基因的表达‑分泌系统的制作方法与工艺
- 抗体捕获蛋白及报告基因融合重组蛋白检测抗体的方法与流程
- 治疗性重组抗体、其编码基因及应用的制作方法与工艺
- 一种制备高效合成泛酸基因工程菌的方法及其应用与流程
- MACF1基因及其表达产物在制备诊断和治疗骨质疏松症药物中的应用的制作方法与工艺
- 野生型IDH2基因作为靶标在制备非小细胞肺癌治疗药物中的应用的制作方法与工艺
- FBN1基因在制备检测先天性单纯性晶状体异位制品中的应用的制作方法与工艺
- TMEM104基因在制备治疗椎间盘退行性疾病药物中的应用的制作方法与工艺
- PSMG4基因在制备男性骨质疏松症诊断产品中的用途的制造方法与工艺