一种槲皮素与紫杉醇共输送肺吸入纳米靶向多孔聚合粒子及其制备方法与流程
本发明涉及一种靶向多孔聚合粒子,具体的说,涉及一种槲皮素与紫杉醇共输送肺吸入纳米靶向多孔聚合粒子及其制备方法和应用,属于生物材料的医学基础应用领域。
背景技术:
肺癌是全球最常见的恶性肿瘤之一,据世界卫生组织的统计数据,全球肺癌以每年0.5%的速度增长,其中非小细胞肺癌(NSCLC)占肺癌的比例约为80%左右,初治病例约75%是中晚期患者,五年内的生存率很低。目前无论是在我国还是全世界,肺癌都是发病率和死亡率最高的癌症,严重威胁人类的健康和生命。
化疗是治疗非小细胞肺癌的主要手段,但是许多化疗药物在肿瘤部位的浓度低,并且难以在肿瘤部位维持有效的治疗浓度。肺吸入化疗药物能够解决药物在肺癌内浓度过低这一化疗失败的主要障碍,而且由于肿瘤部位异物清除能力下降,药物到达后能够存留较长时间,提高化疗效果。肺吸入给药是治疗呼吸系统疾病的简单有效的给药途径。肺吸入化疗药物与全身化疗给药相比,化疗药物可直接作用于癌组织局部,用药剂量小,全身毒副作用少,避免肝脏的首过效应及注射给药的不便,同时吸入疗法已在哮喘、慢性阻塞性肺病等疾病中广泛应用,增加了患者的顺应性。与其它的给药途径相比,肺吸入给药具有极大的吸收表面积,丰富的毛细血管,能够避免肝脏的首过效应,并且肺部有着较薄的上皮屏障、和高的膜通透性。肺吸入给药可以将治疗药物直接输送到病灶区,减少了药物在其他组织的分布。所以直接通过肺吸入的方法给药能够解决在肺部肿瘤内不能达到有效治疗浓度等问题。
紫杉醇是一种具有代表性的抗癌药物,能够促进微管蛋白聚合,防止其解聚,稳定微管,使细胞在进行有丝分裂时不能形成纺锤体和纺锤丝,抑制了细胞分裂和增殖,从而发挥抗癌作用。临床上已经应用于许多癌症的治疗包括肺癌。然而紫杉醇的水溶性很差(低于1 ug/mL)限制了人体的直接应用。而现在已经有用乙醇和聚氧乙烯蓖麻油溶解紫杉醇用于静脉注射,据报道这种注射剂具有神经毒性和致敏性。
槲皮素是重要的天然黄酮类化合物,有着很好的抗氧化和抗炎性,能够抑制血小板聚集和5-羟色胺(5-HT)的释放作用。槲皮素对ADP、凝血酶和血小板活化因子(PAF)诱导的血小板聚集均有明显抑制作用,其中对PAF的抑制作用最强,也能明显抑制凝血酶诱导的血小板3H-5-HT释放。槲皮素还能通过细胞增殖和血管新生相关信号通路的复杂作用而对肿瘤表现出化学预防以及抗肿瘤作用,具有很高的药用价值,有显著抑制促癌剂的作用、抑制离体恶性细胞的生长、抑制艾氏腹水癌细胞DNA、RNA和蛋白质合成的作用。但是由于槲皮素的水溶性差、胃肠道中不稳定、口服生物利用度低,极大的限制了在临床上的应用。
纳米粒作为载体在生物医学领域很具有吸引力,而载化疗增敏剂、基因及化疗药物等联合共输送纳米靶向给药系统能够增强肺癌治疗效果,减少毒副作用。纳米粒能够在水溶液中不使用有毒的增溶剂等很容易的负载疏水性抗癌药物,并且纳米粒可延长药物在肿瘤部位的滞留时间,提高生物利用度,降低毒副作用。包裹着抗癌药物的纳米粒很容易被肿瘤细胞吞噬,增加了药物在肿瘤部位的高积累。而EGFR在NSCLC细胞表面过量表达,可达80%,成为肺癌最突出的主动靶向治疗靶点,以西妥昔单抗为配体能够成功构建对NSCLC 的主动靶向给药系统。然而纳米粒较小的空气动力学直径导致部分随呼气呼出而在肺部沉积量较少,同时由于纳米粒难以粉末化使其在肺部粉雾剂给药系统中的应用受到限制。
近年来,也有关于纳米微球的专利申请,例如“一种肺吸入槲皮素纳米微球及其制备方法”、“一种采取吸入给药紫杉醇治疗肺癌的方法”等,这些专利都是以微球的形式直接负载着药物的形式进行肺吸入给药,这种形式只能有限的提高生物利用度,并且药物是以纯药的形式从微球中释放,并不能十分有效的延长药物的作用时间且对癌细胞无靶向性,很难使药物被细胞所吞噬,从而不能很好的发挥药效。
现有的治疗肺癌的药物存在以下不足:
(1)槲皮素与紫杉醇载药量低,包封率低;
(2)不易崩解,释放的纳米粒在肺部的滞留率较低,用药量多;
(3)缓释效应不明显,短时间释放药物量达,安全性低;
(4)紫杉醇在体内完全释放的时间较短;药物与给药部位接触面积小,单位面积给药浓度低;
(5)生物利用度低,紫杉醇和槲皮素的半衰期短;药物与吸收部位的接触时间短,不利于药物被癌细胞吞噬;
(6)稳定性低;
(7)一次只能单纯给予槲皮素或紫杉醇,疗效差。
技术实现要素:
为解决现有技术存在的技术问题,本发明提供一种槲皮素与紫杉醇共输送肺吸入纳米靶向多孔聚合粒子,以实现以下发明目的:
增加了生物粘附性和安全性,达到缓释效果;提高单一药物给药的疗效,增加化疗药物的敏感性,发挥协同增效作用;降低用药剂量,减少毒性,扩大治疗范围。
(1)本发明所制备的聚合粒子的粒径为1~10 µm,聚合粒子上所负载的槲皮素和紫杉醇纳米粒的粒径为50~420 nm,所述聚合粒子中,槲皮素与紫杉醇载药量分别为5-15%和20-40%,包封率分别为70-95%和70-88%,粒径分布均匀。
(2)本发明所制备的聚合粒子,易崩解,释放的纳米粒在肺部的滞留率高达 68-79%,用药量少。
(3)本发明制备的聚合粒子,具有缓释效应,增加生物粘附性和安全性,减少毒性,扩大治疗范围。
(4)本发明制备的聚合粒子,显著延长有效血药浓度;紫杉醇在体内完全释放的时间从单独使用的1.5-3 h延长到联合使用的6-9 h。
(5)本发明制备的聚合粒子,生物利用度高,紫杉醇的半衰期达1.75-3.9 h,槲皮素的半衰期达1.4-2.1 h。
(6)本发明制备的聚合粒子,稳定性高,15天内包载槲皮素的液相峰面积变化无显著性差异;具有良好的粉末特性。
(7)本发明制备的聚合粒子,槲皮素和紫杉醇发挥抗癌协同作用,抗癌效果好。
本发明另一种目的是提供上述纳米聚合粒子的制备方法,具有操作简便、工艺稳定、易于工业化生产的优点。
为解决上述技术问题,本发明采取的技术方案如下:
一种槲皮素与紫杉醇共输送肺吸入纳米靶向多孔聚合粒子,所述聚合粒子包括以下组分:槲皮素、紫杉醇、壳聚糖或其衍生物、三聚磷酸钠、单克隆抗体西妥昔单抗、磷脂或其衍生物、羟丙基β-环糊精、赋形剂。
以下是对上述技术方案的进一步改进:
所述聚合粒子,包括以下重量份的成分:
槲皮素1~2份
紫杉醇1~2份
壳聚糖或其衍生物1~5份
三聚磷酸钠1~5份
单克隆抗体西妥昔单抗0.01~0.03份
磷脂或其衍生物1~10份
羟丙基β-环糊精1~5份
赋形剂1~15份。
所述聚合粒子的粒径为1~10 μm,负载的纳米粒的粒径为50~420 nm。
所述壳聚糖或其衍生物为高、中、低分子量的壳聚糖或其衍生物中的一种;
所述壳聚糖或其衍生物,为壳聚糖、壳寡糖、壳聚糖季铵盐、羧甲基壳聚糖中的一种或几种;所述赋形剂为甘露醇、海藻糖、乳糖、亮氨酸及其衍生物中的一种或几种;
所述高分子量的壳聚糖或其衍生物,分子量范围为1000~1250kDa;
所述中分子量的壳聚糖或其衍生物,分子量范围为390~700kDa;
所述低分子量的壳聚糖或其衍生物,分子量范围为100~160kDa;
所述壳聚糖或其衍生物的脱乙酰度为85%~98%;
所述壳聚糖衍生物的取代度为50%~90%。
所述高分子量的壳聚糖或其衍生物,分子量最优为1120kDa;
所述中分子量的壳聚糖或其衍生物,分子量最优为660kDa;
所述低分子量的壳聚糖或其衍生物,分子量最优为120kDa;
所述壳聚糖或其衍生物,脱乙酰度最优为96%;
所述壳聚糖衍生物,取代度最优为63%。
所述磷脂或其衍生物为大豆磷脂、卵磷脂、二棕榈酰磷脂酰胆碱DPPC、1,2-棕榈酰磷脂酰甘油钠盐DPPG、二硬质酰磷脂酸胆碱DSPC、二硬脂酰基磷脂酰乙醇胺DSPE、二棕榈酰基磷脂酰乙醇胺DPPE中的一种或几种。
一种槲皮素与紫杉醇共输送肺吸入纳米靶向多孔聚合粒子的制备方法,包括制备槲皮素壳聚糖纳米粒子悬浮液;所述制备槲皮素壳聚糖纳米粒子悬浮液,在匀速100~1000 r/min的搅拌速度下,取壳聚糖或其衍生物总重量的一半、三聚磷酸钠总重量的一半、槲皮素,采用溶剂溶解,分别配制成1-5 mg/mL的溶液,将槲皮素溶液、三聚磷酸钠溶液,以10~60滴/min的速度逐滴滴入壳聚糖溶液中,得到槲皮素壳聚糖纳米粒子悬浮液。
所述溶剂为色谱级乙醇、甲醇、乙酸、乙腈、纯净水中的一种或几种。
还包括制备槲皮素抗体溶液;所述制备槲皮素抗体溶液,取西妥昔单抗总体积的一半,与槲皮素壳聚糖纳米粒子悬浮液混合后,再与1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐和N-羟基琥珀酰亚胺反应24小时,蒸馏水透析3天后,用0.45 μm的微孔滤膜过滤,作为A液。
所述透析,用3500Da透析袋透析;
所述A液,调节滤液浓度为0.1%~2%;
还包括制备紫杉醇壳聚糖纳米粒子悬浮液;所述制备紫杉醇壳聚糖纳米粒子悬浮液;在匀速100~1000 r/min的磁力搅拌速度下,取壳聚糖或其衍生物总重量的一半、三聚磷酸钠总重量的一半、紫杉醇,采用溶剂溶解,分别配制成1-5 mg/mL的溶液,将紫杉醇溶液、三聚磷酸钠溶液,以10~60滴/min的速度逐滴滴入壳聚糖溶液中,得到紫杉醇壳聚糖纳米粒子悬浮液;
所述溶剂为色谱级乙醇、甲醇、乙酸、乙腈、纯净水中的一种或几种。
进一步优化方案:所述磁力搅拌的转速为500 r/min,滴加速度为20滴/min;
进一步的优化方案,所述磁力搅拌的转速为400 r/min,滴加速度为16滴/min。
所述制备方法,还包括制备紫杉醇抗体溶液;所述制备紫杉醇抗体溶液,取西妥昔单抗总体积的一半,与紫杉醇壳聚糖纳米粒子悬浮液混合后,再与1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐和N-羟基琥珀酰亚胺反应24小时,蒸馏水透析3天后,用0.45 μm的微孔滤膜过滤,作为B液。
所述1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐和N-羟基琥珀酰亚胺与壳聚糖或其衍生物的质量比例为:4:6:10-25。
所述透析,用3500Da透析袋透析;
所述B液,调节滤液浓度为0.1%~2%;
所述方法,还包括制备赋形剂溶液,所述制备赋形剂溶液,将赋形剂、羟丙基β-环糊精和卵磷脂溶于蒸馏水中,配置成赋形剂含量为0.25-0.75%的溶液,作为C液;
所述方法,还包括混合过滤,所述混合过滤,将A液与B液在100-600 r/min的转速下连续搅拌的情况下,倒入C液中持续搅拌,用0.45 μm的微孔滤膜过滤得D液;
所述方法,还包括喷雾干燥,所述喷雾干燥,将D液经蠕动泵导入喷雾干燥器,以氮气做动力控制喷雾干燥条件制成粉末聚合粒子;
所述喷雾干燥条件为:进口温度80~170℃,出口温度60~100℃,喷嘴流速300~800 L/h,进样速度1~50 mL/min,喷雾干燥后制成纳米聚合粒子。
进一步优选,所述喷雾干燥,进口温度140℃,出口温度100℃,喷嘴流速400 L/h,进样速度35 mL/min,喷雾干燥后得纳米聚合粒子。
进一步优选,所述喷雾干燥条件为:进口温度120℃,出口温度90℃,喷嘴流速300 L/h,进样速度30 mL/min,喷雾干燥后得纳米聚合粒子。
本发明与现有技术相比,具有以下有益效果:
(1)本发明所制备的聚合粒子的粒径为1~10 µm,聚合粒子上所负载的槲皮素和紫杉醇纳米粒的粒径为50~420 nm,所述聚合粒子中,槲皮素与紫杉醇载药量分别为5-15%和20-40%,包封率分别为70-95%和70-88%,粒径分布均匀。
(2)本发明所制备的聚合粒子,易崩解,释放的纳米粒在肺部的滞留率高,本发明聚合粒子在拟肺部湿度和温度(湿度为60%RH,温度25℃时)的环境下,平衡时(24 h)的吸湿率达到了14-20%,作为一级载体的聚合粒子容易溶解,释放载药纳米粒,释放的纳米粒在肺部的滞留率为68-79%。
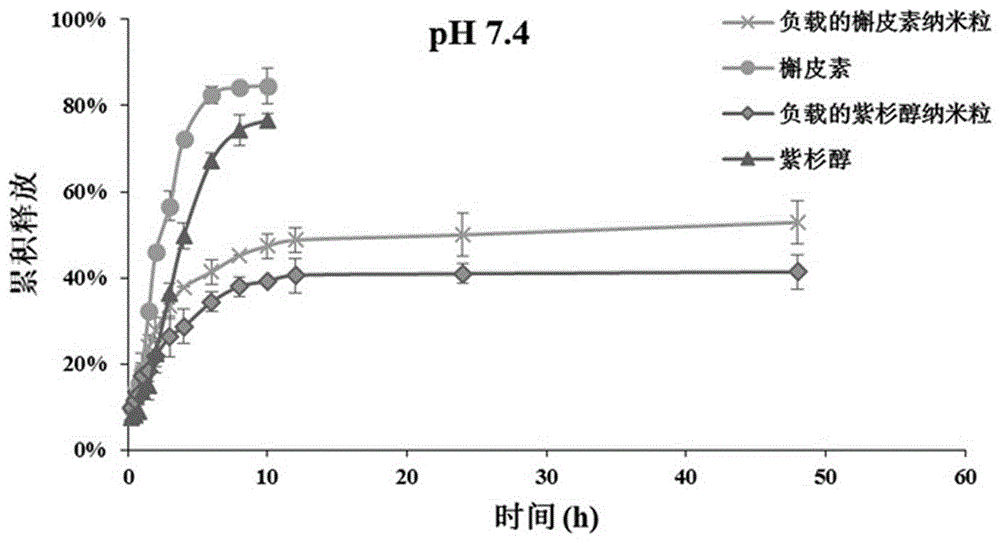
(3)本发明制备的聚合粒子,具有缓释效应,体外释放结果表明纳米聚合粒子在两天内都具有缓释效应,前2 h累积释放了16-26%,12 h累积释放了30-40%,48 h累积释放了40-55%,增加生物粘附性和安全性,减少毒性,扩大治疗范围。
(4)本发明制备的聚合粒子,能显著延长有效血药浓度;紫杉醇在体内完全释放的时间从单独使用的1.5-3 h延长到联合使用的6-9 h;
采用大鼠进行试验,药动实验结果表明本发明纳米聚合粒子能显著延长有效血药浓度,槲皮素和紫杉醇达到最大血药浓度时间Tmax均为0.8-1.1h,槲皮素和紫杉醇单独使用时,达到最大血药浓度时间Tmax均为0.043-0.08 h。
(5)本发明制备的聚合粒子,使得大鼠体内的紫杉醇消除行为减缓、提高生物利用度,显著改变紫杉醇体内的药动学行为而发挥协同作用,本发明制备的聚合粒子中,紫杉醇在体内的血浆清除率为0.048 mg/mg−1·L−1/h ;紫杉醇的半衰期为1.75-3.9 h,槲皮素的半衰期为1.5-2.1 h,紫杉醇单独使用时,在体内的血浆清除率为0.064 mg/mg−1·L−1/h;紫杉醇单独使用时的半衰期为1.3-2.2 h;槲皮素单独使用时的半衰期为0.26-0.51 h;本发明制备的聚合粒子,生物利用度高,槲皮素和紫杉醇的曲线下面积(0-末点)AUC0-t 分别为15-30 mg·L−1·h−1、40-58 mg·L−1·h−1。
(6)本发明药物,稳定性高,15天内包载槲皮素的液相峰面积变化无显著性差异;具有良好的粉末特性。
(7)本发明制备的聚合粒子,使实验肺癌大鼠的存活时间比单独使用同剂量紫杉醇的存活时间延长了15-20天。
(8)本发明制备的聚合粒子,在体外实验中,72 h对A549 细胞增殖的抑制率为71.02 ± 3.12%;紫杉醇单独使用72 h对A549细胞生长的抑制率为(41.38 ± 2.55%)。
(9)本发明聚合粒子,在肺部直接发挥抗癌作用,当槲皮素和紫杉醇联合用药时,极大提高了单一药物给药的疗效,单独使用紫杉醇72 h时A549细胞的凋亡率为(43.61 ± 0.74%);使用相同紫杉醇含量的聚合粒子组的A549细胞的凋亡率为(69.42 ±1.58%);降低了用药剂量,相同的凋亡率仅需2/3紫杉醇含量的聚合粒子,减少了毒性并扩大了治疗范围。
附图说明
附图1为实施例1制备的槲皮素与紫杉醇共输送肺吸入纳米靶向多孔聚合粒子的扫描电镜图;
附图2为实施例1制备的槲皮素与紫杉醇共输送肺吸入纳米靶向多孔聚合粒子的体外释放结果图;
附图3为实施例1制我备的槲皮素与紫杉醇共输送肺吸入纳米靶向多孔聚合粒子药动曲线结果图。
具体实施方式
以下对本发明的优选实施例进行说明,应当理解,此处所描述的优选实施例仅用于说明和解释本发明,并不用于限定本发明。
实施例1一种槲皮素与紫杉醇共输送肺吸入纳米靶向多孔聚合粒子
所述聚合粒子,各组分质量比为:
壳聚糖、槲皮素、紫杉醇、三聚磷酸钠、西妥昔单抗、磷脂、羟丙基β-环糊精、赋形剂质量比为4:2:2:4:0.02:2:5:10;
所述壳聚糖分子量为1120 Kda,脱乙酰度大于95%,粉末状;
所述磷脂为卵磷脂;
所述西妥昔单抗,浓度为1 mg/mL;
所述赋形剂为乳糖。
所述槲皮素与紫杉醇共输送肺吸入纳米靶向多孔聚合粒子,其制备方法包括以下步骤:
(1)称量
按照上述聚合粒子的质量比例,称取各组分;
称取壳聚糖400 mg、槲皮素200 mg、紫杉醇200 mg、三聚磷酸钠400 mg、西妥昔单抗2 mL、磷脂200 mg、羟丙基β-环糊精500 mg、赋形剂1000 mg。
(2)配置壳聚糖溶液
将壳聚糖溶解在200 mL质量分数为1%的醋酸溶液中,制备成2 mg/mL的壳聚糖溶液。
(3)配置槲皮素乙醇溶液
将槲皮素溶于100 mL乙醇中,配置成的2 mg/mL的槲皮素乙醇溶液。
(4)配制三聚磷酸钠溶液
将三聚磷酸钠溶于400 mL蒸馏水,配制成的1 mg/mL的三聚磷酸钠溶液。
(5)配置紫杉醇乙醇溶液
将紫杉醇溶于100 mL乙醇中,配置成2 mg/mL的紫杉醇乙醇溶液。
(6)制备槲皮素壳聚糖纳米粒子悬浮液
在持续匀速500 r/min的搅拌速度下,按照壳聚糖、槲皮素、三聚磷酸钠质量比为1:1:1的比例,取2 mg/mL的壳聚糖溶液100 mL、2 mg/mL的槲皮素乙醇溶液100 mL、1 mg/mL的三聚磷酸钠溶液200 mL,将槲皮素乙醇溶液、三聚磷酸钠溶液,以20滴/min的速度逐滴滴入壳聚糖溶液中,得到槲皮素壳聚糖纳米粒子悬浮液。
(7)制备槲皮素抗体溶液
取1 mg/mL西妥昔单抗1 mL与槲皮素壳聚糖纳米粒子悬浮液混合后,再与80 mg的1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)和120 mg的N-羟基琥珀酰亚胺(NHS)反应24小时,蒸馏水透析3天后,用0.45 μm的微孔滤膜过滤,作为A液。
(8)制备紫杉醇壳聚糖纳米粒子悬浮液
在持续匀速500 r/min的搅拌速度下,按照壳聚糖、紫杉醇、三聚磷酸钠质量比为1:1:1的比例,取2 mg/mL的壳聚糖溶液100 mL, 2 mg/mL的紫杉醇乙醇溶液100 mL和1 mg/mL的三聚磷酸钠溶液200 mL,将紫杉醇乙醇溶液、三聚磷酸钠溶液以20滴/min的速度逐滴滴入壳聚糖溶液中,得到紫杉醇壳聚糖纳米粒子悬浮液。
(9)制备紫杉醇抗体溶液
取1 mg/mL西妥昔单抗1 mL与紫杉醇壳聚糖纳米粒子悬浮液混合后,再与80 mg的EDC 120 mg 的NHS反应24小时,蒸馏水透析3天后,用0.45 μm的微孔滤膜过滤,作为B液。
(10)制备赋形剂溶液
将上述重量份的赋形剂、羟丙基β-环糊精和卵磷脂溶于400 mL蒸馏水中,配置成赋形剂含量为0.25%的溶液,作为C液。
(11)混合过滤
将A液与B液在500 r/min的转速下连续搅拌的情况下,倒入C液中持续搅拌,用0.45 μm的微孔滤膜过滤。
(12)喷雾干燥
将步骤(11)中所得的续滤液经蠕动泵导入Büchi290小型喷雾干燥器的双流向螺旋式喷嘴;
喷雾干燥“一步”制得聚合粒子粉末,喷雾干燥条件为:喷雾干燥进口温度125℃,出口温度90℃,喷嘴流速300 L/h,进样速度30 mL/min,,在干燥器中收集聚合粒子粉末。即可得到负载槲皮素/壳聚糖纳米粒和紫杉醇/壳聚糖纳米粒的聚合粒子。
结果显示:
(1)本发明实施例1所得聚合粒子纳米粒的粒径为50~120 nm,槲皮素与紫杉醇共输送肺吸入纳米靶向多孔聚合粒子的粒径为3~10 µm,槲皮素与紫杉醇载药量分别为10.17%和30.08%,包封率分别为69.8%和75.2%,粒径分布均匀。
(2)本发明实施例1所制备的聚合粒子,易崩解,释放的纳米粒在肺部的滞留率高,本发明实施例1制备的聚合粒子,负载着大量纳米粒子,随着时间的延长,吸湿率明显增加,聚合粒子在拟肺部湿度和温度(湿度为60%RH,温度25℃时)的环境下,平衡时(24 h)的吸湿率达到了16.89%,作为一级载体的聚合粒子容易溶解,释放载药纳米粒,释放的纳米粒在肺部的滞留率为78.47%。
(3)本发明实施例1制备的聚合粒子,具有缓释效应,体外释放结果表明纳米聚合粒子在两天内都具有缓释效应,前2 h累积释放了21.87%,12 h累积释放了40.60%,48 h累积释放了41.40%。
(4)本发明实施例1制备的聚合粒子,能显著延长有效血药浓度;
采用大鼠进行试验,药动实验结果表明该纳米聚合粒子能显著延长有效血药浓度,本发明实施例1制备的聚合粒子,能显著延长有效血药浓度,槲皮素和紫杉醇达到最大血药浓度时间Tmax均为1h,槲皮素和紫杉醇单独使用时,达到最大血药浓度时间Tmax均为0.083h。
(5)本发明实施例1制备的聚合粒子,使得大鼠体内的紫杉醇消除行为减缓、提高生物利用度,显著改变紫杉醇体内的药动学行为而发挥协同作用,本发明实施例1制备的聚合粒子,紫杉醇的半衰期为2.052 h,槲皮素的半衰期为2.891 h,紫杉醇单独使用时的半衰期为1.53 h;槲皮素单独使用时的半衰期为0.32 h;本发明实施例1制备的聚合粒子,生物利用度高,槲皮素和紫杉醇的曲线下面积(0-末点)AUC0-t 分别为29.544 mg·L−1·h−1、57.391 mg·L−1·h−1。
(6)本发明实施例1制备的聚合粒子,使实验肺癌大鼠的存活时间比单独使用同剂量紫杉醇的存活时间延长了20天。
(7)本发明实施例1制备的聚合粒子,在体外实验中,对A549 细胞增殖的抑制率为74.27%。
表1 不同药物组对肺癌大鼠存活时间的影响 (mg/kg)
所述给药浓度,指每kg大鼠给药的剂量,各实验组均给一次药。
表2本发明实施例1制备的聚合粒子对 A549 细胞增殖的影响(24h, x ±s)
上述表2中的剂量,是指加入到培养液中有效成分的浓度。
表3 本发明实施例1制备的聚合粒子部分药动学参数结果 (mg/kg)
实施例2一种槲皮素与紫杉醇共输送肺吸入纳米靶向多孔聚合粒子
所述聚合粒子,各组分质量比为:
壳聚糖、槲皮素、紫杉醇、三聚磷酸钠、西妥昔单抗、磷脂衍生物、羟丙基β-环糊精、赋形剂质量比为4:1:1:2:0.02:3:5:10;
所述壳聚糖分子量为660 Kda,脱乙酰度大于95%;
所述磷脂衍生物为二棕榈酰磷脂酰胆碱DPPC;
所述西妥昔单抗,浓度为1 mg/mL;
所述赋形剂为甘露醇。
所述槲皮素与紫杉醇共输送肺吸入纳米靶向多孔聚合粒子,其制备方法包括以下步骤:
(1)称量
按照上述聚合粒子的质量比例,称取各组分;
称取壳聚糖400 mg,槲皮素100 mg、紫杉醇100 mg、三聚磷酸钠200 mg、西妥昔单抗2 mL、DPPC 300 mg、羟丙基β-环糊精500 mg、赋形剂1000 mg。
(2)配置壳聚糖溶液
将壳聚糖粉末溶解在400 mL质量分数为1%的醋酸溶液中,制备成1 mg/mL的壳聚糖溶液。
(3)配置槲皮素乙醇溶液
将槲皮素溶于100 mL乙醇中,配置成1 mg/mL的槲皮素乙醇溶液。
(4)配制三聚磷酸钠溶液
将三聚磷酸钠溶于200 mL蒸馏水,配制成的1 mg/mL三聚磷酸钠溶液。
(5)配置紫杉醇乙醇溶液
将紫杉醇溶于100 mL乙醇中,配置成1 mg/mL的紫杉醇乙醇溶液。
(6)制备槲皮素壳聚糖纳米粒子悬浮液
在持续匀速200 r/min的搅拌速度下,取1 mg/mL的壳聚糖溶液200 mL, 1 mg/mL的槲皮素乙醇100 mL溶液和1 mg/mL的三聚磷酸钠溶液100 mL;按照壳聚糖、槲皮素、三聚磷酸钠质量比为2:1:1的比例,将槲皮素乙醇溶液、三聚磷酸钠溶液分别以10滴/min的速度逐滴滴入所述壳聚糖溶液中,得到槲皮素壳聚糖纳米粒子悬浮液。
(7)制备槲皮素抗体溶液
取1 mg/mL西妥昔单抗1 mL与槲皮素壳聚糖纳米粒子悬浮液混合后,再与80 mg的1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)和120 mg的N-羟基琥珀酰亚胺(NHS)反应24小时,蒸馏水透析3天后,用0.45 μm的微孔滤膜过滤,作为A液。
(8)制备紫杉醇壳聚糖纳米粒子悬浮液
在持续匀速200 r/min的搅拌速度下,取1 mg/mL的壳聚糖溶液200 mL, 1 mg/mL的紫杉醇乙醇溶液100 mL和1 mg/mL的三聚磷酸钠溶液100 mL,按照壳聚糖、紫杉醇、三聚磷酸钠质量比为2:1:1的比例,将紫杉醇乙醇溶液、三聚磷酸钠溶液分别以10滴/min的速度逐滴滴入所述壳聚糖溶液中,得到紫杉醇壳聚糖纳米粒子悬浮液。
(9)制备紫杉醇抗体溶液
取1mg/mL西妥昔单抗1mL与壳聚糖纳米粒子悬浮液混合后,再与80 mg的EDC, 120 mg 的NHS反应24小时,蒸馏水透析3天后,用0.45 μm的微孔滤膜过滤,作为B液。
(10)制备赋形剂溶液
将上述重量份的赋形剂、羟丙基β-环糊精和DPPC溶于400 mL蒸馏水中,配置成赋形剂含量为0.25%的溶液,作为C液。
(11)混合过滤
将A液与B液在200 r/min的转速下连续搅拌的情况下,倒入C液中持续搅拌,用0.45 μm的微孔滤膜过滤。
(12)喷雾干燥
将步骤(11)中所得的续滤液经蠕动泵导入Büchi290小型喷雾干燥器的双流向螺旋式喷嘴;
喷雾干燥“一步”制得聚合粒子粉末,喷雾干燥条件为:喷雾干燥进口温度140℃,出口温度110℃,喷嘴流速520 L/h,进样速度55 mL/min,,在干燥器中收集聚合粒子粉末。即可得到负载槲皮素/壳聚糖纳米粒和紫杉醇/壳聚糖纳米粒的聚合粒子。
结果显示:
(1)本发明实施例2所得组成聚合粒子纳米粒的粒径为150~420 nm,槲皮素与紫杉醇共输送肺吸入纳米靶向多孔聚合粒子的粒径为3~10 µm,槲皮素与紫杉醇载药量分别为5.87%和20.18%,包封率分别为75.8%和86.1%,粒径分布均匀。
(2)本发明实施例2所制备的聚合粒子,易崩解,释放的纳米粒在肺部的滞留率高,本发明实施例2制备的聚合粒子,负载着大量纳米粒子,随着时间的延长的吸湿率明显增加,聚合粒子在拟肺部湿度和温度(湿度为60%RH,温度25℃时)的环境下,平衡时(24 h)的吸湿率达到了13.15%,作为一级载体的聚合粒子容易溶解,释放载药纳米粒,释放的纳米粒在肺部的滞留率为69.24%。
(3)本发明实施例2制备的聚合粒子,具有缓释效应,体外释放结果表明纳米聚合粒子在两天内都具有缓释效应前2 h累积释放了17.65%,12 h累积释放了38.21%,48 h累积释放了44.47%。
(4)本发明实施例2制备的聚合粒子,能显著延长有效血药浓度;
采用大鼠进行试验,药动实验结果表明该纳米聚合粒子能显著延长有效血药浓度,紫杉醇在体内完全释放的时间从单独使用的2 h延长到联合使用的7 h。本发明实施例2制备的聚合粒子,能显著延长有效血药浓度,槲皮素和紫杉醇达到最大血药浓度时间Tmax均为0.5 h,槲皮素和紫杉醇单独使用时,达到最大血药浓度时间Tmax均为0.053 h。
(5)本发明实施例2制备的聚合粒子,使得大鼠体内的紫杉醇消除行为减缓、提高生物利用度,显著改变紫杉醇体内的药动学行为而发挥协同作用。本发明实施例2制备的聚合粒子,紫杉醇的半衰期为1.752 h,槲皮素的半衰期为1.791h,紫杉醇单独使用时的半衰期为1.31 h;槲皮素单独使用时的半衰期为0.251h;本发明实施例2制备的聚合粒子,生物利用度高,槲皮素和紫杉醇的曲线下面积(0-末点)AUC0-t 分别为21.544 mg·L−1·h−1、42.391 mg·L−1·h−1。
(6)本发明实施例2制备的聚合粒子,使实验肺癌大鼠的存活时间比单独使用同剂量紫杉醇的存活时间延长了12天。
(7)本发明实施例2制备的聚合粒子,在体外实验中,对A549 细胞增殖的抑制率为59.38%。
表4不同药物组对肺癌大鼠存活时间的影响 (mg/kg)
所述给药浓度,指每kg大鼠给药的剂量,各实验组均给一次药。
表5本发明实施例2制备的聚合粒子对 A549 细胞增殖的影响(24h,x±s)
上述表5中的剂量,是指加入到培养液中有效成分的浓度。
表6本发明实施例2制备的聚合粒子部分药动学参数结果 (mg/kg)
实施例3一种槲皮素与紫杉醇共输送肺吸入纳米靶向多孔聚合粒子
所述聚合粒子,各组分质量比为:
壳聚糖、槲皮素、紫杉醇、三聚磷酸钠、西妥昔单抗、磷脂衍生物、羟丙基β-环糊精、赋形剂质量比为5:2:2:5:0.02:1:5:10;
所述壳聚糖分子量为160 Kda,脱乙酰度大于95%;
所述磷脂衍生物为1,2-棕榈酰磷脂酰甘油钠盐DPPG;
所述西妥昔单抗,浓度为1mg/mL;
所述赋形剂为海藻糖。
所述槲皮素与紫杉醇共输送肺吸入纳米靶向多孔聚合粒子,其制备方法包括以下步骤:
(1)称量
按照上述聚合粒子的质量比例,称取各组分;
称取壳聚糖500mg、槲皮素200 mg、紫杉醇200 mg、三聚磷酸钠500 mg、西妥昔单抗2 mL、DPPG 100 mg、羟丙基β-环糊精500 mg、赋形剂1000 mg。
(2)配置壳聚糖溶液
将壳聚糖粉末溶解在500 mL质量分数为1%的醋酸溶液中,制备成1 mg/mL的壳聚糖溶液。
(3)配置槲皮素乙醇溶液
将槲皮素溶于200 mL乙醇中,配置成的1mg/mL槲皮素乙醇溶液。
(4)配制三聚磷酸钠溶液
将三聚磷酸钠溶于500 mL蒸馏水,配制成的1mg/mL三聚磷酸钠溶液。
(5)配置紫杉醇乙醇溶液
将紫杉醇溶于200 mL乙醇中,配置成1 mg/mL的紫杉醇乙醇溶液。
(6)制备槲皮素壳聚糖纳米粒子悬浮液
在持续匀速600 r/min的搅拌速度下,取1 mg/mL的壳聚糖溶液250 mL, 1 mg/mL的槲皮素乙醇溶液200 mL和1 mg/mL的三聚磷酸钠溶液250 mL,按照壳聚糖、槲皮素、三聚磷酸钠质量比为2.5:2:2.5的比例,将槲皮素乙醇溶液、三聚磷酸钠溶液分别以30滴/min的速度逐滴滴入所述壳聚糖溶液中,得到槲皮素壳聚糖纳米粒子悬浮液。
(7)制备槲皮素抗体溶液
取1mg/mL西妥昔单抗1 mL与步骤(6)所述悬浮液混合后,再与80 mg的1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐和120 mg的N-羟基琥珀酰亚胺反应24小时,蒸馏水透析3天后,用0.45 μm的微孔滤膜过滤,作为A液。
(8)制备紫杉醇壳聚糖纳米粒子悬浮液
在持续匀速600 r/min的搅拌速度下,取1 mg/mL的壳聚糖溶液250 mL, 1 mg/mL的紫杉醇乙醇溶液200 mL和1 mg/mL的三聚磷酸钠溶液250 mL,按照壳聚糖、紫杉醇、三聚磷酸钠质量比为2.5:2:2.5的比例,将紫杉醇乙醇溶液、三聚磷酸钠溶液分别以30滴/min的速度逐滴滴入所述壳聚糖溶液中,得到紫杉醇壳聚糖纳米粒子悬浮液。
(9)制备紫杉醇抗体溶液
取1 mg/mL西妥昔单抗1 mL与步骤(8)所得悬浮液混合后,再与80 mg的EDC 、120 mg 的NHS反应24小时,蒸馏水透析3天后,用0.45 μm的微孔滤膜过滤,作为B液。
(10)制备赋形剂溶液
将上述重量份的赋形剂、羟丙基β-环糊精和DPPG溶于200 mL蒸馏水中,配置成赋形剂含量为0.5%的溶液,作为C液。
(11)混合过滤
将A液与B液在600 r/min的转速下连续搅拌的情况下,倒入C液中持续搅拌,用0.45 μm的微孔滤膜过滤。
(12)喷雾干燥
将步骤(11)中所得的续滤液经蠕动泵导入Büchi290小型喷雾干燥器的双流向螺旋式喷嘴;
喷雾干燥“一步”制得聚合粒子粉末,喷雾干燥条件为:喷雾干燥进口温度125℃,出口温度100℃,喷嘴流速300 L/h,进样速度55 mL/min,,在干燥器中收集聚合粒子粉末。即可得到负载槲皮素/壳聚糖纳米粒和紫杉醇/壳聚糖纳米粒的聚合粒子。
结果显示,
(1)本发明实施例3所得组成聚合粒子纳米粒的粒径为90~270 nm,槲皮素与紫杉醇共输送肺吸入纳米靶向多孔聚合粒子的粒径为3~10 µm,槲皮素与紫杉醇载药量为14.61%和39.67%,包封率为88.36%和69.75%,粒径分布均匀。
(2)本发明实施例3所制备聚合粒子,易崩解,释放的纳米粒在肺部的滞留率高,本发明实施例3制备的聚合粒子负载着大量纳米粒子,随着时间的延长的吸湿率明显增加,聚合粒子在拟肺部湿度和温度(湿度为60%RH,温度25℃时)的环境下,平衡时(24 h)的吸湿率达到了20.14,作为一级载体的聚合粒子容易溶解,释放载药纳米粒,释放的纳米粒在肺部的滞留率为62.27%。
(3)本发明实施例3制备的聚合粒子,具有缓释效应,体外释放结果表明纳米聚合粒子在两天内都具有缓释效应前2 h累积释放了25.31%,12 h累积释放了31.76%,48 h累积释放了52.59%。
(4)本发明实施例3制备的聚合粒子,能显著延长有效血药浓度;
采用大鼠进行试验,药动实验结果表明该纳米聚合粒子能显著延长有效血药浓度,紫杉醇在体内完全释放的时间从单独使用的3 h延长到联合使用的9 h。本发明实施例3制备的聚合粒子,能显著延长有效血药浓度,槲皮素和紫杉醇达到最大血药浓度时间Tmax均为1.1 h,槲皮素和紫杉醇单独使用时,达到最大血药浓度时间Tmax均为0.093 h。
(5)本发明实施例3制备的聚合粒子,使得大鼠体内的紫杉醇消除行为减缓、提高生物利用度,显著改变紫杉醇体内的药动学行为而发挥协同作用。本发明实施例3制备的聚合粒子,紫杉醇的半衰期为3.851 h,槲皮素的半衰期为2.091 h,紫杉醇单独使用时的半衰期为2.17 h;槲皮素单独使用时的半衰期为0.511 h;本发明实施例3制备的聚合粒子,生物利用度高,槲皮素和紫杉醇的曲线下面积(0-末点)AUC0-t 分别为29.513 mg·L−1·h−1、48.417 mg·L−1·h−1。
(6)本发明实施例3制备的聚合粒子,使实验肺癌大鼠的存活时间比单独使用同剂量紫杉醇的存活时间延长了21天。
(7)本发明实施例3制备的聚合粒子,在体外实验中,对A549 细胞增殖的抑制率为69.83%。
表7不同药物组对肺癌大鼠存活时间的影响 (mg/kg)
所述给药浓度,指每kg大鼠给药的剂量,各实验组均给一次药。
表8本发明实施例3制备的聚合粒子对 A549 细胞增殖的影响(24 h, x ±s)
上述表8中的剂量,是指加入到培养液中有效成分的浓度。
表9本发明实施例3制备的聚合粒子部分药动学参数结果 (mg/kg)
实施例4一种槲皮素与紫杉醇共输送肺吸入纳米靶向多孔聚合粒子
所述聚合粒子,各组分质量比为:
壳聚糖、槲皮素、紫杉醇、三聚磷酸钠、西妥昔单抗、磷脂衍生物、羟丙基β-环糊精、赋形剂质量比为5:1:1:2:0.04:2:5:15;
所述壳聚糖分子量为160 Kda,脱乙酰度大于95%;
所述磷脂衍生物为二硬脂酰磷脂酸胆碱DSPC;
所述西妥昔单抗,浓度为1 mg/mL;
所述赋形剂为亮氨酸。
所述槲皮素与紫杉醇共输送肺吸入纳米靶向多孔聚合粒子,其制备方法包括以下步骤:
(1)称量
按照上述聚合粒子的质量比例,称取各组分;
称取壳聚糖500 mg、槲皮素100 mg、紫杉醇100 mg、三聚磷酸钠200 mg、西妥昔单抗4 mL、磷脂200 mg、羟丙基β-环糊精500 mg、赋形剂1500 mg。
(2)配置壳聚糖溶液
将壳聚糖粉末溶解在500 mL质量分数为1%的醋酸溶液中,制备成1 mg/mL的壳聚糖溶液。
(3)配置槲皮素乙醇溶液
将槲皮素溶于100 mL乙醇中,配置成的1mg/mL槲皮素乙醇溶液。
(4)配制三聚磷酸钠溶液
将三聚磷酸钠溶于200 mL蒸馏水,配制成的1 mg/mL三聚磷酸钠溶液。
(5)配置紫杉醇乙醇溶液
将紫杉醇溶于100 mL乙醇中,配置成1 mg/mL的紫杉醇乙醇溶液。
(6)制备槲皮素壳聚糖纳米粒子悬浮液
在持续匀速400 r/min的搅拌速度下,取1 mg/mL的壳聚糖溶液250 mL, 1 mg/mL的槲皮素乙醇溶液100 mL和1 mg/mL的三聚磷酸钠溶液100 mL,按照壳聚糖、槲皮素、三聚磷酸钠质量比为2.5:1:1的比例,将槲皮素乙醇溶液、三聚磷酸钠溶液分别以40滴/min的速度逐滴滴入所述壳聚糖溶液中,得到槲皮素壳聚糖纳米粒子悬浮液。
(7)制备槲皮素抗体溶液
取1 mg/mL西妥昔单抗1 mL与步骤(6)所得悬浮液混合后,再与80 mg的1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐和120 mg的N-羟基琥珀酰亚胺反应24小时,蒸馏水透析3天后,用0.45 μm的微孔滤膜过滤,作为A液。
(8)制备紫杉醇壳聚糖纳米粒子悬浮液
在持续匀速400 r/min的搅拌速度下,取1 mg/mL的壳聚糖溶液250 mL, 1 mg/mL的紫杉醇乙醇溶液100 mL和1 mg/mL的三聚磷酸钠溶液100 mL,按照壳聚糖、紫杉醇、三聚磷酸钠质量比为2.5:1:1的比例,将紫杉醇乙醇溶液、三聚磷酸钠溶液分别以40滴/min的速度逐滴滴入所述壳聚糖溶液中,得到紫杉醇壳聚糖纳米粒子悬浮液。
(9)制备紫杉醇抗体溶液
取1 mg/mL西妥昔单抗2 mL与步骤(8)所述悬浮液混合后,再与80 mg的EDC 120 mg 的NHS反应24小时,蒸馏水透析3天后,用0.45 μm的微孔滤膜过滤,作为B液。
(10)制备赋形剂溶液
将上述重量份的赋形剂、羟丙基β-环糊精和DSPC溶于200 mL蒸馏水中,配置成赋形剂含量为0.75%的溶液,作为C液。
(11)混合过滤
将A液与B液在400 r/min的转速下连续搅拌的情况下,倒入C液中持续搅拌,用0.45 μm的微孔滤膜过滤。
(12)喷雾干燥
将步骤(11)中所得的续滤液经蠕动泵导入Büchi290小型喷雾干燥器的双流向螺旋式喷嘴;
喷雾干燥“一步”制得聚合粒子粉末,喷雾干燥条件为:喷雾干燥进口温度140℃,出口温度100℃,喷嘴流速520 L/h,进样速度55 mL/min,,在干燥器中收集聚合粒子粉末。即可得到负载槲皮素/壳聚糖纳米粒和紫杉醇/壳聚糖纳米粒的聚合粒子。
结果显示,
(1)本发明实施例4所得组成聚合粒子纳米粒的粒径为150~420 nm,槲皮素与紫杉醇共输送肺吸入纳米靶向多孔聚合粒子的粒径为1~8 µm,槲皮素与紫杉醇的载药量为10.17%与25.41%,包封率为86.67%与79.68%,粒径分布均匀。
(2)本发明实施例4所制备的聚合粒子,易崩解,释放的纳米粒在肺部的滞留率高,本发明实施例4制备的聚合粒子,负载着大量纳米粒子,随着时间的延长,吸湿率明显增加,聚合粒子在拟肺部湿度和温度(湿度为60%RH,温度25℃时)的环境下,平衡时(24 h)的吸湿率达到了18.68%,作为一级载体的聚合粒子容易溶解,释放载药纳米粒,释放的纳米粒在肺部的滞留率为69.17%。
(3)本发明实施例4制备的聚合粒子,具有缓释效应,体外释放结果表明纳米聚合粒子在两天内都具有缓释效应前2 h累积释放了17.65%,12 h累积释放了35.17%,48 h累积释放了45.77%。
(4)本发明实施例4制备的聚合粒子,能显著延长有效血药浓度;
采用大鼠进行试验,药动实验结果表明该纳米聚合粒子能显著延长有效血药浓度,紫杉醇在体内完全释放的时间从单独使用的 1.8 h延长到联合使用的6.2 h。本发明实施例4制备的聚合粒子,能显著延长有效血药浓度,槲皮素和紫杉醇达到最大血药浓度时间Tmax均为1 h,槲皮素和紫杉醇单独使用时,达到最大血药浓度时间Tmax均为0.088 h。
(5)本发明实施例4制备的聚合粒子,使得大鼠体内的紫杉醇消除行为减缓、提高生物利用度,显著改变紫杉醇体内的药动学行为而发挥协同作用。本发明实施例4制备的聚合粒子,紫杉醇的半衰期为3.151 h,槲皮素的半衰期为1.591 h,紫杉醇单独使用时的半衰期为2.23 h;槲皮素单独使用时的半衰期为0.326 h;本发明实施例4制备的聚合粒子,生物利用度高,槲皮素和紫杉醇的曲线下面积(0-末点)AUC0-t 分别为18.376 mg·L−1·h−1、38.761 mg·L−1·h−1。
(6)本发明实施例4制备的聚合粒子,使实验肺癌大鼠的存活时间比单独使用同剂量紫杉醇的存活时间延长了18天。
(7)本发明实施例4制备的聚合粒子,在体外实验中,对A549 细胞增殖的抑制率为56.86%。
表10不同药物组对肺癌大鼠存活时间的影响 (mg/kg)
所述给药浓度,指每kg大鼠给药的剂量。
表11本发明实施例4制备的聚合粒子对 A549 细胞增殖的影响(24 h, x ±s)
上述表11中的剂量,是指加入到培养液中有效成分的浓度。
表12本发明实施例4制备的聚合粒子部分药动学参数结果 (mg/kg)
实施例5一种槲皮素与紫杉醇共输送肺吸入纳米靶向多孔聚合粒子
所述聚合粒子,各组分质量比为:
壳聚糖、槲皮素、紫杉醇、三聚磷酸钠、西妥昔单抗、磷脂或其衍生物、羟丙基β-环糊精、赋形剂质量比为5:2:2:5:0.02:4:5:15;
所述壳聚糖分子量为160 Kda,脱乙酰度大于95%;
所述磷脂衍生物为二棕榈酰基磷脂酰乙醇胺DPPE;
所述西妥昔单抗,浓度为1 mg/mL;
所述赋形剂为亮氨酸。
所述槲皮素与紫杉醇共输送肺吸入纳米靶向多孔聚合粒子,其制备方法包括以下步骤:
(1)称量
按照上述聚合粒子的质量比例,称取各组分;
称取壳聚糖500 mg、槲皮素200 mg、紫杉醇200 mg、三聚磷酸钠500 mg、西妥昔单抗2 mL、DPPE 400 mg、羟丙基β-环糊精500 mg、赋形剂1500 mg。
(2)配置壳聚糖溶液
将壳聚糖粉末溶解在500 mL质量分数为1%的醋酸溶液中,制备成1 mg/mL的壳聚糖溶液。
(3)配置槲皮素乙醇溶液
将槲皮素溶于200 mL乙醇中,配置成1 mg/mL的槲皮素乙醇溶液。
(4)配制三聚磷酸钠溶液
将三聚磷酸钠溶于500 mL蒸馏水,配制成1 mg/mL的三聚磷酸钠溶液。
(5)配置紫杉醇乙醇溶液
将紫杉醇溶于200 mL乙醇中,配置成1 mg/mL的紫杉醇乙醇溶液。
(6)制备槲皮素壳聚糖纳米粒子悬浮液
在持续匀速300 r/min的搅拌速度下,取1 mg/mL的壳聚糖溶液250 mL, 1 mg/mL的槲皮素乙醇溶液200 mL和1 mg/mL的三聚磷酸钠溶液250 mL,按照壳聚糖、槲皮素、三聚磷酸钠质量比为2.5:2:2.5的比例,将槲皮素乙醇溶液、三聚磷酸钠溶液分别以50滴/min的速度逐滴滴入所述壳聚糖溶液中,得到槲皮素壳聚糖纳米粒子悬浮液。
(7)制备槲皮素抗体溶液
取1 mg/mL西妥昔单抗1 mL与步骤(6)所得悬浮液混合后,再与80 mg的1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐和120 mg的N-羟基琥珀酰亚胺(EDC和NHS)反应24小时,蒸馏水透析3天后,用0.45 μm的微孔滤膜过滤,作为A液。
(8)制备紫杉醇壳聚糖纳米粒子悬浮液
在持续匀速300 r/min的搅拌速度下,取1 mg/mL的壳聚糖溶液250 mL, 1 mg/mL的紫杉醇乙醇溶液200 mL和1 mg/mL的三聚磷酸钠溶液250 mL,按照壳聚糖、紫杉醇、三聚磷酸钠质量比为2.5:2:2.5的比例以50滴/min的速度逐滴滴入所述壳聚糖溶液中,得到紫杉醇壳聚糖纳米粒子悬浮液。
(9)制备紫杉醇抗体溶液
取1 mg/mL西妥昔单抗1 mL与步骤(8)所得悬浮液混合后,再与80 mg的EDC 120 mg 的NHS反应24小时,蒸馏水透析3天后,用0.45 μm的微孔滤膜过滤,作为B液。
(10)制备赋形剂溶液
将上述重量份的赋形剂、羟丙基β-环糊精和磷脂或其衍生物溶于200 mL蒸馏水中,配置成赋形剂含量为0.75%的溶液,作为C液。
(11)混合过滤
将A液与B液在300 r/min的转速下连续搅拌的情况下,倒入C液中持续搅拌,用0.45 μm的微孔滤膜过滤。
(12)喷雾干燥
将步骤(11)中所得的续滤液经蠕动泵导入Büchi290小型喷雾干燥器的双流向螺旋式喷嘴;
喷雾干燥“一步”制得聚合粒子粉末,喷雾干燥条件为:喷雾干燥进口温度125℃,出口温度100℃,喷嘴流速300 L/h,进样速度55 mL/min,,在干燥器中收集聚合粒子粉末。即可得到负载槲皮素/壳聚糖纳米粒和紫杉醇/壳聚糖纳米粒的聚合粒子。
结果显示,
(1)本发明实施例5所得组成聚合粒子纳米粒的粒径为90~209 nm,槲皮素与紫杉醇共输送肺吸入纳米靶向多孔聚合粒子的粒径为1~6 µm,槲皮素与紫杉醇载药量为7.68%和34.54%,包封率为95.2%和87.4%,粒径分布均匀。
(2)本发明实施例5所制备的聚合粒子,易崩解,释放的纳米粒在肺部的滞留率高,本发明实施例5制备的聚合粒子,负载着大量纳米粒子,随着时间的延长的吸湿率明显增加,聚合粒子在拟肺部湿度和温度(湿度为60%RH,温度25℃时)的环境下,平衡时(24 h)的吸湿率达到了19.61%,作为一级载体的聚合粒子容易溶解,释放载药纳米粒,释放的纳米粒在肺部的滞留率为72.43%。
(3)本发明实施例5制备的聚合粒子,具有缓释效应,体外释放结果表明纳米聚合粒子在两天内都具有缓释效应前2 h累积释放了15.17%,12 h累积释放了28.51%,48 h累积释放了37.71%。
(4)本发明实施例5制备的聚合粒子,能显著延长有效血药浓度;
采用大鼠进行试验,药动实验结果表明该纳米聚合粒子能显著延长有效血药浓度,紫杉醇在体内完全释放的时间从单独使用的2.7 h延长到联合使用的8.6 h。本发明实施例5制备的聚合粒子,能显著延长有效血药浓度,槲皮素和紫杉醇达到最大血药浓度时间Tmax均为1 h,槲皮素和紫杉醇单独使用时,达到最大血药浓度时间Tmax均为0.043 h。
(5)本发明实施例5制备的聚合粒子,使得大鼠体内的紫杉醇消除行为减缓、提高生物利用度,显著改变紫杉醇体内的药动学行为而发挥协同作用。本发明实施例5制备的聚合粒子,紫杉醇的半衰期为3.871 h,槲皮素的半衰期为1.421 h,紫杉醇单独使用时的半衰期为1.962 h;槲皮素单独使用时的半衰期为0.266 h。本发明实施例5制备的聚合粒子,生物利用度高,槲皮素和紫杉醇的曲线下面积(0-末点)AUC0-t 分别为14.876 mg·L−1·h−1、41.141 mg·L−1·h−1。
(6)本发明实施例5制备的聚合粒子,使实验肺癌大鼠的存活时间比单独使用同剂量紫杉醇的存活时间延长了19天。
(7)本发明实施例5制备的聚合粒子,在体外实验中,对A549 细胞增殖的抑制率为51.03%。
表13不同药物组对肺癌大鼠存活时间的影响 (mg/kg)
所述给药浓度,指每kg大鼠给药的剂量,各实验组均给一次药。
表14本发明实施例5制备的聚合粒子对 A549 细胞增殖的影响(24 h,x ±s)
上述表14中的剂量,是指加入到培养液中有效成分的浓度。
表15本发明实施例5制备的聚合粒子部分药动学参数结果 (mg/kg)
除非另有说明,本发明中所采用的百分数均为重量百分数,本发明所述的比例,均为质量比例。
最后应说明的是:以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!