细胞型Fas相关死亡区域蛋白样β白介素‑1转换酶抑制蛋白在治疗脂肪肝中的应用的制作方法
本发明属于基因的功能与应用领域,特别涉及一种细胞型Fas相关死亡区域蛋白样β白介素-1转换酶抑制蛋白(cellularFas-assiciateddeathdomain-likeinterleukin-1β-convertingenzyme(FLICE)-likeinhibitoryprotein,cFLIP)作为靶基因在制备预防、缓解和/或治疗脂肪肝的药物中应用。
背景技术:
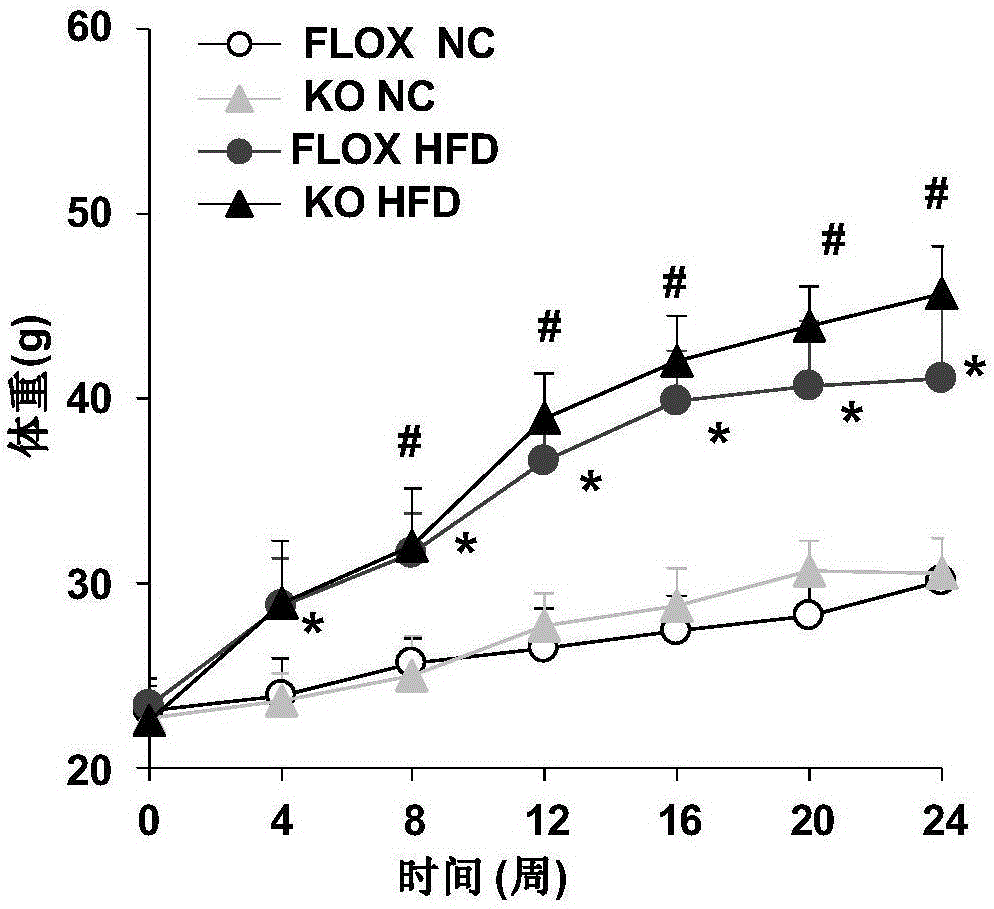
:脂肪肝是指由于各种原因引起的肝细胞内脂肪堆积过多的病变,为一种较为常见的临床不良表现,可由多种疾病诱发,是众多肝脏疾病对肝脏正常功能影响的综合表现,临床表现轻者无症状,重者可危及生命。脂肪肝包括酒精性肝病和非酒精性脂肪性肝病,两者都是全球常见的慢性肝病。非酒精性脂肪性肝病是一种与胰岛素抵抗及遗传易感性密切相关的代谢应激性疾病。随着人们生活水平的不断提高,患病率呈不断上升趋势。非酒精性脂肪肝性肝病不仅可导致转氨酶持续异常、失代偿期肝硬化、肝功能衰竭等严重肝病,也与心血管疾病、2型糖尿病、代谢综合征的发生存在密切联系,严重威胁着人们的健康。因此,非酒精性脂肪性肝病的治疗越来越受到重视,其治疗原则包括:(1)去除病因,治疗原发基础病;(2)基础治疗:生活方式干预、饮食调整及运动治疗等基本措施;(3)针对不同的病理学特征,因人而异与辅助药物治疗;(4)终末期行肝移植治疗。cFLIP是THOME[1]等于1997年首先在病毒中发现的,随后IRMLER等在恶性色素细胞瘤细胞中也发现了此蛋白的存在,即命名为cFLIP[2]。人类cFLIP基因位于2号染色体长臂33-34区,14个外显子,并通过选择性剪接产生多个基因[3]。该蛋白结构上与Caspase-8相似,但无Caspase-8的蛋白水解酶活性。它与含死亡结构域的Fas相关蛋白(Fasassociateddeathdomain,FADD)结合,使Caspase-8不能活化,抑制Caspase-8介导的蛋白酶级联反应,从而阻断Fas介导的死亡受体途径的细胞凋亡[4]。cFLIP不仅是经典的死亡受体介导外源性细胞凋亡通路,而且也不是常规的模式识别受体依赖性凋亡通路[5]。此外,最近的研究表明,cFLIP也参与被称为程序性的坏死或坏死的非凋亡细胞死亡通路。cFLIP的这些功能受异构体、浓度和组织特异性的方式调控,泛素蛋白酶体系统在调节cFLIP蛋白的稳定性有重要作用。参考文献[1].Thome,M.,etal.,ViralFLICE-inhibitoryproteins(FLIPs)preventapoptosisinducedbydeathreceptors.Nature,1997.386(6624):p.517-21.[2].Clarke,P.,etal.,InhibitionofNF-kappaBactivityandcFLIPexpressioncontributetoviral-inducedapoptosis.Apoptosis,2005.10(3):p.513-24.[3].Nakano,H.,etal.,CellularFLICE-InhibitoryProteinRegulatesTissueHomeostasis.CurrTopMicrobiolImmunol,2015.[4].Tsuchiya,Y.,O.NakabayashiandH.Nakano,FLIPtheSwitch:RegulationofApoptosisandNecroptosisbycFLIP.IntJMolSci,2015.16(12):p.30321-41.[5].Wittkopf,N.,etal.,CellularFLICE-likeinhibitoryproteinsecuresintestinalepithelialcellsurvivalandimmunehomeostasisbyregulatingcaspase-8.Gastroenterology,2013.145(6):p.1369-79.技术实现要素:为解决上述现有技术的缺陷和不足,本发明的目的在于提供一种cFLIP基因的表达与脂肪肝之间的相互关系,提供一个用于治疗脂肪肝的靶基因cFLIP的新用途,进而把cFLIP基因应用于脂肪肝的治疗。本发明的目的通过以下技术方案实现:本发明以cFLIP肝脏特异性基因敲除小鼠(cFLIP-KO)与cFLIP-flox小鼠为实验对象,通过高脂饮食诱导的肥胖小鼠模型(dietinducedobesity,DIO)研究cFLIP基因的功能,结果发现与cFLIP-flox小鼠对比,cFLIP-KO小鼠表现出肥胖,其体重明显高于同种饲料饲养的cFLIP-flox小鼠,从小鼠肝脏大体外观,肝脏重量及肝脏/体重比以及脂质成分病理染色结果等均说明HFD组(Highfatdiet,高脂饮食)的cFLIP-KO小鼠脂肪肝病变明显严重,脂质蓄积显著增加。这表明cFLIP基因敲除会加剧脂肪肝的发生,cFLIP基因能够抑制脂肪肝发生。本申请的研究证明了:在高脂诱导的脂肪肝模型中,cFLIP具有抑制肥胖,降低血糖,减少肝脏脂质蓄积,保护肝功能,特别是改善脂肪肝的作用。针对cFLIP的上述功能,提供cFLIP作为药物靶标在筛选保护肝脏的药物中的应用。针对cFLIP的上述功能,提供cFLIP作为药物靶标在筛选预防、缓解和/或治疗脂肪肝的药物中的应用。以上药物是指能够促进cFLIP基因表达的药物。本发明相对于现有技术具有如下的优点及效果:(1)本发明发现cFLIP基因的新功能,即cFLIP基因具有能够抑制脂肪肝的作用。(2)基于cFLIP在抑制脂肪肝中的作用,其可以用于制备预防、缓解和/或治疗脂肪肝的药物。附图说明图1是肝脏特异性cFLIP基因敲除小鼠的构建策略图。图2是cFLIP-flox和cFLIP-KO小鼠的体重结果图(*:p<0.05vscFLIP-floxNC组,**:p<0.01vscFLIP-floxNC组,#:p<0.05vscFLIP-floxHFD组,##:p<0.01vscFLIP-floxHFD组)。图3是cFLIp-KO和cFLIP-flox小鼠的肝脏大体外观结果图;A为肝脏重量,B为肝脏重量与小鼠本身体重比值统计柱状图(##:p<0.01vscFLIP-floxHFD组)。图4是cFLIP-flox和cFLIP-KO小鼠的HE和油红O染色图。图5是cFLIp-KO和cFLIP-flox小鼠肝脏脂质含量测定结果图,分别为肝脏甘油三酯、胆固醇以及游离脂肪酸含量测定结果(*:p<0.05vscFLIP-floxNC组,#:p<0.05vscFLIP-floxHFD)。具体实施方式通过以下详细说明结合附图可以进一步理解本发明的特点和优点。所提供的实施例仅是对本发明方法的说明,而不以任何方式限制本发明揭示的其余内容。实验用动物及饲养:实验动物种属,性别,周龄及来源:cFLIP-flox和cFLIP肝脏特异性基因敲除(cFLIP-KO)小鼠,雄性,8周龄。CFLIP肝脏特异性基因敲除小鼠(cFLIP-KO)由cFLIP-flox小鼠与受蛋白启动子控制、肝细胞特异性表达的Cre转基因小鼠Albumin-Cre(购自TheJacksonLaboratory,货号003574)杂交得到,构建策略见图1。肝脏特异性cFLIP基因敲除小鼠的构建:根据基因信息,利用CRISPRDesign(网址http://crispr.mit.edu/)分别在内含子2和4中各设计一个CRISPR的打靶位点。靶序列分别为:cFLIP-sgRNA1:GGAACCTAGGGGTTTTTTCCGGGGGcFLIP-sgRNA2:ggAATCGAAAAGTTGATATAAGCCAGG此外还设计了一个用于同源修复的供体质粒(DonorVector),它包括两侧同源臂、中间的外显子3以及两个同向的loxp序列。①打靶载体的构建:分别将sgRNA1和sgRNA2对应的两条引物融合成双链DNA,然后用T4DNA连接酶连入经过限制性内切酶BsaI处理过的pUC57-sgRNA载体中。该载体上游有一个T7启动子,可以用于后续的体外转录实验。②条件性敲除骨架载体pBluescriptSK(+)-2loxp的构建:分别合成4条寡聚单链核苷酸序列:loxp1-F:AGCTTGACGTCATAACTTCGTATAGCATACATTATAGCAATTTATACCGGTGATloxp1-R:ATCACCGGTATAAATTGCTATAATGTATGCTATACGAAGTTATGACGTCA;loxp2-F:GATCCCTTAAGATAACTTCGTATAGCATACATTATAGCAATTTATACGCGTA,loxp2-R:CTAGTACGCGTATAAATTGCTATAATGTATGCTATACGAAGTTATCTTAAGG;上述寡核苷酸序列退火后形成loxp1和loxp2两条双链。将pBluescriptIISK(+)载体用HindIII(NEB,R0104L)和EcoRV(NEB,R0195L)双酶切后连接入loxp1退火双链,再将测序正确的载体用BamHI(NEB,R0136L)和SpeI(NEB,R0133L)双酶切,连接入loxp2退火双链,得到条件性敲除骨架载体,命名为pBluescriptSK(+)-2loxp。③供体载体(DonorVector)的构建:根据引物设计原则,设计如下引物(表1)用于扩增供体载体的左右同源臂(LA和RA)以及中间的外显子部分(M)。扩增得到的产物经表1中所示限制性内切酶酶切后得到3个片段,将其分别连入条件性敲除骨架载体pBluescriptSK(+)-2loxp中,得到DonorVector。表1构建供体载体所需引物序列及对应酶切位点引物名称引物序列酶切位点cFLIPLA-FCCGCTCGAGTTATAGCCCACACAGGCTGAXhoIcFLIPLA-RATGGACGTCGAAAAAACCCCTAGGTTCCCAatIIcFLIPM-FCCGGAATTCCGGGGGAGTCTCTGCTTTEcoRIcFLIPM-RGGCGATATCGCCAGGCCTGTCAATTTTACEcoRVcFLIPRA-FCGACGCGTTTATATCAACTTTTCGATTTGACMluIcFLIPRA-RATAAGAATGCGGCCGCTATCAACATGGCGTCAGGAANotI④打靶载体的转录:对CRIPR/Cas9系统包含的两个部分(负责切割作用的Cas9蛋白和引导Cas9蛋白定位到靶位点的gRNA)分别进行转录。对于Cas9蛋白,将其表达载体(pST1374-Cas9)用PmeI进行酶切,以纯化后回收线性化质粒为转录模板,用T7mMESSAGEmMACHINE试剂盒(AM1345,Ambion)进行体外转录,获得加帽的mRNA产物。并用Poly(A)Tailing试剂盒(Ambion)对上述产物加尾,获得成熟的mRNA产物;对于sgRNA,使用MEGAshortscriptTMKit(AM1354,Ambion公司)进行体外转录。将转录得到的Cas9和sgRNA的mRNA使用miRNeasyMicroKit(Qiagen,217084)进行纯化。⑤cFLIP-floxed条件性敲除小鼠的制作将上述成熟的mRNA产物与供体质粒一同注入小鼠受精卵中,移植到代孕母鼠体内进行培育。得到的小鼠进行鉴定。取出生一周后的小鼠脚趾或尾部组织,提取基因组,并通过PCR方法筛选阳性首建鼠。从确定发生同源重组的小鼠中随机挑选一只作为F0代进行后续的繁殖,最终获得cFLIP-floxed纯合小鼠。⑥肝脏特异性cFLIP基因敲除小鼠的制作将上述cFLIP-floxed小鼠与肝脏特异性Albumin-Cre转基因小鼠交配,筛选得到cFLIPfloxed/floxed/Albumin-Cre小鼠,待该小鼠长至6周龄左右后,腹腔注射Tamoxifen,诱导Cre酶的表达,Cre酶特异性的识别两个同向的loxp,并切除两者之间的序列及其中的一个loxp,最后得到肝脏细胞特异性cFLIP基因敲除小鼠。实验动物饲料配方:高脂饲料(HFD)(购自北京华阜康生物科技有限公司,货号D12942):热量百分比:蛋白质:20%;碳水化合物:20%;脂肪:60%,总的热量质量比:5.24kcal/g。低脂饲料(NC)(购自北京华阜康生物科技有限公司,货号D12450B):热量百分比:蛋白质:20%;碳水化合物:70%;脂肪:10%,总的热量质量比:3.85kcal/g。饲养环境及条件:SPF级实验动物中心,室温在22-24℃之间,湿度在40-70%之间,明暗交替照明时间为12h,自由饮水摄食。【实施例1】小鼠脂肪肝(dietinducedobesity,DIO)获得(1)实验动物分组:选用8周龄,雄性,cFLIP-flox小鼠和cFLIP-KO小鼠,分别给与两种特殊饲料D12942高脂饲料(Highfatdiet,HFD)和D12450B低脂饲料(Normalchow,NC)饲养,即cFLIP-floxNC组,KONC组,cFLIP-floxHFD组,KOHFD组共4个组别。(2)模型通过高脂饲料诱导操作流程:采用cFLIP-flox和KO小鼠,建立DIO模型,进行表型相关分析,明确cFLIP基因对脂肪肝发挥的作用。选用8周龄,雄性,cFLIP-flox小鼠和cFLIP-KO小鼠,分别给与两种特殊饲料D12942高脂饲料(Highfatdiet,HFD)和D12450B低脂饲料(Normalchow,NC)饲养,即cFLIP-floxNC组,KONC组,cFLIP-floxHFD组,KOHFD组共4个组别。小鼠空腹体重和空腹血糖每隔4周检测1次。第24周终末取材,取出小鼠肝脏称重,一部分置于甲醛溶液中固定或O.C.T冰冻切片包埋剂(TissueFreezingMedium)包埋作为病理分析用。【实施例2】小鼠体重测定①禁食:上午8:00将待实验小鼠禁食(不禁水),下午2:00开始实验操作。②称重:分别在第0周、4周、8周、12周、16周、20周、24周称重,将一塑料小桶放在动态电子天平上,抓起小鼠,放入称量小桶中,测量体重记录数据。饲料量检测:待称体重操作完成后,给小鼠加饲料,并在动态电子天平上记录小鼠的饲料量。体重变化结果如图1所示,cFLIP-flox小鼠在给与HFD饲料饲养后,从第4周开始体重明显高于其NC饲料组,给与cFLIP-KO小鼠24周的HFD饲料和NC饲料饲养后,从第8周开始HFD组的cFLIP-KO小鼠体重明显高于HFD组的cFLIP-flox小鼠体重,一直持续到第24周(见图2A)。表明cFLIP基因敲除后显著影响了小鼠在HFD饲养状态下的体重。【实施例3】肝脏大体外观测定及病理染色(1)终末肝脏组织取材1)小鼠称重后,迅速脱颈处死。仰卧固定小鼠,用蒸馏水将小鼠胸部,腹部毛发润湿。2)用一镊子钳夹小鼠腹部正中皮肤,沿腹部正中向头部剪开皮肤至剑突下,向尾端剪开皮肤,逐层暴露皮下筋膜,肌肉等,打开腹腔,充分暴露各脏器。3)迅速找到并取下小鼠的肝脏,将取下的肝脏标本置于灭菌纱布上,拭干肝脏表面上残留血液,将肝脏置于无菌培养皿中,迅速称重。称重完成后的肝脏组织一部分用于制备冰冻及石蜡切片,另一部分置于-80℃冰箱中保存以备测定肝脏脂质含量。4)石蜡标本:切取部分肝脏置于10%中性福尔马林中固定。冰冻标本:切取部分肝脏,置于有OCT的锡纸模具中包埋,放在干冰上冰冻固定。2.肝脏组织处理及病理染色相关实验1)肝脏脱水,透明,浸蜡切取10%中性福尔马林中固定好的部分肝叶组织于标记的包埋框内,在小流量流水冲洗30分钟以上。按照以下流程在机器上设置以下程序,①脱水:75%酒精(45分钟)→75%酒精(45分钟)→85%酒精(45分钟)→85%酒精(45分钟)→95%酒精(45分钟)→95%酒精(45分钟)→无水酒精(1小时)→无水酒精(1小时);②透明:二甲苯(1小时)→二甲苯(1小时);③浸腊(65℃):石蜡(1小时)→石蜡(1小时)。待组织冲洗完毕后,将包含组织的包埋框装进机器篮筐内,启动上述程序。上述程序完成后,取出组织包埋框送病理室包埋组织,同时清洗机器备用。2)肝脏组织切片使用切片机切片(切片厚度5μm)。3)肝脏组织苏木精-伊红(HE)染色将肝脏组织石蜡切片放入65℃烘箱(30分钟)→二甲苯中(5分钟×3次)→100%酒精(1分钟)→90%酒精(1分钟)→70%酒精(1分钟)→蒸馏水洗→苏木素(5分钟)→自来水洗去切片上的浮色→1%盐酸酒精(1至3秒)→自来水洗数下→Scott促蓝液(碳酸氢钠0.35g,硫酸镁2g,蒸馏水100mL)(1分钟)→自来水洗数下→伊红(1分钟)→蒸馏水洗去切片上的浮色→70%酒精一下→90%酒精一下→100%酒精(30秒×3次)→二甲苯(2分钟×3次)→在二甲苯未干时封片,拍照。4)肝脏组织油红O染色①将冰冻肝脏组织切片在通风橱中风干30分钟,4%多聚甲醛固定10分钟。置于双蒸水中稍洗10分钟,以除去组织表明的多聚甲醛。②以60%异丙醇处理1分钟。③用油红O(公司sigma,货号O0625,浓度0.5克/100mL100%异丙醇)染色30分钟。④之后以60%异丙醇漂洗1分钟×3次,直至背景干净。⑤用Mayer’s苏木素染液(5滴)淡染细胞核。⑥水漂洗,稀碳酸锂水溶液中促蓝,充分水洗,水洗至细胞核蓝化。⑦用甘油明胶封片,拍照。肝脏大体外观结果见图3所示,在HFD组的cFLIP-KO小鼠无论肝脏重量还是肝脏重量与小鼠本身体重比值均较HFD组的cFLIP-flox小鼠高(如图3A、B)。进一步通过组织切片,进行HE和油红O染色,显微镜下观察各组小鼠肝脏组织在高脂饮食饲养条件下发生了显著的病理改变。通过肝脏HE染色,可以观察到在HFD饲养条件下,cFLIP-flox小鼠和cFLIP-KO小鼠肝脏组织均有脂肪沉积,可以看到cFLIP-flox组小鼠的肝细胞发生脂肪变性、空泡化且融合连成片状,肝脏细胞形态已几乎完全破坏,而cFLIP-KO组小鼠的肝细胞形态变化更为严重(如图4上)。通过肝脏油红O染色来检测肝组织中脂质,可以发现在HFD组的cFLIP-flox小鼠的肝门静脉周围呈大片红色,提示有大量的脂质沉积,而在HFD组的cFLIP-KO小鼠的肝门静脉周围的脂质沉积更显著(如图4下)。这些结果说明cFLIP基因敲除小鼠的脂肪肝明显恶化。【实施例4】肝脏脂质含量测定①从-80℃冰箱取出肝脏组织样品,称量50mg组织,使用研磨器将肝脏组织研磨成粉末状,溶于1mLPBS中,混匀后再与1mL氯仿/甲醇(2:1)共孵育过夜。②以12000g高速离心15min后,收集管底脂质层物质,风干,以去除水分。③将分离出的脂质层物质溶于200μL含1%TritonX-100的PBS溶液中,仔细吹吸混匀。④开启电脑labman软件,打印机,再开启生化分析仪;⑤选择并清洗检测探针、比色杯等,保证探针通畅、比色杯无杂质附着,吸光值在设定的参考范围;⑥在labman软件上检查所需检测指标试剂是否足够,设定检测指标和检测顺序等。⑦将制得的混匀液上机检测,分析。肝脏脂质含量测定结果如图5A-C所示,经过高脂饲料饲养24周后,cFLIPFLOXHFD组小鼠肝脏组织中甘油三酯、胆固醇以及游离脂肪酸含量明显高于其NC对照组,而cFLIPKOHFD组小鼠肝脏组织中脂质成分含量则明显高于cFLIPFLOXHFD组。说明cFLIP基因敲除显著增加了高脂饲料饲养的小鼠肝脏组织中甘油三酯、胆固醇以及游离脂肪酸含量,cFLIP基因敲除小鼠的脂肪肝明显恶化,cFLIP基因对于脂肪肝疾病具有显著的抑制作用。上述结果显示cFLIP-KO小鼠在HFD的诱导下发生的脂肪肝病变显著加重。这些结果表明cFLIP基因对改善脂肪肝具有显著的作用。本发明结果说明cFLIP基因在脂肪肝疾病模型中有着重要的保护作用。上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。SEQUENCELISTING<110>武汉大学<120>细胞型Fas相关死亡区域蛋白样β白介素-1转换酶抑制蛋白在治疗脂肪肝中的应用<130>1<160>12<170>PatentInversion3.3<210>1<211>25<212>DNA<213>cFLIP-sgRNA1<400>1ggaacctaggggttttttccggggg25<210>2<211>27<212>DNA<213>cFLIP-sgRNA2<400>2ggaatcgaaaagttgatataagccagg27<210>3<211>54<212>DNA<213>loxp1-F<400>3agcttgacgtcataacttcgtatagcatacattatagcaatttataccggtgat54<210>4<211>50<212>DNA<213>loxp1-R<400>4atcaccggtataaattgctataatgtatgctatacgaagttatgacgtca50<210>5<211>52<212>DNA<213>loxp2-F<400>5gatcccttaagataacttcgtatagcatacattatagcaatttatacgcgta52<210>6<211>52<212>DNA<213>loxp2-R<400>6ctagtacgcgtataaattgctataatgtatgctatacgaagttatcttaagg52<210>7<211>29<212>DNA<213>cFLIPLA-F<400>7ccgctcgagttatagcccacacaggctga29<210>8<211>29<212>DNA<213>cFLIPLA-R<400>8atggacgtcgaaaaaacccctaggttccc29<210>9<211>27<212>DNA<213>cFLIPM-F<400>9ccggaattccgggggagtctctgcttt27<210>10<211>29<212>DNA<213>cFLIPM-R<400>10ggcgatatcgccaggcctgtcaattttac29<210>11<211>31<212>DNA<213>cFLIPRA-F<400>11cgacgcgtttatatcaacttttcgatttgac31<210>12<211>36<212>DNA<213>cFLIPRA-R<400>12ataagaatgcggccgctatcaacatggcgtcaggaa36当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1