白介素33在制备治疗癫痫病药物中的应用的制作方法
本发明涉及生物医学领域,尤其涉及一种白介素33在制备治疗癫痫病药物中的应用。
背景技术:
癫痫是世界上第三大最常见的慢性神经病理性疾病,伴随特点是易病体质产生的持续性放电,癫痫影响了许多不同年龄段的人群,尤其是新生儿和儿童。尽管治疗癫痫的药物和外科手术日渐改进,但是关于个体癫痫放电的过程和机制性研究仍然很少,并且有效的治疗方法和手段相当匮乏,因此充分研究癫痫的病理变化以及寻求较好的治疗手段已迫在眉睫。
癫痫发作的基础性病理变化包括神经元损伤、突触发芽、海马结构中突触的重构和炎症反应等等,并且炎症反应在癫痫发生中的病理变化中起到了关键性的作用。癫痫发作后,白细胞介素-1β(interleukin-1β,IL-1β)和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等大量炎症细胞因子从激活的星型胶质细胞和小型胶质细胞中产生,这些炎症因子可引起血脑屏障破坏、神经元兴奋性升高、神经元丢失,并可进一步加重癫痫的产生和发展。研究表明,在癫痫发作后,从星型胶质细胞和小型胶质细胞中产生的炎症细胞因子(如IL-1β)和高迁移率蛋白超家族B1(high-mobility group box 1protein,HMGB1)分别激活白细胞介素受体亚型I(IL-1receptor type I,IL-1R type I)和Toll样受体4(Toll-like receptor 4,TLR4),可引起神经元兴奋性升高和突触传递的改变、GABA产物的减少、抑制Ca2+外流;主要从小型胶质细胞中产生炎症因子TNF-α,能刺激星形胶质细胞释放谷氨酸从而引起癫痫的发生。从上述发现可以看出,癫痫发作能激活炎症反应,炎症反应能增加神经元内Ca2+,还可以激活星型胶质细胞增加胞外K+和谷氨酸含量,这些情况都可以提高神经元的兴奋性并降低癫痫发作的阈值,可见癫痫发作和炎症反应之间为正反馈调节。
作为一种新的细胞因子,白介素33(IL-33)最初被发现是存在于内皮静脉的核因子,属于IL-1家族的细胞因子成员,它通过结合异二聚体ST2L和IL-1RAcp复合物受体传导信号。同时,可驱使肥大细胞、嗜碱性粒细胞、嗜酸性粒细胞、自然杀伤性T细胞和自然杀伤性细胞、2型T辅助细胞、2型先天性免疫细胞产生细胞因子,并且IL-33在多种疾病中起到重要性作用,这些疾病包括哮喘、类风湿性关节炎、动脉粥样硬化和心血管疾病等等。
之前的研究认为,IL-33是一把双刃剑,不仅具有通过清除病原减轻坏血病的抗炎症作用,还具有在胶原或者血清诱导的类风湿性关节炎中恶化过敏和炎症的促炎症作用。然而,IL-33双重功能性作用与它的合成、定位和释放具有一定的关联性。本申请的发明人发现IL-33在体内外的发育性和成熟性的中枢神经系统中的表达主要位于核内,仅在胞质中有一小部分表达。此外,从损伤和坏死的细胞释放的IL-33,作为一种全长分子,不需要成熟形式就可以发挥它的生物学活性。虽然IL-33在疾病中的生物学活性已经越来越明确,但是人们对IL-33在癫痫病中的作用和潜在性机制的了解仍然不足。
技术实现要素:
为解决上述技术问题,本发明的目的是提供一种白介素33在制备治疗癫痫病药物中的应用,明确了白介素33对新生鼠癫痫具有保护作用及作用的潜在机制,为临床治疗新生儿癫痫提供新的理论与技术手段。
本发明公开了一种白介素33在制备治疗癫痫病药物中的应用。
进一步的,白介素33能够保护或改善癫痫病引起的神经功能缺损。
进一步的,白介素33通过减少炎症因子的表达拮抗癫痫病中的炎症反应。
进一步的,炎症因子为白细胞介素-1β和肿瘤坏死因子-α。
进一步的,白介素33促进增加抗凋亡蛋白的表达和减少促凋亡蛋白的表达来抑制癫痫病发作后的细胞凋亡。
进一步的,抗凋亡蛋白为P53家族蛋白,Bcl-2家族蛋白中的Bcl-2或Bclxl。
进一步的,促凋亡蛋白为C-myc家族蛋白,Bcl-2家族蛋白中的Bax,Caspase家族蛋白中的caspase-1、caspace-3、caspase-8或caspase-9。
进一步的,白介素33通过减少自噬相关蛋白Beclin-1和LC3-II/LC3-I的比率,并维持P62的高水平抑制自噬性细胞的死亡。
借由上述方案,本发明至少具有以下优点:
本发明公开了IL-33对新生期癫痫反复发作造成的神经功能缺损具有改善作用,并促进患病体体重的恢复;同时IL-33可以减轻新生期癫痫反复发作引起的机体和神经炎症反应;IL-33可以减轻新生期癫痫反复发作引起的神经细胞凋亡和自噬激活;并发现抑制NF-κB信号通路是IL-33发挥抑制炎症反应、进而抑制凋亡和自噬起到神经保护作用的机制之一;本发明为利用IL-33作为治疗癫痫反复发作的一种新型药物提供了依据。
上述说明仅是本发明技术方案的概述,为了能够更清楚了解本发明的技术手段,并可依照说明书的内容予以实施,以下以本发明的较佳实施例并配合附图详细说明如后。
附图说明
图1是对大鼠进行前肢悬吊试验的结果;
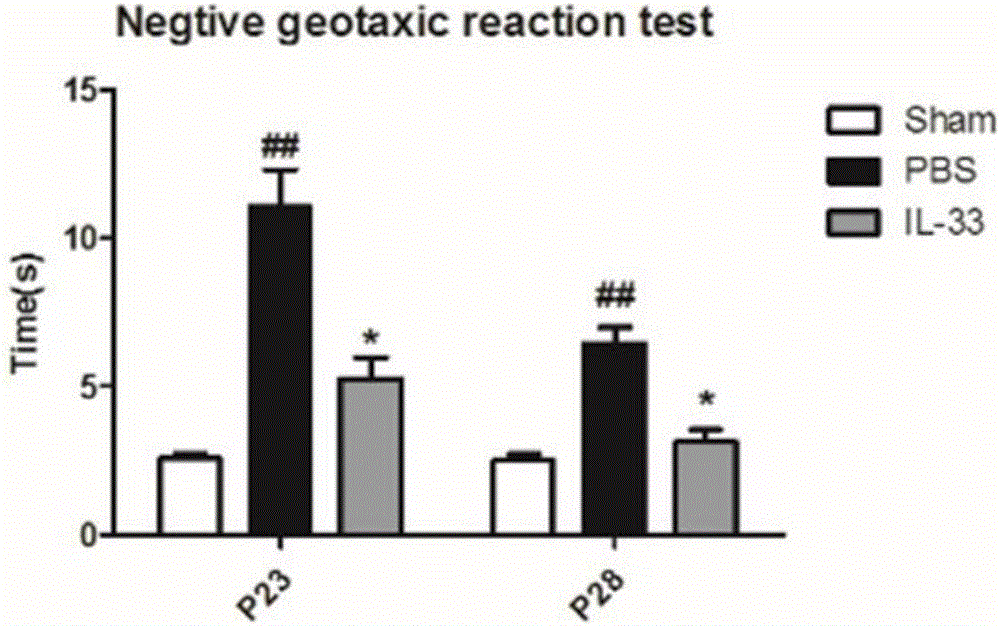
图2是对大鼠进行负向趋地试验的结果;
图3是对大鼠进行悬崖回避试验的结果;
图4是对大鼠进行水迷宫定位航行试验的结果;
图5是对大鼠进行空间探索试验的结果;
图6是对大鼠进行体重测量的结果;
图7是对大鼠血清、大脑皮质和海马组织中的TNF-α的表达水平的测试结果;
图8是对大鼠血清、大脑皮质和海马组织中的IL-1β的表达水平的测试结果;
图9是IL-33对大鼠反复惊厥后大脑皮质和海马组织中Bcl-2蛋白和活化的caspase-3蛋白表达的影响结果;
图10是对图9的直方图统计结果;
图11是IL-33对大鼠反复惊厥后大脑皮质和海马组织中Beclin1、p62蛋白表达的影响结果;
图12是图11的直方图统计结果以及Beclin1/Bcl-2比率的直方图统计结果;
图13图示了IL-33对大鼠反复惊厥后大脑皮质和海马组织中LC3蛋白表达及激活的影响;
图14是图13的直方图统计结果以及LC3II/LC3I的比率。
具体实施方式
下面结合附图和实施例,对本发明的具体实施方式作进一步详细描述。以下实施例用于说明本发明,但不用来限制本发明的范围。
本申请涉及的神经反射实验和行为学实验包括:
(1)前肢悬吊试验,具体如下:
将直径为5mm的光滑玻璃棒置于45cm高的架上,玻璃棒的下方放置柔软的弹力海绵垫,将大鼠轻置于玻璃棒上确保大鼠前肢握住玻璃板后开始计时,大鼠掉落时计时结束,一次实验大鼠测量三次,取最长时间记为前肢悬吊时间,大于180s的记为180s。此项实验可反映大鼠肌力、运动协调能力,时间越短代表肌力、运动协调能力越差。
(2)负向趋地试验,具体如下:
将大鼠头向下放置于45°粗糙的木板(150cm×80cm)斜面上部,以免大鼠看到或者接触到斜板下边缘和底部台面后受探索活动影响而下爬。当大鼠被放下同时开始计时,大鼠回转180°开始往上爬时及时结束,所得时间即负向趋地反应时间,以秒为计算单位。时间越长,表示反应越差。
(3)悬崖回避试验,具体如下:
将大鼠放置于木板平台的边缘,记录大鼠后退或者侧移离开边缘的时间,时间越长,说明了神经反射发育越好。
(4)Morris水迷宫(Morris water maze,MWM)定位航行试验(place navigation):
用于测量大鼠对水迷宫学习记忆的能力,试验于大鼠日龄28天进行,历时6天,第一天让每只大鼠在水池中自由游泳1分钟,以熟悉水池及周围环境;从第二天起,随机将大鼠从某一象限(靶象限除外)置入池内,大鼠登上平台后系统自动终止记录,记为上台潜伏期,即逃避潜伏期(escape latency),实验至第六天结束,每天上午、下午各训练一次,每次分别选择不同象限作为入水点,将大鼠面向池壁放入水中,观察并记录大鼠寻找并爬上平台的路线图、所需时间(逃避潜伏期)搜寻策略。系统设定60s为最长潜伏期,大鼠爬上平台后,让其在平台上再适应10s,若大鼠入水后60s内未能找到平台,将大鼠引至平台上适应10s,其潜伏期记为60s。
(5)Morris水迷宫(Morris water maze,MWM)空间探索试验(spatial probe):
用于检测大鼠在学会寻找平台对平台空间位置的记忆能力,试验于定位航行试验结束24小时后进行。试验时撤去训练时的平台,然后任选一个入水点将大鼠面向池壁放入水中,观察其在60s内原平台所在位置的次数(穿越平台的次数)并记录其搜寻策略。
(6)酶联免疫吸附测定法实验(ELISA):
在大鼠新生期反复惊厥后24h,将大鼠深度麻醉,从心脏抽取0.6-0.8ml血液于抗凝管中,静置30min后,离心,去除上清即为血清;同时,迅速取出脑组织并沿矢状缝分成左右两侧大脑,然后将脑组织放在预先含有蛋白酶抑制剂(PMSF)的裂解液中匀浆,离心,取上清。依据细胞因子检测试剂盒的说明书,利用生物素双抗体夹心酶联免疫吸附法测定样品中大鼠两种细胞因子TNF-α和IL-1β的表达水平。简要的步骤如下:向预先包被了大鼠TNF-α或IL-1β(购买自上海博蕴生物科技有限公司)单克隆抗体的酶标孔中加入前面处理好的脑组织匀浆液,温育;温育后,加入生物素标记的抗TNF-α和IL-1β抗体,再与链霉亲和素-HRP结合,形成免疫复合物,再经过温育和洗涤,去除未结合的酶,然后加入底物A、B,产生蓝色,并在酸的作用下转化成最终的黄色,颜色的深浅与样品中大鼠TNF-α或IL-1β的浓度呈正相关。
(7)免疫印迹实验(Western Blotting):
在新生期反复惊厥后24h将大鼠麻醉后分别分离脑皮质和海马组织,将分离提取的脑组织加入到含有蛋白酶抑制剂的裂解液中超声裂解,离心,匀浆后提取上清液,然后,利用增强型BCA测量蛋白浓度,每孔上样等量50ug蛋白样品利用SDS-PAGE凝胶电泳分离各蛋白,然后,将分离胶上的蛋白转到PVDF膜上,随后,将转有蛋白的PVDF膜孵育在牛奶稀释的抗体中于4℃过夜,第二天洗膜后,蛋白条带在辣根过氧化物酶链接的二抗中室温孵育2h,随后,应用ECL化学发光系统检测蛋白条带,最后扫描蛋白条带和使用Sigma Scan Pro 5分析蛋白条带的灰度值。
(8)体重测量:
在新生期癫痫反复发作实施后24h开始分别测量Sham组、RS组、RS+IL-33组新生大鼠的体重。
实施例1
将15只七日龄的Sprague-Dawley(SD)大鼠随机分为三组,每组5只,三组分别为:单纯对照组(Sham组)、单纯惊厥组(RS组)和IL-33惊厥组(RS+IL-33组)。建模步骤如下:将RS组和RS+IL-33组置于透明可见的封闭玻璃实验舱内,舱顶留一小孔,向此孔内每次注射0.04ml三氟乙醚后迅速封闭舱顶。观察舱内大鼠的惊厥发作情况,在大鼠惊厥发作有所缓解但未恢复正常之前,继续通过舱顶小孔注射等剂量三氟乙醚入舱,使其处于惊厥持续状态。从大鼠首次惊厥发作开始计时,待其惊厥发作30min后取出大鼠,每日惊厥一次,共六日。RS+IL-33组大鼠在每日惊厥后均腹腔注射IL-33,每只注射300ng IL-33,RS组注射等量的含有0.1%BSA的PBS,Sham组不予特殊处理,三组大鼠饲养条件均相同。
在新生鼠出生后23和28天(P23和P28)对三组大鼠分别进行前肢悬吊试验和负向趋地试验,测试结果分别如图1和图2所示。图3反映了在大鼠出生后P23和P28天对三组大鼠进行悬崖回避试验所测得的悬崖回避时间。图4反映了三组大鼠在水迷宫定位航行试验中,连续5天训练的逃避潜伏期的时间。图5为在大鼠出生后P37天,对其进行空间探索试验所记录下穿越平台的次数结果。
对比图1-5中RS组和RS+IL-33组的各项试验结果可知,RS+IL-33组的前肢悬吊试验时间延长、负向趋地试验和悬崖回避试验时间缩短、水迷宫试验潜伏期缩短、定位航行试验时间延长,说明IL-33改善了新生期癫痫反复发作诱导的神经行为功能缺损。
对上述处理过的三组大鼠进行体重测量,结果如图6所示(图中Veh组即为上述实验中的RS组)。对比图6中各组可发现,在新生期癫痫反复发作后,大鼠的体重在损伤后24h明显下降,相对于Sham对照组,随后的连续5天持续下降并且在第五天达到谷底,之后渐渐回升。然而,外源性IL-33在损伤后24h明显改善了体重的下降,相对于损伤对照组,之后渐渐升高,趋向于正常对照组,但是还不能够达到正常值。说明了IL-33对新生期癫痫反复发作后的体重的下降有较好的改善性作用。
应用ELISA酶联免疫吸附实验检测三组大鼠的炎症细胞因子IL-1β和TNF-α的表达水平。如图7-8所示,图7A代表血清中的TNF-α表达水平,图7B代表脑皮质中的TNF-α表达水平,图7C代表海马组织中的TNF-α表达水平,图8A代表代表血清中的IL-1β表达水平,图8B代表脑皮质中的IL-1β表达水平,图8C代表海马组织中的IL-1β表达水平。从图7和图8可知,外源性注入的IL-33,无论是在血清、脑皮质或者海马组织中,均抑制了新生期癫痫反复发作诱导的炎症因子IL-1βand TNF-α的增加,说明IL-33在新生期癫痫反复发作后发挥了抗炎症反应的作用。
对三组小鼠的脑皮质和海马组织分别进行免疫印迹实验,结果见图9-10。图9为应用Western blot方法检测蛋白条带,并用ECL化学发光,最后用CHEMISCOP化学发光成像系统扫描蛋白条带的测试结果,图10反映了使用Sigma Scan Pro 5分析蛋白条带得到的灰度值结果。由测试结果可知,在新生期癫痫反复发作后,抗凋亡蛋白Bcl-2明显减少而促凋亡蛋白明显增加,然而预处理IL-33显著地增加了Bcl-2的表达和减少了Caspase-3的表达变化,说明IL-33对新生期癫痫反复发作后的细胞损伤具有抗凋亡的作用。
对三组小鼠的脑皮质和海马组织分别进行免疫印迹实验,结果见图11-14。图11和图13均为应用Western blot方法检测目的蛋白并用ECL化学发光,最后用CHEMISCOP化学发光成像系统扫描蛋白条带的测试结果,图12和图14反映了使用Sigma Scan Pro 5分析蛋白条带得到的灰度值结果,其中图12使用Beclin1/Bcl-2的比率来确定自噬的激活程度,图14用LC3II/LC3I的比率来确定自噬的激活程度。由测试结果可知,在新生期癫痫反复发作后,自噬相关蛋白Beclin-1和LC3-II/LC3-I比率明显升高,而P62显著下降。然而,预处理IL-33明显下降了Beclin-1的表达和减少了LC3-II/LC3-I的比率,并且维持了P62的高水平,说明IL-33抑制了新生期癫痫反复发作后的自噬激活以及引起的自噬性细胞死亡。
以上所述仅是本发明的优选实施方式,并不用于限制本发明,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明技术原理的前提下,还可以做出若干改进和变型,这些改进和变型也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!