一种右兰索拉唑缓释胶囊及制备方法与流程
本发明属于药物制剂
技术领域:
,具体涉及一种右兰索拉唑缓释胶囊及制备方法。
背景技术:
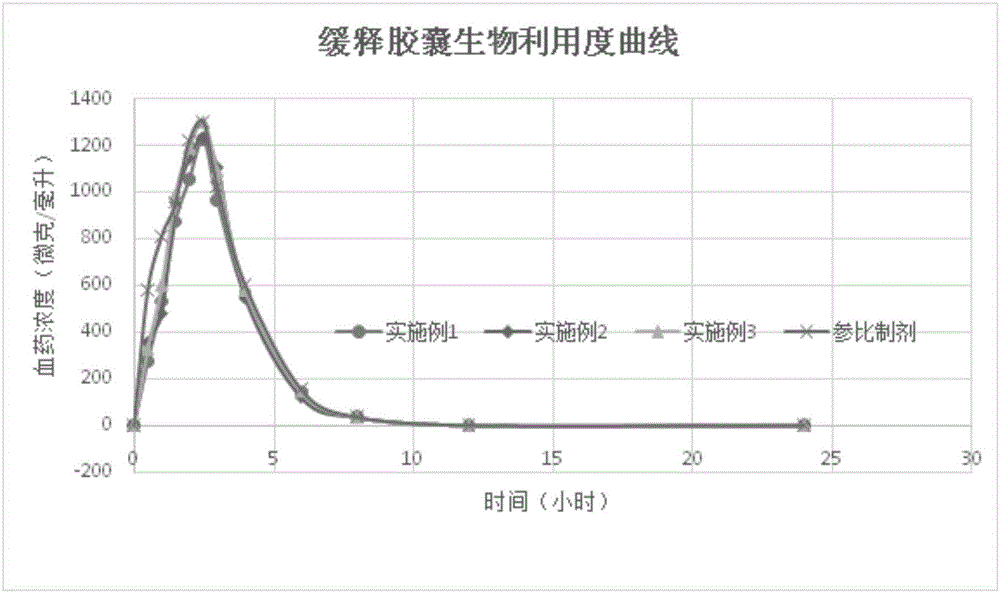
:右兰索拉唑,英文名:(R)-Lansoprazole,别名:2-[[3-甲基-4-(2,2,2-三氟乙氧基)吡啶-2-基]甲基亚磺酰基]-1H-苯并咪唑。美国FDA于2009年1月30日批准日本武田制药公司研发的食管炎治疗新药右兰索拉唑(通用名为Dexlansoprazole)上市。该药是质子泵抑制剂兰索拉唑的对映体,又被称为右旋兰索拉唑,用于治疗与非糜烂性胃食管反流病相关的胃灼热及不同程度的糜烂性食道炎。此次上市剂型是缓释胶囊,内置两层肠溶包衣单位,可使药物在给药后1~2小时和4~5小时后分别出现两个血药浓度峰值,作用时间超过兰索拉唑,且Kapidex的给药时间不受食物和用餐时间的影响。临床Ⅲ期试验显示,该药能为在日间或夜间伴胃灼热症状的胃食管反流病患者提供长达24小时的抑酸作用和持续的症状缓解效果。目前研究较多的右兰索拉唑缓释胶囊一般由两种右兰索拉唑微丸组成,其中一种为肠溶微丸,另一种为缓释微丸。肠溶微丸一般由空白丸芯、活性药物层、隔离衣层和肠溶衣层组成。缓释微丸由空白丸芯、活性药物层、隔离衣层和缓释衣层组成。而右兰索拉唑迟释胶囊则由肠溶微丸与缓释微丸按照质量比为1:3混合,装入胶囊制备而成。右兰索拉唑缓释胶囊的活性药物层一般由右兰索拉唑、填充剂、崩解剂、粘合剂和稳定剂等组成。目前采用的稳定剂一般是碳酸镁、碳酸钠、碳酸氢钠,磷酸氢二钠、氢氧化钠等(公开号为CN104523654A的专利文献)。或者,稳定剂为碳酸钙、碳酸镁、氧化镁、氢氧化钠、氢氧化镁、磷酸氢二钠或葡甲胺等(公告号为CN103961329B的专利文献)。或者,所述稳定剂为氢氧化镁、碳酸镁、碳酸钠或氢氧化钠(公告号为CN102600109的专利文献)。采用这些稳定剂时,长时间存放后,药物中单杂和总杂含量明显增加,导致药物安全性降低。技术实现要素:本发明提供了一种右兰索拉唑缓释胶囊,该缓释胶囊采用新的稳定剂组分,大大提高了药物的稳定性,保证了药物的安全性。本发明的另外一个发明目的是提供一种右兰索拉唑缓释胶囊的制备方法。一种右兰索拉唑缓释胶囊,包括肠溶微丸和缓释微丸,所述肠溶微丸或/和缓释微丸包括活性药物丸芯,该活性药物丸芯中包括右兰索拉唑活性成分和稳定剂,所述稳定剂为氢氧化钙和氢氧化钾的组合物。一种右兰索拉唑缓释胶囊,包括肠溶微丸和缓释微丸,所述肠溶微丸包括活性药物丸芯、隔离层和肠溶层,所述缓释微丸包括活性药物丸芯、隔离层和肠溶缓释层,所述活性药物丸芯中包括右兰索拉唑活性成分和稳定剂,所述稳定剂为氢氧化钙和氢氧化钾的组合物。本发明中,所述右兰索拉唑活性成分可以是右兰索拉唑或者其旋光异构体,或者可接受的盐或者其他可接受的右兰索拉唑API药物等。作为优选,所述氢氧化钙和氢氧化钾的质量比为(1-8):1;作为进一步优选,所述氢氧化钙和氢氧化钾的质量比为(2-8):1,作为优选,所述氢氧化钙和氢氧化钾的质量比为(3-8):1。作为更进一步优选,所述氢氧化钙和氢氧化钾的质量比为7:2或者8:1或者4:1。作为优选,在肠溶微丸中,所述稳定剂与右兰索拉唑活性成分的重量百分比为:10%-20%;在缓释微丸中,所述稳定剂与右兰索拉唑活性成分的重量百分比为:10%-20%。作为优选,在肠溶微丸和缓释微丸中,所述稳定剂与右兰索拉唑活性成分的重量百分比均为10%-20%,作为进一步优选,所述稳定剂与右兰索拉唑活性成分的重量百分比均为14%-17%,更进一步优选为15%-17%。作为进一步优选,所述肠溶微丸和缓释微丸中活性药物丸芯的组成均相同,其中稳定剂与右兰索拉唑活性成分的重量百分比均为14%-17%,进一步为15%-17%。进一步简化了右兰索拉唑缓释胶囊的制备工艺,降低药物制备成本。作为优选,按照其中右兰索拉唑的质量计,所述肠溶微丸和缓释微丸的质量比为1:(2.8-3.2),进一步优选为1:3。其中以肠溶微丸和缓释微丸总质量计算,右兰索拉唑活性成分(API)的总的质量百分比约为15%-25%,进一步优选为18%-22%,更进一步优选为20%-22%。作为优选,所述活性药物丸芯中包括甘露醇;作为进一步优选,以活性药物丸芯总重量计,所述的甘露醇的重量百分比为5%-15%。甘露醇的加入,加快了药物活性成分的崩解速度,保证其在更短的时间内达到有效药物浓度。作为优选,所述活性药物丸芯中,所述甘露醇的重量百分比为8-12%。作为优选,以活性药物丸芯总重量计,所述活性药物丸芯包括:作为优选,所述隔离层为欧巴代YS-1-7006,肠溶微丸和缓释微丸中,所述隔离层与活性药物层丸芯的重量百分比为10%-30%,进一步优选为10%-20%。作为优选,以肠溶微丸总重量计,所述肠溶微丸包括:所述隔离层颗粒为包覆有隔离层的活性药物丸芯。作为优选,所述聚丙烯酸树脂A可以是聚丙烯酸树脂L30D-55或者聚丙烯酸树脂L100-55;可以选择尤特奇L30D-55或者尤特奇L100-55等。作为优选,若以肠溶微丸总重量计,所述聚丙烯酸树脂A所占的重量百分比为10-20%,进一步优选为12-18%。或者,作为优选,若以肠溶微丸和缓释微丸总重量计所述聚丙烯酸树脂A所占的重量百分比为2~5%。活性药物丸芯经过隔离层包衣液包衣后,形成隔离层小丸,作为优选,隔离层小丸中,所述活性药物丸芯所占的重量百分比为80~90%,进一步优选为85-90%。作为优选,以缓释微丸总重量计,所述缓释微丸包括:作为优选,所述聚丙烯酸树脂B可以是聚丙烯酸树脂S100,可以选择市售的尤特奇S100。作为优选,若以缓释微丸总重量计,所述聚丙烯酸树脂B所占的重量百分比为15%-25%,作为进一步优选,所述聚丙烯酸树脂B所占的重量百分比为20-25%。或者作为优选,若以肠溶微丸和缓释微丸总重量计,所述聚丙烯酸树脂B所占的重量百分比为15%-20%。本发明还提供了一种制备上述任一项技术方案所述的右兰索拉唑缓释胶囊的方法,为流化床包衣法。所述流化床包衣法依次包括如下步骤:(1)利用右兰索拉唑包衣混合液在蔗糖空白丸芯上进行包衣得到活性药物层颗粒;(2)利用隔离包衣混合液在隔离层颗粒上进行包衣得到隔离层颗粒;(3)利用肠溶层颗粒包衣液在隔离层颗粒上进行包衣得到肠溶微丸;(4)利用肠溶缓释层包衣液在隔离层颗粒上进行包衣得到缓释肠溶微丸;(5)将得到的肠溶微丸和缓释肠溶微丸进行胶囊填充得到所述的右兰索拉唑缓释胶囊。对于口服药物,药物口服进入体内后,依序经过口腔、食道、胃、十二指肠、空肠、回肠、结肠和直肠。由于在口腔和食道的滞留时间相对较少,因此,在此两段消化道中药物受消化道的影响较小;相对的,在胃、十二指肠、空肠和回肠的平均驻留时间增加,大部分药物在此吸收,因此药物受此段消化道的影响增加;在结肠和直肠由于消化液的减少,药物吸收量也减少,因此药物受此段消化道影响程度下降。根据生物药剂学中对人体消化道环境的描述,胃的平均pH值为1左右,十二指肠的平均pH值为6.0左右,空肠和回肠的平均pH值为7.4左右。我们通常希望,其在胃中的释放度尽可能低,以降低对胃部的刺激等副作用,同时保证右兰索拉唑药物的稳定性;在经过十二指肠时,其中的肠溶微丸中的活性药物组分能够全部释放,被十二指肠吸收,而缓释肠溶微丸不释放;而在到达空肠和回肠时,其中的缓释肠溶微丸开始迅速释放,被空肠和回肠吸收,完成药物的整个吸收过程。而由我们的实验证实,本发明的右旋兰索拉唑胶囊完美的呈现两段释放模式,在经过胃部2个小时左右的时间,几乎没有药物溶出,而在经过十二指肠两个小时左右,其中25%的右旋兰索拉唑被快速释放吸收,在经过空肠和回肠的2个小时剩余75%的右旋兰索拉唑被快速释放吸收,即本发明的右旋兰索拉唑胶囊产品能够延长右旋兰索拉唑的作用时间,使右旋兰索拉唑的抑酸效果得到增加。与现有技术相比,本发明的有益效果体现在:实验表明,采用氢氧化钙和氢氧化钾的组合作为稳定剂时,制备得到的右兰索拉唑缓释胶囊在酸介质中的释放量均为标示量以下,且远远低于原研对照样品的释放量。而且,溶出实验表明本发明得到的右兰索拉唑缓释胶囊的溶出度与原研对照品的溶出度相当,完全符合药物设计要求。更为重要的是,采用氢氧化钙和氢氧化钾作为稳定剂时,相对比单组份的稳定剂,稳定剂的添加量减少,且稳定性更好。同时,本发明的右兰索拉唑缓释胶囊的生物利用度完全符合要求。附图说明图1为实施例制备的缓释胶囊以及对照样的溶出曲线;图2为实施例制备的缓释胶囊和对比样的缓释胶囊生物利用度曲线。具体实施方式下面结合实施例对本发明作进一步说明:实施例1缓释胶囊由肠溶微丸(颗粒)和缓释肠溶微丸(颗粒)组成制备工艺:(1)活性药物层颗粒的制备成份投料量(克)蔗糖空白丸芯400右兰索拉唑600无水氢氧化钙80无水氢氧化钾20羟丙基纤维素240十二烷基硫酸钠300甘露醇180丙酮6800将微粒化的氢氧化钙加入到含丙酮的容器中,混合15分钟,然后加入微粒化的右兰索拉唑,再混合45分钟,然后再加入氢氧化钾溶液,得到的氢氧化钙、氢氧化钾和右兰索拉唑的混合物被保留用作进一步加工。将羟丙基纤维素加入到含丙酮的容器中并混合,直到固体溶解,得到羟丙基纤维素的混合物。将羟丙基纤维素的混合物与氢氧化钙、氢氧化钾和右兰索拉唑的混合物混合,混合0.5小时,将得到的氢氧化钙、氢氧化钾、右兰索拉唑进和羟丙基纤维素的混合物被保留用作进一步加工。将微粒化的甘露醇、十二烷基硫酸钠加入到含丙酮的容器中,混合1.5小时,得到的甘露醇的混合物被保留用作进一步加工。将氢氧化钙、氢氧化钾、右兰索拉唑和羟丙基纤维素的混合物与甘露醇的混合物混合,混合6小时,得到的活性药物包衣液被保留用作进一步加工。将上述活性药物包衣液放入到预先装有蔗糖空白丸芯,且底部带有喷雾器的流化床中(入口气温:31-33℃;物料温度:31-32℃;包衣溶液喷雾速率:26.7g/min;以及喷雾气压:1bar;喷嘴:1.0mm)进行喷雾,喷雾得到的包裹材料于40℃下在流化床中干燥,得到右兰索拉唑包覆的糖丸。该产品通过30目的网筛(最低)和20目网筛(最高)的筛分,得到活性药物层颗粒(或者活性药物丸芯)。(2)隔离层颗粒的制备成份投料量(克)活性药物层颗粒800欧巴代YS-1-7006120纯化水1500隔离包衣混合液制备:向水中加入欧巴代YS-1-7006并混合,制备得到8%欧巴代YS-1-7006混合物,该混合物被留作进一步加工。流化床处理器:预热流化床(带有喷雾器)至入口温度为50℃并具合适的气流。将活性药物层颗粒加入流化床中,使用隔离包衣混合液进行流化包衣(入口温度:65℃;物料温度:42-45℃(设置43℃);喷雾气压:2.5bar;喷嘴:1.0mm;喷雾速度为12mL/min)。生成的包覆材料于60℃下在流化床中干燥1小时,干燥后的产品通过30目的网筛(最低)和20目网筛(最高)的筛分,得到隔离层颗粒。(3)肠溶层颗粒的制备肠溶层颗粒包衣液制备:将尤特奇L30D-55在合适的容器中与异丙醇混合,溶解,得到的尤特奇L30D-55混合物被保留用作进一步加工。将滑石粉通过120目网筛筛分,然后再将筛分后的柠檬酸三乙酯和聚山梨醇酯80以及异丙醇混合,将该混合物加入到尤特奇L30D-55混合物中并进行充分地进一步混合,得到肠溶层颗粒包衣液一。将欧巴代YS-1-7006溶于纯水中,溶清后,加入气相硅胶,搅拌1小时,分散均匀,制备得到肠溶层颗粒包衣液二。流化床处理器(尤特奇L30D-55):预热流化床(带有喷雾器)至入口温度为45℃。将隔离层颗粒加入流化床处理器机器中,使用肠溶层颗粒包衣液进行流化(入口温度:55℃;物料温度:42-45℃(设置43℃);喷雾气压:2.5bar;喷嘴:1.0mm;喷雾速度为15mL/min),其中包衣液一喷完后干燥30min,再喷包衣液二。生成的材料于60℃下在流化床中干燥1小时,得到的产品通过22目的网筛(最低)和16目网筛(最高)的筛分,得到肠溶衣包覆的右兰索拉唑的颗粒,即肠溶层颗粒。(4)肠溶缓释层颗粒的制备成份投料量(克)隔离层颗粒400聚山梨酯803.5柠檬酸三乙酯18.9滑石粉16.5纯化水200异丙醇1400尤特奇S100125尤特奇S100肠衣包衣液的制备:将尤特奇S100在合适的容器中与异丙醇和纯化水进行混合,得到的尤特奇S100混合物被保留用作进一步加工。将滑石粉(通过120目网筛筛分过)、柠檬酸三乙酯和聚山梨醇酯80和纯化水混合,然后将该混合物加入到尤特奇S100混合物中,并进行充分地进一步混合。流化床处理器:预热流化床(带有喷雾器)入口温度45℃并具合适的气流。将被隔离层颗粒加入流化床处理器机器中,使用尤特奇S100肠衣包衣液进行流化(入口温度:45℃;产品温度:42-45℃(设置43℃);喷雾气压:2.1bar;喷嘴:1.0mm;喷雾速度为15mL/min)。生成的材料于60℃下在流化床中干燥1小时,该产品通过22目的网筛(最低)和16目网筛(最高)的筛分,得到肠溶衣包覆的右兰索拉唑的颗粒,即肠溶缓释层颗粒。(5)胶囊填充成份投料量(克)肠溶层颗粒500肠溶缓释层颗粒1500流体气相硅胶20最终混合:将肠溶层颗粒(25%,以右兰索拉唑总量计)、肠溶缓释层颗粒(75%,右兰索拉唑总量计)和流体气相硅胶,以提供最终产品。实施例2缓释胶囊由肠溶微丸和缓释肠溶微丸组成制备工艺:(1)活性药物层颗粒的制备将微粒化的氢氧化钙和氢氧化钾加入到含丙酮的容器中,至少混合15分钟,然后加入微粒化的右兰索拉唑,并混合45分钟,得到的氢氧化钙、氢氧化钾和右兰索拉唑的混合物被保留用作进一步加工。将羟丙基纤维素加入到含丙酮的容器中并混合,直到固体溶解,得到羟丙基纤维素丙酮混合物。将羟丙基纤维素与丙酮混合物与氢氧化钙、氢氧化钾和右兰索拉唑的混合物混合,生成的混合物至少混合0.5小时,得到氢氧化钙、氢氧化钾、右兰索拉唑和羟丙基纤维素的混合物被保留用作进一步加工。将微粒化的甘露醇、十二烷基硫酸钠加入到含丙酮的容器中,至少混合1.5小时,得到的甘露醇混合物被保留用作进一步加工。将上述制备的氢氧化钙、氢氧化钾、右兰索拉唑和羟丙基纤维素的混合物与甘露醇的混合物混合,生成的混合物混合6小时,得到的活性药物层包衣液被保留用作进一步加工。随后将制备得到的活性药物层包衣液放入到底部装有喷雾器的流化床(流化床中预先装有蔗糖空白丸芯)中(入口气温:31-33℃;物料温度:31-32℃;包衣溶液喷雾速率:26.7g/min;喷嘴:1.0mm;以及喷雾气压:1bar),喷雾得到的包裹材料于40℃下在流化床中干燥,得到右兰索拉唑包覆的糖丸。该产品通过30目的网筛(最低)和20目网筛(最高)的筛分,得到活性药物层颗粒。(2)隔离层颗粒的制备成份投料量(克)活性药物层颗粒800欧巴代YS-1-7006120纯化水1500隔离包衣混合液制备:通过向水中加入欧巴代YS-1-7006并混合而制备8%欧巴代YS-1-7006混合物,该混合物被留作进一步加工。流化床处理器:预热流化床,入口温度为50℃。将活性药物层颗粒加入流化床处理器机器中,使用隔离包衣混合液进行流化包衣(入口温度:65℃;物料温度:42-45℃(设置43℃);喷雾气压:2.5bar;喷嘴:1.0mm;喷雾速度为12mL/min)。生成的包覆材料于60℃下在流化床在干燥1小时,以提供隔离层颗粒,该产品通过30目的网筛(最低)和20目网筛(最高)的筛分,得到最终的隔离层颗粒。(3)肠溶层颗粒的制备肠溶层颗粒包衣液:将尤特奇L30D-55在合适的容器中与纯化水混合,得到的尤特奇L30D-55混合物被保留用作进一步加工。滑石粉通过120目网筛筛分,然后再将柠檬酸三乙酯和聚山梨醇酯80与纯化水混合,然后将混合物加入到尤特奇L30D-55混合物中并进行充分地进一步混合,得到肠溶层颗粒包衣液一。将欧巴代YS-1-7006溶于纯水中,溶清后,加入气相硅胶,搅拌1小时,分散均匀,制备得到肠溶层颗粒包衣液二。流化床处理器(尤特奇L30D-55):预热流化床至入口温度45℃并具合适的气流。将隔离层颗粒加入流化床处理器机器中,使用肠溶层颗粒包衣液进行流化(入口温度:55℃;物料温度:42-45℃(设置43℃);喷雾气压:2.5bar;喷嘴:1.0mm;喷雾速度为15mL/min),其中包衣液一喷完后干燥30min,再喷包衣液二。生成的材料于60℃下在流化床中干燥1小时,以提供肠溶衣包覆的右兰索拉唑的颗粒。该产品通过22目的网筛(最低)和16目网筛(最高)的筛分,得到最终的肠溶层颗粒。(4)肠溶缓释层颗粒的制备成份投料量(克)隔离层颗粒400聚山梨酯803.2柠檬酸三乙酯17.4滑石粉16.0纯化水300异丙醇1500尤特奇S100120尤特奇S100肠衣包衣液的制备:将尤特奇S100在合适的容器中与异丙醇和纯化水进行混合,得到的尤特奇S100混合物被保留用作进一步加工。将滑石粉(通过120目网筛筛分过)、柠檬酸三乙酯和聚山梨醇酯80纯化水混合,再加入到尤特奇S100混合物中,并进行充分地进一步混合,得到尤特奇S100肠衣包衣液。流化床处理器:预热流化床至入口温度45℃并具合适的气流。将被隔离层颗粒加入流化床处理器机器中,使用尤特奇S100肠衣包衣液进行流化(入口温度:45℃;产品温度:42-45℃(设置43℃);喷雾气压:2.1bar;喷嘴:1.0mm;喷雾速度为15mL/min)。生成的材料于60℃下在流化床中干燥1小时,以提供肠溶衣包覆的右兰索拉唑的颗粒。该产品通过22目的网筛(最低)和16目网筛(最高)的筛分,得到最终的肠溶缓释层颗粒。(5)胶囊填充成份投料量(克)肠溶层颗粒500肠溶缓释层颗粒1500流体气相硅胶20最终混合:将肠溶层颗粒(25%,以右兰索拉唑总量计)、肠溶缓释层颗粒(75%,右兰索拉唑总量计)和流体气相硅胶,以提供最终产品。实施例3缓释胶囊由肠溶微丸(颗粒)和缓释肠溶微丸(颗粒)组成制备工艺:(1)活性药物层颗粒的制备成份投料量(克)蔗糖空白丸芯400右兰索拉唑600无水氢氧化钙76无水氢氧化钾19羟丙基纤维素250十二烷基硫酸钠300甘露醇180丙酮6800将微粒化的氢氧化钙加入到含丙酮的容器中,混合30分钟,然后加入微粒化的右兰索拉唑,再混合1.5小时,然后加入氢氧化钾溶液,得到的氢氧化钙、氢氧化钾和右兰索拉唑的混合物被保留用作进一步加工。将微粒化的甘露醇、十二烷基硫酸钠加入到含丙酮的容器中,混合2小时,得到的甘露醇、十二烷基硫酸钠的混合物被保留用作进一步加工。将羟丙基纤维素加入到含丙酮的容器中并混合,直到固体溶解,得到羟丙基纤维素的混合物。将甘露醇、十二烷基硫酸钠的混合物与氢氧化钙、氢氧化钾和右兰索拉唑的混合物混合,混合1.5小时,然后加入羟丙基纤维素的混合物,搅拌2小时,过30目筛,得到活性药物包衣液,待喷。将上述活性药物包衣液放入到预先装有蔗糖空白丸芯,且底部带有喷雾器的流化床中(入口气温:31-33℃;物料温度:31-32℃;包衣溶液喷雾速率:40g/min;以及喷雾气压:2.0bar;喷嘴:1.0mm)进行喷雾,喷雾得到的包裹材料于40℃下在流化床中干燥,得到右兰索拉唑包覆的糖丸。该产品通过30目的网筛(最低)和20目网筛(最高)的筛分,得到活性药物层颗粒(或者活性药物丸芯)。(2)隔离层颗粒的制备成份投料量(克)活性药物层颗粒800欧巴代YS-1-7006220纯化水1500隔离包衣混合液制备:向水中加入欧巴代YS-1-7006并混合,制备得到8%欧巴代YS-1-7006混合物,该混合物被留作进一步加工。流化床处理器:预热流化床(带有喷雾器)至入口温度为50℃并具合适的气流。将活性药物层颗粒加入流化床中,使用隔离包衣混合液进行流化包衣(入口温度:65℃;物料温度:42-45℃(设置43℃);喷雾气压:2.5bar;喷嘴:1.0mm;喷雾速度为12mL/min)。生成的包覆材料于60℃下在流化床中干燥1小时,干燥后的产品通过30目的网筛(最低)和20目网筛(最高)的筛分,得到隔离层颗粒。(3)肠溶层颗粒的制备成份投料量(克)隔离层颗粒400聚山梨酯803.2柠檬酸三乙酯14.2滑石粉8.8纯化水450尤特奇L100-5574欧巴代YS-1-70068.9气相硅胶8.9异丙醇1400肠溶层颗粒包衣液制备:将尤特奇L30D-55在合适的容器中与异丙醇混合,得到的尤特奇L30D-55混合物被保留用作进一步加工。将滑石粉通过120目网筛筛分,然后再将筛分后的柠檬酸三乙酯和聚山梨醇酯80以及异丙醇混合,将该混合物加入到尤特奇L30D-55混合物中并进行充分地进一步混合,得到肠溶层颗粒包衣液一;将欧巴代YS-1-7006溶解于纯化水中,溶清后,加入气相硅胶,搅拌1小时,分散均匀,得到包衣液二。流化床处理器(尤特奇L30D-55):预热流化床(带有喷雾器)至入口温度为45℃。将隔离层颗粒加入流化床处理器机器中,使用肠溶层颗粒包衣液进行流化(入口温度:55℃;物料温度:42-45℃(设置43℃);喷雾气压:2.5bar;喷嘴:1.0mm;喷雾速度为15mL/min),其中包衣液1喷完后干燥30min,再喷包衣液二。生成的材料于60℃下在流化床中干燥1小时,得到的产品通过22目的网筛(最低)和16目网筛(最高)的筛分,得到肠溶衣包覆的右兰索拉唑的颗粒,即肠溶层颗粒。(5)肠溶缓释层颗粒的制备成份投料量(克)隔离层颗粒400聚山梨酯803.2柠檬酸三乙酯18.4滑石粉15.9纯化水200异丙醇1400尤特奇S100121尤特奇S100肠衣包衣液的制备:将尤特奇S100在合适的容器中与异丙醇和纯化水进行混合,得到的尤特奇S100混合物被保留用作进一步加工。将滑石粉(通过120目网筛筛分过)、柠檬酸三乙酯和聚山梨醇酯80和纯化水混合,然后将该混合物加入到尤特奇S100混合物中,并进行充分地进一步混合。流化床处理器:预热流化床(带有喷雾器)入口温度45℃并具合适的气流。将隔离层颗粒加入流化床处理器机器中,使用尤特奇S100肠衣包衣液进行流化(入口温度:45℃;产品温度:42-45℃(设置43℃);喷雾气压:2.1bar;喷嘴:1.0mm;喷雾速度为15mL/min)。生成的材料于60℃下在流化床中干燥1小时,该产品通过22目的网筛(最低)和16目网筛(最高)的筛分,得到肠溶衣包覆的右兰索拉唑的颗粒,即肠溶缓释层颗粒。(5)胶囊填充成份投料量(克)肠溶层颗粒500肠溶缓释层颗粒1500流体气相硅胶20最终混合:将肠溶层颗粒(25%,以右兰索拉唑总量计)、肠溶缓释层颗粒(75%,右兰索拉唑总量计)和流体气相硅胶,以提供最终产品。测试例1:缓释胶囊溶出度实验分别取由实施例1、实施例2制的右兰索拉唑缓释胶囊8粒,以及原研右旋兰索拉唑对照样8粒(参比制剂为Dexilant胶囊),参照释放度测定法(中国药典2010年版附录XD第二法)测定上述缓释胶囊在不同介质中的释放度。酸中释放量:以0.1N的盐酸溶液(8.5→1000)500ml为溶出介质,转速为每分钟75转,介质温度恒定在37℃士0.5℃,分别将实施例1、实施例2制备的胶囊、对照样投入到装有上述溶出介质的溶出杯中,依法操作,经2小时,取溶液10ml,0.45μm滤膜过滤,取滤液作为供试品溶液。另精密称取右旋兰索拉唑对照品20mg,至20ml棕色容量瓶,用甲醇溶液并定容至刻度,即得标准储备液。移取该液1.0ml至200ml棕色容量瓶,用0.1NHCl稀释并定容,作为对照溶液。取1cm的比色杯在301nm的波长下分别测定紫外吸收,扣除800-750nm波长段的平均值,计算释放量。检测实施例1、实施例2制备得到的右兰索拉唑缓释胶囊和对照样在酸中的释放量,检测结果见表3。表3实施例实施例1实施例2实施例3对照样(原研)酸中释放量0.89%0.78%0.79%1.18%参比制剂为Dexilant胶囊(对照样)由表3可知,本发明优选兰索拉唑缓释胶囊酸介质中的释放量均为标示量的3%以下,优于对照样。pH6.0释放量:在上述剩余490ml的酸溶液中,加入配制好的pH6.0PBS缓冲液浓溶液210ml,混匀后调pH至6.0(可用(5mol/L)氢氧化钠调整),作为溶出介质,转速为每分钟75转,介质温度恒定在37℃士0.5℃,依法操作,分别在5,10,20,30,45,60,120分钟取样10ml,0.45μm滤膜过滤,取续滤液作为供试品溶液。另移取4.0ml标准储备溶液至200ml棕色容量瓶,用混匀的pH6.0缓冲液稀释并定容,作为对照品溶液。取0.5cm的比色杯在230nm的波长下分别测定对照品溶液的紫外吸收,扣除800-750nm波长段的平均值,计算2小时的释放量。pH7.4释放量:在上述剩余630ml的缓冲液中,加入配制好的pH7.4PBS缓冲液浓溶液270ml,混匀后调pH至7.4,作为溶出介质,转速为每分钟75转,介质温度恒定在37℃士0.5℃,依法操作,分别在5,10,20,30,45,60,120分钟取样10ml,0.45μm滤膜过滤,取续滤液作为供试品溶液。另移取5.0ml标准储备溶液至100ml棕色容量瓶,用混匀的pH7.4缓冲液稀释并定容,作为对照品溶液。取0.5cm的比色杯在284nm的波长下分别测定紫外吸收,扣除800-750nm波长段的平均值,计算2小时的释放量。结果见图1,由图1可知,本发明得到的缓释胶囊的溶出速率与现有的原研样品相当,符合人体生物学要求。测试例2:缓释胶囊的稳定性实验外观本品应为白色至微黄色肠溶球状颗粒。含量色谱条件液相色谱仪:Agilent1200或类似;色谱柱:C18,150×4.6mm,5μm或类似;流速:1.0ml/min;波长:285nm;柱温:35℃;进样量:20μl;流动相:0.02mol/L的乙酸铵:乙腈(60:40),混合,摇匀。0.02mol/L乙酸铵:称取1.54g的乙酸铵用水溶解并稀释至1000ml,摇匀。溶液配制稀释剂:0.01MNaOH-CAN(1:1)供试液:精密称取250mg颗粒至100ml棕色容量瓶内,加入约40ml的甲醇,立即超声30分钟,在超声前几分钟,如果发现容量瓶内有小丸聚集,手动振摇使之分散。超声结束后,冷却至室温,加甲醇定容至刻度,摇匀。取适量混匀后溶液至刻度离心管,在3000rpm转速条件下离心10min。在0.45μm滤膜过滤。移取10ml至50ml量瓶中,用稀释剂稀释至刻度。对照液:精密称定工作对照品50mg于100ml量瓶中,用稀释液溶解并稀释至刻度,吸取10.0ml于50ml量瓶中,用稀释液稀释至刻度。有关物质色谱条件液相色谱仪:Agilent1200或类似;色谱柱:AgilentC18,150×4.6mm,5μm或相似;流速:1.0ml/min;进样量:20μl;波长:285nm;柱温:35℃;流动相A:0.02M乙酸铵—乙腈(80:20)。0.02mol/L乙酸铵:称取1.54g的乙酸铵用水溶解并稀释至1000ml,摇匀;流动相B:乙腈。稀释剂:0.01N氢氧化钠—ACN(1:1)按下表进行梯度洗脱检测结果见表4:表4相关物及外观由表4结果可知,本发明制备得到的胶囊在长时间存放时,具有稳定性优势,对照样在加速两个月后稳定性开始明显降低,单杂和总杂含量明显增加。测试例3:缓释胶囊生物利用度试验为了检验本发明制剂的生物利用度,研究了Beagle犬口服由实施例1,实施例2、实施例3制得的右兰索拉唑缓释胶囊和参比制剂(Dexilant胶囊)相对生物利用度。使用16只雄性Beagle犬进行研究,体重在15KG左右,禁食12小时。采用双制剂双周期交叉实验设计,于给药后0、0.5、1、1.5、2、2.5、3、4、6、8、12、24小时,取血2mL于有肝素的试管中,4000rpm离心10min,取上层血浆,然后HPLC测得右兰索拉唑在犬体内的血药浓度(微克/毫升)。结果见图2。由图2可知,本发明的右兰索拉唑缓释胶囊生物利用度与原研样品的生物利用度相当。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1