反式法尼基硫代水杨酸的应用的制作方法
本发明属于抗痴呆药物领域,具体涉及一种反式法尼基硫代水杨酸(Trans Farnesyl Thiosalicylic Acid/Salirasib,FTS)在制备抗痴呆药物中的应用。
背景技术:
痴呆已被称为世界上当前的“流行病”之一,在发达国家被估计列为第四位最常见的死亡原因。所谓的老年性痴呆症,最常见的为阿尔茨海默病(Alzheimer’s disease,AD)。阿尔茨海默病是一种发生在老年期及老年前期以进行性认知障碍为主要临床表现的神经退行性疾病。随着世界人口进入老龄化,阿尔茨海默病的发病率快速上升,几乎每7秒钟就有一人患病,预测到2050年将增加到11540万人。但是,迄今仍然缺乏疗效显著和可靠、副作用少、维持疗效的抗痴呆药物。
阿尔茨海默病脑的主要特征性病理变化为大脑皮层萎缩,β-淀粉样蛋白(Aβ)沉积,神经原纤维缠结,胆碱能神经系统损害,以及老年斑的形成。中枢胆碱能神经是构成学习记忆的重要生物学基础。海马的乙酰胆碱受体α7亚型(α7nACh)介导钙离子内流参与记忆的形成。AD脑中胆碱能神经元选择性退变。临床病理分析发现α7nACh受体在AD患者脑中的密度明显下降,且α7nACh受体水平降低与AD患者认知功能评分密切相关。Aβ能直接抑制α7nACh受体功能,损害突触传递和可塑性,提出α7nACh受体损害是AD早期认知障碍的重要病理机制。AD脑的神经细胞死亡,导致谷氨酸NMDA受体减少和功能降低也被认为是认知功能减退的关键病理机制。
Ras传导通路参与支气管哮喘、肿瘤等疾病的发生,因此Ras信号通路被作为抗肿瘤和治疗支气管哮喘的靶标。反式法尼基硫代水杨酸(Trans Farnesyl Thiosalicylic Acid/Salirasib,FTS)是一种新型的Ras抑制剂。FTS能模拟Ras的幾基末端法尼半胱氨酸,将活化Ras从它的膜镶嵌结构域上移去从而发挥Ras抑制功能。FTS对结合活化GTP的Ras具有明显的选择性抑制作用。在动物实验中,FTS无明显毒性或不良副作用。
技术实现要素:
解决的技术问题:本发明提供一种反式法尼基硫代水杨酸(FTS)在制备抗痴呆药物中的应用。
技术方案:反式法尼基硫代水杨酸在制备抗痴呆药物中的应用。。
所述反式法尼基硫代水杨酸(FTS)的结构为
FTS别名为2-[[(2E,6E)-3,7,11-三甲基-2,6,10-十二烷三烯-1-基]硫代]苯甲酸;
分子式:C22H30O2S,分子量:358.54。
有益效果:反式法尼基硫代水杨酸(FTS)对老年性痴呆,阿尔茨海默病认知障碍具有明显的改善作用。具体的说,(1)在阿尔茨海默病模型小鼠,FTS经口腔或腹腔注射处理都能改善模型小鼠的认知功能障碍,(2)FTS能减少Aβ的神经毒性,减少神经细胞死亡,(3)FTS能恢复阿尔茨海默病模型小鼠海马脑区的突触传递效应和长时程增强诱导,(4)FTS经口腔、腹腔注射或细胞孵育能剂量依赖地增强小鼠海马脑区的突触传递效应和长时程增强诱导。(5)FTS增强神经细胞谷氨酸NMDA受体的活性;(6)FTS增强神经细胞α7nACh的活性。
附图说明
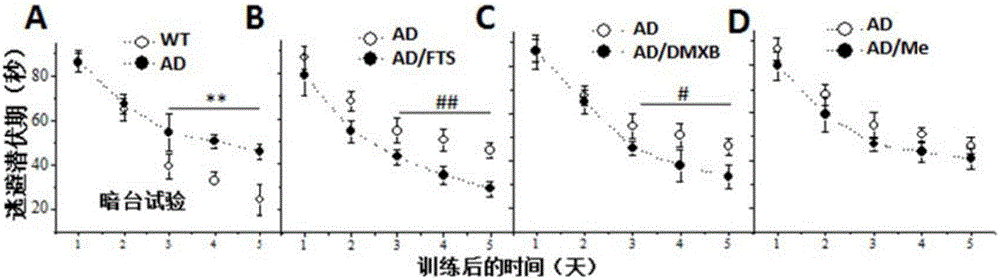
图1为FTS连续20天进行APP/PS1小鼠腹腔注射后,,(A-D))Morris水迷宫隐蔽平台的逃避潜伏期;
图2为Morris水迷宫空间探索时的各象限游泳时间百分比;
图3为“Y“迷宫的进臂交替率(%);
图4-A为海马CA1区的突触传递功能;
图4-B为海马CA1区的长时程增强(LTP)诱导。*P<0.05和**P<0.01vs.野生型小鼠;#P<0.05和##P<0.01vs.APP/PS1小鼠。
图5为FTS连续14天进行Aβ25-35小鼠腹腔注射后,(A-D)Morris水迷宫隐蔽平台的逃避潜伏期;
图6为Morris水迷宫空间探索时的各象限游泳时间百分比;
图7为“Y“迷宫的进臂交替率(%);
图8为海马CA1区神经细胞的计数;
图9为海马CA1区的突触传递功能和长时程增强(LTP)诱导。*P<0.05和**P<0.01vs.对照组小鼠;#P<0.05和##P<0.01vs.Aβ25-35小鼠。
图10为FTS增强海马脑区的突触传递效应和长时程增强诱导的试验结果图。为2-4小时用FTS处理海马脑片后,(A-B)海马CA1脑区的突触传递效应和海马CA1脑区的LTP诱导。*P<0.05和**P<0.01vs.对照组。
图11为FTS连续5天进行小鼠腹腔注射后,(A-B)海马CA1脑区的突触传递效应和海马CA1脑区的LTP诱导。
图12为FTS增强海马神经细胞的谷氨酸NMDA受体活性的试验结果图。为2-4小时用FTS处理海马脑片后,NMDA受体的钙离子内向电流(INMDA)的密度曲线。*P<0.05和**P<0.01vs.对照组。
图13为FTS连续5天进行小鼠腹腔注射后,NMDA受体的钙离子内向电流(INMDA)的密度曲线。*P<0.05和**P<0.01vs.对照组。
图14为FTS增强α7nACh受体活性的试验结果图,为2-4小时用FTS处理海马脑片后,乙酰胆碱(ACh)诱导的α7nACh受体内向电流(IACh)的密度曲线。*P<0.05和**P<0.01vs.对照组。
图15为FTS连续5天进行小鼠腹腔注射后,乙酰胆碱(ACh)诱导的α7nACh受体内向电流(IACh)的密度曲线。*P<0.05和**P<0.01vs.对照组。
具体实施方式
本发明结合附图和实施例作进一步的说明,(1)在阿尔茨海默病模型小鼠,FTS经口腔或腹腔注射等途径处理都能改善小鼠的认知功能障碍,(2)FTS能减少Aβ的神经毒性和神经细胞死亡,(3)FTS能恢复阿尔茨海默病模型小鼠海马脑区的突触传递效应和长时程增强诱导,(4)FTS经口腔或腹腔注射,细胞孵育等途径处理能剂量依赖地增强小鼠海马脑区的突触传递效应和长时程增强诱导。(5)FTS增强神经细胞谷氨酸NMDA受体的活性;(6)FTS增强神经细胞α7nACh受体的活性。
实施例1:FTS改善APP/PS1转基因小鼠(阿尔茨海默病模型)的认知功能和神经系统功能
实验主要材料:
动物饲养在南京医科大学实验动物中心,并且维持在温度23±2℃,湿度55±5%,12:12h光/暗循环的环境下。它们可以自由的取食物和水。
阿尔茨海默病模型小鼠
APP/PS1小鼠:10月龄雄性和雌性APPswe/PS1dE9双转基因型小鼠(以下简称,APP/PS1小鼠)从Jackson实验室(Bar Harbor,ME,USA)购得,运用Jackson实验室推荐的PCR方法进行基因型鉴定。
药物和试剂
反式法尼基硫代水杨酸(Trans-farnesylthiosalicylic acid,FTS)从美国Calbiochem公司购买(Cat#344555)。FTS在5%Tween 80产生乳液或溶解于dimethyl sulfoxide(DMSO)。用生理盐水或人工脑脊液稀释到使用浓度(DMSO的最终浓度低于0.1%),进行腹腔注射(5mg/kg)。
α7nACh受体激动剂3-(2,4-dimethoxybenzylidene)-anabaseine(DMXB,日本大昭制药公司提供,代号GTS-21,Taisho Pharmaceuticals,Tokushima,Japan)溶解在生理盐水中进行腹腔注射(2mg/kg)。
NMDA受体拮抗剂盐酸美金刚(易倍申,批号366825,规格10mg/片,丹麦灵北药厂产品)用0.1%的DMSO配制至所需浓度(Memantine,5mg/kg)进行灌胃给药。
实验操作
空间认知行为的评价:
Morris水迷宫试验:采用Morris水迷宫检测小鼠空间学习的长期记忆功能(Aβ25-35给药后第6-11天)。《隐蔽平台试验(hidden platform trial)》直径120cm、高45cm的圆形白色水池,水深30cm,水温保持(23±1)℃,水中加入食品添加剂深蓝色粉末。将水池等分成四个象限,在池壁上标记四个象限的入水点,在第四象限正中处放一个直径为7cm的圆形平台,平台顶低于水面1cm。迷宫上方安置带有视频拍摄系统的摄像机,以便同步记录小鼠的游泳轨迹。训练期间迷宫外参照物保持不变,室内保持安静。第一次实验前一天(Aβ25-35给药后第5天)撤去隐蔽平台,将小鼠放入水池中自由游泳60秒,以检测各组小鼠间的游泳能力有无差异。前五天进行定向航行实验,每天训练4次,每次训练的设定时间为90秒,训练时将小鼠面向池壁依次从各个象限的入水点入水,观察并记录小鼠的登台潜伏期(即从小鼠入水到找到水下隐蔽平台并立于其上所需时间)。登台潜伏期(逃避潜伏期,escape latency)反应了小鼠的学习记忆能力:登台潜伏期越短,说明小鼠的学习记忆能力越好。如果小鼠在90秒内未找到平台,潜伏期记为90秒。《空间探索试验(probe trial)》第6天(Aβ25-35给药后第11天)撤去隐蔽平台进行空间探索实验,小鼠从平台所在象限的对面象限入水,记录小鼠在60秒内的游泳轨迹,分别对小鼠在各个象限(target quadrant,opposite quadrant,adjacent right and left quadrant)的停留时间进行统计分析。对小鼠原站台所在象限停留时间%进行分析。
“Y”迷宫试验:短期记忆可以用Y-maze实验来评估。Y-maze即黑色Y形三等分辐射式迷路箱,由3个支臂和一个连接区组成,三臂互相间夹角120°,每臂长38.5厘米,上宽8厘米,下宽3.5厘米,高12厘米,三个臂可任选一臂为起始臂。每只小鼠从固定一臂的末端释放,让小鼠自由活动8分钟,记录每次进臂的次序。三次连续进入不同的三个臂被定为交替进臂(如:ABC,ACB,BAC,BCA,CAB,CBA)。交替进臂率的计算为:1-(错误次数/总次数-2)×100%。另外,总的进臂次数也可以确定。
海马突触传递功能检查
脑片制备:小鼠在乙醚麻醉下快速断头取脑,置于0–4℃冰冻人工脑脊液(artificial cerebrospinal fluid,ACSF)中2min左右备用。ACSF成分为(mM):124.0NaCl,4.5KCl,2.0CaCl2,1.0MgCl2,26.0NaHCO3,1.2NaH2PO4,10.0D-glucose。使用前通混合气(95%O2,5%CO2)使pH值稳定在7.4。鼠脑经稍加修饰后移至振动切片机浴槽内,在0–4℃ACSF中切取包含海马的冠状脑片2–4片(厚度400μm)。将切好的脑片迅速转移至持续通饱和氧混合气的ACSF中,在室温(22–25℃)下孵育至少60min后移至恒温记录浴槽,浴槽为浸润式灌流系统,灌流速度1mL/min,温度30±1℃,并持续通氧。记录电极使用标准硼硅酸盐玻璃管经P-97拉制仪拉制,冲灌2M NaCl溶液后电极阻抗为4–5MΩ。刺激电极为自制双极钨丝电极,直径50μm,极间距为100–150μm,尖端裸露40–60μm。刺激电极为双极钨丝电极置于海马脑片CA2或CA1区的谢弗侧支处,进行顺向刺激,距离刺激电极约2–3mm,其尖端位于脑片表面下50–200μm处,记录兴奋性的突触后电位EPSP。记录信号经放大器放大,Bridge模式,滤波5kHz,经A/D卡进行数模转换后用Clampex软件(Axon Inc.,USA)显示并保存。使用SEN-3301刺激器,刺激波宽0.1ms,刺激强度约为0.1–1.0mA,刺激间隔为15秒,每4个刺激进行一次叠加平均获得标准EPSP。每次实验时,刺激强度从阈值开始直至诱发最大EPSP,测定输入–输出(input-output relationship,I/O)曲线。每一个刺激强度取5个反应,以刺激强度为横坐标,以平均的EPSP斜率为纵坐标得到I/O曲线。根据I/O曲线,选择最大反应的刺激强度一半作为测试刺激强度进行长时程增强实验。长时程增强(long-term potentiation,LTP)的诱导是先用实验刺激强度刺激脑片作为条件测试,采集20分钟作为平均的基数值(100%),然后进行高频条件刺激(HFS,100Hz,100次刺激共1秒),再施以高频条件刺激前的同样实验测试,至少稳定记录1小时。高频条件刺激后如果EPSP斜率增加20%或以上,判断为LTP的发生。
统计学分析
定量资料表示为均值±标准误。Morris水迷宫原站台所在象限时间%和“Y”迷宫采用双因数和单因素方差分析。Scheffe`s检验测定两组间的差异显著性。将差异P<0.05定义为差异显著。
试验结果:
(1)Morris水迷宫—隐蔽平台试验:与野生型小鼠相比,10月龄APP/PS1小鼠的逃避潜伏期显著延长(**P<0.01vs.野生型小鼠,n=8,图1-A)。FTS(5mg/kg)处理(20天)能减少APP/PS1小鼠的逃避潜伏期(##P<0.01vs.APP/PS1小鼠,n=8,图1-B)。α7nACh受体激动剂DMXB(2mg/kg)20天处理能部分改善APP/PS1小鼠的逃避潜伏期(#P<0.05vs.APP/PS1小鼠,n=8,图1-C),而美金刚(5mg/kg)不能降低APP/PS1小鼠的逃避潜伏期(P>0.05,n=8,图1-D)。
(2)Morris水迷宫—空间探索试验:与野生型小鼠相比,APP/PS1小鼠在站台象限的游泳时间显著减少(**P<0.01vs.野生型小鼠,n=8,图2)。FTS处理能增加APP/PS1小鼠在站台象限的游泳时间(##P<0.01vs.APP/PS1小鼠,n=8)。DMXB能改善APP/PS1小鼠在站台象限的游泳时间(#P<0.05vs.APP/PS1小鼠,n=8)。美金刚不能增加APP/PS1小鼠在站台象限的游泳时间(P>0.05,n=8)。
(3)“Y“迷宫的检测结果显示,APP/PS1小鼠与野生型小鼠比较进臂交替率有显著性减少(**P<0.01vs.野生型小鼠,n=8,图3)。FTS处理能明显增加APP/PS1小鼠的进臂交替率(##P<0.01vs.APP/PS1小鼠,n=8)。DMXB能增加APP/PS1小鼠的进臂交替率(#P<0.05vs.APP/PS1小鼠,n=8)。美金刚处理并不能明显改善APP/PS1小鼠的进臂交替率(P>0.05,n=8)。
(4)电生理检测结果显示,APP/PS1小鼠的海马CA1区的突触传递斜率明显低于野生型小鼠(**P<0.01vs.野生型小鼠,n=8,图4-A)。FTS处理能提高APP/PS1小鼠的突触传递斜率(#P<0.05&##P<0.01vs.APP/PS1小鼠,n=8)。DMXB使用能恢复APP/PS1小鼠的突触传递斜率(#P<0.05vs.APP/PS1小鼠,n=8)。美金刚处理并不能明显改善APP/PS1小鼠的突触传递斜率(P>0.05,n=8)。
(5)电生理检测结果显示,APP/PS1小鼠的海马CA1区的LTP不能诱导(n=8,图4-B)。FTS处理能恢复APP/PS1小鼠的LTP诱导(n=8)。DMXB能30-40%恢复APP/PS1小鼠的LTP诱导(n=8)。而美金刚处理并不能恢复APP/PS1小鼠的LTP诱导(n=8)。
(图中略写符号,WT:野生型小鼠,AD:APP/PS1小鼠,Me:美金刚;PQ:站台象限,OQ:站台对面象限,R-AQ:站台右侧象限,L-AQ:站台左侧象限)。
结论:FTS有显著的抗阿尔茨海默病痴呆作用。
实施例2:FTS改善Aβ25-35小鼠(阿尔茨海默病模型)的认知损害和保护神经细胞
实验主要材料:
动物饲养在南京医科大学实验动物中心,并且维持在温度23±2℃,湿度55±5%,12:12h光/暗循环的环境下。它们可以自由的取食物和水。
药物和试剂
同实施例1。
阿尔茨海默病模型小鼠
将Aβ25-35溶于无菌双蒸水中配成1mg/mL的溶液,置于37℃水浴箱中孵育4天,使其成为聚集态。注射前可以用生理盐水稀释到终浓度。Maurice等人发现,以上方法处理后可以看到两种类型的Aβ聚集态,分别是双折射的纤维型和球型结构[1]。小鼠经2%水合氯醛腹腔麻醉(400mg/kg)后固定于小鼠脑立体定位仪上。参照Paxinos和Watson小鼠立体定位图谱,以前囟为参考点,在前囟后0.3mm,右侧1.0mm,深度2.5mm用微量进样器将3μl聚集态Aβ25-35(6nmol)或灭菌生理盐水(对照组)分别于15min缓慢注射到小鼠双侧的侧脑室,注射完毕后静待5min后缓慢地拔出微量注射器,缝合皮肤。注射位置的准确性预先通过注射墨汁来确定。动物于Aβ25-35注射后第4-10天进行Morris水迷宫测试,第11天进行“Y”迷宫检测,测得空间学习记忆能力,第12-16天进行海马组织的病理学检查和电生理学LTP检测。
实验操作
空间认知行为的评价:同实施例1。
组织学的检测:Aβ25-35给药后第14天,小鼠用2%水合氯醛(400mg/kg)腹腔麻醉,0.01M PBS和4%多聚甲醛灌流固定,经常规后固定、梯度酒精脱水、透明、石蜡包埋后,做5μm海马连续冠状石蜡切片。石蜡切片在37℃烘箱中过夜后,室温存放。《甲苯胺蓝染色》5μm石蜡切片在37℃烘箱中放1h后,脱蜡水化,ddH2O洗10min,经0.25%甲苯胺蓝染色后用95%酒精分色、梯度酒精脱水、二甲苯透明、中性树胶封片。以海马CA1区和CA3区锥体神经细胞染色清晰为标准,光学显微镜下观察脑组织病理变化(图8的左图)。存活的锥体细胞表现为圆形细胞体中带有一个清晰深染的细胞核。将已固定的海马组织用0.01M PBS冲洗,置于15%蔗糖缓冲溶液中,4℃冰箱过夜,待组织沉底后置于30%蔗糖缓冲液脱水,组织沉底后进行冰冻切片,冠状切片厚40μm,每5张取1张得海马连续切片,进行甲苯胺蓝和TUNEL染色。利用Microbrightfield Stereo Investigator软件计算整个海马CA1或CA3区三维层面上的正常锥体细胞数(图-2G的右图)。
海马突触传递功能检查:同实施例1。
统计学分析方法:同实施例1。
试验结果:
(1)Morris水迷宫—隐蔽平台试验,与对照组相比,Aβ25-35小鼠的逃避潜伏期显著延长(**P<0.01vs.对照组小鼠,n=8,图5-A)。FTS(5mg/kg)处理(12天)能减少Aβ25-35小鼠的逃避潜伏期(##P<0.01vs.Aβ25-35小鼠,n=8,图5-B)。DMXB(2mg/kg)能改善Aβ25-35小鼠的逃避潜伏期(#P<0.05vs.Aβ25-35小鼠,n=8,图5-C)。但是,美金刚处理几乎不能降低Aβ25-35小鼠的逃避潜伏期(#P<0.05vs.Aβ25-35小鼠,n=8,图5-D)。
(2)Morris水迷宫—空间探索试验:与野生型小鼠相比,Aβ25-35小鼠在站台象限的游泳时间显著减少(**P<0.01vs.对照组小鼠,n=8,图6)。FTS处理能增加Aβ25-35小鼠在站台象限的游泳时间(##P<0.01vs.Aβ25-35小鼠,n=8)。DMXB能部分改善Aβ25-35小鼠在站台象限的游泳时间(#P<0.05vs.Aβ25-35小鼠,n=8),但是美金刚处理并不能改善Aβ25-35小鼠在站台象限的游泳时间(P>0.05,n=8)。
(3)“Y“迷宫的检测结果显示,Aβ25-35小鼠与对照组比较进臂交替率有显著性减少(**P<0.01vs.对照组小鼠,n=8,图7)。FTS处理处理能明显增加Aβ25-35小鼠的进臂交替率(##P<0.01vs.Aβ25-35小鼠,n=8)。DMXB能部分改善Aβ25-35小鼠的进臂交替率(#P<0.05vs.Aβ25-35小鼠,n=8)。美金刚不能改善Aβ25-35小鼠的进臂交替率(P>0.05,n=8)。
(4)海马细胞计算结果显示,与对照组相比Aβ25-35小鼠海马CA1区锥体细胞数量明显减少(*P<0.05vs.对照组小鼠,n=8,图8)。FTS处理能明显减少Aβ25-35小鼠海马CA1区锥体细胞的丢失(#P<0.05vs.Aβ25-35小鼠,n=8)。DMXB或美金刚并不能减少Aβ25-35小鼠的锥体细胞的丢失(P>0.05,n=8)。
(5)电生理检测结果显示,Aβ25-35小鼠的海马CA1区不能诱导LTP(n=8,图9)。FTS处理能恢复Aβ25-35小鼠的LTP诱导(n=8)。DMXB能部分恢复Aβ25-35小鼠的LTP诱导(n=8)。但是,美金刚不能改善Aβ25-35小鼠的LTP诱导(n=8)。
(图中略写符号,control:对照组小鼠,Aβ:Aβ25-35小鼠,Me:美金刚;PQ:站台象限,OQ:站台对面象限,R-AQ:站台右侧象限,L-AQ:站台左侧象限)。
结论:FTS具有神经保护作用和抗阿尔茨海默病痴呆的作用。
实施例3:FTS增强小鼠海马脑区的突触传递效应和长时程增强诱导。
实验主要材料:
3月龄的ICR小鼠购自南京医科大学实验动物中心。动物饲养在南京医科大学实验动物中心,并且维持在温度23±2℃,湿度55±5%,12:12h光/暗循环的环境下。它们可以自由的取食食物和水。
药物和试剂
同实施例1。FTS在5%Tween 80产生乳液或溶解于dimethyl sulfoxide(DMSO)。用生理盐水或人工脑脊液(mM:124.0NaCl,4.5KCl,2.0CaCl2,1.0MgCl2,26.0NaHCO3,1.2NaH2PO4,10.0D-glucose)稀释到使用浓度(DMSO的最终浓度低于0.1%),进行腹腔注射(5mg/kg)或脑片孵育(5-15μM)。
海马突触传递功能检查:同实施例1。
统计学分析方法:同实施例1。
试验结果:
(1)用FTS(5-15μM)进行2-4小时的海马脑片孵育能剂量依赖地增强海马CA1脑区的EPSP斜率(*P<0.05和**P<0.01vs.对照组小鼠,n=10;图10-A)。
(2)用FTS(10μM)进行2-4小时的海马脑片孵育,海马CA1脑区的高频条件刺激(100Hz,100次刺激)诱导LTP的幅值明显增加(图10-B)。
(3)为FTS(5mg/kg)连续5天进行小鼠腹腔注射后,海马CA1脑区的EPSP斜率明显增大(**P<0.01vs.对照组小鼠,n=10;图11-A)。
(4)为FTS(5mg/kg)连续5天进行小鼠腹腔注射后,在海马CA1脑区给予弱的高频条件刺激(10次共0.1秒)能诱导LTP,但是在对照组小鼠不能诱导LTP(图11-B),提示LTP诱导阈值显著降低。
结论:FTS能提高神经回来兴奋性和降低LTP诱导阈值。
实施例4:FTS能增强神经细胞的NMDA受体活性
实验主要材料:
30-35天龄的ICR小鼠购自南京医科大学实验动物中心。动物饲养在南京医科大学实验动物中心,并且维持在温度23±2℃,湿度55±5%,12:12h光/暗循环的环境下。它们可以自由的取食食物和水。
药物和试剂
同实施例1。
实验操作
电生理的检测和分析:(1)海马脑片制备:乙醚麻醉后快速断头取脑,置于0-4℃冰冻人工脑脊液中1分钟备用。人工脑脊液使用前通混合气(95%O2,5%CO2)使pH值稳定在7.4。鼠脑稍加修饰后移至振动切片机浴槽内,在0-4℃人工脑脊液中切取包含海马的冠状脑片3-6片(厚度350μm)。将切好的脑片迅速转移至持续通混合气的氧饱和人工脑脊液中,在28℃左右孵育至少60分钟后移至记录浴槽。浴槽为浸润式灌流系统,灌流速度2mL/min,灌流液为持续通95%O2/5%CO2混合气体的ACSF。微电极的拉制:选用长10cm,外径为1.5mm,内径为0.86mm标准硼硅酸盐玻璃毛细管,在水平拉制仪上用四步拉制法拉制成记录用微电极。充灌电极内液后电极尖端入水阻抗为4-6MΩ。电极无需抛光即可直接进行实验。循环灌流系统:实验中人工脑脊液用作灌流液进行循环灌流。溶液置于一定容积的刻度管中,并持续给95%O2/5%CO2混合气,通过恒流泵的动力作用将氧饱和ACSF泵入记录槽。溶液灌流速度由调节阀进行控制,通常为2-3mL/min,需要特殊冲洗的实验,可将流速调至5-8mL/min,以使药物快速而有效的作用于脑片细胞或者将残留的药物迅速冲洗干净。灌流液温度通过恒温水浴锅控制在28-30℃,使得记录槽温度维持在室温附近。保持实验室封闭透光,室内常温(22-25℃),并具备较好的隔离噪音等条件。灌流系统所用的灌流管定期(两周)更换,以免被污塘堵塞。
(2)全细胞膜片钳记录:实验在室温(22-25℃)下进行。将孵育好的脑片,转移到记录糟内,并用铂金丝网固定,置于正置显微镜载物台(配有40×的水镜)上。在40×水镜下,通过CCD(EvolutuonQE)采集图象并可在显示器上进行实时观察。实验过程中,选取脑片上CA1或CA3区胞体饱满均匀,边界清晰的神经元为记录对象。在电压钳模式下用MP-225微型操纵仪引导充有电极内液的玻璃微电极靠近细胞,记录电极入水前要先给予一正压(将1mL注射器向前轻推1/10的体积),以防止电极尖端被污染。待电极靠近细胞,细胞出现小凹陷,并能观察到电极阻抗上升3-5MΩ,释放正压并用给予适当负压进行封接,同时逐步将钳制电压调节到–70mV,形成高阻封接(>1GΩ)。待形成稳定的封接后,给予强烈而短促的负压打破电极尖端下的小片细胞膜,从而形成稳定的全细胞记录模式。全细胞膜片钳所用放大器为EPC-10,数据采集使用2.9kHz低通滤波,并在10kHz采样。在电流记录时,通过实时监控窗口,监测串联电阻(Rs)的变化,防止破膜的回封引起电流动力学参数如幅度和衰减时间(decay time)的变化。其中Rs或者电容值的变化不应超过原值的20%,同时保持Rs<30M,Ra>200M。所采集数据中统计时舍去未补偿的串联电阻导致的电压钳误差超过5mV的神经元数据。采样后数据用PulseFit(HEKA公司)进行数据分析。记录NMDA受体电流(INMDA)时,钳制为–60mV,NMDA溶解到灌流液中,通过快速喷药系统局部对目标神经元胞体进行加药。同时浴槽循环灌流液中加入1μM strychnine,10μM bicuculline,10μM NBQX和0.1μM TTX。电生理结果用pClamp软件(Axon公司)或PulseFit软件(HEKA公司)进行数据处理。膜片钳记录数据分析:相关量效曲线用Hill方程进行拟合,n为Hill系数,EC50为半数有效剂量。
实验结果
(1)海马脑片进行FTS(10μM)4小时孵育,能增加NMDA诱导的NMDA受体内向电流(INMDA)的密度(*P<0.05和**P<0.01vs.对照组小鼠,n=10;图12)。
(2)给与小鼠连续5天的FTS(5mg/kg)腹腔注射,能增加INMDA的密度(**P<0.01vs.对照组小鼠,n=10;图13)。
结论:FTS能增强NMDA受体的活性。
实施例5:FTS能增强神经细胞α7nACh受体的活性
实验主要材料:
同实施例1。
药物和试剂
同实施例4。
实验操作
电生理的检测和分析:(1)同实施例4。记录α7nACh受体电流(IACh)时,钳制为–60mV,乙酰胆碱(ACh)溶解到灌流液中,通过快速喷药系统局部对目标神经元胞体进行加药。同时浴槽循环灌流液中加入1μM strychnine,10μM bicuculline,10μM NBQX和0.1μM TTX。电生理结果用pClamp软件(Axon公司)或PulseFit软件(HEKA公司)进行数据处理。膜片钳记录数据分析:相关量效曲线用Hill方程进行拟合,n为Hill系数,EC50为半数有效剂量。
实验结果
(1)海马脑片进行FTS(10μM)4小时孵育,能增加乙酰胆碱(ACh)诱导的α7nACh受体内向电流(IACh)的密度(*P<0.05vs.对照组小鼠,n=10;图14)。
(2)给与小鼠连续5天的FTS(5mg/kg)腹腔注射,能增加IACh的密度(**P<0.01vs.对照组小鼠,n=10;图15)。
(3)结论:FTS能增强α7nACh受体的活性。
- 还没有人留言评论。精彩留言会获得点赞!