一种鱼胶原蛋白修复海绵及其制备方法与流程
本发明属于生物医用材料领域,涉及一种胶原蛋白海绵及其制备方法,特别涉及一种以鱼皮为原料提取的胶原蛋白,制备孔隙率高、力学性能可调的适于软组织修复的生物医用材料,所述海绵适用于烧烫伤缺损、溃疡、创伤创面等的修复治疗。
背景技术:
胶原蛋白是人体组织的基本成分之一,人体蛋白质总量的 1/3 左右是胶原蛋白。胶原蛋白本身广泛分布于身体取的各个器官之中,如皮肤、骨骼、角膜等。当胶原蛋白被损害后,很多器官(如皮肤、骨骼等)的功能也随之受到影响。在生物医学产业,胶原蛋白是最关键、需求量最庞大的生物医学材料之一。胶原蛋白的种类很多,目前已发现有 26 种,按不同类型可分为Ⅰ、Ⅱ、Ⅲ、Ⅳ型等,其中I型胶原蛋白材料因综合性能优良而被广泛利用。特别是在医学领域中,胶原蛋白可制成胶原海绵、胶原膜或人工皮肤等。美国在上世纪 90 年代就批准将Apligraf 用于静脉溃疡的治疗,国内对于胶原蛋白用作止血材料的研究也取得了一定的进展。由于胶原蛋白本质上就是一种天然组织支架材料,因此胶原蛋白成为构建组织工程支架的理想材料,如皮肤、骨组织、血管等器官的支架,之后体内组织细胞爬入支架内与其生长融合,引导组织再生。纯胶原蛋白组织工程支架具有良好的生物相容性、可塑性、易加工并能有效促进细胞粘附和增殖等优点。
但对脊椎动物与人类共患传染病的忧虑难以消除,如牛海绵状脑病、猪流感、禽流感等。从2009年农业部同卫生部颁布的《人畜共患传染病名录》中,可以发现从鱼类来源的共患传染病甚少。我国是世界上最大的淡水鱼养殖国,据统计2013年我国养殖淡水鱼产量2000多万,随着我国鱼类加工业的快速发展,鱼加工副产物(鱼皮和鱼鳞)利用程度很低,但是其中(特别是鱼皮中)I型胶原蛋白含量在80%以上,因此从鱼皮总提取胶原蛋白不仅能够充分利用资源,提高鱼类加工的附加值,而且可以减少环境污染。所以说鱼皮可为鱼源胶原的开发供给充足的原料,具备开发安全、经济的胶原材料的潜力。
中国专利 CN103772734A 公开了一种哺乳动物源性的高纯度胶原蛋白海绵的制备方法,其含盖了胶原蛋白的提取、提纯、交联和冻干成型的整个过程,其主要目的首先是获得高纯度的胶原蛋白,而后再利用其制备胶原蛋白海绵,但是由于是哺乳动物源性,其成本过高,一定程度上限制了其产业化生产;发明专利CN103007336A公开了一种鱼皮胶原基复合海绵及其制备方法,它是以鱼皮胶原与壳聚糖为原料,冷冻干燥后经交联再进行二次冷冻干燥制备,该专利使用壳聚糖与胶原蛋白混合制备海绵,其中壳聚糖生物相容性较胶原蛋白差, 所以只能作为体表用材料使用,不能作为体内修复材料的应用;发明专利CN103525097A公开了一种水产鱼皮明胶海绵及其制备方法。本发明以水产鱼皮明胶为主料,壳聚糖为辅料,戊二醛为交联剂,将不同配比的原料液通过冷冻干燥制备出性质不同的鱼皮明胶海绵,且其制备过程简单、廉价易得,克服了现有胶原海绵的一些不足。但其明胶失去了胶原特有的三螺旋结构,所以其生物活性远远低于胶原,限制了在生物医学方面的应用,同时该专利所用的交联剂为浓度较高的戊二醛,其产生的细胞毒性不可控。
因此,需要克服现有技术中的上述问题,研发出一种物美价廉、生物相容性好、生物活性高和降解性能可控的胶原蛋白海绵。
技术实现要素:
针对上述情况,本发明的目的是提供一种鱼胶原蛋白修复海绵的制备方法,其制备的海绵不仅保留了胶原的三螺旋结构,而且其生物活性高、降解可控。其特征在于包括以下步骤:
1.一种鱼胶原蛋白修复海绵及其制备方法,其特征在于,包括如下步骤:
1)取冻干的鱼皮胶原蛋白原料,用冰醋酸完全溶解,溶液溶度为8~20mg/ml,然后调节其pH为4~6,20-30℃静置处理24小时, 进行微纳结构自组装;
2)将上述自组装之后的胶原蛋白溶液注入模具中,在-40℃~-80℃下真空冷冻干燥24~48h,得到鱼胶原蛋白海绵;
3)将冻干后的鱼胶原海绵用交联剂进行4~24小时的低温交联,然后纯化水进行清洗透析,再次进行冷冻干燥,然后进行包装与辐照灭菌处理,即可得生物学性能优良、降解性可控的鱼皮胶原蛋白修复海绵。
2. 根据权利要求1所述的一种鱼胶原蛋白修复海绵及其制备方法,其特征在于,所述的鱼胶原蛋白原料的制备方法如下:取鱼皮清洗干净并脱水,加入正丁醇脱脂,于0-4℃搅拌 8-12 小时后加入0.05- 0.2M的NaOH溶液中搅拌数小时,再用去离子水充分清洗经碱溶液处理后的鱼皮直至中性;将清洗后的鱼皮以料液比1:5-20(w/w)的比例放入 0.05-0.5M 的酸性溶液中,加入蛋白酶搅拌 24-60 小时,酶解处理得酶解胶原液,最后加入无水乙醇溶液,直至所述胶原液中的乙醇含量达到30-80%,静置,过滤,得胶原蛋白,无水乙醇脱水,低温真空干燥得胶原蛋白粉末,获得分子量高达300kD的医用级生物材料用天然高分子鱼皮胶原。
3.根据权利要求1所述的一种鱼胶原蛋白修复海绵及其制备方法,其特征在于,所述的鱼皮包括草鱼、罗非鱼、三文鱼、青鱼、鲨鱼在内的鱼皮产物。
4.根据权利要求1所述的一种鱼胶原蛋白修复海绵及其制备方法,其特征在于,所述的冰醋酸体积分数为0.3%~5%。
5.根据权利要求1所述的一种鱼胶原蛋白修复海绵及其制备方法,其特征在于,所述的自组装条件为20-30℃、弱酸性条件下静置致使胶原内部的纳米胶原丝生长,形成网络结构。
6.根据权利要求1所述的一种鱼胶原蛋白修复海绵及其制备方法,其特征在于,所述的注模模具选择为特氟龙模具。
7.根据权利要求1所述的一种鱼胶原蛋白修复海绵及其制备方法,其特征在于,所述交联剂有碳化二亚胺、乙醇、环氧化合物、羟基琥珀酰亚胺、二苯基磷酸盐 ( DPPA)、戊二醛、甲醛、乙醛酸或京尼平中的一种或几种,交联时间为4~24小时。
8.根据权利要求1所述的一种鱼胶原蛋白修复海绵及其制备方法,其特征在于,制备的胶原蛋白修复海绵的孔径为100~400微米,孔隙率为85%以上。
根据权利要求2所述的一种鱼胶原蛋白修复海绵及其制备方法,其特征在于,
鱼皮胶原原料蛋白含量在95%以上,pH大于4.0 。
由于上述技术方案的运用,本发明设计了以鱼皮基为原料制备胶原蛋白修复海绵具有以下优点:
1.本发明所用主要原料为鱼皮提取物,原料来源广泛、廉价易得,极大地克服了现有胶原产品价格昂贵的缺点,提高了经济效益;
2.本发明通过利用胶原三螺旋结构的自组装机理,使其在微纳结构更贴近人体细胞外基质的结构,使其在修复使用上更具有生物相容性;
3.本发明提供的胶原海绵,其孔隙率高,孔径大小均匀且适中,符合更利于细胞与组织的生长;
4.该发明生产上可控性很好,可促进传统医药、医疗器材产业向以生物技术为标志的高新技术迅速发展,符合我国建设资源节约型和环境友好型社会的要求,社会效益显著。
附图说明
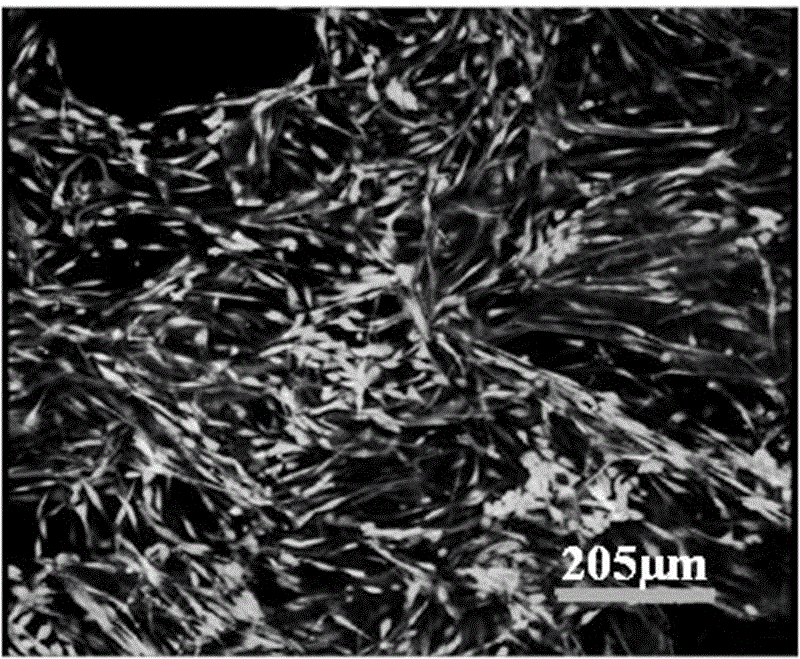
图1:为实施例1中制备的鱼胶原蛋白修复海绵的微观多孔结构图。
图2:为实施例3中细胞相容性实验的激光共聚焦谱图。
图3:为实施例4中肌肉植入实验1个月后组织HE染色观察图。
具体实施方式
下面结合附图及实施例对本发明作进一步描述。
实施例1
胶原蛋白原料的制备:
取鱼皮清洗干净并脱水,加入400ml 10%的正丁醇脱脂,于0-4℃搅拌 8小时后加入0.05M的NaOH溶液中搅拌10小时,再用去离子水充分清洗经碱溶液处理后的鱼皮直至中性。
将清洗后的鱼皮以料液比1:5(w/w)的比例放入0.5M 的酸性溶液中,加入蛋白酶搅拌 24小时,酶解处理得酶解胶原液,最后加入200ml无水乙醇溶液,最终所述胶原液中的乙醇含量达到70%,静置,过滤,得胶原蛋白,再用无水乙醇脱水,低温真空干燥得胶原蛋白粉末,获得分子量高达300kD的医用级生物材料用天然高分子鱼皮胶原。
胶原蛋白修复海绵的制备:
取上述冻干的鱼皮胶原蛋白原料,用冰醋酸完全溶解,溶液溶度为10mg/ml,测其pH为4.2,20℃静置处理24小时, 进行微纳结构自组装。
将上述自组装之后的胶原蛋白溶液注入模具中,在-40℃条件下真空冷冻干燥48h,得到鱼胶原蛋白海绵。
将冻干后的鱼胶原海绵浸入到50ml含50mmol/l(MES)的体积分数为50%的乙醇溶液中,先进行30min预交联,然后加入EDC65mg和NHS15mg进行12小时的低温交联,然后纯化水进行清洗透析,再次进行冷冻干燥,然后进行包装与辐照灭菌处理,即可得生物学性能优良、降解性可控的鱼皮胶原蛋白修复海绵。
图1为所制备的鱼胶原蛋白修复海绵的微观多孔结构图。
实施例2
胶原蛋白原料的制备:
取鱼皮清洗干净并脱水,加入600ml 10%的正丁醇脱脂,于0-4℃搅拌 12小时后加入0.2M的NaOH溶液中搅拌8小时,再用去离子水充分清洗经碱溶液处理后的鱼皮直至中性。
将清洗后的鱼皮以料液比1:10(w/w)的比例放入0.5M 的酸性溶液中,加入蛋白酶搅拌 24小时,酶解处理得酶解胶原液,最后加入100ml无水乙醇溶液,最终所述胶原液中的乙醇含量达到50%,静置,过滤,得胶原蛋白,再用无水乙醇脱水,低温真空干燥得胶原蛋白粉末,获得分子量高达300kD的医用级生物材料用天然高分子鱼皮胶原。
胶原蛋白修复海绵的制备:
取上述冻干的鱼皮胶原蛋白原料,用冰醋酸完全溶解,溶液溶度为12mg/ml,测其pH为4.2,25℃静置处理12小时, 进行微纳结构自组装。
将上述自组装之后的胶原蛋白溶液注入模具中,在-80℃条件下真空冷冻干燥48h,得到鱼胶原蛋白海绵。
将冻干后的鱼胶原海绵浸入到70%的含有0.003%的戊二醛溶液中低温交联12小时,然后纯化水进行清洗透析,再次进行冷冻干燥,然后进行包装与辐照灭菌处理,即可得生物学性能优良、降解性可控的鱼皮胶原蛋白修复海绵。
实施例3
鱼胶原蛋白原料制备方法同实施例2。
胶原蛋白海绵的制备:
取上述冻干的鱼皮胶原蛋白原料,用冰醋酸完全溶解,溶液溶度为15mg/ml,测其pH为5,25℃静置处理24小时, 进行微纳结构自组装。
将上述自组装之后的胶原蛋白溶液注入模具中,在-80℃条件下真空冷冻干燥36h,得到鱼胶原蛋白海绵。
将冻干后的鱼胶原海绵浸入到1%的京尼平溶液中交联48小时,然后用1%的甘氨酸清洗,最后纯化水进行清洗,再次进行冷冻干燥,然后进行包装与辐照灭菌处理,即得鱼皮胶原蛋白修复海绵。
将上述胶原蛋白海绵灭菌进行体外细胞实验,操作方法:除吸收容量外,按照1.25mL/cm2的比例加入浸提介质(浸提介质:含血清细胞培养液)浸提,(37±1)℃,(24±2)h制备试验液,取试验液按照GB/T14233.2-2005中规定的MTT方法进行评级。结果显示细胞毒性为1级。
图2为实施例3中细胞相容性实验的激光共聚焦谱图。
实施例4
用实施例1中的海绵进行肌肉植入实验:
试验前,剪去兔脊椎两侧兔毛,试验时用戊巴比妥钠静脉注射麻醉,按外科常规手术要求以碘酊和75%(V/V)乙醇消毒手术区域皮肤,在兔脊椎两侧约2.5cm处等距离各选4个植入点,每点间隔2.5cm,将试验样品植入到肌肉组织内,每点植入样品大小为10*10mm。
将试验样品植入到家兔背部两侧的的肌肉组织内,于植入1周、2周、3周、4周分别处死动物,肉眼观察植入部位并切取包括植入材料及周围足够多的未受影响的肌肉组织,进行HE染色观察。
在本试验条件下,肌肉植入一周后组织周围有大量嗜中性粒细胞和淋巴细胞,植入两周可见少量淋巴时报,有多核巨细胞且有疏松囊腔形成。肌肉植入4周后,可见样品绝大部分被吸收,仅有少量参与,可见胶原纤维,囊腔形成较前致密。
图3为实施例4中肌肉植入实验1个月后组织HE染色观察图。
显然,上述实施例仅仅是为清楚地说明所作的举例,而并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以列举。而因此所引伸出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
- 还没有人留言评论。精彩留言会获得点赞!