4‑羟基‑2,2,6,6‑四甲基哌啶氧的应用的制作方法
本发明涉及一种改善精子质量的药物,具体涉及4-羟基-2,2,6,6-四甲基哌啶氧的应用。
背景技术:
目前,不孕不育率约占到育龄夫妇的十分之一,其中男性因素不育约占一半,但是不育男性中超过85%均能够产生精子。男性不育临床上的两种重要表现是无精子症和极少精子症,即无精子或有少量精子但畸形且无运动能力,导致男性不育,提高精子的质量是治疗该类型男性不育的一种重要方法。这也说明了改善精子发生从而提高精子质量发挥精子正常功能的重要性。
治疗不孕不育有多种辅助生殖手段,如人工授精(IUI)、体外受精—胚胎移植(IVF)和卵浆内单精子注射(ICSI)等。这些治疗的前体是获得男性不育患者的精子或精子细胞,对于无精子症患者临床采用辅助生殖技术需要通过有创手段获得精子或精子细胞,如睾丸切开活检等。针对该类无精子症患者,倘若能够正常产生部分精子,可为无精子症患者以及极少精子症患者治疗提供无创治疗的可能。
技术实现要素:
解决的技术问题:本发明提供一种4-羟基-2,2,6,6-四甲基哌啶氧的应用,对无精极少精的小鼠模型进行Rescue实验结果表明,睾丸形态有明显改善,精子数量与质量显著提高。
技术方案:4-羟基-2,2,6,6-四甲基哌啶氧在制备改善精子发生的抗氧化产品中的应用。
改善精子发生的抗氧化产品,该产品含有4-羟基-2,2,6,6-四甲基哌啶氧。
优选的,每毫升注射针剂含有以下组分:0.0100g 4-羟基-2,2,6,6-四甲基哌啶氧(Tempol)、1mL生理盐水。
有益效果:1、本发明改善精子数量与质量,对无精子症或者极少精子症小鼠模型进行45天的连续服药,服药结束后取材实验发现精子数量较未给药组有所增多,且精子畸形率下降至正常范围,充分说明Tempol有改善精子发生的作用,也为无精子症患者进行辅助生殖提供了有意义的参考。2、本发明中的溶剂为医用生理盐水,不涉及乙醇或者DMSO等有机溶剂,避免了乙醇或者DMSO对精子的毒害作用。
附图说明
图1 Tempol对小鼠睾丸生精细胞的作用图;
图示说明:A为睾丸切片PAS染色,B横坐标为组别,纵坐标为各级生精细胞(细偶线期精母细胞(Z)、粗线期精母细胞(P)、双线期精母细胞(D)、圆形精子(RS)、长形精子(ES))与支持细胞(Ser)的比值。
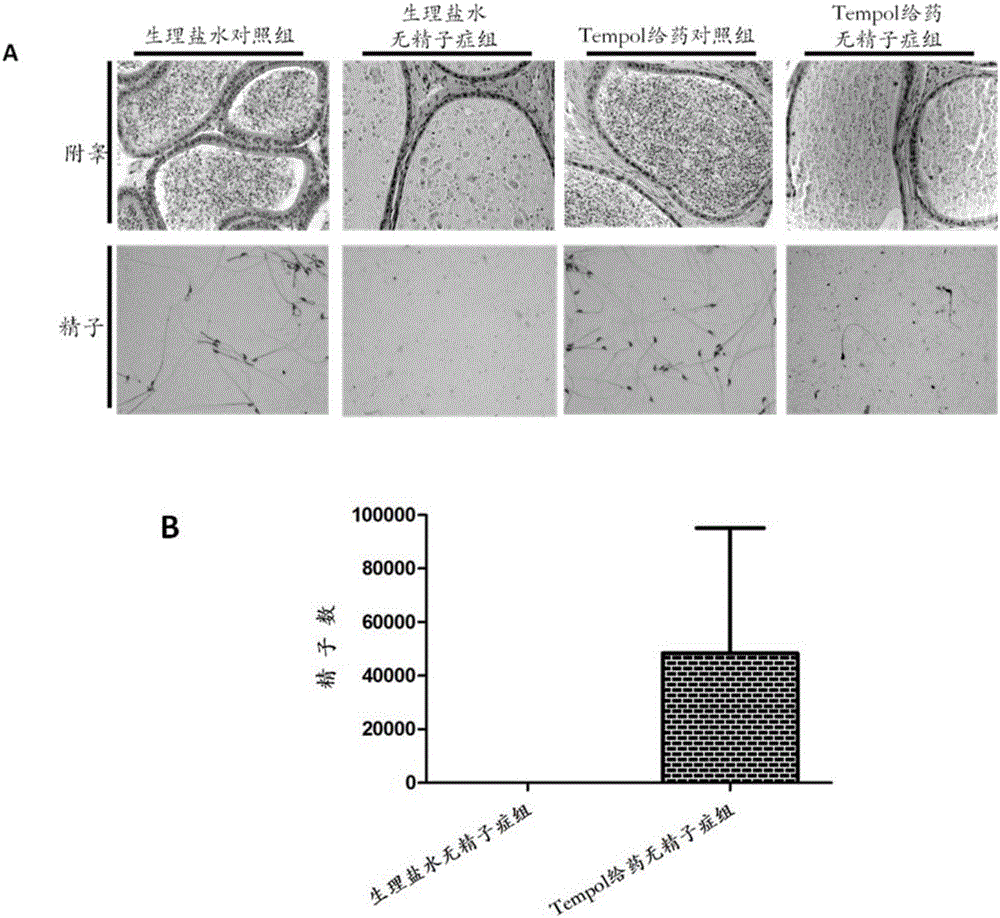
图2 Tempol对小鼠精子数量改善作用图;
图示说明:A为附睾切片及精子涂片HE染色,B为精子总数统计,横坐标为组别,纵坐标为精子数。
图3 Tempol对小鼠氧化应激水平的降低作用图;
图示说明:A为MDA水平统计,横坐标为组别,纵坐标为MDA比值。B为DHE荧光强度统计,横坐标为组别,纵坐标为DHE荧光强度比。
具体实施方式
以下实施例进一步说明本发明的内容,但不应理解为对本发明的限制。在不背离本发明精神和实质的情况下,对本发明方法、步骤或条件所作的修改和替换,均属于本发明的范围。若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段。以下实施例中所使用的试剂和材料均为市售产品,例如,实验中所使用的生理盐水可从SIGMA-ALDRICH,MO,USA购买。
实施例1
1.给药阶段:
给药动物——6月龄无精子症小鼠(来源于生殖医学国家重点实验室的PEX3基因缺
陷导致的遗传性无精子症小鼠模型);
给药周期——45天(小鼠一个完整生精周期);
给药方式——将Tempol(颗粒)溶于生理盐水腹腔注射;
给药量——0.0025g/天(小鼠体重以25g计算)。
2.取材
1)取材:一侧睾丸、附睾MDF固定,另一侧睾丸冰冻切片、提取睾丸组织蛋白,附睾挤精子测活力、做精子涂片;
MDF固定液:甲醛30mL、乙醇15mL、冰醋酸5mL、ddH2O 50mL;
2)组织脱水包埋(睾丸,附睾),按以下步骤处理:
→80wt.%酒精1h;
→80wt.%酒精1h;
→90wt.%酒精1h;
→90wt.%酒精1h;
→100wt.%酒精(一)30min;
→100wt.%酒精(二)30min;
→酒精:二甲苯(1:1)25min;
→二甲苯25min;
→石蜡(一)45min;
→石蜡(二)45min;
→包埋,蜡块于4℃保存。
3)组织切片
切片:切3-5μm厚度,切片于65℃烤箱中过夜(48h后移至37℃烤箱),过夜后置于
37℃烤箱中2h,再放入室温中冷却。
3.HE、PAS染色、精子总数和畸形率统计,按以下步骤处理:
→37℃烤箱二甲苯(一)15min;
→37℃烤箱二甲苯(二)15min;
→100wt.%酒精(一)2min;
→100wt.%酒精(二)2min;
→90wt.%酒精2min;
→80wt.%酒精2min;
→70wt.%酒精2min;
→三蒸水5min×3次。
4.MDA、DHE测定
1)提取蛋白并测浓度
a.取各睾丸组织一小块放入EP管,于各管中加入ripa裂解液(1mL ripa+10μL cooktail);
组织:裂解液=100mg:2000μL;
b.剪碎组织,并超声,3s×2,放冰上降温,3s×2,冰上进行操作;
c.冰上静置1h,每15min涡旋一次;
d.离心4度,14000g,30-60min,吸取上清至新的EP管;
e.BCA测蛋白浓度:
●取10μL样本,将其用裂解液稀释为一半,配制BCA工作液(试剂a:试剂b=50:1,碧云天BCA测蛋白浓度试剂盒)
·取BSA(小牛血清蛋白)蛋白标准液5μg/μL,稀释10倍。将标准品按照0、1、2、4、8、12、16、20μL分别加入96孔酶标仪板的孔中(A1-A8)---用来绘制标准曲线;
●加裂解液将每个小孔内的液体体积补足20μL;
●在样品孔中加1μL样品,平行3孔,结果取平均值,加裂解液19μL;
●各孔加200μL显色液,封口37度孵育30min,打开酶标仪预热;
●检查是否有气泡,用针挑破;
●根据标准曲线计算出样品中蛋白浓度。
2)MDA检测(碧云天试剂盒)
3)DHE检测
准备:取小鼠睾丸冰冻切片,冰冻后不固定,风干,放-80℃保存备用,解冻后PBS(0.01M)洗2次×2min,组画笔画圈。
染色:a.配制DHE染液:0.01M PBS:原液=2500:1(体积比),将5mmol/L稀释为2μmol/L用PBS每个组织加100μL(避光处理),37℃或室温避光孵育30min;
b.孵育结束后用PBS清洗;
c.拍摄荧光,绿光激发,ROS阳性在整个核区被染成红色;
d.对荧光强度进行统计。
实验结果表明:无精极少精模型小鼠在注射Tempol 45天后精子发生得到了明显改善。与未服用Tempol的Pex3KO小鼠相比较,注射Tempol后小鼠睾丸中合胞体大量减少,各级生精细胞数量增多,且有长形精子出现(P<0.1),详细实验数据见图1。附睾尾可见精子数量明显增多,且精子畸形率降低(P<0.001),详细实验数据见图2。注射Tempol后ROS水平较未注射Tempol明显降低P<0.01),详细实验数据见图3。
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明的基础上,可以对之作一些修改或改进,包括Tempol的衍生物、给药方式改变、以及溶剂改动等,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改活改进,均属本发明要求保护的内容。
- 还没有人留言评论。精彩留言会获得点赞!
- 4-(3,5-二甲氧苯基)-5-(3-羟基-4-甲氧基苯基)咪唑的应用
- 4-(3,5-二甲氧苯基)-5-(3-羟基-4-甲氧基苯基)咪唑制剂的制作方法
- 一种同时制备7-羟基-4′-甲氧基黄烷和紫檀茋的方法
- 2-羟基-4-甲氧基二苯甲酮-5-磺酸钠的制备方法
- 一种改性木质素磺酸盐减水剂及其制备方法
- D-(-)-对羟基-α(3-甲氧基-1-甲基-3-氧代-丙烯基)氨基乙酸钾检测技术的制作方法
- 2-羟基-3-甲氧基-5-醛扁桃酸转化为香兰素的方法
- D-(-)-对羟基-α(3-甲氧基-1-甲基-3-氧代-丙烯基)氨基乙酸钾干燥技术的制作方法
- (2-羟基-3-脱氢枞氧基)丙基羟乙基壳聚糖及其制备方法
- 一种2-羟基-4-甲氧基-5-磺酸二苯甲酮的生产方法
- 包含甲氧基黄酮的NOX抑制剤及NFκB抑制剤的制作方法与工艺
- 一种多甲氧基黄酮、组合物及其制剂用于预防或治疗糖尿病的用途的制作方法与工艺
- 一种1‑(2‑羟基‑3‑甲氧苯基)乙酮的制备工艺的制作方法与工艺
- 一种多甲氧基黄酮在制备预防心血管炎症药物上的应用的制作方法与工艺
- 3’-羟基染料木黄酮用于制备抑制黑色素生成的组合物的用途的制作方法与工艺
- 合成5,6,4'‑三羟基黄酮‑7‑0‑D‑葡萄糖醛酸有关物质及其制备方法和应用与流程
- 5‑(4‑羟基‑3‑甲氧基苯亚甲基)‑2‑(2‑硝基苯亚胺基)噻唑烷酮及应用的制作方法与工艺
- 制备荷羟酮(甲基)丙烯酸酯的方法与流程
- 从瓯柑果实中分离纯化多甲氧基黄酮类化合物的方法与流程
- 一种多甲氧基黄酮在制备治疗黑色素瘤的药物上的应用的制造方法与工艺