一组硫代苦参碱衍生物及其盐类在制备抗骨质疏松药物中的应用的制作方法
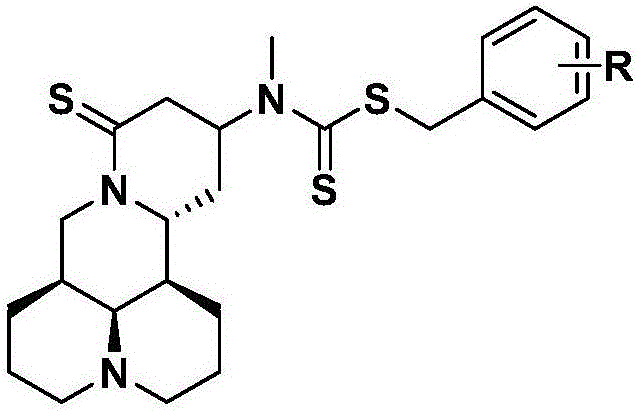
本发明涉及化合物的新用途,具体地说,涉及一组硫代苦参碱衍生物及其盐类在制备抗骨质疏松药物中的应用。
背景技术:
骨质疏松症(Osteoporosis,OP)是以骨量降低、骨组织显微结构发生改变,骨脆性增加、骨强度下降、易骨折为特征的一种骨病[Cosman,F.,et al.,Clinician's Guide to Prevention and Treatment of Osteoporosis,Osteoporos Int.2014,25(10),2359-81.]。骨质疏松症严重的会导致疼痛、骨折、残疾,被称为寂静杀手。近年来研究表明,骨吸收与骨形成的失衡是骨质疏松的病理生理学基础,由促骨形成的成骨细胞和促骨吸收的破骨细胞调控[Del Puente,A.,et al.,Physiopathology of Osteoporosis:From Risk Factors Analysis to Treatment.J Biol Regul Homeost Agents,2015,29(3),527-31.]。
苦参碱类生物碱为中药苦参的主要活性成分,是从豆科植物苦参、广豆根等药材根部提取得到的生物碱,主要包括苦参碱、槐果碱、氧化苦参碱、槐啶碱、槐胺碱等。《神农本草经》有载,苦参味苦,性寒,归心、肝经。据记载,苦参作为我国传统中药,已有一千多年历史,主要用于清热、祛湿、解毒、利尿以及镇痛、抗炎等功效。
天然苦参碱的生物利用度差,限制了其应用。申请人通过结构修饰、活性测定构效关系等手段进一步优化了其结构,降低毒性、提高活性及生物利用度。申请人申请的中国专利CN201510206847.X,公开日2015.07.29,公开了一种苦参碱类化合物及其制备方法与应用,所述的苦参碱类化合物结构通式如图2所示,其中R选自烷基取代基、烷氧基或吸电子基团,还公开了上述苦参碱类化合物的制备方法、药学上可接受的盐类及其用途,实验证实上述苦参碱类化合物及其药学上可接受的盐类对人肝癌细胞株Hun-7有显著的抑制作用,在制备抗肝癌药物方面具有重大潜力。然而,目前关于该苦参碱类化合物及其药学上可接受的盐类在抗骨质疏松方面的作用未见报道。
技术实现要素:
本发明的目的在于提供一组硫代苦参碱衍生物及其盐类的新用途,技术方案如下:
一组硫代苦参碱衍生物及其盐类在制备抗骨质疏松药物中的应用,所述的硫代苦参碱衍生物结构通式如下所示:
其中X为硫原子;R基团选自氢原子或i或ii或iii:
i.烷基,所述烷基选自甲基、乙基、正丙基和异丙基,取代位置为邻位、对位或间位,取代基个数为单取代或多取代;
ii.卤素,所述卤素选自氟、氯、溴和碘,取代位置为邻位、对位或间位,取代基个数为单取代或多取代;
iii.硝基或氰基。
作为本发明的一个优选例,所述的R基团选自i或ii,取代位置为对位。
作为本发明的一个优选例,所述的R基团选自i或ii,取代基个数为单取代。
作为本发明的一个优选例,所述的R基团选自氢原子、氟原子或氰基。
作为本发明的一个优选例,所述的盐类优选为药学上可接受的盐类,包括盐酸盐、硫酸盐、硫酸氢盐、氢溴酸盐、草酸盐、柠檬酸盐、甲磺酸盐等。
本发明还提供了所述硫代苦参碱衍生物及其盐类在制备试剂中的应用,所述的试剂用于:
a)研究骨质疏松病理机制;或
b)评价骨质疏松药物疗效。
本发明进一步提供了所述硫代苦参碱衍生物及其盐类在制备试剂中的应用,所述的试剂用于抑制RAW264.7细胞或小鼠原代单核细胞向破骨细胞分化。
本发明优点在于:
本发明提供了一组硫代苦参碱衍生物及其盐类的新用途,经生物活性测试,该类化合物能显著减少去卵巢后小鼠骨量的丢失,表现为骨小梁数目、骨表面积和组织体积之比、相对骨体积或骨体积分数和骨小梁连接数的增加。能够显著抑制RAW264.7细胞和小鼠原代单核细胞向破骨细胞分化。该类化合物同时具备稳定性好,适于成药,生物利用度高的优点,因此该类化合物可开发为抗骨质疏松药物,或用于制备研究骨质疏松病理机制以及评价骨质疏松药物疗效的试剂。
附图说明
图1.苦参碱,槐果碱及氧化槐果碱的结构。
图2.CN201510206847.X公开的苦参碱类化合物结构通式。
图3.RAW264.7细胞破骨诱导后TRAP染色。
图4.小鼠原代骨髓单核细胞破骨诱导后TRAP染色。
图5.体内实验结果。
具体实施方式
下面结合附图对本发明提供的具体实施方式作详细说明,但本发明的具体实施方式不限于以下实施例。其中M19的制备方法可参考课题组前期研究基础[吴秋业等,苦参碱类化合物及其制备方法与应用,CN101704817A,具体为实施例1-2]。
表1部分优选化合物的结构、产率、质谱和分子式
注:C,H,N三种元素分析的测定之与理论计算值相差0.3%。
实施例1:15-硫代槐果碱的制备
将槐果碱10.0g(0.04mol)和劳森试剂20.0g(0.05mol,购自Alfa公司)置于500ml反应瓶中,加入200ml甲苯,加热回流反应12小时。反应完毕,减压浓缩除去溶剂,粗品过硅胶柱,洗脱剂为二氯甲烷:甲醇(25:1),得产物9.6g,收率91.2%。
实施例2:13-(N-甲基)-氨基-15-硫代苦参碱(M19)的制备
将18-硫代槐果碱10g(4mol)置于500ml反应瓶中,加入200ml甲胺醇溶液和10ml三乙胺,搅拌反应12小时。反应完毕,减压浓缩除去溶剂,粗品过硅胶柱,洗脱剂为二氯甲烷:甲醇(20:1),得产物9.8g,收率83.5%。
实施例3:13-(N-甲基,N-二硫代甲酸对氟苄酯)-氨基-18-硫代苦参碱(表中ZSM-1)的制备
将18-硫代苦参碱(M19)240mg(0.8mmol)和二硫化碳160mg(2mmol)置于25ml反应瓶中,加入5ml乙腈,搅拌下加入374mg(2mmol)对氟溴苄,室温下反应4小时,反应完毕后减压蒸馏除去有机溶剂,粗品过硅胶柱,洗脱剂为二氯甲烷:丙酮(10:1),得白色固体354mg,收率92.5%。
产物的核磁氢谱和质谱数据为:
1H-NMR(300MHz,CDCl3)δ7.41–7.29(m,2H),7.09–6.90(m,2H),6.10(s,1H),5.37(dd,J=12.0,3.8Hz,1H),4.49(d,J=14.5Hz,3H),3.64–2.95(m,6H),2.84(s,2H),2.37–1.13(m,19H).
13C-NMR(75MHz,CDCl3)δ163.87,160.60,131.39,131.34,131.09,130.98,115.67,115.38,77.47,77.25,77.05,76.62,63.82,57.51,56.94,51.58,41.42,35.92,29.69,29.32,27.54,26.74,22.69,21.10,20.49.
实施例4:13-(N-甲基,N-二硫代甲酸对氯苄酯)-氨基-18-硫代苦参碱(表中ZSM-2)的制备
将18-硫代苦参碱(M19)240mg(0.8mmol)和二硫化碳160mg(2mmol)置于25ml反应瓶中,加入5ml乙腈,搅拌下加入400mg(2mmol)对氯溴苄,室温下反应4小时,反应完毕后减压蒸馏除去有机溶剂,粗品过硅胶柱,洗脱剂为二氯甲烷:丙酮(10:1),得白色固体371mg,收率93.5%。
产物的核磁氢谱和质谱数据为:
1H-NMR(300MHz,CDCl3)δ7.35–7.21(m,4H),6.09(s,1H),5.37(dd,J=12.1,3.9Hz,1H),4.48(d,J=17.2Hz,3H),3.61–2.95(m,6H),2.83(s,2H),2.33–1.16(m,18H).
13C-NMR(75MHz,CDCl3)δ134.33,133.44,130.73,128.76,77.50,77.28,77.07,76.65,63.79,57.50,56.94,51.90,51.57,41.38,41.33,35.92,29.69,29.31,29.20,27.54,26.73,21.10,20.49.
实施例5:13-(N-甲基,N-二硫代甲酸对溴苄酯)-氨基-18-硫代苦参碱(表中ZSM-3)的制备
将18-硫代苦参碱(M19)240mg(0.8mmol)和二硫化碳160mg(2mmol)置于25ml反应瓶中,加入5ml乙腈,搅拌下加入500mg(2mmol)对溴溴苄,室温下反应4小时,反应完毕后减压蒸馏除去有机溶剂,粗品过硅胶柱,洗脱剂为二氯甲烷:丙酮(10:1),得白色固体403mg,收率93.5%。
产物的核磁氢谱和质谱数据为:
1H NMR(300MHz,CDCl3)δ7.46–7.38(m,2H),7.29–7.20(m,2H),6.08(s,1H),5.36(dd,J=11.9,3.9Hz,1H),4.56–4.35(m,3H),3.61–2.93(m,6H),2.82(t,J=10.1Hz,2H),2.34–1.13(m,18H).
13C NMR(75MHz,CDCl3)δ134.89,131.71,131.07,121.55,63.78,57.51,56.95,51.59,35.93,29.69,29.32,27.55,26.74,21.12,20.51.
实施例6:13-(N-甲基,N-二硫代甲酸对硝基苄酯)-氨基-18-硫代苦参碱(表中ZSM-4)的制备
将18-硫代苦参碱(M19)240mg(0.8mmol)和二硫化碳160mg(2mmol)置于25ml反应瓶中,加入5ml乙腈,搅拌下加入432mg(2mmol)对硝基溴苄,室温下反应4小时,反应完毕后减压蒸馏除去有机溶剂,粗品过硅胶柱,洗脱剂为二氯甲烷:丙酮(10:1),得白色固体382mg,收率94.5%。
产物的核磁氢谱和质谱数据为:
1H NMR(300MHz,CDCl3)δ8.13(d,J=8.7Hz,2H),7.53(d,J=8.7Hz,2H),6.01(s,1H),5.33(dd,J=12.0,4.0Hz,1H),4.64(s,2H),4.43(d,J=10.1Hz,1H),3.41(ddd,J=74.3,42.9,34.3Hz,6H),2.80(t,J=9.8Hz,2H),2.34–1.11(m,19H).
13C NMR(75MHz,CDCl3)δ147.16,144.28,130.16,129.73,123.68,77.62,77.40,77.19,76.77,63.73,57.47,56.91,51.55,41.40,40.63,35.92,27.54,27.16,26.72,21.09,20.47.
实施例7:13-(N-甲基,N-二硫代甲酸对甲基苄酯)-氨基-18-硫代苦参碱(表中ZSM-7)的制备
将18-硫代苦参碱(M19)240mg(0.8mmol)和二硫化碳160mg(2mmol)置于25ml反应瓶中,加入5ml乙腈,搅拌下加入370mg(1mmol)对甲基溴苄,室温下反应4小时,反应完毕后减压蒸馏除去有机溶剂,粗品过硅胶柱,洗脱剂为二氯甲烷:丙酮(10:1),得白色固体334mg,收率88.1%。
产物的核磁氢谱和质谱数据为:
1H-NMR(300MHz,CDCl3)δ7.26(d,J=7.5Hz,2H),7.12(d,J=7.9Hz,2H),6.12(s,1H),5.36(dd,J=11.9,3.6Hz,1H),4.56–4.37(m,3H),3.61–3.31(m,3H),3.14(s,3H),2.83(t,J=9.1Hz,2H),2.33(s,3H),2.28–1.36(m,17H).
13C-NMR(75MHz,CDCl3)δ194.16,137.45,132.16,129.36,129.35,77.52,77.30,77.10,76.67,63.80,57.55,56.99,56.95,51.59,42.24,41.37,35.92,27.56,26.74,21.17,21.13,20.51.
实施例8:13-[N-甲基,N-二硫代甲酸(2,6-二氯)-苄酯]-氨基-18-硫代苦参碱(表中ZSM-8)的制备
将18-硫代苦参碱(M19)240mg(0.8mmol)和二硫化碳160mg(2mmol)置于25ml反应瓶中,加入5ml乙腈,搅拌下加入480mg(2mmol)溴苄,室温下反应4小时,反应完毕后减压蒸馏除去有机溶剂,粗品过硅胶柱,洗脱剂为二氯甲烷:丙酮(10:1),得白色固体390mg,收率92.1%。
产物的核磁氢谱和质谱数据为:
1H NMR(300MHz,CDCl3)δ7.29(t,J=7.6Hz,2H),7.17(dd,J=8.7,7.4Hz,1H),6.08(s,1H),5.42–5.29(m,1H),4.70(s,2H),4.42(dd,J=9.9,4.0Hz,1H),3.60–2.95(m,6H),2.80(t,J=10.2Hz,2H),2.29–1.12(m,16H).
13C NMR(75MHz,CDCl3)δ194.15,136.53,130.91,129.60,128.39,63.76,57.53,56.99,56.95,51.64,51.58,41.39,38.84,35.91,27.57,26.73,21.14,20.53.
实施例9:13-(N-甲基,N-二硫代甲酸苯甲酯)-氨基-18-硫代苦参碱(表中ZSM-10)的制备
将18-硫代苦参碱(M19)240mg(0.8mmol)和二硫化碳160mg(2mmol)置于25ml反应瓶中,加入5ml乙腈,搅拌下加入342mg(2mmol)溴苄,室温下反应4小时,反应完毕后减压蒸馏除去有机溶剂,粗品过硅胶柱,洗脱剂为二氯甲烷:丙酮(10:1),得白色固体341mg,收率92.5%。
产物的核磁氢谱和质谱数据为:
1H-NMR(300MHz,CDCl3)δ7.46–7.22(m,5H),6.13(s,1H),5.37(dd,J=11.9,3.8Hz,1H),4.49(d,J=22.2Hz,3H),3.63–2.95(m,6H),2.83(s,2H),2.30–1.15(m,17H).
13C-NMR(75MHz,CDCl3)δ135.41,129.43,128.65,127.66,77.49,77.27,77.07,76.65,63.80,57.54,56.96,51.59,43.66,42.40,41.38,35.92,29.69,27.56,26.74,21.12,20.51.s.
实施例10:生物活性测试
一、实验材料
RAW264.7细胞和小鼠骨髓原代骨髓单核细胞购自中科院细胞所,实验用6-8周雌性C57小鼠全部购自第二军医大学实验动物中心。
二、实验方法
1、细胞实验1
实验分为5组。第一组为RW264.7细胞对照组;第二组为RW264.7细胞且使用M-CSF和RANKL诱导组;第三组为1μM ZSM-10处理且使用M-CSF和RANKL诱导组;第四组为2μM ZSM-10处理且使用M-CSF和RANKL诱导组;第五组为4μM ZSM-10处理且使用M-CSF和RANKL诱导组。处理时间为细胞诱导后第三天,然后细胞再经4天诱导。细胞完成总计7天的诱导后,进行TRAP染色,观察破骨细胞诱导的数量并计数进行统计学分析。注:其余化合物测试方法同ZSM-10。
2、细胞实验2
实验分为5组。第一组为小鼠骨髓原代骨髓单核细胞;第二组为诱导组;第三组为1μM ZSM-10处理且使用M-CSF和RANKL诱导组;第四组为2μM ZSM-10处理且使用M-CSF和RANKL诱导组;第五组为4μM ZSM-10处理且使用M-CSF和RANKL诱导组。处理时间为细胞诱导后第三天,细胞再经4天诱导。细胞完成总计7天的诱导后,进行TRAP染色,观察破骨细胞诱导的数量并计数进行统计学分析。注:其余化合物测试方法同ZSM-10。
3、动物实验
3.1分组情况
将24只C57小鼠随机分为3组,每组为8只,分别为假手术组、去卵巢组、ZSM-10干预组:
去卵巢组:采用外科手术摘除小鼠双侧卵巢;
假手术组:除不切除小鼠卵巢外其余操作与去卵巢组相同;
ZSM-10干预组:切除小鼠双侧卵巢后每日一次腹腔注射给予小鼠2mg/10g的ZSM-10。
3.2试验处理
饲养6周后处死小鼠,取小鼠的双侧股骨及血清。
(1)小鼠股骨使用多聚甲醛溶液进行固定、EDTA脱钙后,石蜡包埋切片(4mm),进行苏木精-伊红(HE staining)染色,显微镜下观察小鼠股骨远端干骺端并拍照。
(2)将固定的小鼠股骨行Micro-CT检查,采用SKYSCAN 1176微型CT机对小鼠股骨远端行Micro-CT扫描,构建小鼠股骨远端干骺端二维及三维图像,并使用CT机自带软件对股骨骨小梁数量,骨表面积和组织体积之比进行分析,对相对骨体积,骨矿物质密度,骨小梁连接数进行分析,获得定量结果。
(3)取得的血清在4度条件下冷藏1小时后2500rpm 10min进行离心,取上清液。对血清中IL-6,TNF-α和TRAP-5b进行检测。
三、实验结果
1、细胞实验结果
图3为RAW264.7细胞培养7天后进行TRAP染色的结果,图4为BMMCs细胞培养7天后进行TRAP染色的结果。结果显示,当使用M-CSF和RANKL诱导后破骨细胞数量明显增加,而当使用ZSM-10进行干预后破骨细胞数量明显减少,并且有剂量依赖性,ZSM-10的浓度为4μM时破骨细胞数量最少。结果表明ZSM-10能抑制破骨细胞生成。其余优选化合物也表现出对破骨细胞生成的抑制作用,各优选化合物4μM测试组的破骨细胞数量统计结果见表2。
表2各优选化合物测试组(4μM)的破骨细胞数量
2、动物实验结果
图5A为6周后小鼠股骨远端干骺端切片HE染色。图片显示去卵巢组小鼠骨小梁数目较正常组明显减少,骨小梁间距增大,表现为骨质疏松;给予ZSM-10后小鼠股骨远端干骺端骨小梁数目明显多于卵巢切除组。骨小梁面积统计结果也显示去卵巢后骨质流失,给予ZSM-10后骨质流失缓解。图5B为6周后小鼠股骨远端Micro-CT二维和三维结构。图片显示去卵巢组小鼠骨小梁数目较正常组明显减少,给予ZSM-10后小鼠股骨远端干骺端骨小梁数目明显多于卵巢切除组。图5C为对股骨远端使用计算机软件分析,统计骨小梁数量(Tb.N)、骨表面积和组织体积之比(BS/TV)、相对骨体积或骨体积分数(BV/TV)、骨小梁连接数(Tb.Pf)和骨密度(BMD)后发现ZSM-10组小鼠显著优于去卵巢组小鼠,但不及假手术组,且差异具有统计学意义(p<0.05)。图5D为血清学检测结果。图片中显示,IL-6,TNF-α和TRAP等破骨指标在去卵巢组中明显多于假手术组,给予ZSM-10干预后,其水平降低,说明ZSM-10干预的小鼠体内破骨活性低于去卵巢组,表示ZSM-10干预后其骨质流失减少。
四、实验结论
女性绝经后骨质疏松症属于原发性骨质疏松症,与雌激素水平降低后破骨细胞分化增多、成骨减少有关。去卵巢组小鼠模型模拟人类绝经,在去卵巢6周后表现出显著的骨质疏松表现,主要表现为骨小梁数量明显减少、骨皮质变薄等。ZSM-10显著减少了去卵巢后小鼠骨量的丢失,表现为骨小梁数目、骨表面积和组织体积之比、相对骨体积或骨体积分数和骨小梁连接数的增加。本发明的硫代苦参碱衍生物能够显著抑制RAW264.7细胞株和小鼠原代单核细胞向破骨细胞分化。且本发明的该组硫代苦参碱衍生物具备稳定性好,适于成药,生物利用度高的优点,因此可用于制备抗骨质疏松的药物。
以上已对本发明创造的较佳实施例进行了具体说明,但本发明创造并不限于所述实施例,熟悉本领域的技术人员在不违背本发明创造精神的前提下还可做出种种的等同的变型或替换,这些等同的变型或替换均包含在本申请权利要求所限定的范围内。
- 还没有人留言评论。精彩留言会获得点赞!