辛伐他汀在制备抑制乙肝病毒药物中的应用的制作方法
本发明是涉及药物的用途,特别是辛伐他汀在制备抑制乙肝病毒药物中的应用,属于西药领域。
背景技术:
乙型肝炎病毒(hbv)感染大约4亿人,是世界范围内最常见的慢性感染性疾病,是导致原发性肝细胞癌(hcc)的主要原因,每年约有100万人死于hbv感染所致的肝衰竭、肝硬化和肝癌。目前对hbv感染的治疗主要是干扰素和核苷类似物,干扰素治疗的长期有效率仅为30%左右,并且毒副作用较多;核苷类似物如拉米夫定虽然抗病毒能力较强,但停药后病毒复制水平快速反跳及耐药病毒株的出现,使得临床抗病毒方案的实施面临极大的挑战。因此,对慢性hbv感染治疗的积极探索已成为临床研究的重要领域。
病毒本身的基因组非常小,只能编码有限数量的基因,所以病毒必须利用宿主细胞的因子及元件进行复制,尤其是真核细胞基因复制、转录相关的因子。在流感病毒rna基因的复制过程中,微小染色体维持蛋白(mcms)起着重要的稳定作用,mcms是宿主细胞dna复制起始和延长过程中的重要因子,同时也参与细胞周期调控。mcm7是mcm(minichromosomemaintenanceprotein)蛋白家族成员之一,负责细胞增殖过程中dna复制的启动。研究发现,在体外应用阿托伐他汀处理的分离所得的兔主动脉平滑肌细胞,可以抑制该细胞的增殖能力。该研究还对e2f活性以及mcm6、mcm7进行检测,发现阿托伐他汀可通过影响e2f活性下调mcm蛋白的表达,而这种抑制作用可以被外源性mva解除,证明他汀类药物可能通过其抑制胆固醇合成的作用减少mav合成,进一步抑制dna复制因子mcm6、mcm7的表达,阻滞细胞周期进程。
目前临床常用的辛伐他汀是羟甲戊二酰辅酶a还原酶(hmgcoa还原酶)抑制剂,一直被用来治疗高胆固醇血症及预防心血管疾病。目前尚无辛伐他汀以mcm7为靶点抑制细胞增值的相关研究报道,因此阐明辛伐他汀在hbv感染的相关机制研究具有积极的意义和研究价值。
技术实现要素:
本发明的目是:提供一种辛伐他汀在制备抑制乙肝病毒药物中的应用,由于辛伐他汀具有很强的抗乙肝病毒的活性,为临床制备抑制乙肝病毒药物提供了新的有效方法。
本发明的技术方案是:辛伐他汀在制备抑制乙肝病毒药物中的应用,其特征是:所述的辛伐他汀在制备以mcm7为靶标的药物中的应用。
所述的辛伐他汀在制备以mcm7为靶标的抑制乙肝病毒的药物中的应用。
所述的辛伐他汀在制备以mcm7为靶标的抑制肝癌的药物中的应用。
所述的肝癌是由hbv感染引起的原发性肝癌。
本发明的有益效果是:辛伐他汀通过抑制hepg2.2.15细胞中mcm7表达水平,从而抑制了该细胞中hbv的复制,阻滞细胞周期进程。由于辛伐他汀具有很强的抗乙肝病毒的活性,为临床制备抑制乙肝病毒药物提供了新的有效方法。
附图说明
图1是asirna干扰mcm7后adgfp的表达情况;
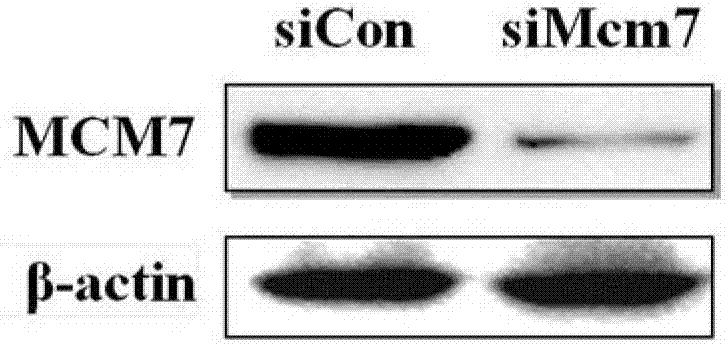
图2是simcm7干扰后hepg2.2.15细胞mcm7表达情况;
图3是下调mcm7后,hepg2.2.15细胞水平hbvdna拷贝数(*vscontrol,p<0.05);
图4是不同浓度辛伐他汀对hepg2.2.15细胞增殖率的影响;
图5是不同浓度辛伐他汀对hepg2.2.15细胞细胞计数的影响;
图6是hepg2.2.15细胞干预4d的细胞形态(a:溶剂对照,b:辛伐他汀40μmol/l);
图75×106个hepg2.2.15细胞上清中hbv的dna拷贝数;
图85×106个hepg2.2.15细胞上清中hbv的dna拷贝数;
图9辛伐他汀对肝癌hepg2.2.15细胞周期的影响;
图10是辛伐他汀干预4d对肝癌hepg2.2.15细胞周期的影响;
图11是辛伐他汀干预后hepg2.2.15细胞周期相关蛋白的表达;
图12a是mcm7转录水平的变化;
图12b是mcm7蛋白水平的变化;
图13是辛伐他汀作用后对hepg2.2.15细胞蛋白水平的影响。
具体实施方式
下面通过给出的具体实施例可以进一步清楚的说明本发明,但不作为对本发明的限定。
本发明的是通过以下的实验得到证实的。
如图1-3所示,通过sirna技术,抑制mcm7的表达,发现腺病毒的gfp表达明显下降,说明mcm7作为宿主细胞dna复制因子,参与病毒的复制。在流感病毒rna基因的复制过程中,微小染色体维持蛋白(mcms)起着重要的稳定作用。我们在hepg2.2.15细胞中,通过sirna技术下调mcm7的蛋白表达,对细胞中的hbvdna拷贝数进行检测,发现抑制hepg2.2.15细胞中mcm7的表达后,细胞中hbvdna拷贝数数降低,说明作为宿主细胞dna复制因子mcm7参与hbv的复制。
首先,采用mtt,细胞计数方法检测不同浓度的辛伐他汀对hepg2.2.15细胞增殖的影响。结果如图4和图5所示:40μmol/l辛伐他汀在药物作用3d后开始抑制hepg2.2.15细胞的增殖,可持续至药物干预后7d;而其他浓度组(5μmol/l,20μmol/l)对细胞增殖无明显作用;阳性对照药物拉米夫定(5μmol/l)对细胞增殖无明显作用。图6是hepg2.2.15细胞干预4d的细胞形态(a:溶剂对照,b:辛伐他汀40μmol/l)。
根据mtt,细胞计数结果,使用40μmol/l和5μmol/l辛伐他汀分别作用于hepg2.2.15细胞,并在不同时间点(1d、4d、7d)收集不同组的细胞及上清,用np-40裂解细胞后,取部分样品采用pcr-荧光探针法测定上清液中及细胞内hbvdna的拷贝数,如图7所示。剩余样品计算单位蛋白浓度的hbvdna拷贝数如图8所示。结果发现:高浓度辛伐他汀在体外抑制hepg2.2.15细胞乙肝病毒复制,上清及细胞水平的hbvdna拷贝数数均降低,并且细胞内降低更明显,且随着作用时间、作用浓度的增高,抑制作用越明显。证实辛伐他汀在体外确有抗hbv的作用。
用40μmol/l和5μmol/l辛伐他汀分别作用于hepg2.2.15细胞,在1d和4d收集不同组的细胞,采用pi单染法检测细胞周期。结果如图9和10显示:辛伐他汀低浓度组及高浓度组对hepg2.2.15细胞作用1d时,对周期均无明显影响;而药物作用4d时,低浓度的辛伐他汀对细胞周期则无明显影响,高浓度辛伐他汀则使g1期细胞明显增多,s期及g2/m期细胞均减少。结果表明辛伐他汀可以使hepg2.2.15细胞发生g1期阻滞,且具有时间、浓度的双重依赖性。
用western-blot检测辛伐他汀作用后hepg2.2.15细胞的mcm7的表达,以及周期相关蛋白p21、p27、p53、cyclind1、prb和rb,结果如图11显示:5μmol/l和40μmol/l作用hepg2.2.15细胞1d时,均无明显抑制mcm7蛋白表达;而在4d时可下调mcm7蛋白水平;在辛伐他汀高浓度作用4d时,cyclind1、prb表达下降,p21、p27的表达增高,而rb、p53表达无明显变化。cyclind1,prb,mcm7作为细胞周期促进因子,其表达下降时,而周期抑制因子p27、p21表达增高,可以抑制细胞周期的进程,这也进一步解释了流式细胞仪检测的周期结果。辛伐他汀可能通过抑制hepg2.2.15细胞中mcm7表达水平,从而抑制了该细胞中hbv的复制。
如图12a所示,通过实时荧光定量pcr的方法,检测5μmol/l、40μmol/l的辛伐他汀分别作用于hepg2.2.15细胞后,mcm7的mrna水平的变化,随作用浓度和作用时间的增加,mcm7的mrna水平表达均明显增高。这与之前western-blot的结果相反,如图12b所示。因此,辛伐他汀药物干预后,细胞中mcm7的mrna水平表达增高,但蛋白水平表达下降。
如图13所示,通过western-blot检测辛伐他汀作用后的hepg2.2.15细胞中p-eif2α蛋白的表达,结果发现,随着药物作用浓度和作用时间的增加,p-eif2α的蛋白表达增强。这说明辛伐他汀对hepg2.2.15细胞进行干预后,会产生类似干扰素样作用。有文献报道ampk可以激活perk,从而使eif2α磷酸化水平增高,而lkb1是ampk的上游激酶,所以我们推测辛伐他汀可能通过激活lkb1-ampk,从而激活perk,使eif2α磷酸化水平增高,抑制下游靶基因翻译,mcm7可能是其下游靶基因之一。而检测显示,药物干预后,lkb1、p-ampk、perk、p-eif2α的蛋白表达水平随作用浓度和作用时间的增加而增强,而mcm7随作用浓度和作用时间的增加而降低,提示辛伐他汀可能通过激活lkb1-ampk通路发挥抗hbv的作用。
实施例1
mtt实验检测细胞增殖能力
取对数生长期肝癌hepg2.2.15细胞,用含0.25%胰酶(trypsin)+0.02%edta的消化液消化细胞离心弃去上清,用完全培养基吹打均匀后使用细胞计数板计数,按细胞数3×104/孔接种于96孔培养板中。孵育24h后用不同浓度的辛伐他汀(如表1)处理细胞,每个浓度设5个副孔。分别在药物作用1、2、3、4、5、6、7d后,加入500μg·ml-1mtt20μl,37℃孵育4h后先吸弃培养液,随后每孔加入dmso150μl,震荡15min混匀,用酶标仪检测570nm下各孔吸光度(a)值。将各测试孔的a值减去本底a值(无细胞培养基加mtt试剂);根据各平行孔的a值计算平均值。
细胞增殖率%=(干预组细胞a值-本底a值)/(对照组细胞a值-本底a值)×100%。实验重复3次,绘制抑制率曲线如图4。
表1辛伐他汀作用浓度
实施例2
细胞计数实验检测细胞增殖能力
取对数生长期肝癌hepg2.2.15细胞,用含0.25%胰酶(trypsin)+0.02%edta的消化液消化细胞离心弃去上清,用完全培养基吹打均匀后使用细胞计数板计数,按细胞数3×104/孔接种于96孔培养板中。孵育24h后用不同浓度的辛伐他汀(如表1)处理细胞,每个浓度设5个副孔。分别在药物作用1、2、3、4、5、6、7d后将细胞用0.25%胰酶消化,充分吹打制备成单细胞悬液。计数板和盖玻片用95%的乙醇擦洗干净,凉干。把盖玻片覆盖在计数板上,充分混匀细胞悬液,吸管吸取细胞,从计数板边缘轻轻滴约10μl细胞悬液,使之充满计数板和盖玻片之间的空隙中,要避免溢出盖玻片,也不要过少或带气泡。在倒置显微镜下用10x物镜观察,计数四角的4个大方格,2个以上细胞组成的细胞团按一个细胞计算,压线的细胞只计上线和左线者。按下列公式计算细胞浓度:(4大格细胞总数/4)x104个/ml。每一样品重复3次,取平均值得细胞悬液浓度。
实施例3
蛋白免疫印记分析法(western-blot)
1)蛋白样品的准备:将事先培养并做相应处理的细胞去除培养基,用预冷(4℃)的pbs冲洗3遍,尽量将残余pbs充分吸干,之后加入预冷的蛋白裂解液,置于冰上裂解30min。此后,用细胞刮培养皿收集细胞,并于4℃下12000rpm离心2min,取上清。取其中少量上清进行蛋白定量,其余部分加入loadingbuffer液,104℃煮30min,之后置于-20℃保存备用。
2)制备电泳凝胶:按表2配制5%浓缩胶及10%分离胶。总蛋白上样量为50μg,60v电泳,待样品前沿进入分离胶后,调电压至100v,继续电泳约1.5h。见表2
表-2凝胶配制
3)蛋白电泳:将蛋白样品调至等浓度后上样,开始先45v电压进行稳流电泳,当电压达65v时改为稳压电泳。当目的蛋白移动至距分离胶下缘1cm左右停止电泳。
4)半干式转膜:预先裁好与胶条同样大小的滤纸和pvdf膜,电泳结束后剥离凝胶,以去离子水漂洗,按pvdf膜>滤纸>凝胶的大小顺序切20层滤纸及一张pvdf膜,pvdf膜在甲醇中浸泡30~60s,后与滤纸一起浸泡在转膜缓冲液中15~30min待用。用半干电转法转膜,在阳极与阴极间依次放置20层滤纸、pvdf膜、凝胶、20层滤纸,设置转膜条件为25v,30min。
5)免疫印迹:转膜成功后,pvdf膜以含有5%脱脂奶粉的tbst,37℃摇床上轻摇60min,封闭非特异结合位点。封闭后用tbst液洗膜,摇床轻摇5min×3次。将膜与稀释的一抗4℃孵育过夜。孵育一抗后tbst液洗膜,摇床轻摇5min×3次。将膜移入二抗工作液(用封闭液按1:2000稀释二抗)37℃2h。孵育二抗后tbst液洗膜,摇床轻摇5min×3次。弃去tbst,加显色液,曝光采集图像。
实施例4
实时荧光定量pcr(real-timepcr)
1)总rna提取冻存已裂解的细胞,室温放置5分钟使其完全溶解。每1ml的trizol试剂裂解的样品中加入0.2ml的氯仿,盖紧管盖。手动剧烈振荡管体15秒后,15到30℃孵育2到3分钟。4℃下12000rpm离心15分钟。离心后混合液体将分为下层的红色酚氯仿相,中间层以及无色水相上层。rna全部被分配于水相中。水相上层的体积大约是匀浆时加入的trizol试剂的60%。将水相上层转移到一干净无rna酶的离心管中。加等体积异丙醇混合以沉淀其中的rna,混匀后15到30℃孵育10分钟后,于4℃下12000rpm离心10分钟。此时离心前不可见的rna沉淀将在管底部和侧壁上形成胶状沉淀块。移去上清液,每1mltrizol试剂裂解的样品中加入至少1ml的75%乙醇(75%乙醇用depch2o配制),清洗rna沉淀。混匀后,4℃下7000rpm离心5分钟。rna干燥:小心吸去大部分乙醇溶液,使rna沉淀在室温空气中干燥5-10分钟。溶解rna沉淀溶解rna时,先加入无rna酶的水40μl用枪反复吹打几次,使其完全溶解,获得的rna溶液保存于-80℃待用。
2)cdna合成在0.5ml的离心管中加入1ul模板总rna;2ul随机引物;2ul10mmdntpmix;加水至15ul体系。混匀后70℃变性rna5分钟,冰上速冷1分钟,离心将溶液收集至管底加入6ul5×pcrbuffer;1ulrnaseout;1ulm-mlvrt;加水至30ul体系。pcr仪中反应条件设置37℃延伸60min,70℃保温15min终止反应。合成好的cdna置于-20℃保存备用。
3)实时定量pcr按以下反应体系进行:2xrealqpcrmastermix(modifieddnapolymerase、sybrgreeni、optimizedpcrbuffer、5mmmgci2、dntpmixincludingdutp)25ul;上游引物f1ul,下游引物r1ul;cdnatemplate2ul。定量pcr仪扩增反应条件设置:50℃2min;95℃10min;95℃15s-60℃60s(40个循环)。
实施例5sirna转染
1)转染前一天的准备工作:取对数生长期细胞经胰酶消化后计数。灭菌一次性六孔板一个,每个孔中滴加lxl05个细胞,并补加2ml含10%fbs的dmem,轻轻晃动培养皿使细胞密度均匀。在37℃,5%c02培养箱中培养24h。
2)转染:100pmol(5u1)sirna分子和5ullipofectamine2000分别用245uldmem稀释后,空白组只含5ullipofectamine2000,将稀释好的lipofectamine2000分别加入到对应的稀释好的sirna分子中,轻轻混合均匀后,于室温下静置20min,使形成sirna.lipofectamine2000复合物。取出培养皿,倒去旧的培养基,用pbs洗一次,各转染组分别加入1500ul血清的dmem。然后分别加入对应的sirna分子复合物,十字方向晃动培养皿以使混合均匀,37℃,5%c02培养箱中继续培养6h。6h后结束转染,弃去培养基,换成新鲜含10%fbs的高糖dmem,37℃,5%c02培养箱中继续培养48-72h。
本发明通过上述实验及实施例进一步说明:由于辛伐他汀通过激活lkb1-ampk,从而激活perk,使eif2α磷酸化水平增高,抑制下游靶基因mcm7的翻译,而下调mcm7的表达可以抑制hepg2.2.15细胞中hbv的复制。mcm7表达受到抑制很可能是辛伐他汀类抗病毒的机制。因此,mcm7是辛伐他汀药物抑制乙肝病毒复制的作用靶点,进一步说明辛伐他汀能够应用于制备以mcm7为靶标的药物中;特别是辛伐他汀在制备以mcm7为靶标的抑制乙肝病毒的药物中的应用;以及所述的辛伐他汀在制备以mcm7为靶标的抑制由hbv感染引起的原发性肝癌的药物中的应用,并为临床治疗乙肝提供了新的有效方法。
本实施例没有详细叙述的部分和英文缩写属本行业的公知常识,在网上可以搜索到,这里不一一叙述。
- 还没有人留言评论。精彩留言会获得点赞!