一种药物脂质体/p53基因复合物及其制备方法和应用与流程
本发明涉及一种药物脂质体/p53基因复合物,更具体地说涉及一种含白藜芦醇的多肽型阳离子药物脂质体的制备及其在与p53基因形成新型抗肿瘤复合物制剂中的应用,属于肿瘤治疗领域新型药物制剂及其制备方法与应用。
背景技术:
:
药物和基因的联合转运治疗是一种利用载体将抗癌药物和基因高效传递到肿瘤细胞当中,适时释放药物和基因已达到协同治疗目标的生物医学治疗方法。目前,联合转运治疗体系主要包括药物/药物、药物/siRNA、药物/pDNA等针对各种疾病的治疗方法体系。运载药物与核酸的载体脂质体,还包括聚合物胶束和PLGA纳米粒子等多聚物载体。在同一载体系统中,联合转运药物和DNA作用于肿瘤细胞比单独转运DNA或者药物更有治疗效果。因此,制备一种安全高效的复合物载体已经成为了近年来研究的重点。
我国具有丰富的药用植物资源,尤其民族地区天然植物种类繁多,目前,喜树碱、紫杉醇、冬凌草类、三尖杉碱类等多种天然抗癌药物大部分均产自该地区。天然抗肿瘤药物研发及应用以其低毒性、低毒副作用的优势已经广泛应用于癌症的治疗中。白藜芦醇作为新发现的一种产自我国民族地区的天然抗癌药物,其药理活性和抗癌机制的研究进展才刚刚起步。目前,已经发现白藜芦醇对乳腺癌、结肠癌、前列腺癌、卵巢癌、皮肤癌、肝癌等多种恶性肿瘤细胞均有明显的抑制作用。其中,白藜芦醇对激素依赖性肿瘤细胞的生长具有显著的抑制作用。从白藜芦醇的结构上看,其是一种非黄酮类的多酚类物质,由于氧化损伤是导致癌症的重要原因之一,多酚的抗氧化功能可以对癌症起到预防作用和一定程度上的抑制作用。白藜芦醇的抗癌机制十分复杂,目前发现,白藜芦醇可以通过激活p38MAPK活性,诱导细胞通路中p53蛋白第15位丝氨酸的磷酸化从而激活p53蛋白的活化,磷酸化的p53蛋白可以下调Bcl-2、Bax等凋亡蛋白的表达,Bax蛋白能开启线粒体膜通道,细胞色素c和其他凋亡前体蛋白就能从线粒体中释放出来,caspase活化,起始凋亡。然而,白藜芦醇在光、热和氧化剂存在条件下容易被氧化分解,在一定程度上限制了其在食品和医药行业的应用。
随着分子生物学的发展,人们从肿瘤致病的分子水平上获知,癌症实际上就是一种基因病,要么是抑癌基因的失活,要么是原癌基因被异常激活。目前,主要的抑癌基因包括Rb基因、p53基因、WT1基因、DCC基因、APC基因、NF1基因、MTS1基因、WAF1基因、BRCA基因和BRCA2基因等。其中,p53基因在调节细胞周期和控制细胞凋亡上发挥重要作用,有研究表明,P53基因通过表达野生型的p53蛋白起到控制细胞凋亡的作用,已经成为了肿瘤方面研究的热点。
阳离子脂质体作为非病毒载体材料能够有效的保护被包裹的药物,提高其稳定性和生物利用度,并且还具有毒性低、生物相容性高和可生物降解等明显优势。在药物和基因联合转运方面,Sadd等通过阳离子脂质体共载沉默Bcl-2、MDP1、MDR1基因的siRNA和阿霉素(DOX)对肺癌细胞进行治疗,并证明了基因与药物的协同治疗作用;Kang等也同样通过阳离子脂质体共载NIK-siRNA和5-氟尿嘧啶(5-FU)治疗肝癌,结果显示,脂质体共载的肿瘤细胞凋亡情况明显多于单载。阳离子脂质体作为药物载体,同时可以介导基因输送入细胞,具有独特的优势和良好的发展前景。
技术实现要素:
为了解决现有技术中的不足,本发明提供一种用于肿瘤治疗的药物脂质体/基因复合物,该复合物由含白藜芦醇的药物脂质体和p53基因组成。本发明还提供该药物脂质体/基因复合物的制备方法。首先以多肽型阳离子类脂、助类脂和白藜芦醇为主要原料,依次通过薄膜分散法、超声水化法和凝胶色谱柱分离法,制备药物脂质体,然后将该药物脂质体与p53基因混合,通过静电复合的方法制备得到药物脂质体/基因复合物。
本发明的目的是通过以下技术方案实现的:一种药物脂质体/p53基因复合物,该复合物由药物脂质体和p53基因组成,药物脂质体与p53基因的质量比为1:1~16:1。
优选的,所述的药物脂质体与p53基因的质量比为2:1~8:1。
所述的药物脂质体的制备方法,具体操作步骤如下:
将多肽型阳离子类脂与白藜芦醇溶解于有机溶剂中,加入助类脂充分溶解,多肽型阳离子类脂、白藜芦醇与助类脂的质量比为5:1:1~200:1:1,溶解后漩涡震荡1-20秒混合均匀,用惰性气体吹膜10-60min,于25-120℃真空干燥1-48h,再加入水于25-45℃超声,配制成浓度为0.5-5mg/mL的水溶液,离心后经葡聚糖凝胶柱分离,得到药物脂质体。
所述有机溶剂为甲醇、氯仿和乙酸乙酯中的一种或一种以上。
本发明另一个目的是请求保护药物脂质体/p53基因复合物的制备方法,具体操作步骤如下:
将药物脂质体与p53基因混合,旋涡震荡1-20秒混合均匀,于20℃-40℃孵育5-60min,通过静电复合的制备方法得到。
所述的助类脂为DOPE、胆固醇、卵磷脂中的一种或一种以上。
优选的,所述的助类脂为DOPE。
优选的,所述的多肽型阳离子类脂为CDO12,CDO14,CDO16。
本发明第三个目的是请求保护药物脂质体/p53基因复合物及上述药物脂质体在制备肿瘤治疗药物中的应用。
本发明提供的药物脂质体/p53基因复合物通过白藜芦醇激活p38MAPK激酶活性诱导p53基因活化,使之表达野生型p53蛋白,协同发挥白藜芦醇和p53基因的抗肿瘤作用,引发肿瘤细胞凋亡,达到肿瘤治疗的目的。体外生物学研究表明,该复合物细胞毒性低、野生型p53蛋白表达高,为肿瘤治疗提供了新思路,具有极大的临床应用价值。
附图说明
图1为白藜芦醇脂质体的透射电镜图,其中(A)为CDO14-RSV20:1,(B)为CDO14-RSV+D 10:1,(C)为CDO14-RSV100:1;
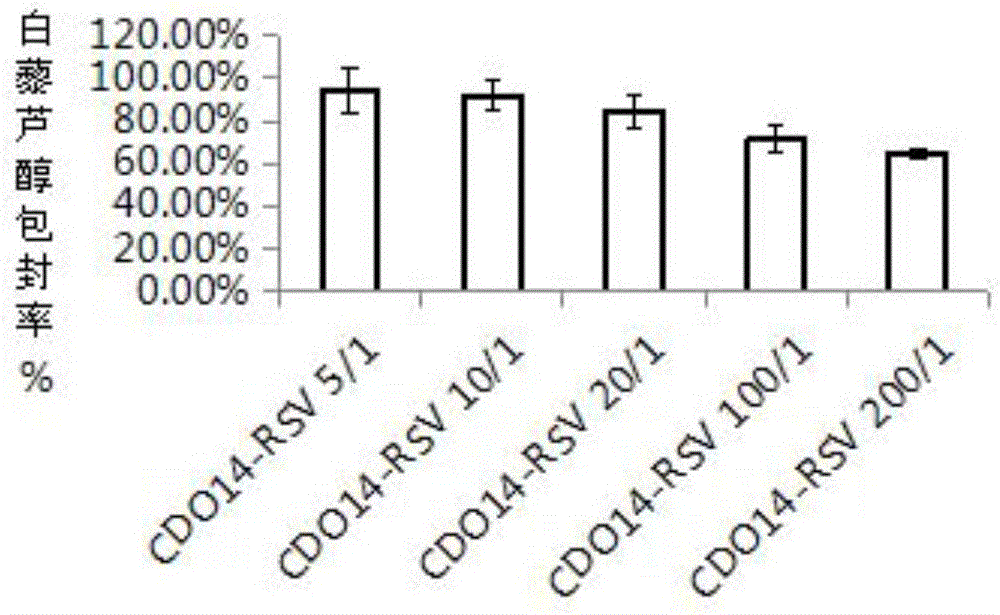
图2为白藜芦醇脂质体包封率检测结果;
图3为白藜芦醇脂质体/P53基因复合物的电泳延滞实验图,其中第1泳道均为Marker(λDNA/EcoR I+Hind III Markers),第2泳道为裸p53基因,第3~9泳道分别为白藜芦醇脂质体与/p53基因复合质量比1:1、2:1、3:1、4:1、6:1、8:1;
图4A为白藜芦醇脂质体/p53基因复合物在Hela细胞中表达效果图;
图4B为白藜芦醇脂质体/p53基因复合物在MCF-7细胞中表达效果图;
图5A为白藜芦醇脂质体/p53基因复合物诱导Hela细胞凋亡图;
图5B为白藜芦醇脂质体/p53基因复合物诱导MCF-7细胞凋亡图;
图6A为白藜芦醇脂质体/P53基因复合物对Hela细胞存活率的影响;
图6B为白藜芦醇脂质体/P53基因复合物对MCF-7细胞存活率的影响。
具体实施方式:
下面通过实施例对本发明做详细描述,但不用于限制本发明的保护范围,如无特殊说明,本发明所涉及化学试剂及药品均市售可得,如无特殊说明,所涉及的方法均为常规方法。
实施例1
将阳离子类脂CDO14与白藜芦醇溶解于甲醇和氯仿的有机溶剂中,加入助类脂DOPE充分溶解,阳离子类脂、白藜芦醇与助类脂的质量比为5:1:1,之后漩涡震荡10秒混合均匀,惰性气体吹膜10min,25℃真空干燥12h,再加入水于25℃超声,配制为浓度为0.5mg/mL的水溶液,离心后经葡聚糖凝胶柱分离,得到药物脂质体,然后将药物脂质体与p53基因混合,药物脂质体与p53基因的质量比是1:1,旋涡震荡10秒混合均匀,20℃孵育10min,通过静电复合的制备方法得到。
实施例2
将阳离子类脂CDO14与白藜芦醇溶解于甲醇的有机溶剂中,加入助类脂胆固醇充分溶解,阳离子类脂、白藜芦醇与助类脂的质量比为10:1:1,之后漩涡震荡15秒混合均匀,惰性气体吹膜15min,30℃真空干燥18h,再加入水于30℃超声,配制为浓度为1.0mg/mL的水溶液,离心后经葡聚糖凝胶柱分离,得到药物脂质体,然后将药物脂质体与p53基因混合,药物脂质体与p53基因的质量比是2:1,旋涡震荡15秒混合均匀,25℃孵育15min,通过静电复合的制备方法得到。
实施例3
将阳离子类脂CDO12与白藜芦醇溶解于乙酸乙酯的有机溶剂中,加入助类脂DOPE充分溶解,阳离子类脂、白藜芦醇与助类脂的质量比为20:1:1,之后漩涡震荡20秒混合均匀,惰性气体吹膜20min,40℃真空干燥24h,再加入水于35℃超声,配制为浓度为1.5mg/mL的水溶液,离心后经葡聚糖凝胶柱分离,得到药物脂质体,然后将药物脂质体与p53基因混合,药物脂质体与p53基因的质量比是3:1,旋涡震荡20秒混合均匀,30℃孵育20min,通过静电复合的制备方法得到。
实施例4
将阳离子类脂CDO16与白藜芦醇溶解于乙酸乙酯的有机溶剂中,加入助类脂卵磷脂充分溶解,阳离子类脂、白藜芦醇与助类脂的质量比为100:1:1,之后漩涡震荡5秒混合均匀,惰性气体吹膜25min,45℃真空干燥30h,再加入水于40℃超声,配制为浓度为2.0mg/mL的水溶液,离心后经葡聚糖凝胶柱分离,得到药物脂质体,然后将药物脂质体与p53基因混合,药物脂质体与p53基因的质量比是4:1,旋涡震荡5秒混合均匀,35℃孵育25min,通过静电复合的制备方法得到。
实施例5
将阳离子类脂CDO16与白藜芦醇溶解于甲醇的有机溶剂中,加入助类脂胆固醇充分溶解,阳离子类脂、白藜芦醇与助类脂的质量比为200:1:1,之后漩涡震荡12秒混合均匀,惰性气体吹膜30min,50℃真空干燥36h,再加入水于45℃超声,配制为浓度为2.5mg/mL的水溶液,离心后经葡聚糖凝胶柱分离,得到药物脂质体,然后将药物脂质体与p53基因混合,药物脂质体与p53基因的质量比是6:1,旋涡震荡10秒混合均匀,40℃孵育30min,通过静电复合的制备方法得到。
实施例6
将阳离子类脂CDO14与白藜芦醇溶解于氯仿的有机溶剂中,加入助类脂卵磷脂充分溶解,阳离子类脂、白藜芦醇与助类脂的质量比为5:1:1,之后漩涡震荡15秒混合均匀,惰性气体吹膜35min,50℃真空干燥40h,再加入水于30℃超声,配制为浓度为3.0mg/mL的水溶液,离心后经葡聚糖凝胶柱分离,得到药物脂质体,然后将药物脂质体与p53基因混合,药物脂质体与p53基因的质量比是8:1,旋涡震荡20秒混合均匀,25℃孵育20min,通过静电复合的制备方法得到。
实施例7
将阳离子类脂CDO14与白藜芦醇溶解于氯仿、甲醇和乙酸乙酯的有机溶剂中,加入助类脂卵磷脂充分溶解,阳离子类脂、白藜芦醇与助类脂的质量比为10:1:1,之后漩涡震荡10秒混合均匀,惰性气体吹膜40min,60℃真空干燥48h,再加入水于40℃超声,配制为浓度为3.5mg/mL的水溶液,离心后经葡聚糖凝胶柱分离,得到药物脂质体,然后将药物脂质体与p53基因混合,药物脂质体与p53基因的质量比是2:1,旋涡震荡15秒混合均匀,40℃孵育15min,通过静电复合的制备方法得到。
实施例8
将阳离子类脂CDO12与白藜芦醇溶解于乙酸乙酯的有机溶剂中,加入助类脂DOPE充分溶解,阳离子类脂、白藜芦醇与助类脂的质量比为100:1:1,之后漩涡震荡15秒混合均匀,惰性气体吹膜20min,80℃真空干燥24h,再加入水于45℃超声,配制为浓度为4.0mg/mL的水溶液,离心后经葡聚糖凝胶柱分离,得到药物脂质体,然后将药物脂质体与p53基因混合,药物脂质体与p53基因的质量比是4:1,旋涡震荡20秒混合均匀,25℃孵育30min,通过静电复合的制备方法得到。
实施例9
将阳离子类脂CDO16与白藜芦醇溶解于甲醇的有机溶剂中,加入助类脂胆固醇充分溶解,阳离子类脂、白藜芦醇与助类脂的质量比为20:1:1,之后漩涡震荡20秒混合均匀,惰性气体吹膜50min,90℃真空干燥12h,再加入水于25℃超声,配制为浓度为4.5mg/mL的水溶液,离心后经葡聚糖凝胶柱分离,得到药物脂质体,然后将药物脂质体与p53基因混合,药物脂质体与p53基因的质量比是6:1,旋涡震荡10秒混合均匀,30℃孵育60min,通过静电复合的制备方法得到。
实施例10
将阳离子类脂CDO14与白藜芦醇溶解于甲醇和氯仿的有机溶剂中,加入助类脂DOPE充分溶解,阳离子类脂、白藜芦醇与助类脂的质量比为5:1:1,之后漩涡震荡3秒混合均匀,惰性气体吹膜60min,100℃真空干燥8h,再加入水于30℃超声,配制为浓度为5.0mg/mL的水溶液,离心后经葡聚糖凝胶柱分离,得到药物脂质体,然后将药物脂质体与p53基因混合,药物脂质体与p53基因的质量比是8:1,旋涡震荡20秒混合均匀,40℃孵育20min,通过静电复合的制备方法得到。
实施例11
将阳离子类脂CDO14与白藜芦醇溶解于甲醇和乙酸乙酯的有机溶剂中,加入助类脂DOPE充分溶解,阳离子类脂、白藜芦醇与助类脂的质量比为100:1:1,之后漩涡震荡10秒混合均匀,惰性气体吹膜20min,120℃真空干燥4h,再加入水于25℃超声,配制为浓度为2.0mg/mL的水溶液,离心后经葡聚糖凝胶柱分离,得到药物脂质体,然后将药物脂质体与p53基因混合,药物脂质体与p53基因的质量比是6:1,旋涡震荡15秒混合均匀,25℃孵育15min,通过静电复合的制备方法得到。
实施例12
将阳离子类脂CDO16与白藜芦醇溶解于氯仿的有机溶剂中,加入助类脂胆固醇充分溶解,阳离子类脂、白藜芦醇与助类脂的质量比为200:1:1,之后漩涡震荡15秒混合均匀,惰性气体吹膜10min,40℃真空干燥20h,再加入水于30℃超声,配制为浓度为1.0mg/mL的水溶液,离心后经葡聚糖凝胶柱分离,得到药物脂质体,然后将药物脂质体与p53基因混合,药物脂质体与p53基因的质量比是1:1,旋涡震荡20秒混合均匀,40℃孵育15min,通过静电复合的制备方法得到。
实施例13
将阳离子类脂CDO12与白藜芦醇溶解于氯仿、乙酸乙酯和甲醇的有机溶剂中,加入助类脂卵磷脂充分溶解,阳离子类脂、白藜芦醇与助类脂的质量比为10:1:1,之后漩涡震荡20秒混合均匀,惰性气体吹膜15min,70℃真空干燥18h,再加入水于40℃超声,配制为浓度为3.0mg/mL的水溶液,离心后经葡聚糖凝胶柱分离,得到药物脂质体,然后将药物脂质体与p53基因混合,药物脂质体与p53基因的质量比是3:1,旋涡震荡15秒混合均匀,35℃孵育30min,通过静电复合的制备方法得到。
实施例14
将阳离子类脂CDO14与白藜芦醇溶解于氯仿的有机溶剂中,加入助类脂胆固醇充分溶解,阳离子类脂、白藜芦醇与助类脂的质量比为20:1:1,之后漩涡震荡1秒混合均匀,惰性气体吹膜20min,30℃真空干燥48h,再加入水于25℃超声,配制为浓度为0.5mg/mL的水溶液,离心后经葡聚糖凝胶柱分离,得到药物脂质体,然后将药物脂质体与p53基因混合,药物脂质体与p53基因的质量比是6:1,旋涡震荡20秒混合均匀,40℃孵育10min,通过静电复合的制备方法得到。
实施例15
将阳离子类脂CDO16与白藜芦醇溶解于甲醇的有机溶剂中,加入助类脂DOPE充分溶解,阳离子类脂、白藜芦醇与助类脂的质量比为100:1:1,之后漩涡震荡10秒混合均匀,惰性气体吹膜40min,100℃真空干燥3h,再加入水于40℃超声,配制为浓度为1.5mg/mL的水溶液,离心后经葡聚糖凝胶柱分离,得到药物脂质体,然后将药物脂质体与p53基因混合,药物脂质体与p53基因的质量比是1:1,旋涡震荡20秒混合均匀,20℃孵育15min,通过静电复合的制备方法得到。
实施例16
将阳离子类脂CDO12与白藜芦醇溶解于乙酸乙酯的有机溶剂中,加入助类脂胆固醇充分溶解,阳离子类脂、白藜芦醇与助类脂的质量比为5:1:1,之后漩涡震荡20秒混合均匀,惰性气体吹膜10min,25℃真空干燥24h,再加入水于45℃超声,配制为浓度为4.5mg/mL的水溶液,离心后经葡聚糖凝胶柱分离,得到药物脂质体,然后将药物脂质体与p53基因混合,药物脂质体与p53基因的质量比是2:1,旋涡震荡10秒混合均匀,25℃孵育20min,通过静电复合的制备方法得到。
实施例17
将阳离子类脂CDO14与白藜芦醇溶解于乙酸乙酯和甲醇的有机溶剂中,加入助类脂卵磷脂充分溶解,阳离子类脂、白藜芦醇与助类脂的质量比为10:1:1,之后漩涡震荡15秒混合均匀,惰性气体吹膜20min,30℃真空干燥48h,再加入水于25℃超声,配制为浓度为2.0mg/mL的水溶液,离心后经葡聚糖凝胶柱分离,得到药物脂质体,然后将药物脂质体与p53基因混合,药物脂质体与p53基因的质量比是3:1,旋涡震荡20秒混合均匀,40℃孵育5min,通过静电复合的制备方法得到。
实施例18
将阳离子类脂CDO12与白藜芦醇溶解于氯仿和甲醇的有机溶剂中,加入助类脂DOPE充分溶解,阳离子类脂、白藜芦醇与助类脂的质量比为100:1:1,之后漩涡震荡20秒混合均匀,惰性气体吹膜30min,60℃真空干燥12h,再加入水于30℃超声,配制为浓度为1.0mg/mL的水溶液,离心后经葡聚糖凝胶柱分离,得到药物脂质体,然后将药物脂质体与p53基因混合,药物脂质体与p53基因的质量比是8:1,旋涡震荡15秒混合均匀,40℃孵育20min,通过静电复合的制备方法得到。
实施例19
将阳离子类脂CDO16与白藜芦醇溶解于甲醇和乙酸乙酯的有机溶剂中,加入助类脂DOPE充分溶解,阳离子类脂、白藜芦醇与助类脂的质量比为5:1:1,之后漩涡震荡20秒混合均匀,惰性气体吹膜20min,30℃真空干燥18h,再加入水于30℃超声,配制为浓度为5.0mg/mL的水溶液,离心后经葡聚糖凝胶柱分离,得到药物脂质体,然后将药物脂质体与p53基因混合,药物脂质体与p53基因的质量比是2:1,旋涡震荡20秒混合均匀,30℃孵育10min,通过静电复合的制备方法得到。
实施例20
将阳离子类脂CDO12与白藜芦醇溶解于氯仿的有机溶剂中,加入助类脂胆固醇充分溶解,阳离子类脂、白藜芦醇与助类脂的质量比为10:1:1,之后漩涡震荡10秒混合均匀,惰性气体吹膜40min,55℃真空干燥20h,再加入水于35℃超声,配制为浓度为1.0mg/mL的水溶液,离心后经葡聚糖凝胶柱分离,得到药物脂质体,然后将药物脂质体与p53基因混合,药物脂质体与p53基因的质量比是3:1,旋涡震荡20秒混合均匀,20℃孵育30min,通过静电复合的制备方法得到。
实施例21
本发明选择子宫颈癌细胞Hela细胞和乳腺癌细胞MCF-7细胞为研究对象,将编码绿色荧光蛋白基因的质粒与药物脂质体复合,利用倒置荧光显微镜观察绿色荧光蛋白的表达情况,可直接反映出复合物是否成功进入细胞并表达的效果。
从图4中可知,Hela细胞和MCF-7细胞中的绿色荧光蛋白表达水平较高,说明本发明的复合物能够成功的被细胞摄入并在细胞中高表达,具有进一步研究和开发的应用价值。
实施例22
Hoechst 33342是一种可以穿透细胞膜的蓝色荧光染料,对细胞的毒性较低,本发明使用子宫颈癌细胞Hela细胞和乳腺癌细胞MCF-7细胞为主要细胞株,利用Hoechst33342对细胞分别进行染色,通过倒置荧光显微镜观察Hoechst33342染色后荧光强度并观察细胞形态和细胞核的状态,进而反应出复合物对细胞凋亡的影响。
从图5中可知,细胞在倒置荧光显微镜下呈亮蓝色荧光,荧光强度较强,并且细胞有点发暗,只呈部分伸展,有部分漂浮细胞,贴壁细胞形态不均一,细胞密度较低,细胞体积变圆变小并变形,细胞边缘模糊,仔细观察细胞核的状态,细胞核皱缩发暗,出现明显凋亡后期的主要标志性特征,说明本发明的药物脂质体/基因复合物具有促进Hela细胞和MCF-7细胞凋亡的作用。
实施例23
活细胞的线粒体中含有琥珀酸脱氢酶,而死细胞中没有,MTT能够被活细胞中的琥珀酸脱氢酶还原生成水不溶性的蓝紫色甲瓒,本发明利用这一性质,用MTT对Hela细胞和MCF-7细胞分别染色,用酶标仪检测,可间接反映活细胞相对于死细胞的数量,进而判断出复合物对肿瘤细胞的增殖抑制能力。
从图6中可知,白藜芦醇脂质体随着与p53基因复合比例的增大,细胞存活率逐渐降低,并且在药物脂质体与p53基因质量比为8/1时,细胞存活率最低。其次,加入CDO14空白脂质体的细胞存活率高于药物脂质体,加入药物脂质体的细胞存活率高于复合物。然后,空白脂质体在脂质体与p53基因复合的1/1~8/1的比例中,细胞存活率均高于90%,且与商品化试剂Lipofectamine 2000和DOTAP相比,空白脂质体毒性相当,甚至更低,说明本发明的复合物对MCF-7细胞和Hela细胞均具有一定细胞增殖抑制能力。
- 还没有人留言评论。精彩留言会获得点赞!